La incidencia de las especies fúngicas como patógenos hospitalarios varía según las regiones.
ObjetivosRegistrar la incidencia y etiología de las fungemias en hospitales de la ciudad de Buenos Aires entre enero de 2005 y diciembre de 2008, conocer sus modificaciones en los 4 años, el tiempo de detección en hemocultivos automatizados y por lisis centrifugación, y su relación con sexo, edad y enfermedad de base.
MétodosEstudio multicéntrico observacional de fungemias en 16 hospitales de la Red de Micología de la ciudad de Buenos Aires.
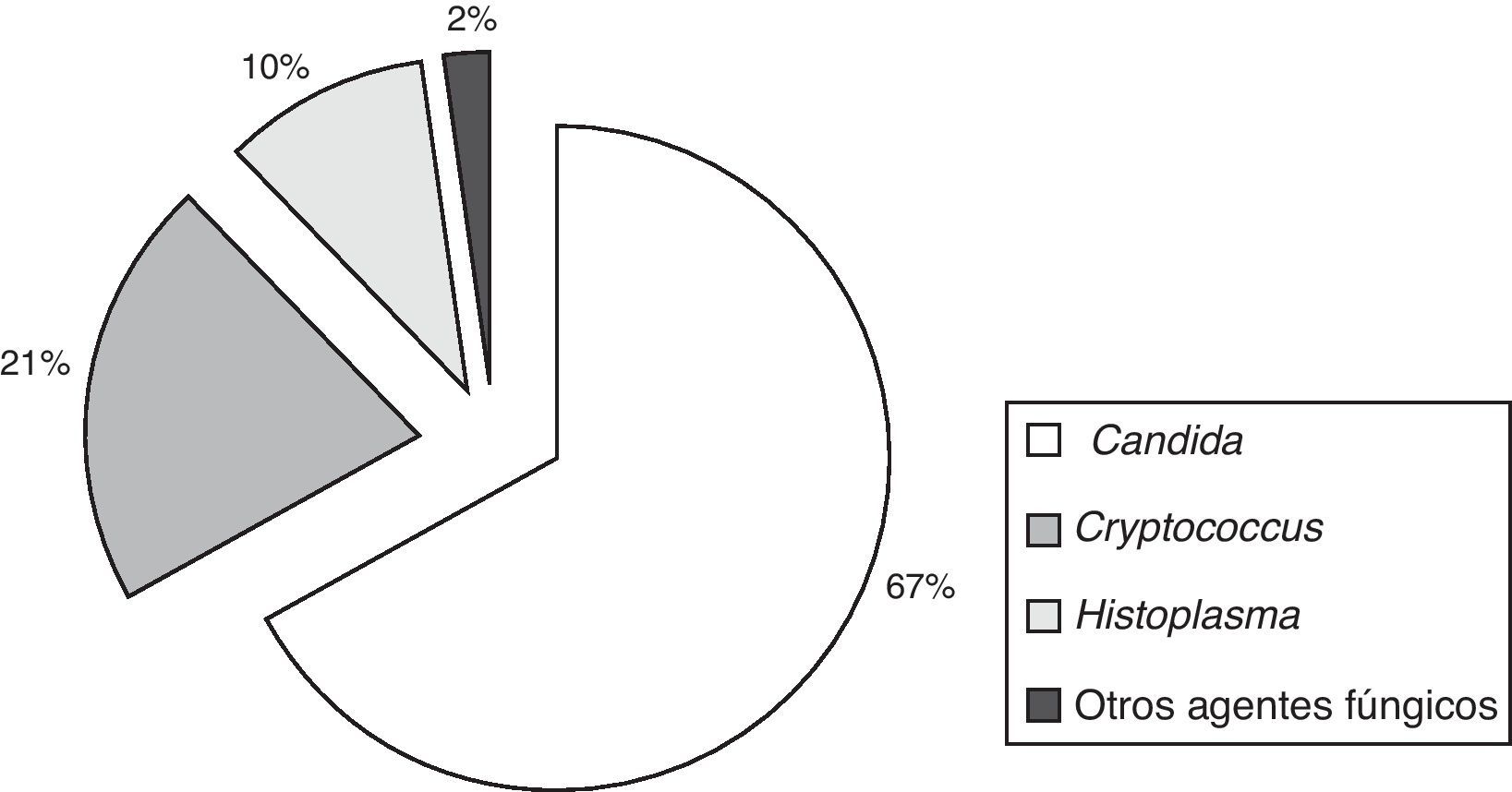
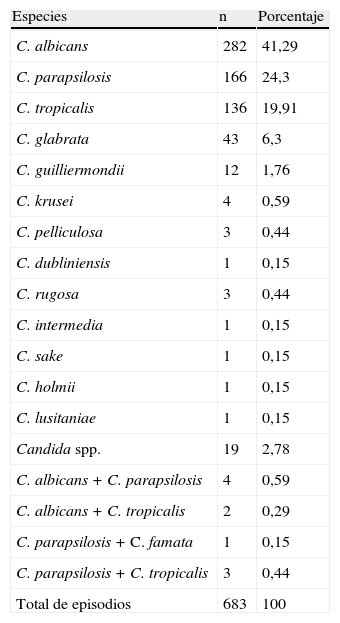
ResultadosSe procesaron 190.920 hemocultivos: 182.050 automatizados y 8.870 por lisis-centrifugación. En 1.020 se recuperaron elementos micóticos. La incidencia global de fungemias fue 1,72 por 1.000 ingresos. Los episodios correspondieron a 683 candidemias (68%), y los restantes 325 (32%) fueron: 214 aislamientos de Cryptococcus, 105 de Histoplasma, 7 de Rhodotorula, 5 de Trichosporon, 2 de Pichia, 2 de Acremonium, uno de Saccharomyces y uno de Fusarium. La incidencia de candidemias fue de 1,15/1.000 ingresos con amplia variación entre centros (0,35 a 2,65). El 97% de las levaduras se detectaron en los primeros 2 días de incubación. Candida albicans se recuperó en el 43% de los episodios. En fungemias diferentes a candidemias, predominaron las causadas por Cryptococcus e Histoplasma capsulatum.
ConclusionesLa incidencia se mantuvo estable en el período estudiado. Predominaron las fungemias por Candida. C. albicans estuvo implicada en menos de la mitad de los episodios. La recuperación de Cryptococcus e H. capsulatum estuvo fuertemente asociada a pacientes VIH reactivos.
The incidence of fungi like pathogens in hospitals varies by regions.
ObjectivesOur goal was not only to record the incidence and etiology of fungaemia, but also the change during the 4 years analysed, to determine the time of detection in automated blood culture and by lysis-centrifugation, and finally to assess the gender, age and underlying disease of the patients with fungaemia.
MethodsAn observational multicentre study of fungaemia was conducted in hospitals in the Mycology Network of Buenos Aires.
ResultsA total of 190,920 blood cultures were processed: 182,050 automated blood culture and 8,870 lysis-centrifugation. Fungi were recovered in 1,020 episodes. The overall incidence of fungaemia was 1.72/1,000 admissions; 683 episodes were due to Candida (68%), and 325 (32%) to other fungi: 214 Cryptococcus, 105 Histoplasma, 7 Rhodotorula, 5 Trichosporon, 2 Pichia, 2 Acremonium, one Saccharomyces and one Fusarium. The incidence of candidaemia was 1.15/1,000 admissions with a wide variation between centres (0.35 to 2.65). Most Candida isolates (97%) were detected in the first 2 days of incubation. Candida albicans was recovered in 43% of the episodes. In fungaemia other than candidaemia, the predominant fungi were Cryptococcus and Histoplasma capsulatum.
ConclusionsThe incidence remained stable during the study period. Fungaemia by Candida were predominant. C. albicans was involved in less than a half of the episodes. The recovery of Cryptoccocus and H. capsulatum is strongly associated with HIV patients.
Las levaduras del género Candida constituyen los patógenos fúngicos predominantes de las infecciones hospitalarias, y ocupan en muchas series el cuarto lugar dentro de los microorganismos recuperados en los hemocultivos6,8,14. Tanto la incidencia como la distribución de las especies varían según la región1,6,20,24,30. Otros géneros fúngicos diferentes a Candida adquieren relevancia en aquellas instituciones con atención a pacientes inmunosuprimidos, especialmente con infección por VIH21.
La evolución de los pacientes con fungemias está ligada a la instauración de un tratamiento adecuado y precoz23,25. El mismo dependerá del tiempo en el que se positivizan los hemocultivos y la rapidez del laboratorio en comunicar la identificación del género y la especie del microorganismo recuperado.
Los objetivos del presente trabajo fueron registrar la incidencia de las fungemias en los hospitales de la ciudad de Buenos Aires y establecer si hubo modificaciones en el curso de los 4 años analizados; determinar los agentes fúngicos involucrados y conocer su tiempo de desarrollo en los hemocultivos; y consignar sexo, edad y enfermedad de base de los pacientes. En los episodios de candidemias, se evaluó el tiempo transcurrido desde el ingreso del paciente hasta el desarrollo de la candidemia, la complejidad de la unidad de hospitalización, el antecedente de catéteres venosos centrales y la antibioticoterapia previa.
Materiales y métodosSe realizó un estudio multicéntrico prospectivo y observacional de las fungemias basado en datos de laboratorio entre enero de 2005 y diciembre de 2008. Los centros asistenciales fueron 16 hospitales integrantes de la Red de Micología de la Ciudad de Buenos Aires: 9 hospitales generales, 3 hospitales universitarios, 2 hospitales pediátricos, un hospital de enfermedades infecciosas y un hospital de enfermedades respiratorias.Trece hospitales aportaron sus datos durante todo el período del estudio y 3 centros (un hospital general y 2 hospitales universitarios) lo hicieron a partir de 2007.
Los hemocultivos fueron procesados por métodos automatizados BACTEC® 9240 (Becton Dikinson, Diagnostic Systems,Sparks, Md., EE.UU.), BacT/ALERT® 3D (bioMérieux, Francia) y por la técnica de lisis-centrifugación3. La identificación de las levaduras se realizó por métodos morfológicos, siembra en agar cromogénico, pruebas bioquímicas9,19 y/o utilización de equipos comerciales: API 20C®, API ID32C®, tarjetas Vitek® (bioMérieux, Francia) o panel Microscan® (Becton Dikinson, Diagnostic Systems,Sparks, Md., EE.UU.). Los hongos filamentosos se identificaron por sus características macro y micromorfológicas11,19.
Un episodio de fungemia fue definido como el aislamiento de una especie fúngica en uno o más hemocultivos. Todos los hemocultivos con desarrollo de Candida posteriores a los 30 días del primero en el mismo paciente, fueron considerados un nuevo episodio6. Se definió como candidemia extranosocomial todos los episodios diagnosticados en pacientes ambulatorios o dentro de las 48 horas de su hospitalización; el resto se consideró como candidemia nosocomial.
Cuando un episodio fue detectado en el laboratorio, se procedió a la recopilación de datos clínicos y epidemiológicos. Se consignó la especie recuperada, el tiempo de desarrollo y la metodología del hemocultivo. Se registró edad, sexo y antecedentes de los pacientes.
En los enfermos con candidemia se documentó, además, la sala de hospitalización en el momento de la toma del hemocultivo, el tiempo transcurrido entre la hospitalización y el desarrollo de la candidemia, el uso de catéteres y antibioticoterapia previa.
Los datos fueron analizados con el programa estadístico VCC Stat v.beta 2.0. Las variables categóricas fueron expresadas en porcentajes, las variables continuas en promedio y mediana. Se consideró una diferencia como estadísticamente significativa cuando p<0,05.
ResultadosDel 1-01-2005 al 31-12-2008 se procesaron 190.920 hemocultivos (182.050 automatizados y 8.870 por lisis-centrifugación).
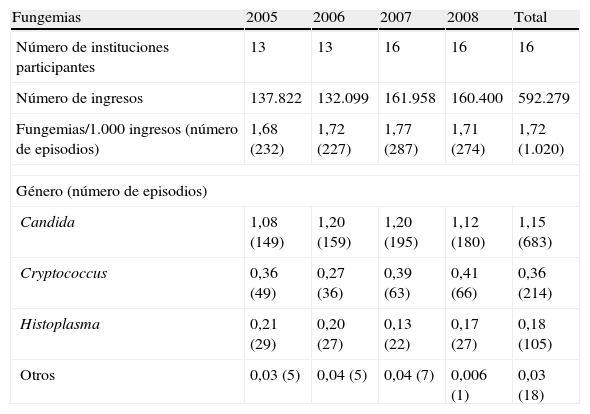
En 1.020 hemocultivos hubo recuperación de elementos fúngicos (tabla 1). La incidencia global de fungemias fue 1,72 episodios por 1.000 ingresos hospitalarios. Hubo 683 episodios por Candida, 214 por Cryptococcus, 105 por Histoplasma capsulatum y 18 episodios por otros agentes fúngicos, entre los cuales se encontraban 7 fungemias por Rhodotorula, 5 por Trichosporon, 2 por Pichia, 2 por Acremonium, uno por Sacharomyces y otro por Fusarium (fig. 1).
Fungemias en la ciudad de Buenos Aires (2005-2008). Etiología e incidencia
| Fungemias | 2005 | 2006 | 2007 | 2008 | Total |
| Número de instituciones participantes | 13 | 13 | 16 | 16 | 16 |
| Número de ingresos | 137.822 | 132.099 | 161.958 | 160.400 | 592.279 |
| Fungemias/1.000 ingresos (número de episodios) | 1,68 (232) | 1,72 (227) | 1,77 (287) | 1,71 (274) | 1,72 (1.020) |
| Género (número de episodios) | |||||
| Candida | 1,08 (149) | 1,20 (159) | 1,20 (195) | 1,12 (180) | 1,15 (683) |
| Cryptococcus | 0,36 (49) | 0,27 (36) | 0,39 (63) | 0,41 (66) | 0,36 (214) |
| Histoplasma | 0,21 (29) | 0,20 (27) | 0,13 (22) | 0,17 (27) | 0,18 (105) |
| Otros | 0,03 (5) | 0,04 (5) | 0,04 (7) | 0,006 (1) | 0,03 (18) |
No hubo diferencias estadísticamente significativas entre las tasas de incidencia en el curso de los 4 años estudiados. En 2005 la incidencia fue del 1,69‰ (IC 95%: 1,47-1,91), en 2006 1,72‰ (IC 95%: 1,20-1,96), en 2007 1,77‰ (IC 95%: 1,57-1,99), y en 2008: 1,71‰ (IC 95%: 1,51-1,92).
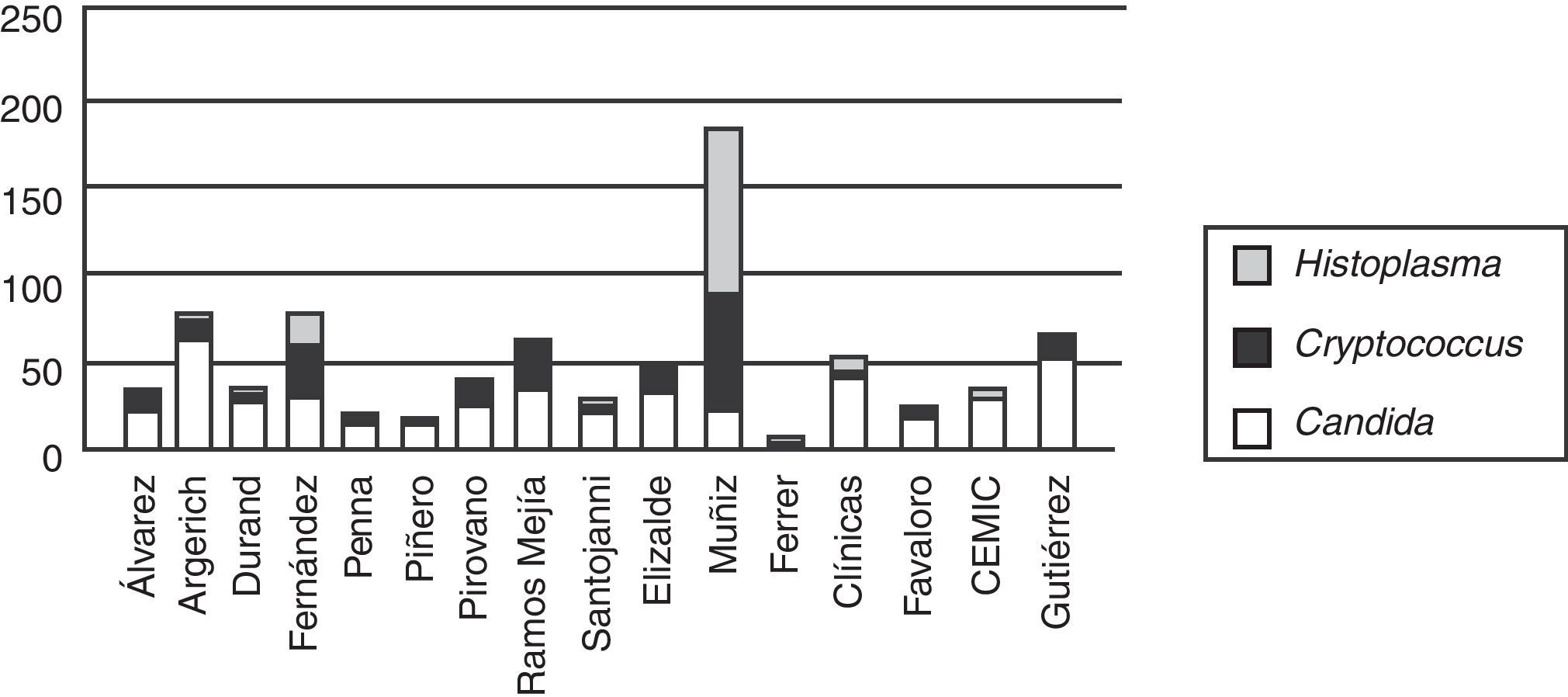
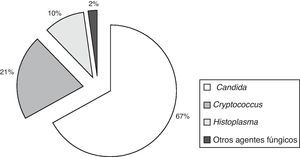
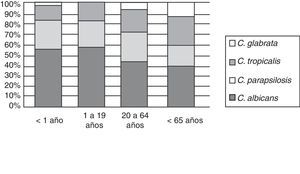
La etiología de las fungemias presentó variaciones entre los centros intervinientes, especialmente entre los hospitales generales y aquellos con alta prevalencia de pacientes VIH reactivos, como el Hospital de Infecciosas Francisco J. Muñiz (fig. 2).
Episodios de fungemia según institución hospitalaria de la ciudad de Buenos Aires (2005-2008). Tipo de instituciones hospitalarias: Muñiz: enfermedades infecciosas; Ferrer: enfermedades respiratorias; Elizalde y Gutiérrez: enfermos pediátricos; CEMIC, Favaloro, Clínicas: universitarios; Álvarez, Argerich, Durand, Fernández, Penna, Piñero, Pirovano, Ramos Mejía, Santojanni: hospitales generales. Los hospitales Piñero, CEMIC y Favaloro incorporaron sus datos a partir de 2007.
La incidencia global del período fue de 1,15 /1.000 ingresos, 1,08‰ (IC 95%: 0,91-1,27) para el año 2005, 1,20‰ (IC 95%: 1,02-1,41) para 2006, 1,20‰ (IC 95%: 1,04-1,39) para 2007 y 1,12‰ (IC 95%: 0,96-1,30) para el año 2008. Se registró una amplia variación de la incidencia entre los centros hospitalarios participantes (de 0,35 a 2,65/1.000 ingresos).
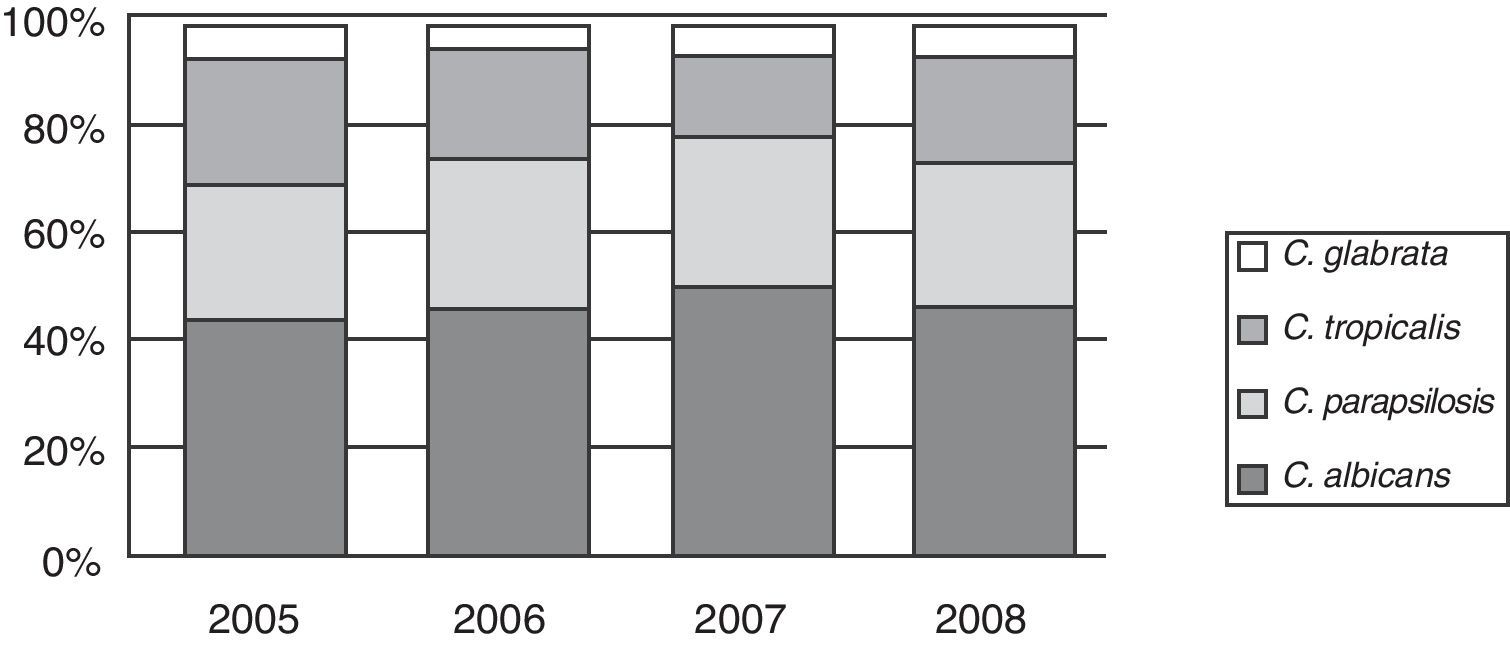
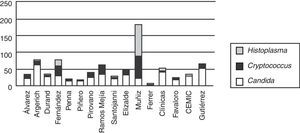
La distribución de las especies de Candida se muestra en la tabla 2. Candida albicans fue recuperada en el 41,3% de los episodios de candidemias, seguida por Candida parapsilosis en 24,3%, Candida tropicalis en 19,9% y Candida glabrata en 6,3%. Hubo un 1,5% de episodios mixtos donde la asociación más frecuente fue C. albicans y C. parapsilosis.
Candidemias en hospitales de la ciudad de Buenos Aires (2005-2008)
| Especies | n | Porcentaje |
| C. albicans | 282 | 41,29 |
| C. parapsilosis | 166 | 24,3 |
| C. tropicalis | 136 | 19,91 |
| C. glabrata | 43 | 6,3 |
| C. guilliermondii | 12 | 1,76 |
| C. krusei | 4 | 0,59 |
| C. pelliculosa | 3 | 0,44 |
| C. dubliniensis | 1 | 0,15 |
| C. rugosa | 3 | 0,44 |
| C. intermedia | 1 | 0,15 |
| C. sake | 1 | 0,15 |
| C. holmii | 1 | 0,15 |
| C. lusitaniae | 1 | 0,15 |
| Candida spp. | 19 | 2,78 |
| C. albicans+C. parapsilosis | 4 | 0,59 |
| C. albicans+ C.tropicalis | 2 | 0,29 |
| C. parapsilosis+C. famata | 1 | 0,15 |
| C. parapsilosis+C. tropicalis | 3 | 0,44 |
| Total de episodios | 683 | 100 |
La distribución porcentual de las 4 especies más frecuentes no mostró modificaciones a lo largo de los 4 años (fig. 3).
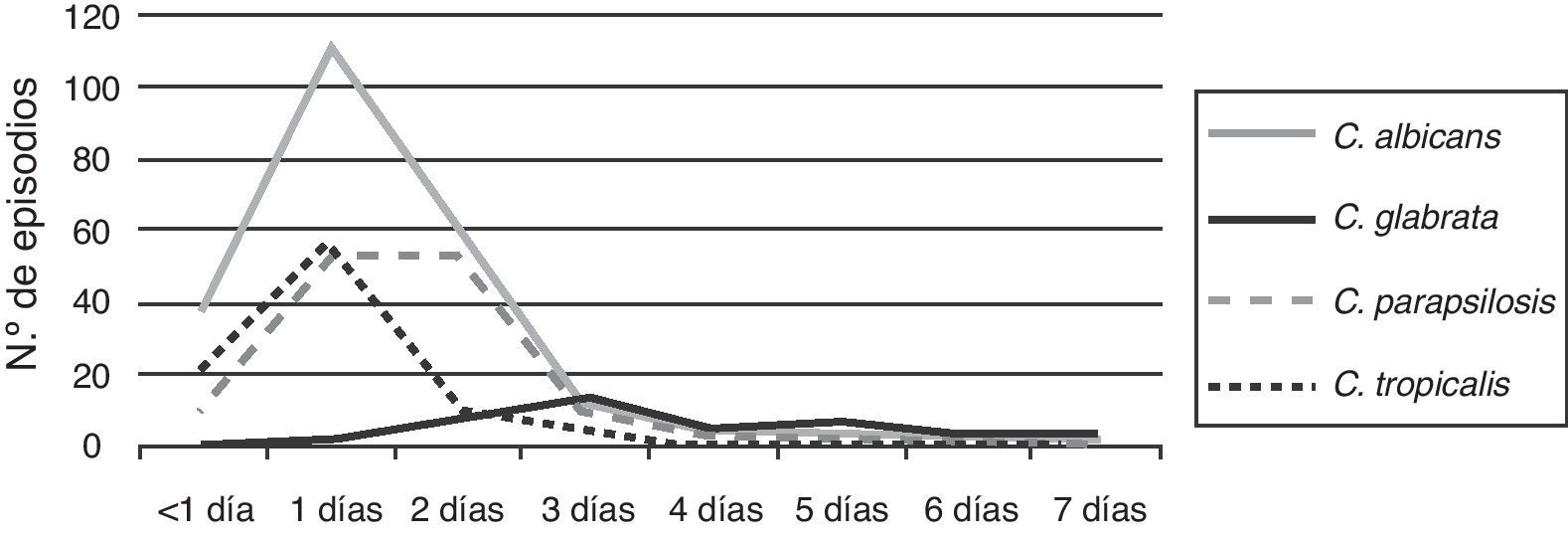
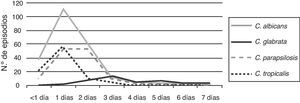
El 97% de las levaduras del género Candida se detectaron en los primeros 2 días de incubación. C. albicans, C. parapsilosis y C. tropicalis tuvieron su pico de detección en el primer día, mientras que C. glabrata lo tuvo entre los días 3 y 4 de incubación (fig. 4).
El 51% de las candidemias se diagnosticaron en varones. El promedio de edad fue de 48 años (extremos: 0 a 99 años); el 29% en menores de 19 años (la mayoría de ellos menores de un año: 17% del total de los aislamientos), 45% entre 20 y 64 años y el 26% en mayores de 64 años.
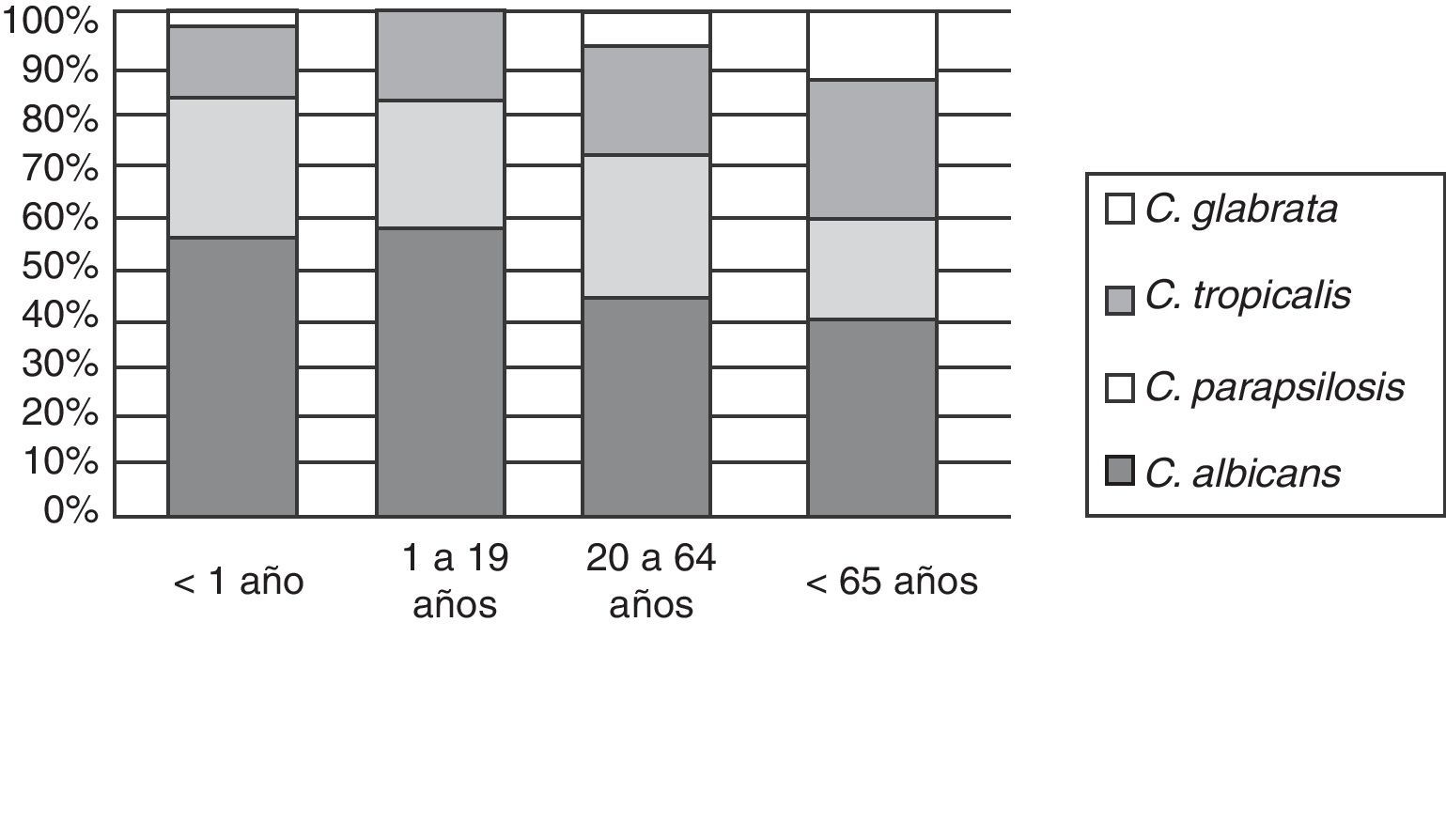
La incidencia de las especies varió con el grupo etario al que pertenecían los pacientes. Se observó un aumento de C. glabrata en los pacientes de mayor edad (fig. 5). Hubo diferencia estadísticamente significativa al comparar la incidencia de esta especie entre los pacientes menores de un año y los mayores de 64 años (p<0,001).
En 392 episodios se registró el tiempo de hospitalización transcurrido hasta el desarrollo de la candidemia. Hubo 35 candidemias que fueron diagnosticadas en pacientes externos o con menos de 48 horas de hospitalización (candidemias extranosocomiales). El resto de los episodios fueron detectados en enfermos que llevaban más de 48 horas desde su ingreso en el hospital, con un promedio de 24 días de internación. El 46% de los pacientes se encontraba hospitalizado en terapia intensiva, el 39% en clínica médica y el 15% en salas de cirugía.
El 57% de los pacientes menores de un año tenía como antecedente más importante la prematuridad. En el resto, los antecedentes más frecuentes fueron cirugía (29%), enfermedades oncohematológicas o tumorales (26%) o insuficiencias funcionales o metabólicas (17%). Se constató el uso de catéteres y de antiobioticoterapia previa en el 85% de los pacientes con candidemias.
Fungemias por CryptococcusHubo 214 episodios de fungemias por Cryptococcus. Se identificó la especie Cryptococcus neoformans en 211, Cryptococcus albidus en 2 y Cryptococcus laurentii en uno.
La incidencia fue de 0,36/1.000 ingresos: 0,35‰ (IC 95%: 026-0,47) en 2005, 0,27‰ (IC 95%: 0,19-0,38) en 2006, 0,39‰ (IC 95%: 0,3-0,5) en 2007 y 0,40‰ (IC 95%: 0,41-0,52) en 2008 (p=0,200). La mayor diferencia se encontró entre 2006 y 2008 (p=0,057).
El 69% de los pacientes eran varones. El promedio de edad fue de 36 años (de 6 a 95 años).
El 96,2% de los aislamientos de C. neoformans fue recuperado de pacientes VIH reactivos. Los pacientes VIH negativos con C. neoformans en los hemocultivos (3,8%) presentaban como condición/enfermedad de base el trasplante renal (3 casos), lupus eritematoso sistémico (2 casos), enfermedades oncohematológicas (2 casos) y cáncer de esófago (1 caso). Los 2 aislamientos de C. albidus y el único de C. laurentii fueron aislados en pacientes VIH negativos.
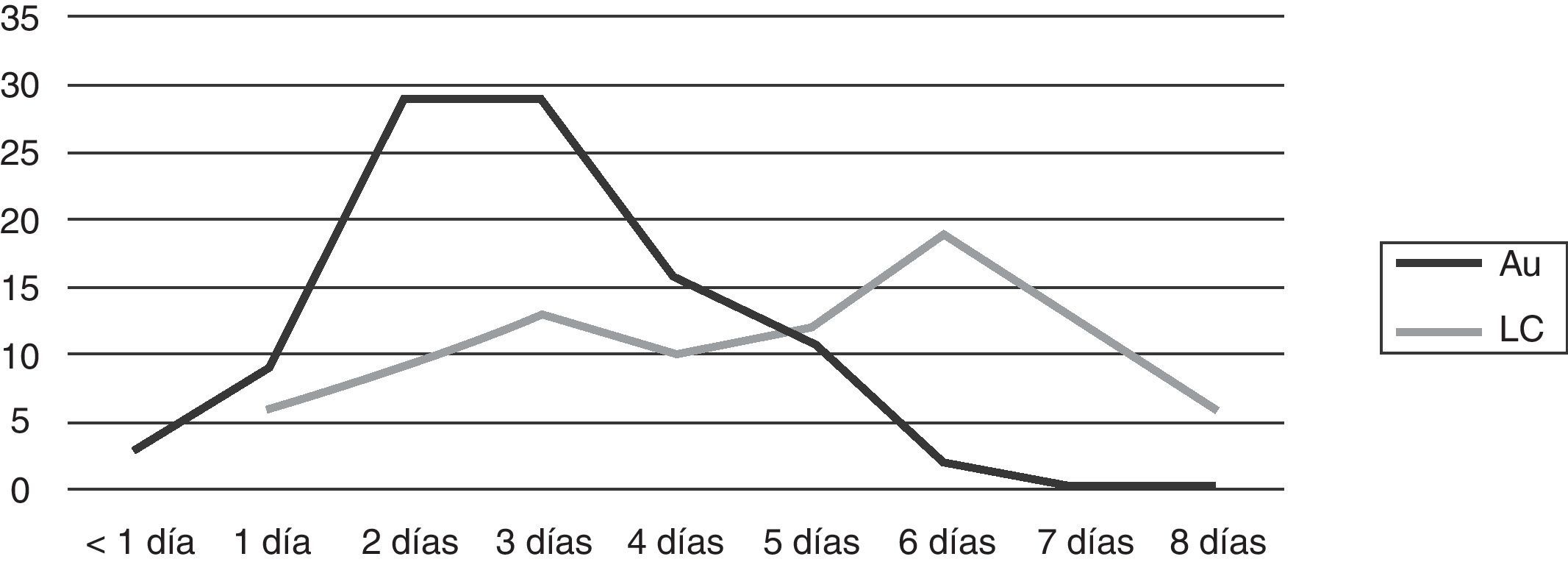
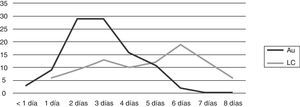
Se registró el tiempo de detección en 187 hemocultivos (99 automatizados y 88 por lisis-centrifugación). En los hemocultivos automatizados el desarrollo fue detectado en un 41% en los primeros 2 días de incubación, llegó al 70% al día 3 y al 98% al día 5 de incubación. La visualización en los cultivos por lisis-centrifugación fue registrada un 17% al segundo día, llegó al 38% el tercer día, y alcanzó el 78% al sexto día de incubación (fig. 6).
Fungemias por HistoplasmaHubo 105 fungemias por H. capsulatum provenientes de hemocultivos por lisis-centrifugación (uno de los aislamientos de H. capsulatum fue además recuperado por Bactec). La incidencia fue de 0,18/1.000 ingresos: 0,21‰ (IC 95%: 0,14-0,30) en 2005, 0,20‰ (IC 95%: 0,13-0,30) en 2006, 0,13‰ (IC 95%: 0,08-0,21) en 2007 y 0,17‰ ingresos (IC 95%: 0,11-0,25) en 2008.
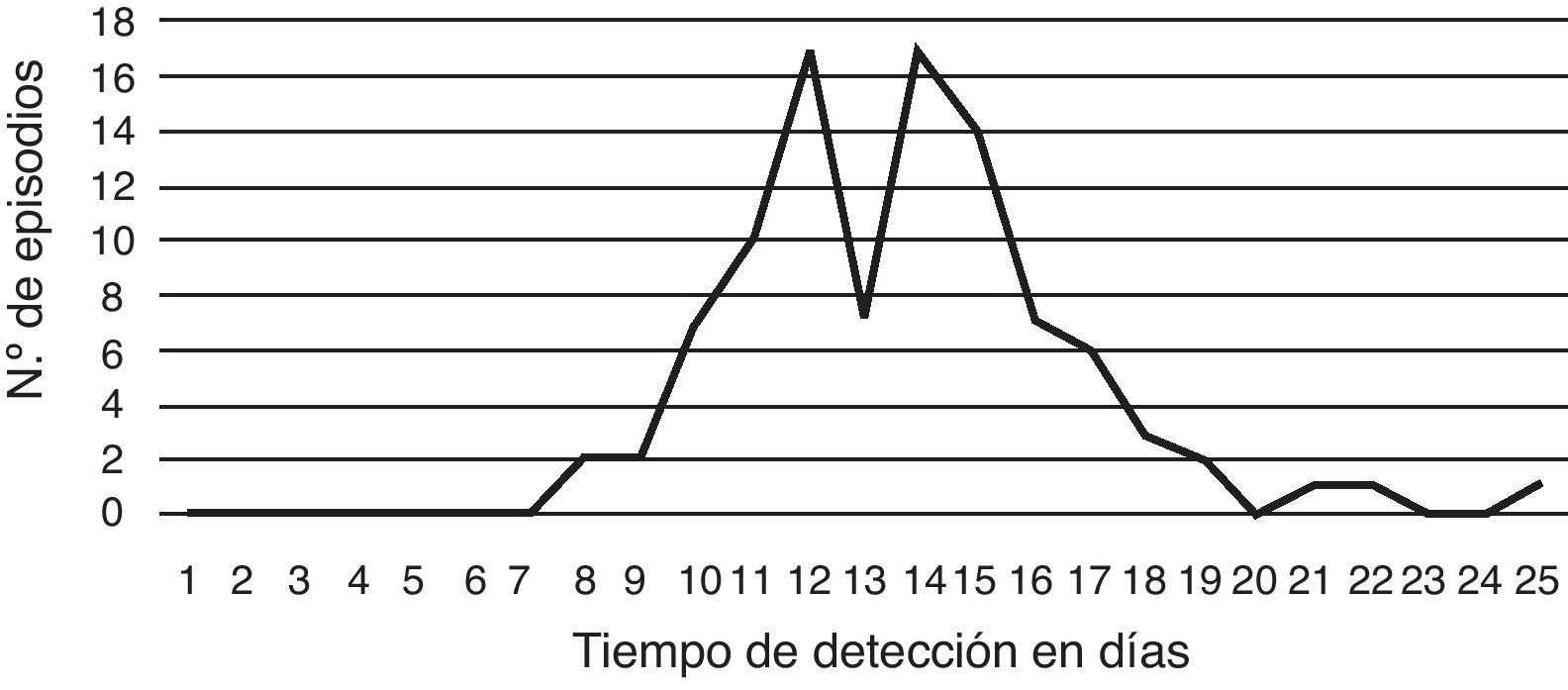
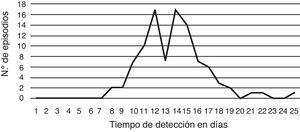
El 82% de los pacientes eran varones y el promedio de edad fue de 34 años (de 14 a 63 años). Todos los pacientes eran VIH reactivos. Los episodios fueron diagnosticados solo en 7 de los 16 hospitales participantes, y el 78% de ellos en el Hospital de Infecciosas Francisco J. Muñiz. El 87% de los aislamientos pudieron ser visualizados entre los días 10 y 17 de incubación (fig. 7).
DiscusiónEste análisis prospectivo, basado en el diagnóstico del laboratorio durante 4 años, constituye el mayor estudio multicéntrico de la ciudad capital de la República Argentina. Si bien no es un estudio poblacional, permite conocer datos que reflejan lo que sucede en la ciudad de Buenos Aires.
La incidencia global de fungemias fue 1,72 episodios por 1.000 ingresos hospitalarios. No se detectaron diferencias significativas en el curso de los 4 años estudiados.
La incidencia de las candidemias en el mismo período fue de 1,15/1.000 ingresos, mayor que la que se observa en EE. UU.40 y Europa13, pero menor que la notificada por Brasil6, aunque como en muchos otros estudios epidemiológicos20, hubo una amplia variación entre los centros (de 0,35 a 2,65 candidemias/1.000 ingresos). En el resto de las fungemias tampoco se observaron diferencias significativas en las tasas de incidencia entre los años estudiados.
La mayoría de las candidemias se producen durante la hospitalización del paciente5,17; sin embargo, un porcentaje de las mismas, entre 7 y 36% según las series5,17,28,38, se detectan en pacientes externos o con menos de 48 horas de hospitalización y constituyen candidemias extranosocomiales. En nuestro estudio, de los 392 episodios donde se registró el tiempo exacto entre la hospitalización y la candidemia, el 9% correspondió a candidemias extranosocomiales. El cambio de atención en salud, con tratamientos y procedimientos diagnósticos o terapéuticos que se realizan en consultorios u hospitales de día, pondrían al paciente en riesgo de desarrollar esta infección, que es percibida por el personal de salud como una patología exclusivamente intrahospitalaria. Es importante, entonces, que este diagnóstico sea tenido en cuenta en la sala de emergencias o al ingreso del paciente en el hospital35,36.
De los pacientes que desarrollaron candidemia durante la hospitalización, la mediana del tiempo transcurrido entre el ingreso del paciente y la candidemia fue de 24 días, similar al de la mayoría de los estudios6,18, que muestra una incidencia pico en la tercera semana de internación.
El promedio de edad en nuestro estudio fue de 48 años. Un alto porcentaje de las candidemias se diagnosticaron en niños (29%), especialmente en neonatos.
Otro grupo vulnerable es el de los pacientes mayores de 64 años18, que representaron más de la cuarta parte de las candidemias, en nuestra casuística. La inmunosenescencia podría explicar parte de esta incidencia12,16, al igual que la inmadurez inmunológica es un factor importante en los neonatos6.
La frecuencia de los antecedentes de antibioticoterapia, uso de catéteres, cirugías y enfermedades neoplásicas coincide con lo habitualmente comunicado4,7,18,25,26, al igual que la internación en terapia intensiva en el momento en que los pacientes desarrollan la candidemia5.
Pudo notarse un aumento significativo de la incidencia proporcional de C. glabrata con la edad de los pacientes. Esta especie representó solo el 2% en menores de un año y llegó al 13% en mayores de 65 años (p=0,0053), lo que coincide con otras publicaciones5,27,29. Este hecho obligaría a establecer un tratamiento inicial que sea efectivo para C. glabrata en los adultos añosos, aun en regiones como la nuestra, con baja incidencia global de esta especie en comparación con estudios norteamericanos o europeos15,37.
C. albicans fue la especie predominante, como en todas las publicaciones13,15,18,33,40, coincidiendo también con lo hallado en otro estudio multicéntrico realizado en Argentina, con la participación de instituciones de todo el país31. El segundo lugar fue ocupado por C. parapsilosis. En países como el nuestro, la recuperación de C. parapsilosis podría estar ligada a una menor adherencia a las medidas universales de lavado de manos y del manejo de catéteres. La menor incidencia de C. glabrata y C. krusei32 podría relacionarse con el menor uso de fluconazol.
Es conocido que la evolución de los pacientes con candidemia está ligada al inicio precoz del tratamiento23,25. Este estudio muestra que el 97% de las levaduras del género Candida se pudieron detectar en los hemocultivos automatizados en los primeros 2 días de incubación. La comunicación inmediata de este hallazgo por el personal del laboratorio puede modificar la evolución del paciente, facilitando el inicio temprano del tratamiento. Es importante resaltar que C. glabrata fue la especie de más lento desarrollo, como ha sido observado por otros investigadores22, lo que plantea la pregunta de si la evolución no favorable de las candidemias por esta especie estaría más ligada a la demora en el desarrollo que a otros factores como la sensibilidad antifúngica27.
Los episodios de criptococosis están fuertemente asociados a la infección por VIH21. Debe valorarse la realización de hemocultivos como una de las metodologías diagnósticas, de buen rendimiento, especialmente en aquellos pacientes en los que está contraindicada la realización de punción lumbar. La detección de estas levaduras capsuladas en los medios automatizados en más del 40% de los episodios se realizó en el segundo día de incubación. Esta detección fue mucho más precoz que lo notificado en otros estudios34, donde la recuperación osciló entre los 7 y los 11 días de incubación.
Las fungemias por Histoplasma en el período estudiado fueron detectadas solo en pacientes VIH reactivos, y la mayoría de ellas (el 78%) en un hospital con alta prevalencia de pacientes portadores de VIH. La histoplasmosis se observa, además de en los pacientes con sida, en los que reciben inmunosupresión con corticoides por una amplia gama de enfermedades (colagenopatías, trasplantes de órganos sólidos, enfermedades oncohematológicas, diversas enfermedades dermatológicas). Se debe sugerir la mayor utilización del hemocultivo por lisis-centrifugación en los hospitales generales como una importante herramienta diagnóstica en pacientes con alteraciones de la inmunidad celular por causas diferentes al VIH.
Cabe resaltar que los hemocultivos por lisis-centrifugación tienen un rendimiento que puede superar tanto en porcentaje como en tiempo de detección al de los medios automatizados, en la recuperación de Histoplasma2, aun utilizando las botellas BACTEC® MYCO/F diseñadas para el aislamiento de micobacterias y hongos10,39.
Otros agentes micóticos pueden ser detectados en los hemocultivos. En nuestra casuística fueron Rhodotorula spp., Trichosporon spp., Pichia spp., Saccharomyces spp., Acremonium spp. y Fusarium spp. El aislamiento de estos agentes suele generar controversias en la decisión de la indicación terapéutica, pero es de vital importancia que el personal del laboratorio comunique rápidamente su detección, especialmente en pacientes neutropénicos. La identificación requerirá de personal entrenado y muchas veces de la derivación a centros especializados para la determinación del género, la especie y la sensibilidad antifúngica.
En conclusión, no se encontraron diferencias en la incidencia de las candidemias a lo largo de los años analizados. C. albicans se recuperó en menos de la mitad de los episodios y la gran mayoría de las candidemias se detectó en los primeros 2 días de incubación. La prematuridad, la cirugía, enfermedades oncohematológicas, tumorales, alteraciones metabólicas y funcionales y el uso de catéteres y antibioticoterapia previa fueron los antecedentes más frecuentes. De los episodios de fungemias diferentes a candidemias, predominaron los causados por Cryptococcus e Histoplasma. La recuperación de estos hongos en los hemocultivos estuvo fuertemente asociada a la atención en el hospital de pacientes VIH reactivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Red de Micología de la Ciudad Autónoma de Buenos Aires: Claudia Alfonso (Hospital General de Agudos Donación F. Santojanni), Alicia Arechavala (Hospital de Infecciosas F.J. Muñiz), Analía Fernández (Fundación Favaloro), María José Gallego (Hospital de Rehabilitación Respiratoria M. Ferrer), Claudia Garbasz (Hospital General de Agudos Dr. I. Pirovano), Susana García (Hospital de Clínicas José de San Martín), Mónica López (Hospital General de Agudos J.M. Ramos Mejía), Andrés Martínez Burkett (Hospital General de Niños Ricardo Gutiérrez), María del Carmen Morales (Hospital General de Agudos P. Piñero), Rosana Pereda (Hospital General de Niños Pedro de Elizalde), María del Carmen Perrone (Hospital de Agudos J.A. Penna), Silvia Relloso (Centro de Educación Medica e Investigación Clínica).
Los componentes del grupo están relacionados en el anexo.