Muchas especies de Alternaria han sido estudiadas por su capacidad de producir metabolitos secundarios bioactivos como la tentoxina (TEN), algunos de los cuales tienen propiedades tóxicas. Las principales toxinas de Alternaria contaminantes de alimentos son el ácido tenuazónico, el alternariol (AOH), el alternariol monometil éter (AME), el altenueno y las altertoxinas i, ii y iii.
ObjetivosDeterminar los perfiles de metabolitos secundarios característicos de cepas de Alternaria aisladas de tomate para su clasificación quimiotaxonómica.
MétodosLos perfiles de metabolitos secundarios se determinaron por HPLC-MS.
ResultadosLos aislamientos de Alternaria obtenidos a partir de tomates con «enmohecimiento negro» pertenecen, según sus características morfológicas, a los grupos especie Alternaria alternata, Alternaria tenuissima y Alternaria arborescens, siendo A. tenuissima el más frecuentemente aislado. Se determinaron los perfiles más característicos de metabolitos secundarios de los grupos especie A. alternata (AOH, AME, TEN), A. tenuissima (AOH, AME, TEN, ácido tenuazónico) y A. arborescens (AOH, AME, TEN, ácido tenuazónico), siendo algunas cepas de este último grupo especie capaces de sintetizar toxinas AAL.
ConclusionesLos perfiles de producción de metabolitos secundarios son una herramienta útil para la diferenciación de aislamientos de Alternaria pertenecientes a grupos especie de esporas pequeñas difícilmente identificables por sus características morfológicas.
Many Alternaria species have been studied for their ability to produce bioactive secondary metabolites, such as tentoxin (TEN), some of which have toxic properties. The main food contaminant toxins are tenuazonic acid, alternariol (AOH), alternariol monomethyl ether (AME), altenuene, and altertoxins i, ii and iii.
AimsTo determine the profiles of secondary metabolites characteristic of Alternaria strains isolated from tomato for their chemotaxonomic classification.
MethodsThe profiles of secondary metabolites were determined by HPLC MS.
ResultsThe Alternaria isolates obtained from spoiled tomatoes belong, according to their morphological characteristics, to the species groups Alternaria alternata, Alternaria tenuissima and Alternaria arborescens, with A. tenuissima being the most frequent. The most frequent profiles of secondary metabolites belonging to the species groups A. alternata (AOH, AME, TEN), A. tenuissima (AOH, AME, TEN, tenuazonic acid) and A. arborescens (AOH, AME, TEN, tenuazonic acid) were determined, with some isolates of the latter being able to synthesize AAL toxins.
ConclusionsSecondary metabolite profiles are a useful tool for the differentiation of small spored Alternaria isolates not easily identifiable by their morphological characteristics.
Las especies del género Alternaria están presentes con frecuencia en una amplia gama de hábitats diferentes, tales como semillas, plantas, productos agrícolas, el suelo y el aire. Las especies de Alternaria se asocian comúnmente con enfermedades en varias plantas17. Este género posee una amplia diversidad morfológica, lo cual ha permitido una serie de intentos de organizar a los taxones en grupos a partir de los caracteres morfológicos4,10,29,32,33. Dentro del género Alternaria, las especies se definen generalmente por las características del conidio, incluyendo el tamaño, la tabicación, presencia y ausencia de pico y el modelo de concatenación. Teniendo en cuenta la medida del conidio se establecieron 2 grupos: el de «esporas grandes» (tamaño del conidio en un rango de [50-]60-100μm) y el de «esporas pequeñas» (tamaño de conidio menor de 60μm). Dentro del grupo de esporas grandes se encuentran especies como Alternaria dauci, Alternaria porri y Alternaria allii. Las especies de esporas pequeñas son el grupo más común en alimentos, encontrándose en dicho grupo Alternaria tenuissima, Alternaria alternata y Alternaria arborescens. Particularmente, las especies de Alternaria de esporas pequeñas son un grupo difícil de clasificar debido a sus pocos caracteres morfológicos característicos, lo que dificulta la discriminación clara entre especies4. Para resolver esta imposibilidad de distinción morfológica de los aislamientos se presentó un método para segregar especies de Alternaria productoras de esporas pequeñas en grupos de morfoespecies (grupos especie) identificables en base a diferentes modelos de esporulación32,33. Aun así es difícil caracterizar morfológicamente a las distintas especies dentro de un grupo. Una identificación correcta y precisa de estas especies es necesaria porque la especie reconocida bajo un determinado nombre representa un determinado conjunto de caracteres, como la preferencia de crecimiento en determinados sustratos, la interacción con el hospedador y la producción de metabolitos, lo que permite predecir su comportamiento2,5,11,26,31. Estas especies tienen la capacidad de producir metabolitos secundarios, que pueden desempeñar un papel importante en la patogénesis de las plantas, y también ser tóxicos para el hombre y los animales17,18. Entre los principales metabolitos secundarios tóxicos producidos se han reportado el ácido tenuazónico (TeA), el alternariol monometil éter (AME), las altertoxinas i, ii y iii, el altenueno (ALT), la curvularina (CURV) y la dehidrocurvularina (DHCURV)1,8,23,35. Las micotoxinas de Alternaria se producen ampliamente en muchos productos alimenticios, en los que a menudo pueden presentarse junto a micotoxinas producidas por especies de hongos pertenecientes a otros géneros. El consumo de estos productos puede, por lo tanto, contribuir a un aumento en la ingestión de las micotoxinas en la dieta humana. Sin embargo, los datos sobre la presencia de toxinas de Alternaria en los alimentos son demasiado limitados para hacer una evaluación de la exposición a estas micotoxinas16,17.
El perfil característico de los metabolitos secundarios puede ser de utilidad en la clasificación de las especies dentro del género como una herramienta adicional al uso de caracteres morfológicos que, como en el caso de algunas estructuras de reproducción, no se diferencian en las condiciones de laboratorio12. Con el avance de las técnicas moleculares, varios estudios han examinado las relaciones taxonómicas entre las especies de Alternaria productoras de esporas pequeñas usando una variedad de métodos, en un intento de establecer consensos con las distintas clasificaciones basadas en características morfológicas. Los estudios moleculares muestran que este grupo de especies posee poca resolución en su filogenia molecular26. Un enfoque polifásico incluyendo la morfología, los análisis moleculares y el perfil de los metabolitos secundarios puede aportar diversos marcadores que permitan caracterizar los distintos aislamientos del género Alternaria3. El objetivo del presente trabajo fue determinar los perfiles de metabolitos secundarios característicos de cepas de Alternaria aisladas de tomate mediante HPLC-espectrometría de masas (MS), para utilizarlos en la clasificación de este género fúngico.
Materiales y métodosMuestreoSe recolectaron frutos de tomate afectados por «enmohecimiento negro» en las localidades de La Plata, Florencio Varela y San Pedro, de la provincia de Buenos Aires, Argentina. Las muestras fueron enviadas al Laboratorio de Microbiología de Alimentos de la Facultad de Ciencias Exactas de la Universidad de Buenos Aires, donde se conservaron a 4°C hasta el momento del análisis.
Cultivos de referenciaSe contó con 4 cultivos de referencia provenientes de la colección del Dr. Emmory G. Simmons, Indiana, EE. UU., para ayudar a la clasificación morfológica: A. alternata (EGS 34128), A. tenuissima (EGS 34015), A. arborescens (EGS 39128) y A. infectoria (EGS 27193). Los cultivos de referencia están disponibles en la colección del CBS Fungal Biodiversity Centre, Utrech, Países Bajos. Se ensayó el perfil de metabolitos de estos 4 cultivos: A. alternata (alternariol [AOH], alternariol monometil éter [AME], ALT), A. tenuissima (TeA, AOH, AME), A. arborescens (TeA, AOH, AME; AAL TA); A. infectoria no produce ninguno de los metabolitos estudiados.
AislamientoCon el objeto de obtener cultivos puros de Alternaria, se tomaron con un bisturí estéril fragmentos de tejido de la zona de tomate infectada. Se colocaron sobre placas de Petri con medio dicloran-cloranfenicol-malta-agar25 y fueron incubados a 25°C durante 7 días. Preparaciones hechas a partir de las colonias que mostraron características distintivas del género Alternaria (micelio oscuro y reverso negro) fueron observadas microscópicamente para la confirmación del género, basada en la presencia de dictiosporas. Cada una de las colonias obtenidas en las placas de aislamiento general fueron reaisladas por inoculación con ansa de pequeños trozos de micelio o esporas a placas con medio de cultivo dicloran-cloranfenicol-malta-agar e incubadas hasta su esporulación a 25°C.
Caracterización de los aislamientosIdentificación morfológicaPara la caracterización morfológica los aislamientos fueron sembrados en agar papa zanahoria25 e incubados a 25°C durante 7 días en ciclos alternantes de luz-oscuridad (8-16h). Una vez obtenidos los cultivos monospóricos20 se procedió a la determinación del grupo especie al que cada aislamiento pertenecía según su modelo de esporulación32,33.
Producción de metabolitos secundariosA partir de los cultivos monospóricos de 7 días a 25°C en agar papa zanahoria se extrajeron porciones de 5mm de diámetro que se sembraron en 7 cajas de Petri con medios inductores de la producción de metabolitos secundarios: agar dicloran-Rosa de Bengala-extracto de levadura-sacarosa, agar extracto de malta, agar sacarosa extracto de levadura, agar avena, agar papa sacarosa, agar sacarosa nitrito3 y agar tomate27. Todos los medios fueron incubados a 25°C durante 14 días en oscuridad.
Extracción de los metabolitos secundariosSe realizó siempre la extracción de 2 porciones de 5mm de diámetro del medio de la colonia, de cada uno de los cultivos que crecían en los 7 medios inductores de la producción de metabolitos. Las 7 porciones se colocaron en un recipiente adecuado y se realizó la extracción de los metabolitos siguiendo la metodología descrita por Andersen et al. (2002)3.
Obtención de perfiles de metabolitos por cromatografía líquida de alta resolución-espectrometría de masasEl análisis por HPLC-MS se realizó en un equipo QTOF, de Bruker (MicrOTOF-Q II®), con HPLC Agilent serie 1200® con inyector automático y detector de arreglo de diodos. Se realizaron simultáneamente la MS y MS/MS. Condiciones de MS: ESI modo positivo. Potencial del capilar: 4,5kV; gas nebulizador: 3bar; gas de secado: 6l/min; temperatura: 200°C. Condiciones de MS/MS: se empleó el modo automático de selección de iones en el cuadrupolo, y se aplicaron energías de colisión (CID) de entre 15 y 25eV según el rango de masas en la celda de colisión. Se empleó argón como gas de colisión. El instrumento se calibró con una solución de formiato de sodio que da numerosos iones en el rango de masa registrado. Condiciones de HPLC: solvente A, HCOOH 0,1%; solvente B, MeOH 0,3ml/min. Temperatura 30°C, gradiente T de 0 a 15min; A: 80, B: 20; T de 15 a 25min; A: 0, B: 100.
La adquisición de datos y el procesado de los espectros se realizaron con el software Bruker Compass® DataAnalysis versión 4.0. Todas las relaciones m/z fueron obtenidas con alta precisión, lo que permitió obtener las fórmulas moleculares de los metabolitos sujetos a análisis. Los espectros de MS/MS se utilizaron para confirmar la identidad de las micotoxinas, además de la comparación de sus tiempos de retención con estándares.
ResultadosCaracterización morfológicaDe un total de 32 muestras analizadas se obtuvieron 70 aislamientos del género Alternaria a partir de frutos de tomate naturalmente infectados. De acuerdo con las características morfológicas se determinaron un total de 48/70 (69%) aislamientos pertenecientes al grupo especie A. tenuissima, 17/70 (24%) pertenecientes al grupo especie A. arborescens y 5/70 (7%) aislamientos pertenecientes al grupo especie A. alternata.
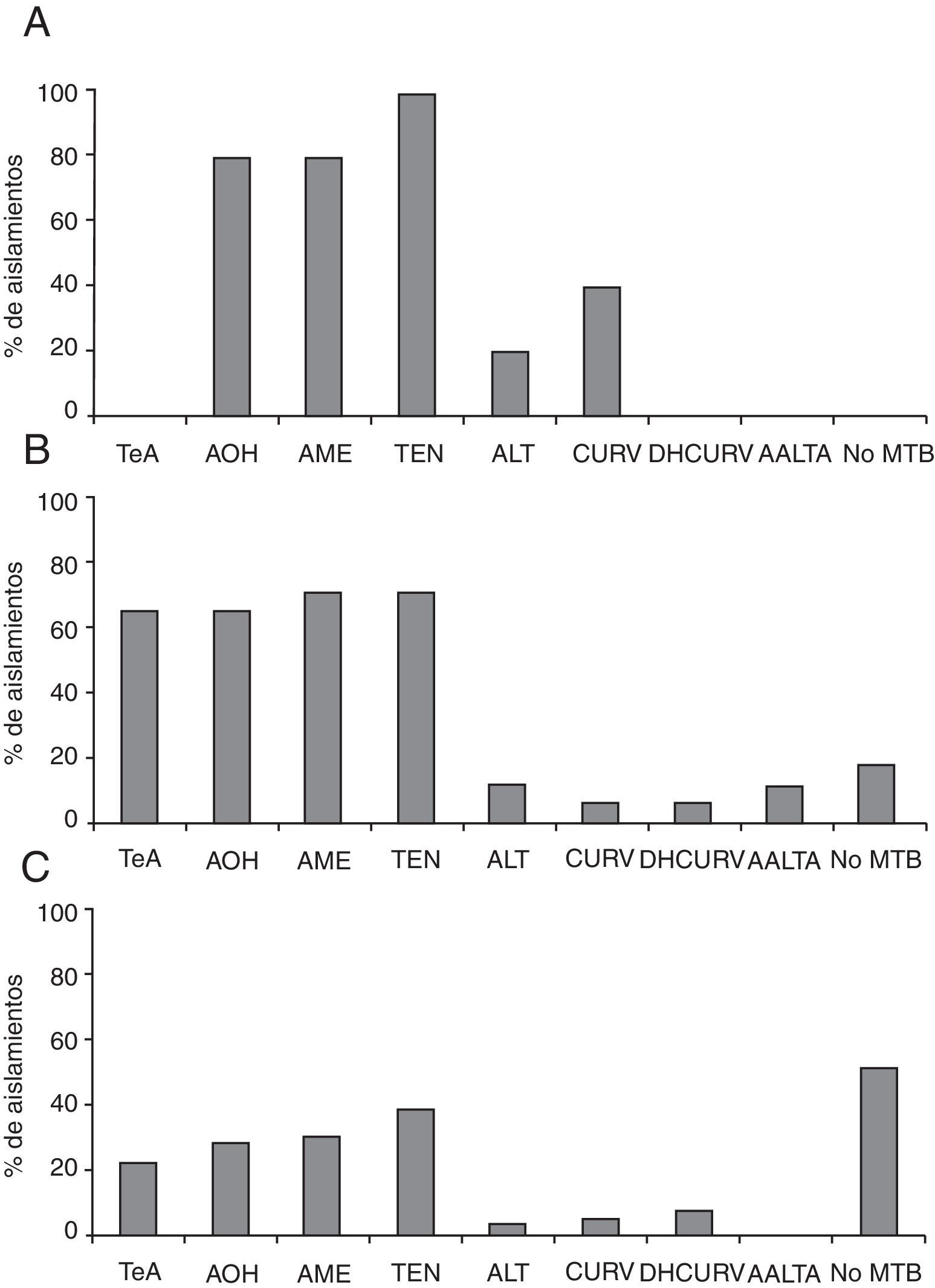
Perfiles de producción de metabolitos secundariosSe determinó la presencia o ausencia de los metabolitos que se detallan en la tabla 1 para cada uno de los aislamientos. Se obtuvieron los cromatogramas por HPLC-MS de los diferentes extractos que contenían los compuestos sintetizados por cada uno de los aislamientos estudiados. En la figura 1 se muestran los perfiles de producción de metabolitos secundarios de los aislamientos autóctonos de A. alternata, A. tenuissima y A. arborescens. El 60% de los aislamientos fue capaz de sintetizar alguno de los metabolitos estudiados, y en la mayoría de los casos varios de ellos de forma simultánea. AME fue producido por el 44% de los aislamientos, AOH por el 41%, TeA por el 31%, tentoxina (TEN) por el 51%, ALT por el 7%, CURV por el 9%, DHCURV por el 7% y AAL TA por el 3%. Comparando los perfiles de producción para cada uno de los grupos especie aislados, se observó que de los aislamientos pertenecientes al grupo especie A. tenuissima (fig. 1 C), un 23% produjeron TeA, un 29% produjeron AOH, un 31% produjeron AME, un 40% produjeron TEN, un 4% produjeron ALT, un 6% produjeron CURV, un 8% produjeron DHCURV, y solo un aislamiento (2%) produjo altertoxina i. Ningún aislamiento produjo AAL TA. Del total de aislamientos de este grupo especie, el 52% no produjeron ninguno de los metabolitos investigados. El grupo especie A. alternata (fig. 1 A) presentó solo 5 aislamientos y un perfil distinto de producción de metabolitos secundarios. Todos los aislamientos resultaron productores de al menos un metabolito, produciendo el 80% de los aislamientos AOH y AME, el 100% TEN, el 20% ALT, el 40% CURV y no observándose la producción de TeA, DHCURV ni AAL TA. Los aislamientos del grupo especie A. arborescens (fig. 1 B) presentaron un perfil similar a los pertenecientes al grupo especie A. alternata en cuanto a la proporción de aislamientos productores de AOH y AME, que resultó en 65 y 71%, respectivamente. Por otro lado, en este grupo especie se detectó una mucho mayor proporción de aislamientos productores de TeA (65%) que entre los aislamientos del grupo especie A. tenuissima. En cuanto a la producción de TEN, los aislamientos de este grupo presentaron un comportamiento intermedio entre los de los 2 grupos anteriores (71%). Los metabolitos producidos en proporciones minoritarias fueron ALT (12%), CURV y DHCURV (6%). Las toxinas AAL solo fueron producidas por aislamientos de A. arborescens, aunque en muy baja proporción (12%). El 17,6% de los aislamientos de este grupo no produjeron ninguno de los metabolitos estudiados.
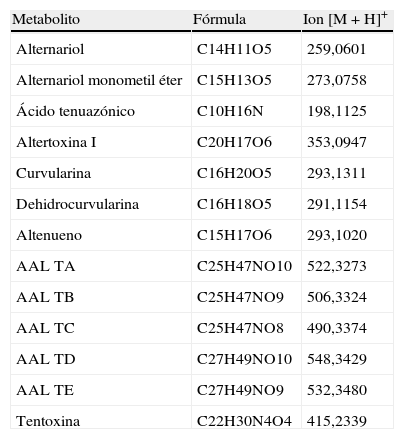
Metabolitos secundarios investigados en especies de Alternaria aisladas de tomate
| Metabolito | Fórmula | Ion [M+H]+ |
| Alternariol | C14H11O5 | 259,0601 |
| Alternariol monometil éter | C15H13O5 | 273,0758 |
| Ácido tenuazónico | C10H16N | 198,1125 |
| Altertoxina I | C20H17O6 | 353,0947 |
| Curvularina | C16H20O5 | 293,1311 |
| Dehidrocurvularina | C16H18O5 | 291,1154 |
| Altenueno | C15H17O6 | 293,1020 |
| AAL TA | C25H47NO10 | 522,3273 |
| AAL TB | C25H47NO9 | 506,3324 |
| AAL TC | C25H47NO8 | 490,3374 |
| AAL TD | C27H49NO10 | 548,3429 |
| AAL TE | C27H49NO9 | 532,3480 |
| Tentoxina | C22H30N4O4 | 415,2339 |
Perfiles de producción de metabolitos secundarios de los aislamientos pertenecientes a los grupos especie: A) A. alternata; B) A. arborescens; C) A. tenuissima.
AAL TA: toxinas AAL-A; ALT: altenueno; AME: alternariol monometil éter; AOH: alternariol; CURV: curvularina; DHCURV: dehidrocurvularina; No MTB: no produce ningún metabolito; TeA: ácido tenuazónico; TEN: tentoxina.
El 17% de los aislamientos de A. tenuissima produjo simultáneamente los 4 metabolitos secundarios, TeA, AOH, AME y TEN, siendo este el perfil más frecuente. El 10% coprodujo AOH, AME y TEN, y el 2% coprodujo TeA, AOH y AME o TeA y TEN. El 80% de los aislamientos pertenecientes al grupo especie A. alternata coprodujeron AOH, AME y TEN, siendo este el perfil característico. Dentro del mismo se distinguieron 3 subgrupos de aislamientos: los productores de AOH, AME y TEN solamente (20%), los que además de los 3 metabolitos principales produjeron CURV (40%), y los que coprodujeron los 3 metabolitos junto con ALT (20,0%). Este grupo especie fue el único donde no se detectó la producción de TeA y donde todos los aislamientos resultaron productores de al menos un metabolito. Los aislamientos pertenecientes al grupo especie A. arborescens presentaron un perfil similar al de los de A. tenuissima en cuanto a la coproducción de TeA, AOH, AME y TEN, siendo este también el perfil predominante en este grupo, con un total de 41% de los aislamientos que producen simultáneamente los 4 metabolitos. Sin embargo, es importante señalar que en este grupo se halló un número mucho más elevado de cepas productoras que en el grupo especie A. tenuissima. La producción simultánea de TeA, AOH, AME, TEN y AAL TA por el 12% de los aislamientos parece ser un perfil determinante de este grupo especie, ya que las toxinas AAL son producidas exclusivamente por miembros de este grupo. No se pudo determinar un perfil de grupo especie para utilizar como herramienta en la identificación, aunque sí pudieron observarse patrones de coproducción (tabla 2).
Perfiles de producción de metabolitos secundarios
| A. tenuissima | A. alternata | A. arborescens | |||||||
| Ácido tenuazónico | + | − | + | + | − | − | − | + | + |
| Alternariol | + | + | + | − | + | + | + | + | + |
| Alternariol monometil éter | + | + | + | − | + | + | + | + | + |
| Tentoxina | + | + | − | + | + | + | + | + | + |
| Curvularina | − | − | − | − | − | + | − | − | − |
| Altenueno | − | − | − | − | − | − | + | − | − |
| AAL TA | − | − | − | − | − | − | − | − | + |
| Porcentaje de aislamientos | 17 | 10 | 2 | 2 | 20 | 40 | 20 | 41 | 12 |
Existen opiniones que difieren fundamentalmente respecto a la utilidad de los caracteres morfológicos para la clasificación de especies de Alternaria productoras de esporas pequeñas. Un grupo de investigadores sostiene que los aislamientos cuyas dimensiones conidiales caen dentro de aquellas publicadas para A. alternata10 deben ser clasificados dentro de esta especie, afirmando que dichos aislamientos son morfológicamente indistinguibles de A. alternata. El sistema de nombrar aislamientos que producen toxinas específicas de huésped como patotipos de A. alternata considera que tales aislamientos son morfológicamente indistinguibles de esta especie22,30. Para resolver esta imposibilidad de distinción morfológica de los aislamientos, se presentó un método para segregar especies de Alternaria productoras de esporas pequeñas en grupos de morfoespecies (grupos especie) identificables en base a diferentes modelos de esporulación32,33. En el presente trabajo se clasificaron 70 aislamientos obtenidos a partir de frutos de tomate afectados por enmohecimiento negro, dentro de los grupos especie descriptos, a fin de determinar cuáles son las morfoespecies de Alternaria asociadas a esta enfermedad en nuestro país. Según sus características morfológicas, los 70 aislamientos de Alternaria fueron agrupados dentro de los grupos especie A. tenuissima, A. alternata y A. arborescens. Se determinó que el 69% de los aislamientos obtenidos a partir de lesiones típicas de enmohecimiento negro pertenecían al grupo especie A. tenuissima, siendo este el principal agente asociado a la enfermedad. El grupo especie A. arborescens fue el segundo agente causal en orden de importancia, con el 24% de los aislamientos. A diferencia de lo reportado en otros estudios, del grupo especie A. alternata solo se encontró un 7% de aislamientos. En un estudio llevado a cabo en Apulia (Italia) durante el verano de 1985 se reportó a A. alternata como la principal especie fúngica contaminante de tomates afectados por enmohecimiento negro en campo y una menor incidencia de A. tenuissima7. En otro estudio sobre un total de 228 frutos de tomate obtenidos de plantas de procesado de tomate de California, que presentaron lesiones características de enmohecimiento negro, A. alternata era también el principal agente causal de esta enfermedad19. Otros autores mencionan que los aislamientos de A. arborescens son también capaces de producir enmohecimiento negro sobre frutos de tomate maduros34. Resulta, además, importante destacar que la coinfección por más de un grupo especie de Alternaria ha sido observada en el presente trabajo. La contaminación simultánea con diferentes especies de Alternaria fue observada en 14 de un total de 32 muestras. A. tenuissima y A. arborescens fueron aisladas conjuntamente de 9 muestras, A. alternata y A. tenuissima de 3 muestras y A. alternata y A. arborescens de una muestra. La presencia de las 3 especies se encontró solamente en una muestra.
Esto resulta importante desde el punto de vista toxicológico, considerando la posibilidad de producción de diferentes metabolitos secundarios por parte de las cepas y teniendo en cuenta que tales metabolitos pueden coexistir y tener efectos sinérgicos. Diferentes tipos de métodos moleculares han sido empleados para segregar o clasificar especies de Alternaria productoras de esporas pequeñas, pero los resultados de estos estudios han sido variables. Los mismos incluyeron análisis RAPD (Random Amplification of Polymorphic DNA) combinado con análisis de «clusters»9,24,29, AFLP (Amplified Fragment Length Polymorphism)6, RFLP (Restriction Fragment Length Polymorphism)13,15 y secuenciación de genes con análisis de clusters o parsimonia13,14,26,28,34,36. Un total de 260 aislamientos de Alternaria productores de esporas pequeñas obtenidos a partir de diferentes tipos de frutas fueron sujetos a un análisis de RAPD-PCR, concluyéndose que A. alternata, Alternaria gaisen, Alternaria longipes y otros taxa saprofitos productores de esporas pequeñas son reconocibles como taxa distintos morfológicamente, evidenciando que el sistema de nombrar taxa de Alternaria productoras de esporas pequeñas como «patotipos» no confiere valor predictivo relativo a caracteres morfológicos observables y genéticos, y debería ser abandonado29. En otro estudio34, de acuerdo con los resultados obtenidos a partir del análisis de AFLPs empleando el ADN genómico total y 3 diferentes primers, no fue posible segregar claramente los diferentes aislamientos de Alternaria obtenidos a partir de frutos de tomate afectados por enmohecimiento negro pertenecientes a los grupos especie A. alternata y A. tenuissima, si bien se han podido agrupar aislamientos pertenecientes al grupo especie A. arborescens en un cluster y al grupo especie A. infectoria en otro. La caracterización de las especies de Alternaria basada en el análisis morfológico y molecular es importante para una correcta identificación, pero generalmente no es suficiente para diferenciar entre grupos de especies afines.
Por otra parte, los perfiles de metabolitos secundarios sintetizados bajo condiciones de cultivo estandarizadas han sido utilizados con éxito para la identificación y clasificación de especies similares21, especialmente entre grupos especie de Alternaria de esporas pequeñas2. Se ha informado que aislamientos pertenecientes a los grupos especie A. alternata, A. tenuissima y A. arborescens producen la mayor parte de los metabolitos conocidos. En el presente estudio, representantes de los 3 grupos produjeron AOH, AME, TEN, ALT y CURV. En el grupo especie A. alternata se produjeron también ALT y CURV, pero no TeA. La producción de TeA y ALT es común entre los aislamientos de los grupos especie A. tenuissima y A. arborescens, en el primero de los cuales también se produjo altertoxina i. Los únicos metabolitos específicos del grupo especie A. arborescens son las toxinas AAL. Muchos aislamientos dentro de estos 3 grupos especie son capaces de producir TEN, un tetrapéptido cíclico que causa la clorosis en varias plantas sensibles7. En el presente trabajo el 80% de los aislamientos pertenecientes al grupo especie A. alternata coprodujeron AOH, AME y TEN. Este grupo fue el único donde no se detectó la producción de TeA y donde todos los aislamientos resultaron productores de al menos un metabolito. Estos resultados concuerdan con datos reportados en la bibliografía3, aunque los 3 aislamientos del grupo especie estudiados en dicho trabajo produjeron también ALT, y en el presente trabajo este metabolito solo fue producido por un aislamiento. Los aislamientos pertenecientes al grupo especie A. arborescens presentaron en un alto porcentaje (41%) un perfil similar al de los de A. tenuissima (coproducción de TeA, AOH, AME y TEN), aunque es importante señalar que presentaron, asimismo, una mayor proporción de cepas productoras. La producción simultánea de TeA, AOH, AME y AAL TA por el 12% de los aislamientos de A. arborescens parecería ser un perfil interesante para ser estudiado dentro de este grupo especie, ya que las toxinas AAL son producidas exclusivamente por miembros de este grupo y podrían ser utilizadas como un posible marcador quimiotaxonómico. Es importante destacar que si bien se han podido determinar los perfiles de producción característicos de cada grupo especie, existe una proporción considerable de aislamientos donde los perfiles se solapan. Eso ocurre entre el 10% de los aislamientos del grupo especie de A. tenuissima y el 20% de los pertenecientes al grupo especie A. alternata que presentan idéntico perfil (AME, AOH y TEN). Se observó, además, que el 41% de los aislamientos del grupo especie A. arborescens fue capaz de sintetizar el mismo perfil (TeA, AOH, AME y TEN) que el 17% de los aislamientos del grupo especie A. tenuissima.
La tendencia más reciente para lograr la identificación precisa de las especies de Alternaria es un enfoque polifásico que integra 3 aspectos: las características morfológicas en medios estandarizados, el análisis molecular y los perfiles de metabolitos secundarios. La combinación de toda la información proporcionada por las diferentes perspectivas representa una poderosa herramienta para la clasificación de este género complejo26. Si bien se han podido determinar los perfiles característicos de los grupos especie A. alternata, A. tenuissima y A. arborescens, existen numerosos aislamientos dentro de cada grupo que comparten perfiles donde alguna de las toxinas no es producida. Aunque dentro de los 3 grupos se encuentran aislamientos productores de las toxinas de Alternaria más comunes (AOH, AME y TEN), se pueden diferenciar los aislamientos de A. alternata, ya que no producen TeA, a diferencia de los aislamientos de los otros 2 grupos. Este sería un criterio muy importante a tener en cuenta, ya que no ha sido posible separar por métodos moleculares en diferentes clusters los grupos especie A. alternata y A. tenuissima. Los aislamientos pertenecientes al grupo especie A. arborescens presentaron en su mayoría un perfil de producción de metabolitos secundarios similar al del grupo especie A. tenuissima, pero podría ser diferenciado de este por sus características morfológicas y por técnicas moleculares26,34.
La producción de metabolitos secundarios por parte de aislamientos pertenecientes a grupos especie de Alternaria constituye una herramienta adicional al uso de caracteres morfológicos y moleculares para la identificación de las mismas, pero no constituye en sí mismo un carácter que pueda ser usado para tal fin, ya que no pudo determinarse un único perfil o patrón de producción de grupo especie.
FinanciaciónEste proyecto ha sido financiado por la Universidad de Buenos Aires y el Consejo Nacional de Investigaciones Científicas y Técnicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.