Agaricus subrufescens Peck es un hongo cuyo cultivo ha despertado gran interés en todo el mundo en los últimos años, adquiriendo gran popularidad. Sus propiedades medicinales y culinarias hacen prever una rápida expansión del cultivo en todo el mundo.
ObjetivosEl trabajo plantea como objetivo la evaluación del efecto sobre los principales parámetros de producción de 3 cepas de Agaricus subrufescens que se han hecho fructificar sobre 5 capas de cobertura diferentes.
MétodosSe ha llevado a cabo un ciclo de cultivo de Agaricus subrufescens en condiciones controladas en el que se han evaluado los principales parámetros de producción.
ResultadosLos mejores resultados han sido proporcionados por la cepa ABL 99/30. Las coberturas basadas en turba presentan mejor comportamiento que las basadas en suelo mineral. El mayor rendimiento (6,75kg/m−2, eficiencia biológica 27,57kg/dt) ha sido proporcionado por la combinación ABL 99/30-Euroveen.
ConclusionesNuestros resultados evidencian que la combinación de la cepa ABL 99/30 utilizando una capa de cobertura basada en turba (Euroveen) ofrece un alto potencial para ser utilizada a escala comercial por el sector productor de hongos. La disponibilidad de alternativas a las especies de hongos comestibles cultivadas habitualmente puede suponer un mejor aprovechamiento de recursos y una mayor rentabilidad económica de la actividad.
Agaricus subrufescens Peck is a mushroom whose cultivation has aroused great interest worldwide in recent years, and is becoming increasingly popular. A rapid expansion of culture throughout the world is foreseen because of its medicinal and culinary properties.
AimsThis work assesses the effect of 5 different casing layers on the production of 3 strains of Agaricus subrufescens.
MethodsA growth cycle of Agaricus subrufescens under controlled conditions has been carried out. The main production parameters were evaluated.
ResultsThe best results were provided by the ABL 99/30 strain. Peat-based casings have a better yield than those based on mineral soil. The highest yield (6.75kg/m2, biological efficiency 27.57kg/dt) was provided by the combination ABL 99/30-Euroveen.
ConclusionsOur results suggest that the combination of the strain ABL 99/30 using a peat-based casing layer (Euroveen) offers a high potential for use on a commercial scale by the edible mushroom production sector. The availability of alternatives to the usually cultivated species can make better use of resources, and increase the profitability of this activity.
En los últimos años, el cultivo del hongo Agaricus subrufescens Peck ha despertado gran interés en todo el mundo, adquiriendo gran popularidad. Es frecuente encontrar referencias al mismo como Agaricus blazei (Murrill) ss. Heinemann o Agaricus brasiliensis Wasser, aunque estos nombres se presentan, no sin cierta polémica, como incorrectamente aplicados o ilegítimos9,21. Más comúnmente se le conoce como «Cogumedo Piedade», «Cogumelo do sol», «Cogumelo de Deus», «Portobello de almendra» o «Cogumelo medicinel» en Brasil, «Himematsutake», «Agarikusutake» y «Kawariharatake» en Japón, «Ji Song Rong» en China y «Almond mushroom» en Norteamérica6,14,28.
El cultivo se encuentra bien establecido en Brasil, Japón, China y Korea8, aunque se está originando la expansión del cultivo a otros muchos países, debido a su alto precio en los mercados internacionales, hecho que puede asociarse no solo a su importante valor medicinal, debido a los numerosos compuestos bioactivos que contiene, sino también al culinario, dado su agradable aroma ligeramente almendrado11. Se comercializa en fresco, pero mayoritariamente deshidratado o pulverizado, en cápsulas, comprimidos e infusiones, siendo también utilizado como ingrediente de productos cosméticos20,21.
Las propiedades medicinales de A. subrufescens han sido destacadas en diversos estudios revisados recientemente por Wisitrassameewong et al. (2012)21. Se ha utilizado tradicionalmente para tratar muchas enfermedades comunes, como aterosclerosis, hepatitis, hiperlipidemia, diabetes, dermatitis y cáncer6. Entre las propiedades beneficiosas de A. subrufescens que han sido publicadas se encuentran reducciones en el crecimiento de tumores, actividades inmunomoduladoras, efectos inmunoestimuladores, actividades antimicrobianas y antivirales, y efectos antialérgicos21.
Para su cultivo se han adoptado los procesos y técnicas previamente establecidos para la producción de champiñón Agaricus bisporus (Lange) Imbach, aunque la tecnología específica de cultivo se encuentra todavía en desarrollo17. Diferentes parámetros, como las condiciones de cultivo en las diferentes etapas del ciclo (temperatura, humedad relativa, concentración de dióxido de carbono, iluminación), los materiales, el proceso de elaboración de los composts y su contenido en humedad, unido a los diferentes aspectos relativos a las capas de cobertura y la fructificación deben ser estudiados para incrementar los rendimientos, adaptando el cultivo a las condiciones específicas de los distintos países productores.
La aplicación de una capa de cobertura sobre el compost colonizado de micelio es una operación imprescindible en la producción comercial tanto de A. bisporus como de A. subrufescens. En esta capa es donde se produce el cambio de la fase de crecimiento vegetativo al reproductivo. En el caso de A. bisporus, numerosos materiales son usados con este fin, siendo diferentes tipos de turbas los más extendidos en todo el mundo, debido principalmente a sus excepcionales propiedades estructurales y de retención de agua22. Para el caso de A. subrufescens, los materiales utilizados vienen condicionados en la mayoría de los casos por su disponibilidad en los países productores. Así, se utilizan habitualmente coberturas basadas en suelos minerales y distintos tipos de turbas locales, aunque podemos encontrar entre sus ingredientes otros materiales, como esquisto calizo, carbón vegetal, serrines, arena, vermiculita, corteza de pino y fibra de coco, entre otros1,2,18,19,23,24,26.
Debido a sus requerimientos en cuanto a las condiciones de cultivo necesarias, en concreto a la alta temperatura ambiental, la producción de A. subrufescens constituye una alternativa a considerar por parte del sector productor de hongos comestibles en España y otros países para mantener la actividad en los meses de verano. En la actualidad este sector se centra principalmente en la producción de A. bisporus, Agaricus bitorquis y Pleurotus spp. Dada la limitada capacidad tecnológica de muchas de las instalaciones de cultivo y el elevado coste energético, la producción se reduce de manera notable en la época estival. Estas mismas instalaciones podrían ser aprovechadas por los productores para llevar a cabo un ciclo de cultivo de A. subrufescens en esos meses17. La tecnología de producción de A. bisporus, en cuanto a la elaboración de sustratos y manejo del ciclo de cultivo, se puede aplicar en su mayoría a A. subrufescens, por lo que no debe producirse ningún problema de adaptación de los productores a la nueva especie cultivada. Además, las condiciones de comercialización del hongo, principalmente deshidratado, evitan la limitación que supone la corta vida útil que presentan en general los hongos comestibles cultivados y permite una comercialización escalonada a lo largo del año. Recientemente, Savoie et al. (2012) han estudiado la viabilidad del cultivo de A. subrufescens utilizando tecnologías e instalaciones existentes en Europa para la producción de champiñón en las diferentes etapas del proceso17.
Con objeto de facilitar la implantación de este cultivo, sirviendo de orientación a los productores, se han evaluado en el presente trabajo los principales parámetros de producción de A. subrufescens a partir de 3 cepas de origen brasileño que se han hecho fructificar sobre 5 capas de cobertura diferentes utilizadas habitualmente en Europa para el cultivo de A. bisporus.
Materiales y métodosAnálisis físicos, químicos y biológicosPara la caracterización física, química y biológica del compost y las mezclas de cobertura se realizaron las siguientes determinaciones: humedad, pH, conductividad eléctrica, contenido en nitrógeno total, materia orgánica y cenizas, relación carbono/nitrógeno, fibra bruta, grasa bruta, celulosa, hemicelulosa, lignina y compuestos solubles neutrodetergentes, densidad real, densidad aparente, porosidad total y capacidad de retención de agua, nematodos, ácaros y hongos competidores. Se utilizó para ello la metodología descrita por Pardo-Giménez et al. (2012)16.
CompostComo sustrato de base para el cultivo de A. subrufescens se utilizó un compost comercial, correspondiente al grupo de los denominados «semisintéticos» y elaborado según la tecnología adoptada para el cultivo de A. bisporus. El proceso de compostaje se llevó a cabo en las siguientes etapas: mezcla de materiales y premojado (4 días con volteo diario), fase i de fermentación en túnel (8 días, con volteos cada 2 días) y fase ii de pasteurización (60±2°C, 8h) y acondicionamiento (45-50°C, 5 días). Las materias primas utilizadas fueron paja de trigo como material de base, gallinaza y urea como suplementos nitrogenados, y yeso como mejorador de estructura y corrector de pH. Las características analíticas fueron las siguientes: humedad=648g/kg; pH (1:5, p/v)=7,55; materia orgánica=678,1g/kg; nitrógeno total=22,7g/kg; relación carbono/nitrógeno=17,3; contenido en cenizas=321,9g/kg; fibra bruta=243,4g/kg; grasa bruta=2,5g/kg; hemicelulosa=94,9g/kg; celulosa=189,3g/kg; lignina=174,6g/kg y compuestos solubles neutrodetergentes=219,3g/kg. Todos los valores observados se ajustaron al rango considerado como óptimo para el cultivo de champiñón27. La ausencia de ácaros y nematodos fue indicadora de un proceso de pasteurización suficiente.
Cepas de micelio seleccionadasLas 3 cepas objeto de estudio fueron obtenidas de la micoteca del Módulo de Cogumelos de la Facultad de Ciencias Agronómicas (Universidad Estadual Paulista, Brasil): ABL 99/30, aislada en Piedade, São Paulo, Brasil, en 1999; ABL 03/44, aislada en Lençóis Paulista, São Paulo, Brasil, en 2003; y ABL 04/49, aislada en São José do Rio Preto, São Paulo, Brasil, en 2004. En el trabajo de Zied (2011) se recopilan las principales características específicas de las cepas seleccionadas23. El sustrato para la preparación del inóculo consistió en una mezcla de granos de trigo, carbonato cálcico y yeso. Se sometió el grano de trigo a ebullición en agua durante unos 25min hasta alcanzar un contenido en humedad aproximado del 50%, tras lo cual se añadieron CaCO3 (20g/kg) y yeso (10g/kg). Tras la homogeneización se transfirió el sustrato a frascos de vidrio, procediéndose a su autoclavado a 121°C durante 2h. Una vez frío, el sustrato se inoculó de acuerdo con la metodología descrita por Zied et al. (2011)23.
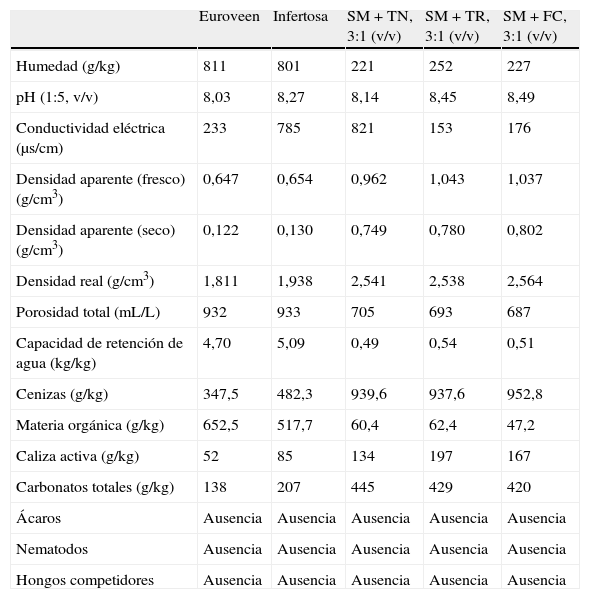
CoberturasSe evaluaron 5 tipos de cobertura diferentes, 2 de ellos mayoritariamente orgánicos, basados en turbas, y 3 mayoritariamente inorgánicos, basados en suelo mineral: a) Euroveen, cobertura comercial de origen holandés (Euroveen B.V., Grubbenvorst, Holanda); b) Infertosa, cobertura comercial de origen español (Infertosa, Valencia, España); c) suelo mineral (SM)+turba negra, mezcla de SM y turba negra en proporción 3:1 (v/v); d) SM+turba rubia, mezcla de SM y turba rubia en proporción 3:1 (v/v), y e) SM+fibra de coco (FC), mezcla de SM y fibra de coco en proporción 3:1 (v/v). Las principales características de las mismas se presentan en la tabla 1. Antes de su aplicación, todas las coberturas fueron sometidas a un tratamiento desinfectante con formalina (1,5L/m3). Debido a las diferentes características de las coberturas y con objeto de conseguir una aparición de micelio uniforme en la sala de cultivo en el momento de la inducción de la fructificación, se aplicaron las mismas sobre el compost con diferentes espesores, 3,75cm en el caso de Euroveen e Infertosa, y 3cm para las basadas en suelo mineral.
Caracterización analítica de los materiales de cobertura utilizados
| Euroveen | Infertosa | SM+TN, 3:1 (v/v) | SM+TR, 3:1 (v/v) | SM+FC, 3:1 (v/v) | |
| Humedad (g/kg) | 811 | 801 | 221 | 252 | 227 |
| pH (1:5, v/v) | 8,03 | 8,27 | 8,14 | 8,45 | 8,49 |
| Conductividad eléctrica (μs/cm) | 233 | 785 | 821 | 153 | 176 |
| Densidad aparente (fresco) (g/cm3) | 0,647 | 0,654 | 0,962 | 1,043 | 1,037 |
| Densidad aparente (seco) (g/cm3) | 0,122 | 0,130 | 0,749 | 0,780 | 0,802 |
| Densidad real (g/cm3) | 1,811 | 1,938 | 2,541 | 2,538 | 2,564 |
| Porosidad total (mL/L) | 932 | 933 | 705 | 693 | 687 |
| Capacidad de retención de agua (kg/kg) | 4,70 | 5,09 | 0,49 | 0,54 | 0,51 |
| Cenizas (g/kg) | 347,5 | 482,3 | 939,6 | 937,6 | 952,8 |
| Materia orgánica (g/kg) | 652,5 | 517,7 | 60,4 | 62,4 | 47,2 |
| Caliza activa (g/kg) | 52 | 85 | 134 | 197 | 167 |
| Carbonatos totales (g/kg) | 138 | 207 | 445 | 429 | 420 |
| Ácaros | Ausencia | Ausencia | Ausencia | Ausencia | Ausencia |
| Nematodos | Ausencia | Ausencia | Ausencia | Ausencia | Ausencia |
| Hongos competidores | Ausencia | Ausencia | Ausencia | Ausencia | Ausencia |
FC: fibra de coco; TN: turba negra; TR: turba rubia; SM: suelo mineral.
El diseño experimental utilizado fue un plan factorial equilibrado 5×3 con 6 repeticiones. El factor 1, con 5 niveles, correspondió al tipo de cobertura. El factor 2, con 3 niveles, correspondió a la cepa utilizada. Se utilizaron un total de 90 cajas, colocadas en 2 niveles, a ambos lados de la sala de cultivo. Cada una de las cajas se llenó con 10kg de compost, compactado a razón de 450kg/m3, presentando una superficie a cubrir de 1.450cm2 (peso de llenado 69,0kg/m2).
Conducción y seguimiento del ciclo de cultivoEl ciclo de desarrollo de A. subrufescens se llevó a cabo en una sala de cultivo experimental, provista de sistemas de humidificación, calefacción/refrigeración, y recirculación/ventilación exterior, que permite el control automático de la temperatura y la humedad relativa, así como de la concentración de dióxido de carbono.
El compost fue inoculado con 12g/kg de micelio sobre grano en relación con el peso fresco de compost e incubado durante 20 días a 28±1°C, con humedad relativa del 95±2% y sin ventilación exterior ni iluminación. Completada la incubación se procedió a aplicar las capas de cobertura, manteniendo las condiciones ambientales de crecimiento vegetativo para facilitar la invasión de las mismas por parte del micelio del hongo. Las coberturas se rastrillaron 8 días después de su aplicación, al aparecer el micelio en superficie, y un día más tarde se procedió a inducir la fructificación reduciendo la temperatura ambiental (19±1°C), la humedad relativa (88±2%) y el nivel de dióxido de carbono (<800ppm), con iluminación (150lux, 12h/día). Tres días después se procedió a elevar de nuevo la temperatura ambiental (24±1°C), manteniéndola así a lo largo del ciclo de cultivo, disminuyendo puntualmente de nuevo a 19±1°C para inducir la segunda y tercera cosechas. La duración total del ciclo de cultivo fue de 82 días, recolectándose 3 cosechas.
Cosecha y parámetros de producciónLa recolección de los carpóforos se realizó diariamente en el estado óptimo comercial de desarrollo, con el mayor peso posible antes de la apertura del sombrero.
Para el establecimiento del rendimiento por unidad de superficie, se pesó, con precisión de 1g, la cantidad de carpóforos producidos diariamente por cada caja (1.450cm2), contando el número de hongos obtenidos. La eficiencia biológica (EB), una estimación práctica de la capacidad de los hongos de convertir sustrato en cuerpos fructíferos, se calculó dividiendo el peso total de champiñones producidos en el cultivo (3 cosechas) por el peso seco total del sustrato, expresando la fracción como kilogramos por 100kg (dt) de compost. La tasa de producción (EB media diaria) se calculó dividiendo la EB por el número total de días de producción desde el momento de la inoculación, expresando la fracción como kilogramos por dt de compost y por día. El peso promedio de los carpóforos, expresado en gramos, se determinó a partir del rendimiento obtenido y el número de carpóforos cosechados.
En el día de la máxima producción de la primera cosecha, se eligieron carpóforos de tamaño y madurez uniformes para el análisis del contenido en materia seca de los mismos. El método utilizado para ello consistió en la medida de la pérdida de peso tras desecación a 105°C durante al menos 72h, hasta peso constante12.
Análisis estadísticoPara la realización del análisis estadístico se utilizó el paquete informático StatGraphics Plus v. 4.1 (Statistical Graphics Corp., Princeton, NJ, EE. UU.). Se empleó la técnica de análisis de varianza para evaluar los datos. Para el establecimiento de diferencias significativas entre medias se utilizó el test de Tukey-HSD (p=0,05).
Resultados y discusiónLas características analíticas de las diferentes capas de cobertura evaluadas se presentan en la tabla 1. Como aspectos destacables encontramos que las coberturas basadas en turbas (Euroveen e Infertosa) presentan, con respecto a las basadas en suelo mineral, valores muy superiores de porosidad y capacidad de retención de agua, 2 de los principales atributos de una buena capa de cobertura. Un material poroso mejora la fructificación al facilitar el intercambio gaseoso, mientras que una alta capacidad de retención de agua supone una mayor disponibilidad para la formación y desarrollo de los carpóforos y aporte de humedad al microclima donde se produce la fructificación, a la vez que facilita las operaciones de riego. La utilización de suelo mineral en la preparación de las capas de cobertura implica un menor contenido en materia orgánica en las mismas, con mayores contenidos en caliza activa y carbonatos totales. La alta conductividad de las coberturas Infertosa y SM+turba negra (785 y 821μS/cm, respectivamente) es consecuencia del origen de las turbas utilizadas, aunque se encuentran por debajo del umbral encontrado como limitante para el caso de A. bisporus. Pardo-Giménez et al. (2004) fijaron en torno a 1.600μS/cm el umbral a partir del cual cabría esperar disminuciones notables de rendimiento15.
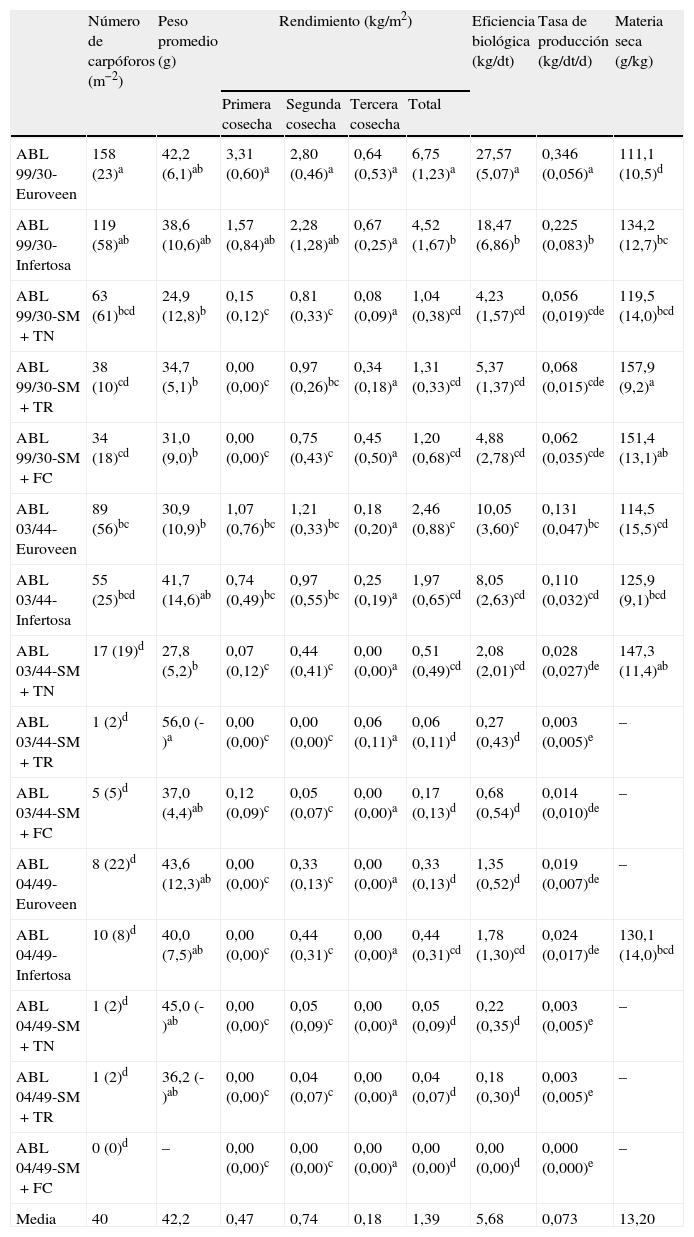
En la tabla 2 se presentan los resultados obtenidos para los parámetros de producción en cada uno de los tratamientos. Los datos de materia seca se presentan incompletos por producción insuficiente. Entre los aspectos más destacables, el mayor número de carpóforos por m2 (158) fue producido por la combinación ABL 99/30-Euroveen, seguido de la ABL 99/30-Infertosa (119). Estas mismas combinaciones proporcionaron los mayores valores de rendimiento, tanto total como en la primera y segunda cosechas, y también de EB. El mayor rendimiento (6,75kg/m2), con EB de 27,57kg/dt, significativamente superior a todos los demás, se obtuvo a partir de la combinación ABL 99/30-Euroveen, aunque los carpóforos presentaron un bajo contenido en materia seca (111,1g/kg). Esta combinación presentó igualmente el mayor valor de la tasa de producción (0,346kg/dt/d). Este parámetro resulta de gran interés para los productores, ya que altos valores del mismo van asociados a altos rendimientos y/o ciclos de producción cortos. Altos valores de EB suponen mayores ingresos, mientras que al reducir la duración de los ciclos de producción se consigue una recuperación más rápida de la inversión, a la vez que se reduce la posible incidencia de plagas y enfermedades. Teniendo en cuenta la humedad del compost y el contenido en materia seca de los carpóforos, el rendimiento proporcionado por la combinación ABL 99/30-Euroveen, expresado en base a materia seca de carpóforos sobre peso fresco de compost, supone una productividad del 1,08%. De acuerdo con Silva et al. (2007), en Brasil se considera que la productividad así expresada debe ser al menos del 1% para que el cultivo sea económicamente viable18. La combinación ABL 99/30-Infertosa, con rendimiento total de 4,52kg/m2 y una EB de 18,47kg/dt, supuso un productividad del 0,87%. El resto de combinaciones proporcionaron rendimientos significativamente inferiores.
Parámetros de producción obtenidos para cada uno de los tratamientos evaluados al cultivar 3 cepas de Agaricus subrufescens y aplicar 5 tipos diferentes de cobertura
| Número de carpóforos (m−2) | Peso promedio (g) | Rendimiento (kg/m2) | Eficiencia biológica (kg/dt) | Tasa de producción (kg/dt/d) | Materia seca (g/kg) | ||||
| Primera cosecha | Segunda cosecha | Tercera cosecha | Total | ||||||
| ABL 99/30-Euroveen | 158 (23)a | 42,2 (6,1)ab | 3,31 (0,60)a | 2,80 (0,46)a | 0,64 (0,53)a | 6,75 (1,23)a | 27,57 (5,07)a | 0,346 (0,056)a | 111,1 (10,5)d |
| ABL 99/30-Infertosa | 119 (58)ab | 38,6 (10,6)ab | 1,57 (0,84)ab | 2,28 (1,28)ab | 0,67 (0,25)a | 4,52 (1,67)b | 18,47 (6,86)b | 0,225 (0,083)b | 134,2 (12,7)bc |
| ABL 99/30-SM+TN | 63 (61)bcd | 24,9 (12,8)b | 0,15 (0,12)c | 0,81 (0,33)c | 0,08 (0,09)a | 1,04 (0,38)cd | 4,23 (1,57)cd | 0,056 (0,019)cde | 119,5 (14,0)bcd |
| ABL 99/30-SM+TR | 38 (10)cd | 34,7 (5,1)b | 0,00 (0,00)c | 0,97 (0,26)bc | 0,34 (0,18)a | 1,31 (0,33)cd | 5,37 (1,37)cd | 0,068 (0,015)cde | 157,9 (9,2)a |
| ABL 99/30-SM+FC | 34 (18)cd | 31,0 (9,0)b | 0,00 (0,00)c | 0,75 (0,43)c | 0,45 (0,50)a | 1,20 (0,68)cd | 4,88 (2,78)cd | 0,062 (0,035)cde | 151,4 (13,1)ab |
| ABL 03/44-Euroveen | 89 (56)bc | 30,9 (10,9)b | 1,07 (0,76)bc | 1,21 (0,33)bc | 0,18 (0,20)a | 2,46 (0,88)c | 10,05 (3,60)c | 0,131 (0,047)bc | 114,5 (15,5)cd |
| ABL 03/44-Infertosa | 55 (25)bcd | 41,7 (14,6)ab | 0,74 (0,49)bc | 0,97 (0,55)bc | 0,25 (0,19)a | 1,97 (0,65)cd | 8,05 (2,63)cd | 0,110 (0,032)cd | 125,9 (9,1)bcd |
| ABL 03/44-SM+TN | 17 (19)d | 27,8 (5,2)b | 0,07 (0,12)c | 0,44 (0,41)c | 0,00 (0,00)a | 0,51 (0,49)cd | 2,08 (2,01)cd | 0,028 (0,027)de | 147,3 (11,4)ab |
| ABL 03/44-SM+TR | 1 (2)d | 56,0 (-)a | 0,00 (0,00)c | 0,00 (0,00)c | 0,06 (0,11)a | 0,06 (0,11)d | 0,27 (0,43)d | 0,003 (0,005)e | – |
| ABL 03/44-SM+FC | 5 (5)d | 37,0 (4,4)ab | 0,12 (0,09)c | 0,05 (0,07)c | 0,00 (0,00)a | 0,17 (0,13)d | 0,68 (0,54)d | 0,014 (0,010)de | – |
| ABL 04/49-Euroveen | 8 (22)d | 43,6 (12,3)ab | 0,00 (0,00)c | 0,33 (0,13)c | 0,00 (0,00)a | 0,33 (0,13)d | 1,35 (0,52)d | 0,019 (0,007)de | – |
| ABL 04/49-Infertosa | 10 (8)d | 40,0 (7,5)ab | 0,00 (0,00)c | 0,44 (0,31)c | 0,00 (0,00)a | 0,44 (0,31)cd | 1,78 (1,30)cd | 0,024 (0,017)de | 130,1 (14,0)bcd |
| ABL 04/49-SM+TN | 1 (2)d | 45,0 (-)ab | 0,00 (0,00)c | 0,05 (0,09)c | 0,00 (0,00)a | 0,05 (0,09)d | 0,22 (0,35)d | 0,003 (0,005)e | – |
| ABL 04/49-SM+TR | 1 (2)d | 36,2 (-)ab | 0,00 (0,00)c | 0,04 (0,07)c | 0,00 (0,00)a | 0,04 (0,07)d | 0,18 (0,30)d | 0,003 (0,005)e | – |
| ABL 04/49-SM+FC | 0 (0)d | – | 0,00 (0,00)c | 0,00 (0,00)c | 0,00 (0,00)a | 0,00 (0,00)d | 0,00 (0,00)d | 0,000 (0,000)e | – |
| Media | 40 | 42,2 | 0,47 | 0,74 | 0,18 | 1,39 | 5,68 | 0,073 | 13,20 |
FC: fibra de coco; TN: turba negra; TR: turba rubia; SM: suelo mineral.
Sustrato: compost de champiñón. Fructificación a 19±1°C. Los valores entre paréntesis corresponden a la desviación estándar. Para cada columna, los valores seguidos de distinta letra en superíndice son significativamente diferentes entre sí (p≤0,05, test de Tukey).
Kopytowski-Filho y Minhoni (2007) evaluaron el comportamiento de la cepa ABL 99/30, utilizada en este trabajo, sobre 3 tipos de compost y 2 ambientes de cultivo, registrando valores de EB entre 21,1 y 34,9kg/dt compost, utilizando como cobertura una mezcla de suelo mineral y carbón vegetal10, aunque la duración del ciclo de cultivo adoptado por los autores fue de 177 días, más de 2 veces superior al empleado en la presente investigación.
Una revisión del efecto de diferentes tipos de cobertura sobre la producción de A. subrufescens observados por diferentes autores muestra cómo en Taiwán, Liang et al. (2008) obtuvieron un rendimiento máximo de 1,93kg/m2 utilizando como coberturas diferentes materiales locales13. Gregori et al. (2008) utilizaron en Eslovenia cobertura comercial para A. bisporus, llegando a obtener 700g de hongos a partir de 3kg de compost8. También en 2008, Cavalcante et al. evaluaron en Brasil diferentes coberturas basadas en suelos locales y arena con diferentes aditivos, obteniendo valores de EB entre 17,73 y 25,97kg/dt 1. Siqueira et al. (2009) llegaron a obtener valores de EB considerables, de 54,6kg/dt compost, evaluando diferentes suelos locales19. Zied et al. (2009), también con coberturas basadas en suelos, registraron valores de EB entre 23,25 y 36,25kg/dt 25. Colauto et al. obtuvieron valores de EB de 27,3kg/dt compost utilizando como cobertura turba brasileña pasteurizada3, y de 36,1kg/dt compost con esquisto calizo, también pasteurizado4. Estos mismos autores volvieron a evaluar el esquisto calizo como material de cobertura en otros trabajos, obteniendo una EB de 46,8kg/dt en un ciclo de 66 días2, llegando a 60,4kg/dt en un ciclo de 90 días5. González Matute et al. (2011) obtuvieron valores de EB entre 13,1 y 34,3kg/dt a partir de sustratos no compostados, con una mezcla de turba y carbonato cálcico como cobertura7.
La producción obtenida en este trabajo combinando la cepa ABL 99/30 y la cobertura Euroveen se encuentra, en general, en el mismo orden de magnitud que la mayoría de las referencias consultadas, dentro de lo que podría considerarse normal teniendo en cuenta la frecuencia con la que se producen resultados anómalos y las grandes diferencias observadas en el cultivo de esta especie. Hay que tener en cuenta que no es fácil comparar datos de los diferentes estudios llevados a cabo a distintas escalas, con desiguales cepas, composts, condiciones de cultivo y duraciones de los periodos de cosecha17.
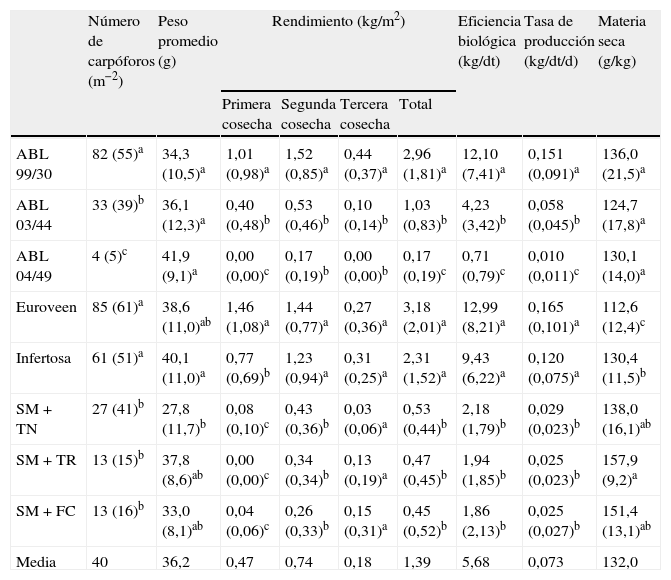
En la tabla 3 se presentan los resultados de los diferentes parámetros de producción por los 2 factores considerados en el diseño experimental. Entre las diferentes cepas, el mejor comportamiento se observó en la ABL 99/30, que proporcionó el mayor número de carpóforos y el mayor rendimiento total y en las 3 cosechas, así como el mayor valor para la EB y la tasa de producción, significativamente superiores todos ellos a los proporcionados por las otras 2 cepas, resultados similares a los obtenidos en Brasil por Zied (2011)23. En este caso la cepa ABL 04/49 presentó el peor comportamiento. Los carpóforos proporcionados por la cepa ABL 99/30 presentaron además menor peso promedio y mayor contenido en materia seca, aunque las diferencias no fueron estadísticamente significativas con respecto a las otras cepas. En cuanto a los materiales de cobertura, se observaron grandes variaciones en los comportamientos de las coberturas con base orgánica (Euroveen e Infertosa) con respecto a las basadas en suelo mineral. A partir de las primeras se cosechó mayor número de carpóforos con mayor peso promedio, dando como consecuencia un mayor rendimiento total, debido básicamente al mejor comportamiento en la primera y segunda cosechas y, como consecuencia, mejores registros para la EB, aunque los carpóforos presentaron menor contenido en materia seca. Los contenidos en materia seca de los carpóforos están directamente influidos por las características de la capa de cobertura (tabla 3), y resultan extremadamente importantes en la producción de A. subrufescens ya que su comercialización se lleva a cabo mayoritariamente tras un proceso de deshidratación. Esto afecta directamente al rendimiento final del proceso, de manera que cuanto mayor sea el contenido de materia seca, mayor será la eficiencia del procesado (lavado, laminado y deshidratación).
Parámetros de producción obtenidos para los factores considerados en el diseño experimental al cultivar 3 cepas de Agaricus subrufescens y aplicar 5 tipos diferentes de cobertura
| Número de carpóforos (m−2) | Peso promedio (g) | Rendimiento (kg/m2) | Eficiencia biológica (kg/dt) | Tasa de producción (kg/dt/d) | Materia seca (g/kg) | ||||
| Primera cosecha | Segunda cosecha | Tercera cosecha | Total | ||||||
| ABL 99/30 | 82 (55)a | 34,3 (10,5)a | 1,01 (0,98)a | 1,52 (0,85)a | 0,44 (0,37)a | 2,96 (1,81)a | 12,10 (7,41)a | 0,151 (0,091)a | 136,0 (21,5)a |
| ABL 03/44 | 33 (39)b | 36,1 (12,3)a | 0,40 (0,48)b | 0,53 (0,46)b | 0,10 (0,14)b | 1,03 (0,83)b | 4,23 (3,42)b | 0,058 (0,045)b | 124,7 (17,8)a |
| ABL 04/49 | 4 (5)c | 41,9 (9,1)a | 0,00 (0,00)c | 0,17 (0,19)b | 0,00 (0,00)b | 0,17 (0,19)c | 0,71 (0,79)c | 0,010 (0,011)c | 130,1 (14,0)a |
| Euroveen | 85 (61)a | 38,6 (11,0)ab | 1,46 (1,08)a | 1,44 (0,77)a | 0,27 (0,36)a | 3,18 (2,01)a | 12,99 (8,21)a | 0,165 (0,101)a | 112,6 (12,4)c |
| Infertosa | 61 (51)a | 40,1 (11,0)a | 0,77 (0,69)b | 1,23 (0,94)a | 0,31 (0,25)a | 2,31 (1,52)a | 9,43 (6,22)a | 0,120 (0,075)a | 130,4 (11,5)b |
| SM+TN | 27 (41)b | 27,8 (11,7)b | 0,08 (0,10)c | 0,43 (0,36)b | 0,03 (0,06)a | 0,53 (0,44)b | 2,18 (1,79)b | 0,029 (0,023)b | 138,0 (16,1)ab |
| SM+TR | 13 (15)b | 37,8 (8,6)ab | 0,00 (0,00)c | 0,34 (0,34)b | 0,13 (0,19)a | 0,47 (0,45)b | 1,94 (1,85)b | 0,025 (0,023)b | 157,9 (9,2)a |
| SM+FC | 13 (16)b | 33,0 (8,1)ab | 0,04 (0,06)c | 0,26 (0,33)b | 0,15 (0,31)a | 0,45 (0,52)b | 1,86 (2,13)b | 0,025 (0,027)b | 151,4 (13,1)ab |
| Media | 40 | 36,2 | 0,47 | 0,74 | 0,18 | 1,39 | 5,68 | 0,073 | 132,0 |
SM: suelo mineral; TN: turba negra; TR: turba rubia; FC: fibra de coco.
Sustrato: compost de champiñón. Fructificación a 19±1°C. Los valores entre paréntesis corresponden a la desviación estándar. Para cada factor en cada columna, los valores seguidos de distinta letra en superíndice son significativamente diferentes entre sí (p≤0,05, test de Tukey).
Los resultados obtenidos avalan la potencialidad del cultivo de A. subrufescens como alternativa a las especies cultivadas habitualmente, buscando un mejor aprovechamiento de recursos y una mayor rentabilidad económica. El presumible beneficio económico se apoya en unos costes de producción de compost y micelio similares al caso de A. bisporus, con un mayor precio de mercado del producto, a lo que se une la disponibilidad de infraestructuras existentes (centrales de compostaje, salas de producción y comercializadoras) infrautilizadas en la época estival, dadas las limitaciones estacionales. No obstante, el hecho de que se presenten con frecuencia rendimientos anómalos, cosechas no bien definidas y largos ciclos de producción, implica la necesidad de seguir avanzando en el establecimiento de las condiciones óptimas de cultivo, la selección de cepas bien adaptadas y el desarrollo de sustratos que faciliten la regularidad de la producción. La optimización se puede ver económicamente favorecida por la existencia de instalaciones y tecnologías desarrolladas para la producción de champiñón, que pueden ser utilizadas en cultivos comerciales de A. subrufescens. Una propuesta factible sería cultivar en las mismas instalaciones A. subrufescens en verano (un ciclo de cultivo) y A. bisporus el resto del año (5-6 ciclos). Los tratamientos desinfectantes habituales a las que son sometidas las salas de cultivo entre ciclos y las medidas higiénicas preventivas llevadas a cabo para limitar la incidencia de enfermedades deben ser suficientes para limitar los riesgos de intercontaminación. La experiencia previa con la alternancia del cultivo de A. bisporus y Agaricus bitorquis en las mismas instalaciones así lo evidencia. Esta alternancia de cultivos puede incluso ser beneficiosa en caso de incidencia endémica de enfermedades en alguna sala de cultivo. Por otro lado, y dado que el sustrato se comercializa inoculado por las centrales de compostaje, las precauciones en las mismas se deben centrar en una adecuada limpieza de la maquinaria de siembra y ensacado, práctica habitual al cambiar de cepa de la misma especie. Todas estas medidas de optimización del cultivo facilitarán su expansión a nuevos países productores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.