Las artritis fúngicas de origen hematógeno suelen afectar preferentemente a pacientes con afectación de la inmunidad celular o a usuarios de drogas por vía intravenosa. En el paciente inmunocompetente suele producirse por la inoculación del microorganismo mediante un mecanismo invasor. La experiencia del tratamiento con azoles en estos pacientes es muy escasa.
Caso clínicoPresentamos un caso clínico de artritis por Scedosporium apiospermum caracterizado por su lenta instauración, falta de respuesta a posaconazol y caspofungina, y resolución final mediante desbridamiento y tratamiento con voriconazol.
ConclusionesLa administración de voriconazol junto al desbridamiento quirúrgico constituye un tratamiento eficaz en la artritis por S. apiospermum.
Fungal arthritis is usually of haematogenous origin, and mainly affects patients with impaired cellular immunity or users of intravenous drugs. The infection in immunocompetent patients is generally caused by direct inoculation of the microorganism through an invasive device. The experience of azole therapy in these patients is limited.
Case reportWe report a case of arthritis caused by Scedosporium apiospermum characterized by its slow onset, lack of response to posaconazole and caspofungin, and its successful resolution after surgical debridement and treatment with voriconazole.
ConclusionsTreatment with voriconazole and surgical debridement is an effective therapy for arthritis due to S. apiospermum.
La artritis séptica es una patología en la que el pronóstico para el paciente depende en gran medida de la consecución de un diagnóstico etiológico temprano4. Aunque la mayoría de los casos están producidos por bacterias como Staphylococcus aureus o el género Streptococcus, algunas están causadas por hongos9. Las artritis fúngicas de origen hematógeno suelen aparecer preferentemente en pacientes con afectación de la inmunidad celular, como los que reciben tratamiento con quimioterapia o esteroides, o en usuarios de drogas por vía intravenosa. En el paciente inmunocompetente la infección se suele producir por la introducción directa del microorganismo en el interior de la articulación, mediante un mecanismo traumático o invasor a través de un cuerpo extraño10,32. El curso clínico subagudo o crónico y la negatividad de los cultivos bacterianos suelen condicionar un retraso en el diagnóstico y el tratamiento de estos pacientes7,10.
A continuación presentamos un caso peculiar, en cuanto a su etiología, presentación clínica y respuesta al tratamiento.
Caso clínicoVarón de 84 años, con antecedentes de diabetes mellitus tipo 2, en tratamiento con glicazida y metformina, afectado de carcinoma de laringe que fue tratado con cirugía radical, úlcera duodenal intervenida (vagotomía más piloroplastia), arteriopatía periférica y embolia mesentérica, por lo que recibía tratamiento con acenocumarol. Acudió a la consulta externa de Reumatología por dolor localizado en la inserción del tendón del tricipital izquierdo. En la radiografía se observaba calcificación superficial del tendón en su proximidad con el olécranon. Los valores de la proteína C reactiva, la velocidad de sedimentación y el resto de parámetros de la analítica básica eran normales. Ante la ausencia de mejoría con reposo, calor local y antiinflamatorios no esteroideos, se decidió la realización de infiltración subcutánea con triancinolona 40mg, que fue repetida al mes por la escasa mejoría observada. A los 2 meses de esta segunda punción el paciente comenzó a notar incremento del dolor y la aparición progresiva de tumefacción e impotencia funcional. No presentó fiebre ni otra sintomatología.
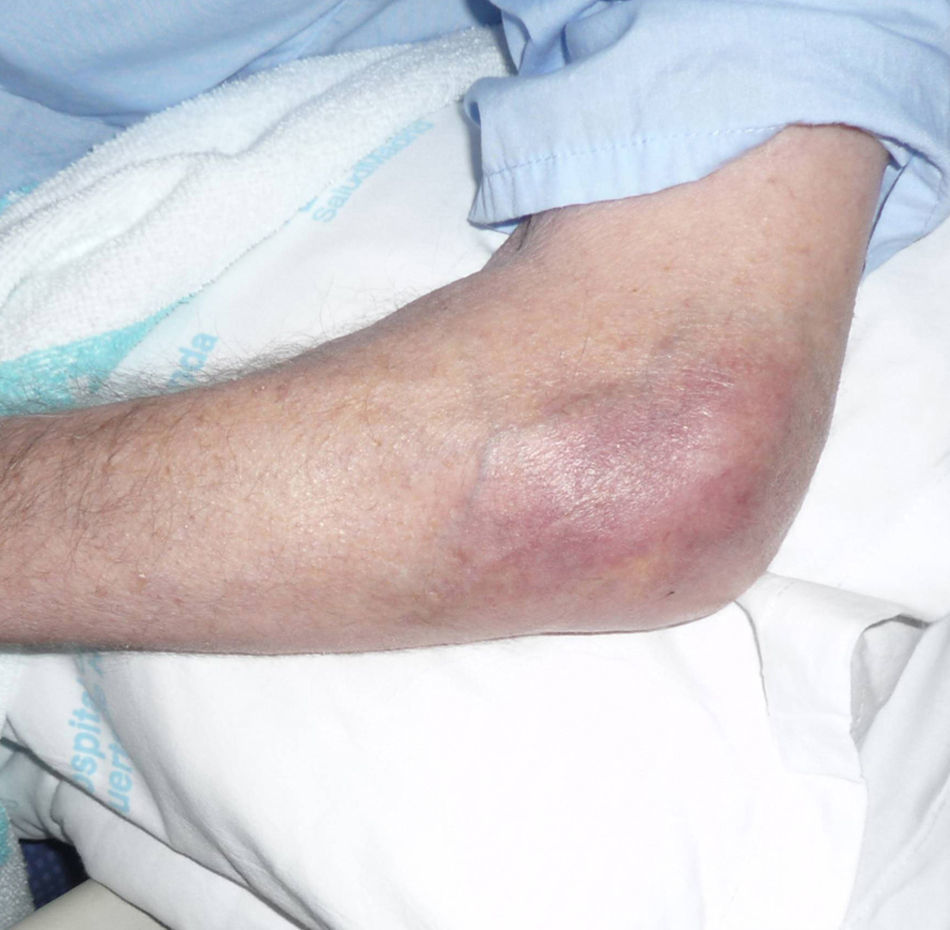
A los 2 meses tras el inicio de la sintomatología fue revisado en la consulta, donde se constató aumento de la tumefacción y de la limitación para la flexoextensión con dolor a la pronosupinación del codo izquierdo (fig. 1). Había derrame articular moderado, pero no alteraciones vasculonerviosas ni inflamación de otras articulaciones. El paciente continuaba sin fiebre.
En la analítica destacaban una hiperglucemia moderada (glucosa 135mg/dl), proteína C reactiva elevada (121mg/l) y una velocidad de sedimentación acelerada (94mm en la primera hora). La cifra de leucocitos era normal (7.890 l/mm3) y el índice de anticoagulación, algo elevado (INR 4,8). La radiografía del codo mostraba calcificación superficial del cartílago tricipital, como en las radiografías realizadas con anterioridad. Las radiografías de tórax, rodillas, pelvis y carpos no mostraban alteraciones relevantes. Otras determinaciones obtenidas fueron anticuerpos antinucleares negativos, factor reumatoide negativo y reacción de Mantoux negativa con segunda prueba (booster) positiva (20mm de induración).
Se realizó artrocentesis del codo, obteniendo 5 cm3 de líquido amarillento, turbio, con glucosa de 58mg/dl, proteínas de 6,2g/dl y recuento leucocitario de 8.800 células/mm3 (con predominio de polimorfonucleares). El líquido fue remitido a Microbiología, donde fue inoculado en un frasco Bactec Plus aerobio que se incubó en el sistema Bactec® 9240 (Becton Dickinson; Nueva Jersey, EE.UU.). Se instauró antibioterapia empírica con cloxacilina y ceftriaxona. El paciente no presentó mejoría con este tratamiento.
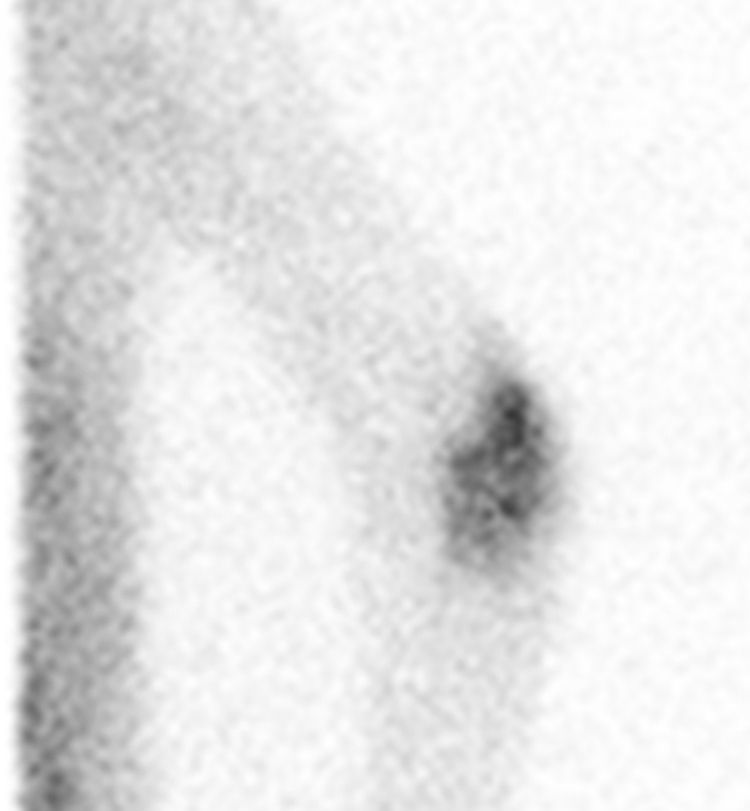
Mediante resonancia magnética se observó hiperintensidad de señal en el espacio articular, sugestiva de derrame articular con marcado engrosamiento irregular de la sinovial y signos de celulitis periarticular. Una gammagrafía ósea puso de manifiesto hallazgos compatibles con un proceso inflamatorio con compromiso óseo (captación en húmero y cúbito). Mediante una gammagrafía con galio 67 se observó un depósito patológico en la articulación del codo (fig. 2).
Tras 4 días de incubación se aisló un hongo filamentoso que creció en agar sangre, agar chocolate y agar Sabouraud-cloranfenicol a 37 y 40°C, pero no a 45°C ni en presencia de actidiona. Por sus características macroscópicas y microscópicas fue identificado como Scedosporium apiospermum. Como es sabido, la clasificación de Scedosporium/Pseudallescheria se ha modificado últimamente, de tal manera que hasta hace pocos años se conocían únicamente 2 especies de Scedosporium, Scedosporium prolificans y S. apiospermum. Esta última constituye en realidad un complejo de especies que se diferencian, entre otros muchos aspectos, en la sensibilidad a los antifúngicos14. Por tanto, con el diagnóstico presuntivo de S. apiospermum se envió la cepa aislada al Centro Nacional de Microbiología del Instituto de Salud Carlos III (Majadahonda, Madrid), que confirmó definitivamente su identificación, obteniendo los siguientes valores de CMI: itraconazol>8mg/l, posaconazol 0,5mg/l, voriconazol 1mg/l, anfotericina B 2mg/l y caspofungina 2mg/l.
En ese momento se retiró el tratamiento antibiótico y se prescribió voriconazol (400mg/12h por vía intravenosa el primer día, y 200mg/12h durante los días siguientes). Cuatro días después fue sometido a desbridamiento quirúrgico con la realización de artrotomía y sinovectomía. No se observó exudado purulento en las partes blandas periarticulares ni afectación ósea. El examen microscópico con KOH del líquido articular no puso de manifiesto estructuras fúngicas. En los cultivos del líquido articular y de los tejidos circundantes se volvió a aislar S. apiospermum. Las tinciones y cultivos para bacterias y micobacterias fueron negativos.
Durante la primera semana de tratamiento con voriconazol se observó una mejoría del dolor y de la tumefacción, pero al noveno día el tratamiento tuvo que ser retirado por síndrome confusional grave. El voriconazol fue sustituido por posaconazol considerando su baja CMI. La dosis empleada fue de 200mg/6h por vía oral, que se administraba tras la ingesta de alimentos con componentes grasos. El paciente mejoró neurológicamente durante la siguiente semana.
Una vez en su domicilio, tras el alta hospitalaria, el paciente presentó empeoramiento del dolor, tumefacción y eritema, por lo que se decidió añadir caspofungina que se administró de forma ambulatoria en el hospital de día (70mg por vía intravenosa, como dosis inicial, y 50mg posteriormente). Después de un mes de tratamiento combinado con posaconazol y caspofungina el paciente no experimentó mejoría;volvió a ingresar para nuevo desbridamiento. Se observó que el tejido subcutáneo presentaba signos inflamatorios y exudado serosanguinolento. Los cultivos y tinciones para bacterias, micobacterias y hongos de este segundo desbridamiento fueron negativos. Considerando su buena respuesta inicial, se decidió reintroducir el voriconazol pero con vigilancia estrecha de los efectos adversos y de sus niveles plasmáticos. La dosis de mantenimiento de 200mg/12h era bien tolerada (alucinaciones ocasionales que no presentaron problemas para el paciente). Los niveles plasmáticos valle, repetidos en 3 ocasiones, se mantuvieron entre 1 y 2,5mg/l. Después de completar 6 meses de tratamiento, el paciente permaneció sin signos inflamatorios locales aunque presenta una limitación funcional con un arco articular de 20°. Durante el seguimiento clínico la velocidad de sedimentación y la proteína C reactiva permanecieron dentro de la normalidad.
DiscusiónS. apiospermum es un hongo filamentoso, saprofito y ubicuo de la familia Microascaceae que se puede encontrar en el suelo, el estiércol, la vegetación seca y el agua contaminada6. Puede producir infecciones localizadas en el paciente inmunocompetente después de un traumatismo o cirugía que pueden afectar el ojo, la piel y el tejido subcutáneo, el hueso o el sistema nervioso central6. En pacientes inmunodeprimidos suele producir infecciones diseminadas de extrema gravedad con participación de piel, vías respiratorias, sistema nervioso central, articulaciones y aparato musculoesquelético2,5,16,23,24,33.
Respecto al mecanismo de producción de la infección, se debe considerar la naturaleza ubicua de Scedosporium spp., que podría haber favorecido una eventual contaminación de la piel del paciente por esporas en el momento en que se procedió a realizar una infiltración articular16. En este sentido conviene recordar lo importante que resulta la preparación de la piel antes de la punción para evitar la transmisión percutánea de hongos y bacterias14. Se han descrito brotes hospitalarios, en pacientes neutropénicos, durante la realización de obras23. Para evitar este tipo de brotes se instalan filtros HEPA en las dependencias hospitalarias donde se atiende a estos pacientes. Su instalación en las consultas externas donde se realizan punciones articulares a pacientes no severamente inmunocomprometidos, no obstante, carece de sentido35.
Los casos descritos en pacientes inmunocompetentes suelen estar precedidos de un traumatismo que favorece la introducción intraarticular del microorganismo5,8,13,15. Se han descrito 14 casos de monoartritis por S. apiospermum que se caracterizan por su lenta instauración tras un traumatismo abierto, punción periarticular o cirugía14,32,38,39. Varios autores han sugerido un efecto favorecedor de la infección local por parte de los esteroides inyectados por vía intraarticular25,34.
Este prolongado período de incubación se relaciona con la lenta replicación del hongo y con una eventual contaminación tisular de escasa magnitud13,39. El antecedente de tendinitis en el caso presentado pudo dificultar la sospecha de una complicación infecciosa, dado que el dolor podría ser atribuido a su patología previa. A diferencia de otros casos comunicados, nuestro paciente no presentó fiebre, lo que podría relacionarse con su avanzada edad20,39.
El procesamiento de las muestras obtenidas únicamente para cultivos bacterianos puede retrasar el diagnóstico10,39. Por ello, el procesamiento del líquido articular para cultivos fúngicos es esencial para identificar el agente etiológico. En nuestro paciente la inoculación del líquido articular en un frasco aerobio de hemocultivo permitió el aislamiento de un hongo filamentoso, posteriormente identificado como S. apiospermum, y por tanto un diagnóstico más rápido38. La inoculación de líquidos orgánicos estériles en frascos de hemocultivos que se procesan en los sistemas de incubación y lectura continua y automática de hemocultivos, en nuestro caso el sistema BACTEC® 9240, incrementa de manera significativa el aislamiento de microorganismos patógenos presentes en la muestra clínica11,15. Se debe destacar que en muchos casos no se identifican estructuras fúngicas en la biopsia tisular o líquido articular, mediante tinciones habituales o PAS, circunstancia que también se observó en el caso presentado32,39. Por otra parte, ni la presencia de leucocitosis y aceleración de la velocidad de sedimentación ni el predominio de polimorfonucleares en el líquido articular son específicos de este tipo de infecciones39. Tampoco la resonancia suele mostrar signos que permitan sospechar la etiología fúngica de estos casos, como son derrame articular, hipertrofia de la sinovial, lesiones intraarticulares, tendinitis y captación ósea subcondral6,10. Todas estas circunstancias dificultan la consecución de un diagnóstico correcto.
La clave del tratamiento es la combinación del desbridamiento quirúrgico con la medicación antifúngica. Dada la escasa respuesta de estas infecciones al tratamiento antimicótico aislado, se considera indispensable disminuir la carga microbiana mediante desbridamiento quirúrgico (a veces con sinovectomía)18,37. En los últimos años se han empleado con éxito distintos fármacos antifúngicos como el ketoconazol, el miconazol y el itraconazol, así como las infiltraciones intraarticulares de anfotericina B39. A pesar del éxito comunicado con la asociación voriconazol-terbinafina, la adición de este fármaco no se consideró oportuna por la evolución del caso con el desbridamiento y el voriconazol22. La sensibilidad de S. apiospermum a la anfotericina B suele ser peor que para el voriconazol26,36. Aunque hay casos que han evolucionado bien con este antifúngico, también se han observado fracasos cuando se ha empleado anfotericina B30.
El aspecto más destacable del caso presentado fue el fracaso terapéutico con posaconazol. A pesar de que el paciente fue instruido en que debía tomar el fármaco antes de ingerir algún alimento graso y de que presentaba una CMI adecuada, la evolución fue desfavorable21. No obstante, no se llegó a determinar la concentración plasmática del posaconazol, lo que hubiera permitido comprender mejor la evolución del paciente. No se dispone de información clínica sobre la penetración articular y ósea del posaconazol. No se consideró el empleo de terapias innovadoras, como el interferón gamma, por la respuesta favorable al voriconazol tras el desbridamiento quirúrgico1.
Varios estudios han demostrado que el voriconazol es más activo in vitro contra S. apiospermum que la anfotericina B, el itraconazol o el posaconazol8,17,26. Estudios sobre animales de experimentación también sugieren una mejor respuesta con voriconazol que con posaconazol3,12. Asimismo, considerando el número de pacientes tratados exitosamente, el voriconazol podría ser más eficaz que el posaconazol en las infecciones por S. apiospermum27,29,31,40. Por tanto, se considera que el voriconazol es el antifúngico de elección en las infecciones por S. apiospermum, junto con otros antifúngicos como el posaconazol que podrían considerarse de rescate8,17,19,28. Debido a que muchos casos fueron diagnosticados antes de la aparición del voriconazol, la mayoría de ellos fueron tratados con itraconazol, miconazol, ketoconazol o anfotericina B por vía intraarticular o intravenosa (a pesar de que la respuesta a la anfotericina B ha sido muy pobre)30. El pronóstico vital de los pacientes inmunocompetentes fue favorable y el funcional dependió de la realización de un tratamiento quirúrgico precoz y de la administración de un antifúngico sensible35,38.