El aumento en los últimos años de pacientes inmunodeprimidos y el uso de fármacos citotóxicos e inmunosupresores ha aumentado la incidencia de infecciones fúngicas invasivas.
ObjetivosEvaluar la utilización de anfotericina B liposomal de acuerdo con la indicación, la dosis, la efectividad y la nefrotoxicidad.
MétodosEstudio retrospectivo de un período de 8 años donde se tomaron como referencia las indicaciones y posología descritas en la ficha técnica. La efectividad se midió en función de la resolución de la infección, no recurrencia o aparición, supervivencia a los 7 días, no suspensión y no adición de otro antifúngico. La efectividad se analizó en función de indicación, dosis, duración del tratamiento, dosis acumulada y comorbilidad. La nefrotoxicidad fue medida como un aumento de la creatinina sérica por encima de 2 veces la basal.
ResultadosSe trataron 47 episodios, de los cuales el 91,5% de los tratamientos se ajustaron a las indicaciones. Se logró efectividad en un 44,7% de los casos: 33% en neutropénicos, 50% de las aspergilosis, 60% de las candidiasis y 100% de las leishmaniasis. Las tasas de respuesta en los tratados durante≤15 días y>15 días fueron de 25 y 56,5% (p=0,039), respectivamente. Las causas principales del fracaso fueron exitus (23%) y falta de efectividad (17%). Un 9% de los pacientes sufrió nefrotoxicidad.
ConclusionesLos datos de efectividad y nefrotoxicidad concuerdan con los obtenidos en otros estudios. Su efectividad se ha visto asociada con la duración del tratamiento. La anfotericina B liposomal es un fármaco seguro con efectividad moderada.
The increase in immunosuppressed patients and in the use of cytotoxic and immunosuppressive agents in the last few years has led to a rise in the incidence of invasive fungal infections.
AimsThe objective of this study is to evaluate the use of liposomal amphotericin B according to its indication, dosage, effectiveness and nephrotoxicity.
MethodsThis is a retrospective study over a 8 year-period. Indications and dosage described in the Summary of Product Characteristics were taken as reference. Effectiveness was measured in terms of resolution of infection, no recurrence or emergence, survival at 7th day, no discontinuation and no addition of another antifungal. Effectiveness was also analysed in relation to indication, dosage, treatment duration, cumulative dose and comorbidity. Nephrotoxicity was defined as a doubled serum creatinine when compared with basal values.
ResultsA total of 47 episodes were analysed, with 91.5% of treatments being adequate for the indications. Effectiveness was achieved in 44.7% of cases: 33% in neutropenic patients, 50% of aspergillosis, 60% of candidiasis, and 100% of the leishmaniasis. Response rates in patients treated for 15 days or less and those for more than 15 days were 25 and 56.5% (P=.039), respectively. The main causes of failure were death (23%) and lack of effectiveness (17%), with 9% of patients suffering from nephrotoxicity.
ConclusionsThe effectiveness and nephrotoxicity data agree with those obtained in other studies. Liposomal amphotericin B is a safe drug with a moderate effectiveness that is associated with the duration of the treatment.
El aumento en los últimos años de pacientes inmunodeprimidos y de enfermedades que requieren el uso de fármacos citotóxicos o inmunosupresores ha elevado la incidencia de infecciones fúngicas graves, siendo tratadas muchas de ellas con la formulación liposomal de anfotericina B. Esto ha conducido a la necesidad de contrastar los resultados de efectividad y toxicidad del tratamiento con dicho fármaco en la práctica habitual con los datos de eficacia y seguridad obtenidos en los ensayos clínicos. La situación clínica de los pacientes incluidos en estos ensayos y el manejo de los mismos pueden ser distintos cuando un medicamento se utiliza en la práctica clínica habitual, y, por consiguiente, dar resultados diferentes.
Por ello, el objetivo de este trabajo fue evaluar la utilización de la anfotericina B liposomal de acuerdo con la indicación, la dosis, la efectividad y la nefrotoxicidad.
MétodosSe realizó un estudio retrospectivo de prescripción-indicación, donde se evaluaron todos los pacientes tratados con anfotericina B liposomal en un período de 8 años (enero 2002-diciembre 2009) en un hospital general de tercer nivel (Hospital Universitario Príncipe de Asturias).
Los casos se obtuvieron mediante búsqueda informatizada por prescripción de anfotericina B liposomal en los softwares Gestión de unidosis y Gestión de pacientes ambulantes de Farmatools®. Se recogieron los siguientes parámetros: sexo, edad, servicio de hospitalización, diagnóstico principal, comorbilidades, indicación, peso, dosis en función del peso, dosis acumulada total o suma de las dosis administradas al paciente durante todo el tratamiento, dosis acumulada total en función del peso, duración, resolución, recurrencia, falta de efectividad, reacciones adversas, otros tratamientos antifúngicos y nefrotóxicos, cultivos microbiológicos, creatinina basal y datos de creatinina sérica durante la duración del tratamiento y hasta 10 días después de su fin.
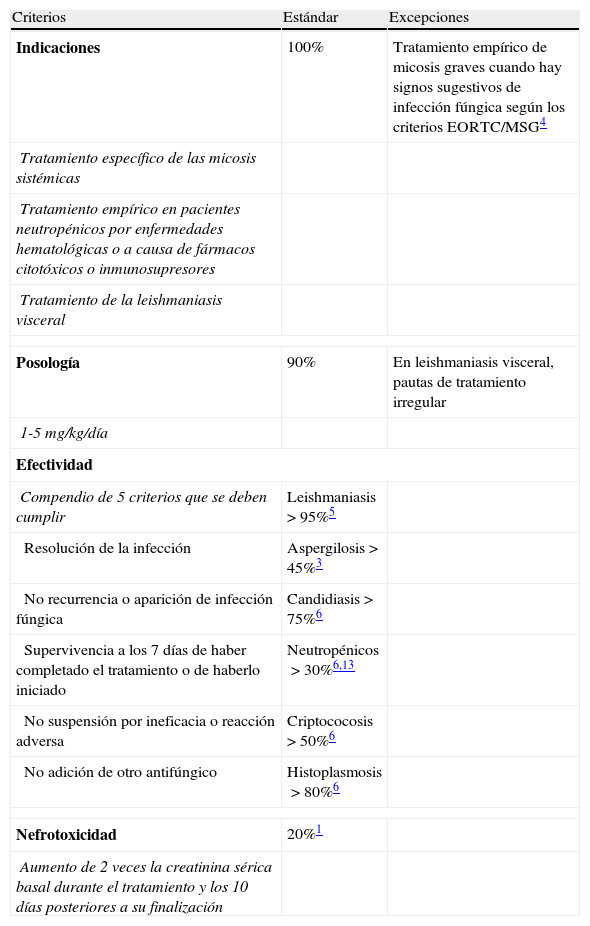
Los criterios de utilización se muestran en la tabla 1. Los datos de la columna estándar son los porcentajes que se deberían alcanzar en base a las evidencias disponibles. Para evaluar el uso, se tomaron como patrón de referencia las indicaciones y dosis descritas en la ficha técnica del producto1: tratamiento específico de micosis sistémicas graves; tratamiento empírico de las micosis en pacientes con neutropenia grave a consecuencia de enfermedades hematológicas malignas o por el uso de fármacos citotóxicos o inmunosupresores; y leishmaniasis visceral. En esta última no se tuvo en cuenta la falta de respuesta a antimoniales pentavalentes y se aceptaron pautas posológicas irregulares ampliamente descritas en la literatura5,7,12. Además, también se aceptó como indicación adecuada su utilización en el tratamiento empírico de pacientes con signos sugestivos de infecciones fúngicas sistémicas según los criterios EORTC/MSG4. Las dosis adecuadas fueron aquellas comprendidas entre 1 y 5mg/kg/día.
Criterios de utilización
| Criterios | Estándar | Excepciones |
| Indicaciones | 100% | Tratamiento empírico de micosis graves cuando hay signos sugestivos de infección fúngica según los criterios EORTC/MSG4 |
| Tratamiento específico de las micosis sistémicas | ||
| Tratamiento empírico en pacientes neutropénicos por enfermedades hematológicas o a causa de fármacos citotóxicos o inmunosupresores | ||
| Tratamiento de la leishmaniasis visceral | ||
| Posología | 90% | En leishmaniasis visceral, pautas de tratamiento irregular |
| 1-5mg/kg/día | ||
| Efectividad | ||
| Compendio de 5 criterios que se deben cumplir | Leishmaniasis>95%5 | |
| Resolución de la infección | Aspergilosis>45%3 | |
| No recurrencia o aparición de infección fúngica | Candidiasis>75%6 | |
| Supervivencia a los 7 días de haber completado el tratamiento o de haberlo iniciado | Neutropénicos>30%6,13 | |
| No suspensión por ineficacia o reacción adversa | Criptococosis>50%6 | |
| No adición de otro antifúngico | Histoplasmosis>80%6 | |
| Nefrotoxicidad | 20%1 | |
| Aumento de 2 veces la creatinina sérica basal durante el tratamiento y los 10 días posteriores a su finalización | ||
La efectividad se midió en función de los siguientes criterios: resolución de la infección (según criterio médico, mejoría clínica, radiológica y microbiológica, cuando disponible), no recurrencia (reaparición de la infección en un período de hasta 7 días tras el fin del tratamiento, medida clínica y microbiológicamente) o aparición de infección fúngica durante el tratamiento, supervivencia a los 7 días de haber completado el tratamiento o de haberlo iniciado, no suspensión por falta de efectividad (empeoramiento clínico o no mejoría según criterio médico) o por reacciones adversas, y no adición de otro antifúngico. Para considerar un tratamiento efectivo se debían cumplir los 5 criterios. La efectividad se analizó globalmente, en función de la indicación, de la dosis (≤3 y >3mg/kg/día), de la duración del tratamiento (≤15 y>15 días), de la dosis acumulada total (<5 y>5g), de la dosis acumulada en función del peso (≤50 y>50mg/kg) y del índice de comorbilidad de Charlson ajustado por edad. Se estableció el corte de dosis en 3mg/kg/día por ser la dosis más utilizada en la bibliografía3,6, y de duración en 15 días por tratarse de la mediana o la media de días de tratamiento6. La mortalidad se analizó en función de las mismas variables que la efectividad. Si algún paciente recibió varias dosis estas se analizaron como si fueran diferentes tratamientos para evaluar la efectividad y se clasificaron los pacientes según la dosis media recibida (≤3 o >3mg/kg/día) para el análisis de la mortalidad. Además, se analizó la influencia del grado de comorbilidad en la dosis y duración del tratamiento.
La nefrotoxicidad fue medida como un aumento de la creatinina sérica por encima de 2 veces la basal durante el período de tratamiento antifúngico y durante los 10 días posteriores a su fin. Se tomó como creatinina basal el valor de creatinina sérica inmediatamente anterior al comienzo del tratamiento.
El análisis estadístico de los datos se basó en la prueba exacta de Fisher para muestras independientes. Para el análisis de la influencia del índice de Charlson se utilizó la prueba Chi cuadrado de Pearson. Se tomó como nivel de significación un valor de p≤0,05.
Los datos fueron obtenidos de la historia clínica, de las pruebas de laboratorio disponibles en la aplicación Servolab® y del software de gestión de farmacia Farmatools®. El análisis estadístico se realizó con SPSS Statistics® v.17.0.
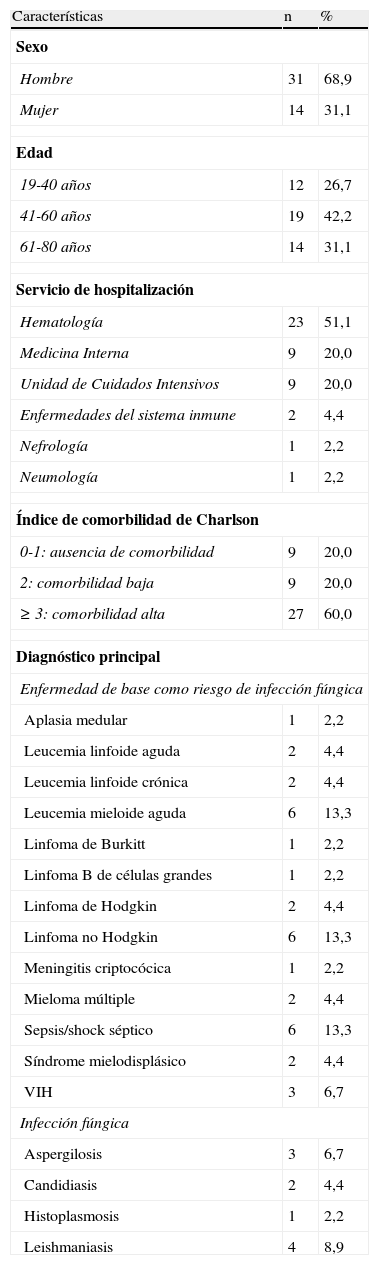
ResultadosDe los 47 pacientes tratados con anfotericina B liposomal, se analizaron 45 debido a la exclusión de 2 de ellos por falta de datos. Las características de los pacientes se describen en la tabla 2. Más del 90% corresponden a los servicios de Hematología, Medicina Interna y UCI, que en ese período contaron con 43.358 ingresos, por lo que uno de cada 963 pacientes ingresados en estos servicios recibió tratamiento con anfotericina, aumentando a uno de cada 100 en Hematología. La mediana del peso fue 66kg (45-105kg) y la de creatinina basal fue 0,8mg/dl (0,3-11,3mg/dl).
Características de los pacientes
| Características | n | % |
| Sexo | ||
| Hombre | 31 | 68,9 |
| Mujer | 14 | 31,1 |
| Edad | ||
| 19-40 años | 12 | 26,7 |
| 41-60 años | 19 | 42,2 |
| 61-80 años | 14 | 31,1 |
| Servicio de hospitalización | ||
| Hematología | 23 | 51,1 |
| Medicina Interna | 9 | 20,0 |
| Unidad de Cuidados Intensivos | 9 | 20,0 |
| Enfermedades del sistema inmune | 2 | 4,4 |
| Nefrología | 1 | 2,2 |
| Neumología | 1 | 2,2 |
| Índice de comorbilidad de Charlson | ||
| 0-1: ausencia de comorbilidad | 9 | 20,0 |
| 2: comorbilidad baja | 9 | 20,0 |
| ≥3: comorbilidad alta | 27 | 60,0 |
| Diagnóstico principal | ||
| Enfermedad de base como riesgo de infección fúngica | ||
| Aplasia medular | 1 | 2,2 |
| Leucemia linfoide aguda | 2 | 4,4 |
| Leucemia linfoide crónica | 2 | 4,4 |
| Leucemia mieloide aguda | 6 | 13,3 |
| Linfoma de Burkitt | 1 | 2,2 |
| Linfoma B de células grandes | 1 | 2,2 |
| Linfoma de Hodgkin | 2 | 4,4 |
| Linfoma no Hodgkin | 6 | 13,3 |
| Meningitis criptocócica | 1 | 2,2 |
| Mieloma múltiple | 2 | 4,4 |
| Sepsis/shock séptico | 6 | 13,3 |
| Síndrome mielodisplásico | 2 | 4,4 |
| VIH | 3 | 6,7 |
| Infección fúngica | ||
| Aspergilosis | 3 | 6,7 |
| Candidiasis | 2 | 4,4 |
| Histoplasmosis | 1 | 2,2 |
| Leishmaniasis | 4 | 8,9 |
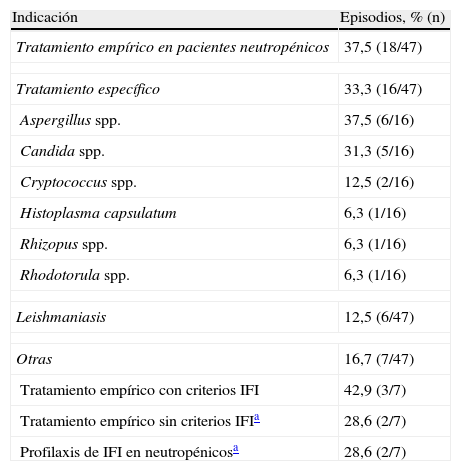
Dos pacientes recibieron en 2 ingresos diferentes tratamiento con anfotericina B liposomal, por lo que se evaluaron un total de 47 episodios. Las indicaciones para las que la anfotericina B liposomal fue utilizada se detallan en la tabla 3, y las tasas de respuesta obtenidas, en la tabla 4. El 91,5% de los tratamientos (43/47) se ajustó a las indicaciones tomadas como válidas en este estudio. Se logró efectividad en un 44,7% (n=21) de todos los tratamientos. En 8 episodios de los 47 se efectuó un escalado de dosis, por tanto, el análisis de esta se realizó sobre un total de 55 episodios. El 9,1% de las dosis utilizadas (5/55) superaron la establecida como máxima. La dosis media fue 3,8mg/kg/día (rango 1-10mg/kg/día). Recibieron dosis≤3mg/kg/día el 69,2% (9/13) de los pacientes con un índice de Charlson 0-1, el 60,0% (6/10) de los que presentaron un índice de 2 puntos y el 50,0% (16/32) de los que tenían un índice de Charlson>3 (p=0,483). La duración del tratamiento fue≤15 días en el 55,6% (5/9) de los que presentaron ausencia de morbilidad, del 66,7% (6/9) en el grupo de morbilidad baja y del 44,8% (13/29) en el de morbilidad alta (p=0,496).
Indicaciones
| Indicación | Episodios, % (n) |
| Tratamiento empírico en pacientes neutropénicos | 37,5 (18/47) |
| Tratamiento específico | 33,3 (16/47) |
| Aspergillus spp. | 37,5 (6/16) |
| Candida spp. | 31,3 (5/16) |
| Cryptococcus spp. | 12,5 (2/16) |
| Histoplasma capsulatum | 6,3 (1/16) |
| Rhizopus spp. | 6,3 (1/16) |
| Rhodotorula spp. | 6,3 (1/16) |
| Leishmaniasis | 12,5 (6/47) |
| Otras | 16,7 (7/47) |
| Tratamiento empírico con criterios IFI | 42,9 (3/7) |
| Tratamiento empírico sin criterios IFIa | 28,6 (2/7) |
| Profilaxis de IFI en neutropénicosa | 28,6 (2/7) |
Tasas de efectividad
| Variable | Efectividad | p |
| Global (n=47) | 44,7% (21/47) | |
| Según indicación (n=47) | ||
| Tratamiento empírico en pacientes neutropénicos | 33,3% (6/18) | |
| Tratamiento específico | 50,0% (8/16) | |
| Aspergillus spp. | 50,0% (3/6) | |
| Candida spp. | 60,0% (3/5) | |
| Cryptococcus spp. | 0,0% (0/2) | |
| Histoplasma capsulatum | 100,0% (1/1) | |
| Rhizopus spp. | 0,0% (0/1) | |
| Rhodotorula spp. | 100,0% (1/1) | |
| Leishmaniasis | 100,0% (6/6) | |
| Otros | 28,6% (2/7) | |
| Tratamiento empírico con criterios IFI | 33,3% (1/3) | |
| Tratamiento empírico sin criterios IFI | 0,0% (0/2) | |
| Profilaxis de IFI en neutropénicos | 50,0% (1/2) | |
| Según dosis (n=55) | ||
| ≤3mg/kg/día vs.>3mg/kg/día | 51,6% (18/31) vs. 33,3% (8/24) | 0,273 |
| Según duración (n=47) | ||
| ≤15 días vs.>15 días | 25,0% (6/24) vs. 56,5% (13/23) | 0,039 |
| Según dosis acumulada (n=47) | ||
| <5g vs.>5g | 42,4% (14/33) vs. 50,0% (7/14) | 0,752 |
| Según dosis acumulada/peso (n=47) | ||
| ≤50mg/kg vs.>50mg/kg | 29,2% (7/24) vs. 56,5% (13/23) | 0,080 |
| Según índice de Charlson (n=47) | ||
| 0-1: ausencia de comorbilidad | 44,4% (4/9) | 0,756 |
| 2: comorbilidad baja | 55,6% (5/9) | |
| 3: comorbilidad alta | 41,4% (12/29) | |
El tratamiento con≤3mg/kg/día (n=31) y>3mg/kg/día (n=24) fue efectivo en un 51,6 y un 33,3%, respectivamente (p=0,273). Las tasas de respuesta positiva en los pacientes tratados durante 15 días o menos (n=24) y en los que recibieron tratamiento durante más de 15 días (n=23) fue de 25,0 y 56,5%, respectivamente (p=0,039). La duración media del tratamiento fue de 20 días. El éxito del tratamiento en el grupo de pacientes que recibió una dosis acumulada total<5g (n=33) fue del 42,4%, frente al 50% (p=0,738) en el grupo que recibió>5g (n=14).
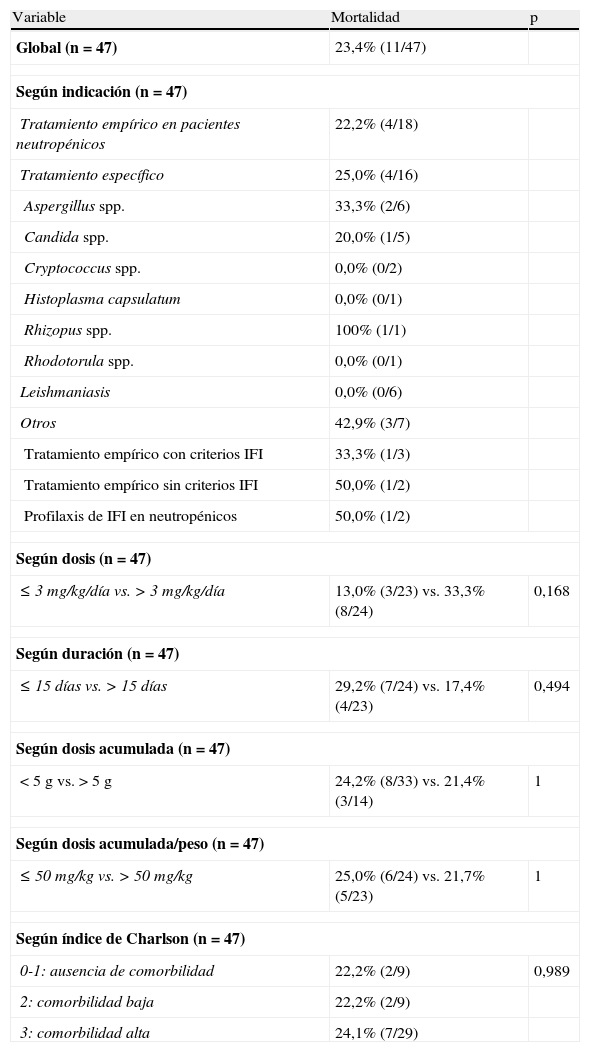
De los 26 episodios en los que el tratamiento no fue efectivo, el 42,3% fue debido a exitus (n=11) y el 30,8% a falta de efectividad (n=8), por recurrencia de la infección el 7,7% (n=2) y por la necesidad de adición de otro antifúngico el 11,5% (n=3). El tratamiento se tuvo que suspender en 2 pacientes (7,7%) a causa de reacciones adversas relacionadas con la infusión. La mortalidad global fue del 23,4%, y en los pacientes que recibieron una dosis media≤3mg/kg/día (n=23) y>3mg/kg/día (n=24) fue de 13,0 y 33,3%, respectivamente (p=0,17) (tabla 5).
Mortalidad
| Variable | Mortalidad | p |
| Global (n=47) | 23,4% (11/47) | |
| Según indicación (n=47) | ||
| Tratamiento empírico en pacientes neutropénicos | 22,2% (4/18) | |
| Tratamiento específico | 25,0% (4/16) | |
| Aspergillus spp. | 33,3% (2/6) | |
| Candida spp. | 20,0% (1/5) | |
| Cryptococcus spp. | 0,0% (0/2) | |
| Histoplasma capsulatum | 0,0% (0/1) | |
| Rhizopus spp. | 100% (1/1) | |
| Rhodotorula spp. | 0,0% (0/1) | |
| Leishmaniasis | 0,0% (0/6) | |
| Otros | 42,9% (3/7) | |
| Tratamiento empírico con criterios IFI | 33,3% (1/3) | |
| Tratamiento empírico sin criterios IFI | 50,0% (1/2) | |
| Profilaxis de IFI en neutropénicos | 50,0% (1/2) | |
| Según dosis (n=47) | ||
| ≤3mg/kg/día vs.>3mg/kg/día | 13,0% (3/23) vs. 33,3% (8/24) | 0,168 |
| Según duración (n=47) | ||
| ≤15 días vs.>15 días | 29,2% (7/24) vs. 17,4% (4/23) | 0,494 |
| Según dosis acumulada (n=47) | ||
| <5g vs.>5g | 24,2% (8/33) vs. 21,4% (3/14) | 1 |
| Según dosis acumulada/peso (n=47) | ||
| ≤50mg/kg vs.>50mg/kg | 25,0% (6/24) vs. 21,7% (5/23) | 1 |
| Según índice de Charlson (n=47) | ||
| 0-1: ausencia de comorbilidad | 22,2% (2/9) | 0,989 |
| 2: comorbilidad baja | 22,2% (2/9) | |
| 3: comorbilidad alta | 24,1% (7/29) | |
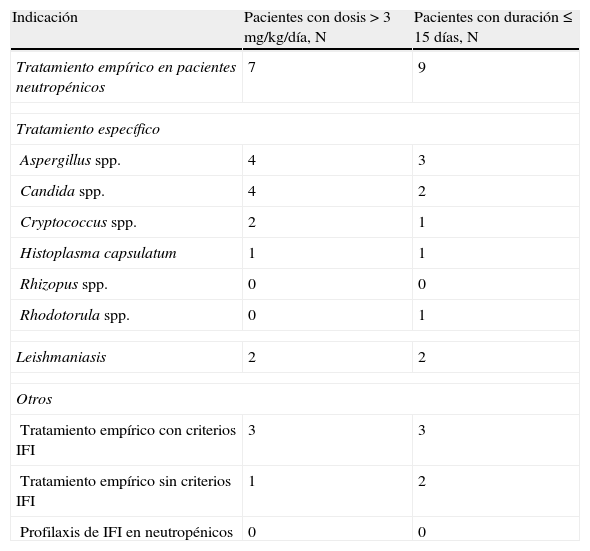
La información sobre los pacientes que recibieron dosis>3mg/kg/día y de los pacientes en los que se administró durante≤15 días se detalla en la tabla 6.
Pacientes que recibieron dosis>3mg/kg/día y de los pacientes con una duración de tratamiento≤15 días
| Indicación | Pacientes con dosis>3mg/kg/día, N | Pacientes con duración≤15 días, N |
| Tratamiento empírico en pacientes neutropénicos | 7 | 9 |
| Tratamiento específico | ||
| Aspergillus spp. | 4 | 3 |
| Candida spp. | 4 | 2 |
| Cryptococcus spp. | 2 | 1 |
| Histoplasma capsulatum | 1 | 1 |
| Rhizopus spp. | 0 | 0 |
| Rhodotorula spp. | 0 | 1 |
| Leishmaniasis | 2 | 2 |
| Otros | ||
| Tratamiento empírico con criterios IFI | 3 | 3 |
| Tratamiento empírico sin criterios IFI | 1 | 2 |
| Profilaxis de IFI en neutropénicos | 0 | 0 |
Un 9% (n=4) sufrió nefrotoxicidad, pero en ningún caso fue causa de suspensión del tratamiento. Los 4 pacientes en los que se manifestó habían recibido una dosis acumulada superior a 3g (n=24; p=0,059), y 2 de ellos superior a 10g (n=7; p=0,092), con una pauta diaria de 3 y 5mg/kg, respectivamente. La aparición tuvo lugar antes de los 15 días de tratamiento en 2 de los casos. Tres de los 4 pacientes estaban en tratamiento con otros fármacos nefrotóxicos. En 2 casos la nefrotoxicidad no fue reversible ya que los pacientes fallecieron durante el ciclo de antifúngico.
DiscusiónEste estudio presenta varias limitaciones; la principal es que se trata de un análisis retrospectivo con las dificultades que esto conlleva en la recogida de los datos y, por tanto, las variables de resolución, recurrencia o falta de efectividad dependen en gran parte del criterio del médico. Además, cabe destacar el escaso número de tratamientos con anfotericina B liposomal a lo largo de los 8 años del período de estudio, hecho que podría ser debido en parte a la utilización de la formulación lipídica de anfotericina B, y en parte a la aparición de nuevos antifúngicos en los últimos años.
La utilización se adecuó a las indicaciones descritas en este trabajo en la mayoría de los casos. Se obtuvieron datos de efectividad concordantes con la literatura científica en leishmaniasis (>95%)5 y valores en el límite inferior en pacientes neutropénicos (33-50%)6,13. Los datos de respuesta para las indicaciones no contempladas en este estudio no son representativos debido al bajo número de pacientes. Asimismo, tampoco lo son los datos de respuesta por patógeno causal en los casos de criptococosis e histoplasmosis. En la aspergilosis, estos concuerdan con los descritos en la literatura (45-50%)3; sin embargo, en la candidiasis sistémica los porcentajes de respuesta obtenidos se encuentran por debajo (75-90%)6.
La prescripción de dosis altas, tanto en las dosificaciones en función del peso como en las acumuladas, no se asoció a mejores resultados clínicos, pero sí la duración de la terapia, obteniéndose una efectividad mayor cuando esta superaba los 15 días de tratamiento. El grupo de pacientes que recibió tratamiento durante 15 días o menos sufrió mayor mortalidad, siendo esta la causa mayoritaria del fin del tratamiento en este grupo de pacientes, pero esta diferencia no fue estadísticamente significativa. El diseño del estudio imposibilita establecer si la mortalidad de los pacientes fue por falta de efectividad o por la gravedad de estos. Sin embargo, se observó que el grado de comorbilidad no influyó en la efectividad, la mortalidad, la dosis o la duración del tratamiento.
Con los datos de nefrotoxicidad obtenidos no se puede establecer claramente la relación causal debido a que no se puede distinguir la aportación de cada fármaco nefrotóxico a la toxicidad renal total. Tampoco se puede concluir que la nefrotoxicidad se vea asociada a la administración de dosis altas o a la duración del tratamiento, a pesar de los datos referidos en la literatura6,7. Sin embargo, los datos de frecuencia de aparición de esta reacción adversa coinciden con los que se describen en la ficha técnica del producto (<10%)1.
Similares resultados a los obtenidos en este trabajo se han observado en otros estudios que evalúan el uso de anfotericina B liposomal en la práctica clínica. Un estudio multicéntrico alemán con 406 pacientes en los que se administró el fármaco durante una media de 20 días, y con una dosis media de 2,3mg/kg/día, obtuvo tasas de efectividad medidas como respuesta completa del 51,5%, una mortalidad del 12,6% y una nefrotoxicidad del 4,2%9. Las diferencias en cuanto a mortalidad pueden ser debidas a la distinta gravedad de las poblaciones de estudio. Otro estudio multicéntrico español, llevado a cabo en 179 pacientes que recibieron el tratamiento en UCI, con una duración media de 15 días y dosis media de 3,7mg/kg/día, mostró una efectividad del 54%2. En un trabajo comparativo de voriconazol (n=32) frente a anfotericina B liposomal (n=26), las tasas de respuesta obtenidas medidas como resolución de la fiebre en el grupo de anfotericina fueron del 54%, un 11% sufrieron recurrencia de la infección, se suspendió el tratamiento por falta de efectividad a criterio del médico en un 8% de los casos, se observó nefrotoxicidad en un 27% y el 23% murieron11.
La anfotericina B ha sido durante décadas el antifúngico de elección. Las formulaciones lipídica y liposomal tienen un perfil de seguridad similar10 y se asocian a mucha menor nefrotoxicidad que la formulación convencional, habiéndose demostrado que hasta un 50% de los pacientes a los que se administre anfotericina B liposomal frente a la convencional no presentarán daño renal8,13.
En los últimos años se han comercializado nuevos tratamientos antifúngicos más seguros que dificultan la selección del mejor régimen para cada paciente. Sin embargo, y a la vista de los resultados obtenidos en este trabajo, la anfotericina B liposomal sigue teniendo su hueco dentro del arsenal terapéutico disponible para el tratamiento de la IFI, obteniéndose una efectividad moderada, con unas tasas de curación que casi alcanzan el 50%. Es el antifúngico de mayor espectro disponible hasta el momento, pudiendo ser utilizado en la mayoría de las infecciones por hongos. Sigue siendo el tratamiento de elección en la leishmaniasis y en la meningitis criptocócica con o sin fluorocitosina. Es la alternativa al voriconazol más efectiva en la aspergilosis invasiva y a las equinocandinas en la candidiasis invasiva, siendo estas la primera opción por su menor toxicidad. Es útil en el tratamiento empírico en pacientes neutropénicos, especialmente en aquellos que han recibido profilaxis con fluconazol. No es necesario monitorizar sus niveles séricos, se puede dar con seguridad en pacientes con daño hepático y no presenta riesgo de interacciones farmacológicas, salvo con otros fármacos que produzcan daño renal. Este estudio ha demostrado que es un fármaco bastante seguro, incluso en pacientes con la función renal alterada o en tratamiento con otros nefrotóxicos. La nefrotoxicidad no parece un factor limitante de la utilización de la anfotericina B liposomal en la práctica clínica.
Declaración de los autoresEl contenido de este trabajo es original y no ha sido publicado con anterioridad. Se presentó como formato póster en el XV Congreso de la SEIMC, que tuvo lugar del 1 al 4 de junio de 2011 en Málaga.
Todos los autores están de acuerdo con el contenido de este artículo.
Se han seguido los protocolos establecidos para acceder a los datos de las historias clínicas a fin de realizar esta publicación.
Conflicto de interesesNo existe conflicto de intereses.