El enfermo cirrótico presenta riesgo quirúrgico y anestésico especial por insuficiencia hepática, por trastornos de coagulación y por la posibilidad de descompensación ascítica. Por ello diseñamos una técnica quirúrgica para la reparación de sus hernias ventrales.
Presentamos un estudio observacional sobre la reparación de hernias ventrales de 13 pacientes hepatópatas con antecedentes de episodios de descompensación ascítica. A todos se les realizó la misma técnica quirúrgica, consistente en cierre primario y dos prótesis superpuestas supraaponeuróticas (biológica la profunda y de polipropileno la superficial).
Las operaciones tuvieron lugar entre mayo de 2010 y febrero de 2015, con un seguimiento medio de 25.3 meses. Fueron 9 varones y 4 mujeres, con un promedio de edad de 57.8 años. Las hernias eran 8 umbilicales, 3 epigástricas y 2 infraumbilicales; 9 de ellas primarias y 4 posquirúrgicas. Su riesgo anestésico era ASA-III y ASA-IV, Child-Pugh B y C. A todos se les aplicó anestesia general. El tiempo quirúrgico medio fue de 45 minutos. El seguimiento hospitalario fue realizado por cirujanos y hepatólogos. La estancia media fue de 5.9 días. Las complicaciones locales fueron escasas; 4 presentaron descompensación hepática. No hemos detectado recidivas.
La hernia menoscaba la calidad de vida del paciente cirrótico, y debemos ser capaces de resolverlas. La técnica descrita es supraaponeurótica, basada en la aplicación de prótesis duales, pero a medida. La biológica impermeabiliza el cierre, y la de polipropileno refuerza la reparación.
Es un procedimiento sencillo, rápido y seguro, asequible a cualquier cirujano general. Las posibles complicaciones aparecerían en el plano superficial, facilitando su resolución.
The cirrhotic patient have special anesthetic and surgical risk: hepatic failure, coagulation disorders and the possibility of ascetic decompensation. Therefore we designed a surgical technique for repair their ventral hernias.
We present an observational study about the repair of ventral hernias in 13 patients with liver disease with background of ascitic decompensation. All patients underwent the same surgical technique consistingin a primary closure and two supra-aponeurotic overlapped prosthesis (biological deep, and polypropylene superficial).
Operated from May 2010 to February 2015, the mean follow up is 25.3 months. Were 9 men and 4 women. With age-averageis 57.8 years. Umbilical hernias were 8, epigastric 3 and infra-umbilical 2; 9 primary and 4 post-surgery. Anesthetic risk were ASA-III, ASA-IV. Child-Pugh B and C. The general anesthesia was applied to all. The operative time average was 45minutes. Hospital care was performed by surgeons and hepatologists; the stay average was 5.9 days. Local complications were infrequent; 4 had hepatic decompensation; we have not detected recurrences.
The hernia deteriorate the quality of life in cirrhotic patient, and we must be able to resolve them. Our technique is based in onlay techniques an in the use of dual prosthesis. The biological prosthesis proof the suture, an the polypropylene prosthesis reinforces the repair.
It is a fast, safe and simple procedure, available to any general surgeon. Possible complications appear in the surface plane, facilitating its resolution.
El cirujano general, y sobre todo el especializado en pared abdominal, dispone de un arsenal de técnicas reparadoras de los diversos tipos de defectos herniarios, con el que obtiene habitualmente buenos resultados en los pacientes que no presentan comorbilidades o en los que estas son leves. Sin embargo, cuando el paciente presenta patología concomitante grave o el tipo de hernia es complejo, el contexto es distinto; dicha situación aumenta considerablemente el riesgo y es motivo de exigentes y ponderadas decisiones acerca de la técnica quirúrgica que se ha de elegir1,2.
Un ejemplo paradigmático de dicha situación es la del paciente cirrótico, ya que, en la actualidad, su enfermedad suele ser de larga evolución, durante la cual es factible la aparición de una hernia ventral (especialmente la hernia umbilical, que padece alrededor de un 20% de los individuos que desarrollaron ascitis3). La frecuente descompensación ascítica4 aumenta la presión intraabdominal, lo que provoca distensión progresiva de la pared del abdomen y que acaba originando una hernia umbilical o epigástrica. Dichas hernias podrían estrangularse, o podría romperse la pared del saco con la consiguiente evisceración5,6. En el paciente laparotomizado, además, la ascitis facilita la dehiscencia precoz y la hernia incisional. Asimismo, la filtración del líquido ascítico a través de la herida es una complicación potencialmente grave y difícil de tratar7. Esta dualidad, hernia y ascitis, causa un aumento del riesgo quirúrgico y anestésico, tanto por la insuficiencia hepática crónica8 como por los trastornos añadidos de la coagulación sanguínea que les predisponen al sangrado fácil y peligroso9.
Ante dicha situación problemática, nuestro grupo ha diseñado una variante técnica original, aplicable específicamente a estos pacientes. Nuestras pretensiones fueron: 1) conseguir un cierre del defecto con la mayor estanqueidad posible frente a la filtración ascítica, para lo cual utilizamos dos prótesis superpuestas, una laminar y otra reticular, implantadas en el espacio supraaponeurótico, y 2) que la técnica resulte sencilla y rápida, y que requiera una mínima disección de planos anatómicos musculofasciales.
El objetivo del trabajo es aportar una opción técnica original para la reparación de la pared abdominal en los pacientes cirróticos ascitógenos con hernias ventrales, y ofrecer el análisis de los resultados preliminares obtenidos en este tipo de enfermos complejos.
Material y métodosPacientesSe trata de un estudio prospectivo observacional de 13 pacientes cirróticos con hernias ventrales tratadas mediante una reparación original utilizando dos prótesis, como se describirá más adelante. Los pacientes fueron remitidos a una Unidad de Cirugía de Pared Abdominal Compleja de un hospital terciario por ser portadores de una hernia ventral (primaria o incisional) sintomática. Todos padecían de cirrosis hepática ascitógena, y fueron diagnosticados y controlados por la Unidad de Hepatología del mismo hospital. Todos tenían antecedentes de algún episodio de descompensación aguda de la ascitis, y cuatro de ellos habían sido tratados de su hipertensión portal con un shunt transyugular intrahepático portosistémico (TIPS). Todos fueron operados consecutivamente, además, por el mismo equipo quirúrgico, coordinado por uno de sus componentes (V. M. M.), realizándoseles siempre la misma técnica, sin ningún criterio de selección o de exclusión por edad o tamaño de la hernia, ni por la supuesta complejidad de esta. Sí se excluyeron aquellos pacientes que presentaban un excesivo riesgo operatorio (para esta o cualquier intervención) y los que requirieron cirugía de urgencia.
Las variables estudiadas se recogen en un protocolo de diseño personal, adaptado a nuestro medio hospitalario. En él se anotan las características de las intervenciones realizadas sobre la pared abdominal en la citada Unidad de Pared Abdominal. Revisamos las variables señaladas:
- •
Del paciente: anemia, alteración de la coagulación, historia familiar de hernia, tabaquismo, herniosis, obesidad, cirugía previa, fármacos consumidos y riesgo anestésico (según la clasificación ASA).
- •
De la hernia ventral: primaria o recidivada; ubicación y sintomatología.
- •
De la intervención: tipo de anestesia; clase de intervención según el grado de contaminación de la herida; tipo de prótesis implantadas (biológica y polipropileno).
- •
Días de estancia hospitalaria.
- •
Complicaciones posoperatorias: locales, abdominales y generales.
- •
Presencia de recidiva.
A todos se les realizó una visita prequirúrgica la semana anterior a la fecha prevista para la intervención, siendo evaluados por los facultativos de la Unidad de Pared y de la Unidad de Hepatología. Aquellos pacientes con alteraciones hematológicas graves fueron previamente controlados y tratados por los hematólogos, quienes fueron los que indicaron la fecha idónea para la intervención a demanda de los controles clínicos y analíticos. Una vez comprobado que estaban en condiciones de ser operados, ingresaron la víspera de la cirugía, realizándoseles al ingreso un último análisis. No se pautó profilaxis antitrombótica con heparina de bajo peso molecular por las habituales alteraciones de la coagulación.
Técnica quirúrgicaA todos los pacientes se les aplicó por protocolo la profilaxis antibiótica: 1g de cefalosporina de segunda generación intravenoso (Cefonicid®) administrado media hora antes de la incisión cutánea, repitiendo la dosis de 1g cada 24h durante la estancia hospitalaria.
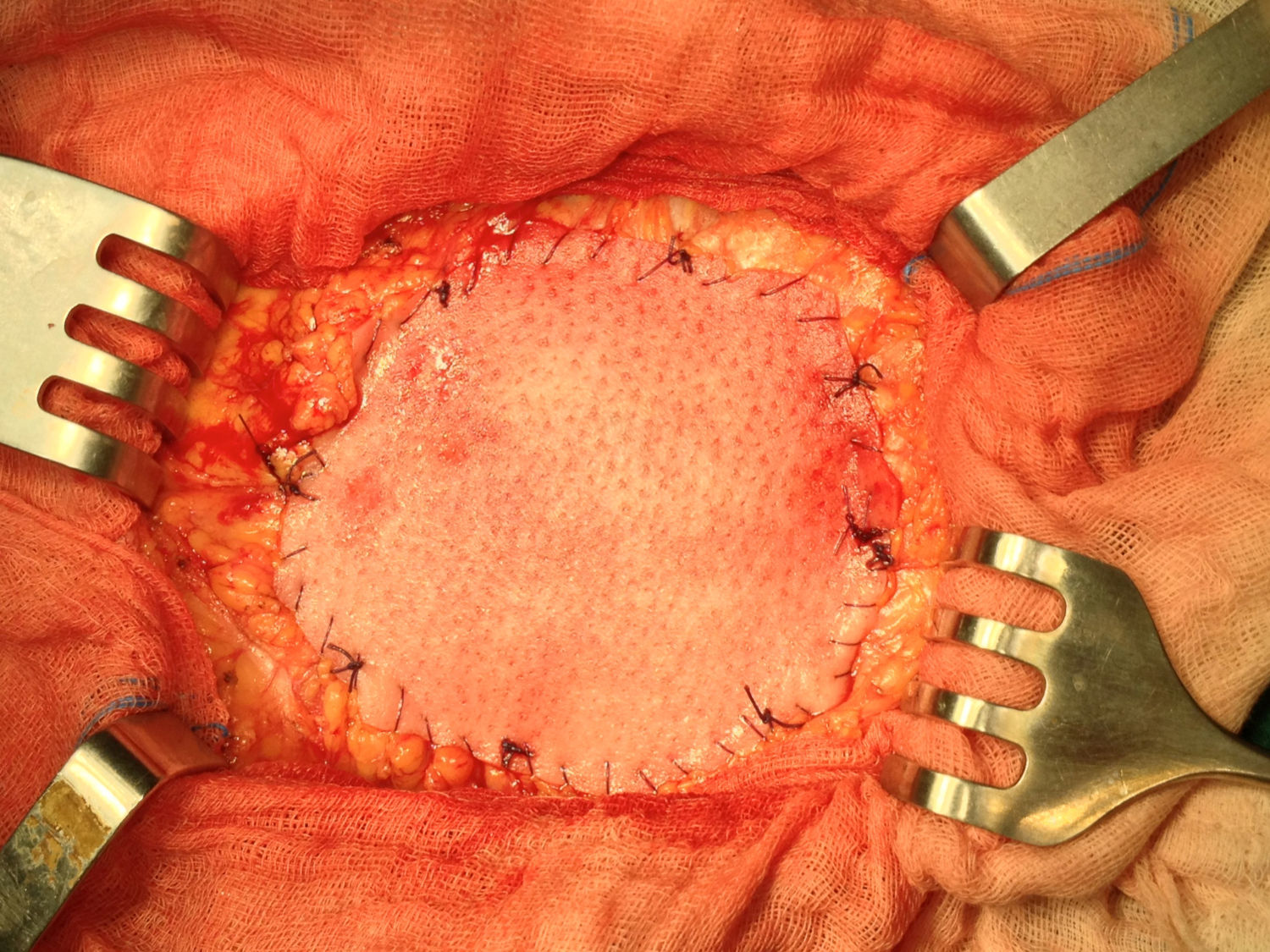
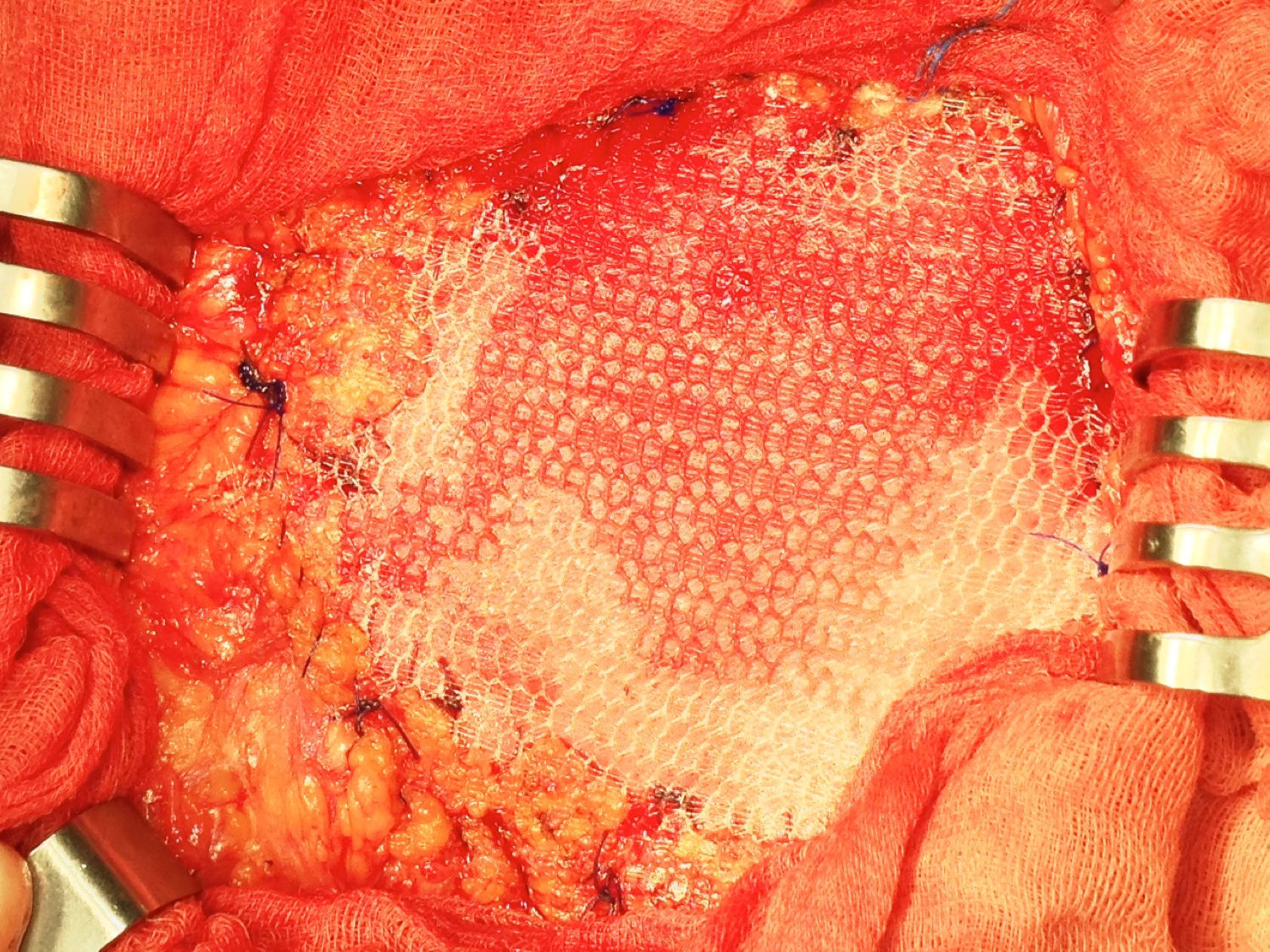
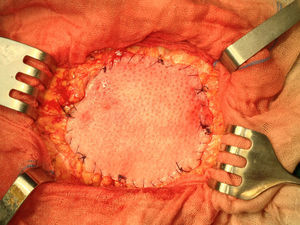
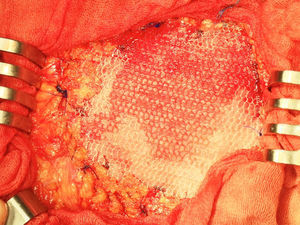
Una vez anestesiado el paciente (todos con anestesia general, unos con intubación traqueal y otros con mascarilla laríngea), se procede a la incisión de la piel y al despegamiento del tejido celular subcutáneo en la extensión necesaria para liberar completamente el saco herniario, que se abre despegándole las posibles adherencias viscerales (asas, epiplón), reduciendo su contenido a cavidad; si el paciente presenta ascitis, se le aspira, prescindiendo de cualquier otra maniobra añadida intraperitoneal para evitar lesiones de las habituales venas dilatadas varicosas del epiplón mayor por la hipertensión portal a ese nivel. Expuesto el defecto de la pared, se procede al cierre primario peritoneo-aponeurótico, suturando ambos bordes con una continua doble de acido poliglicólico en sentido cráneo-caudal, plano que se aproxima sobradamente sin tensión tras drenar la ascitis, sin realizar ningún desdoblamiento fascial. Sobre esta reparación se implanta la primera prótesis laminar biológica de dermis porcina o de pericardio bovino, sobrepasando el defecto en 3-4cm, adaptándola a la superficie aponeurótica con cierta tensión mediante cuatro puntos sueltos también de acido poliglicólico, reforzando dicha fijación con una sutura perimetral continua de monofilamento absorbible (Poliglecaprona®), bien ajustada a la superficie aponeurótica, pretendiendo conseguir una mayor adherencia y la hermeticidad en todo el perímetro protésico (fig. 1). A continuación, sobre la prótesis biológica se superpone la segunda prótesis, una malla de polipropileno tricotado, macroporosa de baja densidad, que rebasará a la subyacente (la biológica) en unos 10mm; se tensa con puntos sueltos de acido poliglicólico y, a su vez, también se refuerza mediante una sutura perimetral continua de monofilamento no absorbible (polipropileno) (fig. 2).
Realizamos una exhaustiva hemostasia del lecho subcutáneo que, además, instilamos con trombina (Surgiflo® o Floseal®, según disponibilidad) para prevenir o reducir el posible hematoma. Para terminar se colocan drenajes aspirativos de tipo redón, uno o varios, dependiendo del tamaño del espacio despegado, que serán retirados en sala o en policlínica a la semana de la intervención. Por último, se aproximan los bordes de dicho espacio subcutáneo con sutura absorbible, y el cierre de la piel con grapas metálicas. Colocamos apósito y una faja abdominal compresiva.
PosoperatorioEl paciente permanece en la sala de despertar controlado por el servicio de anestesia, donde se le administrará la analgesia habitual (2g de metamizol intravenoso cada 6h, o 1g de paracetamol intravenoso cada 8h, si el paciente es alérgico a pirazolonas). La tolerancia oral a líquidos se le inicia al llegar a la sala de hospitalización, y el cambio de dieta se establece a demanda según la recuperación del tránsito intestinal. Inician la deambulación al día siguiente de la intervención. Durante su estancia, los pacientes son controlados conjuntamente por los Servicios de Cirugía y Hepatología, hasta el alta hospitalaria. Las revisiones posoperatorias se programan a la primera y segunda semana tras el alta (en caso de complicación, control clínico a demanda), a los dos meses, al año y luego anualmente hasta el quinto año, prolongando las revisiones con cita abierta permanente. En las correspondientes visitas registramos en nuestros protocolos el estado evolutivo, la morbilidad posoperatoria derivada de la cirugía y la producida directa e indirectamente por su enfermedad hepática, así como los posibles reingresos y reintervenciones.
Análisis estadísticoTodos los datos fueron transferidos a un fichero electrónico en soporte Microsoft Acces® diseñado por uno de los autores (V. M. M.), cuyos parámetros y variables se procesan en una hoja de cálculo de Microsoft Excel®. Las variables se analizan mediante cálculo estadístico descriptivo básico: número de casos y porcentaje, media aritmética, desviación típica y amplitud de intervalos.
ResultadosEntre mayo de 2010 y febrero de 2015 operamos de hernia ventral con la técnica descrita a 13 pacientes: cierre del defecto más implantación de dos prótesis (una biológica y otra de polipropileno) en posición preaponeurótica. Se aplicó a 9 varones (69%) y a 4 mujeres (31%), con una media global de edad de 57.8 años (39-70 años). Todos presentaban una hernia ventral sintomática, dolorosa y con episodios de incarceración. De ellas, 8 (61%) eran umbilicales, 3 (23%) epigástricas y 2 (16%) infraumbilicales, siendo primarias 9 (69%) y 4 (31%) posquirúrgicas. El diámetro transversal del defecto herniario osciló entre 2 y 8cm, con considerable riesgo de estrangulación de epiplón o de asa intestinal.
Presentaban un riesgo anestésico ASA-III 10 pacientes (77%), y ASA IV, 3 (23%). La cirugía practicada fue considerada como limpia en todos los pacientes.
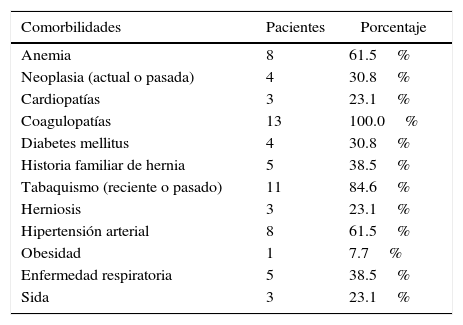
Estos estaban afectados de cirrosis hepática de origen posterior a hepatitis C o alcohólica, filiados en la escala Child-Pugh: 10 pacientes (77%) del tipo B y 3 enfermos del tipo C. Todos tenían antecedentes de descompensaciones ascíticas repetidas y alteraciones de la coagulación, y había disminución de índice de Quick en 7 (54%) y plaquetopenia en 10 (77%). El total de comorbilidades detectadas se refleja en la tabla 1.
Comorbilidades detectadas en los pacientes
| Comorbilidades | Pacientes | Porcentaje |
|---|---|---|
| Anemia | 8 | 61.5% |
| Neoplasia (actual o pasada) | 4 | 30.8% |
| Cardiopatías | 3 | 23.1% |
| Coagulopatías | 13 | 100.0% |
| Diabetes mellitus | 4 | 30.8% |
| Historia familiar de hernia | 5 | 38.5% |
| Tabaquismo (reciente o pasado) | 11 | 84.6% |
| Herniosis | 3 | 23.1% |
| Hipertensión arterial | 8 | 61.5% |
| Obesidad | 1 | 7.7% |
| Enfermedad respiratoria | 5 | 38.5% |
| Sida | 3 | 23.1% |
Para la profilaxis solo se utilizó una clase de antibióticos –cefalosporina de segunda generación–, ya que no hubo ningún alérgico a penicilinas y derivados.
Las prótesis biológicas implantadas en el plano profundo fueron 10 de matriz porcina (77%) y 3 de pericardio bovino (23%), elegidas según su disponibilidad en el hospital; las superficiales fueron todas mallas de polipropileno de baja densidad. El procedimiento quirúrgico tuvo una duración variable, dependiendo del tipo de hernia y de la minuciosa liberación de adherencias epiploicas al saco. El tiempo quirúrgico promedio «apertura-cierre» fue de 45 minutos (35-70 minutos).
La estancia hospitalaria global promedia fue de 5.9 días (1-15 días), ocupando las estancias más prolongadas aquellos pacientes con patologías concomitantes ajenas a la intervención quirúrgica.
Las complicaciones posquirúrgicas locales fueron escasas. Un paciente (7.7%) tuvo una sufusión hemorrágica, resuelta de manera conservadora. En un caso (7.7%) aparecieron trastornos tróficos superficiales en la herida sin afectación de las prótesis, solucionados con apósitos argénticos en la lesión. Otro enfermo (7.7%) presentó parestesias locales en la zona operatoria que se prolongaron durante el primer mes y precisaron durante ese tiempo de tratamiento analgésico; los otros pacientes no necesitaron analgesia a la semana de la intervención. Ninguno presentó seroma, hematoma, rechazo de las prótesis ni colección subcutánea de ascitis.
También fueron escasas las complicaciones generales, como descompensación hepática posoperatoria con ascitis en 4 pacientes (30.8%), que requirieron varias paracentesis junto al tratamiento médico habitual, hasta lograr la recuperación.
El seguimiento clínico promedio fue de 25.3 meses (1-44 meses). Durante este fallecieron 2 pacientes por progresión de su enfermedad hepática y de uno de ellos se perdió el control a los 6 meses. Los 10 restantes han presentado una reparación sólida y sin recidivas hasta la actualidad.
DiscusiónLa hernia ventral sintomática del paciente cirrótico, con o sin ascitis, debe operarse siempre (salvo contraindicación absoluta). En estos enfermos es habitual que se produzca un aumento progresivo del volumen abdominal, lo que va a acrecentar la intensidad de las molestias, así como el riesgo de incarceración, de estrangulación o de ruptura espontánea de la hernia10. La situación originada por las complicaciones de estas hernias es grave11, ya que nos obligará a recurrir a la cirugía urgente en la que nos tendremos que enfrentar a una resección intestinal o a una peritonitis aguda, lo que aumentará la mortalidad de forma exponencial12, máxime considerando que el paciente suele ser portador de comorbilidades complejas (cardiopatías, neumopatías, alteraciones de la coagulación, etc.). Todo ello justifica la priorización de los estudios preoperatorios para agilizar la intervención de forma electiva y evitar el alto riesgo operatorio que tiene este grupo de pacientes cirróticos con hernia ventral cuando son operados de urgencia.
Cualquier técnica de reparación de la pared abdominal en pacientes del tipo de nuestros operados precisa un procedimiento anestésico meticulosamente programado, sobre todo si preferimos emplear la anestesia general. Dicho procedimiento anestésico fue el aplicado a todos los pacientes de la muestra, lo cual nos proporcionó las condiciones operatorias más adecuadas. Sin embargo, aunque no hubo ningún caso de contraindicación absoluta para la anestesia general, y la pericia de los miembros del Servicio de Anestesia nos permitió aplicarla, también sería factible realizar nuestra técnica quirúrgica bajo anestesia local o regional, asumiendo los riesgos específicos de esas modalidades anestésicas13.
En todo caso, la solución quirúrgica para estos enfermos herniados con funcionalismo hepático alterado y riesgo de ascitis es recomendable. Tiene el fin de prevenir o disminuir las molestias locales derivadas de la hernia, ya que ella les limita funcionalmente, provocándoles una merma importante de su calidad de vida14. Otra circunstancia a tener en cuenta es que, actualmente, el enfermo hepatópata por cirrosis sobrevive muchos años con su enfermedad15, alcanzando las décadas altas de la vida. La media de edad entre nuestros pacientes fuede 58 años, similar a la de otras series3.
Durante su evolución clínica, tanto la hepatopatía en sí como algunos de los fármacos consumidos generan determinados desequilibrios en la homeostasis de la matriz extracelular al inducir cambios bioquímicos en el equilibrio síntesis/degradación de las fibras de colágeno tipo I/tipo III, lo cual facilitará la aparición de la hernia16; ello provoca una perturbación de la calidad de vida del hepatópata17, cuyo único recurso de mejora es la cirugía, sobre todo si es electiva.
Cada vez es más frecuente que este tipo de pacientes sea seleccionado para programas de trasplante hepático, y en esas circunstancias convendría diferir la corrección de la hernia ventral para realizarla simultáneamente con el trasplante. Pero a veces, en situaciones de alto riesgo de complicación, no es posible retrasarla. Debemos entonces programar la cirugía con una intervención poco agresiva que repare la hernia de una manera segura. Se puede aprovechar el acto quirúrgico para evacuar el líquido intraabdominal, e incluso para implantar un shunt peritoneo-venoso, mejorando el control de la ascitis y el bienestar del paciente5.
La reparación herniaria que proponemos es, habitualmente, sencilla. Las complicaciones técnicas dependen de circunstancias concomitantes, por ejemplo las posibles adherencias intestinales (cuyos mecanismos biológicos de formación están todavía sin resolver18) que podrían atrapar un segmento de intestino delgado, subocluirlo, incarcerarlo o estrangularlo, y que se deben liberar; o la hipertensión portal, que dilatará las venas de la pared abdominal y del epiplón, varicosidades que podrían lesionarse provocando hemorragias perioperatorias que, a su vez, facilitan la descompensación de la enfermedad hepática.
La tendencia actual hacia la reparación laparoscópica de estas hernias19 debe tomarse con cautela. El manejo de las referidas adherencias intrabdominales es complejo, dado el alto riesgo de lesión de las varicosidades epiploicas que facilitarían el sangrado. Otro riesgo potencial añadido es el generado por los trocares (durante la penetración transparietal podrían lesionar la red venosa colateral de la pared abdominal y provocar hematoma o hemoperitoneo); además, una vez extraídos, es necesario asegurar la hermeticidad de los puertos para evitar la posibilidad de hemorragias, la aparición de una nueva hernia en dicho puerto o la posible fuga de ascitis20. Por ello, es un escenario que requiere una amplia experiencia en abordajes laparoscópicos en esta clase de pacientes.
Dadas las circunstancias de riesgo –tanto operatorios como generales– que presentan estos pacientes, nuestro grupo se ha decantado por la técnica descrita como opción alternativa dentro de los procedimientos de cirugía abierta, con la intención de evitar el abordaje laparoscópico que, en nuestra opinión, es más complejo y peligroso. Asimismo, consideramos que nuestra técnica es más asequible a cualquier cirujano general sin necesidad de que sea un experto en pared abdominal. Además, cuenta con la ventaja de que es aplicable en cirugía programada o de urgencias.
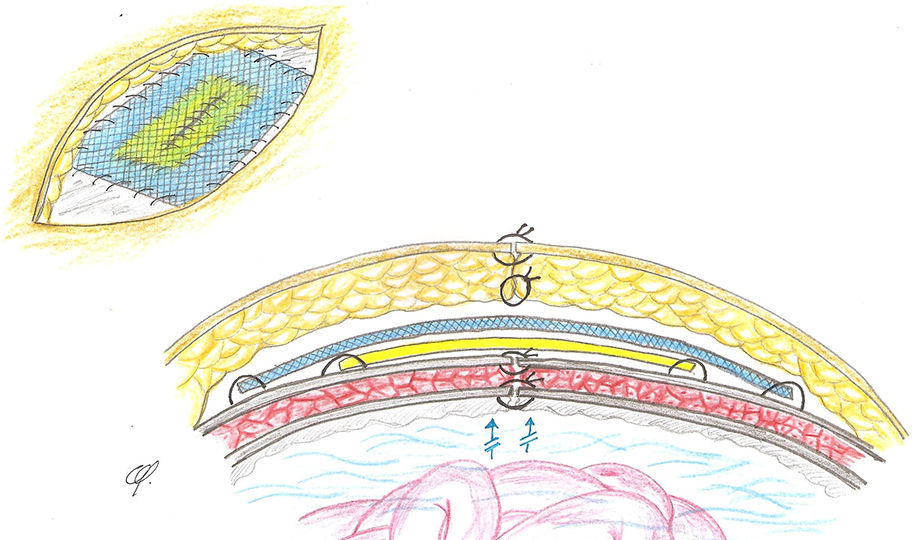
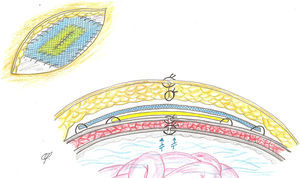
La misión de las prótesis en cirugía herniaria (ventral o inguinal) es o sustituir tejidos perdidos o reforzar tejidos debilitados. Por ello, pueden implantarse una, dos y hasta tres prótesis21. Las adaptamos en número y extensión a los planos defectuosos para reforzar, restituir y proporcionar estabilidad funcional a la pared abdominal22. Cuando se implantan dos prótesis, estas suelen estar dispuestas por encima y por debajo de las superficies musculoaponeuróticas que constituyen el defecto herniario, reconstruyéndolo o no, por lo que ambas prótesis quedan físicamente separadas entre sí por un plano anatómico23. Sin embargo, en la técnica descrita, aplicada a los cirróticos con ascitis, ambas prótesis quedan físicamente superpuestas y unidas en posición supraaponeurótica, modo de implantación ampliamente admitido y difundido, basado en las llamadas prótesis composites24–27: se recortan y adaptan al defecto en íntimo contacto, una biológica sobre la que se coloca la de polipropileno (fig. 3).
De la prótesis biológica, adosada al plano anatómico subyacente, aprovechamos su estructura laminar compacta (que le proporciona la necesaria impermeabilidad) para evitar la posible filtración y acúmulo de ascitis en el espacio subcutáneo. Sin embargo, en nuestra experiencia, la porosidad de las prótesis laminares absorbibles impide su idoneidad para aplicarlas en nuestra técnica. Asimismo, el alto riesgo de contaminación e infección de las prótesis laminares sintéticas permanentes cuando son implantadas en el espacio subcutáneo tampoco las hace recomendables para este procedimiento. Pero sabemos que la prótesis biológica es, a medio o largo plazo, absorbible, y es reemplazada por un tejido en el espacio subcutáneo prefascial que no va a tener la suficiente resistencia para asegurar la reparación herniaria, ni asegurarla cuando el paciente sufra la tremenda distensión abdominal que provoca la descompensación ascítica28.
La efectividad de la malla de polipropileno colocada en posición superficial está ampliamente demostrada en las reparaciones herniarias, inguinales o ventrales29. Nuestra concepción técnica al añadir esta prótesis en pacientes con tendencia a la distensión fue la de asegurar la reconstrucción, que consolidará cuando el tejido conjuntivo se integre progresivamente en la retícula del polipropileno subyacente30.
El procedimiento técnico desarrollado por nuestro grupo es original, dado que hasta el momento no hemos hallado otro similar en toda la bibliografía revisada. Es sencillo y rápido. También es seguro, tal y como hemos podido comprobar tras la evolución posoperatoria precoz y durante el seguimiento de los pacientes, que en promedio es de más de 2 años. En nuestra opinión, es recomendable para ser utilizado por cualquier cirujano general, sin que requiera conocimientos profundos ni especiales en pared abdominal. Aunque el número de casos aportados en este trabajo es limitado, podemos afirmar que las complicaciones derivadas de esta cirugía son escasas y leves, salvo las cuatro insuficiencias hepáticas posoperatorias referidas. Dichas complicaciones hepáticas se resolvieron exitosamente gracias a la imprescindible colaboración con los especialistas hepatólogos llevada a cabo desde la preparación preoperatoria, durante la estancia hospitalaria y hasta la aparición de las citadas descompensaciones hepáticas31.
Debemos comentar que el coste de esta modalidad de reparación herniaria es superior al de reparaciones similares aplicadas a otros tipos de pacientes, debido al encarecimiento que provoca el uso de las caras y discutidas prótesis biológicas, pero los resultados obtenidos nos avalan y aconsejan su empleo. Creemos que el sobrecoste de la prótesis compensa los gastos en estancias de hospital, reintervenciones u otros métodos terapéuticos que nos veíamos obligados a aplicar cuando, al utilizar otras técnicas, aparecían las complicaciones derivadas de la filtración de ascitis.
Se reconoce que el tratamiento quirúrgico de la hernia ventral del paciente cirrótico ascitógeno presenta un mejor pronóstico que si dicha hernia la manejamos de manera conservadora3,4,7. Ello se debe al alto porcentaje de incarceraciones que presentan estas hernias, que requieren intervención urgente, lo cual aumenta considerablemente las complicaciones locales y generales, así como la mortalidad32. Son inconvenientes que evitamos con la cirugía, máxime si a la reparación del defecto le añadimos la implantación de una prótesis33.
Concluimos que, en la corta serie de pacientes presentada, la doble aplicación protésica (polipropileno y biológica) ha generado unos resultados iniciales halagüeños. Alentados por ello, creemos que nuestra técnica podría incluirse en el arsenal terapéutico de la hernia ventral del paciente cirrótico ascitógeno. Somos conscientes de que se precisan más estudios prospectivos (observacionales, aleatorizados o multicéntricos) dedicados a investigar la resolución de dichas hernias, investigaciones que esperemos justifiquen definitivamente este original modelo técnico, empleado por nuestro grupo en los citados pacientes.
Responsabilidades éticasProtección de personas y animalesHemos seguido los protocolos mencionados.
Confidencialidad de los datosEn mi artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoEn mi artículo no aparecen datos de pacientes.
Conflicto de interesesEn este trabajo no existe ningún conflicto de intereses.
Presentado como comunicación oral en el Congreso de la Sociedad Hispanoamericana de Hernia en Santiago de Chile (octubre de 2014) Comunicación oral en el Congreso Nacional de Pared Abdominal en Madrid (2015).