Introducción
La artritis reumatoide es una enfermedad inflamatoria crónica desencadenada, probablemente, por diferentes antígenos exógenos o endógenos. Estos antígenos inducen una respuesta autoinmune que perpetúa la inflamación sinovial en pacientes con predisposición genética, con la consiguiente destrucción tisular1-4. El inicio puede ser independiente del o de los antígenos implicados2, pero la fase inflamatoria parece dirigida por antígenos específicos. La fase de destrucción articular también es independiente de los antígenos.
El desarrollo de la enfermedad depende de la interacción entre linfocitos T, linfocitos B, macrófagos y células sinoviales5. Los linfocitos B pueden actuar como células presentadoras de antígeno6,7 y envían señales estimuladoras esenciales para la activación, la expansión clonal y la función de las células T CD4+8, segregan citocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) en la membrana sinovial y producen factor reumatoide4,9-13. De hecho, el principal hallazgo histológico en la membrana sinovial reumatoide son los folículos de linfocitos B y células plasmáticas. La acumulación de estas células depende de los mecanismos de supervivencia celular, que en estos linfocitos B pueden ser diferentes de los de otros linfocitos B autorreactivos14,15 por la ayuda de linfocitos T que reconocen antígenos exógenos. Esto explicaría la existencia de una respuesta inductora de factor reumatoide antiinmunoglobulina (Ig) G dependiente de células T y la ausencia aparente de linfocitos T autorreactivos.
En 1998, Edwards y Cambridge16,17 postularon que los clones de linfocitos B relacionados con la formación de factor reumatoide de clase IgG u otro isotipo pueden perpetuarse, con la ayuda de linfocitos T colaboradores, y expresar su propio antígeno unido al fragmento C3d,g promotor de supervivencia17, y que algunos factores reumatoides IgG1 pueden inducir las manifestaciones clínicas de la artritis reumatoide por la generación de TNF-α a través de la interacción con el receptor Fc-γ-RIIIa de la IgG16,18. Finalmente, las células del estroma sinovial y de la médula ósea pueden mantener las células B activadas y, con ello, acumular células plasmáticas19. Según esta hipótesis, la depleción de los linfocitos B implicados en el desarrollo de la artritis reumatoide induciría su remisión, lo cual se ha comprobado en estudios preliminares20,21.
CD20 como antígeno diana: rituximab
El CD20 es un antígeno de superficie transmembrana que parece estar implicado en la regulación del crecimiento y en la diferenciación de los linfocitos B, y posiblemente actúa como canal del calcio22. Este antígeno se expresa únicamente en los precursores de las células B y en las células B maduras, pero no está presente en las células progenitoras ni en las células plasmáticas. La respuesta terapéutica a la depleción de células CD20 no se relaciona con la producción de autoanticuerpos23,24, lo que sugiere una alteración de las funciones inmunológicas de dichas células. Los linfocitos B son capaces de capturar antígenos mediante receptores específicos, presentarlos una vez procesados en el contexto de las moléculas HLA de clase II y estimular las células CD4+, con lo que el repertorio de células B establece cuáles son los antígenos presentados eficazmente. La expansión de un subgrupo de células B especializadas en la captura y presentación de determinados antígenos podría alterar el equilibrio entre tolerancia y autorreactividad de las células T. En los pacientes con artritis reumatoide, el repertorio de células B está alterado25, y es posible que después de la depleción de dichas células B alteradas se genere un repertorio sano y se restaure el equilibrio de las células T24. Por otra parte, las respuestas T en los folículos linfocitarios y centros germinales sinoviales dependen de las células B. Como sugieren algunos modelos experimentales11, la depleción de células B podría suprimir la producción de citocinas como el TNF-α o la interleucina-1β.
Rituximab es un anticuerpo quimérico humano-murino desarrollado por ingeniería genética que reconoce el antígeno CD20 de superficie expresado por células B26. Las líneas celulares que no expresan CD20 no resultan afectadas. Es una IgG1κ humana, con una región variable aislada de un anticuerpo anti-CD20 murino. La especificidad por el antígeno CD20 se encuentra en las regiones variables murinas, mientras que el resto del anticuerpo es de origen humano, lo que permite utilizar eficientemente el complemento y los mecanismos de la lisis mediada por células in vivo. Puesto que la mayor parte de la molécula es de origen humano tiene una baja inmunogenicidad, y se han documentado anticuerpos antiquiméricos humanos en menos de un 1% de los pacientes tratados con rituximab27.
Rituximab reduce eficazmente el recuento de células B circulantes al menos por 3 mecanismos diferentes. El principal es la citotoxicidad mediada por complemento: al unirse a C1q, activa la cascada del complemento y causa la lisis de las células CD2026. El segundo mecanismo es la unión a los receptores Fc de las células efectoras humanas, macrófagos y células natural killer (NK), lo que induce citotoxicidad mediada por células dependientes del anticuerpo28. Finalmente, el rituximab puede inducir apoptosis29. Estudios más recientes han demostrado nuevas acciones sobre otros sistemas celulares implicados en la proliferación y en la diferenciación celular y en la regulación del ciclo celular, como los canales de calcio, que producen un aumento del calcio intracelular, la activación de las tirosincinasas de la proteína src, en particular lyk y fyn, y la activación de caspasa 330-32.
Los anticuerpos anti-CD20 fueron desarrollados para el tratamiento del linfoma no hodgkiniano. Diferentes estudios posteriores han demostrado su efecto beneficioso en otras enfermedades, como la trombocitopenia inmune33, la anemia hemolítica autoinmune34 o la granulomatosis de Wegener35. Su farmacocinética se ha evaluado en pacientes con linfoma. La concentración sérica depende de la dosis, que se mantiene en un rango de 100-500 mg/m² administrados por vía intravenosa. Después de una monodosis de 250 o 500 mg/m², el recuento de linfocitos B periféricos se reduce en un 90% en 3 días. A pesar de la depleción de linfocitos B, la concentración de las diferentes inmunoglobulinas se mantiene, posiblemente debido a que las células plasmáticas son respetadas.
Depleción de linfocitos B en la artritis reumatoide. Experiencia clínica con rituximab
La remisión de la artritis reumatoide en pacientes con linfoma no hodgkiniano tratados con rituximab llevó a Edwards y Cambridge a plantear la hipótesis de que los linfocitos B podrían desempeñar un papel importante en el desarrollo de la enfermedad y a realizar un primer estudio abierto de depleción de linfocitos B en pacientes con artritis reumatoide grave refractaria al tratamiento. En dicho estudio20, como en el tratamiento del linfoma de células B, combinaron rituximab con ciclofosfamida y corticoides durante 3 semanas. Seleccionaron 5 pacientes con enfermedad inflamatoria grave que no habían respondido al tratamiento con 5 fármacos antirreumáticos modificadores de la enfermedad (FAME). Durante 3 h los pacientes recibieron 4 infusiones de 200, 600, 600 y 600 mg de rituximab, por vía intravenosa, los días 2, 8, 15 y 22, respectivamente. En un paciente se omitió la cuarta dosis debido a un episodio de dolor pleurítico y fiebre. Además se les administró prednisolona oral, entre 30 y 60 mg, los días 1 a 22, y ciclofosfamida intravenosa, 750 mg, los días 4 y 17.
Todos los pacientes mostraron una rápida mejoría de la sinovitis. La anemia remitió en todos ellos y los nódulos desaparecieron en el paciente 5. A los 6 meses los 5 habían alcanzado una respuesta del American College of Rheumatology (ACR) 50, y 3 una respuesta ACR 70 sin introducción de terapia adicional. Los pacientes que tomaban previamente prednisolona pudieron reducir la dosis a 5 mg diarios. Después de un año, 3 pacientes mantenían una respuesta ACR 70. Uno tuvo una breve reactivación en la semana 28 y recibió un nuevo tratamiento con rituximab, ciclofosfamida y prednisolona, alcanzando de nuevo una respuesta ACR 70. Otro tuvo una reactivación a las 38 semanas y también fue tratado, y alcanzó una respuesta ACR 70 a los 17 meses. El descenso de células B llegó a niveles indetectables en todos los casos y se mantuvo bajo durante al menos 6 meses. Las reactivaciones en los 2 pacientes coincidieron con el aumento de linfocitos B. Las concentraciones de factor reumatoide disminuyeron en todos los pacientes. No se observaron efectos adversos mayores atribuibles al tratamiento y no hubo reacciones graves relacionadas con la infusión. La interpretación de estos resultados es difícil, ya que las dosis de ciclofosfamida y prednisolona administradas podrían haber suprimido la respuesta celular y la producción de citocinas inflamatorias, aunque no parece probable que su efecto durara más de 6 meses.
De Vita et al21 confirmaron estos resultados iniciales en 5 pacientes con artritis reumatoide que no habían respondido a una terapia combinada con metotrexato y ciclosporina. En 2 de ellos también había fracasado la terapia con agentes bloqueadores del TNF-α. El tratamiento consistió en infusiones intravenosas de 375 mg/m² de rituximab una vez por semana durante 4 semanas. Sólo se permitió como terapia concomitante bajas dosis de esteroides, antiinflamatorios no esteroideos o hidroxicloroquina. Dos de los pacientes tuvieron una respuesta notable a partir del segundo mes, ACR 70 y ACR 50 respectivamente, de más de 10 meses de duración. Otros 2 alcanzaron una respuesta ACR 20 con recaídas a partir del quinto mes. En todos ellos se redujeron los niveles de proteína C reactiva y de factor reumatoide. En contraste, el quinto paciente, sin factor reumatoide sérico, no respondió al tratamiento. La depleción de linfocitos B se confirmó en todos los pacientes y no se observaron efectos adversos. En los pacientes con mejor respuesta se pudo demostrar una reducción en la progresión de las erosiones en el carpo.
Recientemente, Emery et al36 han presentado los resultados de eficacia y seguridad del primer ensayo clínico aleatorizado, doble ciego, controlado con placebo y multicéntrico de una población formada por 161 pacientes con artritis reumatoide. Todos los pacientes tenían una enfermedad activa, con un índice DAS (Disease Activity Score) medio de 6,9, eran seropositivos y presentaban una enfermedad refractaria al tratamiento previo con FAME (2,6 de media) incluido el metotrexato. Los pacientes fueron asignados aleatoriamente a uno de los 4 grupos de tratamiento.
- Grupo A: metotrexato (más de 10 mg cada semana por vía oral).
- Grupo B: rituximab (2 infusiones intravenosas de 1 g).
- Grupo C: rituximab (2 infusiones intravenosas de 1 g) y ciclofosfamida (2 infusiones intravenosas de 750 mg).
- Grupo D: rituximab (2 infusiones intravenosas de 1 g) y metotrexato (más de 10 mg cada semana por vía oral).
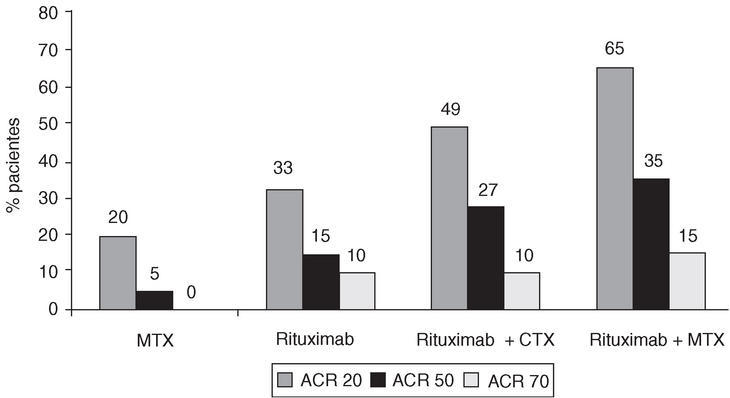
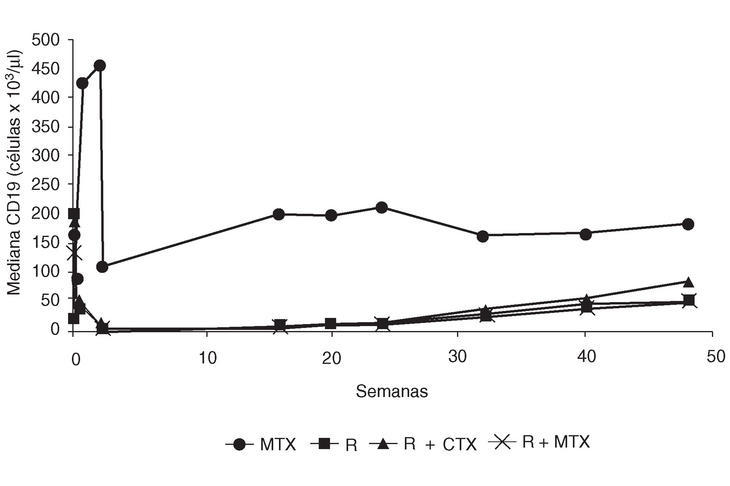
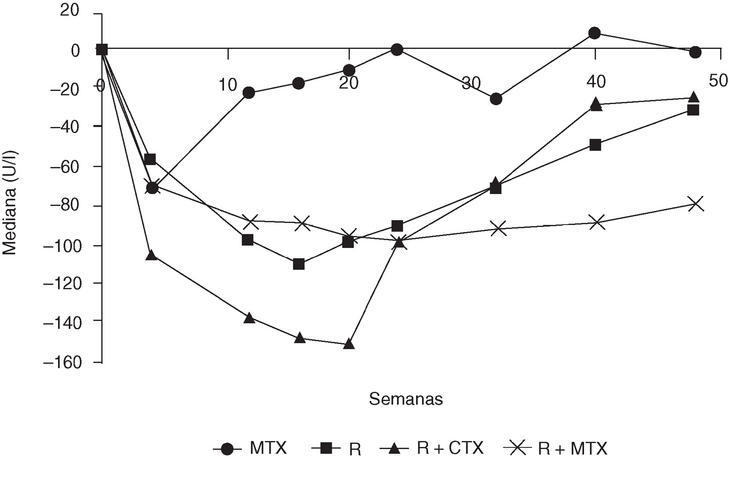
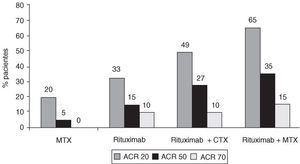
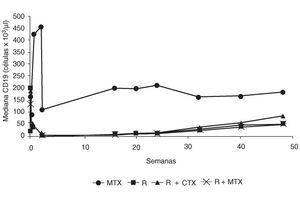
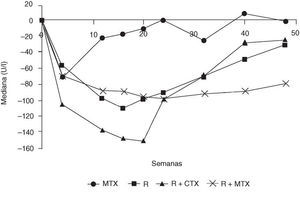
Todos los pacientes recibieron 100 mg de metilprednisolona por vía intravenosa los días previos a la administración de rituximab y ciclofosfamida, y entre 60 y 30 mg de prednisolona oral los demás días. A partir del día 18, los pacientes volvieron a recibir las dosis basales de esteroides. En la semana 48, el número de pacientes del grupo D (rituximab más metotrexato) que había alcanzado respuestas mantenidas ACR 20, 50 y 70, era superior al de los otros grupos (fig. 1). Los índices DAS y HAQ (Health Assessment Questionnaire) también fueron mejores en este grupo. Los 3 regímenes con rituximab fueron bien tolerados, con efectos adversos similares a los del grupo con metotrexato (grupo A). La mayoría ocurrió durante la primera infusión de rituximab y se resolvió espontáneamente o con tratamiento sintomático. En general, fueron considerados leves. La concentración de CD19 permaneció baja en todos los grupos que recibieron rituximab (fig. 2), y retornó a los valores normales a partir de la semana 32. Las diferentes poblaciones de células T (CD3, CD4, CD8) sólo se alteraron durante el período de infusión y regresaron rápidamente a sus valores normales, lo que podría deberse a la acción de los esteroides. Las concentraciones de inmunoglobulinas permanecieron dentro de los límites normales, y fue la IgM la que mostró mayores cambios relacionados con la reducción de los niveles de factor reumatoide (fig. 3). Estos resultados confirman las primeras observaciones que sugerían que un período corto de tratamiento con rituximab se asociaba con una mejoría significativa en pacientes con artritis reumatoide.
Figura 1. Respuestas ACR a las 48 semanas en una cohorte de pacientes con artritis reumatoide tratados con rituximab solo o asociado con ciclofosfamida (CTX) o con metotrexato (MTX) comparado con metotrexato.
Figura 2. Depleción de linfocitos CD19 en pacientes con artritis reumatoide tratados con rituximab. MTX: metotrexato; R: rituximab; CTX: ciclofosfamida.
Figura 3. Valores de factor reumatoide en pacientes con artritis reumatoide seguidos de la depleción de linfocitos B. MTX: metotrexato; R: rituximab; CTX: ciclofosfamida.
Resumen y conclusiones
La participación de los linfocitos B en la patogénesis de la artritis reumatoide no está claramente definida. Estudios recientes demuestran que las células B o sus productos intervienen en el desarrollo y la perpetuación de la enfermedad a través de diferentes mecanismos: como célula presentadora de antígeno, enviando señales coestimuladoras necesarias para la expansión clonal y funciones efectoras de las células T, o por su capacidad para segregar citocinas proinflamatorias o producir factor reumatoide.
La terapia dirigida específicamente contra las células B ha merecido gran interés en los últimos años debido a los resultados de los estudios preliminares con rituximab, un anticuerpo monoclonal anti-CD20 capaz de reducir eficazmente el número de células B en pacientes con artritis reumatoide activa sin una toxicidad significativa. Ha demostrado que la depleción de linfocitos B es clínicamente eficaz, apoyando la hipótesis de que las células B contribuyen de forma importante en la patogénesis de la artritis reumatoide y son esenciales para el mantenimiento de la inflamación crónica y la actividad de la enfermedad.
Los resultados del estudio de Edwards et al han confirmado que el tratamiento con rituximab se asocia con un destacado beneficio clínico y que la combinación de rituximab con metotrexato es la que consigue mayores niveles de respuesta en los pacientes con artritis reumatoide seropositiva activa. La mejoría clínica es sostenida, con un buen perfil de tolerancia y seguridad, y coincide con una intensa y prolongada depleción de linfocitos CD20 periféricos. Aunque son necesarios nuevos estudios, la terapia dirigida a la eliminación de las células B y sus autoanticuerpos podría ser una nueva opción terapéutica en la artritis reumatoide activa refractaria al tratamiento.