BIOBADASER es el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas. Fue creado en febrero de 2000 siguiendo las directrices del grupo de seguridad de OMERACT1, y con los siguientes objetivos:
1. Evaluar, en condiciones no experimentales, el tiempo transcurrido hasta la suspensión de terapias biológicas en pacientes con patología reumática, así como los motivos que llevan a dicha interrupción.
2. Identificar acontecimientos adversos relevantes que aparezcan durante el tratamiento de enfermedades reumáticas con terapias biológicas, y estimar su frecuencia de aparición.
3. Identificar efectos adversos inesperados.
4. Identificar acontecimientos adversos relevantes que aparezcan tras la suspensión del tratamiento.
5. Estimar el riesgo relativo de aparición de acontecimientos adversos con terapias biológicas en pacientes con artritis reumatoide frente a pacientes no expuestos a estos tratamientos.
6. Identificar factores de riesgo de padecer reacciones adversas con estos tratamientos.
Desde un principio se decidió no recoger de forma sistemática ninguna variable de eficacia, dado que complicaría la recogida de datos y la viabilidad del estudio. La interrupción del tratamiento se considera como una variable de efectividad.
BIOBADASER está respaldado por la Sociedad Española de Reumatología (SER) y por la Agencia Española del Medicamento y tiene un presupuesto anual en torno a 20.000 euros. Son sus responsables un comité, dirigido por J.J. Gómez-Reino, formado principalmente por reumatólogos y una representante de la Agencia del Medicamento (D. Montero). El proyecto es coordinado desde la Unidad de Investigación de la SER, donde se monitoriza la entrada de datos. Inicialmente, la entrada y la monitorización de los datos eran realizadas por una reumatóloga, María Jesús Martínez, que recibía faxes preformados desde los centros participantes. En el presente y desde el año 2002, la entrada de datos se realiza directamente en Internet en una aplicación ad hoc (http://biobadaser.ser.es) a la que cada responsable de un centro accede por contraseña. Los datos son monitorizados semanalmente por una secretaria de investigación, Raquel Ruiz, que ha iniciado además un proceso de monitorización in situ para comprobar la adecuación de los datos aportados, con énfasis en advertir interrupciones del tratamiento o acontecimientos adversos relevantes no comunicados.
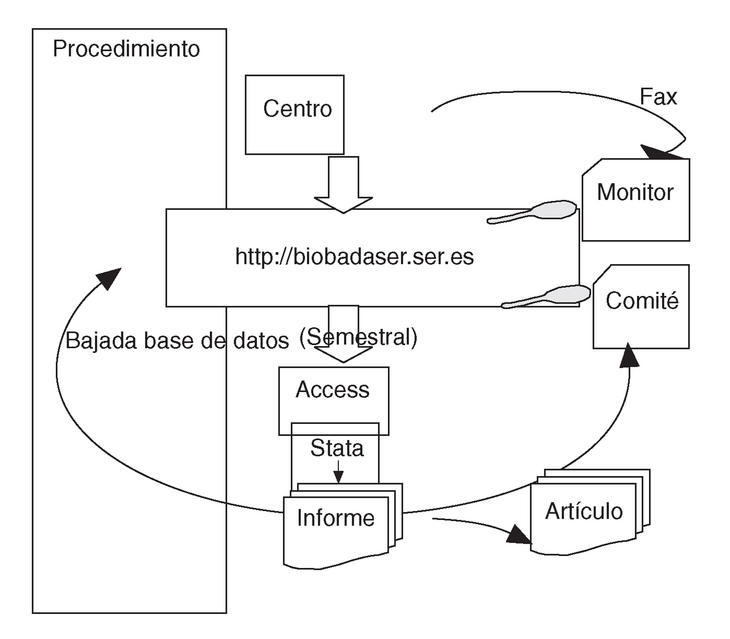
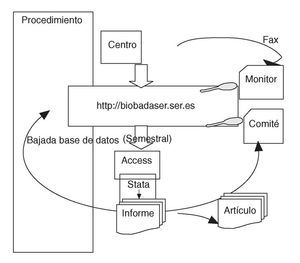
La entrada de datos en BIOBADASER es continua, a medida que se producen incorporaciones de pacientes e incidencias. Cada 6 meses se realiza un llamamiento a los participantes para que actualicen sus datos antes del informe semestral, que se lleva a cabo con los datos de junio y diciembre de cada año (fig. 1). Ocasionalmente se solicitan datos adicionales de pacientes que hayan tenido acontecimientos concretos sobre los que se esté llevando un estudio detallado.
Figura 1. Flujo de información en BIOBADASER. El centro participante introduce la información en la base de datos en el servidor mediante la aplicación de Internet. Opcionalmente puede remitir los datos vía fax a la SER. Tanto el monitor como el comité pueden acceder a la información en BIOBADASER y alertar sobre acontecimientos imprevistos o errores. Cada 6 meses se baja la base de datos del servidor y se analiza con rutinas preparadas en Stata, tras lo que se produce un informe que se manda, en abierto, a la página web de BIOBADASER y a la Revista Española de Reumatología. Ocasionalmente se producen artículos sobre asuntos específicos.
Este tipo de registros es fundamental para poder establecer la probabilidad de ocurrencia de un acontecimiento adverso determinado en pacientes en los que se administre un medicamento concreto. Esta estimación es muy difícil con otros sistemas de farmacovigilancia, en los que no se conoce el denominador ni se busca activamente la aparición de efectos adversos. No es la situación ideal de un ensayo clínico, donde sí se podría estimar la probabilidad de acontecimientos adversos, con la salvedad de que casi nunca el tamaño muestral ni el tiempo de seguimiento bastan para estimar la ocurrencia de acontecimientos de baja frecuencia.
En la SER se cuenta, además, con un grupo control adecuado que permite realizar una estimación del riesgo de un acontecimiento en pacientes similares, y no ya sólo frente a la población general: la cohorte EMECAR2. Sin este grupo control no podríamos saber si una comorbilidad determinada es más frecuente en pacientes en tratamiento con agentes biológicos, o si se trata de una comorbilidad frecuente en pacientes con enfermedades reumáticas inflamatorias, que son patologías con elevada morbimortalidad. EMECAR es una cohorte de artritis reumatoide en la que participan 788 pacientes de 34 centros y que se inició en 1999, antes del uso habitual de los agentes biológicos, y cuyo objetivo principal es estimar la frecuencia de comorbilidad en la artritis reumatoide, por lo que podría parecer un grupo control específicamente creado para BIOBADASER. En fecha 7 de enero de 2004, EMECAR aporta información de 1.158 pacientes/año. En la misma fecha, y con un año menos de seguimiento, BIOBADASER aporta información de 6.970 pacientes/año.
Datos de BIOBADASER a enero de 2004
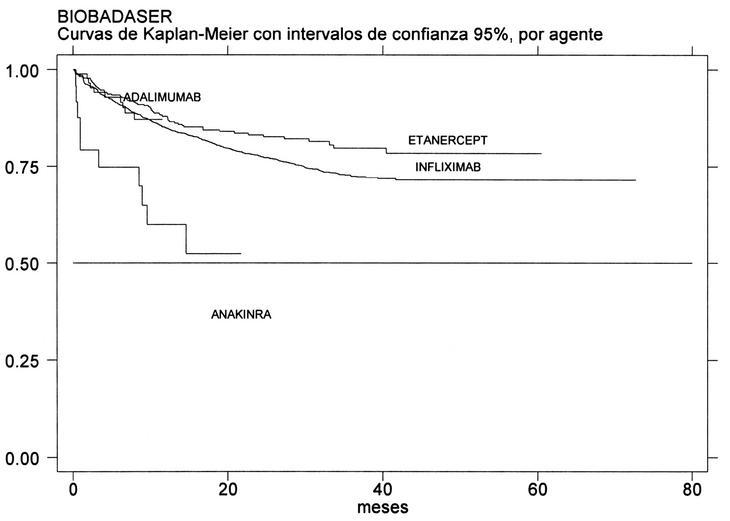
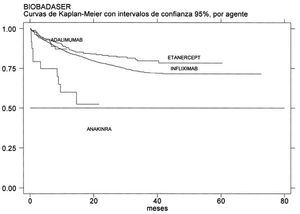
En enero de 2004, BIOBADASER contenía información de 3.622 pacientes de 92 centros, los cuales habían empezado hasta un total de 3.879 tratamientos con agentes biológicos (3.004 con infliximab, 769 con etanercept, 93 con adalimumab y 31 con anakinra); 261 pacientes habían estado con más de un agente. Por protocolo, BIOBADASER está formado por pacientes con cualquier patología reumática para la que se hayan utilizado agentes biológicos, y los diagnósticos más frecuentes son la artritis reumatoide (2.557; 71%), la espondilitis anquilosante (346; 10%), la artritis psoriásica (335; 9%) y formas de artritis crónica juvenil (150; 4%). En total, se han comunicado 777 interrupciones del tratamiento (20%) en 719 pacientes. La supervivencia del tratamiento a un año está sobre el 80% con etanercept y con infliximab (fig. 2), y no hay datos suficientes para estimarla en adalimumab o en anakinra, aunque parece que en este último agente la supervivencia del fármaco a un año está por debajo del 60%. Las causas de suspensión del tratamiento son principalmente los acontecimientos adversos (387; 50%) y la ineficacia (262; 34%).
Figura 2. Supervivencia del tratamiento en BIOBADASER.
Es importante entender qué se entiende como acontecimiento adverso relevante en BIOBADASER. Un acontecimiento adverso relevante es todo suceso desfavorable que, independientemente de la dosis (o relación con el fármaco), produzca la muerte del paciente, ponga en peligro su vida, obligue a un ingreso hospitalario o lo prolongue, o produzca una discapacidad persistente o importante. Los acontecimientos médicos importantes que no pongan en peligro inmediato la vida ni produzcan la muerte pero que comprometan al paciente o requieran intervención para prevenir alguno de los resultados enumerados en la definición anterior, también se consideran acontecimientos adversos relevantes.
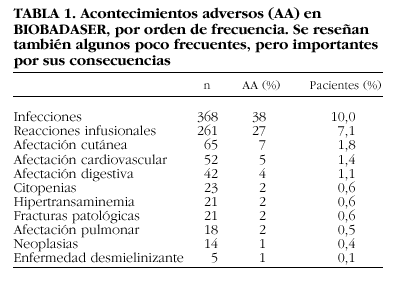
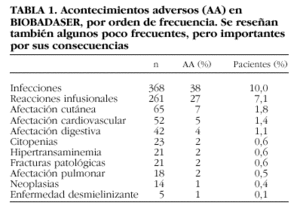
En BIOBADASER entendemos que los acontecimientos que no se comunican no son lo suficientemente importantes y, por el contrario, los comunicados son relevantes, a pesar de que algunos no parezcan convenir completamente a la definición. Se ha comunicado un total de 973 acontecimientos en 726 pacientes, lo que supone una tasa del 25% de todos los tratamientos. La tabla 1 recoge los tipos de acontecimientos adversos comunicados a BIOBADASER, por orden de frecuencia. Se han reseñado además algunos que, no siendo muy frecuentes, sí son importantes por sus consecuencias, como las neoplasias, las citopenias o las enfermedades desmielinizantes.
La tasa de acontecimientos adversos por agente biológico es la siguiente: infliximab, 29%; etanercept, 11%; adalimumab, 24%, y anakinra, 16%. Se han comunicado 39 fallecimientos, que corresponden al 4% de los acontecimientos adversos y al 1% de los pacientes registrados. Las causas de muerte han sido: infección (52% de los casos), muerte de causa cardiovascular (26%), afección pulmonar (11%) y pancitopenia (3%); el resto son de causa única o desconocida.
Datos importantes sobre la seguridad de los agentes biológicos
Los acontecimientos más frecuentemente registrados han sido, desde el principio del registro, las infecciones. Este aumento de la tasa de infecciones en pacientes en tratamiento con agentes biológicos ha sido recogido en varias series3-6. De entre los microorganismos implicados llama la atención la tasa de tuberculosis y de infecciones por herpes zoster. La tasa de tuberculosis en BIOBADASER ha disminuido desde 290 a 184 casos/100.000 pacientes/año desde la comunicación conjunta AEM-SER sobre las medidas profilácticas (marzo de 2002). No obstante, se siguen registrando casos de tuberculosis en pacientes que inician tratamiento. El riesgo frente a la población general es de 8,3 (intervalo de confianza [IC] del 95%, 4,3-15,2), y frente a pacientes sin tratamiento con agentes biológicos, de 2,8 (IC del 95%, 1,1-7,5). Otra infección a tener en cuenta es el herpes zoster. Se han detectado 32 casos, lo que supone una tasa de 300 casos/100.000 pacientes/año, mientras que en EMECAR ésta es de 170/100.000. Esto se traduce en un riesgo de incidencia relativo de 1,7 (IC del 95%, 0,4-15,3).
La insuficiencia cardíaca se considera un acontecimiento adverso del tratamiento con agentes biológicos. Los 11 casos comunicados a BIOBADASER suponen una tasa de incidencia de 100 casos/100.000 pacientes/año, frente a 860 en EMECAR, por lo que el riesgo de incidencia relativo está casi a favor de los biológicos: 0,1 (IC del 95%, 0,04-0,3). Quizá sea aventurado, no obstante, asegurar que los agentes biológicos prevengan la insuficiencia cardíaca, porque, al tratarse de un riesgo previamente conocido, es verosímil que no se los esté administrando a pacientes con riesgo de desarrollarla.
Otro acontecimiento controvertido son los linfomas y todo tipo de neoplasias. A fecha de 7 de enero de 2004 se había comunicado un linfoma y una gammapatía monoclonal. La comparación de tasas de incidencia en las 2 cohortes arroja un riesgo relativo de 0,08 (IC del 95%, 0,01-1,6), por lo que no se puede asegurar que los agentes biológicos aumenten o disminuyan la tasa de linfomas en pacientes con enfermedades reumáticas inflamatorias.
Por último, es importante reseñar que se han comunicado 5 procesos desmielinizantes en BIOBADASER (tasa de incidencia, 71 casos/100.000 pacientes/año). Hasta la fecha no hemos encontrado ningún proceso similar en la cohorte de EMECAR.
Retos en BIOBADASER
Cuando se inicia el quinto año de seguimiento, todavía quedan incógnitas y retos en BIOBADASER. Entre otros, ¿cómo asegurar la causalidad con tantos otros medicamentos que toman los pacientes en el registro? No hay que olvidar que muchos de los pacientes en BIOBADASER están tomando, además de los agentes biológicos, otros medicamentos que pueden ser la causa de los acontecimientos comunicados. Entre ellos destaca que hasta el 60% de los pacientes que presentaron un acontecimiento adverso estaban además en tratamiento con metotrexato, y el 63%, con esteroides. Otro problema, que se agrava con el tiempo de seguimiento, es la atribución de acontecimientos a agentes en pacientes que han utilizado más de uno y más de dos agentes biológicos. Y por último, ¿hasta cuándo seguir recogiendo información?