La toxicología forense requiere resultados analíticos científicamente indiscutibles y legalmente defendibles. Los criterios cualitativos son proporcionados por prestigiosos organismos de ámbito internacional y local. Este trabajo revisa y evalúa los documentos elaborados por ellos, con el fin de recoger en uno solo las distintas directrices existentes. El objetivo es contribuir a la calidad de la pericia y al avance en la unidad de criterio científico, aspectos cruciales en toxicología forense para obtener resultados toxicológicos científicamente sólidos. Se discuten los criterios necesarios para una correcta detección e identificación, detallándose las estrategias de detección y los requisitos para validar las metodologías. Respecto a la identificación, se reconoce la importancia de la espectrometría de masas, y también se hace referencia a los criterios relativos a las técnicas analíticas y a los tóxicos. Esta revisión y recopilación pretende además, servir a aquellos profesionales que deban evaluar los resultados toxicológicos emitidos por los laboratorios forenses.
Forensic toxicology requires indisputable and legally defensible analytical results. The qualitative criteria are provided by prestigious international and local organizations. This work reviews and evaluates them to gather in one document these different existing guidelines. The aim of this work is to contribute to the quality of the expertise and to implement the common scientific criteria. Both aspects are crucial in forensic toxicology to achieve toxicological results based on solid scientific foundations. The criteria, to be taken into consideration, for a correct detection and identification are discussed. The strategies for detection and the requirements for validation of these methodologies are detailed. The importance of mass spectrometry, as the most reliable technique for identification, is recognized. The criteria for analytical techniques and for toxics are also detailed. Moreover, this review and compendium of criteria try to serve those professionals who need to evaluate the toxicological findings submitted by the forensic laboratories.
La toxicología forense (TF) se define como una de las disciplinas científico-técnicas que constituyen las denominadas Ciencias Forenses y que sitúa a la Toxicología al servicio de la Administración, fundamentalmente de la Justicia.
Según la Sociedad de Toxicología Forense (SOFT)1 las 4 disciplinas que componen la TF son:
- -
La toxicología forense post mortem: investiga la ausencia o presencia de drogas (tanto sustancias de abuso como terapéuticas o medicamentos) y de sus metabolitos, alcohol y otros tóxicos volátiles, monóxido de carbono y otros tóxicos gaseosos, así como de cualquier otro producto químico (metales, pesticidas, etc.) en fluidos y tejidos humanos, evaluando su papel determinante o contribuyente en la causa y etiología de la muerte.
- -
La toxicología conductual: tiene como objetivo la investigación del alcohol y de las drogas en relación con los efectos que ocasionan en el comportamiento y en el desarrollo de tareas, en el marco de las consecuencias médico-legales derivadas de su uso (conducción de vehículos y delitos contra la libertad sexual, entre otros).
- -
El control del dopaje: su objetivo es la detección de drogas en competidores deportistas (humanos y animales) con la finalidad de proteger su salud y bienestar, mantener el nivel de competición y evitar el fraude. El Comité Olímpico Internacional (COI), la Agencia Mundial Antidopaje (WADA) y la Federación Internacional de Autoridades en Carreras de Caballos (IFHA), revisan y actualizan anualmente las listas de sustancias prohibidas.
- -
La investigación de drogas en el ámbito laboral: su finalidad es detectar la presencia de drogas en los empleados de ciertos sectores laborales (militares, cuerpos policiales, conductores de transportes públicos, entre otros).
No es posible hablar de la TF sin hablar de la toxicología analítica. Esta hace uso de las herramientas que proporciona la química analítica en la estimación cualitativa y cuantitativa de las sustancias de interés toxicológico presentes en los distintos tipos de matrices2.
En sus aspectos más generales, los criterios cualitativos en TF son proporcionados mediante directrices publicadas por los más prestigiosos organismos de ámbito internacional o local en el área, entre los que destacan:
- -
«Laboratory guidelines»3, de la Asociación Internacional de Toxicólogos Forenses (TIAFT).
- -
«Forensic Toxicology Laboratory Guidelines, 2006 version»4 de la Sociedad de Toxicólogos Forenses y la Academia Americana de Ciencias Forenses (SOFT/AAFS)
- -
«Guidelines and Recommendations of the GTFCh»5 de la Sociedad Alemana de Química y Toxicología Forense (GTFCh).
Los criterios cualitativos referentes a la espectrometría de masas (MS), técnica analítica considerada fundamental en TF para la identificación inequívoca de compuestos, están recogidos en varias normativas:
- -
Por un lado, la reglamentación sobre el análisis de residuos en productos de origen animal. En Europa aparece recogida en el Diario Oficial de las Comunidades Europeas «European Union Decision 2002/657/EC»6, en EE. UU. es recogida por la Administración Americana de Alimentos y Medicamentos (FDA) en el documento «Guidance for Industry, Mass Spectrometry for Confirmation of the Identity of Animal Drug Residues, Final Guidance, n° 118»7.
- -
Por otro, la reglamentación analítica para el control del dopaje en las prácticas deportivas elaborado por la WADA en el documento «WADA Technical Document TD2003IDCR, Identification Criteria for Qualitative Assays, Incorporating Chromatography and Mass Spectrometry»8.
Los requisitos generales para la Competencia de los Laboratorios de Ensayo y Calibración que están recogidos en la norma UNE-EN ISO/EC 17025:20059, constituyen la base de la acreditación, y también están presentes en la filosofía de las recomendaciones y normativas anteriormente citadas.
El presente trabajo tiene como objetivo revisar y evaluar las normativas y recomendaciones en relación con los criterios cualitativos en TF. Con ello, se pretende enfatizar la necesidad de su cumplimiento en las prácticas rutinarias de los laboratorios de TF. Además, también se pretende contribuir a la calidad de la pericia y al avance en la unidad de criterio científico, aspectos cruciales en TF para obtener resultados analíticos basados en fundamentos científicos sólidos que sean comparables y legalmente defendibles ante los Tribunales de Justicia. Finalmente, esta revisión y recopilación de criterios pretende servir de referencia a aquellos profesionales que deban evaluar los resultados toxicológicos emitidos por los laboratorios forenses (tabla 1).
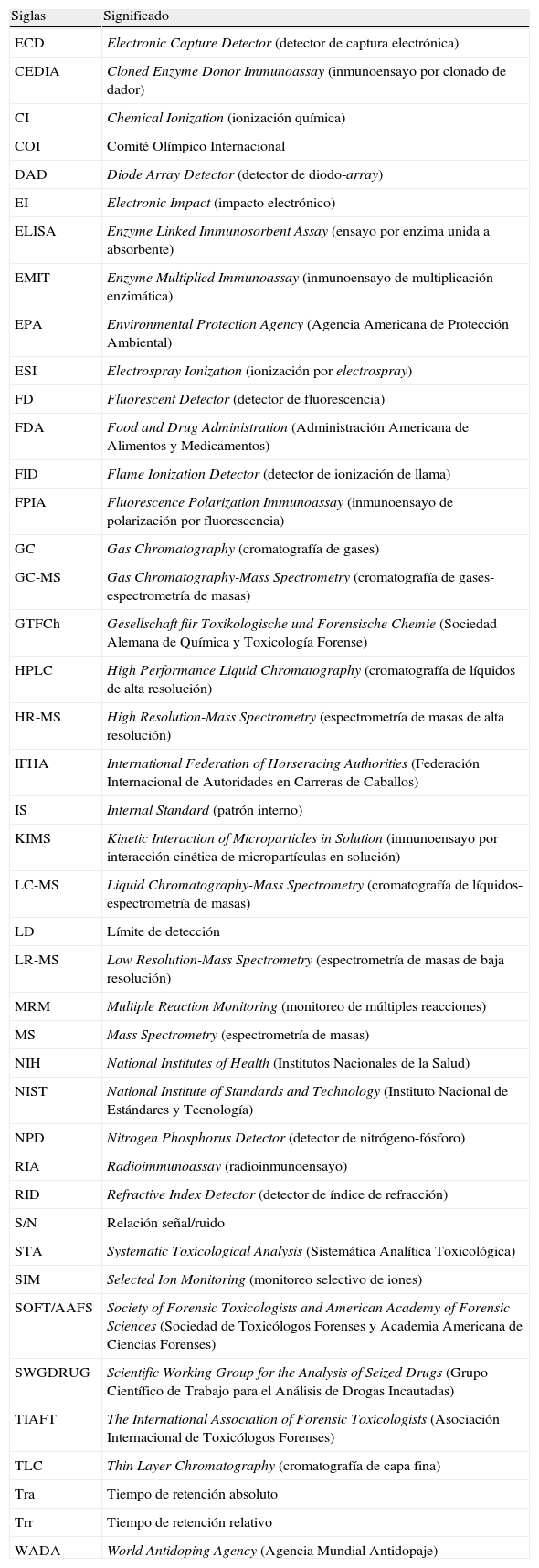
Siglas utilizadas en el texto
| Siglas | Significado |
| ECD | Electronic Capture Detector (detector de captura electrónica) |
| CEDIA | Cloned Enzyme Donor Immunoassay (inmunoensayo por clonado de dador) |
| CI | Chemical Ionization (ionización química) |
| COI | Comité Olímpico Internacional |
| DAD | Diode Array Detector (detector de diodo-array) |
| EI | Electronic Impact (impacto electrónico) |
| ELISA | Enzyme Linked Immunosorbent Assay (ensayo por enzima unida a absorbente) |
| EMIT | Enzyme Multiplied Immunoassay (inmunoensayo de multiplicación enzimática) |
| EPA | Environmental Protection Agency (Agencia Americana de Protección Ambiental) |
| ESI | Electrospray Ionization (ionización por electrospray) |
| FD | Fluorescent Detector (detector de fluorescencia) |
| FDA | Food and Drug Administration (Administración Americana de Alimentos y Medicamentos) |
| FID | Flame Ionization Detector (detector de ionización de llama) |
| FPIA | Fluorescence Polarization Immunoassay (inmunoensayo de polarización por fluorescencia) |
| GC | Gas Chromatography (cromatografía de gases) |
| GC-MS | Gas Chromatography-Mass Spectrometry (cromatografía de gases-espectrometría de masas) |
| GTFCh | Gesellschaft für Toxikologische und Forensische Chemie (Sociedad Alemana de Química y Toxicología Forense) |
| HPLC | High Performance Liquid Chromatography (cromatografía de líquidos de alta resolución) |
| HR-MS | High Resolution-Mass Spectrometry (espectrometría de masas de alta resolución) |
| IFHA | International Federation of Horseracing Authorities (Federación Internacional de Autoridades en Carreras de Caballos) |
| IS | Internal Standard (patrón interno) |
| KIMS | Kinetic Interaction of Microparticles in Solution (inmunoensayo por interacción cinética de micropartículas en solución) |
| LC-MS | Liquid Chromatography-Mass Spectrometry (cromatografía de líquidos-espectrometría de masas) |
| LD | Límite de detección |
| LR-MS | Low Resolution-Mass Spectrometry (espectrometría de masas de baja resolución) |
| MRM | Multiple Reaction Monitoring (monitoreo de múltiples reacciones) |
| MS | Mass Spectrometry (espectrometría de masas) |
| NIH | National Institutes of Health (Institutos Nacionales de la Salud) |
| NIST | National Institute of Standards and Technology (Instituto Nacional de Estándares y Tecnología) |
| NPD | Nitrogen Phosphorus Detector (detector de nitrógeno-fósforo) |
| RIA | Radioimmunoassay (radioinmunoensayo) |
| RID | Refractive Index Detector (detector de índice de refracción) |
| S/N | Relación señal/ruido |
| STA | Systematic Toxicological Analysis (Sistemática Analítica Toxicológica) |
| SIM | Selected Ion Monitoring (monitoreo selectivo de iones) |
| SOFT/AAFS | Society of Forensic Toxicologists and American Academy of Forensic Sciences (Sociedad de Toxicólogos Forenses y Academia Americana de Ciencias Forenses) |
| SWGDRUG | Scientific Working Group for the Analysis of Seized Drugs (Grupo Científico de Trabajo para el Análisis de Drogas Incautadas) |
| TIAFT | The International Association of Forensic Toxicologists (Asociación Internacional de Toxicólogos Forenses) |
| TLC | Thin Layer Chromatography (cromatografía de capa fina) |
| Tra | Tiempo de retención absoluto |
| Trr | Tiempo de retención relativo |
| WADA | World Antidoping Agency (Agencia Mundial Antidopaje) |
Según la TIAFT3, el análisis toxicológico comprende la detección, identificación y cuantificación de sustancias con interés toxicológico y la interpretación de sus resultados.
El análisis toxicológico cualitativo tiene como objetivo determinar mediante una serie de procesos (pretratamiento de muestras, extracción-purificación y análisis instrumental), la presencia o ausencia de sustancias tóxicas en una muestra biológica. En el análisis cualitativo, la primera etapa consiste en la detección de todas las sustancias que tengan interés toxicológico. La segunda etapa es la identificación inequívoca de las sustancias detectadas. Dadas las connotaciones legales y sociales derivadas de los resultados analíticos, cualquier aspecto o procedimiento relacionado debe ser científicamente indiscutible y legalmente defendible. Siempre deben conocerse los parámetros de validación del método, someterse a consideración y documentarse en los informes analíticos con el fin de que los resultados puedan ser interpretados correctamente3.
A continuación se recopilan y evalúan los criterios cualitativos en TF estructurándolos de manera que en primer lugar se exponen los relativos a la detección de tóxicos y, a continuación, los que se refieren a la «identificación inequívoca» de tóxicos.
Criterios de detecciónEstrategias de detecciónEn función del objetivo del análisis cualitativo se establecen las siguientes estrategias de detección3:
- -
Análisis directo: cuando el objeto del análisis cualitativo es la detección de uno o varios tóxicos en concreto, se emplean las técnicas apropiadas para ese tipo de tóxicos.
- -
Análisis indirecto («general unknown», test de screening o de barrido): cuando el objetivo es la detección o exclusión de una amplia gama de sustancias potencialmente tóxicas, pero de ninguna en concreto. Requiere una estrategia analítica más completa y que se conoce como Sistemática Analítica Toxicológica (STA). Su objetivo es la detección e «identificación inequívoca» de todas las sustancias que tengan interés toxicológico. Para ello, se aplican uno o varios procedimientos analíticos, de modo simultáneo o secuencial, basados siempre en principios analíticos diferentes.
En la detección inicial de tóxicos es habitual en los laboratorios forenses la utilización de test de inmunoensayo (como CEDIA, EMIT, KIMS, ELISA, FPIA y RIA, entre otros), de cromatografías de gases (GC) con distintos detectores (de ionización de llama [FID], de nitrógeno-fósforo [NPD] y de captura electrónica [ECD] entre otros) y de cromatografías de líquidos de alta resolución (HPLC) con distintos detectores (como por ejemplo, de diodo-array [DAD], de índice de refracción [RID] y de fluorescencia [FD]). Los resultados de estas técnicas de detección son siempre resultados presuntivos y es absolutamente necesario proceder siempre a su identificación inequívoca (confirmación) mediante técnicas analíticas más específicas, recomendándose la MS.
Criterios para validar métodos de detecciónAntes de implantar un método analítico en la rutina de un laboratorio forense es necesario proceder a su validación9, en este sentido, el trabajo de Peters et al.10 constituye un recopilatorio de pautas excelente y es considerado un referente en los laboratorios forenses.
Respecto a la validación de los procedimientos analíticos cualitativos no se dispone de recomendaciones relativas al alcance de la validación de estos métodos11; no obstante, la mayoría de los autores parecen estar de acuerdo en que, al menos, se deben evaluar la selectividad y el límite de detección (LD), siendo también importante conocer la precisión, el rendimiento y la robustez11–14. Peters et al.10 recomiendan además, que para métodos de cromatografía de líquidos con detector de espectrometría de masas (LC-MS), se estudie también el efecto matriz (disminución o aumento de la señal del ión) especialmente si se emplea la ionización por electrospray (ESI)15–22.
Al respecto de la validación, la TIAFT3 recomienda, como mínimo evaluar en el método el grado de alcance de su detección (bien sea el LD o el punto de corte [cut-off] establecido en función del LD) y la reproducibilidad en torno a él.
Con relación a la validación de los métodos la SOFT/AAFS4 establece:
- -
Deben ser apropiados y validados para cada tipo de muestra. En particular, por ejemplo, los test de inmunoensayo, diseñados inicialmente para ser aplicados en orina deben ser adecuadamente validados si se aplican en sangre.
- -
Si se emplea un cut-off (o punto de corte), la precisión del ensayo debe demostrarse en torno a él.
- -
Las muestras sembradas con las concentraciones establecidas como cut-off deben ser claramente diferenciables de aquellas que no contienen el analito en cuestión.
En el caso de los análisis cualitativos, se deberían analizar rutinariamente con cada tanda materiales de referencia (si esto no fuera posible, al menos analizar controles fabricados en el propio laboratorio, pero de fuentes diferentes a las utilizadas para fabricar los calibradores), que permitan verificar el grado de alcance de su detección (bien sea el LD o el cut-off establecido) y la reproducibilidad en torno a él.
La calidad es necesario entenderla no como una meta, sino como una pauta de trabajo que conducirá al laboratorio a la mejora progresiva de sus resultados analíticos. Uno de los aspectos más importantes consiste en evitar posibles contaminaciones de las muestras, para lo cual se establecen los siguientes criterios4:
- -
Constituye una buena práctica separar los análisis de los fluidos biológicos de otros materiales sospechosos de contener drogas (p. ej., cucharillas, jeringuillas, etc.).
- -
Lo correcto es realizar estos análisis en salas diferentes, y si esto no fuera posible, al menos se utilizará material de vidrio y pipetas diferentes.
- -
En el caso de no poder utilizar equipos de análisis diferentes (p. ej., cromatografía de gases-espectrometría de masas [GC-MS]), debe demostrarse la ausencia de contaminaciones residuales y de arrastres cromatográficos.
Una vez detectada la presencia de uno o más compuestos con relevancia toxicológica, se debe proceder a su «identificación inequívoca»3. Dado que hoy en día es muy habitual hablar también en los laboratorios forenses de «confirmación», este término se puede considerar lícito siempre y cuando la «confirmación» no se trate de una mera comparación de señales, sino que reúna los requisitos de una «identificación inequívoca».
La correcta identificación requiere como regla general utilizar al menos 2 fundamentos analíticos diferentes, para lograr la exclusión de todas las posibles sustancias candidatas, excepto de una, lo que se conoce como «criterio de exclusión». Por ello, se ha de resaltar la importancia de la MS como técnica confirmativa por excelencia. La MS combina la sensibilidad y la especificidad en un grado hasta ahora no alcanzado por otras técnicas analíticas. Por ello, la MS es universalmente reconocida como la técnica más idónea para la «identificación inequívoca» de compuestos. En los laboratorios forenses es frecuente que esté acoplada a cromatógrafos de gases (GC-MS) o de líquidos (LC-MS)23–30.
Los modernos espectrómetros de masas están equipados con sistemas computarizados de comparación de espectros (bases de datos) muy eficaces. Las versiones más modernas de las librerías de MS (para GC-MS) son:
- -
«Wiley 9thedition/NIST 2011 (W9/N11)»31, que contiene 800.000 espectros de compuestos en general.
- -
«NIST 11 EPA/NIH Mass Spectral Database and Search Program (NIST11/NIST08)»32, contiene 243.893 espectros de compuestos en general.
- -
«Mass Spectral and GC Data of Drugs, Poisons, Pesticides, Pollutants and Their Metabolites 2011 (Maurer, Pfleger, Weber) (Sept. 2011)»33 con 8.650 espectros, incluyendo más de 5.200 espectros de metabolitos.
- -
La librería del Scientific Working Group for the Analysis of Seized Drugs (SWGDRUG)34 con 1.459 espectros de drogas y compuestos relacionados.
La TIAFT3 establece con relación a la identificación inequívoca, que se realizará comparando bajo el mismo método analítico las señales de la muestra problema, con las señales de patrones auténticos de referencia y/o con las de compuestos de referencia almacenados en bases de datos. Las bases de datos deben contener:
- -
Las sustancias de interés toxicológico, sus metabolitos y otras sustancias relacionadas (isómeros, en ocasiones enantiómeros), sustancias endógenas, etc.
- -
Los datos de la reproducibilidad interlaboratorios, los cuales deben incluirse en la evaluación de los resultados obtenidos por comparación y en las conclusiones.
Se recomienda, que la señal analítica detectada se compare siempre con las proporcionadas por patrones auténticos de referencia analizados paralelamente con las muestras del caso. La comparación única con datos bibliográficos o con datos obtenidos de bases de datos, no es fiable del todo, ya que estos pueden estar afectados por las condiciones analíticas en las que se hayan obtenido.
Para una señal analítica detectada, solo debe existir una sola posibilidad de concordancia con una sola sustancia candidata de referencia, quedando excluidas las restantes sustancias candidatas de referencia, es lo que se conoce como «criterio de exclusión».
Las recomendaciones de la SOFT/AAFS en relación a la identificación inequívoca son las siguientes4:
- -
La revisión final de la búsqueda en las librerías solo debe realizarla un toxicólogo experto y con juicio crítico en la interpretación de espectros de masas. En la práctica rutinaria, la interpretación de un análisis de MS en el modo de «full scan» (adquisición total) se realiza de manera semiautomática por el software del instrumento mediante librerías. El grado de concordancia de la búsqueda viene acompañado de un factor, donde el 1 o el 100% indicarían concordancias perfectas. Dichos factores únicamente tienen un valor orientativo en el proceso de identificación.
- -
Para que el resultado de la búsqueda se pueda considerar positivo, todos los iones más importantes presentes en el compuesto conocido de referencia deben estar presentes en el compuesto «desconocido». En ocasiones, iones de baja abundancia presentes en el compuesto de referencia pueden estar ausentes en el espectro del compuesto «desconocido». Si en el espectro del compuesto «desconocido» hay además, iones con abundancia relativa importante, se debe investigar si son debidos a una sustancia que haya coeluído o al ruido de fondo originado por el sangrado de la columna o por la difusión del aceite de la bomba.
- -
Los espectros de masas obtenidos mediante GC-MS por ionización química y mediante LC-MS son más sencillos que los obtenidos mediante GC-MS por impacto electrónico, por lo que ofrecen menos posibilidades para la elección de iones cualificadores. Sin embargo, se puede ajustar la energía de ionización (p. ej., el voltaje del cono o del fragmentador de un LC-MS de simple cuadrúpolo) para producir iones adicionales o iones secundarios de más intensidad. Una opción posible (la que se emplea en LC-MS) consiste en realizar el análisis, en condiciones de ionización débil (para maximizar la señal del ión cuantificador) y de ionización fuerte (para aumentar la fragmentación y facilitar la confirmación). En algunas circunstancias, la monitorización de un solo ión del analito puede constituir una opción, siempre que sea un ión muy característico del analito y que este se haya caracterizado por otros métodos.
- -
La utilización de un isótopo o de un aducto de iones como ión cualificador no es válida.
En cuanto a las técnicas, las recomendaciones son las siguientes4:
- -
La utilización de un segundo inmunoensayo (p. ej., radioinmunoensayo [RIA]) para confirmar los resultados obtenidos mediante otro inmunoensayo (p. ej., inmunoensayo de polarización fluorescente [FPIA]) no es aceptable, aunque ambos inmunoensayos estén basados en principios diferentes.
- -
La detección de un analito mediante inmunoensayo, y su posterior confirmación por GC-NPD o GC-FID no proporciona suficiente especificidad en el ámbito forense.
- -
La confirmación utilizando el mismo sistema de detección inicial podría aceptarse si se utiliza la derivatización química (p. ej., sililación o acetilación), ya que se produciría un cambio en los tiempos de retención.
- -
La confirmación utilizando un segundo sistema de GC con una columna similar, aunque no sea idéntica es inaceptable, ya que los índices de retención de muchos analitos no difieren sustancialmente de uno a otro (p. ej., columnas DB-1 y DB-17).
- -
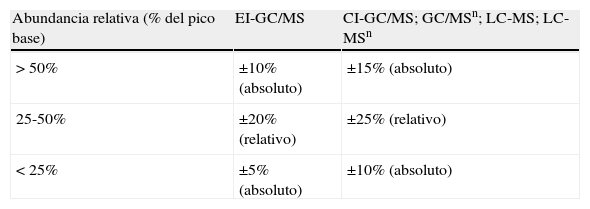
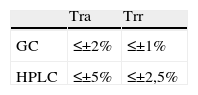
Cuando la MS en el modo SIM se utilice para la identificación de un analito, bien sea como parte de un procedimiento cuantitativo o no, se recomienda el uso de al menos un ión cualificador para el analito y otro para el patrón interno (IS) además, de un principal para cada uno de ellos. Como criterio de aceptación las ratio (cocientes de respuestas) de iones deben estar comprendidas en un±20% de la ratio correspondiente del control o calibrador. Algunas ratios de iones son dependientes de la concentración, por lo que en tales casos y para establecer esta comparación debe utilizarse un control o calibrador de concentración similar, es preferible a utilizar la media de las ratio considerando todos los calibradores. Las ratios de iones en los análisis mediante LC/MS son más dependientes de la concentración y del tiempo que en GC-MS, por ello las ratio de aceptación varían hasta±25% o±30% (tablas 2-6).
Tabla 2.Rangos de tolerancias máximas permitidas en las intensidades relativas de iones* para asegurar la identificación mediante MS (SIM y MRM) en condiciones óptimas de incertidumbre
Abundancia relativa (% del pico base) EI-GC/MS CI-GC/MS; GC/MSn; LC-MS; LC-MSn > 50% ±10% (absoluto) ±15% (absoluto) 25-50% ±20% (relativo) ±25% (relativo) < 25% ±5% (absoluto) ±10% (absoluto) n representa el número de cuadrupolos en tandem del equipo de MS y es un número entero mayor o igual a 2.
Fuente: tomado de referencias6,8.
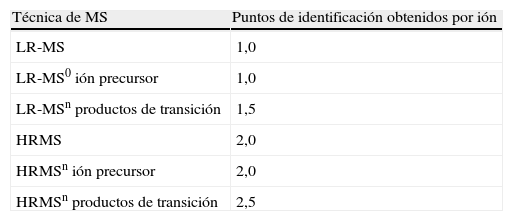
Tabla 3.Requerimientos generales para la identificación inequívoca mediante MS
Requerimientos generales - Para todos los iones cualificadores S/N*≥3:1 - Preferiblemente iones moleculares y fragmentos, alternativamente aductos - Iones cualificadores diferentes para los diferentes derivados Requerimientos para «Full Scan» - Al menos 4 iones cualificadores con abundancias relativas ≥10% - El ión molecular ⇒ presente si su abundancia relativa es ≥10% (no MS-MS) Requerimientos para «SIM» - Al menos 3 iones cualificadores, representativos de toda la molécula - Monitorizar preferentemente el ión molecular - Los iones de isótopos son solamente aceptables en los elementos «A+2» - Los iones resultado de pérdida de agua o sus derivados NO son aceptables - Monitorizar 2 iones solo es aceptable en casos excepcionales Requerimientos para «MRM» - Al menos 2 transiciones - Los iones precursores idénticos son aceptables si las transiciones que se monitorizan son suficientemente diferentes Tabla 4.Relación entre un rango de clases de fragmentos de masas y puntos de identificación obtenidos
Técnica de MS Puntos de identificación obtenidos por ión LR-MS 1,0 LR-MS0 ión precursor 1,0 LR-MSn productos de transición 1,5 HRMS 2,0 HRMSn ión precursor 2,0 HRMSn productos de transición 2,5 n representa el número de cuadrupolos en tandem del equipo de MS y es un número entero mayor o igual a 2.
Notas:
1. Cada ión solo se contabiliza una vez.
2. GC-MS con EI se considera diferente a GC-MS con CI.
3. Diferentes analitos pueden utilizarse para incrementar el número de puntos de identificación si los derivados se obtienen por distintas reacciones químicas.
4. Para las sustancias del grupo A del Anexo 1 de la Directiva 96/23/EC cuando una de las siguientes técnicas se haya utilizado en los análisis: HPLC acoplada con DAD, FD, o inmunograma; TLC bi-dimensional acoplada con MS; un máximo de un punto de identificación proporciona el cumplimiento de los criterios relevantes de estas técnicas.
Fuente: tomado de referencias6.
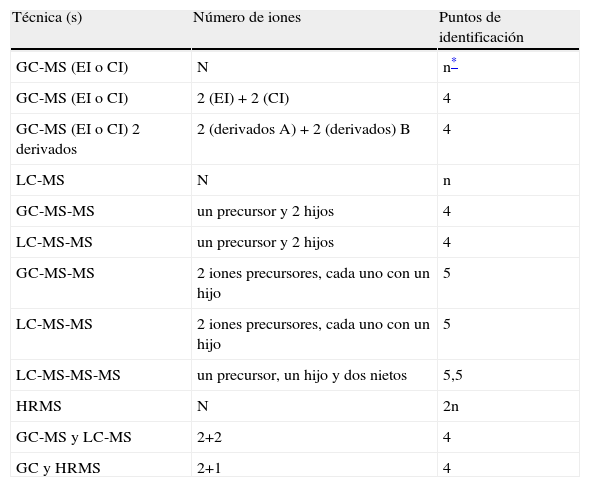
Tabla 5.Ejemplos de números de puntos de identificación obtenidos para un rango de técnicas de MS y sus combinaciones
Técnica (s) Número de iones Puntos de identificación GC-MS (EI o CI) N n* GC-MS (EI o CI) 2 (EI)+2 (CI) 4 GC-MS (EI o CI) 2 derivados 2 (derivados A)+2 (derivados) B 4 LC-MS N n GC-MS-MS un precursor y 2 hijos 4 LC-MS-MS un precursor y 2 hijos 4 GC-MS-MS 2 iones precursores, cada uno con un hijo 5 LC-MS-MS 2 iones precursores, cada uno con un hijo 5 LC-MS-MS-MS un precursor, un hijo y dos nietos 5,5 HRMS N 2n GC-MS y LC-MS 2+2 4 GC y HRMS 2+1 4
Con relación al etanol (alcohol etílico), aunque los falsos positivos desde el punto de vista meramente analítico son improbables, en principio se recomienda usar un segundo sistema analítico con fines confirmativos4,35. Una solución alternativa consiste en utilizar una segunda columna cromatográfica, de manera que tenga lugar un cambio en el tiempo de retención y en el orden de elución de los volátiles más usuales (p. ej., etanol, isopropanol, acetona). El segundo análisis debe realizarse sobre una nueva alícuota tomada de la muestra, o sobre otra muestra del mismo caso4.
Se desaconseja la utilización de métodos enzimáticos para acometer estos análisis en el ámbito forense, dados los falsos positivos que pueden obtenerse y la falta de precisión y exactitud de esta técnica presuntiva. Se recomienda la utilización de la muestra de humor vítreo en toxicología forense post mortem, para confirmar la presencia de alcohol etílico en la muestra de sangre, ya que permite dilucidar si el alcohol etílico detectado en la muestra de sangre procede de ingesta ante mortem, o por el contrario, es debido a los procesos de putrefacción post mortem o a contaminación. Descartar la contaminación de la muestra de sangre se considera imprescindible, especialmente cuando esta procede de cavidades centrales y la víctima ha fallecido como consecuencia de un gran traumatismo, como en muertes por precipitación o por accidente de tráfico.
En la práctica, la extensión y naturaleza de los métodos usados para confirmar la presencia de un analito en particular dependerá del caso y de su naturaleza. Por ejemplo, en un caso de suicidio bien documentado, donde una nota de despedida aparece junto a un envase vacío de digoxina prescrito a esa persona, un método validado por RIA puede ser suficiente. Sin embargo, un caso de muerte relacionado con digoxina sin sospechas de suicidio y sin indicios de prescripción, puede requerir una investigación más extensa y completa que incluya LC-MS4. Por tanto, con relación al analito, es el toxicólogo forense el responsable último, que decide en base a su criterio como experto si se cumplen los requisitos mínimos de identificación14,18.
ConclusionesEn definitiva, el cumplimiento de los criterios cualitativos, basados en normativas y recomendaciones vigentes, es fundamental para poder obtener resultados toxicológicos científicamente sólidos, y por tanto, indiscutibles y legalmente defendibles ante los Tribunales de Justicia. La calidad de la pericia y el avance en la unidad de criterio científico, aspectos fundamentales en TF, se sustentan en su cumplimiento. La correcta detección e identificación de tóxicos requiere la aplicación de metodologías analíticas de detección validadas basadas en los criterios establecidos. La MS constituye un instrumento analítico clave para la identificación de tóxicos. Los profesionales que deban evaluar los resultados toxicológicos emitidos por los laboratorios forenses deben estar familiarizados con los criterios existentes.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.