Las bronquiectasias son una causa frecuente de ingreso en ancianos. Aunque algunas guías recomiendan el uso de antibiótico inhalado a largo plazo en bronquiectasias sin fibrosis quística falta evidencia que avale el uso de estos tratamientos en esta población. El objetivo de nuestro trabajo es evaluar la efectividad y tolerancia del tratamiento inhalado con colistina a largo plazo en pacientes ancianos con bronquiectasias sin fibrosis quística e infección crónica por P aeruginosa para reducir las exacerbaciones graves que precisan ingreso.
Material y métodosEstudio cuasi experimental, prospectivo, controlado, abierto. Incluimos pacientes con bronquiectasias diagnosticadas por TAC y persistencia de Pseudomonas aeruginosa en esputo después de tratamiento apropiado. Todos los pacientes recibieron educación y fisioterapia respiratoria. El grupo de intervención recibió además colistina inhalada 1millón UI dos veces al día. Se recogieron datos demográficos, características clínicas y funcionales, ingresos y visitas a urgencias en el año previo. Los pacientes fueron seguidos durante un año recogiendo cada 2 meses cultivo de esputo, datos clínicos funcionales, y uso de recursos sanitarios.
ResultadosSe incluyeron 39 pacientes, 20 en el grupo con colistina y 19 en el grupo de tratamiento convencional. No hubo diferencias significativas entre los 2 grupos en las características basales. La edad media fue de 77,7+/-5, y el FEV1 41%. Cinco pacientes (25%) interrumpieron el tratamiento por efectos secundarios. Pseudomonas aeruginosa desapareció del esputo en 9 pacientes del grupo de tratamiento (45%) y solo en uno del grupo control, con significación estadística, sin embargo, al final del año de estudio no hubo diferencias en el número de ingresos (grupo control 1,6+/-1,7 and 2,7+/-3 grupo con colistina) ni en días ingresados (19+/-31 and 23+/-20). Tampoco se detectaron diferencias entre los dos grupos en resultados funcionales o síntomas clínicos. No hubo cambios en la flora ni en la sensibilidad antibiótica.
ConclusionesEl tratamiento inhalado con colistina a largo plazo en pacientes ancianos colonizados por Pseudomonas hizo que disminuyera la presencia de Pseudomonas aeruginosa en esputo, pero esto no se tradujo en una disminución en el uso de recursos sanitarios, ni en mejoría clínica o funcional. Los efectos secundarios fueron frecuentes. Son necesarios más estudios para identificar subgrupos de pacientes que se beneficien de estos tratamientos a largo plazo.
Bronchiectasis is a frequent cause of admission for elderly patients and chronic respiratory diseases. Although some guidelines recommend long-term treatment with inhaled antibiotics in non-cystic fibrosis bronchiectasis with chronic Pseudomonas aeruginosa (P. aeruginosa) infection, there is limited evidence supporting these prolonged antibiotic treatments in this population. The aim of this study was to assess the effectiveness of inhaled colistin in elderly patients with bronchiectasis and chronic bronchial P. aeruginosa infection in reducing hospital readmissions.
Material and methodsA prospective, controlled and open label study was conducted on patients with bronchiectasis diagnosed by computed tomography and persistence of P. aeruginosa in sputum after appropriate antimicrobial therapy. All patients received education, and physiotherapy training. The intervention group also received nebulized colistin 1million IU twice a day for one year. Data were collected on the demographics, clinical and functional characteristics, admissions in previous year, and sputum microbiology. Patients were followed up every two months for one year, with readmissions, microbiological results, functional tests, and deaths being evaluated.
ResultsThe study included 39 patients, of whom 20 received nebulized colistin and 19 conventional therapy. There were no differences between the two groups in baseline clinical and functional characteristics or previous hospital stay. The mean age was 77.7+/-5, Charlson index 2.85, and FEV1% 41.3+/-15. Five patients (25%) stopped the nebulized treatment because of adverse effects. P. aeruginosa was eradicated in 45% of the colistin treated patients, and in only one of the control group (statistically significant), but at the end of the study year, there were no differences in the number of hospital admissions (control group 1.6+/-1.7 and 2.7+/-3 colistin group), or days of stay (19+/-31 and 23+/-20). There were no differences in lung function or clinical symptoms between the two groups No significant changes were observed in P. aeruginosa A antibiotic sensitivity or in sputum flora.
ConclusionsMore patients in the treatment group achieved Pseudomonas eradication, but benefits in clinical symptoms, lung function or use of healthcare resources in our elderly patients, could not be demonstrated. Adverse effects were common. Further studies are needed in order to identify factors associated with response, or subgroups of patients with bronchiectasis and chronic infection with P. aeruginosa, who benefit from (expensive) long term treatments with inhaled antibiotics.
Las bronquiectasias se definen como dilataciones anormales y permanentes de las vías aéreas subsegmentarias de diferente etiología, asociadas a inflamación crónica e infecciones respiratorias frecuentes. Son el estadio final de múltiples enfermedades (hasta en el 50% de los casos quedan catalogadas como idiopáticas) y suponen una patología irreversible y progresiva, con un impacto sanitario importante con ingresos frecuentes y tratamientos antibióticos intravenosos prolongados.
La prevalencia de las bronquiectasias no está del todo establecida, entre 16 y 53 afectados por 100.000 adultos, lo que sí está claro es que aumentan con la edad (hasta 272/100.000 en mayores de 75 años) con un máximo a los 80-84 años1,2,3. Datos de análisis de bases de datos poblacionales en USA detectan un aumento anual de bronquiectasias como causa de ingreso hasta de un 8%4, probablemente a causa del envejecimiento de la población y la alta prevalencia de patologías respiratorias crónicas evolucionadas. En recientes estudios en pacientes con EPOC severo se han descrito hasta en el 50%5,6.
Las bronquiectasias se asocian a infecciones de repetición y entre ellas Pseudomonas aeruginosa (P. aeruginosa) es el patógeno de más importancia, asociándose la colonización por este germen a un estado de inflamación crónica con aumento de la respuesta local y sistémica y con daño pulmonar. Se ha relacionado además la infección por Pseudomonas con peor pronóstico y un aumento de mortalidad (OR 3,61)7. Parece por tanto que el controlar la infección por este germen debe desempeñar un papel importante en el manejo de la enfermedad.
Por ello, se ha propuesto el uso de antibióticos inhalados a largo plazo basándose en la idea de poder alcanzar altas concentraciones de antibiótico en la vía aérea y reducir los efectos sistémicos8–18. Esta estrategia se ha demostrado muy eficaz en la fibrosis quística (FQ) con estudios aleatorizados amplios y por extrapolación de estos resultados se ha extendido su uso a las bronquiectasias no FQ, de hecho según una auditoría realizada en Reino Unido hasta un 10% de pacientes con BQ no FQ recibe antibiótico inhalado19.
Existen varias normativas (SEPAR y BTS) para el manejo de bronquiectasias no FQ, que incluyen el tratamiento con antibióticos inhalados, colistina y tobramicina inhalada en el tratamiento a largo plazo de la infección-colonización crónica por Pseudomonas, sin embargo falta evidencia que avale su uso en bronquiectasias de etilogía distinta a la FQ20,21. Por el momento sigue siendo un tratamiento de uso compasivo fuera de indicación de ficha técnica. Se trata de un tratamiento no exento de efectos secundarios, de elevado coste y muy prolongado.
Los escasos estudios existentes apenas han incluido población anciana que es donde la prevalencia de bronquiectasias es mayor.
Por ello nos planteamos evaluar la efectividad y tolerancia del tratamiento inhalado con colistina a largo plazo (un año) en pacientes ancianos con bronquiectasias no FQ y colonización-infección crónica por Pseudomonas para reducir las exacerbaciones graves que precisan ingreso.
Objetivos secundarios de este estudio fueron valorar la utilidad de la colistina inhalada para erradicación en esputo de P. aeruginosa, definida como 2 cultivos negativos separados al menos un mes, efectos sobre la función pulmonar y efectos adversos.
Material y métodosEstudio cuasi experimental, prospectivo, controlado, abierto, realizado entre 2008 y 2012 en nuestro centro, un hospital de subagudos o de crónicos de 185 camas, que atiende a pacientes con patología respiratoria avanzada en sus agudizaciones y recibe pacientes de toda Vizcaya.
SujetosSe incluyeron pacientes mayores de 65 años con bronquiectasias diagnosticadas por TACAR, en los que tras un ingreso y tratamiento correcto con dos antibióticos intravenosos durante 15 días según antibiograma se continuó aislando P. aeruginosa en cultivo con el paciente estable al menos un mes tras el fin de tratamiento antibiótico. Se excluyeron pacientes con demencia, o enfermedad terminal asociada. Todos los pacientes firmaron consentimiento informado.
IntervenciónGrupo control: además de optimización del tratamiento, recibió un plan integral que incluyó educación estandarizada y plan de ejercicios con fisioterapia respiratoria. Grupo intervención: además de lo anterior recibió colistina inhalada 1.000.000UI diluida en 3cc de agua destilada administrada con compresor de alto flujo CR60+venstream, tras 30min de aerosol salbutamol+atrovent, o colistina (Promixin R) comercial con I-neb dos veces al día, según la capacidad del paciente y su cuidador.
La primera dosis se administró en consulta o en la unidad de día para verificar tolerancia y adiestrar al paciente. La medicación se recogía mensualmente en el servicio de farmacia con entrega de envases vacíos. Todos los pacientes recibían además dentro del tratamiento estándar azitromicina a dosis baja. La duración del estudio fue de 52 semanas.
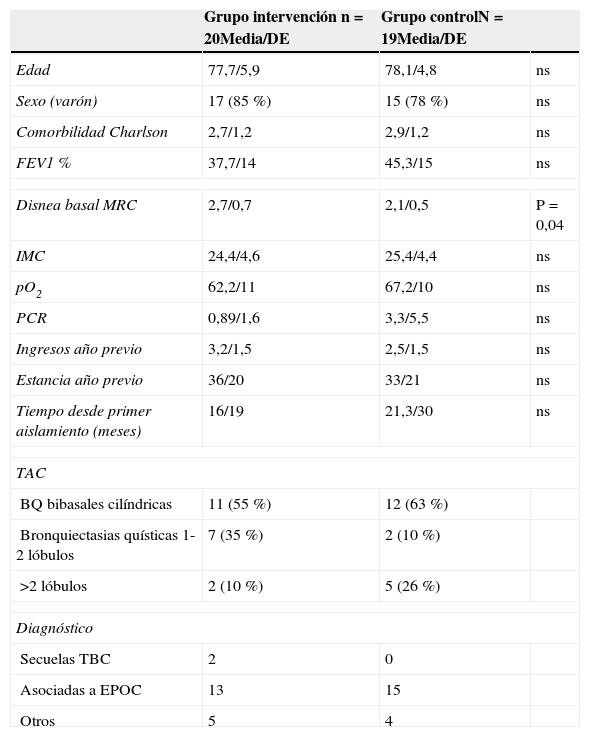
Las variables recogidas basalmente fueron datos demográficos, uso de recursos sanitarios en año previo: visitas a urgencias, número de ingresos y días ingresado, disnea basal medida por la escala MRC, espirometría posbroncodilatación, gasometría basal. Se recogieron variables de laboratorio, hemograma y función renal, incluyendo como marcador de inflamación PCR. Se realizó cultivo de esputo con antibiograma (se recogió fecha del primer aislamiento de Pseudomonas). Los datos basales se muestran en la tabla 1.
Caracteristicas basales de los pacientes al inicio del estudio
| Grupo intervención n=20Media/DE | Grupo controlN=19Media/DE | ||
|---|---|---|---|
| Edad | 77,7/5,9 | 78,1/4,8 | ns |
| Sexo (varón) | 17 (85%) | 15 (78%) | ns |
| Comorbilidad Charlson | 2,7/1,2 | 2,9/1,2 | ns |
| FEV1% | 37,7/14 | 45,3/15 | ns |
| Disnea basal MRC | 2,7/0,7 | 2,1/0,5 | P=0,04 |
| IMC | 24,4/4,6 | 25,4/4,4 | ns |
| pO2 | 62,2/11 | 67,2/10 | ns |
| PCR | 0,89/1,6 | 3,3/5,5 | ns |
| Ingresos año previo | 3,2/1,5 | 2,5/1,5 | ns |
| Estancia año previo | 36/20 | 33/21 | ns |
| Tiempo desde primer aislamiento (meses) | 16/19 | 21,3/30 | ns |
| TAC | |||
| BQ bibasales cilíndricas | 11 (55%) | 12 (63%) | |
| Bronquiectasias quísticas 1-2 lóbulos | 7 (35%) | 2 (10%) | |
| >2 lóbulos | 2 (10%) | 5 (26%) | |
| Diagnóstico | |||
| Secuelas TBC | 2 | 0 | |
| Asociadas a EPOC | 13 | 15 | |
| Otros | 5 | 4 | |
Los pacientes fueron seguidos en consulta externa cada 2 meses durante un año con controles clínicos, monitorización de efectos secundarios, cultivo de esputo, espirometría y marcadores de inflamación cada visita. La variable principal del estudio fue el número de ingresos al cabo de un año. Se recogieron también días totales de estancia, visitas a URG y éxitus.
Calculamos el tamaño muestral en función de la desviación estándar de 1,1 para la variable principal basándonos en estudios previos con colistina para un 80% de potencia para detectar diferencias de un ingreso, con un error alfa de 0,05 lo que hace necesarios 19 pacientes en cada grupo12.
Análisis estadísticoTodos los análisis especificados se realizaron en base a la intención de tratar. Se utilizó el programa SPSS v.19 para el análisis. Se realizó análisis descriptivo para resumir las características de la población en ambos grupos, utilizando medias y desviación estándar (DE) en las variables continuas y porcentajes en las cualitativas. Para la comparación de la variable principal y las distintas características cuantitativas entre dos grupos se utilizó la t de Student o la U de Mann-Whitney y la prueba de la Chi cuadrado o el test exacto de Fisher para variables cualitativas. Se consideró significativo un valor de p<0,05.
ResultadosSe evaluaron 30 pacientes en el grupo de intervención incluyéndose finalmente 20 pacientes. La causa más frecuente de no inclusión fue la desaparición de Pseudomonas en esputo o la incapacidad para desplazarse a consultas cada 2 meses. Un paciente no toleró la primera dosis de colistina en consultas. Se incluyeron 25 pacientes en el grupo control, uno no aceptó y 4 fueron excluidos también por desaparición de Pseudomonas en el momento de la inclusión. Un paciente del grupo control se perdió en el seguimiento tras la visita inicial.
No hubo diferencias en las características basales entre ambos grupos salvo la disnea que fue significativamente mayor en el grupo intervención.
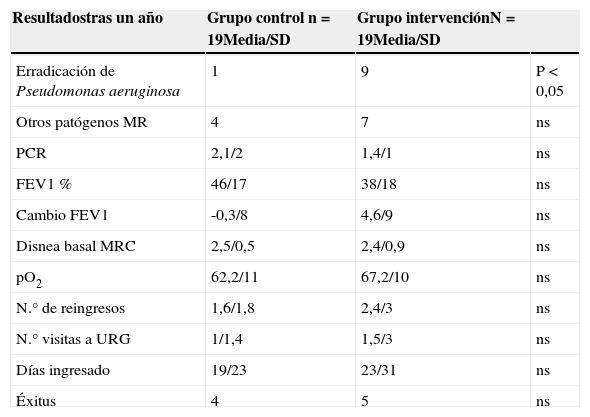
Los resultados de las principales variables tras un año de tratamiento se muestran en la tabla 2.
Resultados tras un año de seguimiento
| Resultadostras un año | Grupo control n=19Media/SD | Grupo intervenciónN=19Media/SD | |
|---|---|---|---|
| Erradicación de Pseudomonas aeruginosa | 1 | 9 | P<0,05 |
| Otros patógenos MR | 4 | 7 | ns |
| PCR | 2,1/2 | 1,4/1 | ns |
| FEV1% | 46/17 | 38/18 | ns |
| Cambio FEV1 | -0,3/8 | 4,6/9 | ns |
| Disnea basal MRC | 2,5/0,5 | 2,4/0,9 | ns |
| pO2 | 62,2/11 | 67,2/10 | ns |
| N.° de reingresos | 1,6/1,8 | 2,4/3 | ns |
| N.° visitas a URG | 1/1,4 | 1,5/3 | ns |
| Días ingresado | 19/23 | 23/31 | ns |
| Éxitus | 4 | 5 | ns |
De los pacientes incluidos en el grupo de tratamiento con colistina inhalada 5 (25%) abandonaron el tratamiento por efectos secundarios 4 por broncoespasmo y uno por molestias inespecíficas y calambres. La media de tiempo hasta abandono del tratamiento fue de 2 meses.
Efectividad del tratamientoUso de recursos sanitarios: El uso de colistina inhalada no supuso diferencias en el número de reingresos, visitas a urgencias o días ingresados con respecto a los que no lo recibieron, de hecho fue mayor que en el grupo control aunque no estadísticamente significativo.
Resultados microbiológicosEn un 45% de los pacientes en tratamiento inhalado se consiguió la erradicación de la P. aeruginosa frente a un caso en el grupo control. Sin embargo esto no supuso una menor tasa de ingresos. En el subgrupo de pacientes en que se consiguió la erradicación sí se detectó una menor tendencia a ingresar aunque no fue significativa por el escaso numero de pacientes (1,9 +/-2,3 en el grupo en que se erradicó vs 2,3+/-3 en el grupo en que persistió). No se registró ningún caso de aparición de resistencia a colistina. Aunque se detectó la aparición en algunos casos de otros patógenos estos hallazgos no fueron significativos.
Sorprendentemente no se detectó relación entre el tiempo desde el primer aislamiento (duración de la colonización) y la erradicación o no de P. aeruginosa.
Resultados funcionalesNo se detectaron diferencias significativas ni en FEV1 o pO2 basal, ni en parámetros clínicos como disnea MRC o en marcadores de inflamación como PCR.
DiscusiónNuestros resultados con tratamiento inhalado con colistina a largo plazo en pacientes ancianos con patología respiratoria evolucionada discrepan en parte con lo publicado hasta ahora respecto a la variable principal del estudio, el número de ingresos y días de hospitalización, si bien la mayoría de los estudios previos con colistina son pequeños o retrospectivos. Así Dahr encuentra disminución en el número de ingresos respecto al periodo pretratamiento (3 vs 0,99)11. Otro trabajo también retrospectivo con colistina inhalada en combinación con tratamiento iv encuentra menos exacerbaciones en el grupo tratado con colistina, y una tendencia a la disminución de ingresos, aunque no significativa, ni siquiera en subgrupo de pacientes en los que consigue la erradicación de P. aeruginosa17.
Un estudio recientemente publicado, multicéntrico y randomizado con colistina inhalada vía I-neb, con 70 pacientes en cada grupo(edad media 54 años), encuentra mejoría en calidad de vida y en resultados microbiológicos, pero para la variable principal de estudio tiempo hasta la primera exacerbación, no encuentra diferencias significativas en el grupo total, cuando reanalizan los datos para los pacientes con cumplimiento mayor del 80% de las dosis sí observan mejoría significativa en el tiempo hasta la primera exacerbación22.
Existen otros trabajos controlados y prospectivos, algunos muy recientemente publicados, con antibióticos diferentes de colistina en bronquiectasias no FQ, que encuentran una disminución del número de exacerbaciones y el tiempo hasta la primera exacerbación11,13–16. Todos estos estudios están realizados en pacientes significativamente más jóvenes.
Por el contrario, en la misma línea que nuestros resultados, un estudio reciente con aztreonam inhalado pese a buenos datos previos en fibrosis quística, no logra mejoría en tiempo hasta la primera exacerbación o calidad de vida en pacientes con bronquiectasias no FQ23. Tampoco la revisión Cochrane de uso de antibiótico prolongado para bronquiectasias no FQ encuentra diferencias entre antibiótico y placebo en probabilidad de padecer una exacerbación24.
La guía británica de manejo de bronquiectasias recomienda el tratamiento con antibiótico inhalado solo en los pacientes con tres o más exacerbaciones al año y en aquellos muy sintomáticos19, sin embargo en nuestros datos, si analizamos solo los paciente que ingresaron > de 2 veces en año previo, tampoco obtenemos diferencias significativas entre los 2 grupos (2,3 ingresos en el grupo control vs 2,6 ingresos en el grupo de intervención, y tampoco en días ingresados, 28 grupo control vs 25 grupo tratado con colistina).
La mayoría de los pacientes de nuestro estudio (71%) tienen EPOC muy evolucionada con bronquiectasias cilíndricas bibasales, y quizá en estos pacientes la falta de resultados esté condicionada por concurrencia de otra enfermedad como la EPOC también inflamatoria y progresiva.
Por otra parte se trata de pacientes ancianos en los que es posible que la inmunosenescencia y el propio envejecimiento pulmonar jueguen un importante papel en la no mejoría clínica.
En relación a los resultados microbiológicos son muchos los estudios que obtienen datos similares a los nuestros y avalan la eficacia de la colistina inhalada para erradicar en esputo la P. aeruginosa8,17, sin embargo estos estudios no fueron diseñados para valorar resultados clínicos, en ellos se alcanzan tasas de erradicación que oscilan entre 22 y el 80%. Al igual que en estos estudios no observamos alteraciones significativas en flora de esputo ni aparición de resistencias. Sin embargo esto no se traduce en mejoría en el uso de recursos sanitarios, cuando analizamos el subgrupo de pacientes en los que se obtiene erradicación de la P. aeruginosa en esputo tampoco obtenemos resultados estadísticamente significativos respecto a número de ingresos o días ingresados.
Igual que en nuestros datos prácticamente en ningún estudio se obtiene cambios en la función pulmonar salvo en un único estudio hecho en pacientes con EPOC (18 pacientes) que obtiene mejoría en función pulmonar y calidad de vida10.
La tasa alta de efectos adversos, un 25% en nuestro caso, fundamentalmente broncoespasmo y opresión torácica, ya había sido descrita previamente, con tasas de abandono en algunos casos similares a las nuestras (24% en estudio de Scheinberg, donde hasta un 95% presentó algún efecto adverso, o un 10% de abandonos en el trabajo de Drobnic), que probablemente esté relacionada con la severidad de la obstrucción de nuestros pacientes.
Nuestro estudio presenta varias limitaciones, no es randomizado, aunque los dos grupos tienen características basales similares, y tiene un tamaño muestral modesto. Por otro lado no hemos recogido datos de calidad de vida (en el protocolo inicial se incluyó el cuestionario de Saint George pero fue muy difícil de cumplimentar por parte de los pacientes y se decidió retirar en un análisis intermedio).
Recientemente han aparecido dos propuesta de estratificación según la gravedad de las bronquiectasias25,26, que incluye una valoración multidimensional para predecir mortalidad, es posible que si hubiéramos clasificado a los pacientes por gravedad y analizado por grupos hubiéramos encontrado resultados diferentes en algunos de los subgrupos.
En conclusión, el tratamiento antibiótico con colistina a largo plazo en pacientes ancianos colonizados por Pseudomonas hizo que disminuyera la presencia de P. aeruginosa en esputo pero esto no se tradujo en una disminución en el uso de recursos sanitarios. No hemos conseguido demostrar beneficios respecto a reingresos ni visitas a urgencias con el uso de colistina inhalada a largo plazo en pacientes ancianos con BQ colonizados por P. aeruginosa. La tasa de rechazo y abandono por efectos secundarios de estos tratamientos es alta en esta población.
Probablemente no todos los pacientes se beneficien de terapia inhalada con antibiótico a largo plazo, y son necesarios más estudios para identificar y caracterizar mejor a los pacientes que se pueden beneficiar de este tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.