PROCESO DE ENVEJECIMIENTO
El envejecimiento expresa con el paso del tiempo un deterioro progresivo en las células y organismos diferenciados, en el que se fundamenta una creciente vulnerabilidad ante sobrecargas externas y la disminución de la capacidad de supervivencia1. El deterioro puede ser una consecuencia directa de los procesos de envejecimiento o una reacción secundaria. El daño oxidativo y su reparación incompleta pueden ser causas coadyuvantes fundamentales que subyacen en la senescencia asociada a una progresiva acumulación de alteraciones nocivas macromoleculares y de membrana2,3. Se postula que hasta un 1-2% del oxígeno utilizado puede generar radicales de oxígeno, producidos de forma endógena por mitocondrias y peroxisomas (véanse, por ejemplo, Barja4 y Sohal5). La acumulación de lesiones en células y tejidos se debe a que la reparación, a nivel molecular (reparación de ADN, o proteólisis, sustitución de ácidos grasos fosfolipídicos), subcelular (autofagia) y a nivel celular, y de tejidos (apoptosis), no es lo suficientemente efectiva y desciende al aumentar la edad. El declive en la reparación celular puede explicar muchas alteraciones relacionadas con la edad, que incluyen el aumento de alteraciones en el ADN6 y proteínas7, los cambios en la composición fosfolipídica8, la acumulación de mitocondrias9 y peroxisomas dañadas10 así como de lípidos de membrana, como el dolicol11. Todo ello conduce al progresivo aumento de células dañadas en los tejidos12. Éstas son las causas fundamentales de la acumulación de alteraciones nocivas en macromoléculas y membranas, así como del declive funcional de órganos y sistemas a medida que avanza la edad13.
EFECTOS DE LA RESTRICCIÓN CALÓRICA
Está documentado que la restricción calórica (RC) reduce el crecimiento y el tamaño corporal, y que tiene un efecto positivo sobre el ciclo vital medio y máximo de roedores y diversas especies de invertebrados (protozoos, moscas, pulgas de agua, nematodos, rotíferos y arañas) y vertebrados (peces, hamsters, perros)14. Investigaciones realizadas a lo largo de más de 60 años han demostrado que la RC es la única intervención nutricional que contrarresta de forma coherente los cambios asociados a la edad en la función de los tejidos15. Se están llevando a cabo estudios longitudinales sobre los efectos de la RC en primates no humanos. Aunque ninguno de ellos lleva en marcha el tiempo suficiente para arrojar resultados sobre la influencia de la RC en la longevidad de estos animales; no obstante, datos preliminares sugieren que la RC tendría efectos beneficiosos en la morbilidad y mortalidad16. La RC es también efectiva en la prevención del cáncer17 y retrasa la edad de aparición y/o el índice de progresión de la mayoría de enfermedades asociadas a la edad1,14. Los efectos de la RC dependen tanto de la duración en su la aplicación como de la edad de comienzo. En roedores, el tratamiento es más efectivo cuando se inicia en animales jóvenes. Resulta sorprendente que respecto al aumento en un 10% de supervivencia en ratas, la RC de comienzo a los 6 meses de edad es casi tan efectiva como la RC aplicada a partir de las 6 semanas de edad18. La RC se puede iniciar en ratones de mediana edad logrando todavía un importante efecto en la prolongación de la vida19, pero algunos estudios en ratas han demostrado que la RC no aumenta la longevidad cuando se inicia a edades más avanzadas20. En cuanto al grado de restricción, el máximo beneficio se da con una RC del 40% o con la ingesta en días alternos. No obstante, se obtiene una significativa, aunque menor, prolongación del período vital con una RC del 10% o un día de ayuno por semana21,22. Para entender el mecanismo es fundamental recordar que todos los procedimientos de restricción calórica implican un patrón de ingesta de comida seguido de muchas horas de ayuno, y que este modo de alimentación tiene un efecto notable sobre la regulación de la macroautofagia23, que es un mecanismo esencial de reparación celular. Las formas de las curvas de supervivencia18 indican que la RC prolonga tanto el promedio de la duración de la vida como la supervivencia máxima. La extensión del promedio del período vital no significa necesariamente que los procesos de envejecimiento se hayan ralentizado, ya que la prevención de muerte prematura incrementaría este valor, incluso sin involucrar a los procesos de envejecimiento. Por el contrario, en relación con la extensión de la supervivencia máxima, la RC muestra un efecto claro y reproducible, y está íntimamente ligado al mecanismo básico y universal del envejecimiento.
MECANISMO DE LOS EFECTOS DE LA RESTRICCIÓN CALÓRICA: LAS 4 HIPÓTESIS DE MASORO
La RC tiene importantes efectos beneficiosos sobre la mayoría de los cambios asociados a la edad que ocurren en las células y tejidos, y es comúnmente aceptado que ralentiza los procesos de envejecimiento ya que retarda el deterioro asociado a la edad de muchos procesos fisiológicos, e incrementa así la capacidad de un organismo para sobrevivir como adulto a medida que aumenta la edad cronológica14. La RC afecta notablemente al peso y temperatura corporales, así como al metabolismo de la glucosa, lípidos y aminoácidos, que influyen en muchas funciones endocrinas (incluyendo la secreción de insulina, glucagón y glucocorticoides)24, y contrarresta alteraciones asociadas a la edad en la señalización celular14,25-27. La RC previene muchos cambios asociados a la edad a nivel molecular, subcelular, celular y de tejidos, incluyendo la acumulación de 8-OH-dG en ADN6 y de carbonil en proteínas28,29, la alteración asociada a la edad en la composición de lípidos de las citomembranas8,30, y parte de la acumulación asociada a la edad de residuos de glucosilación avanzada en el colágeno de piel y aorta31. En una escala temporal de mayor duración, la RC reduce el incremento asociado a la edad en la generación mitocondrial de superóxido y peróxido de hidrógeno9. Sin embargo, se desconoce si la RC puede mejorar el funcionamiento de las mitocondrias en todas las células y tejidos, o potenciar la degradación por separado de mitocondrias defectuosas.
En principio, los mecanismos de acción de la RC pueden indicar una protección contra el estrés oxidativo o una mejor reparación, o ambas cosas. Tomando como base todas las investigaciones publicadas, existen pocas dudas de que, a largo plazo, la RC protege del estrés oxidativo a roedores y, posiblemente, también a monos32. No obstante, ello no significa que la RC disminuya la acumulación de moléculas dañadas por oxidación en células y tejidos actuando directamente sobre la producción de especies reactivas de oxígeno. Por ejemplo, está demostrado que la RC aumenta la reparación de moléculas de ADN dañadas por oxigenación y estimula el recambio de proteínas y organelas, así como la sustitución de estructuras dañadas por aquellas otras intactas de nueva síntesis. La prevención por RC de la acumulación asociada a la edad de daños oxidativos en mitocondrias33 puede ser importante, ya que aumentos en el escape del protón mitocondrial pueden ser tanto una causa como una consecuencia del estrés oxidativo. Cuando se combina el conocimiento actual sobre las acciones fisiológicas y los efectos de expresión génica de la RC con los hallazgos de la manipulación genética que alargan la vida de especies vertebradas e invertebradas, surgen 4 hipótesis: atenuación del daño oxidativo; cambio en el sistema glucosa-insulina; modificación del eje hormona de crecimiento (GH)/factor de crecimiento similar a la insulina tipo 1 (IGF-1), y hormesis14. El reciente descubrimiento que la macroautofagia está implicada en el mecanismo del envejecimiento y en el efecto de la restricción caloríca, puede encuadrar estas 4 hipótesis en un único marco.
MACROAUTOFAGIA
La macroautofagia es un proceso universal y dinámico que tiene lugar en todas las células eucariotas y comprende una reorganización de membranas subcelulares para aislar citoplasma y organelas y transportarlo al lisosoma o vacuola, donde se degrada y recicla34,35. La maquinaria básica para la macroautofagia es idéntica entre células de levaduras y mamíferos36. La macroautofagia también se ha demostrado en plantas, y parece estar implicada en la reacción celular ante el recorte de nutrientes37,38. Distintas vías de señalización controlan la macroautofagia, la síntesis de proteínas y la supervivencia de células. La macroautofagia está íntimamente relacionada con la ejecución de programas de proliferación y de muerte celular39 a través de la acción de diversas cinasas, fosfatasas y guanosín trifosfato40. El proceso es importante para mantener un equilibrio bien ajustado entre anabolismo y catabolismo, con el fin de tener un crecimiento y desarrollo celular normal bajo la regulación de condiciones extracelulares como la concentración de nutrientes y hormonas. La intensa investigación realizada en células de mamíferos durante las últimas 3 décadas ha demostrado que la macroautofagia se activa durante el ayuno cuando descienden los valores de aminoácidos e insulina, facilitando la producción de nutrientes a partir de fuentes endógenas. Por el contrario, dentro del margen fisiológico de la concentración de aminoácidos en plasma los valores altos (posprandiales) de insulina suprimen totalmente la macroautofagia41-43. Curiosamente, la macroautofagia es el único mecanismo celular para la degradación de membranas y organelas alteradas, incluyendo mitocondrias44 y peroxisomas45,46. Según las premisas fisiológicas, la hipótesis de trabajo sería que la ingesta continuada ad líbitum debe dar como resultado la supresión sostenida de macroautofagia y, por tanto, acumulación de mitocondrias, peroxisomas y componentes de membrana alterados. Por otro lado, la restricción dietética debería prevenir o retardar la aparición de estos cambios. Recientes descubrimientos de biología molecular demuestran que los genes de autofagia son esenciales para el desarrollo y prolongación del ciclo vital de Caenorhabditis elegans47. La formación de vacuolas autofágicas se controla también a través de situaciones de tensión intracelular, incluyendo la agregación de proteínas mal dobladas y la acumulación de organelas alteradas, y está presente en la remodelación y atrofia celular. En conclusión, la vía de degradación que permite a la célula eliminar organelas superfluas o innecesarias y reciclar los componentes para su reutilización48, está bajo un control permisivo a través de la nutrición y la lesión celular. La estrecha relación entre nutrición y reparación celular puede convertirse en el talón de Aquiles de la gente bien alimentada que vive en las prósperas sociedades occidentales, con una propensión al envejecimiento acelerado y la aparición de enfermedades asociadas a la edad. De aquí el planteamiento que la macroautofagia desempeña un papel fundamental en el envejecimiento y en los efectos de prolongación de la vida de la restricción calórica49,50, así como en la muerte celular y las enfermedades asociadas a la edad, incluyendo enfermedades neurodegenerativas y algunas formas de cáncer40.
DEMOSTRACIÓN DE QUE LA AUTOFAGIA PUEDE MEDIAR EN LOS EFECTOS DE LA RESTRICCIÓN CALÓRICA
Hemos conseguido pruebas que la macroautofagia puede estar implicada en el proceso de envejecimiento, siendo el mejor mediador de los efectos de la RC51,52. En primer lugar, en ratas alimentadas ad líbitum, la reacción macroautofágica inducida in vivo disminuía notablemente a partir de los 6 meses de edad y era prácticamente desdeñable en ratas más viejas53. Es más, la tasa de máxima proteólisis macroautofágica en células hepáticas aisladas incubadas in vitro (sin aminoácidos añadidos en el medio), se reducía a partir de los 6 meses de edad54. En segundo lugar, la RC protegía contra estos cambios, tanto in vivo53, como in vitro55 y mejoraba la respuesta de las células hepáticas a la insulina y glucagón de manera significativa. En tercer lugar, la protección por RC ante el declive de proteólisis autofágica asociado a la edad se correlacionaba con la esperanza de vida56. Además, se obtuvieron pruebas de que el declive asociado a la edad de la macroautofagia en ratas alimentadas ad líbitum se relacionaba con un deterioro progresivo de membranas celulares. Efectivamente, se observó una acumulación significativa de dolicol asociada a la edad en tejidos de rata de más de 6 meses de edad30,57,58 que se veía retardada significativamente mediante la RC30,58 mostrando una correlación con la esperanza de vida y la función macroautofágica de proteólisis56,59. Se concluye que la alteración reguladora asociada a la edad de la macroautofagia condicionada por los valores plasmáticos de aminoácidos, glucagón y corticosterona, que determinan la tasa de recambio de membranas y organelas, así como la acumulación de componentes celulares dañados, se puede frenar o intensificar, respectivamente, mediante un valor bajo o alto de ingesta.
INTERVENCIÓN FARMACOLÓGICA: FÁRMACOS QUE MODULAN LA MACROAUTOFAGIA PUEDEN MODIFICAR ADECUADAMENTE EL RITMO DE ENVEJECIMIENTO
Con la finalidad de explorar la hipótesis que el ritmo de macroautofagia podría influir en la tasa de envejecimiento, se redujo la función autofágica-lisosomal con la inyección de inhibidores de tiolproteasas (p. ej., leupeptina) y agentes lisosomotrópicos como cloroquina, inhibidores generales de enzimas lisosomales60. La inhibición farmacológica crónica de la proteólisis autofágica indujo la formación de agregados lisosomales muy semejantes a la ceroidolipofuscina61, lo que subraya la validez de la inhibición proteolítica como modelo de envejecimiento62. Por otro lado, el incremento de la proteólisis autofágica mediante un agente antilipolítico administrado en animales en período de ayuno es un método seguro y altamente reproducible que permite el estudio, bajo condiciones convenientemente fisiológicas, de los efectos sobre el envejecimiento de la macroautofagia inducida hormonalmente (valores bajos de insulina y altos de glucagón)63,64. Así, el tratamiento agudo causaba una degradación importante en organelas aisladas seleccionadas de células hepáticas, incluyendo peroxisomas y, a menor escala, en mitocondrias65. Los resultados preliminares mostraron que el tratamiento semanal a largo plazo con agentes antilipolíticos intensifica los efectos beneficiosos de una ligera restricción calórica del 10% (ayuno un día a la semana), sobre parámetros que, como es conocido, se correlacionan con la esperanza de vida66. En conclusión, se encontró una manera de intensificar farmacológicamente el efecto de la dieta sobre el proceso de envejecimiento67.
LA AUTOFAGIA PUEDE MEDIAR EN LOS EFECTOS DE LA DISRUPCIÓN GENÉTICA SOBRE EL EJE DE INSULINA IGF-1 Y LA HORMESIS
A pesar de que todavía faltan pruebas experimentales, el conocimiento de la fisiología invita a plantear que los cambios inducidos hormonalmente en la macroautofagia podrían explicar los efectos de inyección crónica de insulina exógena, invirtiendo los beneficios de la RC respecto a la alteración mitocondrial68, y también los efectos de intervenciones génicas que alteran las vías de señalización de la insulina GH/IGF-1, mediante la reducción del crecimiento y el tamaño, y la prolongación de la longevidad del organismo69. En cuanto a la hormesis, con la ayuda del microscopio electrónico se han encontrado pruebas que varios estresores (ayuno, inyecciones de cortisol, inyecciones de reserpina, encierro, transección de médula espinal, inmersión en agua caliente, exposición al frío y al ejercicio muscular forzado en un tambor giratorio, restricciones físicas) pueden inducir la formación de vacuolas autofágicas junto con un aumento significativo de corticosterona en plasma e hipotermia70,71, y que estos efectos pueden cambiar con la edad72. En conclusión, la activación de la macroautofagia y consiguiente eliminación de mitocondrias y peroxisomas alterados puede ser el denominador común de las 4 hipótesis de Masoro sobre los mecanismos de los efectos de la RC contra el envejecimiento.
CONCLUSIONES
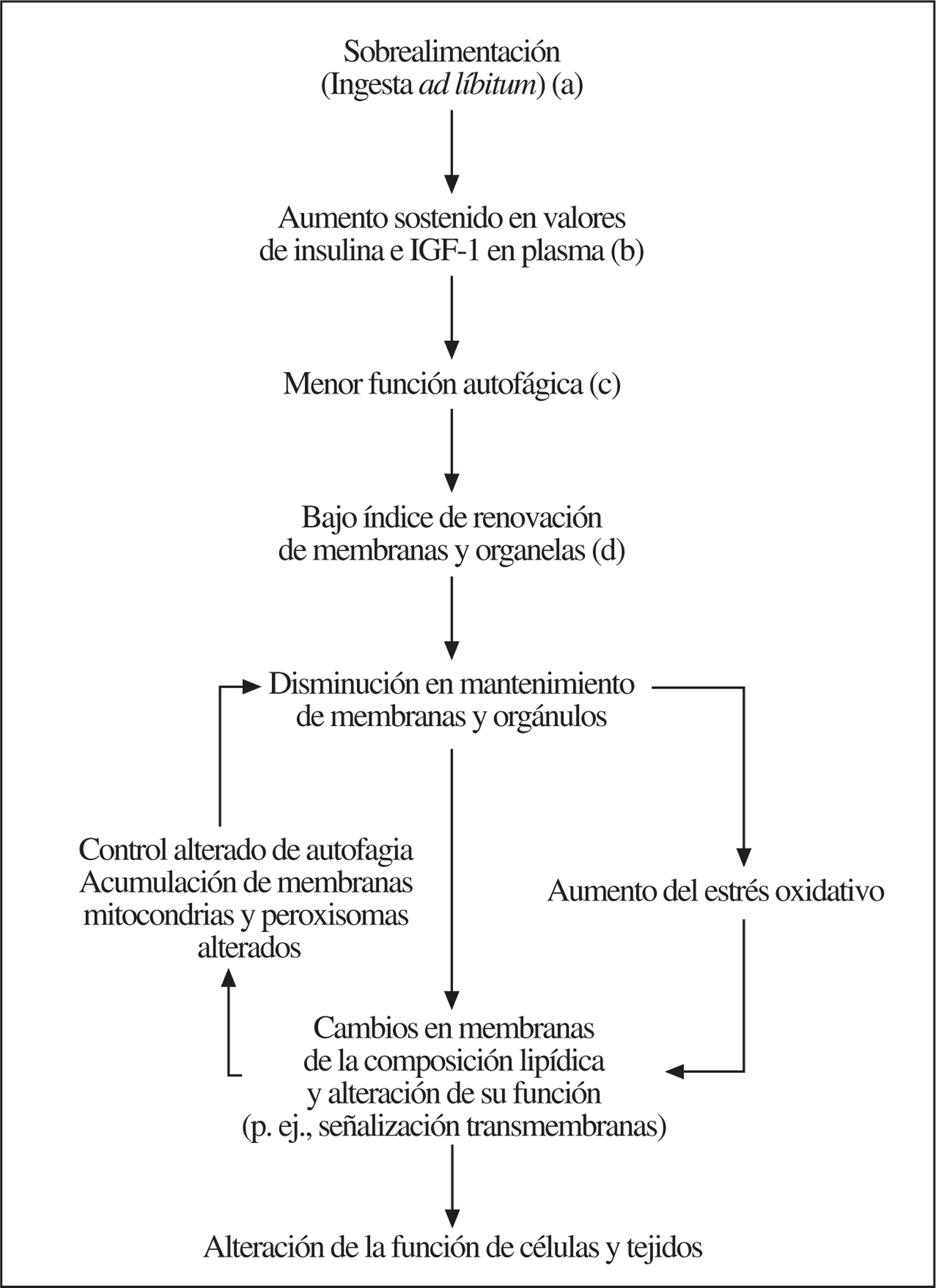
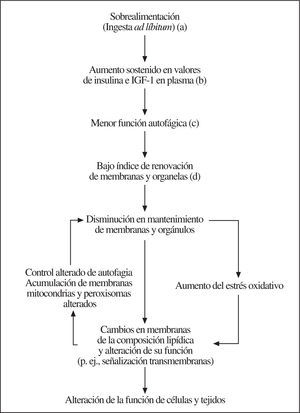
La ingesta ad líbitum (p. ej., sobrealimentación) puede afectar negativamente la longevidad al aumentar la glucosa en plasma, la secreción de insulina y los valores de aminoácidos e IGF-1, ya que estos cambios metabólicos y endocrinos inhiben la macroautofagia y ralentizan la tasa de recambio de proteínas de larga vida, membranas y organelas. Así, la mayor permanencia de macromoléculas y estructuras celulares puede incrementar la acumulación de macromoléculas peroxidadas y organelas defectuosas en las células, acelerando el proceso de envejecimiento. La acumulación de membranas73, mitocondrias74,75 y peroxisomas alterados76,77 podría aumentar la producción de radicales libres y de lesiones celulares. La mayor formación de radicales libres, la alteración de ese metabolismo en membranas y de la señalización celular puede iniciar un círculo vicioso que en algún caso convierta los cambios celulares en irreversibles (fig. 1)50. Por el contrario, la restricción calórica, el ejercicio físico, las disrupciones genéticas de la insulina y del eje GH/IGF-1, así como los estresores de baja intensidad, pueden disminuir los valores de insulina e IGF-1, y aumentar los de glucagón y corticosterona. De esta forma, mediante la estimulación de la macroautofagia se podría prevenir la acumulación de macromoléculas y componentes subcelulares alterados, lo que prolongaría la duración de la vida. Finalmente, estos efectos estarían también al alcance de una intervención farmacológica.
Figura 1.a) Prevención por restricción calórica; b) prevención por modificación genética de la estructura insulínica y del eje GH/IGF-1; c) prevención en ratones FIRKO78 y por administración de fármacos antilipolíticos, y d) inducible por estresores de baja intensidad (hormesis). Fuente: modificado, con permiso, de Bergamini et al79.