Comparar las características de la prostatitis aguda (PA) en los pacientes ancianos ≥75 años con los <75 años atendidos en un servicio de urgencias hospitalario (SU).
Material y métodosEstudio descriptivo observacional y prospectivo de los pacientes con PA atendidos de forma consecutiva durante un año en el SU de un hospital terciario. Se incluyen los datos relativos a la comorbilidad, episodios previos, clínica, microbiología, tratamiento, evolución a 30 días y se comparan los pacientes en función de la edad.
ResultadosSe han incluido 241 episodios de PA con una edad media de 62,9±16 años y 64 (26,5%) con ≥75 años. Fueron positivos 104 de los 215 (48,4%) urocultivos y 25 de los 136 (18,4%) hemocultivos. El aislamiento más frecuente fue Escherichia coli con resistencias en los pacientes ancianos >30% para ciprofloxacino, amoxicilina-clavulánico y cotrimoxazol, y 15,4% de cepas productoras de beta-lactamasas de espectro extendido. En el análisis univariante la manipulación de la vía urinaria, los antecedentes de cáncer, la antibioterapia previa, la insuficiencia renal, la proporción de cepas de E. coli resistentes y el ingreso hospitalario resultaron más frecuentes en los pacientes ≥75 años. A pesar de ello, únicamente el tratamiento antibiótico inadecuado resultó significativamente más frecuente en los pacientes ancianos en el análisis multivariante (p=0,004).
ConclusionesAl establecer el tratamiento empírico inicial de la PA en el SU, especialmente en los pacientes ancianos, es importante tener en cuenta el patrón de resistencias a los antibióticos de uso más frecuente.
To compare the characteristics of acute bacterial prostatitis between patients ≥75 years old with those <75 years old attended in the Emergency Department.
Material and methodsA descriptive and observational study was conducted with a prospective follow-up including all consecutive patients with acute bacterial prostatitis that were admitted during one year to the Emergency Department of a tertiary-care hospital. Data were collected for demographic variables, comorbidities, clinical and microbiological findings, treatment, outcome, and re-consultation at 30 days follow-up. Patients were compared depending on age.
ResultsA total of 241 episodes of acute bacterial prostatitis were included. The mean age was 62.9±16 years, and 64 patients (26.5%) were ≥75 years old. In the microbiology findings, 104 out of 215 (48.4%) of urine cultures and 25 out of 136 (18.4%) blood cultures were positive. Escherichia coli was the most frequent isolation, with resistance rates in elderly patients above 30% for ciprofloxacin, amoxicillin-clavulanic, and cotrimoxazole, and 15.4% of extended spectrum beta-lactamase producing strains. In the univariate analysis, previous manipulation of the urinary tract, history of cancer, previous antibiotic treatment, resistant E. coli strains, renal impairment, and admission to the hospital were more frequent among patients ≥75 years. Nonetheless, in the multivariate analysis only inadequate empirical antibiotic treatment was found to be significantly more frequent in elderly patients (P=.004).
ConclusionsDrug-resistance patterns to commonly used antibiotics should be considered when choosing empirical treatment for acute bacterial prostatitis in the Emergency Department setting, especially for patients ≥75 years.
La definición y clasificación de consenso de la prostatitis del National Institute of Health1 incluye 4 tipos de prostatitis: la prostatitis aguda (PA), que se presenta con clínica urinaria de instauración aguda, especialmente disuria y polaquiuria, a menudo acompañada de síntomas sistémicos como fiebre, malestar general y mialgias; la prostatitis crónica bacteriana, habitualmente responsable de infecciones urinarias recurrentes con la misma cepa bacteriana; el síndrome de dolor pélvico crónico, que puede acompañarse de clínica miccional en ausencia de infección, y la prostatitis inflamatoria asintomática. En concreto, la PA afecta aproximadamente al 1% de los hombres a lo largo de su vida2, supone una causa común de consulta en los servicios de urgencias hospitalarios (SU) y puede requerir tratamiento en régimen de hospitalización por la posibilidad de complicaciones derivadas del proceso séptico3. En cualquier caso, existen pocos datos en la literatura acerca de las características de la PA en los pacientes ancianos. En este estudio, se presentan las características generales de los pacientes con PA atendidos en un SU y se analizan las diferencias entre los pacientes ≥75 años y los <75 años.
Material y métodosEstudio analítico, descriptivo, observacional y prospectivo de todos los casos atendidos en el SU recogidos durante un año (enero-diciembre de 2012) con diagnóstico de PA en pacientes con clínica miccional de curso agudo y/o fiebre y sedimento patológico. Se registraron los datos relativos a la edad, comorbilidad, patología prostática, sondaje vesical o manipulación de la vía urinaria, clínica, tratamiento, microbiología, destino al alta del SU y recurrencia con reconsulta en el SU a los 30 días, y se han comparado los pacientes en función de la edad (≥75 años vs. <75 años). El tratamiento empírico inicial con aislamiento posterior de cepas resistentes según antibiograma se ha definido como antibioterapia inadecuada. Se ha considerado como bacteriuria significativa la presencia de ≥105UFC/ml o un recuento de >104UFC/ml con >40 leucocitos/μl y como contaminación el aislamiento de 2 o más microorganismos. Se ha utilizado el sistema MicroScan para la identificación y el antibiograma de las bacterias aisladas en los urocultivos y hemocultivos. Las cepas se han clasificado como sensibles, intermedias o resistentes según las recomendaciones del Clinical Laboratory Standards Institute (CLSI)4. Asimismo, se han clasificado como cepas multirresistentes aquellas con resistencia a 3 o más familias de antibióticos. En la descripción de las variables cualitativas se han utilizado frecuencias absolutas y relativas, y en el caso de las cuantitativas, la media con desviación estándar. En el análisis comparativo, se ha usado el test Chi-cuadrado para las variables cualitativas y la prueba t-Student para las variables cuantitativas de medidas independientes. Se ha realizado un análisis univariante y otro multivariante para los valores significativos. Se consideró que las diferencias eran estadísticamente significativas con una p<0,05. El programa estadístico utilizado fue el SPSS 19.0. No se ha recibido ningún tipo de financiación y el estudio fue aprobado por el Comité Ético y de Investigación Clínica del centro que consideró la exención del consentimiento informado por la naturaleza observacional del proyecto.
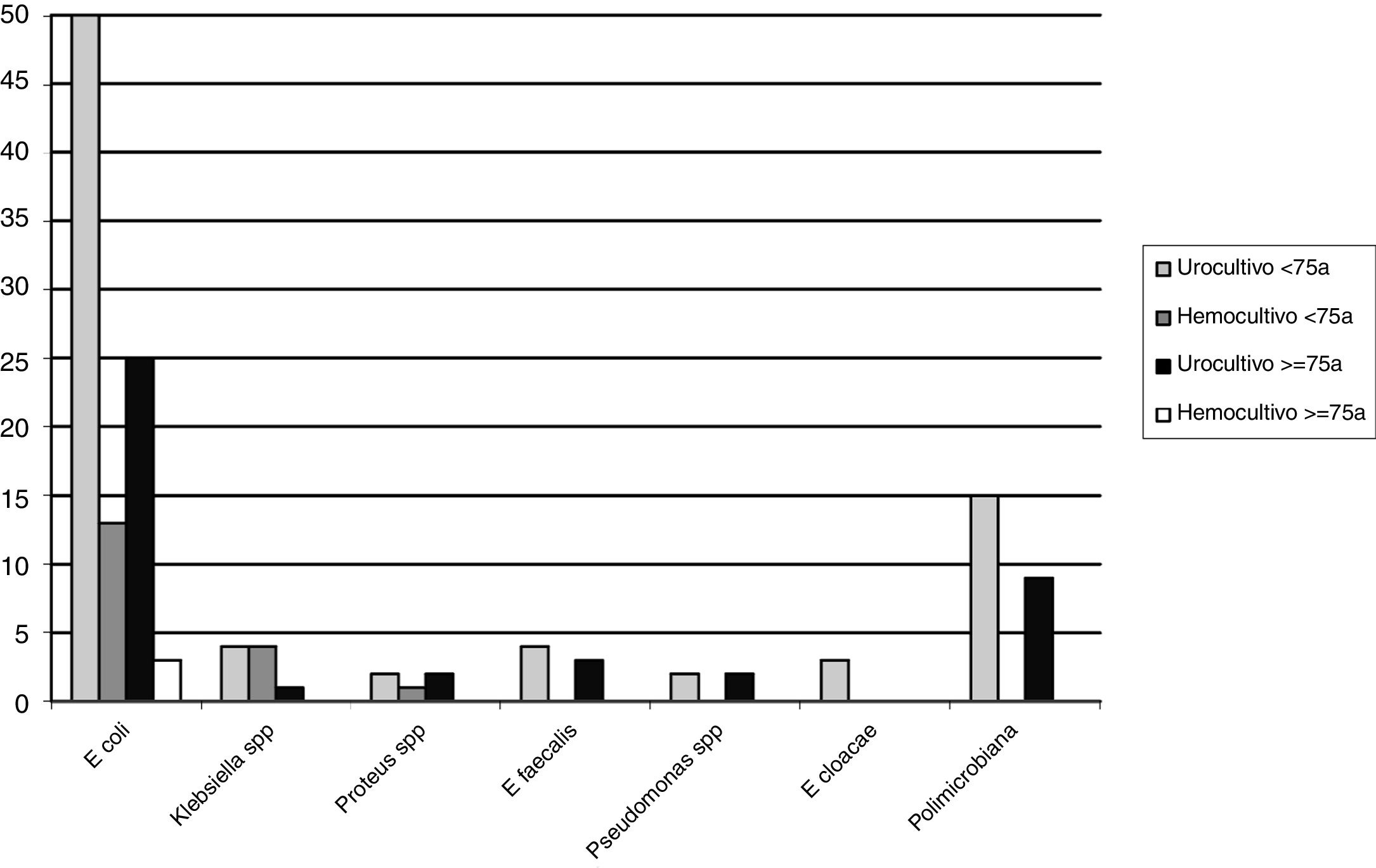
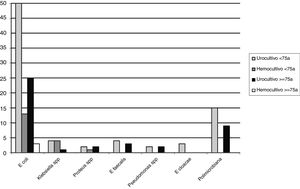
ResultadosSe han incluido 241 episodios de PA sin pérdidas en el seguimiento a 30 días. La edad media era de 62,9±16 años y 64 (26,5%) pacientes tenían ≥75 años. En conjunto, se registró manipulación previa de la vía urinaria en 40 casos (16,6%), un episodio anterior de PA en 46 (19,1%) y antecedentes de cáncer o adenoma prostático en 38 (15,8%) y 54 (22,4%), respectivamente. En 176 casos (73%) había clínica miccional, con una media de 3,4±4 días, fiebre ≥38°C en 154 (63,9%) y se planteó el ingreso hospitalario en 70 casos (29%). Resultaron positivos 104 de los 215 (48,4%) urocultivos y 25 de los 136 (18,4%) hemocultivos. El microorganismo aislado más frecuentemente fue Escherichia coli (fig. 1), con resistencias en el total de la serie cerca del 30% para ciprofloxacino, >20% para amoxicilina-clavulánico y cotrimoxazol, y un 6% de cepas productoras de beta-lactamasas de espectro extendido (BLEE). En el análisis univariante no se hallaron diferencias entre los pacientes ≥75 años y los <75 años en relación con la clínica, la proporción de cultivos positivos y/o aislamientos y en la antibioterapia empírica pautada en el SU. Por el contrario, los pacientes ancianos recibieron con mayor frecuencia antibióticos en los 3 meses previos, tenían con más frecuencia antecedentes de cáncer o manipulación previa de la vía urinaria y alteración de la función renal. Asimismo, se observó en la población anciana una mayor proporción de cepas de E. coli resistentes a ciprofloxacino, a la combinación amoxicilina/clavulánico-ciprofloxacino, más cepas productoras de BLEE, mayor proporción de cepas multirresistentes y mayor proporción de antibioterapia empírica inadecuada. Por último, se planteó el ingreso hospitalario más frecuentemente en los pacientes ≥75 años, sin diferencias en la proporción de recurrencias con reconsulta en el SU y/o reingreso hospitalario en el seguimiento a 30 días entre los dos grupos (tabla 1). En el análisis multivariante en función de la edad de los valores significativos en el univariante, únicamente la mayor proporción de tratamientos antibióticos empíricos inadecuados pautados en el SU en los pacientes ancianos mostró diferencias, con una OR ajustada de 5,46 (IC 95%: 1,71-17,3; p=0,004).
Número de aislamientos en urocultivos y hemocultivos según la edad. Otros: urocultivos, Morganella morganii (n=1, <75 años), Citrobacter spp. (n=1, ≥75 años), y Haemophilus influenzae (n=1, <75 años); hemocultivos: Streptococcus spp. (n=1), Streptococcus aureus (n=1) y Bacteroides gracilis (n=1) (<75 años todos los casos).
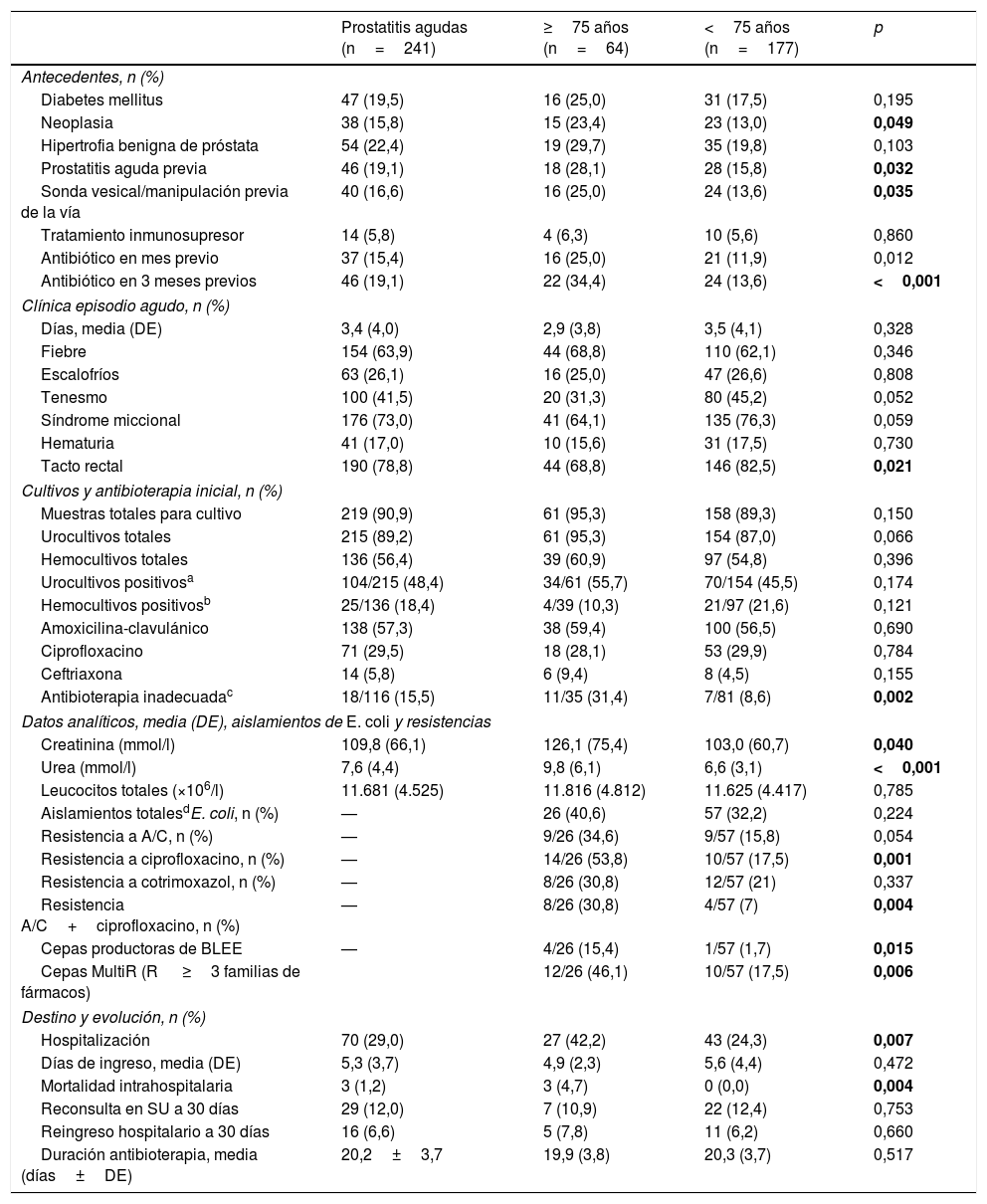
Características basales de los episodios de prostatitis aguda y análisis bivariante en función de la edad
| Prostatitis agudas (n=241) | ≥75 años (n=64) | <75 años (n=177) | p | |
|---|---|---|---|---|
| Antecedentes, n (%) | ||||
| Diabetes mellitus | 47 (19,5) | 16 (25,0) | 31 (17,5) | 0,195 |
| Neoplasia | 38 (15,8) | 15 (23,4) | 23 (13,0) | 0,049 |
| Hipertrofia benigna de próstata | 54 (22,4) | 19 (29,7) | 35 (19,8) | 0,103 |
| Prostatitis aguda previa | 46 (19,1) | 18 (28,1) | 28 (15,8) | 0,032 |
| Sonda vesical/manipulación previa de la vía | 40 (16,6) | 16 (25,0) | 24 (13,6) | 0,035 |
| Tratamiento inmunosupresor | 14 (5,8) | 4 (6,3) | 10 (5,6) | 0,860 |
| Antibiótico en mes previo | 37 (15,4) | 16 (25,0) | 21 (11,9) | 0,012 |
| Antibiótico en 3 meses previos | 46 (19,1) | 22 (34,4) | 24 (13,6) | <0,001 |
| Clínica episodio agudo, n (%) | ||||
| Días, media (DE) | 3,4 (4,0) | 2,9 (3,8) | 3,5 (4,1) | 0,328 |
| Fiebre | 154 (63,9) | 44 (68,8) | 110 (62,1) | 0,346 |
| Escalofríos | 63 (26,1) | 16 (25,0) | 47 (26,6) | 0,808 |
| Tenesmo | 100 (41,5) | 20 (31,3) | 80 (45,2) | 0,052 |
| Síndrome miccional | 176 (73,0) | 41 (64,1) | 135 (76,3) | 0,059 |
| Hematuria | 41 (17,0) | 10 (15,6) | 31 (17,5) | 0,730 |
| Tacto rectal | 190 (78,8) | 44 (68,8) | 146 (82,5) | 0,021 |
| Cultivos y antibioterapia inicial, n (%) | ||||
| Muestras totales para cultivo | 219 (90,9) | 61 (95,3) | 158 (89,3) | 0,150 |
| Urocultivos totales | 215 (89,2) | 61 (95,3) | 154 (87,0) | 0,066 |
| Hemocultivos totales | 136 (56,4) | 39 (60,9) | 97 (54,8) | 0,396 |
| Urocultivos positivosa | 104/215 (48,4) | 34/61 (55,7) | 70/154 (45,5) | 0,174 |
| Hemocultivos positivosb | 25/136 (18,4) | 4/39 (10,3) | 21/97 (21,6) | 0,121 |
| Amoxicilina-clavulánico | 138 (57,3) | 38 (59,4) | 100 (56,5) | 0,690 |
| Ciprofloxacino | 71 (29,5) | 18 (28,1) | 53 (29,9) | 0,784 |
| Ceftriaxona | 14 (5,8) | 6 (9,4) | 8 (4,5) | 0,155 |
| Antibioterapia inadecuadac | 18/116 (15,5) | 11/35 (31,4) | 7/81 (8,6) | 0,002 |
| Datos analíticos, media (DE), aislamientos de E. coli y resistencias | ||||
| Creatinina (mmol/l) | 109,8 (66,1) | 126,1 (75,4) | 103,0 (60,7) | 0,040 |
| Urea (mmol/l) | 7,6 (4,4) | 9,8 (6,1) | 6,6 (3,1) | <0,001 |
| Leucocitos totales (×106/l) | 11.681 (4.525) | 11.816 (4.812) | 11.625 (4.417) | 0,785 |
| Aislamientos totalesdE. coli, n (%) | — | 26 (40,6) | 57 (32,2) | 0,224 |
| Resistencia a A/C, n (%) | — | 9/26 (34,6) | 9/57 (15,8) | 0,054 |
| Resistencia a ciprofloxacino, n (%) | — | 14/26 (53,8) | 10/57 (17,5) | 0,001 |
| Resistencia a cotrimoxazol, n (%) | — | 8/26 (30,8) | 12/57 (21) | 0,337 |
| Resistencia A/C+ciprofloxacino, n (%) | — | 8/26 (30,8) | 4/57 (7) | 0,004 |
| Cepas productoras de BLEE | — | 4/26 (15,4) | 1/57 (1,7) | 0,015 |
| Cepas MultiR (R ≥3 familias de fármacos) | 12/26 (46,1) | 10/57 (17,5) | 0,006 | |
| Destino y evolución, n (%) | ||||
| Hospitalización | 70 (29,0) | 27 (42,2) | 43 (24,3) | 0,007 |
| Días de ingreso, media (DE) | 5,3 (3,7) | 4,9 (2,3) | 5,6 (4,4) | 0,472 |
| Mortalidad intrahospitalaria | 3 (1,2) | 3 (4,7) | 0 (0,0) | 0,004 |
| Reconsulta en SU a 30 días | 29 (12,0) | 7 (10,9) | 22 (12,4) | 0,753 |
| Reingreso hospitalario a 30 días | 16 (6,6) | 5 (7,8) | 11 (6,2) | 0,660 |
| Duración antibioterapia, media (días±DE) | 20,2±3,7 | 19,9 (3,8) | 20,3 (3,7) | 0,517 |
A/C: amoxicilina-clavulánico; BLEE: beta-lactamasas de espectro extendido; DE: desviación estándar; E. coli: Escherichia coli; MultiR: multirresistentes; R: resistente; SU: servicio de urgencias.
En el presente estudio se encontraron diferencias significativas en el análisis univariante por lo que respecta a los antecedentes de cáncer de próstata, los episodios previos de PA o de manipulación de la vía urinaria y al tratamiento antibiótico en los meses previos al comparar los pacientes ≥75 años con el resto. Sin embargo, únicamente el patrón de resistencias antibióticas mantiene la significación estadística una vez llevado a cabo el análisis multivariante. El tratamiento de la PA no resulta fácil por la poca penetración de muchos antibióticos en el tejido prostático y el problema creciente de las resistencias5. La capacidad de difusión hacia el tejido prostático viene determinada por distintas variables como son el tamaño molecular, la liposolubilidad, la fijación a las proteínas plasmáticas, el grado de ionización o disociación (pKa) plasma/próstata favorable y un gradiente de pH adecuado. En este sentido, los beta-lactámicos tienen un pKa bajo y son escasamente liposolubles, por lo que penetran poco, excepto en el caso de algunas cefalosporinas. Por el contrario, las quinolonas, las sulfamidas, los macrólidos, las tetraciclinas y aminoglucósidos como la tobramicina penetran bien6,7. De acuerdo con los resultados globales de la serie presentada, prácticamente el 30% de las cepas de E. coli mostraron resistencia tanto a ciprofloxacino como a amoxicilina-clavulánico, y más del 20% a cotrimoxazol. Además, en los pacientes ancianos más del 50% de los aislamientos de E. coli eran resistentes a ciprofloxacino, el 46,1% eran resistentes a 3 o más familias de antibióticos, y el tratamiento empírico pautado en el SU resultó inadecuado en el 31,4% de los casos. Como se ha descrito, la proporción de cepas de E. coli resistentes a fluoroquinolonas en el conjunto de las infecciones del tracto urinario, tanto de adquisición comunitaria como nosocomial, ha aumentado de forma considerable a lo largo de las últimas décadas8-10, y entre los factores de riesgo se han apuntado el género masculino, los episodios previos y recurrentes de infección urinaria, el uso de ciprofloxacino y la cateterización11. En el caso de las cepas de E. coli productoras de BLEE, con un número de aislamientos relativamente pequeño, resultaron asimismo más frecuentes en los pacientes ancianos, con una prevalencia similar a la descrita en la literatura12,13. Por último, el número total de aislamientos distintos de E. coli en los urocultivos y/o hemocultivos resultó ser demasiado pequeño para analizar posibles diferencias en los patrones de resistencia.
Las características generales de la serie presentada coinciden a grandes rasgos con otros estudios2,3. Como en nuestra serie, los pacientes ≥75 años suponen más del 20% del total de pacientes analizados y la clínica y los hallazgos microbiológicos son similares. Cabe destacar que se registran recaídas en el 17% de los casos3 y que el fracaso clínico y el microbiológico aumentan con la edad2. En relación con este último aspecto, no hemos hallado diferencias en la proporción de recurrencias con reconsulta en el SU o reingresos en el seguimiento a 30 días entre los grupos de edad, aunque esto pudiera explicarse, en parte, por la mayor tendencia al ingreso hospitalario de los pacientes ancianos tras la primera valoración o bien por el tamaño de la muestra analizada. En cualquier caso, en los pacientes ancianos, además de valorar la conveniencia del ingreso hospitalario de acuerdo a la situación clínica, funcional, social y mental, es importante tener en cuenta la elevada proporción de resistencias en el momento de establecer un tratamiento empírico en el SU.
Entre las limitaciones del estudio, cabe mencionar su carácter unicéntrico y el número relativamente pequeño en algunos subgrupos, lo que puede condicionar una baja potencia estadística.
Como conclusión, no se han encontrado diferencias por lo que respecta a la presentación clínica y los microorganismos aislados al comparar los pacientes ancianos con el resto, pero, en cambio, la resistencia a los antibióticos de uso más frecuente es claramente superior en el grupo de pacientes de mayor edad.
Conflicto de interesesNinguno.