El objetivo de esta investigación es estudiar el tumor lipoesclerosante mixofibroso (TLEMF), una tumoración benigna y rara con predilección de asiento en el extremo proximal femoral.
Caso clínicoSe presenta un caso clínico atendido en este centro con realización de raspado y relleno de la cavidad, con injerto de cresta ilíaca de una lesión que inicialmente fue etiquetada de quiste óseo o encondroma en cadera. La anatomía patológica informó de TLEMF; aunque no se sospechaba el diagnóstico, se realizó un tratamiento correcto y el sujeto evolucionó de manera adecuada.
ConclusionesEl TLEMF es infrecuente y se sospecha ante una lesión radiológica lítica, geográfica, con márgenes de esclerosis variable y asiento en la epífisis y metáfisis proximal femoral. No hay una aceptación unánime de esta entidad en la literatura médica, pero hay autores que argumentan que es una variante de la displasia fibrosa.
To look into the liposclerosing myxofibrous tumor, a rare benign tumor formation with a predilection for the proximal femur.
Clinical caseWe present a case treated in our hospital. We performed curettage and filling of the defect with an iliac crest graft; the lesion had initially been diagnosed as a one cyst/enchondroma in the hip. The pathological study revealed the presence of a liposclerosing myxofibrous tumor. Although this diagnosis was not suspected, the treatment administered was correct and the patient evolved satisfactorily.
ConclusionsThe liposclerosing myxofibrous tumor is a rare condition. Its presence may be suspected when the X-ray reveals a lytic lesion, with variable sclerotic margins, lodged in the femoral epiphysis or proximal shaft. There is no unanimous acceptance of this entity in the literature, with some authors claiming that it could be a variant of fibrous dysplasia.
El tumor lipoesclerosante mixofibroso (TLEMF)2–8 es una entidad rara, con predilección de asiento en el extremo proximal del fémur de adultos jóvenes en torno a la cuarta década de vida1–3,8.
Otras denominaciones son tumor fibroóseo polimorfo, enfermedad fibroquística polimorfa de hueso, lesión fibroósea polimorfa de hueso2,3, lesión fibroósea polimorfa de hueso con asiento en fémur proximal9 o displasia fibrosa atípica4,5.
En la radiología simple aparece como una lesión lítica de aspecto geográfico con bordes bien definidos y márgenes de esclerosis variable que puede presentar calcificaciones en su interior1–3,8.
Obliga al diagnóstico diferencial con otras entidades como displasia ósea, quiste óseo, lipoma, fibroma no osificante, encondroma e infarto óseo2,8.
Su tratamiento es el de muchas lesiones óseas tumorales benignas: legrado, raspado de la cavidad y relleno de ésta con injerto óseo y fijación en caso de precisarse8.
Asimismo, debe realizarse un seguimiento periódico pues se describe degeneración sarcomatosa entre el 10 y el 16% de los casos2–4; aunque no se sabe el porcentaje exacto, se sospecha una cifra inferior (como se verá más adelante).
Caso clínicoVarón de 43 años enviado desde las consultas externas de Medicina Interna que consultaba por artralgias y elevación de ferritina.
Se solicitó analítica (hemograma, bioquímica, velocidad de sedimentación globular, proteína C reactiva), que reflejó hiperuricemia.
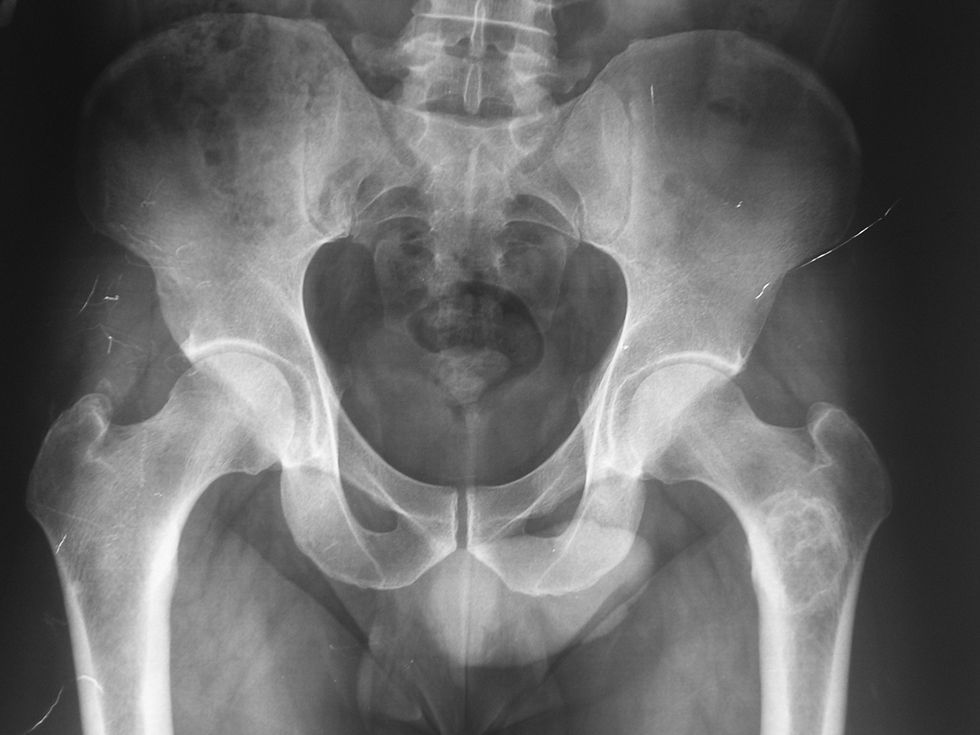
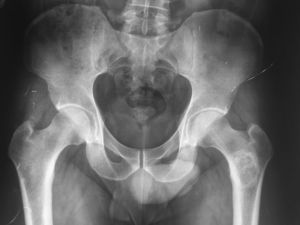
Se realizó serie ósea que informó la existencia de una lesión osteolítica compatible con encondroma y condrosarcoma a la altura de la metáfisis del fémur izquierdo.
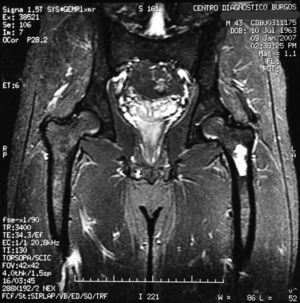
El diagnóstico fue quiste óseo del fémur izquierdo e hiperuricemia, y se descartó enfermedad reumatológica y hemocromatosis. El sujeto fue dado de alta en consultas externas de Medicina Interna y se lo derivó a consulta de Traumatología y Cirugía Ortopédica (fig. 1).
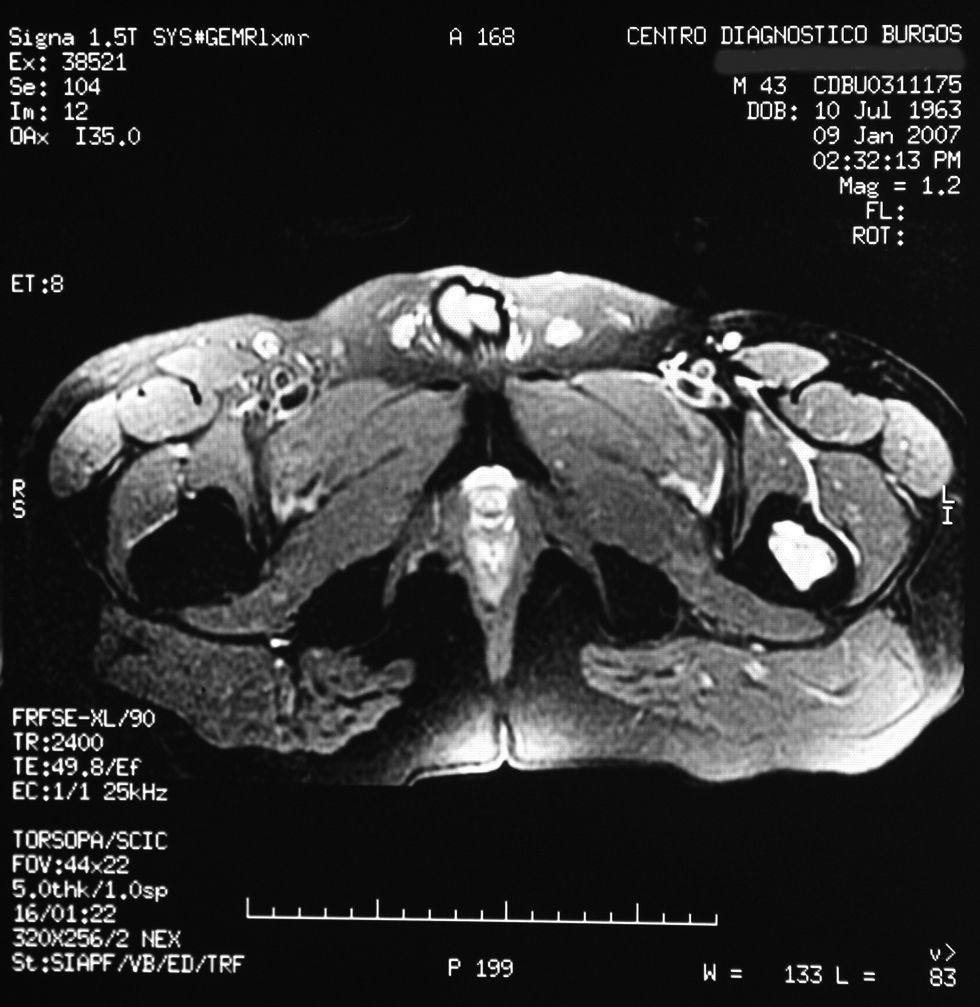
Desde la consulta en este centro, se solicitó resonancia magnética (RM); el informe completo fue el siguiente:
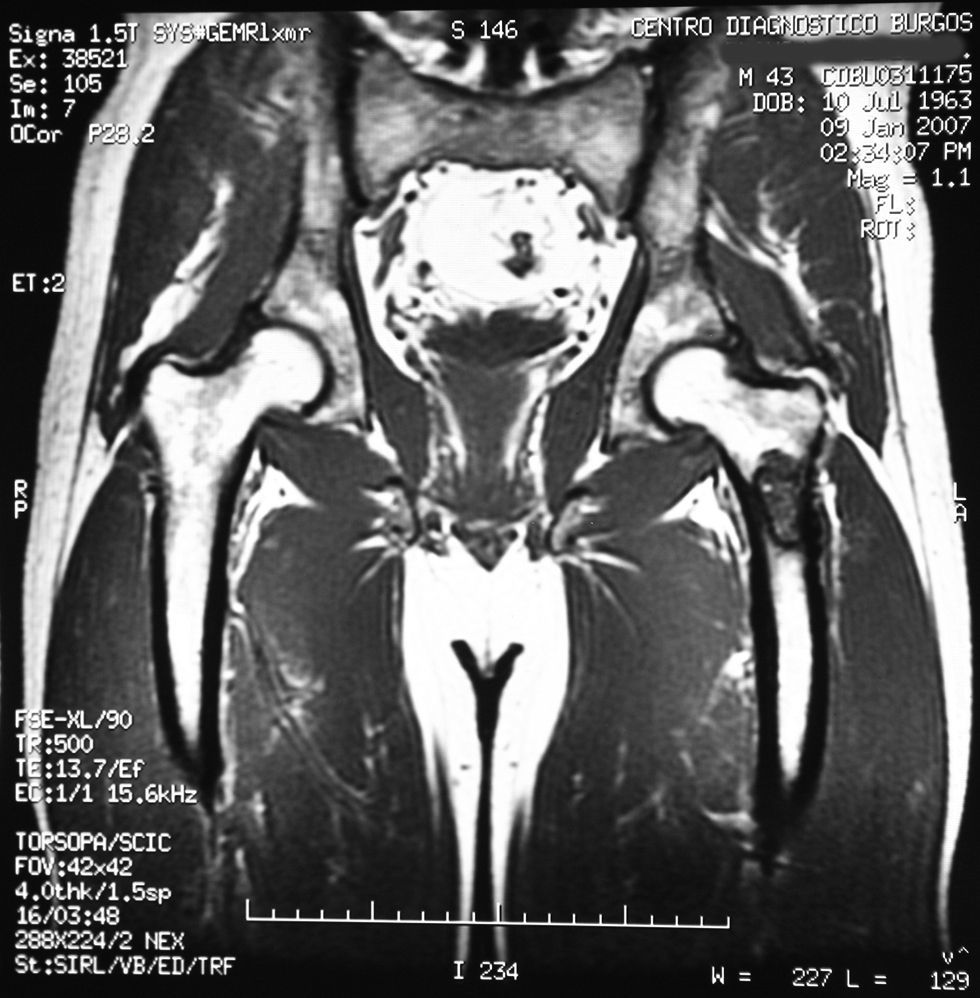
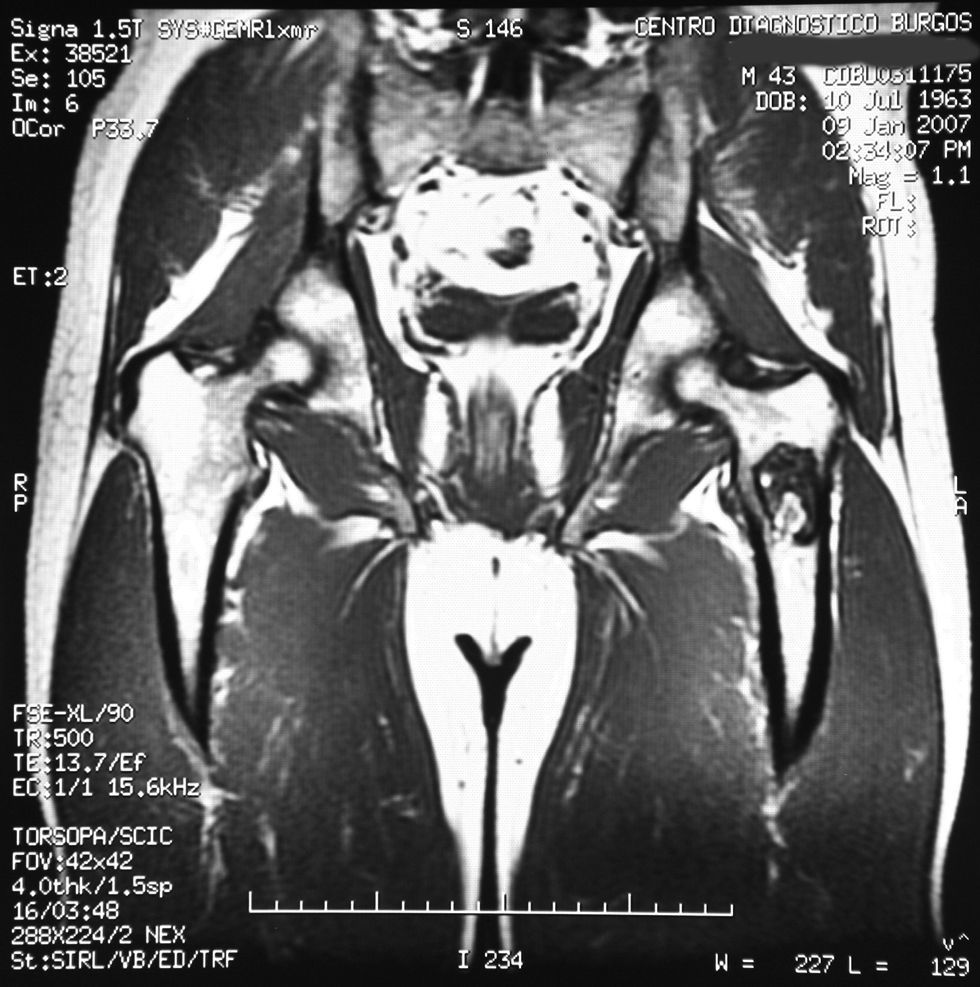
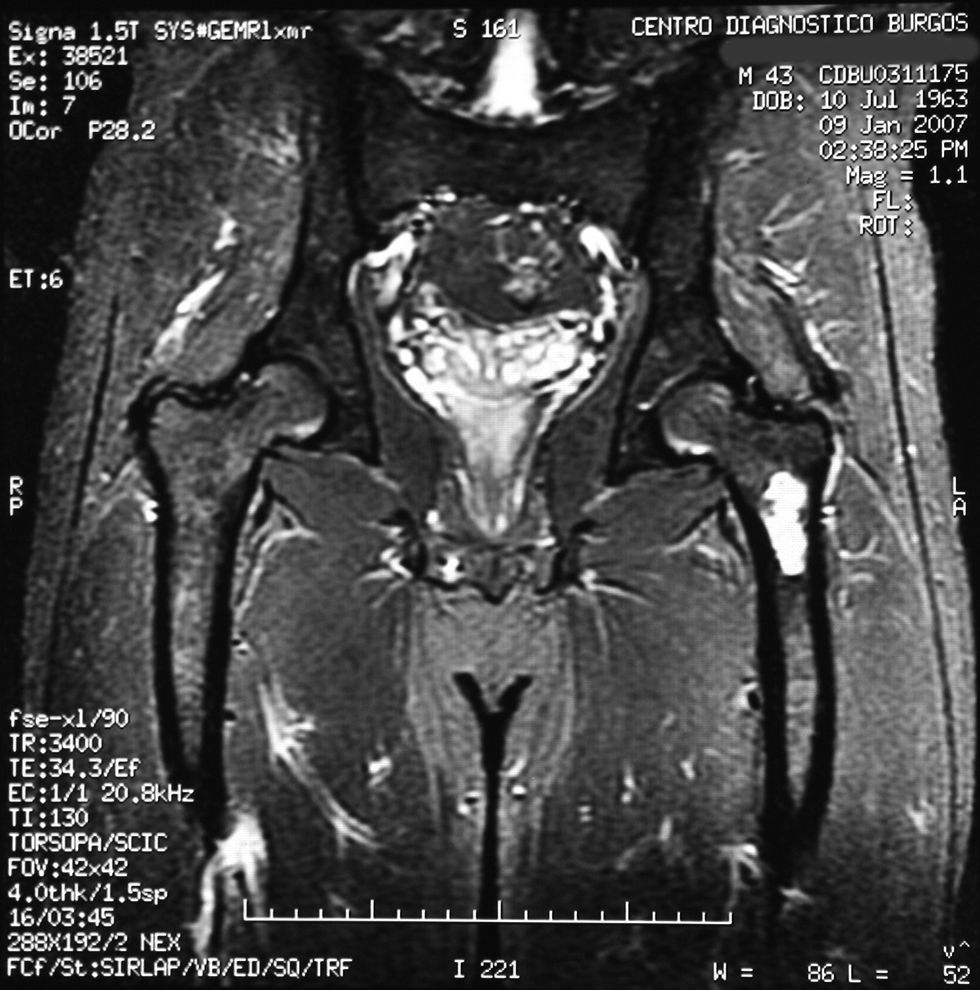
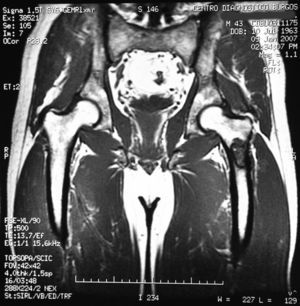
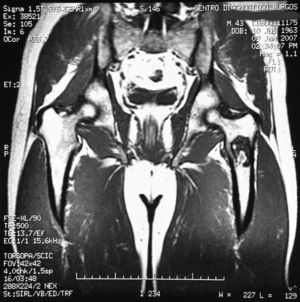
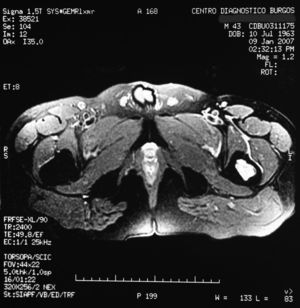
«Se aprecia una tumoración en la metáfisis proximal del fémur izquierdo bien definida, de borde hipointenso en todas las secuencias, con la matriz hipointensa en T1 e hiperintensa en T2, con imágenes hipointensas en todas las secuencias en probable relación con calcificación.
No hay afectación de la cortical ósea.
No se aprecian otras alteraciones en el resto de estructuras osteomusculares de la zona emitida.
Tumoración en metáfisis proximal del fémur izquierdo de aspecto benigno en relación con un encondroma» (figs. 2–5).
Sobre la base de este diagnóstico se decidió intervención quirúrgica.
Bajo anestesia raquídea y control radioscópico se practicó un abordaje externo de Bauer, raspado y limpieza de la cavidad en la región proximal del fémur izquierdo. Se rellenó la cavidad ósea resultante con injerto de esponjosa de la cresta ilíaca ipsolateral y se colocó cerclaje óseo para fijar la ventana ósea. Se envió la muestra a Anatomía Patológica.
El sujeto recibió tratamiento analgésico, profilaxis antibiótica, antitrombótica y de protección gástrica, y fue dado de alta a las 72h de la intervención.
Durante el primer mes del postoperatorio, caminaba con ayuda de muletas y descargaba la extremidad afectada; se le autorizó la carga parcial tras este primer mes y la carga total a partir del tercer mes.
Todas las pruebas diagnósticas, su posterior utilización o difusión, así como la intervención quirúrgica, se realizaron tras la obtención del consentimiento informado del sujeto.
La patóloga de este centro realizó el diagnóstico de anatomía patológica previa consulta con el Servicio de Anatomía Patológica del hospital de referencia (Hospital General Yagüe de Burgos), adonde se enviaron diversos cortes y se confirmó el diagnóstico.
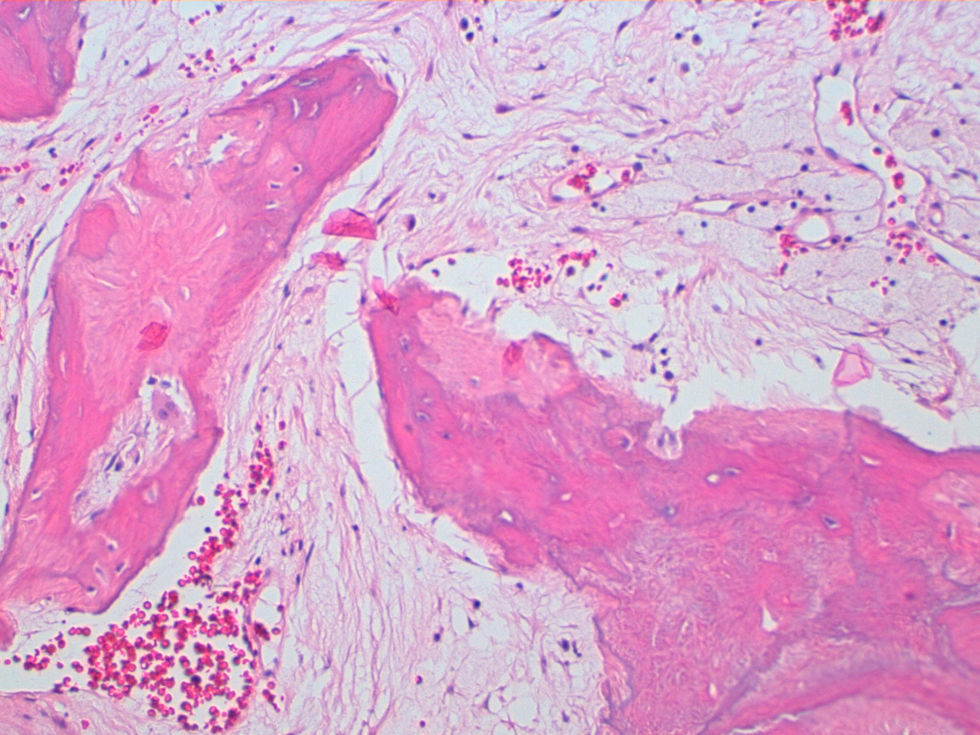
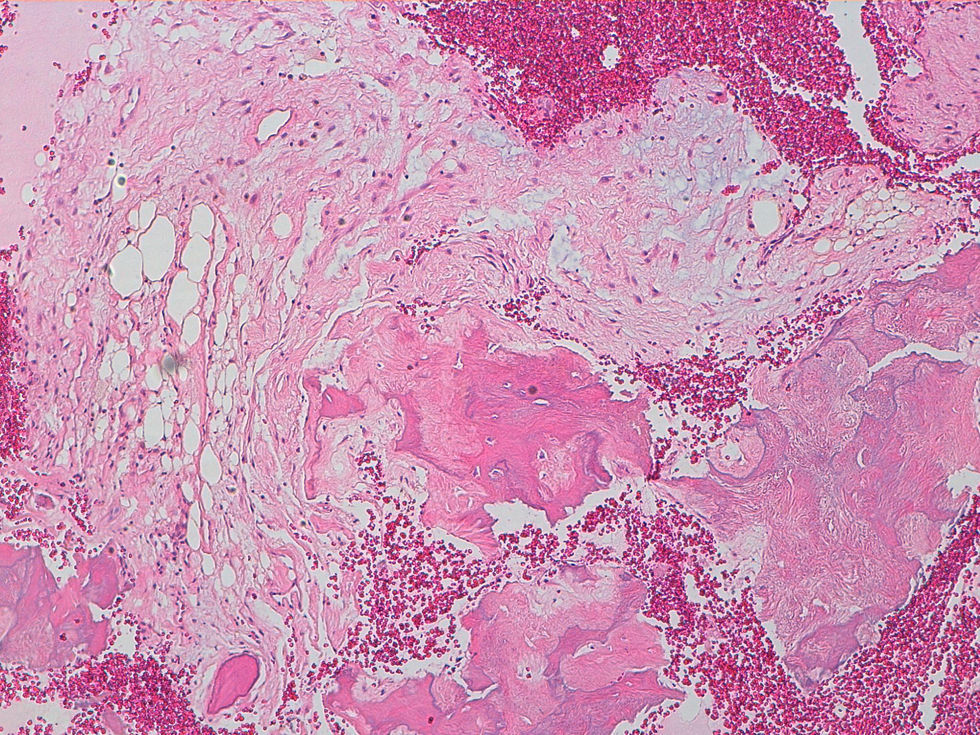
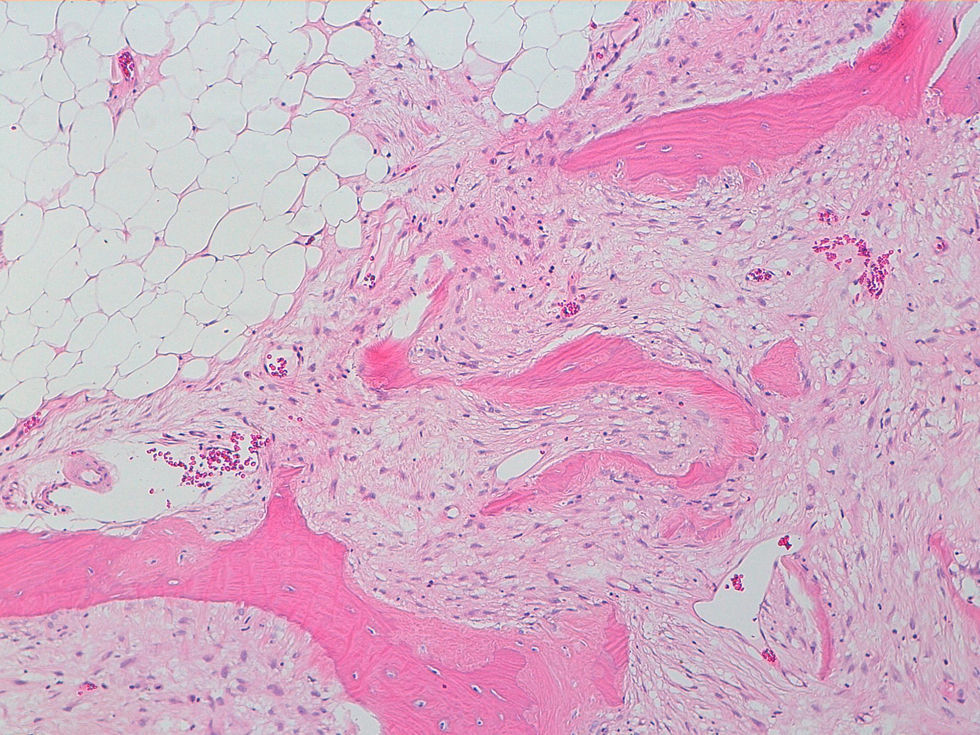
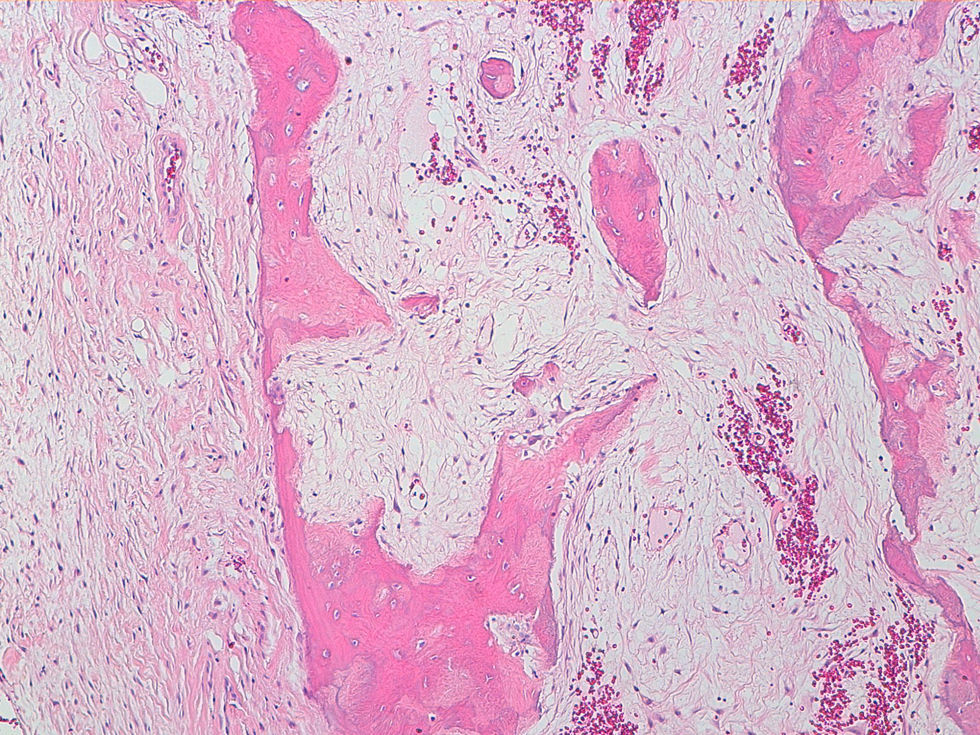
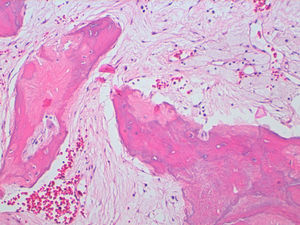
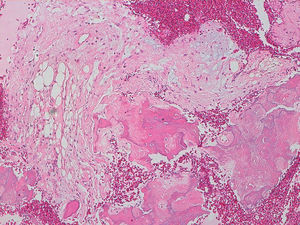
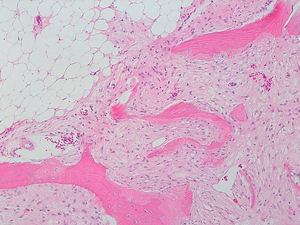
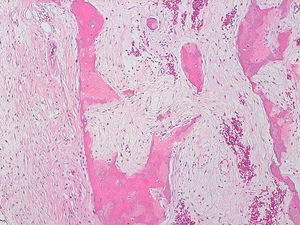
La descripción del informe fue la siguiente: «Microscópicamente se estudian varios fragmentos de una lesión ósea que muestra trabéculas óseas neoformadas toscas y con imágenes geográficas de seudoPaget carentes de revestimiento osteoblástico y osteoclástico. Asimismo, muestra áreas de trabéculas curvilíneas y osículas circulares que remedan la displasia fibrosa. El fondo de la lesión es fibromixoide, escasamente celular sin células desvitalizadas ni células plasmáticas. Pueden observarse áreas adiposas y áreas focales de células xantomizadas. El tejido fibromixoide se introduce, ocasionalmente, en los espacios de Havers de hueso compacto periférico preexistente».
Diagnóstico: «Tumor mixofibroso lipoesclerosante (tumor fibroóseo polimorfo)». (figs. 6–9).
Los seguimientos en consulta se realizaron cada 3 meses y, al año de la cirugía, el sujeto se halla asintomático, con incorporación total y plena a su actividad social y laboral.
La evolución radiográfica fue correcta con restitución cortical a la altura del fémur e integración ósea del injerto, y en la tomografía computarizada (TC) practicada al año se observó una cavidad residual sin que hubiera pruebas de recidiva de la enfermedad (no se solicitó RM por los artefactos que pudieran provocar el cerclaje).
DiscusiónEl TLEMF de cadera es una lesión fibroósea atípica y benigna con una variedad compleja de patrones histológicos que pueden incluir lipoma, fibroxantoma, mixoma, características de tipo displasia fibrosa, formación de quistes, necrosis grasa, osificación isquémica y raramente cartílago1–4,8. Asimismo, pueden encontrarse hialinización estromal y nidos de hueso de aspecto pagético2–5.
Las trabéculas óseas pueden mostrar esclerosis, mosaicismo, osificación isquémica y hueso laminar bien formado2,3,9. Su asiento de predilección es la región proximal del fémur en un 80 a un 90% de los casos1–3,8,9, pero se han descrito en otras localizaciones menos frecuentes, como la diáfisis femoral o los huesos ilíaco, húmero, tibia y segunda costilla2–4.
Para algunos autores lo más común es que se trate de un hallazgo radiográfico casual2. Para otros, el primer síntoma es el dolor, de intensidad y duración muy variable3,8. También puede iniciar como una fractura patológica2,3.
El rango de edad es de la segunda a la séptima década de la vida, con una media de aproximadamente 40 años1–3,8. Su desarrollo puede producirse durante la infancia y su manifestación clínica o diagnóstico en la edad adulta2 sin preferencia por alguno de los sexos1–3,8.
Su radiología simple es la de una lesión lítica geográfica con un borde bien definido y con frecuencia esclerótico, mineralización interna y, en algunos casos, expansión leve del hueso.
Así, el diagnóstico diferencial mediante la radiología simple se establece con aquellas entidades que muestren imágenes líticas bien definidas en el extremo proximal del fémur: displasia ósea, quiste óseo, lipoma, fibroma no osificante, encondroma e infarto óseo, entre otras2,8.
En un trabajo de 1993, Ragsdale basó su diagnóstico diferencial con otras entidades en la radiología simple y en los hallazgos de anatomía patológica. Ahora es conveniente adentrarse un poco en la imagen del TLEMF en la TC y la RM, de acuerdo con la literatura médica revisada.
Según Resnick, el TLEMF puede manifestarse en la TC y en la RM como una mezcla de elementos internos sin signos de grasa1. O’Dwyer lo describe en la TC como una lesión con margen esclerótico y matriz no específica8. Según Kransdorf, en cortes axiales de la porción media de la lesión se muestra la naturaleza globular de la matriz mineralizada3.
En trabajos posteriores se citan imágenes de RM que en la secuencia T2 muestran heterogeneidad moderada e intensidad alta o parcialmente baja para la grasa, así como un borde lesional bien definido (al menos en parte)7.
En la secuencia T1 se ha descrito como una señal hipointensa y en la secuencia T2 como una señal hiperintensa (concordante con el presente caso). La imagen lesional inespecífica y esa hiperintensidad en la secuencia T2 (debido al alto contenido mixoide) presentan irregularidades internas debidas a las posibles calcificaciones4,8.
Kransdorf apunta a una imagen en la secuencia T1 con una señal similar al esqueleto muscular y en la secuencia T2 moderadamente heterogénea, con un margen bien definido y áreas de alta o intermedia intensidad en esta señal3. También afirma que en la gammagrafía ósea con Tecnecio-99m se muestra una acumulación del trazador en el lugar de asiento de la lesión3. No se encontró en la literatura médica una imagen de TC o RM típica que pueda ayudar al diagnóstico definitivo o diferencial con otros procesos.
Según O’Dwyer8, el diagnóstico de TLEMF debe basarse en los hallazgos radiográficos simples, la biopsia guiada por imagen y la anatomía patológica.
Es importante recordar nuevamente que la radiografía simple siempre muestra unas características constantes: lesión lítica bien definida con borde esclerótico, probable mineralización interna y predilección por la región intertrocantérica1–3,8.
El trabajo de Ragsdale de 1993 sitúa el porcentaje de malignidad en un 16%, si bien señala que la incidencia exacta de la degeneración sarcomatosa es desconocida y probablemente esté sobredimensionada, lo que demostraría que la desmoplasia isquémica presente favorece a la génesis tumoral2,3,8.
En su trabajo de 1999, Kransdorf indica un 10% de malignidad, pero avisa que debe tomarse con precaución pues se puede especular con que está sobrevalorado (en su serie incluía los casos de degeneración sarcomatosa con diagnóstico previo de TLEMF), o bien la posibilidad de malignidad puede ser considerablemente más baja al ser muchas veces un hallazgo casual3. Sin embargo, para algunos autores como Heim-Hall, el riesgo sería menor al ser una variante de la displasia fibrosa (0,5% de acuerdo con las cifras de malignidad de ésta)5.
Hay autores que reconocen claramente al TLEMF como una entidad propia, a pesar de su histogénesis variada, sobre la base de sus características típicas en una radiografía simple y al asiento típico en la región intertrocantérica del fémur proximal1–3,8,9.
Otros autores opinan que puede tratarse de una variante postraumática de la displasia fibrosa y afirman que es una evolución de ésta que se asienta en el extremo proximal del fémur debido a las solicitaciones mecánicas tan intensas que suceden en esa región anatómica, lo que provoca fracturas de fatiga sobre una displasia fibrosa, y que la diferencia radiográfica entre una lesión y otra no es tal5.
También hay autores que afirman que no está clara la diferencia o la relación entre una entidad y otra, y que se necesita una mayor investigación para no incurrir en errores diagnósticos4,6,7.
Asimismo, se discute si están relacionados con los lipomas intraóseos1,3 o si son cambios involutivos a partir de una lesión ósea benigna previa de naturaleza fibromixoide o fibroósea3,4. Por otra parte, se han reconocido 3 casos de TLEMF (2 en el trabajo de Matsuba y uno en el de Corsi) que presentan mutación del gen GNAS, una subunidad alfa de la proteína G en el codón Arg201, que incrementa la formación de monofosfato de adenosina cíclico.
Esta mutación es la causa del síndrome de McCune-Albright y también se presenta en la displasia fibrosa poliostótica y en ciertos casos de displasia fibrosa monostótica6–8. Con esto, se añade más incertidumbre a la cuestión de si el TLEMF es una entidad independiente o no de la displasia fibrosa.
El tratamiento del TLEMF consiste en raspado de la lesión y relleno de la cavidad con injertos óseos; se puede asociar osteosíntesis si es preciso.
Los casos que se presentan con fractura patológica pueden requerir artroplastia de cadera8. En los hallazgos casuales y sin la presencia de clínica dolorosa se puede optar solamente por vigilancia8. Asimismo, deben valorarse el beneficio y el riesgo de realizar una escisión profiláctica a una lesión benigna, con los riesgos de una cirugía mayor3, especialmente en una región como el extremo proximal del fémur con las cargas importantes que soporta.
Debe realizarse un seguimiento periódico de la lesión, pues se ha descrito transformación maligna de ésta (degeneración sarcomatosa en un 10 a un 16% de los casos)2–4,8, aunque tampoco esta cuestión está aclarada del todo.
El cirujano ortopédico debe saber hacer un diagnóstico de las lesiones tumorales del esqueleto, primero diferenciándolas de otras lesiones de tipo displásico, infeccioso, etc., y luego valorando si presentan características de benignidad o malignidad en caso de sospecha de tumor.
Es evidente que, ante cualquier duda, se tiene que enviar al sujeto a un centro especializado en donde se desarrollará el diagnóstico definitivo mediante la realización de una biopsia y se establecerán las estrategias terapéuticas10. Así, pueden evitarse sorpresas diagnósticas como las del presente caso, con las consecuencias graves que una planificación y una actuación terapéutica incorrectas pueden acarrear a estos sujetos.
En conclusión, hay que pensar en la posibilidad diagnóstica de TLEMF ante una lesión lítica de márgenes geográficos bien definidos y con esclerosis variable, de asiento en la región proximal del fémur.
El diagnóstico diferencial se establece con aquellas entidades que muestren imágenes líticas bien definidas en el extremo proximal del fémur; entre éstas, se encuentra la displasia ósea, el quiste óseo, el lipoma, el fibroma no osificante, el encondroma, el infarto óseo, etc2,8.
Dada la rareza de este proceso, que puede no encontrarse reflejado en la literatura médica convencional, no hay unanimidad en cuanto a que sea una entidad propia como tal; ni con el trabajo y la experiencia de este grupo de estudio se puede afirmar que realmente el TLEMF sea una entidad nosológica propia o una variante de la displasia fibrosa.
Cuando se plantean dudas en cuanto a la naturaleza de la lesión o a la diferenciación entre benignidad y malignidad, o si se piensa de entrada que una lesión es maligna, se necesita el estudio mediante una biopsia y se debe derivar al sujeto a un centro de referencia con experiencia en enfermedad tumoral ósea.
Conflicto de interesesLos autores no han recibido ayuda económica alguna para la realización de este trabajo. Tampoco han firmado ningún acuerdo por el que vayan a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estos autores estén afiliados.