La investigación preclínica sobre la artrofibrosis postraumática se ha centrado principalmente en modelos experimentales de conejo. No obstante, existe un creciente interés por desarrollar y validar modelos en animales de menor tamaño, lo que permitiría una investigación más coste-efectiva. El objetivo de este estudio es validar el modelo en rata descrito recientemente por Owen et al.
Material y métodosSe utilizaron 20 ratas hembra Sprague Dawley de 14 semanas de edad: 10 se emplearon para el análisis de la rigidez biomecánica, mediante la medición del ángulo de extensión pasiva (passive extension angle [PEA]) a diferentes pares de torsión (PEA-2, PEA-4, PEA-8) y en el momento de rotura capsular, y 10 se emplearon para el análisis de la fibrosis histológica, mediante la medición del área y el grosor de la cápsula posterior. La rodilla izquierda se utilizó como control. La cirugía inicial se realizó sobre la rodilla derecha (rodilla operada) según la técnica descrita por Owen et al.: lesión intraarticular, rotura de la cápsula posterior e inmovilización en flexión mediante una sutura percutánea. Tras 4 semanas de inmovilización, se retiró la sutura y se permitió la libre movilidad durante otras 4 semanas antes del sacrificio.
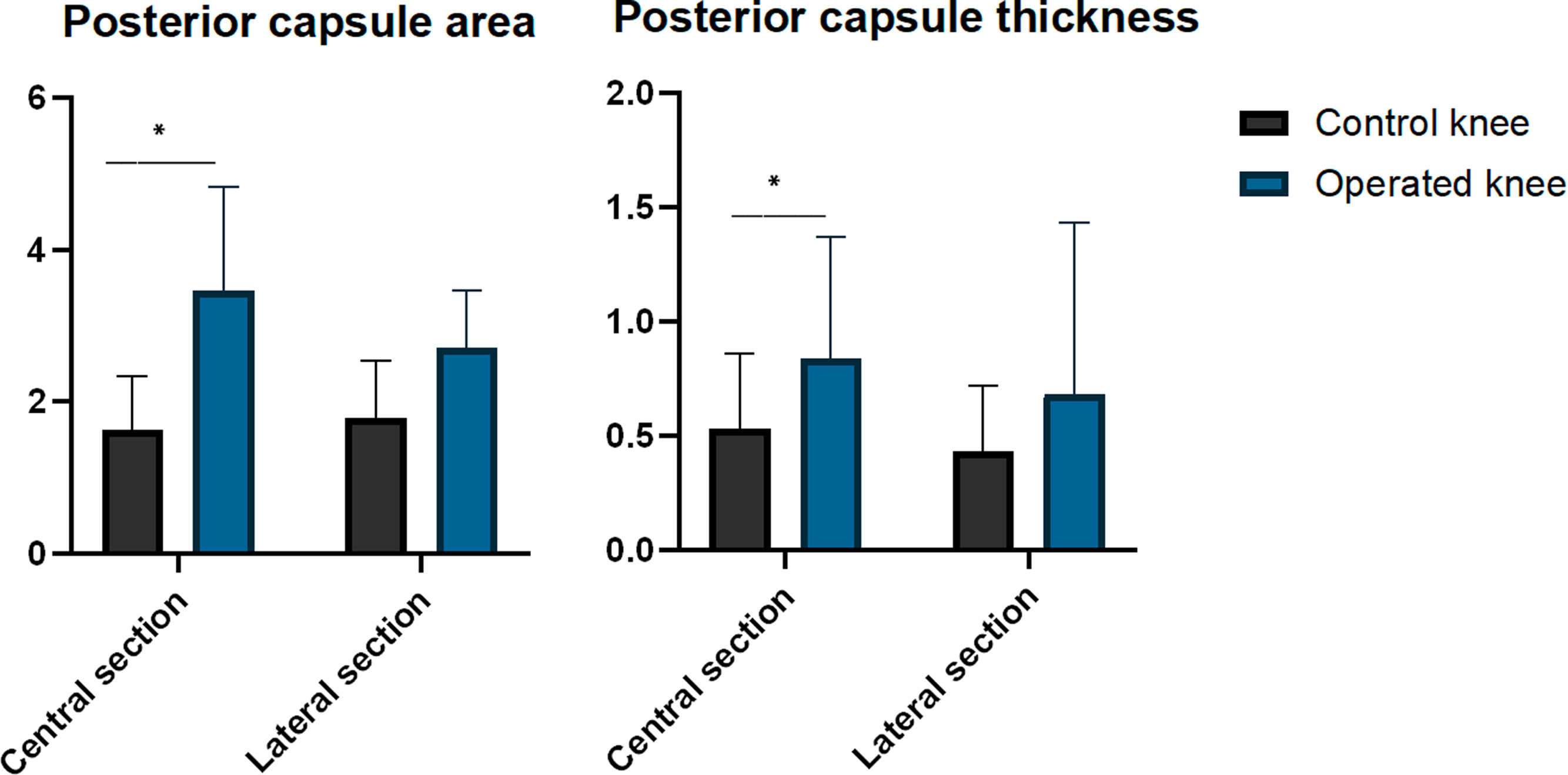
ResultadosLas rodillas operadas presentaron un menor PEA-4 (−40,6°; p=0,011), PEA-8 (−45,6°; p=0,044) y PEA en la rotura capsular (−66,5°; p=0,043 en comparación con las rodillas control. Los valores medios obtenidos en nuestra serie para PEA-2, PEA-4 y PEA-8 fueron comparables a los de Owen et al. Las rodillas operadas presentaron una mayor área (1,82mm2; p=0,033) y grosor (0,31mm; p=0,043) de la cápsula posterior en comparación con las rodillas control.
ConclusionesSegún nuestros resultados, el modelo de artrofibrosis postraumática descrito por Owen et al. es capaz de inducir rigidez biomecánica y fibrosis histológica. Nuestros resultados biomecánicos son comparables a los de Owen, lo que confirma la reproducibilidad del modelo.
Experimental post-traumatic arthrofibrosis studies have been conducted using mostly rabbit models. However, there is great interest in developing and validating models in smaller animals, which would allow for more cost-effective research. The aim is to validate a model in rats recently described by Owen et al.
Materials and methodsTwenty 14-weeks old Sprague Dawley female rats were used in the study: 10 rats were used to assess biomechanical contracture, as passive extension angle at different torques (PEA-2, PEA-4, PEA-8) and at capsule disruption, and 10 rats to assess histological fibrosis (area and thickness of posterior capsule). Left knee acted as control. Index surgery was performed on the right knee (operated knee) as described by Owen at al.: intra-articular injury, disruption of posterior capsule, and immobilization with a percutaneous suture in flexion. After a 4-week immobilization period, the suture was removed, followed by another 4-week remobilization period and euthanasia.
ResultsOperated knees showed lower PEA-4 (−40.6°; P=.011), PEA-8 (−45.6°; P=.044) and PEA at capsule disruption (−66.5°; P=.043) than the control knees. Mean PEA-2, PEA-4 and PEA-8 from our sample were similar to those reported by Owen et al. Operated knees showed a larger posterior capsule area (1.82mm2; P=.033) and thickness (.31mm; P=.043) than the control knees.
ConclusionsThe post-traumatic arthrofibrosis model described by Owen et al. has the capacity to induce biomechanical contracture and histological fibrosis. Our biomechanical results are comparable to those of Owen, supporting the model's reproducibility.
La rigidez articular tras una lesión traumática o quirúrgica (artrofibrosis postraumática) se debe, en gran medida, a una fibrosis excesiva de la cápsula articular. Tras un traumatismo o una cirugía invasiva que alteren las estructuras articulares, esta rigidez resulta especialmente relevante en articulaciones de elevada congruencia, como la rodilla o el codo1-4. Actualmente, las estrategias terapéuticas para tratar la rigidez se limitan a la fisioterapia o a la liberación quirúrgica5-10. Desafortunadamente, más allá de la movilización precoz, no existen terapias preventivas eficaces que reduzcan la fibrosis capsular tras una lesión traumática o una intervención reconstructiva11-16. Las razones por las cuales algunos pacientes desarrollan fibrosis excesiva tras un traumatismo o cirugía siguen sin conocerse. En los últimos años se ha avanzado en la comprensión de los mecanismos celulares y moleculares implicados. Se sabe que la limitación del movimiento se origina en la cápsula articular más que en la musculatura17-19. Además, se ha observado una proliferación de células fibroblásticas denominadas miofibroblastos en la cápsula articular durante las dos primeras semanas tras el trauma, lo que sugiere que estas células son las principales responsables del desarrollo de la artrofibrosis20-22.
Los estudios experimentales se han realizado mayoritariamente en modelos de conejo. Este modelo ha demostrado ser válido y reproducible para evaluaciones tanto biomecánicas como histológicas17,23,24. No obstante, existe un gran interés en desarrollar y validar modelos en animales de menor tamaño, que permitan investigaciones más económicas25,26. En particular, un modelo reproducible de rigidez articular en ratas reduciría significativamente los costes y facilitaría el estudio de una amplia variedad de agentes terapéuticos, dado que se dispone de un conocimiento amplio sobre la farmacocinética de numerosos fármacos en esta especie.
Algunos autores han intentado utilizar modelos en rata, aunque en ciertos casos solo se ha empleado inmovilización sin inducir lesión articular, se han omitido periodos de libre movilidad o se ha lesionado el cartílago articular o el músculo27-33. Li et al.34 adaptaron a la rata el modelo de conejo descrito por Hildebrand utilizando suturas de polipropileno, pero no demostraron que la rigidez persistiera tras el periodo de libre movilidad. Baranowski et al.19 desarrollaron un modelo en rodilla de rata que incluía una lesión capsular y un defecto extracartilaginoso, con inmovilización mediante una aguja de Kirschner transósea durante cuatro semanas y posterior libre movilidad. Sin embargo, no se realizaron evaluaciones histológicas ni moleculares que confirmasen la fibrosis capsular, y el uso de agujas transóseas conllevaba riesgo de migración o fractura iatrogénica. Además, los estudios que utilizaron este modelo para ensayar tratamientos farmacológicos no lograron demostrar diferencias con respecto al miembro control, posiblemente debido a una falta de sensibilidad del modelo35-37. Por ello, Owen et al.25 desarrollaron un nuevo modelo en rata, integrando conocimientos de estudios previos en conejo, con el objetivo de permitir investigaciones a mayor escala y más coste-efectivas en el tratamiento de la artrofibrosis postraumática. Este modelo incluye una lesión articular grave, periodos tanto de inmovilización como de libre movilidad, evaluación biomecánica bajo pares de torsión estandarizados, y valoración histológica mediante medidas cuantitativas.
El objetivo de este estudio es validar el modelo de artrofibrosis postraumática descrito por Owen et al., demostrando su capacidad para inducir rigidez biomecánica y fibrosis capsular histológica, así como su reproducibilidad.
Material y métodosAnimales y condiciones de alojamientoEste estudio fue aprobado por el Comité de Experimentación Animal de nuestra institución (PROEX 227.6/23; 29/09/2023). Todos los animales del estudio fueron adquiridos en Janvier Laboratories, Inc. (Saint-Berthevin, Francia) y permanecieron en cuarentena durante una semana tras su llegada antes de ser trasladados a la sala de experimentación. Las ratas se alojaron en grupo (n=4 por jaula), con acceso ad libitum a pienso estándar y agua del grifo filtrada. Las condiciones ambientales se mantuvieron constantes (temperatura de 21±2°C y humedad del 45±10%). El fotoperiodo fue de 12horas de luz al día, y se proporcionaron elementos de enriquecimiento ambiental.
Diseño del estudioEstudio experimental prospectivo.
Se utilizaron veinte ratas hembra Sprague Dawley (Rattus norvegicus domestica) con 14 semanas de edad y un peso medio de 305,1gramos (desviación estándar [DE]: 31,5). Se empleó un único sexo para reducir la variabilidad interindividual. Diez ratas se destinaron al estudio biomecánico y otras diez al estudio histológico. En cada animal, la rodilla derecha fue sometida a la intervención experimental (rodilla operada), mientras que la rodilla izquierda actuó como control interno (rodilla control).
ProcedimientoCirugía inicialSe realizó un procedimiento quirúrgico idéntico en la rodilla derecha de cada rata, siguiendo el protocolo descrito por Owen et al.25, a excepción del sistema de inmovilización percutáneo explicado más adelante. Todas las intervenciones se realizaron bajo anestesia general con sevofluorano inhalado (8% para inducción y 3,5–4% para mantenimiento en 1l de oxígeno) mediante mascarilla nasal. Se administró profilaxis antibiótica con cefazolina (30mg/kg), analgesia postoperatoria con buprenorfina (0,1mg/kg) y anestesia local subcutánea en la zona de la incisión con bupivacaína (2ml de una solución de 2g/100ml) antes de la incisión quirúrgica. Las rodillas se prepararon con solución de povidona yodada y se mantuvieron en condiciones estériles. Se realizó una incisión cutánea medial sobre la rodilla y una artrotomía parapatelar lateral. Se seccionaron los ligamentos cruzados y se generaron defectos corticales extracartilaginosos en los cóndilos femorales medial y lateral, utilizando una aguja de calibre 18G, prestando cuidado de preservar los ligamentos colaterales. Posteriormente, se hiperextendió la rodilla 45° para provocar la rotura de la cápsula posterior. La inmovilización de la rodilla en flexión completa se realizó siguiendo el método percutáneo descrito por Dagneaux et al.38, Se utilizó una aguja intramuscular de calibre 22G para pasar percutáneamente una sutura no reabsorbible (2-0 Prolene; Ethicon, Johnson & Johnson, EE.UU.). La aguja se introdujo por la cara anterior del fémur a nivel de la diáfisis media, se dirigió lateralmente hacia la tibia y emergió por la superficie anterior de esta. Se pasó la sutura en dirección retrógrada hasta hacerla emerger en la cara medial del fémur. La sutura se anudó rodeando la tibia anterior junto al hueso. La artrotomía y la piel se cerraron con suturas reabsorbibles. Se obtuvo una imagen fluoroscópica para confirmar la correcta inmovilización y descartar fractura iatrogénica. Los animales recibieron 5ml de suero salino subcutáneo y se trasladaron a una jaula de recuperación cálida.
Periodo de inmovilizaciónTras la cirugía índice, las ratas permanecieron en jaulas con libertad de movimiento durante un periodo de inmovilización de 4 semanas. Se administró buprenorfina oral (0,4mg/kg), disuelta en crema de chocolate, durante los primeros días postoperatorios.
Retirada de la sutura de inmovilización y periodo de libre movilidadAl completar las 4 semanas de inmovilización, se realizó una segunda intervención para retirar la sutura. La preparación y la anestesia fueron idénticas a las de la cirugía inicial. Se obtuvo una imagen fluoroscópica para verificar la inmovilización en flexión completa. A través de una pequeña incisión cutánea, se localizó el nudo en la cara medial del fémur, se cortó la sutura y se extrajo. A continuación, las ratas permanecieron otras 4 semanas con libertad de movimiento en jaula (periodo de libre movilidad).
Eutanasia y extracción de las rodillasTras el periodo de libre movilidad, los animales fueron sacrificados mediante inyección intraperitoneal de pentobarbital (3ml de una solución 1/10), y ambas rodillas (operada y control) se extrajeron mediante desarticulación de cadera y tobillo, dejando el fémur y la tibia unidos por todas las estructuras blandas, excepto la piel.
Procesamiento y análisis biomecánicoLos extremos proximales del fémur y distales de la tibia se prepararon para exponer el hueso cortical, preservando la cápsula posterior y los tejidos periarticulares hasta 1cm proximal y distal a la articulación. Las muestras se transportaron al laboratorio de biomecánica en suero fisiológico, y se evaluaron en un plazo máximo de 6horas. Los extremos óseos se fijaron con cemento de polimetilmetacrilato (PMMA; Stryker, Mahwah, NJ, EE.UU.) en jeringas de 5ml. La rodilla se acopló a un soporte impreso en 3D de ácido poliláctico (PLA), conectado a una célula de carga dinámica de 10Nm (Servosis Testing Machines, Madrid, España), para registrar el par aplicado a una velocidad constante de 1°/s hasta el fallo (fig. 1). Se prestó especial atención a alinear el eje de rotación de la rodilla con el eje de la máquina. Para cada rodilla se registró el ángulo de extensión pasiva espontánea (passive extensión angle [PEA]). La prueba biomecánica se realizó hasta que se produjo la rotura completa de la cápsula, generando una curva PEA (grados) - par (Nm). Los archivos digitales de cada curva se codificaron de forma ciega para los investigadores principales. A partir de las curvas se determinaron los valores de PEA a 2N·cm (PEA-2), 4N·cm (PEA-4) y 8N·cm (PEA-8), así como el PEA y el par en el punto de rotura capsular, definido como el primer pico de la curva con caída brusca de la resistencia torsional39,40.
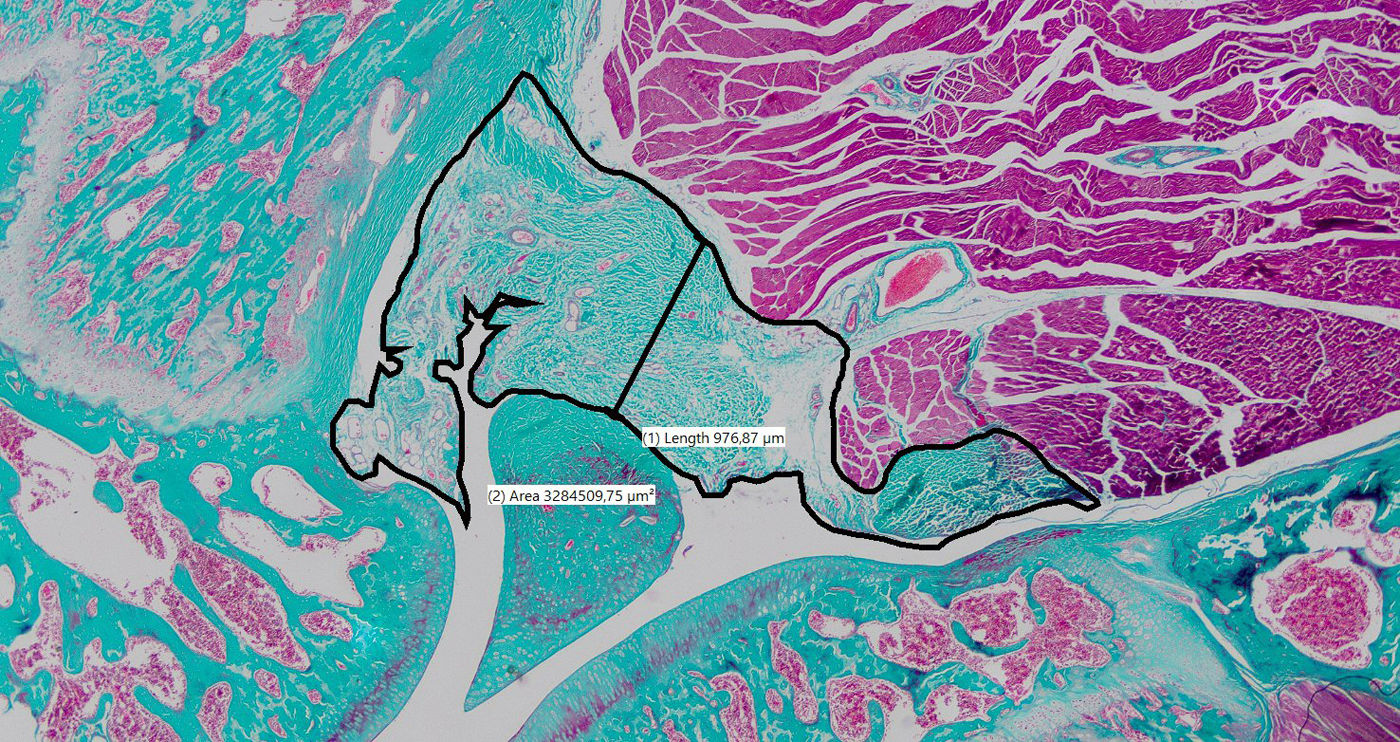
Procesamiento y análisis histológicoLas rodillas se fijaron inmediatamente en formalina tamponada al 10% y se enviaron al laboratorio de anatomía patológica de nuestra institución. Se realizó una disección liberando tejidos blandos y hueso hasta 1cm por encima y por debajo de la articulación, preservando la cápsula posterior. Las muestras se descalcificaron en ácido nítrico al 10%, se incluyeron en parafina y se seccionaron en plano parasagital, obteniendo cortes representativos de la región central y lateral de la articulación. Los cortes laterales se consideraron adecuados si se visualizaban el cuerno posterior del menisco, la meseta tibial y el cóndilo femoral. Los cortes centrales debían demostrar ambos ligamentos cruzados. Para cada rodilla, se realizaron tinciones con hematoxilina-eosina y tricrómico de Masson en ambas regiones, resultando en un total de 4 cortes teñidos por rodilla. Las imágenes se digitalizaron a 20× con un microscopio óptico (Zeiss, Alemania) y un sistema de captura de alta resolución. El grosor de la cápsula posterior se midió sobre una línea perpendicular al tendón rotuliano, cruzando lo más próximo posible al centro del espacio femorotibial41. El área de tejido capsular posterior se determinó mediante contorneado manual de sus límites (fig. 2).
Cálculo del tamaño muestral y análisis de datosEl análisis estadístico se realizó con el software SPSS 30.0 (IBM, Armonk, NY, EE.UU.). El tamaño muestral se calculó para el estudio biomecánico, considerando un error tipoI del 5%, una potencia del 80%, una diferencia mínima detectable de 20° y una DE de 15°. Con un ajuste por pérdida estimada del 10%, se determinó una muestra de 10 ratas por grupo. Dado que las rodillas no pueden reutilizarse para ambos análisis (biomecánico e histológico), se duplicó el tamaño muestral a 20 ratas: 10 para el análisis biomecánico y 10 para el histológico. Se evaluó la normalidad de las variables cuantitativas mediante la prueba de Shapiro-Wilk. Las variables con distribución normal se expresaron como media y DE; las de distribución no normal, como mediana y rango intercuartílico (RI). Para comparar características basales de la muestra, se usaron la prueba de chi-cuadrado o Fisher para variables cualitativas y t de Student o U de Mann-Whitney para variables cuantitativas independientes, según su distribución. Para variables pareadas se utilizó ANOVA de medidas repetidas, con corrección de Bonferroni cuando procedía. La capacidad del modelo para generar rigidez y fibrosis se evaluó comparando rodillas operadas y control mediante t de Student para muestras pareadas o test de Wilcoxon, según su distribución. Para comparar nuestros resultados con los de Owen, se calcularon intervalos de confianza del 95% (IC95%) a partir del error estándar, para las variables comunes a ambos estudios (biomecánicas: PEA-2, PEA-4, PEA-8; histológicas: área y grosor de la cápsula posterior), siguiendo los principios de la inferencia estadística. Los datos del estudio de Owen fueron extraídos de su publicación original. Para comparar la variabilidad entre muestras, se analizaron el cociente entre errores estándar (SE0:SE1) y el coeficiente de variación (CV) de cada medida. Por último, se realizó un análisis de curva ROC (Receiver Operating Characteristic) para evaluar la sensibilidad y la especificidad de los métodos cuantitativos empleados, determinando el área bajo la curva (area under the curve [AUC]) y el valor umbral óptimo mediante el índice de Youden. El nivel de significación estadística se fijó en p<0,05.
ResultadosSeguimiento: ganancia de peso y pérdidasTodas las ratas aumentaron de peso adecuadamente después de cada cirugía (tabla 1). Una rata murió durante la primera semana debido al sobrecrecimiento de incisivos, lo que dificultó la alimentación. Se excluyeron 5 rodillas adicionales (3 operadas y 2 de control) debido a problemas durante el procesamiento y análisis biomecánico o durante la fijación histológica. Esto resultó en una pérdida total de 7 rodillas durante el estudio (17,5%). Tres animales (15%) presentaron fallos de inmovilización al momento de su retiro, en forma de rotura o aflojamiento del nudo de la sutura. Estos animales no fueron excluidos y se realizó un análisis por intención de tratar. Los tres fallos ocurrieron en rodillas con menos de 140° de flexión al momento de la cirugía índice (p=0,036).
Aumento de peso durante el experimento
| Cirugía inicial | Retirada de la inmovilización | Eutanasia | ||
|---|---|---|---|---|
| Día 0 | Semana 4 | Semana 8 | Valor p (2gl) | |
| Peso (gramos) | 305,1 (DE 31,5) | 324,5 (DE 18,9) | 363,9 (DE 18,5) | p=0,001a |
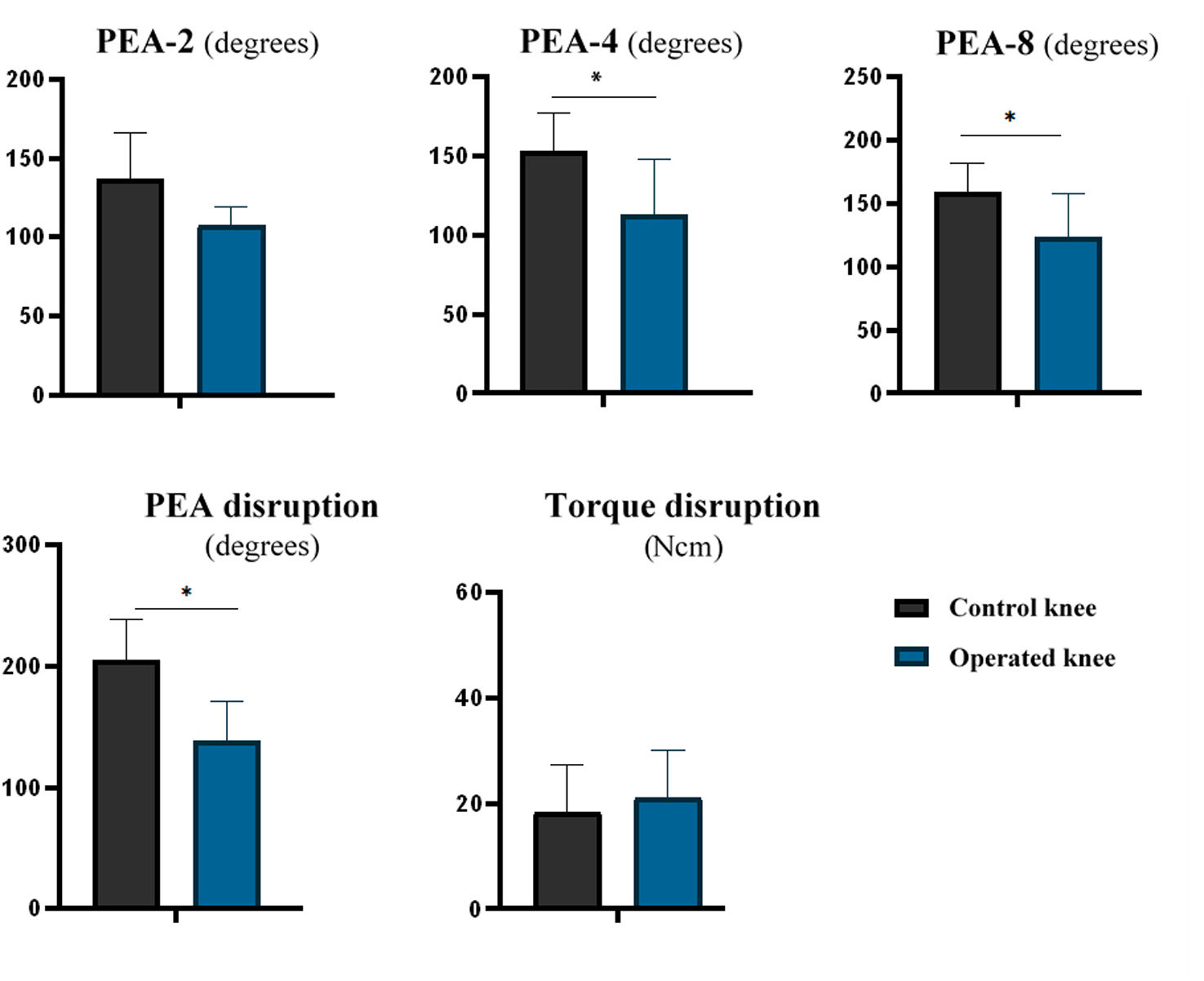
Las rodillas operadas presentaron menores valores de PEA-4 (diferencia media: 40,6° [IC95%: 12,2 a 69,0; p=0,011]) y PEA-8 (diferencia media: 45,6° [IC95%: 13,43 a 77,45; p=0,044]) en comparación con las rodillas de control. Sin embargo, no hubo diferencias estadísticamente significativas para PEA-2 (diferencia media: 28,3° [IC95%: −4,6 a 61,1; p=0,082]). Las rodillas operadas presentaron menor PEA al momento de la rotura capsular que las de control (mediana: operada=138,1° [RI: 33,4] vs. control=204,6° [RI: 33,6]; p=0,043). No se observaron diferencias en el par de torsión al momento de la rotura capsular (diferencia media: 2,75N·cm [IC95%: −14,10 a 8,59; p=0,588]) (tabla 2 y fig. 3).
Resultados biomecánicos
| Rodilla operada | Rodilla control | ||
|---|---|---|---|
| PEA-2 (grados) | 136,7 (DE 29,5) | 107,5 (DE 11,6) | p=0,065 |
| PEA-4 (grados) | 153,4 (DE 24,0) | 112,8 (DE 35,2) | p=0,011 |
| PEA-8 (grados) | 159,1 (DE 22,6) | 123,7 (DE 34,0) | p=0,044 |
| PEA rotura (grados) | 204,6 (IR 33,6) | 138,1 (IR 33,4) | p=0,043 |
| Par de torsión rotura (N·cm) | 18,4 (DE 8,9) | 21,2 (DE 8,9) | p=0,588 |
Los valores se presentan como media y desviación estándar (DE) o mediana y rango intercuartílico (RI).
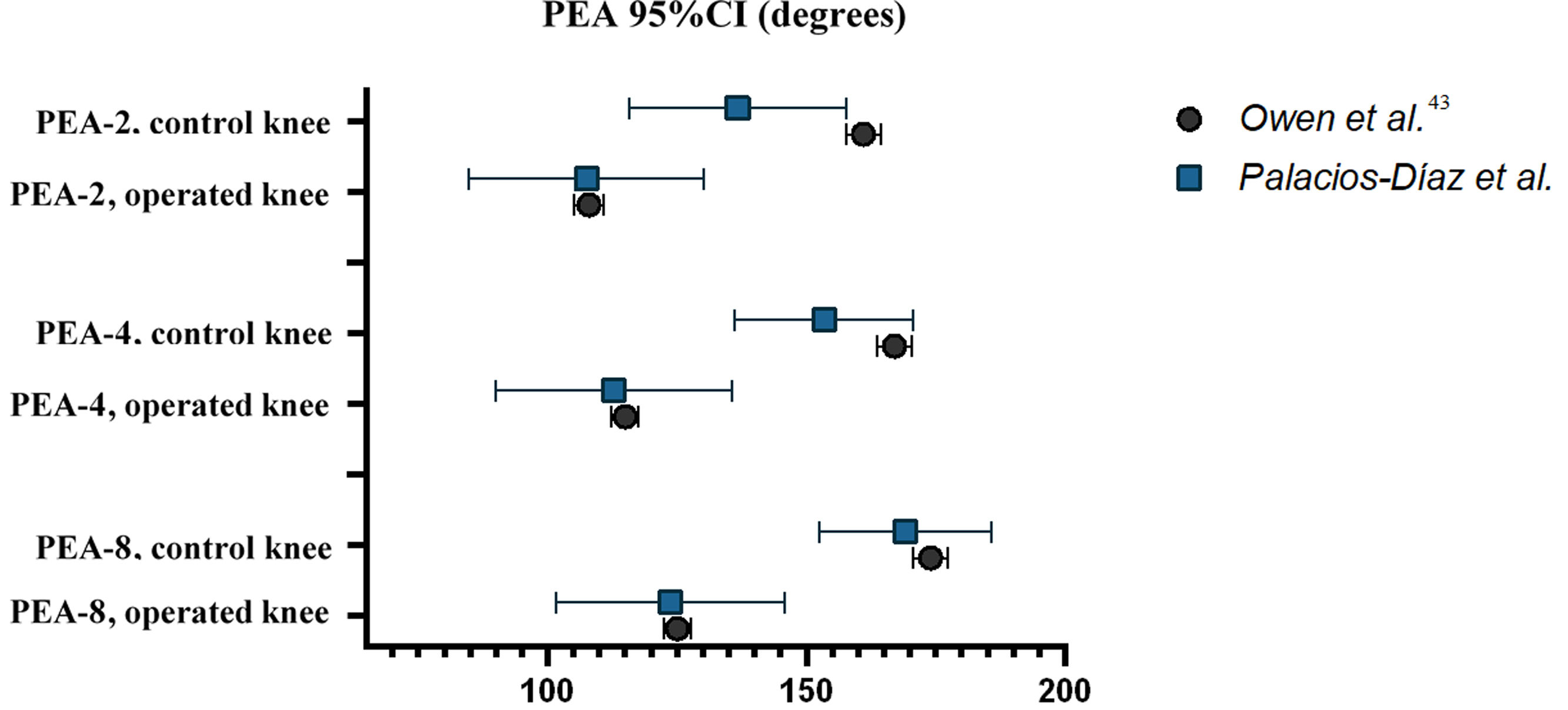
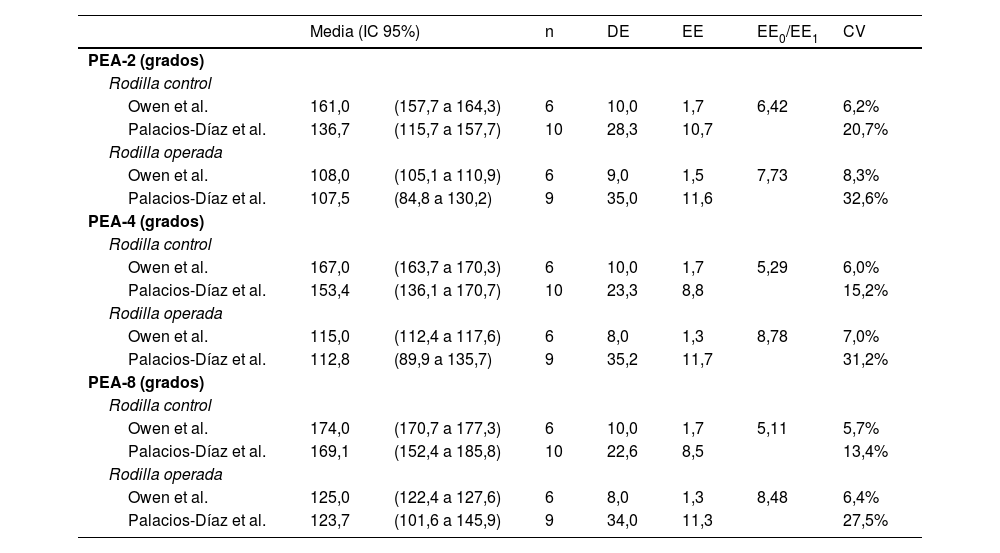
Los valores medios de PEA-2, PEA-4 y PEA-8 para las rodillas operadas y de control en nuestra muestra son similares a los publicados por Owen et al. Además, todos los IC95% de nuestra muestra incluyen los IC95% de la muestra de Owen et al., excepto el límite superior de PEA-2 en rodillas de control. Sin embargo, el error estándar de nuestra muestra (SE0) es mayor que el publicado por Owen et al. (SE1), con una media del cociente SE0/SE1 de 6,97 (rango: 5,11 a 8,78), y el coeficiente de variación medio (CV0: 23,4%) es también mayor que el de la muestra de Owen et al. (CV1: 6,6%), reflejando una mayor variabilidad en nuestras mediciones biomecánicas (tabla 3 y fig. 4).
Reproducibilidad de los resultados biomecánicos
| Media (IC 95%) | n | DE | EE | EE0/EE1 | CV | ||
|---|---|---|---|---|---|---|---|
| PEA-2 (grados) | |||||||
| Rodilla control | |||||||
| Owen et al. | 161,0 | (157,7 a 164,3) | 6 | 10,0 | 1,7 | 6,42 | 6,2% |
| Palacios-Díaz et al. | 136,7 | (115,7 a 157,7) | 10 | 28,3 | 10,7 | 20,7% | |
| Rodilla operada | |||||||
| Owen et al. | 108,0 | (105,1 a 110,9) | 6 | 9,0 | 1,5 | 7,73 | 8,3% |
| Palacios-Díaz et al. | 107,5 | (84,8 a 130,2) | 9 | 35,0 | 11,6 | 32,6% | |
| PEA-4 (grados) | |||||||
| Rodilla control | |||||||
| Owen et al. | 167,0 | (163,7 a 170,3) | 6 | 10,0 | 1,7 | 5,29 | 6,0% |
| Palacios-Díaz et al. | 153,4 | (136,1 a 170,7) | 10 | 23,3 | 8,8 | 15,2% | |
| Rodilla operada | |||||||
| Owen et al. | 115,0 | (112,4 a 117,6) | 6 | 8,0 | 1,3 | 8,78 | 7,0% |
| Palacios-Díaz et al. | 112,8 | (89,9 a 135,7) | 9 | 35,2 | 11,7 | 31,2% | |
| PEA-8 (grados) | |||||||
| Rodilla control | |||||||
| Owen et al. | 174,0 | (170,7 a 177,3) | 6 | 10,0 | 1,7 | 5,11 | 5,7% |
| Palacios-Díaz et al. | 169,1 | (152,4 a 185,8) | 10 | 22,6 | 8,5 | 13,4% | |
| Rodilla operada | |||||||
| Owen et al. | 125,0 | (122,4 a 127,6) | 6 | 8,0 | 1,3 | 8,48 | 6,4% |
| Palacios-Díaz et al. | 123,7 | (101,6 a 145,9) | 9 | 34,0 | 11,3 | 27,5% | |
CV: coeficiente de variación; DE: desviación estándar; EE0: error estándar de nuestra muestra; EE1: error estándar de la muestra de Owen et al.; n: tamaño de la muestra.
Intervalos de confianza del 95% calculados utilizando el error estándar de la media para PEA-2, PEA-4 y PEA-8 del estudio original de Owen et al. y nuestro estudio (referido como Palacios-Díaz et al.).
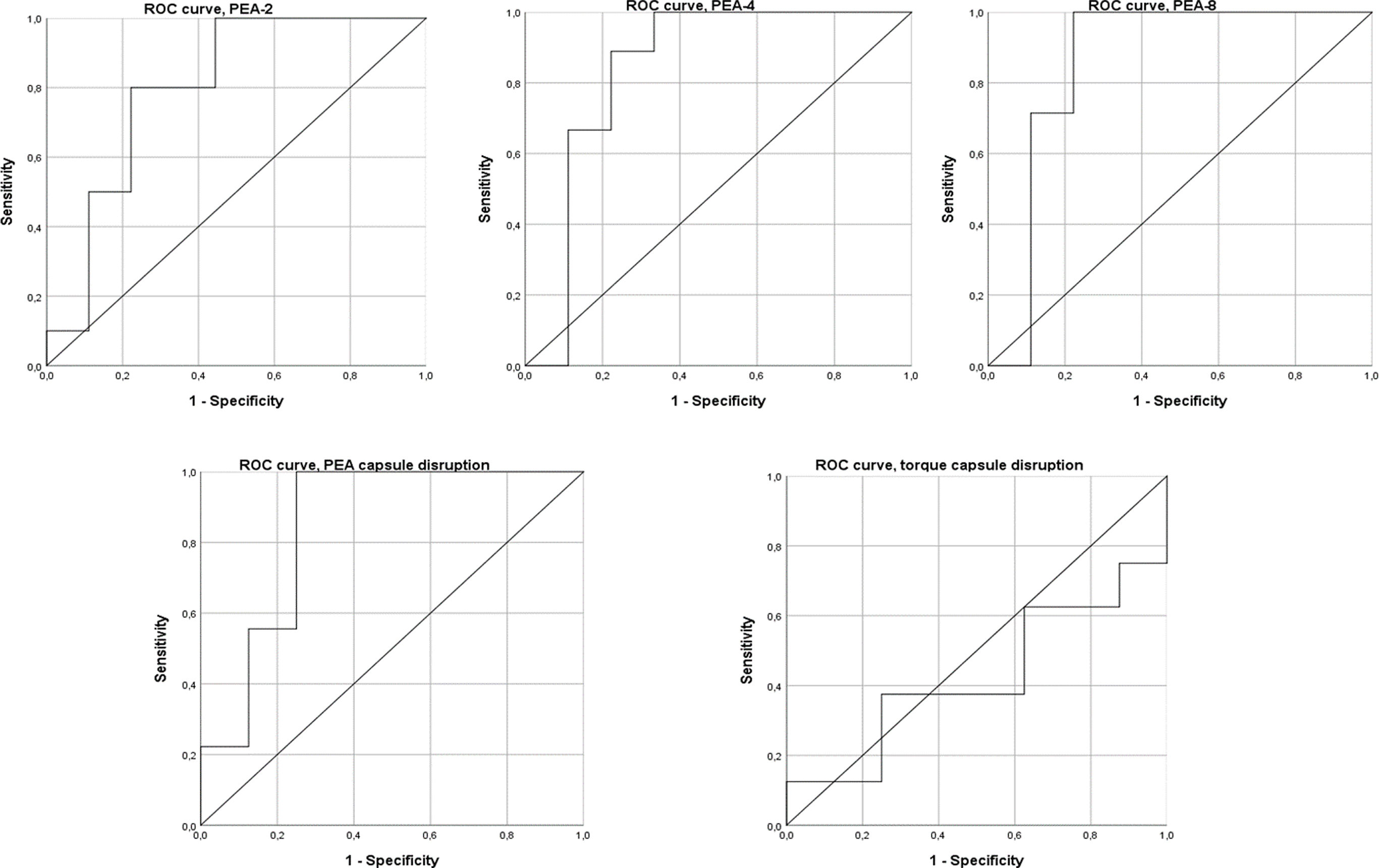
El análisis de la curva ROC demuestra que PEA-4, PEA-8 y PEA en la rotura capsular pueden considerarse buenos predictores de artrofibrosis, y que PEA-2 es un predictor aceptable. Sin embargo, el par de torsión en la rotura capsular no tuvo capacidad discriminativa. PEA-2 demostró un AUC de 0,76 (IC95%: 0,52 a 1,00), con un umbral de 103,1° que ofrece 100% de sensibilidad y 55,6% de especificidad. PEA-4 presentó un AUC de 0,83 (IC95%: 0,60 a 1,00), con un umbral de 115,5° que ofrece 100% de sensibilidad y 66,7% de especificidad. PEA-8 tuvo el mayor valor predictivo con un AUC de 0,86 (IC95%: 0,64 a 1,00), y un umbral de 133,60° con 100% de sensibilidad y 88,9% de especificidad. PEA en la rotura capsular demostró un AUC de 0,85 (IC95%: 0,64 a 1,00), con un umbral de 155,8° que ofreció 100% de sensibilidad y 75,0% de especificidad. El torque en la rotura capsular demostró un AUC de 0,53 (IC95%: 0,21 a 0,85) (fig. 5).
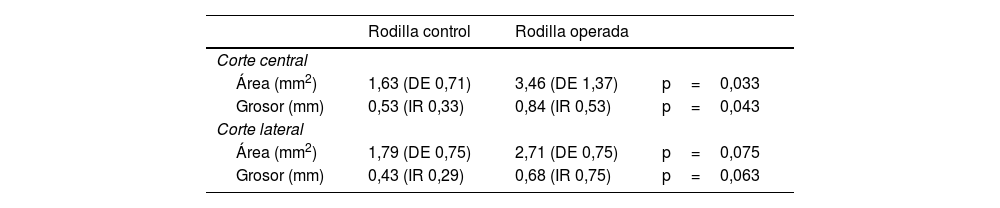
Resultados histológicosLas rodillas operadas demostraron un área mayor de la cápsula posterior en comparación con las rodillas de control al evaluar el corte central (diferencia media: 1,82mm2 [IC95%: 0,21 a 3,44; p=0,033]). Sin embargo, no hubo diferencias significativas al evaluar el corte lateral (diferencia media: 9,16mm2 [IC95%: −0,12 a 1,96; p=0,075]). Las rodillas operadas demostraron un mayor grosor de la cápsula posterior que las de control en el corte central (mediana: operadas=0,84mm [RI: 0,53] vs. control=0,53mm [RI: 0,33]; p=0,043). No obstante, las diferencias no fueron significativas en el corte lateral (mediana: operadas=0,68mm [RI: 0,75] vs. control=0,43mm [RI: 0,29]; p=0,063) (tabla 4 y fig. 6).
Resultados histológicos
| Rodilla control | Rodilla operada | ||
|---|---|---|---|
| Corte central | |||
| Área (mm2) | 1,63 (DE 0,71) | 3,46 (DE 1,37) | p=0,033 |
| Grosor (mm) | 0,53 (IR 0,33) | 0,84 (IR 0,53) | p=0,043 |
| Corte lateral | |||
| Área (mm2) | 1,79 (DE 0,75) | 2,71 (DE 0,75) | p=0,075 |
| Grosor (mm) | 0,43 (IR 0,29) | 0,68 (IR 0,75) | p=0,063 |
Los valores se presentan como media y desviación estándar (DE) o mediana y rango intercuartílico (RI).
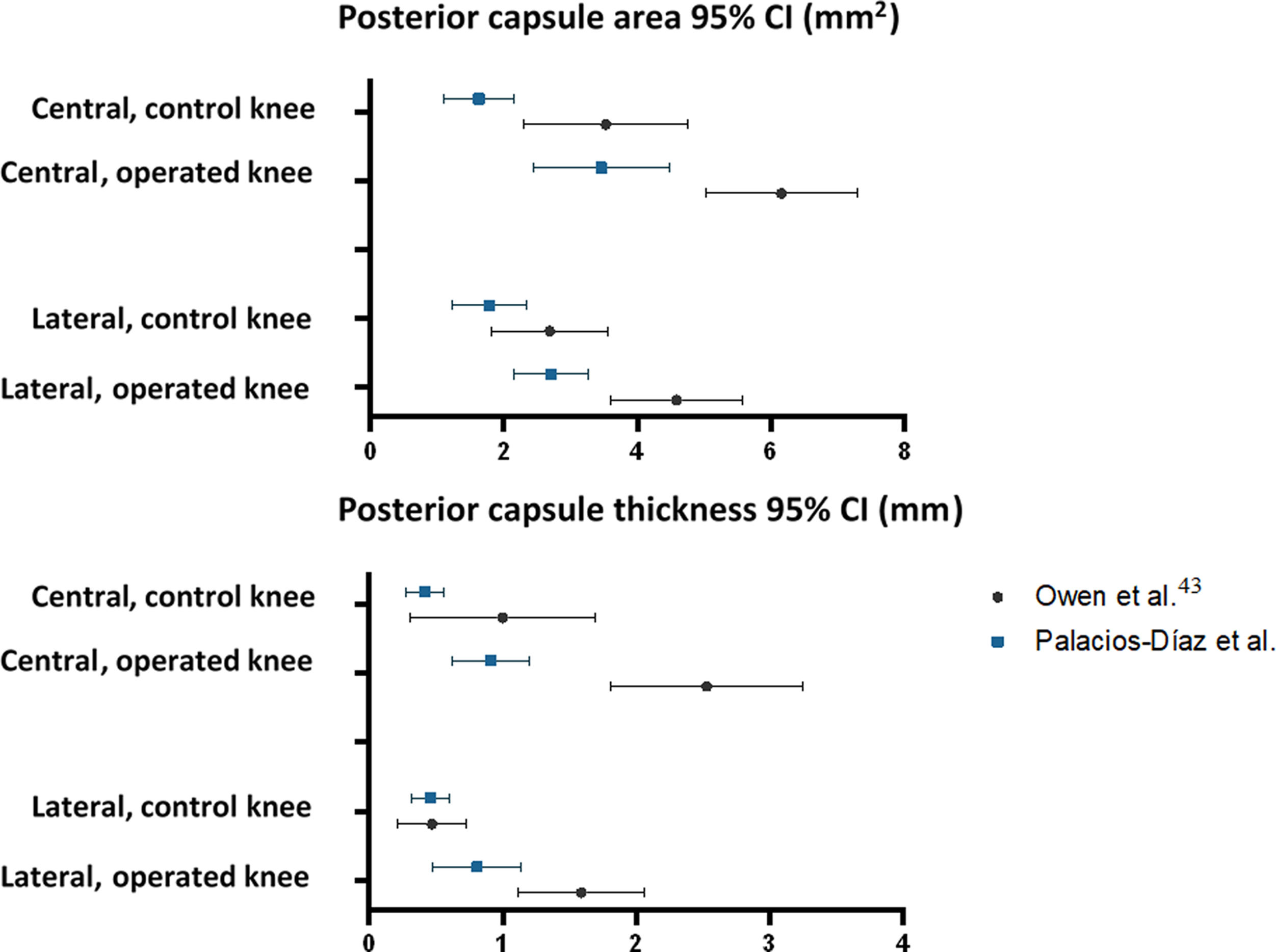
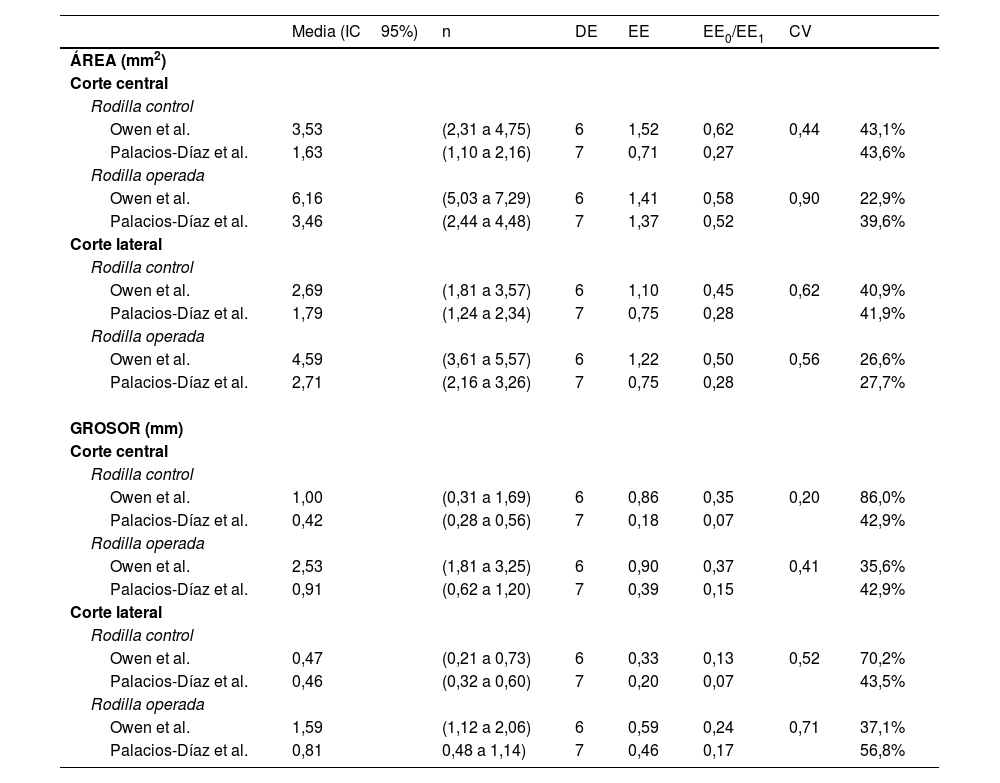
El área media de la cápsula posterior y su grosor en los cortes central y lateral de las rodillas operadas y de control de nuestra muestra no coinciden generalmente con lo publicado por Owen et al. De los ocho pares posibles de IC95%, solo uno (grosor del corte lateral en rodillas de control) demostró superposición completa entre el estudio de Owen et al. y el nuestro. En tres casos hubo alguna superposición, y en los cuatro restantes no hubo ninguna. No obstante, el error estándar de nuestra muestra (SE0) fue menor al publicado por Owen et al. (SE1), con una razón media SE0/SE1 de 0,54 (rango: 0,20 a 0,90), y el CV0 fue menor (42,3% vs. 45,3%), reflejando menor variabilidad en nuestras mediciones histológicas (tabla 5 y fig. 7).
Reproducibilidad de los resultados histológicos
| Media (IC95%) | n | DE | EE | EE0/EE1 | CV | ||
|---|---|---|---|---|---|---|---|
| ÁREA (mm2) | |||||||
| Corte central | |||||||
| Rodilla control | |||||||
| Owen et al. | 3,53 | (2,31 a 4,75) | 6 | 1,52 | 0,62 | 0,44 | 43,1% |
| Palacios-Díaz et al. | 1,63 | (1,10 a 2,16) | 7 | 0,71 | 0,27 | 43,6% | |
| Rodilla operada | |||||||
| Owen et al. | 6,16 | (5,03 a 7,29) | 6 | 1,41 | 0,58 | 0,90 | 22,9% |
| Palacios-Díaz et al. | 3,46 | (2,44 a 4,48) | 7 | 1,37 | 0,52 | 39,6% | |
| Corte lateral | |||||||
| Rodilla control | |||||||
| Owen et al. | 2,69 | (1,81 a 3,57) | 6 | 1,10 | 0,45 | 0,62 | 40,9% |
| Palacios-Díaz et al. | 1,79 | (1,24 a 2,34) | 7 | 0,75 | 0,28 | 41,9% | |
| Rodilla operada | |||||||
| Owen et al. | 4,59 | (3,61 a 5,57) | 6 | 1,22 | 0,50 | 0,56 | 26,6% |
| Palacios-Díaz et al. | 2,71 | (2,16 a 3,26) | 7 | 0,75 | 0,28 | 27,7% | |
| GROSOR (mm) | |||||||
| Corte central | |||||||
| Rodilla control | |||||||
| Owen et al. | 1,00 | (0,31 a 1,69) | 6 | 0,86 | 0,35 | 0,20 | 86,0% |
| Palacios-Díaz et al. | 0,42 | (0,28 a 0,56) | 7 | 0,18 | 0,07 | 42,9% | |
| Rodilla operada | |||||||
| Owen et al. | 2,53 | (1,81 a 3,25) | 6 | 0,90 | 0,37 | 0,41 | 35,6% |
| Palacios-Díaz et al. | 0,91 | (0,62 a 1,20) | 7 | 0,39 | 0,15 | 42,9% | |
| Corte lateral | |||||||
| Rodilla control | |||||||
| Owen et al. | 0,47 | (0,21 a 0,73) | 6 | 0,33 | 0,13 | 0,52 | 70,2% |
| Palacios-Díaz et al. | 0,46 | (0,32 a 0,60) | 7 | 0,20 | 0,07 | 43,5% | |
| Rodilla operada | |||||||
| Owen et al. | 1,59 | (1,12 a 2,06) | 6 | 0,59 | 0,24 | 0,71 | 37,1% |
| Palacios-Díaz et al. | 0,81 | 0,48 a 1,14) | 7 | 0,46 | 0,17 | 56,8% |
CV: coeficiente de variación; DE: desviación estándar; EE0: error estándar de nuestra muestra; EE1: error estándar de la muestra de Owen et al.; n: tamaño de la muestra.
Intervalos de confianza del 95% calculados utilizando el error estándar de la media para el área y el grosor de la cápsula posterior del estudio original de Owen et al. y nuestro estudio (referido como Palacios-Díaz et al.).
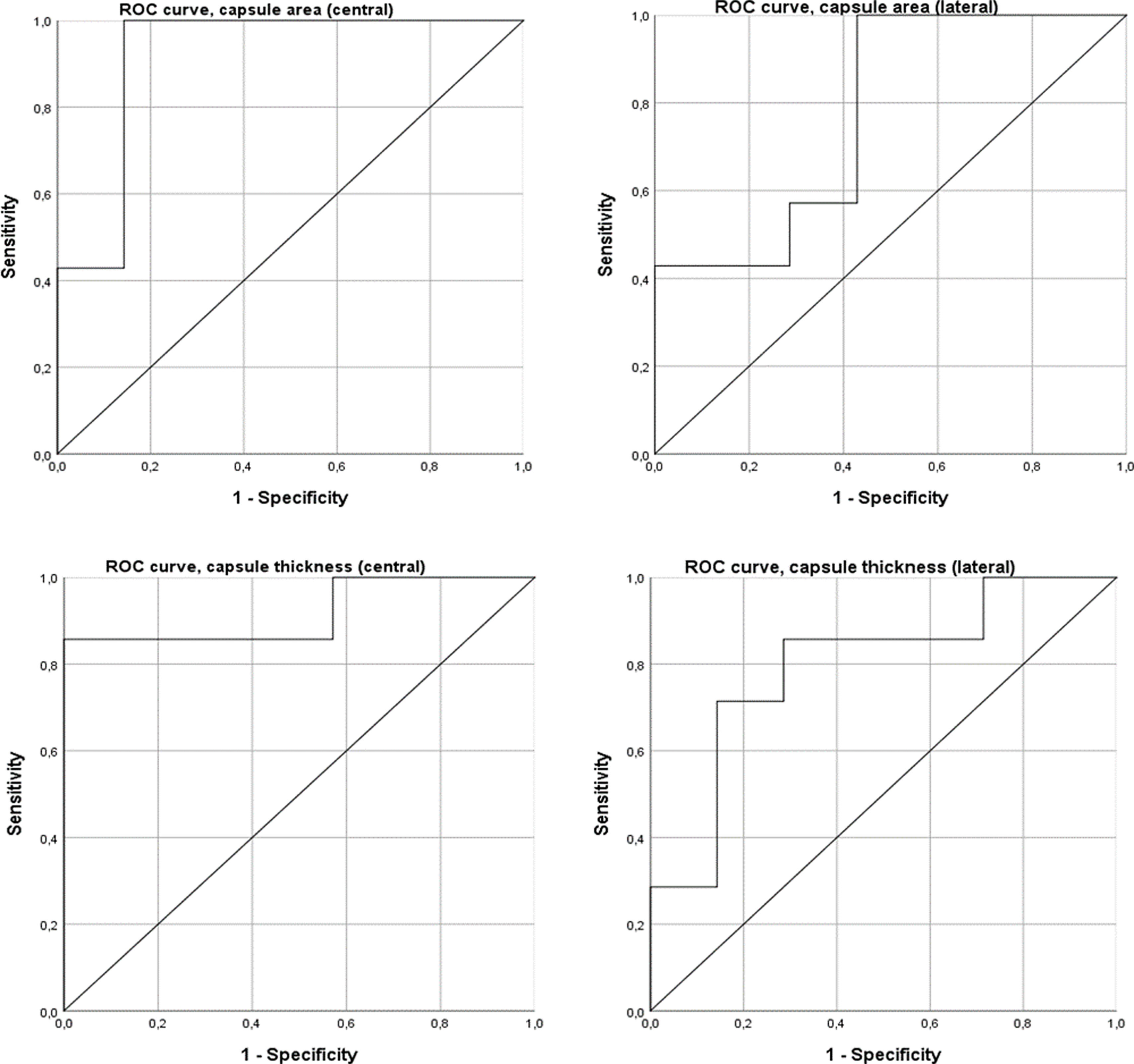
El análisis de curva ROC demostró que el área y el grosor de la cápsula posterior en el corte central pueden clasificarse como predictores excelentes de artrofibrosis, mientras que el área y el grosor en el corte lateral pueden clasificarse como predictores aceptables. El área de la cápsula posterior en el corte central presentó un AUC de 0,92 (IC95%: 0,75 a 1,00), con un umbral de 1,89mm2 que ofreció 100% de sensibilidad y 85,7% de especificidad. El grosor de la cápsula posterior en el corte central demostró un AUC de 0,92 (IC95%: 0,75 a 1,00), con un umbral de 0,61mm que ofreció 85,7% de sensibilidad y 100% de especificidad. El área de la cápsula posterior en el corte lateral demostró un AUC de 0,78 (IC95%: 0,52 a 1,00) y el grosor en esta misma sección tuvo un AUC de 0,79 (IC95%: 0,55 a 1,00) (fig. 8).
DiscusiónLos principales hallazgos de nuestro estudio son que las rodillas operadas presentaron un menor ángulo de extensión pasiva en distintos niveles (PEA-4, PEA-8 y PEA en la rotura capsular) y una mayor área y grosor de la cápsula posterior en comparación con las rodillas control. Además, los valores medios obtenidos en nuestra serie para PEA-2, PEA-4 y PEA-8 fueron comparables a los de Owen et al.
Según la evidencia derivada de los modelos de conejo más utilizados, consideramos que el modelo más adecuado para la evaluación de fármacos en la artrofibrosis postraumática debe incluir una lesión articular severa, incorporar períodos de inmovilización y libre movilidad, y evaluar los resultados biomecánicos bajo torques estandarizados, así como los resultados histológicos mediante mediciones cuantitativas17,19,23-26.
Una lesión articular severa que incluya un procedimiento quirúrgico abierto para inducir una lesión ósea directa y una lesión indirecta de la cápsula articular, seguida de un período de inmovilización, promueve una pérdida permanente de movilidad articular y se asemeja estrechamente a la fisiopatología de la artrofibrosis postraumática en humanos17,19,24,26. En cambio, los modelos no traumáticos o de lesiones leves provocan rigidez articular que revierte hasta la normalidad tras el periodo de libre movilidad, dificultando así demostrar diferencias significativas en estudios comparativos2,17,18,23,24,42,43. El modelo descrito por Owen et al. induce una lesión severa, cumpliendo todos estos criterios. Además, tanto sus resultados como los nuestros avalan su validez: provoca rigidez biomecánica y fibrosis capsular histológica que no se resuelve tras un período prolongado de libre movilidad.
Algunos estudios han empleado un período de inmovilización de 8semanas, lo que respalda la idea de que ese es el pico de producción de tejido fibroso44-52. En el estudio de Owen et al. se logró artrofibrosis articular permanente utilizando dos períodos de inmovilización distintos: 4 y 8semanas25. En nuestro estudio, validamos el modelo de 4semanas basándonos en la evidencia de que la expresión máxima de miofibroblastos en la cápsula articular ocurre a las 2semanas del trauma22. Además, estudios previos en ratas utilizando un período de inmovilización de 4semanas han logrado inducir una rigidez articular severa y permanente19,43. Tanto en nuestro estudio como en el original, se logró inducir exitosamente una rigidez biomecánica severa y fibrosis capsular histológica, con sensibilidad suficiente para diferenciarlas del tejido sano con solo 4semanas de inmovilización. Esto también permite una mayor relación coste-efectividad en comparación con períodos más largos y mejora el bienestar animal al refinar el procedimiento experimental.
En el estudio original, la aguja de Kirschner utilizada en modelos previos fue reemplazada por una sutura de acero inoxidable 2.0 atada alrededor del fémur y la tibia, eliminando así el riesgo de fractura asociado con el túnel tibial17,25. En 2023, Dagneaux et al.38 demostraron la inducción de rigidez articular severa en ratones utilizando un nuevo método de inmovilización percutánea con sutura de polipropileno no absorbible 3.0 alrededor del fémur y la tibia. Una diferencia clave entre nuestro estudio y el de Owen et al. radica en la adopción del método de inmovilización de Dagneaux et al.38, en sustitución del protocolo original. Las principales ventajas de este método son que reduce costes y evita la incisión lateral adicional del procedimiento de Owen et al., refinando el modelo animal y evitando una cicatriz extra que podría actuar como factor de confusión. Nuestros resultados, junto con los de otros autores, confirman la efectividad de este método percutáneo, ya que la rigidez articular generada es severa y claramente distinguible de los controles53. Sorprendentemente, el riesgo de rotura de la sutura de polipropileno parece ser menor que el de la sutura de acero inoxidable, según la literatura y nuestros resultados25,38,53. Además, en nuestro estudio la rotura de la sutura se asoció a un ángulo de inmovilización insuficiente, lo que sugiere que asegurar una inmovilización en flexión completa podría prevenir esta complicación. Dagneaux et al.38 reportaron una incidencia del 4,2% de necrosis del pie como principal complicación en ratones. Esto no se observó en nuestro estudio, lo que podría deberse al mayor tamaño de las ratas comparado con los ratones.
Los modelos validados en conejos utilizan un torque estandarizado de 20N·cm para medir el PEA17,23,24. Sin embargo, dicha estandarización aún no se ha implementado en modelos de rata, siendo esto un aspecto fundamental. Varios estudios en ratas han demostrado que utilizar torques de 2, 3,5 o 4N·cm permite diferenciar articulaciones operadas de las no operadas26. En este sentido, los torques utilizados en nuestro estudio —2, 4 y 8N·cm— son los mismos que en el estudio original, y representan un rango que expone los miembros control desde rangos fisiológicos (0-170°) hasta suprafisiológicos (>170°), habiéndose demostrado diferencias estadísticamente significativas entre las articulaciones experimentales y de control, excepto con 2N·cm en nuestro estudio25. Usar un torque de 8N·cm parece ser el más adecuado, ya que ha demostrado la mayor capacidad predictiva en ambos estudios25.
En nuestro estudio también se midió tanto el PEA como el torque en el punto de rotura de la cápsula posterior39,40. El PEA en la rotura fue menor en las rodillas operadas, lo que refuerza la capacidad del modelo para inducir rigidez. Sin embargo, los tejidos rígidos y fibrosos, al ser menos fisiológicos, también pueden ser más frágiles y requerir menos fuerza para romperse, lo cual podría haber disminuido nuestra sensibilidad para detectar diferencias en el par de torsión. Más allá del valor exacto del par de torsión, creemos que analizar las curvas en puntos de corte predeterminados brinda una visión más completa y detallada del comportamiento mecánico y la rigidez articular.
La mayor variabilidad de nuestros resultados biomecánicos podría explicarse por diferencias metodológicas respecto al estudio de Owen et al. Dado que tanto las rodillas operadas como las de control se ven afectadas, las diferencias no serían atribuibles a la inmovilización mediante sutura de polipropileno en lugar de acero. Por lo tanto, la falta de precisión en las mediciones biomecánicas parece ser la principal fuente de variabilidad. La máquina utilizada por Owen et al. fue diseñada por ingenieros del Biomechanics Lab Core Facility de la Mayo Clinic (Minnesota, EE.UU.), mientras que la nuestra fue fabricada por Servosis (Madrid, España)25. Esta diferencia podría explicar la disparidad en precisión. Además, en el estudio original la rodilla se fijaba directamente a una pieza metálica, mientras que en nuestro caso se utilizó un soporte impreso en 3D de ácido poliláctico (PLA), un bioplástico con mayor deformación que el metal, lo cual también podría haber influido54. A pesar de esta variabilidad, se encontraron diferencias estadísticamente significativas, lo que respalda la validez del modelo experimental.
En el estudio de Owen et al., los cortes centrales demostraron la mejor capacidad predictiva25. Nuestros resultados respaldan esta observación, ya que solo en esos cortes se observaron diferencias entre las rodillas operadas y no operadas. Por tanto, el corte sagital central, fácilmente identificable por los ligamentos cruzados, debe considerarse la principal sección histológica para evaluar fibrosis capsular posterior25. En el estudio original, los cortes mediales desarrollaron menos fibrosis en comparación con los centrales y laterales. La causa no está clara, pero la combinación de la artrotomía parapatelar lateral y la respuesta inflamatoria del traumatismo intraarticular podría generar una reacción más intensa en las zonas capsulares central y lateral. Por ello, y para reducir costos, decidimos no incluir las secciones mediales.
Para lograr mayor precisión y reproducibilidad en la evaluación del tejido fibroso, el estudio original empleó mediciones histológicas cuantitativas y objetivas, en lugar de enfoques cualitativos o semicuantitativos. Además, estudios previos se han limitado a mediciones lineales en un corte sagital18,19. En el estudio de Owen et al., las mediciones lineales (espesor capsular posterior) demostraron diferencias, pero su capacidad predictiva fue menor que la de las mediciones bidimensionales (área capsular posterior), según las curvas ROC, ofreciendo mayor sensibilidad y especificidad25. En nuestra muestra no se observaron tales diferencias, ya que tanto el área como el espesor en cortes centrales mostraron excelente capacidad predictiva. En cambio, las mediciones en el corte lateral mostraron menor capacidad predictiva, sin diferencias entre rodillas operadas y no operadas. Esto puede deberse a una mayor variabilidad al medir el corte lateral, ya que resulta difícil distinguir los límites entre el borde posterior del menisco lateral y la cápsula posterior, al ser esta una extensión capsular55,56. Se necesitan más estudios para refinar esta medición con una definición más objetiva.
A pesar de una mayor precisión en las mediciones histológicas en nuestro estudio (en cortes centrales y laterales), no pudimos demostrar la reproducibilidad de estas variables: los intervalos de confianza entre ambos estudios difieren considerablemente. Creemos que se requiere una mayor estandarización del procesamiento histológico y del método de medición. Por ejemplo, los límites de la cápsula deben definirse con claridad. Además del menisco lateral, debe establecerse con precisión el límite entre la membrana fibrosa de la cápsula y su continuidad con la membrana perióstica. También, estudios previos han establecido un ángulo de 90° de flexión para el procesamiento de las muestras, lo cual permitiría un pliegue más homogéneo de tejidos blandos como la cápsula30,57.
En nuestro estudio la mortalidad animal fue baja, aunque la pérdida total de extremidades fue algo superior a la reportada globalmente en modelos preclínicos de artrofibrosis postraumática26. No obstante, el procedimiento se considera seguro, ya que las ratas ganaron peso adecuadamente tras la cirugía y no se registraron muertes intraoperatorias, a diferencia de la pérdida global del 12% por fracturas o anestesia. La pérdida de extremidades durante el procesamiento o las mediciones fue algo mayor en nuestro estudio (aunque cercana al 10%), principalmente debido a fracturas durante las pruebas biomecánicas, errores histológicos o valores extremos atípicos26. Estas complicaciones son frecuentes en la experimentación animal58,59.
Otra limitación de nuestro estudio es que no evaluamos la integridad del cartílago articular. Owen et al. demostraron la presencia de cambios degenerativos en el cartílago de las rodillas operadas, lo que podría confundir los resultados relacionados con la investigación de la artrofibrosis25 Este parece ser un fenómeno que ocurre en ratas, pero no en otros modelos animales, posiblemente porque las ratas cargan peso en la extremidad lesionada desde el postoperatorio inmediato. Aunque esto no excluye su uso, debe considerarse cuidadosamente al interpretar los resultados60,61.
Este trabajo tiene unas limitaciones y fortalezas que deben enumerarse. Como limitaciones, destaca la mayor variabilidad observada en los resultados biomecánicos en comparación con estudios previos, probablemente atribuible a diferencias metodológicas en los dispositivos de medición y los materiales utilizados para la fijación de la extremidad. Además, no se evaluó la integridad del cartílago articular, lo cual podría representar un factor de confusión relevante en la interpretación de los hallazgos. Tampoco se incluyeron cortes histológicos mediales, y no se logró demostrar la reproducibilidad de las mediciones histológicas, lo que se podría achacar a la falta de estandarización en el procesamiento y en la definición de los límites de la cápsula. La pérdida de extremidades durante el estudio, aunque esperada en este tipo de modelos, fue ligeramente superior a lo publicado en la literatura. A pesar de las limitaciones, nuestros resultados muestran que el modelo de artrofibrosis postraumática descrito por Owen et al. tiene la capacidad de inducir rigidez biomecánica (evaluada como PEA-4, PEA-8 y PEA en la rotura capsular) incluso después de la libre movilidad. Además, la fibrosis capsular histológica fue diferente entre la rodilla operada y de control, tanto en una dimensión (espesor) como en dos (área) al evaluar la sección central. La adopción del método de inmovilización percutánea descrito por Dagneaux et al.38 representa una mejora técnica que reduce costes, evita una incisión adicional y refina el modelo animal. Pese a la mayor variabilidad en los resultados biomecánicos, nuestros hallazgos son comparables a los de Owen, apoyando la reproducibilidad del modelo desde el punto de vista biomecánico.
Favorecemos un modelo de artrofibrosis postraumática en ratas que incluye una lesión articular grave, un procedimiento de inmovilización percutánea durante un período de 4semanas, la fijación de la extremidad a la máquina biomecánica directamente sobre una pieza metálica, un análisis biomecánico en puntos de corte de torque predeterminados —especialmente a 8N·cm— y la evaluación de cortes histológicos centrales mediante mediciones bidimensionales, como el área de la cápsula posterior. Creemos que se requiere una mayor estandarización del procesamiento y de los métodos de medición histológicos.
ConclusiónEl modelo de artrofibrosis postraumática descrito por Owen et al. es válido al inducir rigidez biomecánica y fibrosis capsular histológica persistente. La adopción del método de inmovilización percutánea propuesto por Dagneaux et al. representa una mejora significativa, ya que contribuye a refinar el modelo animal. Nuestros resultados confirman que este modelo es reproducible desde el punto de vista biomecánico, lo que refuerza su utilidad en la investigación preclínica de la artrofibrosis postraumática.
Nivel de evidenciaNivel de evidencia V.
FinanciaciónEste proyecto fue financiado por la 17.ª Beca de Investigación Básica SECEC 2023 (Société Européenne pour la Chirurgie de l’Épaule et du Coude [SECEC]) y por la Ayuda para Proyectos de Investigación en Cirugía Ortopédica y Traumatología 2024 de la Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT).
Consideraciones éticasInvestigación aprobada por el Comité de Ética del hospital. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.