Actualmente yano se pone en duda que la administración profilácticade antibióticos en determinados tipos de cirugíaortopédica y traumatológica, resulta una herramientade extraordinaria importancia en la prevención de lainfección quirúrgica (IQ). En un metanálisispublicado recientemente20 se señalaba, una vezanalizados 12 estudios, que la profilaxis es capaz de prevenir el56% de las infecciones en promedio y que reduce la tasa deinfección profunda un 47%. No obstante, muchos de losmatices inherentes a esta práctica preventiva no han sidoaclarados definitivamente. Por ejemplo, siguen existiendo dudassobre el tipo de intervenciones subsidiarias de profilaxis, sobreel tipo de antibiótico a administrar, sobre la dosis, sobreel momento idóneo de administración, sobre laduración e incluso puede no existir claridad sobre elobjetivo concreto que se pretende alcanzar con laadministración profiláctica de antibióticos enla cirugía. Por ello, resulta un reto especialmenteatractivo para cualquier persona dedicada a la antibioterapia,escribir un texto que intente aclarar las dudas que puedenpresentarse en algunas ocasiones. Se ha elegido el sistema deresponder a algunas de las preguntas que con mayor frecuenciapueden surgir para que el lector interesado localice con facilidadlos temas que puedan interesarle de forma especial.
¿Cuál es el objetivo de la profilaxisquirúrgica?
Clarificar esteconcepto parece a priori de gran importancia para poderentender la totalidad de los aspectos técnicos del problema.Cualquier tipo de intervención quirúrgica supone unincremento del riesgo de que el paciente sufra un procesoinfeccioso en el postoperatorio. Estas infecciones, puedenpresentarse en el área anatómica en la que se harealizado la intervención o en otras localizaciones. Lasprimeras son propiamente IQ, mientras que las restantes, que puedenestar o no relacionadas de forma indirecta con la cirugía,no pueden calificarse propiamente como IQ.
Un ejemplo puedeclarificar la diferencia. Una infección de la heridaquirúrgica o un proceso infeccioso localizado en un materialde osteosíntesis es sin duda alguna, una IQ. Una bacteriemiao una sepsis producida por la diseminación delmicroorganismo causante, también debe ser considerada comoIQ. Sin embargo, la presencia de una neumonía, de unainfección urinaria, incluso la asociada con elcatéter colocado en el propio quirófano, no deben serconsideradas IQ.
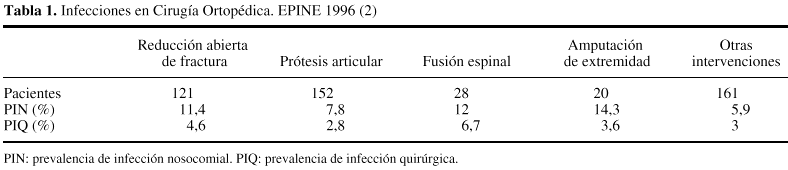
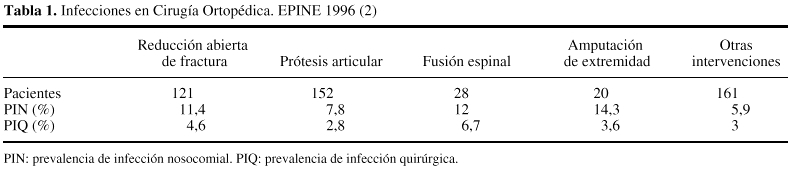
En unapublicación reciente34 se describía laprevalencia de infecciones en pacientes sometidos a cirugíaortopédica, observada dentro de los resultados globales delEPINE, durante el año 1996 (tabla 1). Dentro de estosresultados llama la atención que la prevalencia deinfección nosocomial más elevada se alcanzaba en lospacientes con amputación de extremidad (14,3%), si bien laprevalencia de infección quirúrgica en estospacientes era del 3,6%. Curiosamente el tipo intervenciónque presentaba mayor prevalencia de IQ era la cirugía defusión espinal (6,7%), mientras que la prevalencia de IQ enpacientes con prótesis articular se situaba en el2,8%.
Aclarada ladiferencia entre infección nosocomial e IQ, resulta sencillocomprender que el objetivo de la profilaxis quirúrgica es laprevención de la IQ y, en ningún caso, laprevención de cualquiera de las infecciones que el pacientepuede presentar durante el ingreso hospitalario generado por laintervención quirúrgica. Este objetivo justificaplenamente alguna de las características típicas dela profilaxis quirúrgica y especialmente el tipo defármaco y la duración del tratamiento.
En cierto modo,el hecho de que la profilaxis quirúrgica resulte eficaz parareducir la incidencia de la IQ en algunos tipos de intervenciones,podría generar alguna confusión al médico, quepodría utilizar este argumento para justificar laadministración de antibióticos de amplio espectrodurante todo el postoperatorio, intentando reducir la incidencia detodas las infecciones que pueden presentarse en elmismo.
La realidad esque por el momento no ha logrado demostrarse este supuesto papelprotector con ninguno de los antibióticos existentes.Más aún, parece evidente que la administraciónde antibióticos de forma indiscriminada figura entre lascausas más importantes del desarrollo de resistencias, de lapresencia de infecciones hospitalarias, del encarecimiento delcoste de la intervención y de la aparición dereacciones adversas. El recuerdo del impresionante perfil deresistencias actual de Pseudomonas aeruginosa, Enterobacter sp, Xantomonasmaltophilia, Acinetobacter sp, Enterococcus sp, Staphylococcussp yStreptococcuspneumoniae puede ser argumento más que suficiente.
¿Cualesson las indicaciones de la profilaxis quirúrgica?
Estacuestión es una de las más controvertidas puesto queexiste la tendencia de extrapolar la experiencia existente enalgunos tipos de intervenciones, a la totalidad de ellas.Atendiendo a criterios puramente científicos, lo correctosería plantear la utilización de profilaxisantibiótica únicamente en aquellas intervenciones enlas que este tipo de técnica haya demostrado, de formaevidente, su capacidad para reducir la incidencia de infecciones.Debe considerarse que la evidencia se alcanza cuando los resultadosse obtienen en el curso de estudios realizados utilizando elmétodo adecuado y por ello, sólo deben aceptarseresultados de estudios en los que se ha evaluado la eficacia de laprofilaxis de forma controlada, es decir comparándola conlos resultados obtenidos en un grupo control estudiado de formaconcurrente que, en principio, no debe recibir profilaxis. Claroque este tipo de estudios plantea grandes dificultadeslogísticas. La incidencia actual de IQ en la cirugíaortopédica limpia acostumbra a ser inferior a 5%, concualquiera de los tipos de profilaxis actualmente utilizado.Cualquier estudio que pretenda demostrar diferencias consignificación estadística favorable a un tipo deprofilaxis frente a otro tipo, debe incluir en el estudio unnúmero muy elevado de pacientes. Por ejemplo, si se pretendedemostrar que una de las pautas de profilaxis es capaz de reducirla incidencia de IQ en un 50%, resultará necesario incluiren el estudio 900 pacientes. Es evidente que esta cifra tanconsiderable está al alcance de muy pocos centros y porconsiguiente los esfuerzos realizados en estudios con menorcasuística, pueden ser poco concluyentes.
En el campo dela cirugía ortopédica y traumatológica laprofilaxis está plenamente indicada en la artroplastiaarticular (cadera, rodilla, etc.), colocación de aloinjertoóseo masivo, reducción abierta de fracturas, yamputaciones de extremidad inferior.31,32,2,15 Existendudas, al no haberse documentado plenamente la eficacia, sobre lautilización profiláctica de antibióticos en lacirugía limpia con implante, laminectomía yartrodesis vertebral, aunque en modelos experimentales se hademostrado la posible utilidad en la cirugía vertebral coninstrumentación.16 La profilaxis no estáindicada en la artroscopia.
Debeseñalarse que la administración deantibióticos en fracturas abiertas, reimplantes de partesanatómicas o en pacientes politraumatizados con grandesheridas, tiene un objetivo terapéutico y por ello, no puedeconsiderarse estrictamente como profilaxis.
¿Qué antibióticos debenutilizarse?
Laelección del antibiótico ha de basarse en dosargumentos fundamentales: la incidencia de las bacterias queproducen con mayor frecuencia infección en cada uno de lostipos de cirugía y el patrón de actividad de losantibióticos frente a estas bacterias.
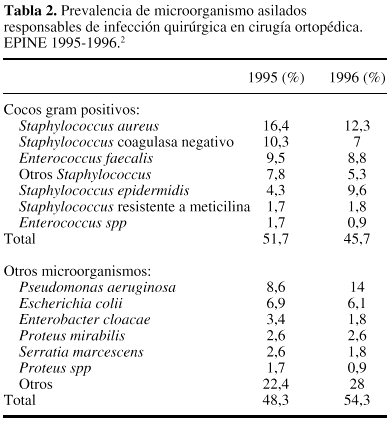
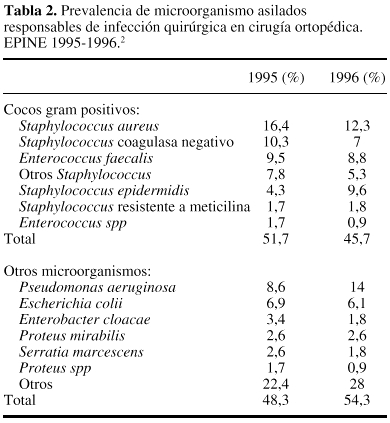
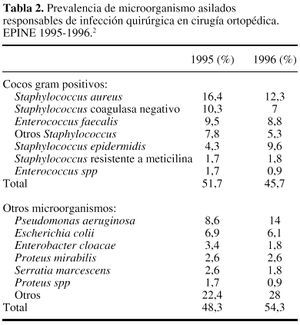
Referente a lasprimeras, y recogiendo datos nacionales obtenidos en EPINE en losaños 1995-1996 (tabla 2) se puede concluir la elevadafrecuencia de aislamientos de cocos Gram positivos,especialmente Staphylococcus.34
En el caso de lacirugía ortopédica y traumatológica se aceptaque existen pocas diferencias entre centros e incluso entredistintos países, referentes al tipo de microorganismoresponsable de la IQ y con una elevada prevalencia de Staphylococcus. Los datos obtenidos en elestudio EPINE34 confirman esta apreciación (tabla2). A pesar de esta certeza, resulta importante que cada centrodisponga de la incidencia de aislados responsables de las distintasIQ, así como de su patrón de sensibilidad a losantibióticos. Conviene recordar que no son infrecuentes losbrotes de IQ generados por bacterias que con un perfil especial deresistencia a los antibióticos, pueden obligar a cambiar, deforma temporal, el tipo de antibacteriano elegido para laprofilaxis.
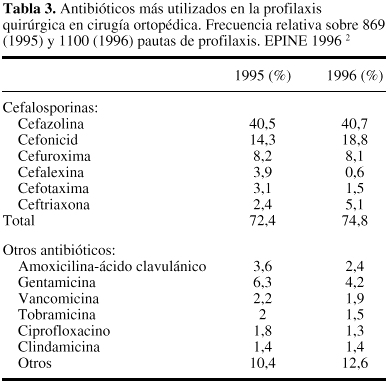
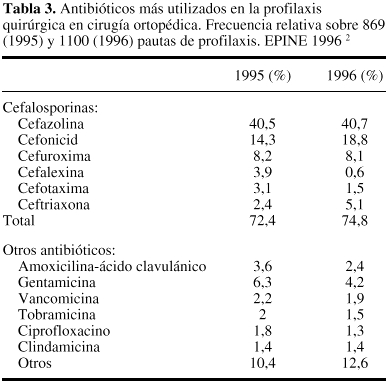
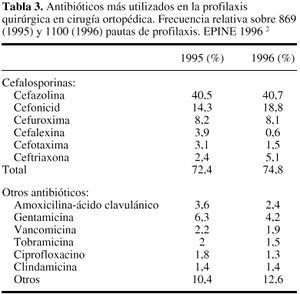
Puesto que loscocos Gram positivos del género Staphylococcus son los microorganismosimplicados con mayor frecuencia en la IQ, el antibióticoelegido debe caracterizarse por su actividad frente a estasbacterias. Globalmente, por tanto, cefalosporinas, cloxacilina,clindamicina y glucopéptidos pueden ser a priorifármacos de interés en esta indicación. Losdatos contenidos en la tabla 334 confirman estaestimación, puesto que la utilización decefalosporinas en la profilaxis de la cirugíaortopédica puede llegar a alcanzar, en nuestro país,una frecuencia relativa superior al 70%, destacando las cifras deutilización de uno de los fármacos de primerageneración: cefazolina.
Aunqueaparentemente los fármacos descritos cumplen el criterio depresentar actividad frente a Staphylococcus, un análisismás detallado de la información existente sobre lasituación actual de las resistencias, puede exigirnos unareflexión sobreañadida. La progresión de lasresistencias de las bacterias frente a los antibióticosparece un hecho universal y por consiguiente, ha afectadotambién a las diferentes especies de S. aureus, puede resultar resistente a lameticilina, clindamicina, etc. en un porcentaje que puede oscilarentre el 5 y el 38%,26,29 mientras que las especiescoagulasa negativas (S.epidermidis,etc.) pueden alcanzar una resistencia que supera el50%.9
Estacircunstancia podría llegar a aconsejar, al menos enteoría, la utilización profiláctica deantibióticos dotados de la máxima actividad frentea Staphylococcus, como es el caso de los glucopéptidos: vancomicinao teicoplanina. Afortunadamente esta circunstancia no se producetodavía, por lo que a pesar de las resistencias, losantibióticos más convencionales, cefalosporinas yclindamicina, siguen figurando como de primera elección enesta indicación, sin que por el momento existan dudas de sueficacia. No obstante, se ha comprobado que en algunos hospitalespuede existir una tendencia a la utilizaciónprofiláctica de vancomicina, en relación con unafrecuencia elevada de aislamiento de Staphylococcus resistente a meticilina comobacteria responsable de IQ.13 Cloxacilina es unapenicilina ampliamente utilizada hace algunos años, pero queen la actualidad, ha sido sustituida por cefalosporinas,circunstancia que puede justificarse, al menos de forma parcial porlos resultados obtenidos en algunosestudios.20
Existe algunaexplicación científica a la aparentecontradicción que de hecho supone que fármacos conproblemas de resistencias puedan resultar útiles en laprofilaxis quirúrgica. En la cirugía limpiaortopédica la tasa de contaminación de una herida esmuy reducida: del orden de 102 UFC (unidades formadorasde colonias).1,36 Por consiguiente, el número debacterias que contaminan de forma inicial la herida y queposteriormente serán responsables de la IQ, es muy reducido.En estas circunstancias, concentraciones elevadas de unantibiótico podrían ser suficientes para reducir lacarga bacteriana hasta el punto de impedir el desarrollo ulteriorde un proceso infeccioso.
Laelección del antibiótico entre alguno de los citados,resulta más laboriosa porque en ella deben participar otroselementos no citados hasta el momento. La tolerancia, la comodidad,el coste económico y la orientación que se dictadesde la política hospitalaria de uso de antibacterianospueden ser, en definitiva, los factores que terminan incidiendo enla elección del fármaco. En el último apartadode este artículo se describen con mayor detalle lascaracterísticas más relevantes de los fármacoscitados.
Aunque noincluido como profilaxis resulta necesario señalar que laadministración de antibióticos frente acirugía sucia debe realizarse con otro concepto distinto. Enestos casos el paciente debe considerarse como infeccioso y porello, como subsidiario de administración deantibióticos, en principio de espectro amplio, es decir quepresenten actividad frente a la mayoría de bacterias que conprobabilidad elevada están presentes en la zonaquirúrgica antes del inicio de la intervención. Enestos casos el factor terreno, tipo de elemento quecontaminó la herida, puede tener gran importancia parajustificar la presencia de cocos Gram positivos (Streptococcus sp, Staphylococcus sp), bacilos Gramnegativos (enterobacterias) e incluso bacterias anaerobias. Larecogida precoz de muestras para estudio microbiológico y laadministración de antibioterapia empírica con pautasde eficacia demostrada: clindamicina y aminoglucósido,cefalosporina y aminoglucósido, o la asociación debetalactámico con inhibidor de betalactamasa(amoxicilina-ácido clavulánico opiperacilina-tazobactam) parece la estrategia másadecuada.
¿Cuál es el momento idóneo del comienzo dela profilaxis quirúrgica?
De todos losapartados de la profilaxis, éste es, sin duda alguna, uno delos más controvertidos e interesantes. Si se considera queel objetivo de la profilaxis es evitar la IQ y que el momento demayor riesgo es precisamente el propio acto quirúrgico,parece lógico señalar que el antibiótico debeestar presente, con concentraciones adecuadas, en el tejidoobjetivo de la manipulación quirúrgica, durante latotalidad del acto quirúrgico.
Esta premisa hasido comprobada de forma evidente puesto que en un amplio estudiopublicado en 1992, se describía cómo la tasa deinfecciones de la herida quirúrgica aumentaba de formasignificativa desde el 0,6%, en los pacientes a los que laprofilaxis se administraba entre 2 h antes y el momento previo a laintervención, y hasta 1,4-3,3% en el grupo de pacientes enlos que la administración profiláctica delantibiótico se instauraba entre 3 y 24 h después deiniciada la intervención.10
Laexposición de una zona anatómica cruenta al medioambiente es el factor decisivo que puede justificar la presencia debacterias en el campo quirúrgico, No importa queéstas lleguen desde el aire o penetren a través delmaterial introducido en el campo. La cuestión es que algunasbacterias, escasas en número, tal y como se ha comentado enapartados anteriores, van a llegar a una zona expuesta y cruenta.El depósito de estas bacterias se va a producir sobre lasuperficie de los órganos y tejidos en los que lalesión predominante es la hemorragia. En estas superficiesel trauma quirúrgico origina la presencia casiinstantánea de procesos de reparación conagregación plaquetaria, depósito de fibrina yformación de coágulos, fenómenos que seinician con la incisión y que acaban varias horas, e inclusodías, después de finalizada la intervención.Por consiguiente, el lugar de depósito y de crecimientoposterior de las bacterias contaminantes seránpredominantemente los coágulos y tapones de fibrina. Estoselementos presentan componentes (colágeno,fibrinógeno y fibrina), que resultan muy atractivospara Staphylococcus y Streptococcus, ya que probablemente facilitan sufijación.4,28
Estacircunstancia tiene una importancia extraordinaria, cuando seconsidera que la capacidad de los diferentes antibacterianos paradifundir al interior de los coágulos, depende de formadecisiva del tiempo de administración del fármacorespecto al tiempo de formación del coágulo.Así si el antibiótico está presente en lasangre en concentraciones elevadas, en el instante en el que seproduce el trauma que genera el fenómeno hemorrágicoel fármaco escapará de la sangre, junto con loselementos celulares, y pasará a constituirse como parteintegrante del coágulo, justificando de esta forma unaconcentración elevada, a menudo semejante a laplasmática.35 Con ello se asegurará suprevisible eficacia en el caso de que existan bacteriascontaminantes. Las dosis del fármaco administradas, una vezque el proceso de depósito de fibrina estáconstituido, alcanzan concentraciones reducidas puesto que estoselementos no disponen de sistema vascular, única víade acceso del antibiótico.28,19,35
Este argumentojustifica plenamente las diferencias que pueden presentarse en laeficacia cuando la profilaxis se inicia antes de la incisiónquirúrgica o después de ella, e incluso sirve paraponer en duda la posible utilidad de continuar administrando elfármaco una vez finalizada la IQ.
El momentoexacto para la administración depende de algunas de lascaracterísticas del fármaco y de la vía deadministración elegidas. Si es posible laadministración por vía IV en bolus, el momentoidóneo será el instante previo a laintervención. Si, en cambio, se prefiere laadministración en perfusión de 20-30 minutos, trasdilución previa en un volumen de 100-250 ml,resultaría ideal esperar a que ésta finalice parainiciar la IQ. Finalmente, si la vía elegida es la IM debeconsiderarse que la concentración plasmáticamáxima de la mayoría de los fármacos sealcanza entre 1 y 2 horas después de laadministración, tiempo que conviene transcurra antes deiniciar la incisión quirúrgica. Cualquiera de lasopciones es adecuada y probablemente de eficacia similar, noobstante debe considerarse que las concentraciones alcanzadas enplasma, a igualdad de dosis, son superiores cuando elfármaco se administra por vía IV en bolus.
¿Cuál es la duración ideal de laprofilaxis?
En estacuestión al igual que en otras, existe controversia. Paraalgunos autores puede ser suficiente con la administraciónpreoperatoria y peroperatoria de antibióticos.32Para otros, parece más razonable continuar administrando elantibiótico durante las primeras 24-48 h delpostoperatorio.31 Esta controversia puede tener suorigen en la verificación de la eficacia de administrarantibióticos en dosis única preoperatoria,comparativamente con la de placebo25,6 y, a su vez, lapresencia de resultados de estudios que muestran la eficacia cuandoel fármaco se administra en dosismúltiples.5,7,17 Incluso algunos estudios handemostrado que la dosis múltiple no presenta mayor eficaciaque la dosis única preoperatoria.21
Los resultadosde estos estudios contrastan con los obtenidos por otros autores yque consignan mayor incidencia de IQ entre pacientes que recibenuna dosis única de 2 g de cefamandol en el preoperatorioinmediato, cuando lo comparan con los observados en el grupoestudio, que recibe la misma dosis y, además, una dosissimilar peroperatoria a las dos horas de la primera, más 1 gdel mismo fármaco, ocho, 16 y 24 horasdespués.14 Este estudio plantea un tipo de pautaprofiláctica especial, dado que además de las dosispre y postoperatorias, incluye administración de una dosisen el peroperatorio. El motivo de administrar esta dosis esmantener una concentración elevada del fármacodurante la totalidad del tiempo quirúrgico es decir mientrasexiste riesgo de sangrado traumático contaminable pormicroorganismos, objetivo deseable para evitar el sobrecrecimientoposterior.
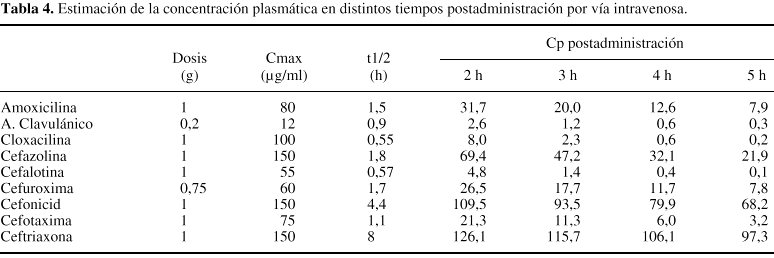
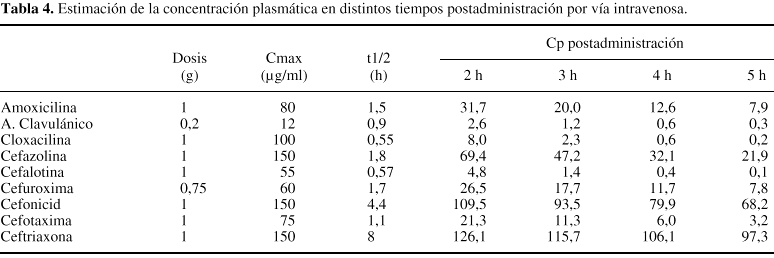
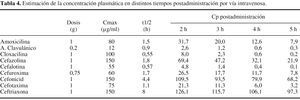
Curiosamente,algunas pautas profilácticas recomendadas pueden llegar aolvidar un hecho de importancia, la velocidad con la que elfármaco es eliminado del organismo. Cualquier fármacopresenta un tiempo de permanencia concreto y conocido, dentro delorganismo de un paciente y si se exceptúa suadministración por vía intravenosa enperfusión continua y algunas formas retardadas deadministración intramuscular, las concentraciones delfármaco en el plasma y en los tejidos decrecen de formadirectamente relacionada con la velocidad de eliminación delfármaco. Existe un parámetro farmacocinéticoque cuantifica la velocidad de eliminación de unfármaco del organismo: la semivida de eliminación.Ésta expresa el tiempo en que tarda en reducirse a la mitadla concentración plasmática del fármaco y, portanto, cuanto menor sea este valor, con mayor velocidad seeliminará. En la tabla 4 se describe una estimaciónde las concentraciones plasmáticas que alcanzan algunos delos antibióticos betalactámicos utilizados en laprofilaxis quirúrgica, en tiempos consecutivospostadministración.
Si se revisa ladinámica propia del acto quirúrgico, tendremos quevalorar que, si se ha administrado en el preoperatorio inmediatouna dosis de un fármaco con semivida de eliminaciónreducida, se corre un riesgo: el fármaco puede ser eliminadoa tal velocidad que en el transcurso de la intervención susconcentraciones sean inferiores a las deseables y, porconsiguiente, el riesgo de que las previsibles bacteriascontaminantes no sean erradicadas, elevado. La revisión delas estimaciones descritas en la tabla 4 permite comprobarcómo los fármacos con menor semivida deeliminación pueden alcanzar dos horas después de laadministración, y por tanto aún dentro del tiempo dela cirugía, una concentración excesivamentereducida.
Debeañadirse que en el caso de la cirugíaortopédica la presencia frecuente de algunos Staphylococcus resistentes puede exigir laconsecución de concentraciones de antibióticoespecialmente elevadas. Esta situación puede suceder en lapráctica con algunos de los fármacos utilizados deforma habitual: cloxacilina, cefalotina, cefotaxima, etc. quepresentan una semivida de eliminación reducida.
Enrelación con estos hechos, algunos autores recomiendanreadministrar una dosis, del antibiótico cuando lacirugía continúa cuatro horas después de laadministración de la primera dosis o de forma másrigurosa, en el momento en el que el tiempo de cirugíasobrepase dos veces la semivida de eliminación delfármaco elegido.22 Es evidente que este tipo decuestiones pierde su dimensión si el fármaco elegidopresenta una semivida muy prolongada, como cefonicid oceftriaxona
Si se excluye elestudio comentado anteriormente, puede señalarse que hastala fecha ningún ensayo clínico ha demostrado quecontinuar administrando antibióticos en el postoperatoriosuponga ventaja alguna frente a la administración enpreoperatorio inmediato. Por consiguiente, puede afirmarse que porel momento no hay evidencias clínicas de una posible mayoreficacia de la prolongación de la profilaxis y por ello,este tipo de pauta parece prescindible. Se podría argumentarque continuar administrando 1-3 dosis de cualquierantibiótico en el postoperatorio inmediato no representariesgo alguno para el paciente, pero no debe perderse de vista queel uso de antibacterianos, por sí mismo, es probablemente elfactor causal de resistencias más importante y por ello, elriesgo social puede llegar a ser inaceptable.
Naturalmente,estas cuestiones sólo tienen cabida cuando el objetivo de laadministración de antibióticos esprofiláctico. En los restantes casos, es decir en lacirugía sucia, el objetivo es tratar una más queprevisible infección y por ello los antibióticosdeben iniciarse lo antes posible y mantenerse hasta que exista lacerteza de que el proceso infeccioso ha desaparecido.
Existe un tipoespecial de cirugía, la corrección quirúrgicade fracturas abiertas. La tendencia inicial promovida desde losresultados de algunos estudios,27 era el mantenimientode la antibioterapia durante al menos diez días.Posteriormente, se ha ido reduciendo este tiempo de formaprogresiva, conforme se han descrito los resultados de algunosestudios bien diseñados, en los que no se apreciabandiferencias cuando se utilizaban pautas de duraciónmás cortas (1-5 días).11 En cualquier casotampoco en este tipo de pauta existe un acuerdo unánime.Probablemente la pauta más racional es la que parte de laestimación de que el mayor riesgo infeccioso se localiza enla propia intervención quirúrgica y, por tanto, serecomienda administrar antibióticos potentes a dosiselevadas. La duración debe ser en cualquier caso, inferior asiete días.18
¿Qué dosis de antibiótico debeutilizarse?
Al igual que enlas cuestiones previas no existe acuerdo unánime y síla tendencia a administrar dosis convencionales, habitualmente de 1g de un fármaco betalactámico. Estas pautas resultaneficaces, de acuerdo a lo extendido de su utilización, noobstante, atendiendo a los conocimientos actuales, podríaresultar insuficiente al menos si se considera que el objetivo dela profilaxis es impedir la multiplicación de las bacteriasque con mayor frecuencia contaminan el campoquirúrgico.
El hecho de queel efecto bactericida de los betalactámicos no depende de laconcentración alcanzada, sino que depende del tiempo duranteel que la concentración se mantiene por encima de la CMI,podría ser utilizado para explicar la necesidad deadministrar dosis reducidas repetidas en el tiempo. No obstante,debe recordarse que muchas especies de Staphylococcus precisan concentracioneselevadas para ser eliminadas y que ésto sólo seconsigue administrando dosis superiores a las actualmenterecomendadas, es decir, dosis de 2 g, al menos en el caso de laprimera dosis preoperatoria.
¿Puedeser necesaria la profilaxis en pacientes portadores deprótesis de cadera o rodilla?
Laexistencia de infecciones tardías del materialprotésico en las que no se logra identificar una fuenteprimaria, ha planteado numerosas dudas sobre la pauta a seguir paraintentar evitar este tipo de procesos. Se ha señalado que lafuente primaria sería la propia intervención, quefacilitaría la contaminación por microorganismos quepermanecerían aquiescentes esperando la ocasiónpropicia, de características desconocidas, para desarrollarel proceso infeccioso.8 También se ha especuladocon que su origen sería secundario a bacteriemias provocadaspor actuaciones agresivas: endoscopias, manipulaciones dentarias,etc., al igual que lo que acontece en los pacientes portadores deválvula protésica cardiaca.12,30 Ningunade las dos opciones ha sido comprobada de forma fehaciente. Porello no puede establecerse, por el momento, unarecomendación sistemática sobre el usoprofiláctico de antibióticos previo a este tipo demaniobras.
¿Puedeser útil en la profilaxis la administración deantibióticos por vía tópica?
Esuno de los temas controvertidos, probablemente por la falta deestudios bien diseñados. Parece evidente que lairrigación del campo con antibióticos durante laintervención puede no tener eficacia alguna, ante el escasotiempo de contacto del fármaco. Por otro lado, debeconsiderarse que la irrigación sólo es posible unavez que se ha producido el trauma quirúrgico y, por ello, elantibiótico administrado va a tener grandes dificultadespara incorporarse a los depósitos de fibrina ycoágulos preformados.24
Otrométodo de interés es la administración deantibióticos utilizando sistemas de depósito quepermiten que el fármaco vaya liberándose conlentitud, por lo que se alcanzan concentraciones elevadas ysostenidas. En el caso de la profilaxis quirúrgica, elsistema más utilizado es la aplicación de cemento enla prótesis con un fármaco aminoglucósido:gentamicina. Este sistema ha mostrado su eficacia en las pautas derecambio de prótesis infectadas.33 No obstante nose ha estudiado adecuadamente su utilidad en la profilaxis de lacirugía limpia y, además, debe recordarse que elantibiótico elegido: gentamicina, no es un fármacoque destaque por su actividad frente a Staphylococcus.
¿Qué peculiaridades presentan los fármacosde mayor utilidad?
Acontinuación, se describirán las peculiaridadesmás importantes de los fármacos que pueden estarindicados en la profilaxis de la IQ en cirugíaortopédica(3,15,23,): cloxacilina,cefalosporinas, clindamicina y glucopéptidos.
Cloxacilina
En la actualidades la única isoxazolilpenicilina disponible en nuestropaís. Considerando su actividad antibacteriana ocupa unpapel relevante, al ser un antibiótico de espectro reducidopero con actividad frente a Streptoccoccus beta hemolíticoy Staphylococcussp, siempreque las cepas no sean resistentes a la meticilina. Probablemente,las circunstancias que limitan en la práctica lautilización de este fármaco son su corta semivida deeliminación (no alcanza una hora) y su distribucióntisular poco adecuada, limitada por la elevada proporcióndel fármaco que circula en plasma fijado a proteínas.En la actualidad, es un fármaco que tiende a ser sustituidopor cefalosporinas que presentan una actividad similar y mejorperfil farmacocinético.
Cefalosporinas
Son, sin dudaalguna, los fármacos más utilizados en estaindicación. Inicialmente las cefalosporinas de primerageneración parecen ser las de mayor interés dado quemantienen una actividad excelente frente a Staphylococcus y, además, puedenmejorar las características farmacocinéticas decloxacilina. Entre los fármacos de este grupo se hanutilizado especialmente: cefazolina, cefalotina y cefaloridina. Noobstante parece que es, precisamente, el primero de los citados,cefazolina, el de mayor interés, una vez que se descartacefaloridina por el riesgo de nefrotoxicidad y cefalotina porpresentar una semivida de eliminación excesivamente corta.Cefazolina tiene una semivida de eliminación de 1,8 h, buenapenetración tisular y está disponible para laadministración IV o IM. A estas peculiaridades hay queañadir un coste económico reducido.
Probablemente enrelación con el interés de presentar una semivida deeliminación prolongada (superior a 4 h) se ha estudiado laeficacia de una cefalosporina de segunda generación,cefonicid, administrada en dosis única preoperatoria,comprobándose que la incidencia de infección erasimilar a la alcanzada con cefazolina administrada en dos dosis,una preoperatoria y otra 2 h después de laprimera.
Tambiénse ha estudiado el papel de otras cefalosporinas de segundageneración: como cefuroxima e incluso de la cefalosporinasde tercera generación (cefotaxima o ceftriaxona). Engeneral, los resultados obtenidos en estos estudios no alcanzandiferencias estadísticamentes significativas con el grupocontrol. No obstante, deben estudiarse con meticulosidad estosresultados, dado que en ocasiones la ausencia designificación estadística puede ser laexpresión de la inclusión en el estudio de untamaño de muestra excesivamente reducido. Además,siguen existiendo dudas sobre el impacto que la utilizaciónmasiva de antibióticos de amplio espectro (y lascefalosporinas de tercera generación los son) puede tenersobre el ecosistema bacteriano. Por ello no debe extrañarque este tipo de fármacos no sean incluidos en algunos delos principales protocolos existentes.
Clindamicina
Estefármaco presenta algunas características deinterés. Por un lado tiene buen actividad in vitro frente a cocos Gram positivos.Entre sus propiedades farmacocinéticas, destaca su grancapacidad para difundir al tejido óseo, a la piel y a partesblandas y una semivida de eliminación (2-3,5 h) que supera ala de otros fármacos. Desgraciadamente, la sospechatodavía no confirmada de su implicación conincidencia elevada en cuadros de colitis pseudomembranosa, puedeser el factor que en mayor medida limite a este fármaco enla mayoría de sus posibles indicaciones. En la actualidadpuede ser considerado como una alternativa idónea a losbetalactámicos cuando éstos estáncontraindicados.
Glucopéptidos
Este reducidogrupo de fármacos formado por vancomicina y teicoplanina,presenta un espectro antibacteriano muy adecuado, puesto que son,prácticamente siempre, activos frente a la prácticatotalidad de cocos Gram positivos, incluyendo las cepas deStaphylococcus que se muestranresistentes a meticilina. La necesidad de preservar su actividadfrente a cocos Gram positivos multirresistentes, unido a lareciente descripción de resistencias entre éstosúltimos, relacionadas previsiblemente con el aumento delconsumo de estos fármacos, ha supuesto que suutilización en cualquier tipo de profilaxis haya quedadorelegado a situaciones anecdóticas en las que,previsiblemente, cualquier otro fármaco pueda resultarineficaz o esté contraindicado. El problema con este tipo defármacos parece tan importante que en EEUU se ha recomendadoque se proscriba su utilización en indicaciones que, hastahace escasas fechas, eran de primera elección, como eltratamiento de la colitis pseudomembranosa o el tratamientoempírico de la fiebre en el paciente neutropénico.Puede resultar incluso discutible la utilizaciónprofiláctica de estos fármacos en los hospitales enlos que la incidencia de aislamiento de Staphylococcus resistente a la meticilinaresulte muy elevada.
Conclusiones
Cuando se finaliza la redacción de un artículo deestas características pueden existir serias dudas sobre suutilidad, al menos si la pretensión inicial era la declarificar los diversos aspectos del tema. Efectivamente, en estecaso la duda es mantenida por el autor una vez comprobada laimposibilidad de establecer hechos que resulten indiscutibles. Noobstante, parece imprescindible concluir señalando que laprofilaxis en la cirugía ortopédica ytraumatología es obligada en determinadas intervenciones,puesto que su utilización se asocia a reducción de laincidencia de IQ. Las cefalosporinas de primera generaciónsiguen siendo, en nuestros días, antibióticos muyútiles aunque otras cefalosporinas, en relación consu semivida de eliminación más prolongada, puederesultar muy eficaces. El inicio de la administración debeser siempre en el preoperatorio inmediato y existen evidencias queseñalan la conveniencia de readministrar el fármacodurante la intervención en el caso de que su semivida deeliminación sea corta respecto a la duración de laintervención. No es nada evidente que continuaradministrando antibióticos en el postoperatorio se asocie amejoría de la eficacia. Es posible que resulte necesarioreplantearse la dosis elegida para intentar disponer de actividadfrente a algunas bacterias más resistentes y continuarestudiando la idoneidad de utilizar elementos que liberanantibióticos de forma retardada.
Losavances en este campo son evidentes pero, a pesar de ello, siguenproduciéndose infecciones quirúrgicas que debenservir de acicate para continuar investigando las causas y lasposibles soluciones.