La liberación local de antibióticos es crucial en infecciones protésicas debido a la limitada penetración ósea de los tratamientos sistémicos. Con el aumento de resistencias bacterianas, se buscan alternativas que permitan emplear estos antibióticos sin afectar sus propiedades. El objetivo de este estudio es explorar la aplicación de la estereolitografía en la fabricación de objetos personalizados que incorporan antibióticos termolábiles y su comportamiento biomecánico.
Material y métodosSe empleó una impresora 3D de estereolitografía (SLA) con resina biocompatible Optoprint® Lumina, y se crearon diferentes modelos a los cuales se les añadían diferentes cantidades de amoxicilina-clavulánico. Se realizaron estudios mecánicos para evaluar el comportamiento de los modelos impresos en 3D previo y tras la liberación de antibiótico.
ResultadosLas piezas de resina sin antibiótico mostraron mayor resistencia, mientras que la adición del antibiótico redujo la resistencia en un 18%, y tras la elución de la amoxicilina-clavulánico, la reducción alcanzó el 56% de su resistencia total. En comparación, las piezas de cemento con antibiótico mantuvieron más del doble de resistencia tras la elución. La pérdida progresiva de la resistencia biomecánica se correspondía con la liberación del antibiótico de las piezas de resina.
ConclusionesLos resultados de este estudio sugieren que es posible diseñar piezas con características estructurales variables mediante la impresión SLA (esterolitografía) utilizando resina biocompatible, combinada con la incorporación de fármacos, incluidos antibióticos termolábiles.
Local antibiotic delivery is crucial in prosthetic infections due to the limited bone penetration of systemic treatments. With the rise of bacterial resistance, alternatives are being explored to utilize these antibiotics without compromising their properties. The aim of this study is to investigate the application of stereolithography in manufacturing customized objects that incorporate thermolabile antibiotics and analyze their biomechanical behavior.
Materials and methodsA stereolithography (SLA) 3D printer with biocompatible resin Optoprint® Lumina was used to create different models, incorporating various amounts of amoxicillin-clavulanic acid. Mechanical studies were conducted to evaluate the performance of the 3D-printed models before and after antibiotic release.
ResultsResin pieces without antibiotics demonstrated higher resistance, while adding the antibiotic reduced resistance by 18%, and after the elution of amoxicillin-clavulanic acid, the reduction reached 56% of their total strength. Comparatively, antibiotic-loaded cement pieces retained more than twice the resistance post-elution. The progressive loss of biomechanical strength correlated with the antibiotic release from the resin pieces.
ConclusionsThe results of this study suggest that it is feasible to design pieces with variable structural characteristics using SLA (stereolithography) printing with biocompatible resin, combined with the incorporation of drugs, including thermolabile antibiotics.
La cirugía protésica ha sido definida como la cirugía del sigloxx. La cirugía del sigloxxi será el recambio protésico. El envejecimiento de la población, conjuntamente con un cambio social a una población más activa y con mayor demanda funcional, ha llevado a un aumento progresivo de la cirugía protésica en todo el mundo. La principal complicación de esta cirugía es la infección protésica, tanto por frecuencia como por su impacto sobre la calidad de vida del paciente que la sufre.
En el tratamiento de las infecciones protésicas la liberación de antibiótico local es un elemento fundamental, debido a la particular penetración ósea de los fármacos sistémicos. Actualmente en el campo de la medicina se sigue empleando el cemento óseo (polimetilmetacrilato [PMMA]) para dar solución a situaciones terapéuticas como la creación de espaciadores para infecciones osteoarticulares1–3, como soporte estructural en defectos óseos con la adicción de antibiótico4 o mediante su empleo en revisiones quirúrgicas para dar estabilidad a los implantes, como por ejemplo las prótesis5,6. Sin embargo, debido a las propiedades de polimerización del cemento, no todos los antibióticos pueden ser empleados, quedando relegados los termolábiles por la alteración de las propiedades fisicoquímicas que sufren, disminuyendo así su capacidad antimicrobiana frente a las infecciones7–9. Por ello, y debido al aumento de resistencias bacterianas en la actualidad, es necesario encontrar alternativas para poder aumentar el espectro del uso de los antibióticos que no se vean alterados por la polimerización del cemento, y que además presente una resistencia mecánica óptima10–14.
La impresión 3D ha supuesto una revolución no solo en la capacidad para fabricar nuevos productos sanitarios, sino también en el desarrollo de materiales para este tipo de fabricación. Existen en la actualidad resinas diseñadas para la impresión 3D que polimerizan cuando la luz ultravioleta incide sobre ellas. Estas resinas tienen la ventaja de no necesitar calor para su polimerización. Además, presentan una alta capacidad para albergar otras sustancias en su composición, como minerales u otros productos activos. La creación de implantes mediante esta técnica permitiría la adición de antibióticos termolábiles, como los beta lactámicos, en su composición, permitiendo la liberación local de antibióticos durante un tiempo controlable13–17.
El objetivo de este estudio consiste en diseñar piezas para su impresión 3D mediante SLA (estereolitografía) con resina biocompatible y antibiótico (amoxicilina-clavulánico), que den soporte estructural y permitan la elución del fármaco a lo largo del tiempo, analizando así mismo su resistencia mecánica.
Material y métodosEstudio experimental in vitro realizado de forma prospectiva durante los años 2021 hasta 2023. Para la realización de los diversos estudios se diseñaron piezas cilíndricas de 10mm de diámetro y 5mm de altura (fig. 1) con orificios de 1mm de diámetro cada 2mm con ayuda del software informático Meshmixer®.
Para la fabricación de las piezas mediante impresión 3D (modeloA) se utilizó la resina Optiprint® Lumina 500mg/400ml (Dentona) debido a su biocompatibilidad y su aprobación para uso en humanos. Esta resina, basada en metacrilato, es adecuada para la impresión 3D fotopolimerizable y funciona con impresoras que emplean luz en el rango de 385nm a 405nm.
Para la elección de antibiótico se decidió emplear amoxicilina-clavulánico debido a que es un antibiótico de amplio espectro, empleado en múltiples infecciones y que presenta el limitante de ser termosensible, por lo que no se emplea junto con el cemento óseo. Es por ello que se decidió emplear con el objetivo de aumentar el abanico terapéutico que existe actualmente. Para a los 10g de resina se le añadieron 100mg amoxicilina-clavulánico, se mezcló con la ayuda de una varilla de vidrio, se esperó durante 5min y trascurrido este tiempo se comprobó la homogeneidad de la mezcla. Se repitió el proceso y se comprobó que se obtenían mezclas homogéneas idóneas para la impresión en 3D.
Para preparar las piezas en 3D se pesaron 10g de resina Optiprint® Lumina en una balanza de precisión ABJ 220-4NM® (Kern). Luego se añadió en las piezas amoxicilina-clavulánico (Normon® 2000/200mg polvo para solución para perfusión). Se generaron cinco grupos de piezas: sin antibiótico, con 1g, con 1,5g y con 2g de antibiótico, y con 2g de antibiótico eluido tras 7días. Se decidió iniciar con 1g y 1,5g para comprobar el comportamiento de las piezas liberadas, así como 2g por ser las dosis que se emplean habitualmente en los pacientes. La impresora utilizada fue la Elegoo Mars2®, un modelo de estereolitografía (SLA) que emplea el método de impresión «de abajo hacia arriba».
Para la creación de las piezas de cemento (modeloB) utilizadas en el estudio comparativo se empleó el cemento Palacos® LV (Haraeus). La fabricación de las piezas de cemento se realizó de forma estandarizada, siguiendo la normativa ISO 5833 y las instrucciones del fabricante del cemento Palacos® LV. Brevemente, se mezclaron los 40g del componente sólido, que son los que se presentan habitualmente con los paquetes de cemento, con 2g de amoxicilina-clavulánico en polvo, utilizando el método de dilución geométrica para obtener una mezcla homogénea. A partir de un diseño previo se utilizó la impresora 3D Creality Ender-3® para fabricar un molde de ácido poliláctico (PLA) que permitió la creación de las piezas cilíndricas de cemento de 10mm de diámetro y 10mm de altura. En este caso, las piezas obtenidas eran macizas y no presentaban orificios cilíndricos en su interior (fig. 2).
Tras la obtención de las piezas impresas en 3D se procedió a medir la fuerza de compresión necesaria para romper las piezas de resina. Las piezas impresas únicamente con resina sirvieron como control para determinar la resistencia a la rotura de la resina Optiprint® Lumina polimerizada, que fue comparada con la resistencia a la rotura de las piezas de cemento que contenían 2g de amoxicilina-clavulánico.
Por tanto, se evaluaron tres grupos de piezas de resina:
- 1.
Un grupo en el que las piezas de resina no presentaban antibiótico.
- 2.
Un grupo en el que las piezas se analizaron antes de la elución del antibiótico, para observar cómo la presencia de amoxicilina-clavulánico afectaba la dureza de la resina.
- 3.
Otro grupo en el que las piezas fueron estudiadas después de la elución de 7días, con el fin de determinar la resistencia tras la liberación de los antibióticos.
La fuerza de rotura de las piezas del modeloA (resina) previo a la elución y tras la elución se comparó con las piezas del modeloB (cemento con 2g de amoxicilina-clavulánico).
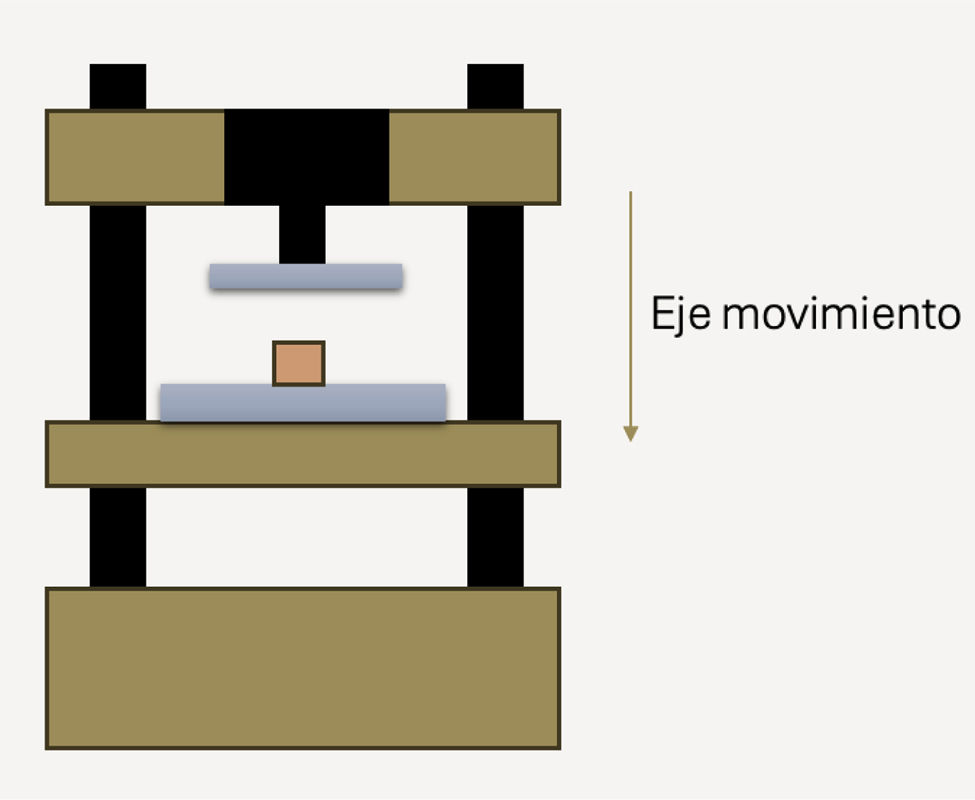
Para determinar la resistencia mecánica, cada pieza fue colocada en el carro de desplazamiento inferior de la máquina de ensayo motorizada PCE-MTS500® (PCE Instruments) (fig. 3). La fuerza aplicada fue monitorizada mediante el dinamómetro PDE-DFG N 5K (PCE Instruments), que mide la fuerza de compresión desde 0 a 5.000N con una precisión del 0,1%. La máquina de ensayo podía aplicar fuerzas de hasta 5.000N, con una velocidad de avance del carro que oscilaba entre 30mm/min y 230mm/min.
Cada pieza fue sometida a compresión en la máquina de ensayo para determinar la fuerza de rotura. Los datos obtenidos se registraron y almacenaron en el ordenador, siendo posteriormente tratados con Microsoft® Excel para generar gráficas que mostraban la fuerza de compresión aplicada en función del tiempo hasta la rotura de las piezas.
Datos y análisis estadísticoLos datos obtenidos se expresaron como media ±error estándar de la media. Para determinar las diferencias de las medias entre dos grupos se utilizó una prueba t de Student. Se determinaron las piezas necesarias para su impresión mediante estadística. Para determinar las diferencias entre tres grupos se utilizó un análisis de varianza (ANOVA) de una vía seguido de un test de Bonferroni. En todos los casos una probabilidad menor de 0,05 (p<0,05) se consideró significativa. El análisis estadístico se realizó con el software Prism6 (GraphPad Software Inc.).
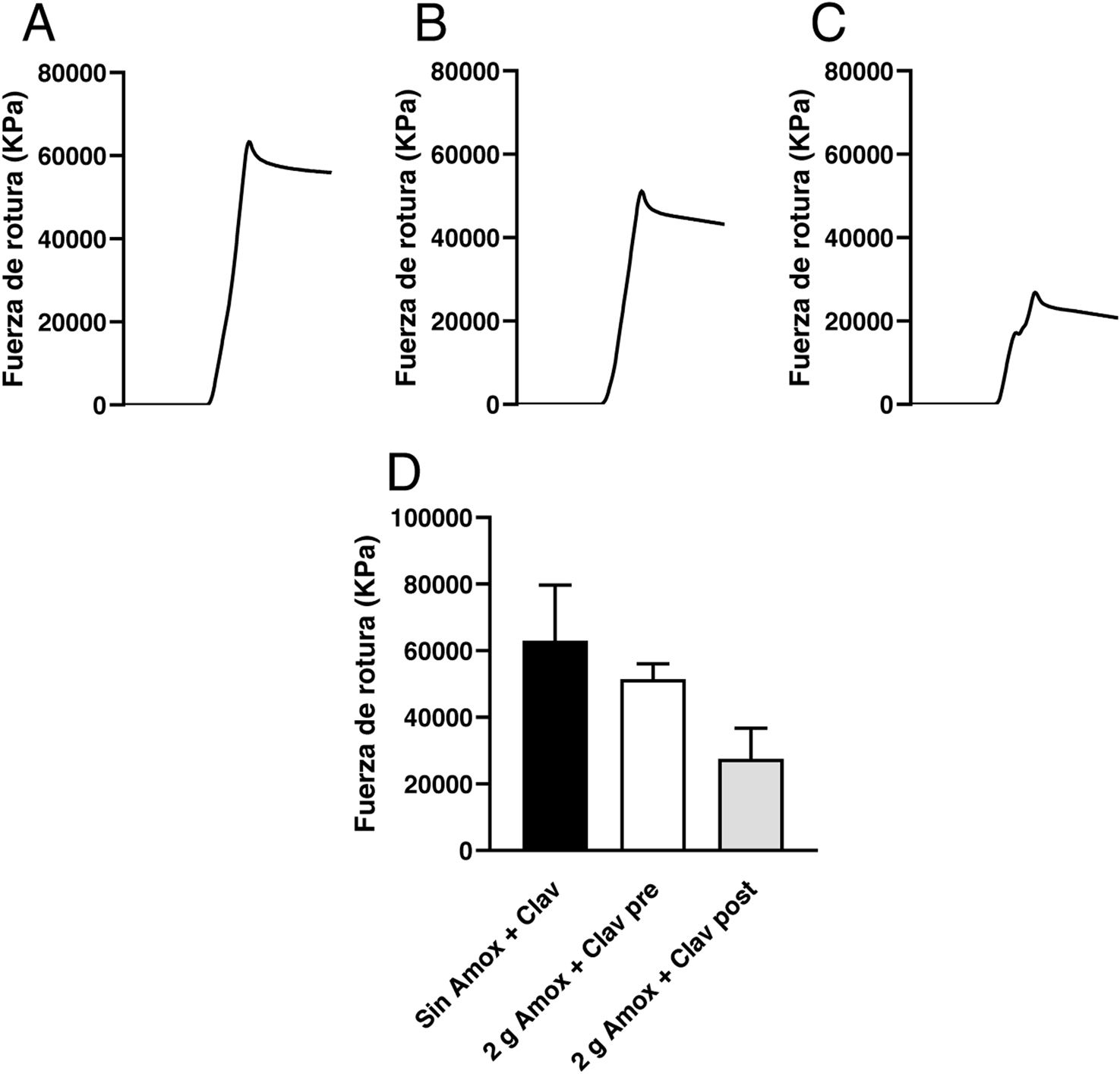
ResultadosLos resultados obtenidos para cada una de las piezas tras ser sometidas al dinamómetro PDE-DFG N 5K para poder determinar la fuerza de rotura fue, para las piezas del modeloA sin antibiótico, un valor medio de 62.940±1.676KPa. En las piezas que se imprimieron de resina junto con la mezcla de antibiótico se obtuvo un valor medio de 38.366±7.721KPa con 1g de antibiótico, pero sin que el antibiótico se hubiera liberado, 44.490±7.599KPa, con 1,5g de antibiótico sin que este se hubiera liberado y con 2g de antibiótico mezclado con la resina sin que se hubiera liberado 51.445±4.594KPa (fig. 4).
Registros de la fuerza de compresión aplicada hasta la rotura de las piezas del modeloA, impresas con 10g de resina Optiprint® Lumina, A)en ausencia (Sin Amox + Clav) o en presencia de 2g de amoxicilina-clavulánico; B)antes (2g Amox + Clav pre) y C)después (2g Amox+ Clav post) de la elución de los fármacos. D)Valores medios y desviación estándar de la fuerza de rotura de las piezas del modeloA en las diferentes condiciones experimentales.
En el caso de las piezas resina-antibiótico en las cuales había habido liberación de antibiótico se obtuvo para las matrices de resina con 1g de antibiótico 60.573±1.499KPa, para las matrices de resina con 1,5g 64.723±1.653KPa, y para las matrices de resina con 2g 25.706±9.197KPa (tabla 1).
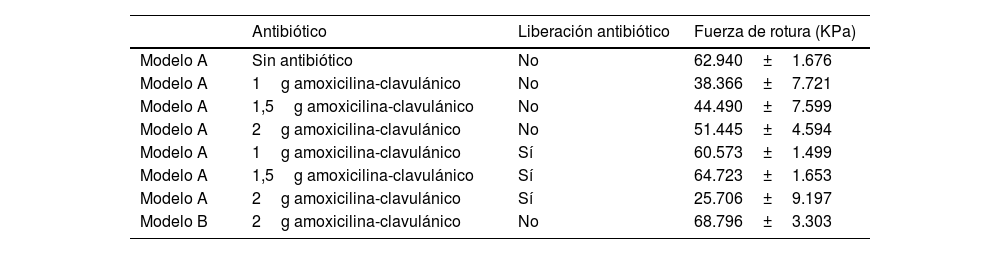
Resumen de las matrices empleadas biomecánicamente, si tenían presencia o no de antibiótico y la comparación con el cemento
| Antibiótico | Liberación antibiótico | Fuerza de rotura (KPa) | |
|---|---|---|---|
| Modelo A | Sin antibiótico | No | 62.940±1.676 |
| Modelo A | 1g amoxicilina-clavulánico | No | 38.366±7.721 |
| Modelo A | 1,5g amoxicilina-clavulánico | No | 44.490±7.599 |
| Modelo A | 2g amoxicilina-clavulánico | No | 51.445±4.594 |
| Modelo A | 1g amoxicilina-clavulánico | Sí | 60.573±1.499 |
| Modelo A | 1,5g amoxicilina-clavulánico | Sí | 64.723±1.653 |
| Modelo A | 2g amoxicilina-clavulánico | Sí | 25.706±9.197 |
| Modelo B | 2g amoxicilina-clavulánico | No | 68.796±3.303 |
El modelo A con 2g de antibiótico en su mezcla liberado presentó una resistencia de 25.706KPa, que era un valor significativamente inferior a los 51.445KPa de la matriz de resina mezclada con 2g de antibiótico que no se hubiera liberado, y así mismo superior a los 68.796KPa del modeloB (pieza fabricada con cemento) con 2g de antibiótico en su mezcla.
En las piezas del modelo A, impresas únicamente con resina Optiprint® Lumina que no poseían antibiótico, se observó mayor resistencia a la rotura que aquellas a las que se les añadió 2g de amoxicilina-clavulánico. La adición de este antibiótico redujo la fuerza de rotura en un 18%. Además, tras la elución del antibiótico durante 7días, las piezas mostraron una reducción adicional de la resistencia, alcanzando una disminución del 56% en comparación con las piezas sin antibiótico.
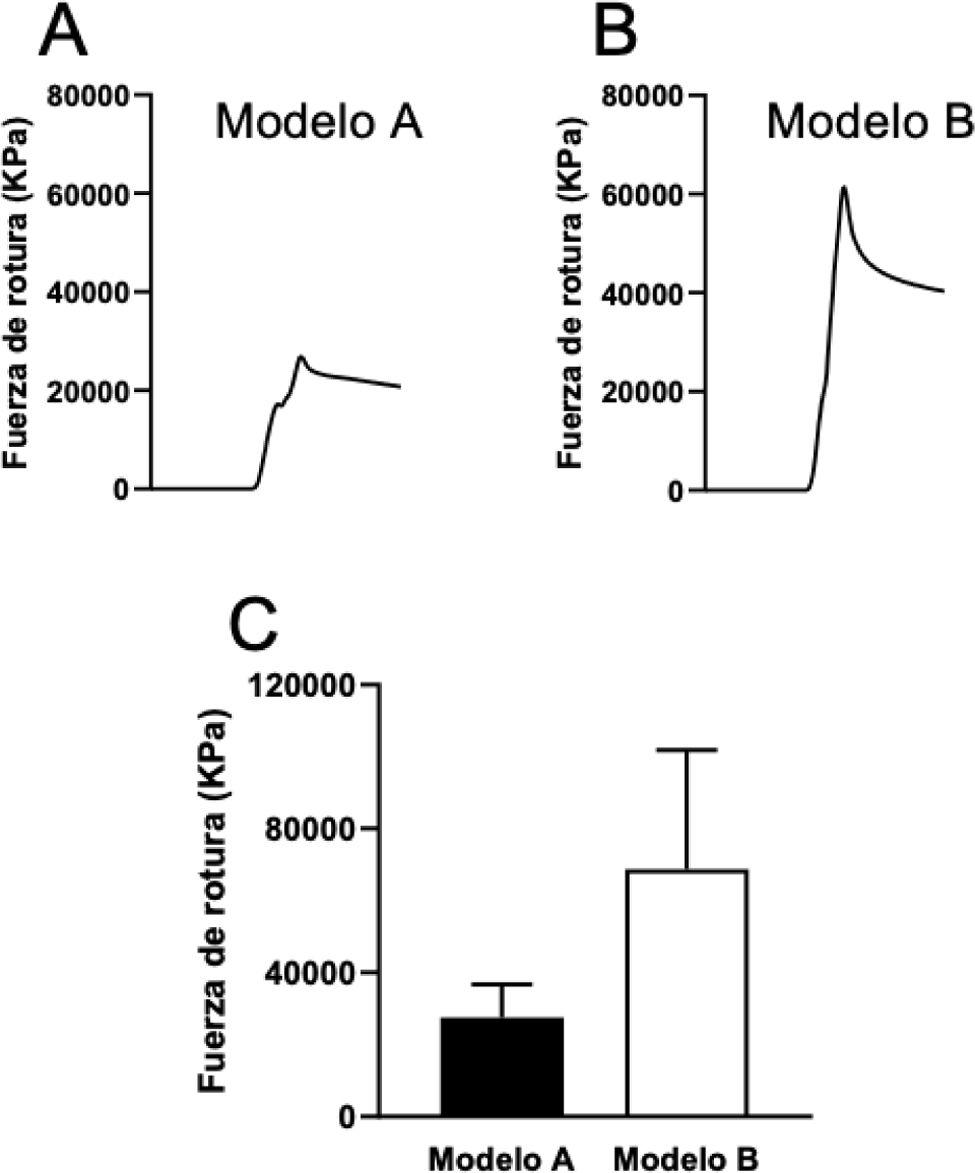
La fuerza de rotura de las piezas del modeloA tras la elución del antibiótico de su interior (2g post) fue comparada con las piezas del modeloB, fabricadas con cemento y mezclado con 2g de amoxicilina-clavulánico. La fuerza de compresión necesaria para la rotura de la pieza del modeloB (con cemento) fue más del doble en comparación con la fuerza aplicada para romper la pieza del modeloA (de resina) (fig. 5). La pieza fabricada con cemento y amoxicilina-clavulánico presentó una mayor dureza que la pieza impresa con resina Optiprint® Lumina. La pieza del modeloB (con cemento) mostró una resistencia significativamente mayor a la rotura incluso después de la elución de los fármacos, existiendo diferencias en la resistencia mecánica en términos de dureza y resistencia comparativa (fig. 6).
Registro de la fuerza de compresión desarrollada hasta la rotura de: A)una pieza del modeloA (resina), y B)una pieza del modeloB (cemento) fabricadas con 2g de amoxicilina-clavulánico después de la elución de los fármacos durante 7días. C)Valores medios de la fuerza de rotura de la pieza del modeloA y modeloB fabricadas con 2g de amoxicilina-clavulánico después de la elución de los fármacos durante 7días.
Actualmente, aunque el PMMA óseo sigue siendo el material más empleado como cárrier de antibiótico local para el tratamiento local de las infecciones, precisa de una elevada temperatura para su polimerización, limitando por tanto el empleo de ciertos tipos de antibióticos18. Biomecánicamente la esterilización por radiación gamma o beta influye también en las propiedades del cemento, ya que reduce el peso molecular del polímero, a diferencia del óxido de etileno, que no afecta dicho peso molecular19. Es por ello que, a pesar de que la resistencia del cemento es óptima, existe una importante limitación a la hora de emplearlo como cárrier local de antibiótico20,21.
En nuestro estudio observamos que las piezas del modeloA impresas únicamente con resina, sin antibiótico, presentaron una resistencia tensil media de 62.000KPa, coincidiendo con valores previamente descritos en la literatura22. Por otro lado, las piezas del modelo que contenían 2g de antibiótico mostraron un valor medio de 51.445KPa. Tras la elución del antibiótico, este modelo redujo su resistencia tensil a 25.706KPa.
Con respecto al cemento, la literatura describe ampliamente la resistencia tensil del PMMA, que puede alcanzar hasta 75.000KPa22,23. Este valor es cercano al observado en nuestro estudio, en el que las piezas de PMMA alcanzaron una resistencia tensil media de 69.000KPa. Comparado con el cemento, la disminución en la resistencia del modeloA demuestra que la eliminación del antibiótico de la estructura vuelve la pieza más frágil y disminuye considerablemente su resistencia a la rotura, pero a pesar de todo mantiene valores óptimos para ser empleados en el paciente. Los valores mecánicos de las piezas con resina y antibiótico, antes de la elución, son similares a los de las piezas impresas solo con resina22,24.
Aunque en las pruebas mecánicas demostraron que el modeloA (fabricado con resina) tenía una menor resistencia tras la elución del antibiótico comparado con aquellas piezas que no habían eluido el fármaco, esta disminución se justifica por la liberación del antibiótico, lo que provoca que las piezas sean menos resistentes a la rotura en comparación con las fabricadas con cemento, en las cuales no existe prácticamente liberación del antibiótico de su interior debido a la alteración de las propiedades fisicoquímicas de amoxicilina-clavulánico. Una de las grandes ventajas de la resina utilizada en nuestro estudio es que, al ser piezas impresas mediante la tecnología SLA, preservan las propiedades fisicoquímicas de antibióticos como amoxicilina-clavulánico, que son termolábiles, lo que amplía las posibilidades de su aplicación en la práctica clínica, aumentando así el arsenal terapéutico disponible. Aun así, los valores impresos fueron mayores a los descritos en la literatura de las fuerzas tensiles con valores máximos de 47.000KPa, siendo inferiores a los valores obtenidos en este estudio del modeloA (resina) con el antibiótico sin liberar25.
Comparado con otros materiales presentes en el mundo de la impresión 3D se encuentra el filamento tipo PLA (también llamado ácido poliláctico), que además se emplea en las impresoras por extrusión. La variabilidad mecánica en la impresión por extrusión es una de las más elevadas, alcanzando aproximadamente el 50%, en contraste con la impresión SLA, cuya variabilidad es de apenas un 1%24. Se ha documentado que los objetos fabricados mediante impresión SLA pueden soportar fuerzas tensiles de hasta 66.000KPa, mientras que los generados con tecnología por extrusión26 alcanzan solo 33.000KPa. La resistencia a la tensión aumenta con el incremento del grosor de la capa, ya que las fracturas suelen originarse en la unión entre capas, donde ocurre la polimerización. Gracias a la baja anisotropía y la eficiente polimerización entre capas, las piezas obtenidas con SLA presentan mayor resistencia a la tensión en comparación con las fabricadas mediante impresoras por extrusión.
Aunque se ha empleado el diseño cilíndrico con perforaciones para facilitar el estudio y las pruebas in vitro, a la hora de la aplicación clínica podría emplearse la mezcla antibiótico-resina con moldes o bien estructuras que sean necesarias o que deseen emplearse para los pacientes. La impresión 3D permite obtener objetos custom-made dependiendo de las necesidades tanto del cirujano como del paciente, realizando una práctica clínica mucho más personalizada. Eso implica que podrían diseñarse piezas como placas o tornillos para implantarlas dentro del paciente, con el objetivo de dar, por una parte, soporte estructural, y por otra, eluir antibiótico para realizar profilaxis o tratamiento de las infecciones osteoarticulares.
Entre las limitaciones presentes de este estudio se encuentra que es un estudio experimental in vitro y que además, para su aplicabilidad clínica, se requeriría realizar un estudio con experimentación animal para su validación preclínica previo a un ensayo clínico. Además, la bibliografía que existe actualmente sobre este campo es escasa.
ConclusionesLa impresión SLA permite la obtención de piezas con resina biocompatible con amoxicilina-clavulánico, un antibiótico termolábil que actualmente no puede ser empleado en el cemento óseo debido a la alteración de sus propiedades fisicoquímicas por su polimerización. Aunque presenta una resistencia mecánica con valores menores comparados con el cemento óseo, son óptimos para su empleo en un futuro en los pacientes.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónEste proyecto ha recibido la beca INVESTIGACIÓN DE LA SECOT de 2022.
Conflicto de interesesLos autores declaran que no ha habido conflicto de intereses