Valorar los factores clínicos, radiológicos e histológicos que pueden predecir la recidiva local de fibromatosis.
MétodosHemos realizado un estudio retrospectivo de 51 pacientes con diagnóstico de fibromatosis en nuestra institución desde 1983 hasta 2014. La media de seguimiento es de 83 meses. Hemos estudiado parámetros clínicos, localización, profundidad, tamaño, márgenes quirúrgicos e índice de proliferación (Ki-67) del tumor. Asimismo, hemos valorado el riesgo de recidiva en función del tratamiento adyuvante y la relación del tratamiento con la funcionalidad del paciente.
ResultadosHemos observado diferencias estadísticamente significativas en cuanto a la profundidad (p=0,003) y la localización (p<0,001) como factores de riesgo de recidiva local. No existen diferencias estadísticamente significativas en cuanto a edad, sexo, tamaño, márgenes quirúrgicos ni tratamientos adyuvantes, ni en el Musculoskeletal Tumor Society Score en función del tratamiento recibido. El Ki-67 tiene una media de 1,9% (rango 1-4) y su valor no se asocia con el riesgo de recidiva.
DiscusiónLos tumores profundos a la fascia y los localizados en extremidades son más agresivos que los localizados superficialmente y en el tronco. El Ki-67 no tiene valor predictivo en las recidivas de la fibromatosis. La radioterapia, la quimioterapia u otros tratamientos adyuvantes como el tamoxifeno no han sido eficaces en el control local de la enfermedad. La gran cantidad de recidivas, incluso en pacientes con resecciones adecuadas, induce a plantear la posibilidad de una actitud expectante en tumores asintomáticos o en enfermedad estable.
To evaluate the clinical, radiological and histological factors that can predict local recurrence of fibromatosis.
MethodsA retrospective study was conducted on 51 patients diagnosed with fibromatosis in this hospital from 1983 to 2014. The mean follow-up was 83 months. A study was made of the clinical parameters, location, depth, size, surgical margins, and proliferation index (Ki-67). An evaluation was also made of the risk of recurrence depending on the adjuvant treatment and the relationship between treatment and patient functionality.
ResultsTumour location and depth were identified as risk factors for local recurrence, showing statistically significant differences (P<.001 and P=.003, respectively). There were no statistically significant differences in age, gender, size, surgical margins, or adjuvant treatments, or in the Musculoskeletal Tumour Society Score according to the treatment received. The mean Ki-67 was 1.9% (range 1-4), and its value was not associated with the risk of recurrence.
DiscussionDeep fibromatosis fascia tumours, and those located in extremities are more aggressive than superficial tumours and those located in trunk. The Ki-67 has no predictive value in local recurrence of fibromatosis. Radiotherapy, chemotherapy, or other adjuvant treatments such as tamoxifen have not been effective in local control of the disease. Given the high recurrence rate, even with adequate margins, a wait and see attitude should be considered in asymptomatic patients and/or stable disease.
La fibromatosis, o tumor desmoide, es una proliferación clonal derivada de células mesenquimales que asienta en la fascia y estructuras musculoaponeuróticas. Constituye un grupo poco prevalente de tumores de partes blandas, con una incidencia de 2,4-4,3 nuevos casos por 106 habitantes-año1–3.
Durante muchos años, el tratamiento habitual de este tumor ha sido fundamentalmente quirúrgico, reservando la quimioterapia, la radioterapia u otros tratamientos sistémicos, como el tamoxifeno o, más recientemente, el imatinib o el toremifeno2,4, para aquellos casos en los que los márgenes quirúrgicos fueran positivos, mejorando el control local de la enfermedad1.
Puede aparecer en prácticamente cualquier localización del cuerpo5,6 y es localmente agresivo, con un alto índice de recidiva local, a pesar de una resección quirúrgica amplia, aunque sin capacidad de metastatizar a distancia2.
En los últimos años, se ha propuesto el manejo conservador como una opción aceptable de tratamiento, ya que no es infrecuente la detención espontánea del crecimiento del tumor. Esto evitaría las complicaciones funcionales y los efectos posradiación que se asocian al manejo radical convencional de la fibromatosis1.
Al tratarse de una entidad poco frecuente, las series de las que disponemos en la literatura no nos permiten establecer un consenso respecto a algunos de los factores que influyen en la evolución natural de esta enfermedad. Nuestra intención es valorar los datos que pueden predecir la recidiva local.
MétodosHemos realizado un estudio retrospectivo en el que se han identificado 192 pacientes con diagnóstico anatomopatológico de fibromatosis en nuestra institución desde 1983 hasta 2014. Fueron excluidos aquellos cuyo diagnóstico clínico fuera enfermedad de Dupuytren, Ledderhorse o tumores desmoides intraabdominales, ya que su pronóstico es más favorable, así como pacientes cuyo diagnóstico final fuera dudoso.
De los pacientes incluidos, se recogieron las siguientes variables: edad en el momento del diagnóstico, sexo, tipo de prueba de imagen empleada en el diagnóstico, localización, tamaño y profundidad del tumor, su relación con el paquete vascular, el tratamiento inicial que recibieron, los márgenes de resección del tumor primario, recidivas, tiempo hasta la recidiva, su tratamiento y márgenes quirúrgicos y, finalmente, el tiempo de seguimiento, estado actual de los pacientes y funcionalidad según el Musculoskeletal Tumor Society Score. Debido al amplio rango de años en el que fueron diagnosticados nuestros pacientes, también hemos recogido las variaciones en el tipo de tratamiento a lo largo del tiempo.
Todos nuestros casos fueron identificados inicialmente en función de su presentación en nuestro centro como primarios o recidivas; sin embargo, en el análisis estadístico no se tiene en cuenta dicha diferencia para la clasificación de los tumores primarios o recidivas y la posterior determinación de factores de riesgo.
Posteriormente, se realizó el análisis estadístico mediante Chi2, para valorar la influencia del sexo, la edad, la profundidad, el tamaño, la localización, los márgenes quirúrgicos y el tratamiento inicial sobre las recidivas locales.
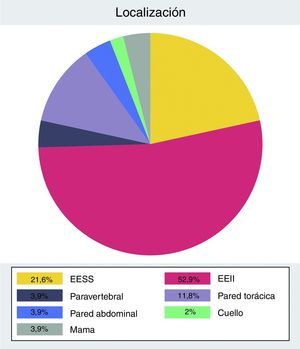
Para dicho análisis, en función de la edad, fueron clasificados como «jóvenes» aquellos pacientes que tenían≤30 años, o «mayores» si tenían>30 años. Según el tamaño, se clasificaron como «pequeños» los tumores que medían<5cm y «grandes» los que medían≥5cm, al igual que los sarcomas de partes blandas. Finalmente, la localización fue dividida en 2 grandes grupos: extremidades y tronco, incluyendo en este último los localizados en cuello, mama, pared torácica, pared abdominal y paravertebrales.
Se valoró el tratamiento inicial de nuestros pacientes. La mayoría de ellos recibieron cirugía como terapia única. Algunos casos recibieron, además de la cirugía, terapias adyuvantes como radioterapia, quimioterapia o tamoxifeno.
La clasificación de los márgenes de resección sigue los criterios de Enneking. Además, se realizó una revisión de las preparaciones histológicas para la cuantificación del Ki-67, de los bloques histológicos a partir del año 1992.
ResultadosNuestra serie cuenta con 51 pacientes con diagnóstico clínico y anatomopatológico de fibromatosis. De ellos, 29 fueron tratados primariamente en nuestro centro y 22 se presentaron como recidivas.
La media de seguimiento es de 83 meses (rango 6-240 meses).
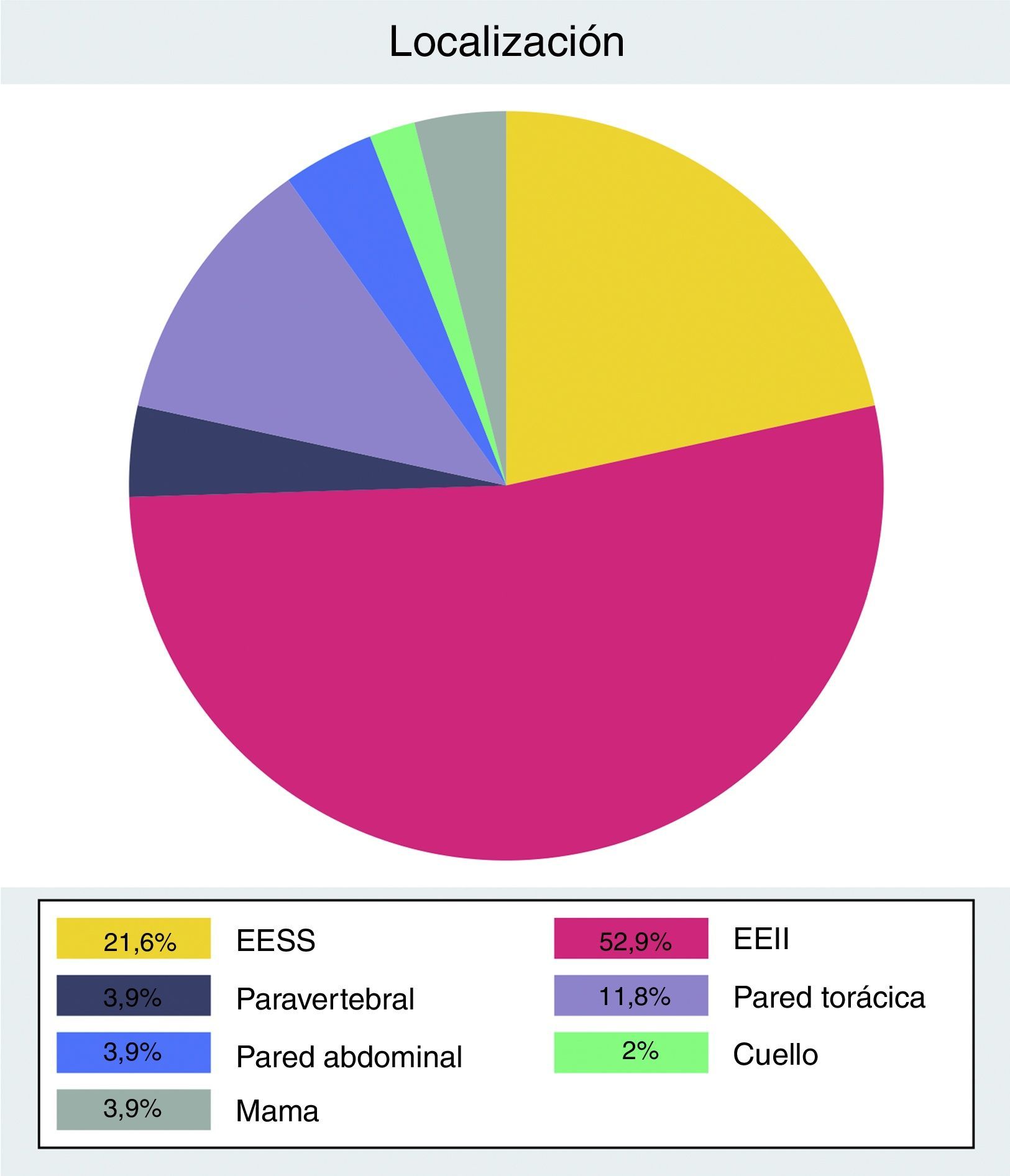
La distribución anatómica presenta mayor prevalencia de tumores localizados en las extremidades (n=38) respecto al tronco (n=13) (fig. 1).
La edad media en el momento del diagnóstico es 26 años, con un rango que va desde los 2 a los 68 años. La distribución por sexos muestra una discreta predominancia masculina, a diferencia del resto de las series publicadas.
El tamaño medio, medido como el diámetro máximo del tumor, es 9,9cm (rango 3 a 31cm). Respecto a la fascia, la mayoría se encuentran profundos a ella. La prueba de imagen empleada para el estudio de estos tumores fue, inicialmente, la ecografía. A partir del año 1990, el diagnóstico se realiza mediante resonancia magnética.
Se consiguió una resección completa tanto macroscópica como microscópicamente (R0) en 11 pacientes. En 16, los márgenes fueron microscópicamente positivos (R1), y en 11 casos, la resección fue intencionadamente incompleta de entrada (R2) debido, principalmente, a la gran morbilidad derivada de una cirugía radical en determinadas localizaciones como el hueco poplíteo, la ingle y la axila. En 13 pacientes no disponemos de información acerca del resultado de los márgenes de resección del tumor primario (tabla 1).
Características de los pacientes afectos de fibromatosis y del tumor primario
| n | % | |
|---|---|---|
| Sexo | ||
| Hombre | 28 | 45,1 |
| Mujer | 23 | 54,9 |
| Profundidad | ||
| Superficial | 9 | 17,6 |
| Profundo | 41 | 80,4 |
| ND | 1 | 2 |
| Tamaño | ||
| <5cm | 4 | 7,8 |
| ≥5cm | 47 | 92,2 |
| Relación paquete vascular | ||
| Sí | 9 | 17,7 |
| No | 17 | 33,3 |
| ND | 25 | 49 |
| Tratamiento tumor primario | ||
| Cirugía | 40 | 78,4 |
| Cirugía+RT | 9 | 17,6 |
| Cirugía+QT | 1 | 2 |
| Cirugía+RT+tamoxifeno | 1 | 2 |
| Márgenes resección primario | ||
| R0 | 11 | 21,6 |
| R1 | 16 | 31,4 |
| R2 | 11 | 21,5 |
| ND | 13 | 25,5 |
| Recidiva local | ||
| No | 13 | 25,5 |
| Sí | 37 | 72,5 |
| ND | 1 | 2 |
ND: no disponible; QT: quimioterapia; RT: radioterapia.
En nuestros pacientes, el índice de proliferación, cuantificado mediante el Ki-67, tiene una media de 1,9% (rango 1-4).
El número total de recidivas de nuestra series es 37, incluyendo los casos incidentes (n=15) más los que se presentaron como recidiva en nuestra institución (n=22). De entre ellos, 22 presentaron nuevas recidivas (n=7 y n=15, respectivamente). La incidencia de rerecidivas es menor en los casos tratados primariamente en nuestro centro (46,7 vs. 68,2%), aunque dicha diferencia no es estadísticamente significativa (p=0,443). Tampoco hay diferencias estadísticamente significativas en las rerecidivas en función del tratamiento de la primera recidiva (p=0,112).
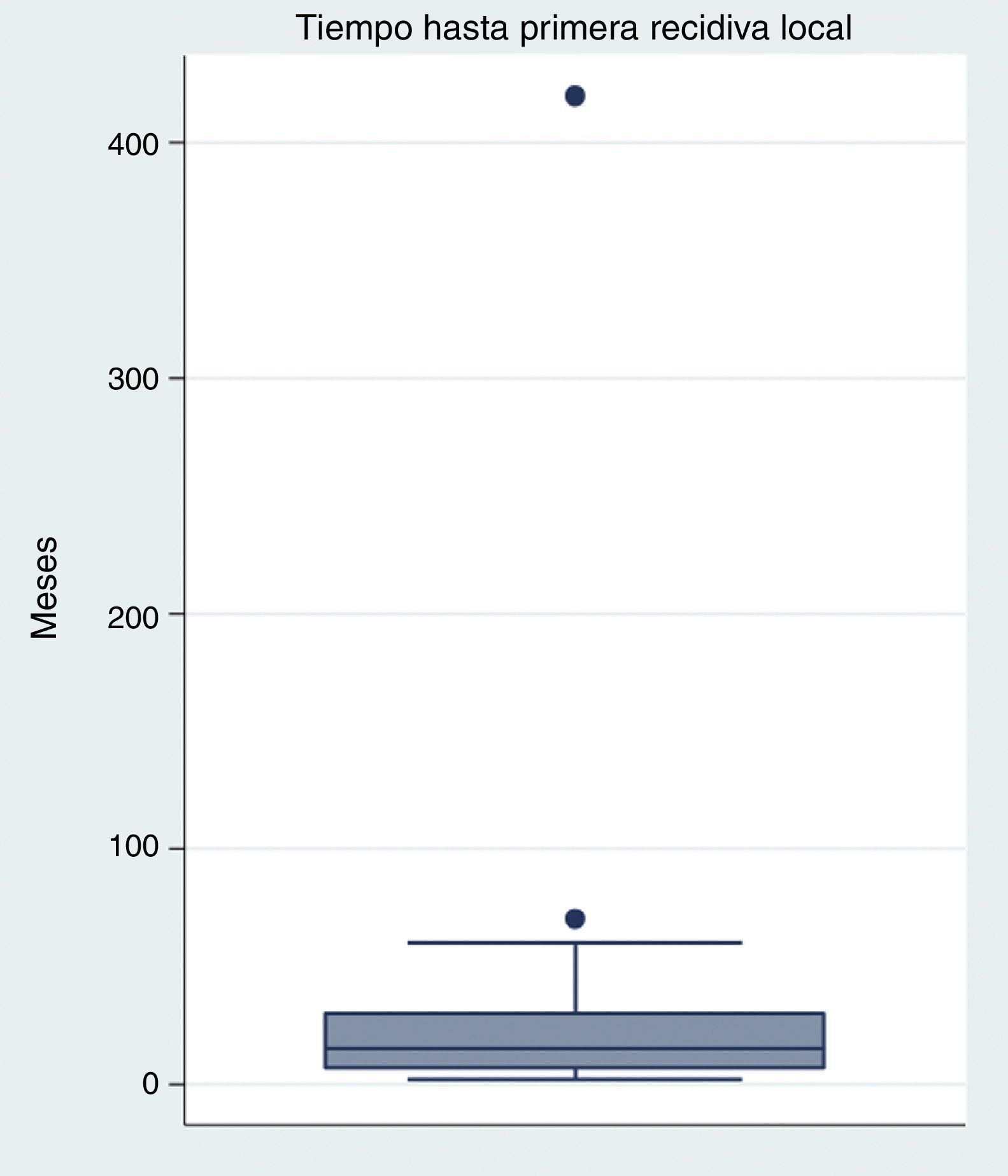
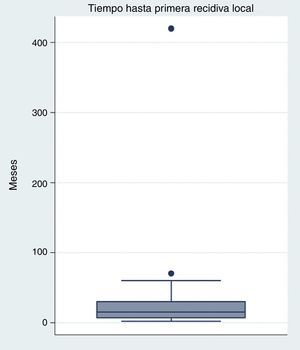
El tiempo medio transcurrido entre la resección primaria y la primera recidiva es de 32 meses (rango 2-420 meses), aunque lo más frecuente es la recidiva durante el primer año (fig. 2). El tiempo medio hasta las nuevas recidivas es similar al de la primera (media 22,56, rango 2-42).
Debido al reducido número de casos tratados con terapias adyuvantes no se identifica un patrón claro de elección de dicho tratamiento. Lo que sí se observa es variación a lo largo de los años en cuanto al tipo de radioterapia. Hasta el año 1999, los pacientes sometidos a radioterapia recibieron la intraoperatoria complementada posteriormente con radioterapia externa, mientras que a partir de dicho año se emplea braquiterapia más radioterapia externa. En ambos grupos la dosis media recibida es de 45Gy, y en ningún caso supera los 60Gy.
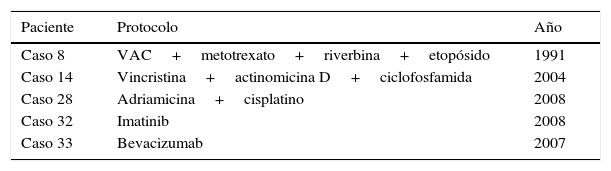
En cuanto al protocolo de quimioterapia, tampoco observamos homogeneidad (tabla 2).
Protocolos de quimioterapia administrados
| Paciente | Protocolo | Año |
|---|---|---|
| Caso 8 | VAC+metotrexato+riverbina+etopósido | 1991 |
| Caso 14 | Vincristina+actinomicina D+ciclofosfamida | 2004 |
| Caso 28 | Adriamicina+cisplatino | 2008 |
| Caso 32 | Imatinib | 2008 |
| Caso 33 | Bevacizumab | 2007 |
VAC: vincristina+doxorrubicina+ciclofosfamida.
En el momento actual, 27 pacientes se encuentran libres de enfermedad, 8 se encuentran en fase de progresión, 15 en fase de enfermedad estable y de un paciente no disponemos de información.
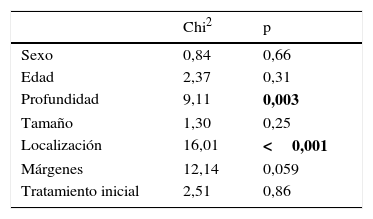
En nuestra serie no hemos observado diferencias estadísticamente significativas en cuanto a sexo, edad, tamaño, márgenes ni tratamiento inicial como factores de riesgo de recidiva local. Por el contrario, sí que hemos observado un mayor riesgo de recidiva local en aquellos pacientes que presentan tumores profundos a la fascia (p=0,003) y tumores localizados en las extremidades (p<0,0001) (tabla 3).
El Musculoskeletal Tumor Society Score tampoco muestra diferencias estadísticamente significativas (p=0,19) entre aquellos pacientes que fueron tratados con cirugía únicamente comparados con los que fueron tratados con cirugía más radioterapia y los que fueron seguidos mediante vigilancia periódica. Otras complicaciones descritas, derivadas de la cirugía, incluyen linfedema (n=2) y parálisis del ciático poplíteo externo (n=1).
DiscusiónEn la mayoría de los estudios actuales, se considera la positividad de los márgenes quirúrgicos como un factor de riesgo para la recidiva local; sin embargo, no existe un consenso universal al respecto3,6–8. En nuestro caso, no hemos observado diferencias estadísticamente significativas en cuanto a este parámetro.
A pesar de no haber unanimidad al respecto, el efecto negativo que tiene una cirugía incompleta con márgenes positivos (R1, R2) sobre la recidiva local de la enfermedad tiene una fuerte base biológica9. Hasta un 75% de los tumores desmoides presentan mutaciones asociadas a la ß-catenina. La gran mayoría son esporádicos, aunque existe un pequeño porcentaje que está asociado a mutaciones del gen APC, en el síndrome de Gardner1,10,11.
En la fase inicial de la cicatrización de heridas se liberan factores de crecimiento que activan la ß-catenina. Esta proteína tiene un papel importante en la cicatrización, ya que estimula la proliferación fibroblástica, por lo que tiene también trascendencia en los trastornos fibroproliferativos. La resección tumoral incompleta implica dejar células genéticamente alteradas en el lecho, expuestas a los mecanismos de cicatrización de los tejidos. De esta forma, la propia cirugía actúa como un potenciador tumoral en aquellos casos en los que hay una aberración en la ß-catenina.
Se han identificado varias mutaciones en el gen CTNNB1, responsable de la codificación de la ß-catenina. Las mutaciones de este gen que se asocian a la fibromatosis son T41A, S45F y 45P, pero el único que tiene valor pronóstico como predictor de recidiva local es S45F12. Estas variaciones en las mutaciones de la ß-catenina pueden explicar, en parte, las diferencias en el desarrollo de recidivas en relación con los márgenes quirúrgicos1,8,12.
Como hemos visto hasta ahora, la evolución de este tumor es, hasta cierto punto, impredecible. En muchos casos hay una alta tendencia a la recidiva local a pesar de una resección aparentemente completa. Por otro lado, algunos estudios apoyan el hecho de que las terapias adyuvantes pueden ser eficaces en el control de la enfermedad; sin embargo, tampoco hay consenso al respecto, puesto que hay tumores desmoides en los que se ha observado la detención espontánea de su crecimiento3,7,13,14. Lo que sí parece claro es que a medida que aumentamos las medidas terapéuticas, además de incrementar el control de la enfermedad, acrecentamos las consecuencias funcionales, especialmente derivadas de la cirugía radical y la radioterapia13,14.
Hemos de recordar que, en nuestra serie, el tratamiento mediante vigilancia periódica se ha llevado a cabo solo en pacientes que ya han desarrollado una recidiva local, por lo tanto, no sabemos qué habría pasado si no hubiéramos operado los primarios.
En los tumores de alto grado, cuando observamos recidivas múltiples, el tiempo libre de enfermedad entre cada una de las recidivas se va acortando de forma progresiva. En los tumores desmoides, las recidivas no siguen este patrón. Tal como hemos visto en nuestra serie, las recidivas, tanto primarias como secundarias, se dan con más frecuencia durante el primer año, sin que el tiempo libre de enfermedad entre la primera y la segunda recidiva se acorte de manera significativa.
Debido a la falta de evidencia en nuestra serie acerca de la eficacia de los diferentes tratamientos sobre el control local de la enfermedad, no podemos aconsejar activamente el uso de la radioterapia, la quimioterapia o el tamoxifeno como tratamientos adyuvantes.
Se ha visto que en casos seleccionados, en los que el tumor es asintomático y no muestra un comportamiento agresivo a lo largo de su seguimiento, el tratamiento conservador mediante vigilancia periódica alcanza un control local de la enfermedad a 3 años similar al de los pacientes en los que se ha realizado una resección completa (R0)1,3,7.
Debido al alto índice de recidivas locales y a la morbilidad derivada de las múltiples cirugías, debe considerarse la posibilidad de una actitud expectante en todos aquellos tumores desmoides, primarios o recidivas, asintomáticos y que no presentan crecimiento a lo largo de su evolución.
Nivel de evidenciaNivel de evidencia III.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Juan Pons de Villanueva y al Dr. Dámaso Aquerreta.