Existe poca información sobre la evolución, complicaciones y los tratamientos recibidos por los pacientes críticos con COVID-19 que requieren ingreso en una unidad de cuidados intensivos (UCI). El objetivo de este estudio es describir la evolución clínica, los tratamientos utilizados, las complicaciones y resultados de pacientes críticos COVID-19 ingresados en siete UCI de Anestesiología en la Región de Galicia durante el pico de la pandemia en marzo-abril 2020.
MétodosEntre el 21 de marzo y el 19 de abril de 2020 evaluamos a todos los pacientes críticos COVID-19 ingresados en las UCI de Anestesiología de siete hospitales en Galicia, en el Noroeste de España. Los resultados, complicaciones y los tratamientos administrados se registraron hasta el 6 de mayo de 2020, fecha final del seguimiento.
ResultadosUn total de 97 pacientes críticos COVID-19 fueron incluidos. Durante su estancia en UCI, 80 pacientes (82,5%) necesitaron ventilación mecánica, y 22 pacientes (22,7%) traqueotomía. El decúbito prono se usó frecuentemente en pacientes intubados (67,5%) y despiertos (27,8%). Las medicaciones usadas fueron antivirales (92,7%), corticoides (93,8%), tocilizumab (57,7%), y dosis intermedias y altas de anticoagulantes (83,5%). Las complicaciones más frecuentes fueron infecciones adquiridas en UCI (52,6%), eventos trombóticos (16,5%), y reintubaciones (9,3%). Tras un seguimiento medio de 42 (34-45) días, 15 pacientes fallecieron (15,5%), 73 pacientes (75,2%) habían sido dados de alta de UCI y nueve pacientes (9,3%) permanecían todavía en la unidad.
ConclusionesUn alto porcentaje de nuestros pacientes críticos COVID-19 requirieron ventilación mecánica, posición prona, medicaciones antivirales, corticoides y anticoagulantes. Las complicaciones en UCI fueron frecuentes, principalmente infecciones y eventos trombóticos. Tuvimos una mortalidad relativamente baja del 15,5%.
There are limited information on outcome, complications and treatments of critically ill COVID-19 patients requiring admission to an intensive care unit (ICU). The aim of this study is to describe the clinical ICU course, treatments used, complications and outcomes, of critically ill COVID-19 patients admitted in seven ICU in Galicia region during the 2020 March-April pandemic peak.
MethodsBetween March 21 and April 19, 2020, we evaluated critically ill COVID-19 patients admitted to the ICU of Anesthesia of seven hospitals in Galicia, northwestern Spain. Outcome, complications, and treatments were monitored until May 6, 2020, the final date of follow-up.
ResultsA total of 97 critically ill COVID-19 patients were included. During ICU stay, mechanical ventilation became necessary in 80 (82.5%) patients, and tracheostomy in 22 (22.7%) patients. Prone position was used frequently in both intubated (67.5%) and awake (27.8%) patients. Medications consisted of antivirals agents (92.7%), corticosteroids (93.8%), tocilizumab (57.7%), and intermediate or high doses of anticoagulants (83.5%). The most frequent complications were ICU-acquired infection (52.6%), thrombosis events (16.5%), and reintubation (9.3%). After a median follow-up of 42 (34-45) days, 15 patients (15.5%) deceased, 73 patients (75.2%) had been discharged from ICU, and nine patients (9.3%) were still in the ICU.
ConclusionsA high proportion of our critically ill COVID-19 patients required mechanical ventilation, prone positioning, antiviral medication, corticosteroids, and anticoagulants. ICU complications were frequent, mainly infections and thrombotic events. We had a relatively low mortality of 15,5%.
Desde la aparición de la infección por el nuevo coronavirus (SARS-CoV-2) en Wuhan, China, en diciembre de 2019, ésta se ha extendido rápidamente por China y muchos otros países1-2. El 31 de enero 2020, España confirmó su primer paciente con COVID-19, y Galicia, una pequeña región ubicada al Noroeste del país, aproximadamente un mes después. Galicia vivió un incremento de infecciones graves con numerosos ingresos a la UCI antes del 28 de marzo de 2020.
Varios estudios han aportado datos sobre pacientes críticamente enfermos con COVID-193-14. La mayoría de ellos describen las características clínicas de los pacientes con COVID-19 en el hospital o la UCI, además del porcentaje de pacientes que requieren ventilación mecánica, así como las tasas de mortalidad4-14. Sin embargo, en muchos de estos estudios solo se realizaron breves seguimientos. Además, no proporcionaron datos sobre los medicamentos administrados como anticoagulantes, antibióticos, agentes antivirales o corticoides; ni complicaciones como infecciones, eventos tromboembólicos, barotrauma o reintubaciones.
Por lo tanto, se realizó un estudio observacional, prospectivo, multicéntrico, que incluyó a pacientes críticamente enfermos, que tenían infección por COVID-19 y que requirieron ingreso en una UCI de Anestesiología en siete hospitales diferentes en el Noroeste de España. Nuestro objetivo fue evaluar el curso clínico en UCI de estos pacientes, su resultado, complicaciones, así como los tratamientos utilizados.
MétodosEntre el 21 de marzo y el 19 de abril de 2020, evaluamos prospectivamente todos los pacientes con casos de COVID-19 en estado crítico ingresados en las UCI de Anestesia de siete hospitales ubicados en Galicia, Noroeste de España. El resultado clínico se controló hasta el 6 de mayo de 2020, última fecha de seguimiento. Se definió un caso confirmado de COVID-19 por un resultado positivo en una reacción en cadena de la polimerasa con transcriptasa inversa (RTPCR)15. El Comité de Ética de Galicia (código 2020-188) aprobó este estudio y debido a la rápida aparición de esta enfermedad infecciosa, se eliminó la necesidad de consentimiento informado de los pacientes.
Se recogieron los siguientes datos de todos los pacientes al ingreso en UCI: edad, sexo, altura, enfermedades concomitantes y tratamientos domiciliarios; además de la puntuación de la escala de evaluación de la fisiología aguda y salud crónica ii (APACHE ii), la presión arterial parcial de oxígeno (PaO2), la fracción de oxígeno inspirado (FiO2), la relación PaO2/FiO2 y pruebas de laboratorio iniciales (hemograma, bioquímica sérica, enzimas miocárdicas, interleuquina-6, ferritina sérica, procalcitonina, lactato deshidrogenasa, dímero D, proteína C-reactiva). La evaluación adicional consistió en la presencia de infecciones coexistentes, tiempo desde la parición de los síntomas iniciales hasta el ingreso en el hospital y en la UCI y la evaluación de la radiografía de tórax.
Durante la estancia en UCI evaluamos el resultado global de los pacientes, su medicación (vasopresores, antibióticos, antivirales, corticoides, anticoagulantes, etc.), el modo de apoyo respiratorio (ventilación mecánica invasiva, ventilación no invasiva, cánulas nasales de alto flujo), el uso de oxigenación por membrana extracorpórea (ECMO), el uso de terapia de reemplazo renal, el uso de decúbito prono en pacientes despiertos o intubados, la necesidad de traqueostomía para ventilación mecánica prolongada (traqueotomía quirúrgica frente a traqueotomía percutánea por dilatación), los valores de laboratorio más altos durante el ingreso en UCI (interleuquina-6, ferritina sérica, procalcitonina, lactato deshidrogenasa, dímero D, proteína C-reactiva), las complicaciones (infección adquirida en UCI, complicaciones tromboembólicas, necesidad de reintubación, lesión renal aguda que requiere terapia de reemplazo renal, neumotórax, reingreso en UCI, etc.) y el resultado en UCI que incluyó el número de pacientes que fallecieron, los que fueron dados de alta y los que aún permanecían en la unidad al finalizar el seguimiento al 6 de mayo de 2020.
Los autores diseñaron el ensayo, recopilaron los datos y realizaron el análisis. Todos los autores revisaron el manuscrito, dan fe de su exactitud y la integridad de los datos, y aprobaron la decisión de enviar el manuscrito para su publicación.
Análisis estadísticoEl objetivo principal del estudio fue describir el curso clínico de los pacientes críticos enfermos por COVID-19 ingresados en las UCI de Anestesia de la región de Galicia durante el pico de la pandemia de marzo a abril de 2020, los tratamientos utilizados, las complicaciones y resultados. Los pacientes y los datos de seguimiento se recopilaron hasta que más del 85% de los pacientes con COVID-19 experimentaron los resultados de interés (murieron en la UCI o fueron dados de alta de la unidad). Como objetivo secundario se compararon las características de los pacientes entre aquellos que sobrevivieron y los fallecidos durante el ingreso en la UCI.
Las variables numéricas se describieron mediante mediana y rango intercuartílico. Las variables categóricas fueron descritas como frecuencia y porcentaje. Basado en la prueba de Levene, la prueba de hipótesis nula no paramétrica se realizó debido a que las variables continuas son heterocedásticas frente a factores categóricos. Las variables numéricas y categóricas se compararon con el uso de las pruebas pareadas de Wilcoxon o Kruskal-Wallis, y las variables factoriales se compararon con la prueba de χ2 de Pearson. Todos los valores de p obtenidos fueron penalizados con el procedimiento Benjamini-Hochberg. Todos los análisis se realizaron en R v.3.6®.
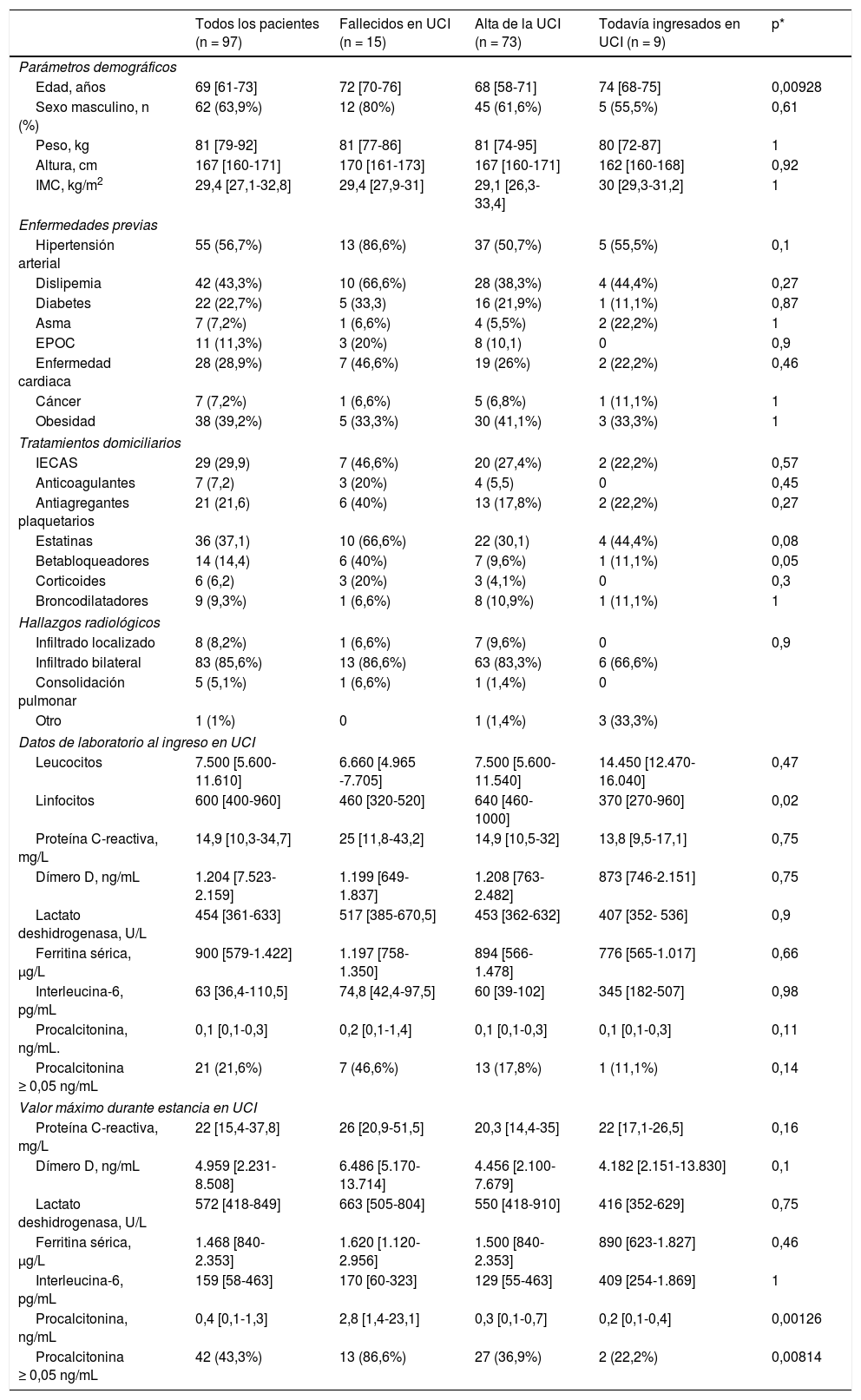
ResultadosEntre el 21 de marzo y el 19 de abril de 2020, 97 pacientes críticamente enfermos por COVID-19 fueron ingresados en las UCI de Anestesia de siete hospitales del Noroeste de España. La tabla 1 muestra las características de los pacientes, sus enfermedades coexistentes, medicación crónica y evaluación de la radiografía de tórax en el momento del ingreso a la UCI. La mediana de edad de los pacientes fue de 69 (61-73) años. La edad avanzada se asoció con el fallecimiento durante la estancia en UCI (tabla 1). Las patologías coexistentes más frecuentes fueron la hipertensión arterial (56,7%), la dislipemia (43,3%) y la obesidad (39,2%). Se obtuvo una radiografía de tórax de todos los pacientes y el 85,6% tenía hallazgos radiológicos con infiltrados parcheados bilaterales. Los valores de las pruebas de laboratorio al ingreso en la UCI y los niveles más altos obtenidos durante la estancia en UCI se muestran en la tabla 1. Un recuento linfocitario más bajo al ingreso y unos niveles más altos de procalcitonina durante la estancia en la UCI se asociaron con mal pronóstico.
Características clínicas y parámetros analíticos al ingreso en la UCI y valores más elevados durante la estancia en UCI de los 97 pacientes
| Todos los pacientes (n = 97) | Fallecidos en UCI (n = 15) | Alta de la UCI (n = 73) | Todavía ingresados en UCI (n = 9) | p* | |
|---|---|---|---|---|---|
| Parámetros demográficos | |||||
| Edad, años | 69 [61-73] | 72 [70-76] | 68 [58-71] | 74 [68-75] | 0,00928 |
| Sexo masculino, n (%) | 62 (63,9%) | 12 (80%) | 45 (61,6%) | 5 (55,5%) | 0,61 |
| Peso, kg | 81 [79-92] | 81 [77-86] | 81 [74-95] | 80 [72-87] | 1 |
| Altura, cm | 167 [160-171] | 170 [161-173] | 167 [160-171] | 162 [160-168] | 0,92 |
| IMC, kg/m2 | 29,4 [27,1-32,8] | 29,4 [27,9-31] | 29,1 [26,3-33,4] | 30 [29,3-31,2] | 1 |
| Enfermedades previas | |||||
| Hipertensión arterial | 55 (56,7%) | 13 (86,6%) | 37 (50,7%) | 5 (55,5%) | 0,1 |
| Dislipemia | 42 (43,3%) | 10 (66,6%) | 28 (38,3%) | 4 (44,4%) | 0,27 |
| Diabetes | 22 (22,7%) | 5 (33,3) | 16 (21,9%) | 1 (11,1%) | 0,87 |
| Asma | 7 (7,2%) | 1 (6,6%) | 4 (5,5%) | 2 (22,2%) | 1 |
| EPOC | 11 (11,3%) | 3 (20%) | 8 (10,1) | 0 | 0,9 |
| Enfermedad cardiaca | 28 (28,9%) | 7 (46,6%) | 19 (26%) | 2 (22,2%) | 0,46 |
| Cáncer | 7 (7,2%) | 1 (6,6%) | 5 (6,8%) | 1 (11,1%) | 1 |
| Obesidad | 38 (39,2%) | 5 (33,3%) | 30 (41,1%) | 3 (33,3%) | 1 |
| Tratamientos domiciliarios | |||||
| IECAS | 29 (29,9) | 7 (46,6%) | 20 (27,4%) | 2 (22,2%) | 0,57 |
| Anticoagulantes | 7 (7,2) | 3 (20%) | 4 (5,5) | 0 | 0,45 |
| Antiagregantes plaquetarios | 21 (21,6) | 6 (40%) | 13 (17,8%) | 2 (22,2%) | 0,27 |
| Estatinas | 36 (37,1) | 10 (66,6%) | 22 (30,1) | 4 (44,4%) | 0,08 |
| Betabloqueadores | 14 (14,4) | 6 (40%) | 7 (9,6%) | 1 (11,1%) | 0,05 |
| Corticoides | 6 (6,2) | 3 (20%) | 3 (4,1%) | 0 | 0,3 |
| Broncodilatadores | 9 (9,3%) | 1 (6,6%) | 8 (10,9%) | 1 (11,1%) | 1 |
| Hallazgos radiológicos | |||||
| Infiltrado localizado | 8 (8,2%) | 1 (6,6%) | 7 (9,6%) | 0 | 0,9 |
| Infiltrado bilateral | 83 (85,6%) | 13 (86,6%) | 63 (83,3%) | 6 (66,6%) | |
| Consolidación pulmonar | 5 (5,1%) | 1 (6,6%) | 1 (1,4%) | 0 | |
| Otro | 1 (1%) | 0 | 1 (1,4%) | 3 (33,3%) | |
| Datos de laboratorio al ingreso en UCI | |||||
| Leucocitos | 7.500 [5.600-11.610] | 6.660 [4.965 -7.705] | 7.500 [5.600-11.540] | 14.450 [12.470-16.040] | 0,47 |
| Linfocitos | 600 [400-960] | 460 [320-520] | 640 [460-1000] | 370 [270-960] | 0,02 |
| Proteína C-reactiva, mg/L | 14,9 [10,3-34,7] | 25 [11,8-43,2] | 14,9 [10,5-32] | 13,8 [9,5-17,1] | 0,75 |
| Dímero D, ng/mL | 1.204 [7.523- 2.159] | 1.199 [649-1.837] | 1.208 [763-2.482] | 873 [746-2.151] | 0,75 |
| Lactato deshidrogenasa, U/L | 454 [361-633] | 517 [385-670,5] | 453 [362-632] | 407 [352- 536] | 0,9 |
| Ferritina sérica, μg/L | 900 [579-1.422] | 1.197 [758-1.350] | 894 [566-1.478] | 776 [565-1.017] | 0,66 |
| Interleucina-6, pg/mL | 63 [36,4-110,5] | 74,8 [42,4-97,5] | 60 [39-102] | 345 [182-507] | 0,98 |
| Procalcitonina, ng/mL. | 0,1 [0,1-0,3] | 0,2 [0,1-1,4] | 0,1 [0,1-0,3] | 0,1 [0,1-0,3] | 0,11 |
| Procalcitonina ≥ 0,05 ng/mL | 21 (21,6%) | 7 (46,6%) | 13 (17,8%) | 1 (11,1%) | 0,14 |
| Valor máximo durante estancia en UCI | |||||
| Proteína C-reactiva, mg/L | 22 [15,4-37,8] | 26 [20,9-51,5] | 20,3 [14,4-35] | 22 [17,1-26,5] | 0,16 |
| Dímero D, ng/mL | 4.959 [2.231-8.508] | 6.486 [5.170-13.714] | 4.456 [2.100-7.679] | 4.182 [2.151-13.830] | 0,1 |
| Lactato deshidrogenasa, U/L | 572 [418-849] | 663 [505-804] | 550 [418-910] | 416 [352-629] | 0,75 |
| Ferritina sérica, μg/L | 1.468 [840-2.353] | 1.620 [1.120-2.956] | 1.500 [840-2.353] | 890 [623-1.827] | 0,46 |
| Interleucina-6, pg/mL | 159 [58-463] | 170 [60-323] | 129 [55-463] | 409 [254-1.869] | 1 |
| Procalcitonina, ng/mL | 0,4 [0,1-1,3] | 2,8 [1,4-23,1] | 0,3 [0,1-0,7] | 0,2 [0,1-0,4] | 0,00126 |
| Procalcitonina ≥ 0,05 ng/mL | 42 (43,3%) | 13 (86,6%) | 27 (36,9%) | 2 (22,2%) | 0,00814 |
UCI: Unidad de Cuidados Intensivos; IMC: índice de masa corporal; EPOC: enfermedad pulmonar obstructiva crónica.
Los valores se muestran como número (porcentaje) o mediana [rango intercuartílico].
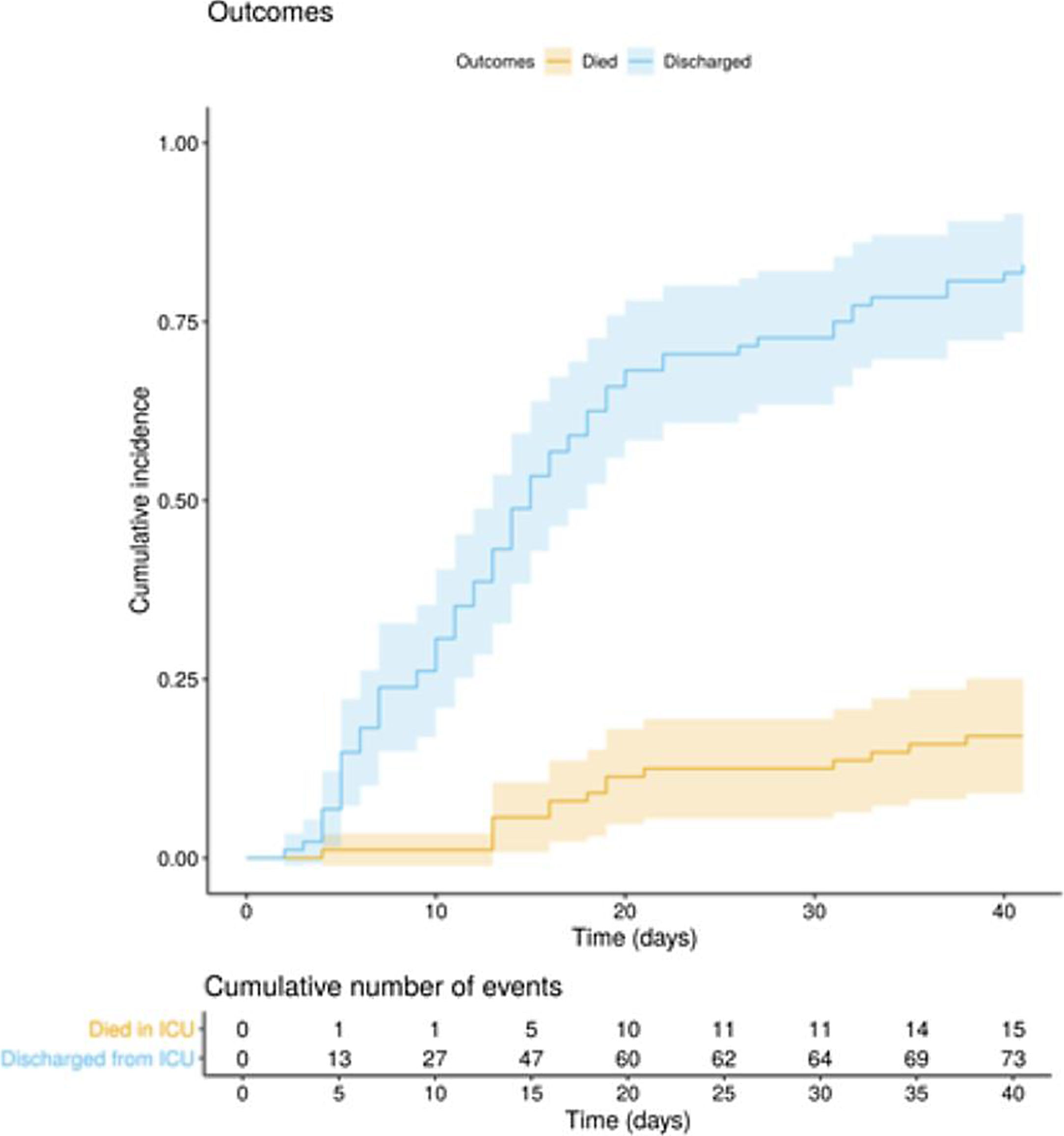
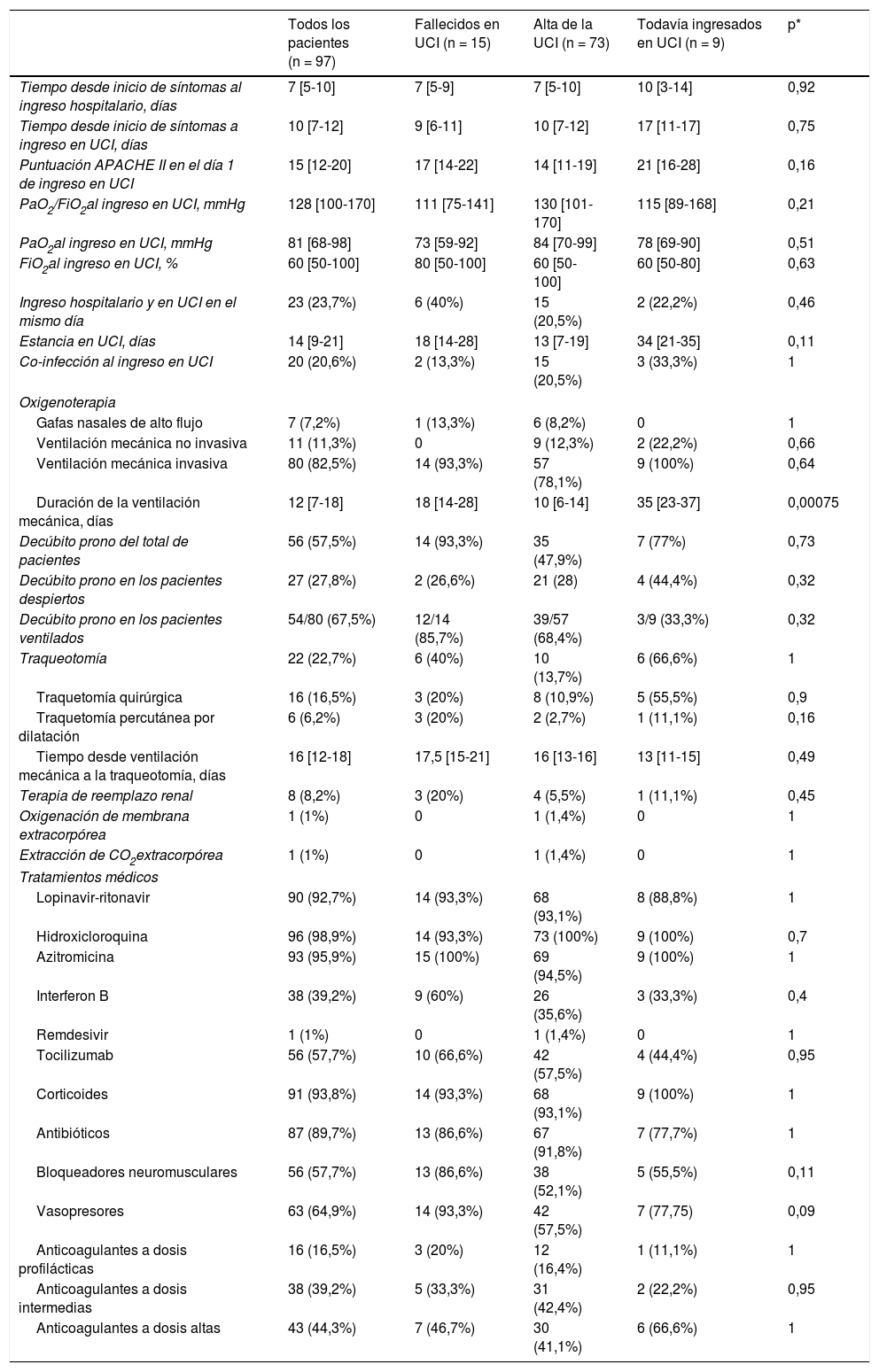
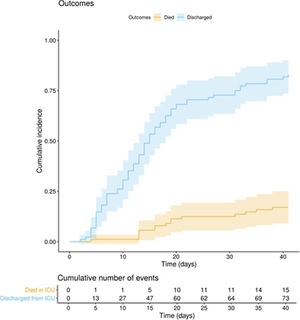
La evolución clínica y los tratamientos durante la estancia en la UCI se resumen en la tabla 2. La mediana de tiempo desde el inicio de los síntomas hasta el ingreso hospitalario y en la UCI fue de 7 (5-10) días y de 10 (7-12) días, respectivamente. La puntuación media de la escala APACHE ii de todos los pacientes fue de 15 (12-20). El 6 de mayo de 2020, después de una mediana de seguimiento de 42 (34-45) días, del total 97 de pacientes, 15 (15,5%) pacientes habían fallecido, 73 (75,2%) habían sido dados de alta de UCI, y 9 de ellos (9,3%) aún se encontraban en esta unidad. La incidencia acumulada de pacientes fallecidos en UCI o dados de alta de la UCI se presenta en la figura 1. La duración media de la estancia en la UCI entre los fallecidos fue de 18 (14-28) días. De los 73 pacientes dados de alta de la UCI, un paciente (1,4%) falleció en el hospital fuera de la UCI, 10 (13,7%) permanecían hospitalizados y 62 (84,9%) fueron dados de alta del hospital. Cuatro pacientes (5,5%) fueron reingresados en UCI durante la estancia hospitalaria.
Medidas clínicas y tratamientos administrados a los 97 pacientes ingresados en las UCI de Anestesia
| Todos los pacientes (n = 97) | Fallecidos en UCI (n = 15) | Alta de la UCI (n = 73) | Todavía ingresados en UCI (n = 9) | p* | |
|---|---|---|---|---|---|
| Tiempo desde inicio de síntomas al ingreso hospitalario, días | 7 [5-10] | 7 [5-9] | 7 [5-10] | 10 [3-14] | 0,92 |
| Tiempo desde inicio de síntomas a ingreso en UCI, días | 10 [7-12] | 9 [6-11] | 10 [7-12] | 17 [11-17] | 0,75 |
| Puntuación APACHE II en el día 1 de ingreso en UCI | 15 [12-20] | 17 [14-22] | 14 [11-19] | 21 [16-28] | 0,16 |
| PaO2/FiO2al ingreso en UCI, mmHg | 128 [100-170] | 111 [75-141] | 130 [101-170] | 115 [89-168] | 0,21 |
| PaO2al ingreso en UCI, mmHg | 81 [68-98] | 73 [59-92] | 84 [70-99] | 78 [69-90] | 0,51 |
| FiO2al ingreso en UCI, % | 60 [50-100] | 80 [50-100] | 60 [50-100] | 60 [50-80] | 0,63 |
| Ingreso hospitalario y en UCI en el mismo día | 23 (23,7%) | 6 (40%) | 15 (20,5%) | 2 (22,2%) | 0,46 |
| Estancia en UCI, días | 14 [9-21] | 18 [14-28] | 13 [7-19] | 34 [21-35] | 0,11 |
| Co-infección al ingreso en UCI | 20 (20,6%) | 2 (13,3%) | 15 (20,5%) | 3 (33,3%) | 1 |
| Oxigenoterapia | |||||
| Gafas nasales de alto flujo | 7 (7,2%) | 1 (13,3%) | 6 (8,2%) | 0 | 1 |
| Ventilación mecánica no invasiva | 11 (11,3%) | 0 | 9 (12,3%) | 2 (22,2%) | 0,66 |
| Ventilación mecánica invasiva | 80 (82,5%) | 14 (93,3%) | 57 (78,1%) | 9 (100%) | 0,64 |
| Duración de la ventilación mecánica, días | 12 [7-18] | 18 [14-28] | 10 [6-14] | 35 [23-37] | 0,00075 |
| Decúbito prono del total de pacientes | 56 (57,5%) | 14 (93,3%) | 35 (47,9%) | 7 (77%) | 0,73 |
| Decúbito prono en los pacientes despiertos | 27 (27,8%) | 2 (26,6%) | 21 (28) | 4 (44,4%) | 0,32 |
| Decúbito prono en los pacientes ventilados | 54/80 (67,5%) | 12/14 (85,7%) | 39/57 (68,4%) | 3/9 (33,3%) | 0,32 |
| Traqueotomía | 22 (22,7%) | 6 (40%) | 10 (13,7%) | 6 (66,6%) | 1 |
| Traquetomía quirúrgica | 16 (16,5%) | 3 (20%) | 8 (10,9%) | 5 (55,5%) | 0,9 |
| Traquetomía percutánea por dilatación | 6 (6,2%) | 3 (20%) | 2 (2,7%) | 1 (11,1%) | 0,16 |
| Tiempo desde ventilación mecánica a la traqueotomía, días | 16 [12-18] | 17,5 [15-21] | 16 [13-16] | 13 [11-15] | 0,49 |
| Terapia de reemplazo renal | 8 (8,2%) | 3 (20%) | 4 (5,5%) | 1 (11,1%) | 0,45 |
| Oxigenación de membrana extracorpórea | 1 (1%) | 0 | 1 (1,4%) | 0 | 1 |
| Extracción de CO2extracorpórea | 1 (1%) | 0 | 1 (1,4%) | 0 | 1 |
| Tratamientos médicos | |||||
| Lopinavir-ritonavir | 90 (92,7%) | 14 (93,3%) | 68 (93,1%) | 8 (88,8%) | 1 |
| Hidroxicloroquina | 96 (98,9%) | 14 (93,3%) | 73 (100%) | 9 (100%) | 0,7 |
| Azitromicina | 93 (95,9%) | 15 (100%) | 69 (94,5%) | 9 (100%) | 1 |
| Interferon B | 38 (39,2%) | 9 (60%) | 26 (35,6%) | 3 (33,3%) | 0,4 |
| Remdesivir | 1 (1%) | 0 | 1 (1,4%) | 0 | 1 |
| Tocilizumab | 56 (57,7%) | 10 (66,6%) | 42 (57,5%) | 4 (44,4%) | 0,95 |
| Corticoides | 91 (93,8%) | 14 (93,3%) | 68 (93,1%) | 9 (100%) | 1 |
| Antibióticos | 87 (89,7%) | 13 (86,6%) | 67 (91,8%) | 7 (77,7%) | 1 |
| Bloqueadores neuromusculares | 56 (57,7%) | 13 (86,6%) | 38 (52,1%) | 5 (55,5%) | 0,11 |
| Vasopresores | 63 (64,9%) | 14 (93,3%) | 42 (57,5%) | 7 (77,75) | 0,09 |
| Anticoagulantes a dosis profilácticas | 16 (16,5%) | 3 (20%) | 12 (16,4%) | 1 (11,1%) | 1 |
| Anticoagulantes a dosis intermedias | 38 (39,2%) | 5 (33,3%) | 31 (42,4%) | 2 (22,2%) | 0,95 |
| Anticoagulantes a dosis altas | 43 (44,3%) | 7 (46,7%) | 30 (41,1%) | 6 (66,6%) | 1 |
UCI: Unidad de Cuidados Intensivos; PaO2: presión arterial parcial de oxígeno; FiO2: fracción de oxígeno inspirado; APACHE ii: escala de evaluación de fisiología aguda y salud crónica ii.
Los datos se expresan como número (porcentaje), mediana [rango intercuartílico].
La duración media de la estancia en la UCI y la estancia hospitalaria fue de 14 (9-21) días y 27 (19-38) días, respectivamente. Durante la estancia en UCI, 80 de ellos (82,5%) recibieron ventilación mecánica, 63 (64,9%) requirieron vasopresores y 8 (8,2%) fueron tratados con terapia de reemplazo renal (tabla 2). Entre aquellos con ventilación mecánica, 14 (17,5%) fallecieron, 57 (71,2%) fueron dados de alta de la UCI, y nueve (11,2%) permanecieron en la UCI. La mediana de duración de la ventilación mecánica invasiva fue de 12 (7-18) días. Veintidós pacientes (22,5%) requirieron traqueotomía para ventilación mecánica prolongada. La ventilación en decúbito prono se utilizó con frecuencia tanto en pacientes intubados como en pacientes en ventilación espontánea (tabla 2). La mayoría de los 97 pacientes recibió medicación antiviral, antibióticos, anticoagulantes y corticoides (tabla 2). Se administró tocilizumab en 56 (57,3%) pacientes.
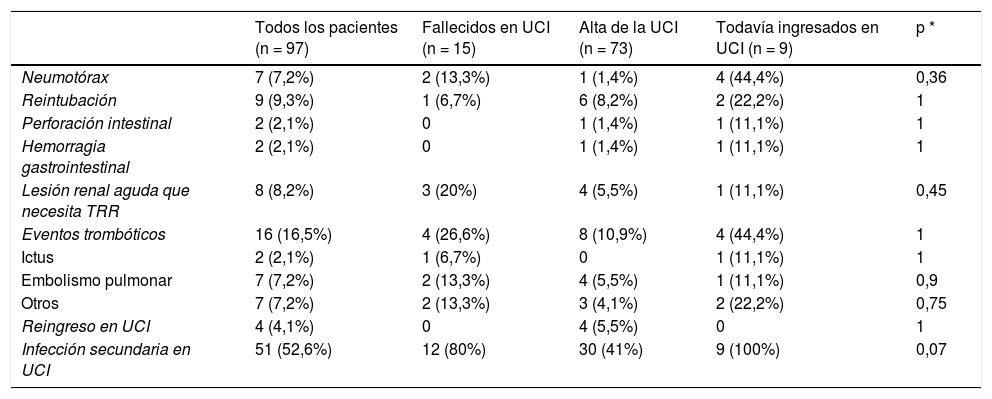
Las complicaciones se resumen en la tabla 3. Las complicaciones más frecuentes fueron infecciones adquiridas en UCI (52,6%), episodios tromboembólicos (16,5%), reintubación (9,3%), lesión renal aguda que requirió terapia renal sustitutiva (8,2%) y neumotórax (7,2%).
Complicaciones y resultados de los 97 pacientes COVID-19 atendidos en las UCI de Anestesia
| Todos los pacientes (n = 97) | Fallecidos en UCI (n = 15) | Alta de la UCI (n = 73) | Todavía ingresados en UCI (n = 9) | p * | |
|---|---|---|---|---|---|
| Neumotórax | 7 (7,2%) | 2 (13,3%) | 1 (1,4%) | 4 (44,4%) | 0,36 |
| Reintubación | 9 (9,3%) | 1 (6,7%) | 6 (8,2%) | 2 (22,2%) | 1 |
| Perforación intestinal | 2 (2,1%) | 0 | 1 (1,4%) | 1 (11,1%) | 1 |
| Hemorragia gastrointestinal | 2 (2,1%) | 0 | 1 (1,4%) | 1 (11,1%) | 1 |
| Lesión renal aguda que necesita TRR | 8 (8,2%) | 3 (20%) | 4 (5,5%) | 1 (11,1%) | 0,45 |
| Eventos trombóticos | 16 (16,5%) | 4 (26,6%) | 8 (10,9%) | 4 (44,4%) | 1 |
| Ictus | 2 (2,1%) | 1 (6,7%) | 0 | 1 (11,1%) | 1 |
| Embolismo pulmonar | 7 (7,2%) | 2 (13,3%) | 4 (5,5%) | 1 (11,1%) | 0,9 |
| Otros | 7 (7,2%) | 2 (13,3%) | 3 (4,1%) | 2 (22,2%) | 0,75 |
| Reingreso en UCI | 4 (4,1%) | 0 | 4 (5,5%) | 0 | 1 |
| Infección secundaria en UCI | 51 (52,6%) | 12 (80%) | 30 (41%) | 9 (100%) | 0,07 |
UCI: Unidad de Cuidados Intensivos; TRR: terapia de reemplazo renal.
Los valores se expresan como número (porcentaje), mediana [rango intercuartílico].
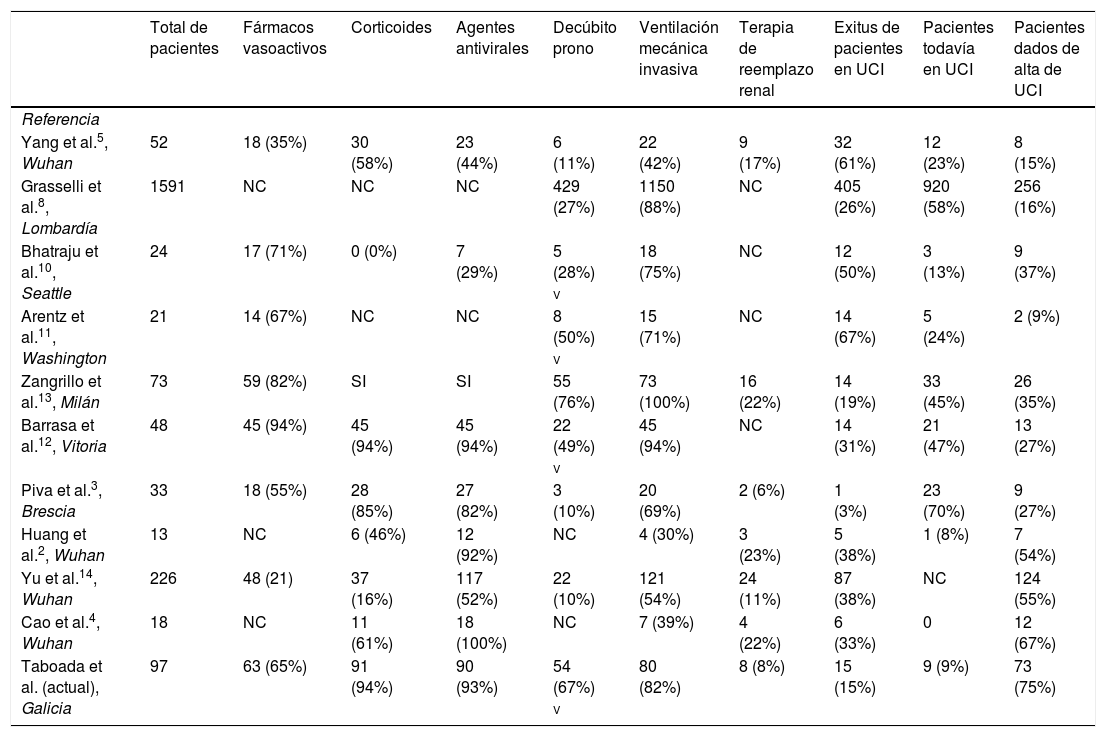
La tabla 4 resume los resultados y tratamientos administrados en los principales estudios de pacientes críticos con COVID-19 ingresados en la UCI en diferentes países.
Resumen de los tratamientos y resultados de diferentes estudios realizados en pacientes críticos con COVID-19
| Total de pacientes | Fármacos vasoactivos | Corticoides | Agentes antivirales | Decúbito prono | Ventilación mecánica invasiva | Terapia de reemplazo renal | Exitus de pacientes en UCI | Pacientes todavía en UCI | Pacientes dados de alta de UCI | |
|---|---|---|---|---|---|---|---|---|---|---|
| Referencia | ||||||||||
| Yang et al.5, Wuhan | 52 | 18 (35%) | 30 (58%) | 23 (44%) | 6 (11%) | 22 (42%) | 9 (17%) | 32 (61%) | 12 (23%) | 8 (15%) |
| Grasselli et al.8, Lombardía | 1591 | NC | NC | NC | 429 (27%) | 1150 (88%) | NC | 405 (26%) | 920 (58%) | 256 (16%) |
| Bhatraju et al.10, Seattle | 24 | 17 (71%) | 0 (0%) | 7 (29%) | 5 (28%) v | 18 (75%) | NC | 12 (50%) | 3 (13%) | 9 (37%) |
| Arentz et al.11, Washington | 21 | 14 (67%) | NC | NC | 8 (50%) v | 15 (71%) | NC | 14 (67%) | 5 (24%) | 2 (9%) |
| Zangrillo et al.13, Milán | 73 | 59 (82%) | SI | SI | 55 (76%) | 73 (100%) | 16 (22%) | 14 (19%) | 33 (45%) | 26 (35%) |
| Barrasa et al.12, Vitoria | 48 | 45 (94%) | 45 (94%) | 45 (94%) | 22 (49%) v | 45 (94%) | NC | 14 (31%) | 21 (47%) | 13 (27%) |
| Piva et al.3, Brescia | 33 | 18 (55%) | 28 (85%) | 27 (82%) | 3 (10%) | 20 (69%) | 2 (6%) | 1 (3%) | 23 (70%) | 9 (27%) |
| Huang et al.2, Wuhan | 13 | NC | 6 (46%) | 12 (92%) | NC | 4 (30%) | 3 (23%) | 5 (38%) | 1 (8%) | 7 (54%) |
| Yu et al.14, Wuhan | 226 | 48 (21) | 37 (16%) | 117 (52%) | 22 (10%) | 121 (54%) | 24 (11%) | 87 (38%) | NC | 124 (55%) |
| Cao et al.4, Wuhan | 18 | NC | 11 (61%) | 18 (100%) | NC | 7 (39%) | 4 (22%) | 6 (33%) | 0 | 12 (67%) |
| Taboada et al. (actual), Galicia | 97 | 63 (65%) | 91 (94%) | 90 (93%) | 54 (67%) v | 80 (82%) | 8 (8%) | 15 (15%) | 9 (9%) | 73 (75%) |
NC: no comunicado; SI: administrado, pero sin aclarar el porcentaje de pacientes; v: porcentaje referido a los pacientes que recibieron ventilación mecánica invasiva.
En este estudio observacional multicéntrico, se describe el curso clínico en UCI de 97 pacientes críticamente enfermos con COVID-19; 46 días después del primer ingreso en UCI y después de un seguimiento medio de 42 (34-45) días, 15 (15,5%) pacientes habían fallecido, 73 (75,5%) habían sido dados de alta y 9 (9,3%) continuaban todavía en la UCI.
La tasa de mortalidad fue similar a la notificada previamente en un gran hospital terciario en Milán13, pero menor que en otros centros (tabla 4)3,14. La menor tasa de mortalidad del presente estudio en comparación con las anteriores puede deberse a varios factores.
En primer lugar, en el Noroeste de España hubo una menor carga asistencial del sistema de salud en comparación con el norte de Italia8, Wuhan2,4,5,14, Seattle10 o Washington11 (tabla 4). Los médicos de estas regiones probablemente hayan necesitado trabajar al límite de sus capacidades. El rápido aumento en el número de casos excedió frecuentemente el número de camas de UCI o ventiladores disponibles, reduciendo así las probabilidades de obtener un buen resultado en estos pacientes críticamente enfermos16. En los siete hospitales participantes del presente estudio, solo alrededor del 70% de las camas de la UCI estaban ocupadas, por lo que los médicos pudieron trabajar en condiciones adecuadas y sin limitaciones de recursos. Otra posible explicación que puede haber disminuido la mortalidad en nuestros pacientes, puede haber sido el uso de medicamentos como corticoides y anticoagulantes, además del empleo precoz de ventilación mecánica protectora en pacientes con SDRA y de la ventilación en decúbito prono, tanto en pacientes intubados como en aquellos que se mantuvieron en ventilación espontánea.
La mayoría de los pacientes con COVID-19 solo tienen síntomas leves, sin embargo, algunos de ellos se deterioran y desarrollan insuficiencia respiratoria debido a un SDRA grave que requiere intubación y ventilación mecánica. En el presente estudio, 80 pacientes (82,5%) requirieron ventilación mecánica tras su ingreso en UCI. La ventilación en decúbito prono con ciclos prolongados de tiempo (≥ 16 h/día) se utilizó en el 67,5% de ellos, según lo recomendado por la Organización Mundial de la Salud (OMS)15. El decúbito prono es una estrategia disponible en el manejo de pacientes con SDRA, que mejora la oxigenación y la supervivencia15,17,18. Explicaciones para esta mejoría en la oxigenación son que el procedimiento mejora la relación ventilación/perfusión pulmonar, la presión transpulmonar a lo largo del eje ventral-dorsal se distribuye de manera más homogénea en comparación con la posición supina, y se promueve el reclutamiento de áreas dorsales no ventiladas del pulmón19. El decúbito prono en nuestros pacientes de UCI (67,5%) fue empleado con más frecuencia de lo que se describió recientemente para otras poblaciones de pacientes similares: 27% en Lombardía8, 28% en Seattle10 o 11% en Wuhan5,14 (tabla 4). Una posible explicación para esta diferencia de uso puede ser la diferente carga de trabajo entre hospitales o regiones. El posicionamiento en decúbito prono en un paciente intubado es complicado, requiriendo de cuatro o cinco operadores para realizarlo. Tras una mejora significativa de la oxigenación en pacientes con COVID-19 inicialmente intubados, esta maniobra también se utilizó en pacientes despiertos con SDRA moderado o severo, intentando mejorar la oxigenación y evitar una intubación. En teoría, muchos de los mecanismos que explican una mejora de la oxigenación con el decúbito prono en pacientes intubados pueden ser aplicables a pacientes no intubados20-21. En pacientes despiertos, esta maniobra es más fácil. Los pacientes pueden colocarse boca abajo por sí mismos, manteniendo la postura adecuada durante el mayor tiempo posible. Los pacientes con COVID-19 y SDRA leve a moderado pueden colocarse en prono incluso fuera de la UCI, por ejemplo en las salas de hospitalización general, mejorando la oxigenación, y disminuyendo así el número de ingresos en UCI, en caso de que las UCI solo dispongan de un número de camas escaso13.
Actualmente hay datos limitados sobre los mejores medicamentos para el tratamiento de los pacientes con COVID-19 y particularmente cuándo comenzarlos. Se han sugerido tratamientos antivirales, antiinflamatorios, anticoagulantes e inmunosupresores. En una etapa temprana de la infección viral, es decir, en los cinco a ocho primeros días desde el inicio de la enfermedad, probablemente se deba recomendar la terapia antiviral; mientras que más tarde, es decir, ocho a 20 días tras el inicio de la enfermedad, debido a una respuesta inmune excesiva que conduce a un estado de hiperinflamación, puede ser útil el uso de agentes inmunomoduladores para reducir la inflamación sistémica21-22. Como el ingreso en UCI se produjo 10 (7-12) días después del inicio de los síntomas y la duración media de la estancia en la UCI fue de 14 (9-21) días, es probable que la mayoría de nuestros pacientes críticamente enfermos estuvieran en la etapa de hiperinflamación. Por lo tanto, un enfoque válido fue tratar la respuesta inmune con agentes como tocilizumab y/o un corticoide21-22. En el presente estudio, se administraron corticoides en el 93,8% de los casos, de forma similar a un estudio anterior13, pero en un porcentaje superior al de otras investigaciones5,10 (tabla 4). La OMS15 no recomienda el uso rutinario de corticoides en pacientes con COVID-19 fuera de los ensayos clínicos, y hay un debate sobre si deben usarse corticoides en pacientes con COVID-1923-29. Estudios realizados en pacientes con infección por H1N1 y el SARS encontraron que los corticoides redujeron las tasas de mortalidad y acortaron la duración de la estancia hospitalaria en pacientes críticamente enfermos24-25. Un estudio retrospectivo reciente de 201 pacientes con COVID-19 en China reveló que en aquellos con SDRA, la metilprednisolona disminuyó el riesgo de mortalidad7. Por tanto, varias sociedades médicas y guías recomiendan ahora el uso de corticoides en pacientes COVID-19 con SDRA24,27,28. Los médicos de la Chinese Thoracic Society han desarrollado una declaración de consenso de expertos sobre el uso de corticoides en la neumonía 2019-CoV24. El Instituto Nacional Italiano de las Enfermedades Infecciosas L. Spallanzani también recomienda el uso de corticoides para los afectados con SDRA27. Los hallazgos post mortem como el edema pulmonar y la formación de membranas hialinas apoyan el uso de corticoides29. Recientemente, el Grupo Colaborativo RECOVERY observó que en pacientes hospitalizados con COVID-19 que reciben ventilación mecánica invasiva u oxígeno, el uso de dexametasona resultó en una menor mortalidad a los 28 días30. Es de esperar que los ensayos clínicos futuros nos den respuesta a la adecuada administración de estos medicamentos, incluida la eficacia de este tratamiento, el momento adecuado de inicio del mismo y la dosis y duración apropiada de la terapia30-31.
Estudios recientes señalaron la presencia de eventos tromboembólicos en pacientes que padecían COVID-1932-34. En consecuencia, la mayoría de los pacientes de la presente investigación recibieron dosis intermedias o altas de heparinas de bajo peso molecular. Las complicaciones trombóticas ocurrieron en el 16,5% de casos. En pacientes COVID-19 severos, un aumento del nivel de dímero D o un nivel elevado de citocinas proinflamatorias como la IL-6 fueron relacionados con un mal pronóstico35. Estos hallazgos pueden demostrar una relación entre trombosis e inflamación, dos procesos que se refuerzan mutuamente. Varios autores observaron que el COVID-19 puede predisponer a tromboembolismo venoso y arterial debido a una inflamación excesiva, hipoxia, inmovilización y coagulación intravascular difusa32-34. En un estudio reciente de doce pacientes que fallecieron por COVID-1932, los autores encontraron una alta incidencia de trombosis venosa profunda (58%). Un tercio de estos pacientes tuvo una embolia pulmonar como causa directa de muerte. Las complicaciones trombóticas han sido descritas por diferentes autores. Klok et al.32, informaron una incidencia del 31% de complicaciones trombóticas en pacientes de UCI con COVID-19. Del mismo modo, Helms et al.34, en un estudio de cohorte prospectivo multicéntrico en cuatro hospitales participantes, observó que el 42% de sus pacientes COVID-19 con SDRA, desarrolló complicaciones trombóticas potencialmente mortales. En estos estudios, los autores sugieren el uso de dosis más altas de medicación anticoagulante en pacientes con COVID-19 críticamente enfermos que las administradas habitualmente. En este contexto, algunos autores36-37 y varias sociedades profesionales38-39 ya han hecho recomendaciones para la terapia antitrombótica en pacientes con COVID-19. Se necesitan ensayos aleatorios para determinar si los anticoagulantes sistémicos proporcionan un beneficio de supervivencia en pacientes hospitalizados con COVID-19.
El presente estudio tiene algunas limitaciones. Esta investigación solo incluyó a pacientes críticamente enfermos ingresados en UCI de Anestesiología de hospitales ubicados en el Noroeste de España, donde teníamos una presión global menor sobre el sistema sanitario en comparación con otras regiones españolas u otros países. Por tanto, los resultados pueden no reflejar la experiencia de otras UCI en distintas regiones. Además, el estudio fue observacional y las intervenciones descritas en este documento no formaron parte de un ensayo controlado aleatorizado. Por último, nueve pacientes (9,3%) todavía estaban en la UCI el 6 de mayo de 2020. Como consecuencia, los datos de resultado final para estos pacientes no estaban disponibles.
En conclusión, los pacientes críticamente enfermos con COVID-19 ingresados en las UCI de Anestesiología de siete hospitales del Noroeste de España, durante el brote de marzo-abril de 2020, presentaron un alto porcentaje de complicaciones, principalmente infecciones y eventos trombóticos. Tuvimos una mortalidad relativamente baja del 15,5%. Las intervenciones de cuidados críticos más frecuentes consistieron en ventilación mecánica y ventilación en decúbito prono, así como varios tratamientos, que incluyen agentes antivirales, antibióticos, corticoides y anticoagulantes. Se necesitan con urgencia ensayos clínicos aleatorizados para determinar los tratamientos más efectivos para pacientes con COVID-19 críticamente enfermos.
Mensaje finalEn esta investigación prospectiva multicéntrica en pacientes críticos con COVID-19, que requirieron ingreso en una unidad de cuidados intensivos (UCI), observamos que las complicaciones fueron frecuentes, con una tasa de mortalidad relativamente baja, del 15%. En una gran proporción de nuestros pacientes utilizamos ventilación mecánica invasiva, decúbito prono, corticoides y anticoagulantes.
FinanciaciónNo se recibió financiación para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los médicos y enfermeras de los hospitales participantes.