El síndrome cardiohepático (SCH) representa un desafío importante para el manejo perioperatorio debido a la compleja interacción entre la función hepática y cardíaca. El SCH abarca diversas condiciones en las que las patologías hepáticas y cardiovasculares se exacerban mutuamente. Los pacientes con enfermedad hepática crónica, cirrosis o insuficiencia cardíaca suelen presentar una mayor morbilidad y mortalidad perioperatoria, lo que requiere estrategias anestésicas personalizadas. La comprensión integral de la fisiopatología del SCH es valiosa para optimizar la evaluación de riesgos y guía el manejo perioperatorio. Las herramientas de estratificación de riesgo como las puntuaciones Child-Pugh y MELD se utilizan comúnmente, pero tienen limitaciones a la hora de calcular los riesgos perioperatorios. El modelo actualizado STS 2024 incluye parámetros específicos del hígado, mejorando la predicción de riesgos en cirugía cardíaca. La nueva puntuación VOCAL-Penn aborda las brechas en los modelos de riesgo tradicionales, proporcionando una evaluación más precisa para pacientes con enfermedad hepática avanzada.
El manejo perioperatorio se centra en minimizar el estrés hemodinámico y evitar fármacos de metabolismo hepático. Drogas como el remifentanilo, el atracurio y el esmolol son preferidos por su mínimo metabolismo hepático. Vasopresores como la terlipresina y la vasopresina, que actúan sobre la circulación esplácnica, mejoran la hemodinámica en estos pacientes. La optimización de la nutrición y el manejo de líquidos es esencial para reducir las complicaciones perioperatorias dentro del marco de Recuperación Intensificada post Cirugía (ERAS, por sus siglas en inglés).
El manejo efectivo de los pacientes con SCH requiere un enfoque multidisciplinario que integre una evaluación de riesgos exhaustiva y estrategias anestésicas individualizadas. Este enfoque mejora los resultados al reducir las complicaciones perioperatorias y la mortalidad en esta población de alto riesgo.
Cardiohepatic syndrome (CHS) presents a significant challenge in perioperative management due to the complex interaction between liver and heart dysfunction. CHS, analogous to cardiorenal syndrome, encompasses various conditions where hepatic and cardiovascular pathologies exacerbate one another. Patients with chronic liver disease, cirrhosis, or heart failure often exhibit increased perioperative morbidity and mortality, necessitating tailored anesthetic strategies. A comprehensive understanding of CHS pathophysiology is crucial, as it informs risk assessment and guides perioperative management. Risk stratification tools such as the Child-Pugh and MELD scores are commonly used, but they have limitations in fully capturing perioperative risks. The updated STS 2024 model includes liver-specific parameters, improving risk prediction in cardiac surgeries. Additionally, the VOCAL-Penn score addresses gaps in traditional risk models, providing a more accurate assessment for patients with advanced liver disease.
Perioperative management focuses on minimizing hemodynamic stress and avoiding drugs metabolized by the liver. Agents like Remifentanil, Atracurium, and Esmolol are preferred for their minimal hepatic metabolism. Vasopressors such as terlipressin and vasopressin, which target the splanchnic circulation, improve hemodynamics in these patients. Within the Enhanced Recovery After Surgery (ERAS) framework, optimizing nutrition and fluid management is essential for reducing perioperative complications. Effective management of patients with CHS requires a multidisciplinary approach that integrates comprehensive risk assessment and individualized anesthetic strategies. This approach improves outcomes by reducing perioperative complications and mortality in this high-risk population.
Los pacientes con síndrome cardiohepático (SCH) representan un reto único para la atención perioperatoria debido a la interdependencia entre las disfunciones hepática y cardiovascular. El SCH, que es análogo al síndrome cardiorrenal, describe un rango de condiciones en el que se exacerban mutuamente las disfunciones hepática y cardíaca. El SCH es cada vez más reconocido en la práctica clínica, particularmente en los pacientes con hepatopatía crónica, cirrosis e insuficiencia cardíaca. Dichos pacientes se presentan a menudo para cirugía con altas tasas de morbimortalidad debido a esta interacción compleja.
La carga global de la enfermedad hepática sigue aumentando, pues la cirrosis afecta a más de 2 millones de personas en el mundo al año, coexistiendo a menudo con la disfunción cardíaca. En el ámbito perioperatorio, este fallo orgánico dual complica el manejo anestésico y requiere estrategias personalizadas. Por ejemplo, los pacientes con SCH se enfrentan a una serie de riesgos únicos, que incluyen inestabilidad hemodinámica, alteración del metabolismo de los fármacos e incremento de la susceptibilidad a las complicaciones tales como coagulopatía e insuficiencia renal. Comprender estos riesgos y el modo en que afectan al manejo perioperatorio es esencial para mejorar los resultados. Para entender mejor las complicaciones que surgen durante la anestesia en los pacientes con hepatopatía, es esencial revisar primero la anatomía y función del hígado. Dicho órgano, siendo la víscera de mayor tamaño del cuerpo humano, juega un papel central en la regulación de las funciones metabólicas corporales. Recibe el 25% del gasto cardíaco total a través de un sistema circulatorio doble: el 75% de la vena portal y el 25% de la arteria hepática. Este suministro dual de sangre permite que el hígado mantenga una reserva funcional significativa, aun cuando el flujo sanguíneo está comprometido. Sin embargo, a medida que la función hepática se deteriora, también lo hace su capacidad para mantener la homeostasis metabólica y la función proteínica, haciéndose evidentes las consecuencias clínicas una vez que su capacidad se reduce por debajo del 30%. Comprender los mecanismos subyacentes de la interacción hígado/corazón en el SCH es clave para el desarrollo de estrategias de manejo efectivas1–3.
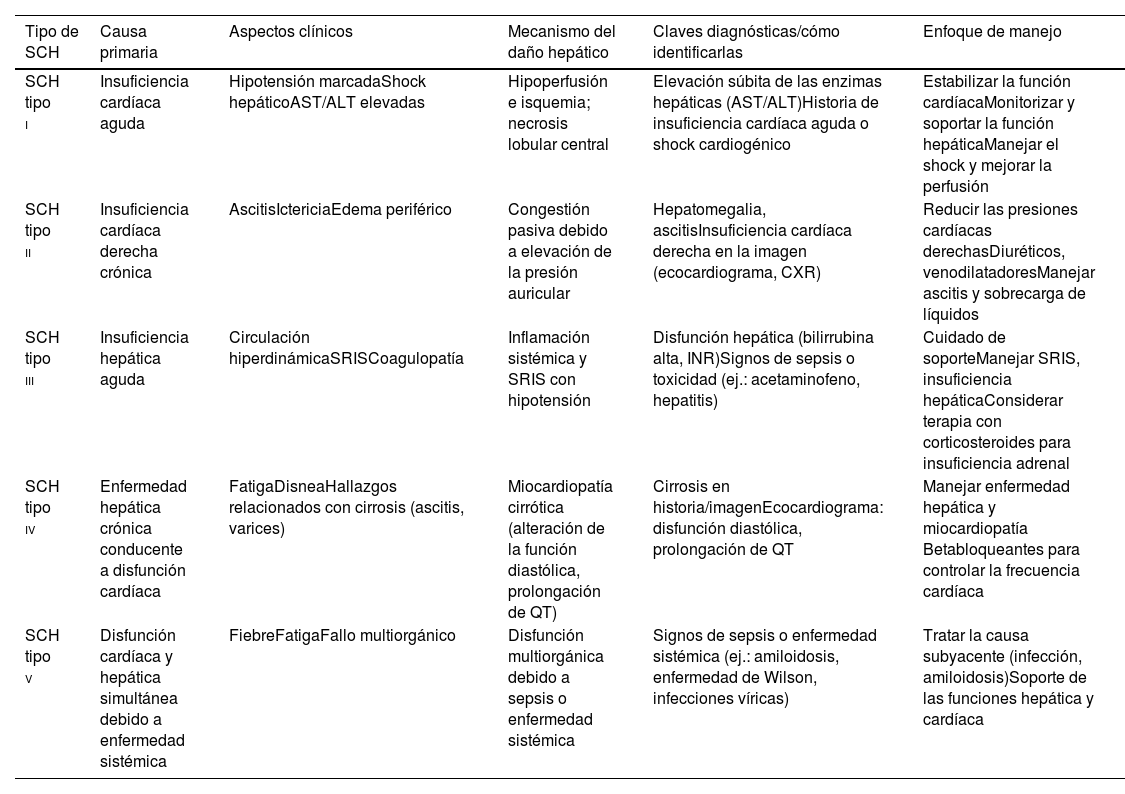
Patofisiología de la insuficiencia hepática perioperatoriaEl SCH, que muestra analogía con el síndrome cardiorrenal, fue descrito por vez primera por Poelzl y Auer como la interacción bidireccional entre el hígado y el corazón, conducente a un espectro de trastornos interrelacionados causados por mecanismos neurohormonales y citotóxicos. Se han definido 5 tipos de SCH, dependiendo de si la disfunción primaria tiene su origen en el corazón o en el hígado (tabla 1). El SCH de tipo i se caracteriza por hipoperfusión y lesión hepática isquémica a pesar de la capacidad del hígado para extraer hasta el 95% del oxígeno de la sangre. Cuando se produce un descenso crítico del flujo sanguíneo, la hipoxemia afecta predominantemente a la zona centrilobular, originando incrementos notables de las transaminasas, lo cual es indicativo de citólisis inducida por la isquemia. El SCH de tipo ii presenta un patrón de colestasia causada por el incremento de presión en el lado cardíaco derecho. La elevación de la presión hidrostática origina compresión de los canalículos biliares, revirtiendo el flujo biliar y elevando los niveles séricos de fosfatasa alcalina y gammaglutamil transferasa1–3. Este patrón está asociado normalmente a insuficiencia cardíaca crónica derecha. A pesar de que el SCH de tipos i y ii tiene principalmente un origen cardíaco, el SCH de tipo iii se produce por insuficiencia hepática aguda, desencadenada a veces por traumatismos, toxinas (tales como envenenamiento por paracetamol) o infección. Esto origina circulación hiperdinámica y síndrome de respuesta inflamatoria sistémica. En el 60% de los casos, la insuficiencia suprarrenal exacerba la inestabilidad hemodinámica. La identificación y el manejo tempranos de la insuficiencia suprarrenal, tal como la terapia de sustitución con corticosteroides, pueden estabilizar a los pacientes durante el periodo perioperatorio4. El SCH de tipo iv surge de la hepatopatía crónica conducente a disfunción cardíaca progresiva, a menudo asintomática hasta ser desencadenada por factores de estrés tales como la cirugía o la infección. Estos pacientes son propensos a padecer miocardiopatía cirrótica, y exhiben características tales como prolongación de QT y disfunción diastólica. Mecánicamente, el deterioro de la señalización del receptor β-adrenérgico, la sobreproducción de óxido nítrico y el incremento de la actividad de los endocannabinoides contribuyen a esta forma de insuficiencia cardíaca. Por último, el SCH de tipo v implica la disfunción simultánea de ambos órganos debido a condiciones sistémicas, tales como sepsis, amiloidosis o trastornos genéticos como la enfermedad de Wilson o la hemocromatosis. Por ejemplo, las infecciones como el VIH y la hepatitis C pueden causar miocarditis, complicando aún más el manejo de estos pacientes1,5–8 (fig. 1). Clínicamente, los pacientes con SCH presentan un alto riesgo perioperatorio debido al impacto combinado de vasodilatación esplácnica, circulación hiperdinámica y deterioro de la respuesta a los vasopresores tales como norepinefrina9–11. Dichos factores, junto con la elevación de la presión de enclavamiento capilar pulmonar y la presión venosa central, dificultan el manejo de fluidoterapia y hemodinámica. Los fármacos como terlipresina, que constriñe selectivamente la circulación esplácnica, ofrecen beneficios terapéuticos, redistribuyendo el flujo sanguíneo a los órganos esenciales12,13.
Comparación e identificación de los tipos de síndrome cardiohepático
| Tipo de SCH | Causa primaria | Aspectos clínicos | Mecanismo del daño hepático | Claves diagnósticas/cómo identificarlas | Enfoque de manejo |
|---|---|---|---|---|---|
| SCH tipo i | Insuficiencia cardíaca aguda | Hipotensión marcadaShock hepáticoAST/ALT elevadas | Hipoperfusión e isquemia; necrosis lobular central | Elevación súbita de las enzimas hepáticas (AST/ALT)Historia de insuficiencia cardíaca aguda o shock cardiogénico | Estabilizar la función cardíacaMonitorizar y soportar la función hepáticaManejar el shock y mejorar la perfusión |
| SCH tipo ii | Insuficiencia cardíaca derecha crónica | AscitisIctericiaEdema periférico | Congestión pasiva debido a elevación de la presión auricular | Hepatomegalia, ascitisInsuficiencia cardíaca derecha en la imagen (ecocardiograma, CXR) | Reducir las presiones cardíacas derechasDiuréticos, venodilatadoresManejar ascitis y sobrecarga de líquidos |
| SCH tipo iii | Insuficiencia hepática aguda | Circulación hiperdinámicaSRISCoagulopatía | Inflamación sistémica y SRIS con hipotensión | Disfunción hepática (bilirrubina alta, INR)Signos de sepsis o toxicidad (ej.: acetaminofeno, hepatitis) | Cuidado de soporteManejar SRIS, insuficiencia hepáticaConsiderar terapia con corticosteroides para insuficiencia adrenal |
| SCH tipo iv | Enfermedad hepática crónica conducente a disfunción cardíaca | FatigaDisneaHallazgos relacionados con cirrosis (ascitis, varices) | Miocardiopatía cirrótica (alteración de la función diastólica, prolongación de QT) | Cirrosis en historia/imagenEcocardiograma: disfunción diastólica, prolongación de QT | Manejar enfermedad hepática y miocardiopatía Betabloqueantes para controlar la frecuencia cardíaca |
| SCH tipo v | Disfunción cardíaca y hepática simultánea debido a enfermedad sistémica | FiebreFatigaFallo multiorgánico | Disfunción multiorgánica debido a sepsis o enfermedad sistémica | Signos de sepsis o enfermedad sistémica (ej.: amiloidosis, enfermedad de Wilson, infecciones víricas) | Tratar la causa subyacente (infección, amiloidosis)Soporte de las funciones hepática y cardíaca |
El primer paso para seleccionar la estrategia anestésica adecuada es realizar una evaluación clínica amplia para estimar el tipo y grado de compromiso hepático, de la forma más precisa posible. Se han desarrollado diversos sistemas de puntuación para predecir el riesgo perioperatorio en los pacientes con hepatopatía, siendo las puntuaciones Child-Pugh y Model for End-stage Liver Disease (MELD) las más ampliamente utilizadas. Sin embargo, cada uno de estos sistemas tiene limitaciones, especialmente al evaluar los factores dinámicos que complican el riesgo perioperatorio. La puntuación Child-Pugh, aunque es ampliamente utilizada, incorpora elementos subjetivos tales como encefalopatía y ascitis, originando variabilidad en la interpretación, dependiendo de la experiencia del clínico. La puntuación MELD, desarrollada inicialmente para candidatos a trasplante hepático que reciben TIPS, se ha ido refinando a lo largo del tiempo, incorporando su última versión, MELD 3.0, factores tales como sodio, albúmina y sexo para mejorar su poder predictivo más allá de la medicina de trasplantes. Debido a dichas incorporaciones, MELD 3.0 proporciona una estimación mucho más amplia de los resultados, en un rango más amplio de contextos quirúrgicos14–16. A pesar de estos avances, los sistemas de puntuación tradicional dejan a menudo de captar el alcance pleno del riesgo en los pacientes sometidos a procedimientos cardiotorácicos. Por ejemplo, la anestesia cardiotorácica plantea dificultades únicas en los pacientes con compromiso hepático, y requiere factores predictivos del riesgo adicionales. Para satisfacer esta necesidad, se ha actualizado el sistema de puntuación STS 2024 para incluir cálculos más detallados de la morbimortalidad de los pacientes sometidos a procedimientos cardíacos. El nuevo modelo ajusta factores tales como las intervenciones previas, la función orgánica (incluyendo parámetros hepáticos como la albúmina y la bilirrubina) y las cirugías complejas, como por ejemplo la reparación multivalvular. Ello representa una mejora significativa de la estratificación del riesgo, especialmente en los pacientes con disfunción hepática, en los que la predicción precisa del riesgo es esencial para guiar el manejo perioperatorio17. A pesar de estas actualizaciones, no se tienen en cuenta todos los factores relacionados con el hígado. EuroSCORE no incluye aún parámetros hepatoespecíficos en su evaluación del riesgo, aunque se espera que la versión 3 venidera aborde esta brecha18. Dada la complejidad de la enfermedad hepática, combinar múltiples sistemas de puntuación puede ofrecer una evaluación preanestésica del riesgo más precisa. Por ejemplo, combinar Child-Pugh y MELD e integrarlas en los modelos de riesgo cardíaco tradicionales tales como STS o EuroSCORE puede aportar una visión más amplia del riesgo global del paciente.
A pesar de que las puntuaciones Child-Pugh y MELD son de uso común, no captan plenamente la complejidad del riesgo perioperatorio en los pacientes con enfermedad hepática avanzada. Esto llevó al desarrollo de la puntuación VOCAL-Penn, diseñada para abordar este hueco. Dicha escala se basa en estudios observacionales retrospectivos, y ha sido validada en múltiples centros en Estados Unidos. Incluye parámetros tales como albúmina, bilirrubina, INR, creatinina y recuento plaquetario, ofreciendo una visión más precisa de los retos específicos a los que se enfrentan los pacientes hepatopáticos que reciben cirugía. La inclusión de esta puntuación añade otra dimensión a la predicción del riesgo, y en particular a los procedimientos abdominales y ortopédicos, aunque su aplicación se está ampliando asimismo a las cirugías cardíaca y vascular19. Cabe decir lo mismo de la puntuación de la Clínica Mayo20. La tabla 2 resume las puntuaciones del riesgo más ampliamente utilizadas. La evaluación precisa del riesgo no predice únicamente la morbimortalidad, sino que también informa directamente de la toma de decisiones perioperatoria. Una evaluación amplia del riesgo utilizando estas herramientas ayuda a guiar las decisiones clínicas clave, tales como la selección de agentes anestésicos, el manejo de líquidos y la necesidad de una supervisión intraoperatoria más estrecha. Por ejemplo, en pacientes con puntuaciones MELD elevadas, o estadios de Child-Pugh avanzados, las estrategias para minimizar el estrés hemodinámico y optimizar el equilibrio de los líquidos llegan a ser críticas para evitar la descompensación durante y después de la cirugía. A pesar de estos avances, los modelos del riesgo tradicionales no captan plenamente el estado nutricional. Los pacientes con hepatopatías crónicas están a menudo malnutridos, y la evaluación nutricional juega un papel esencial en la evaluación del riesgo. Métodos tales como el análisis de la bioimpedancia y los ultrasonidos pueden ayudar a identificar la sarcopenia, que está asociada a peores resultados quirúrgicos, prolongación de la estancia hospitalaria y mayor mortalidad perioperatoria. La detección temprana de la sarcopenia y demás deficiencias nutricionales permite las intervenciones dirigidas, particularmente dentro del marco Enhanced Recovery After Surgery (ERAS), centrado en optimizar el estatus nutricional preoperatoriamente21.
Puntuaciones del riesgo para la enfermedad hepática y cardiovascular en los pacientes con síndrome cardiohepático
| Puntuación | Investigación y validación clínica | Parámetros con relación hepática | Categorías del riesgo (rangos de puntuación) | Mortalidad por categoría del riesgo | Notas clínicas | Limitaciones | Recursos de Internet |
|---|---|---|---|---|---|---|---|
| Child-Pugh | Estudio inicial: Pugh et al., 1973Validación: retrospectivo, unicéntricoTamaño muestral: 436 pacientes (Hospital Hammersmith) | BilirrubinaAlbúminaINRAscitisEncefalopatía | Clase A (5-6): bajoClase B (7-9): moderadoClase C (10-15): alto | Clase A: <10%Clase B: 10-30%Clase C: >30% | Utilizada para evaluar la gravedad de la cirrosis, como guía en manejo perioperatorio en cirugías no cardíacas | Las puntuaciones de encefalopatía y ascitis son subjetivas, causando variabilidad en la interpretación clínica | MDCalc: Child-Pugh |
| MELD 3.0 | Estudio inicial: Kamath et al., 2001Validación: retrospectivo, multicéntricoTamaño muestral: 2.319 pacientes (Clínica Mayo y otros centros) | BilirrubinaCreatininaINRSodioAlbúminaSexo | MELD<12: bajoMELD 13-20: moderadoMELD>20: alto | MELD<12: <5%MELD 13-20: 15-20%MELD>20: 30-40% | Ampliamente utilizada en trasplante hepático y cirugías no cardíacas; útil para predecir la mortalidad perioperatoria | Diseñada principalmente para pacientes de trasplante hepático, y menos precisa para cirugías cardíacas | Calculadora UNOS MELD |
| VOCAL-Penn | Estudio inicial: Malinchoc et al., 2000Validación: retrospectivo, multicéntricoTamaño muestral: 824 pacientes (Universidad de Vanderbilt y otros centros) | AlbúminaBilirrubinaINRCreatininaRecuento plaquetario | Puntuación<8: bajoPuntuación 9-12: moderadoPuntuación>12: alto | Puntuación<8: <10%Puntuación 9-12: 15-20%Puntuación>12: 30-50% | Útil para enfermedad hepática avanzada y cirugías abdominales, ampliándose a casos cardíacos | Limitada a pacientes hepatopáticos y cirugías con relación hepática, y no ampliamente utilizada en cirugía cardíaca | Calculadora VOCAL-Penn |
| Puntuación del riesgo de la Clínica Mayo | Estudio inicial: Hayashi et al., 2007Validación: prospectivo, multicéntricoTamaño muestral: 978 pacientes (Clínica Mayo y otros centros) | AlbúminaBilirrubinaINRSodio | Puntuación<8: bajoPuntuación 9-12: moderadoPuntuación>12: alto | Puntuación<8: <10%Puntuación 9-12: 15-20%Puntuación>12: >30% | Utilizada principalmente en ámbitos de trasplantes hepáticos, adaptada para el riesgo perioperatorio en cirugías mayores no cardíacas | Utilidad limitada para predecir los resultados de la cirugía cardíaca debido a la exclusión de los factores cardiovasculares | Mayo Clinic MELD |
| EuroSCORE | Estudio inicial: Nashef et al., 1999Validación: prospectivo, multicéntricoTamaño muestral: 19.030 pacientes (128 centros en 8 países europeos) | No específica del hígado, incluye la enfermedad hepática como comorbilidad | EuroPUNT<2: bajoEuroPUNT 3-5: moderadoEuroPUNT>5: alto | EuroPUNT<2: <5%EuroPUNT 3-5: 10-20%EuroPUNT>5: >20% | Diseñada para pacientes de cirugía cardíaca, incorporando a la evaluación del riesgo comorbilidades como la enfermedad hepática | Evaluación limitada por los parámetros incluidos respecto al paciente. Se centra en parámetros cardíacos y carece de datos hepáticos detallados | Calculadora EuroSCORE |
| Puntuación STS | Estudio inicial: Shroyer et al., 1996Validación: prospectivo, multicéntricoTamaño muestral: 663.000 pacientes (base de datos STS, EE. UU.) | No específica del hígado, incluye la enfermedad hepática como comorbilidad | STS<2: bajoSTS 3-5: moderadoSTS>5: alto | STS<2: <5%STS 3-5: 10-20%STS>5: >20% | Herramienta primaria para cirugías cardíacas, adaptada para representar la enfermedad hepática en el riesgo perioperatorio | Limitada a cirugías cardíacas, no se centra fuertemente en la disfunción hepática fuera de las comorbilidades | Calculadora del riesgo STS |
Los pacientes con SCH tienen un riesgo significativo de complicaciones intraoperatorias y postoperatorias debido a la interacción compleja entre las disfunciones hepática y cardíaca. Intraoperatoriamente, la hipotensión refractaria es una dificultad frecuente y grave, particularmente en los pacientes con SCH de tipo iv, en los que la reducción de la resistencia vascular periférica limita la efectividad de los vasopresores estándar. La hiperperfusión esplácnica es también común, originando dificultades en el manejo de los líquidos e hipoperfusión orgánica potencial, a pesar del reemplazo intensivo de volumen. Las arritmias cardíacas son frecuentes durante la cirugía, particularmente en pacientes con miocardiopatía cirrótica. Dichas arritmias se exacerban a menudo por los desequilibrios electrolíticos, tales como la hiponatremia, que puede incrementar el riesgo de arritmias ventriculares y complicar el manejo anestésico. Los trastornos metabólicos son otra dificultad. Puede desarrollarse rápidamente hipoglucemia debido a la alteración de la gluconeogénesis hepática, pudiendo surgir acidosis metabólica de la hipoperfusión tisular, requiriendo ambas situaciones monitorización intraoperatoria estrecha. Los pacientes con SCH tienen también un riesgo incrementado de coagulopatía, que puede manifestarse como hemorragia excesiva o, paradójicamente, trombosis, especialmente en el ámbito de la hipertensión portal. Dichas coagulopatías presentan una dificultad para el equilibrio del riesgo de hemorragia, siendo necesario prevenir episodios trombóticos.
En el periodo postoperatorio, la descompensación hepática aguda es una dificultad significativa. El estrés fisiológico de la cirugía puede exacerbar la disfunción hepática, originando un empeoramiento de la ascitis, ictericia y la aparición de encefalopatía hepática, que puede estar desencadenada por factores tales como trastornos electrolíticos, infecciones o medicaciones que alteran el aclaramiento hepático. La insuficiencia cardíaca es otro riesgo postoperatorio mayor, particularmente en pacientes con miocardiopatía cirrótica y alteración de la función ventricular. La combinación de las dificultades del manejo de los líquidos y el potencial de sobrecarga circulatoria puede precipitar la descompensación aguda.
Las complicaciones renales son también comunes en estos pacientes, que tienen riesgo de desarrollar lesión renal aguda o síndrome hepatorrenal, especialmente tras periodos de hipotensión intraoperatoria o desequilibrio de los líquidos. Dichas complicaciones renales pueden empeorar considerablemente los resultados postoperatorios. Las infecciones plantean también un riesgo serio para los pacientes con SCH, que a menudo están inmunocomprometidos. Las infecciones postoperatorias, tales como la peritonitis bacteriana espontánea, la neumonía o la sepsis, son frecuentes y pueden contribuir a un rápido declive de la situación clínica. Pueden desarrollarse también complicaciones respiratorias, incluyendo el síndrome de distrés respiratorio agudo, particularmente en casos de sobrecarga de líquidos o infecciones graves.
Estrategias de manejoDado el alto riesgo de complicaciones, debe personalizarse detenidamente el manejo perioperatorio en los pacientes con SCH, para abordar las disfunciones hepática y cardíaca. Las recomendaciones generales para el manejo de la anestesia general y cardíaca se muestran en la tabla 3. Según lo debatido en la evaluación del riesgo preanestésico, las herramientas tales como las escalas MELD y Child-Pugh aportan un marco para identificar a los pacientes de alto riesgo, lo cual es esencial para personalizar las estrategias anestésica y perioperatoria. Los pacientes con puntuaciones más altas, tales como MELD>16 o Child-Pugh B o C, se enfrentan a riesgos significativamente incrementados, y necesitarán un enfoque más conservador y una monitorización intraoperatoria estrecha16,22.
Lista de revisión para procedimientos generales y cardíacos
| Fase preoperatoria |
| □ Evaluación del riesgo: utilizar las puntuaciones Child-Pugh o MELD 3.0 para evaluar la función hepática y determinar el riesgo perioperatorio. Para casos avanzados, considerar el uso de la puntuación VOCAL-Penn |
| □ Acceso vascular: garantizar el acceso vascular adecuado de la administración de líquidos y transfusiones. Evaluar la necesidad de acceso venoso central |
| □ Monitorización del gasto cardíaco: planificar la monitorización continua del gasto cardíaco para optimizar la fluidoterapia |
| □ Equipo multidisciplinario: realizar una evaluación profunda de las comorbilidades con un equipo multidisciplinario (deberán incluirse gastroenterología/hepatología, cardiología, endocrinología y hematología) |
| □ Perfil de coagulación: evaluar el estatus de coagulación y optimizar el uso de pruebas en el punto de atención, incluyendo TEG®/ROTEM® y Multiplate® para obtener un perfil de coagulación detallado |
| □ Optimización preoperatoria de la coagulación: administrar vitamina K para optimizar la coagulación antes de la cirugía, de ser necesario. Revisar la función plaquetaria con agregometría/mapeo plaquetario, si se dispone de ello |
| En cirugía cardíaca |
| □ Evaluación del riesgo: utilizar las puntuaciones EuroSCORE o puntuación del riesgo STS para evaluar el riesgo perioperatorio, incorporando la enfermedad hepática como comorbilidad. Considerar la combinación con MELD para una evaluación más amplia |
| □ Estrategia multidisciplinar: coordinar con el perfusionista y demás especialistas (cardiología, hepatología) el desarrollo de una estrategia amplia de manejo de la disfunción hepática y cardíaca |
| Fase intraoperatoria |
| Inducción |
| □ Opioides: utilizar remifentanilo |
| □ Benzodiazepina: considerar remimazolam para sedación |
| □ Hipnóticos: elegir etomidato, propofol o ketamina, dependiendo de la condición del paciente |
| □ Relajante muscular: preferiblemente atracurio o cisatracurio. Utilizar succinilcolina sólo si son normales los niveles de potasio y la función renal |
| Nota: rocuronio y vecuronio tienen efectos prolongados; utilizarlos sólo si se dispone de sugammadex para revertirlos |
| Mantenimiento |
| □ Agentes inhalados: preferiblemente desflurano o isoflurano. Utilizar sevoflurano con precaución. Considerar el uso de óxido nitroso |
| □ Monitorización neuromuscular: utilizar monitorización tren de 4 (TOF) a lo largo de la cirugía, desde la inducción a la extubación. Garantizar una ratio TOF>90% antes de la extubación |
| □ Manejo de la coagulación en el punto de atención (POC): realizar pruebas viscoelásticas si se dispone de ellas (TEG®/ROTEM®), y medidas de agregometría (mapeo plaquetario Multiplate® o TEG® 6s) para personalizar la estrategia de hemoterapia |
| En cirugía cardíaca |
| □ Bypass cardiopulmonar (CPB): para pacientes que reciben CPB, utilizar cebado retrógrado autógeno para minimizar la hemodilución y la retención de líquidos |
| □ Manejo de vasopresores: iniciar tempranamente la terapia con vasopresores para neutralizar la vasodilatación esplácnica. Los agentes de preferencia incluyen: terlipresina: 0,5-2mg IV cada 6h; vasopresina: 0,01-0,03U/min; norepinefrina: 0,05-0,4μg/kg/min |
| □ Presión oncótica: mantener la presión oncótica adecuada, a fin de cerrar la «brecha de albúmina» corrigiendo los niveles bajos de albúmina |
| □ Manejo de productos hemoderivados: garantizar la disponibilidad de productos hemoderivados suficientes, y en particular para los pacientes con alto riesgo de hemorragia |
| □ Ahorro de sangre: utilizar tecnología de recuperación de sangre intraoperatoria para reducir la necesidad de transfusiones alogénicas |
| Fase postoperatoria |
| □ Monitorización estrecha: evaluar frecuentemente la función hepática, especialmente en pacientes con puntuaciones MELD o Child-Pugh altas. Ajustar la atención postoperatoria basada en el estado de los líquidos, la coagulación y el potencial de descompensación hepática |
| □ Soporte nutricional: seguir los protocolos Enhanced Recovery After Surgery (ERAS) para optimizar la nutrición y recuperación postoperatorias, en particular en los pacientes con malnutrición o sarcopenia preoperatorias |
| En cirugía cardíaca |
| □ Continuar la monitorización hemodinámica: supervisar continuamente los signos de descompensación hepática o cardíaca. En los pacientes de alto riesgo (ej.: MELD>20 o Child-Pugh clase C), manejar estrechamente los líquidos y supervisar los signos de hipotensión o coagulopatía |
| □ Movilización temprana y nutrición: seguir los protocolos ERAS para promover la movilización temprana y la mejora de la recuperación. Garantizar un soporte nutricional intensivo para los pacientes con enfermedad hepática, para prevenir las complicaciones postoperatorias |
En los pacientes con puntuaciones del riesgo elevadas, es esencial adoptar estrategias de manejo que minimicen el estrés hemodinámico. Dichas estrategias implican a menudo una selección cuidadosa de los fármacos que sorteen el metabolismo hepático, para reducir la carga en el hígado y mantener a la vez la función cardiovascular estable. Por ejemplo, los vasopresores como la terlipresina, que constriñen selectivamente la circulación esplácnica, son preferibles para mejorar la hemodinámica sistémica en los pacientes de SCH.
La elección de los fármacos debe tener en cuenta la alteración del metabolismo hepático y los defectos de la unión proteínica. Los fármacos que dependen de las enzimas del citocromo P450 pueden acumularse en los pacientes con disfunción hepática, causando efectos prolongados y toxicidad incrementada. Por tanto, son preferibles los agentes anestésicos que son metabolizados por las esterasas plasmáticas, tales como remifentanilo y atracurio, debido a su rápido aclaramiento y mínima dependencia del metabolismo hepático (tabla 4). Atracurio, que experimenta la eliminación de Hofmann y el metabolismo de la esterasa, es particularmente útil en los pacientes con SCH de tipo iv, que presentan a menudo disfunciones hepática y cardíaca. Su farmacocinética predecible garantiza un bloqueo neuromuscular efectivo sin riesgo de acción prolongada, aun en la hepatopatía grave. Deberán utilizarse con precaución rocuronio y vecuronio en dichos pacientes, dado que su metabolismo es puramente hepático, y el bloqueo neuromuscular será prolongado. Sería mejor evitarlos, a menos que se dispusiera de sugammadex para revertirlo. Sugammadex no se metaboliza en el hígado y es aclarado casi exclusivamente por parte de los riñones. Los estudios han reflejado que no existe prolongación del tiempo de recuperación ni recurrencia del bloqueo en los pacientes hepatópatas23,24.
Fármacos anestésicos comunes y su uso en los pacientes hepáticos
| Fármaco | Uso clínico | Metabolismo | Ventajas en los pacientes hepáticos |
|---|---|---|---|
| Etomidato | Inducción de la anestesia | Metabolizado por esterasas plasmáticas y hepáticas | Acumulación mínima; aporta estabilidad hemodinámica, idóneo para pacientes con disfunción hepática |
| Propofol | Inducción y mantenimiento de la anestesia | Metabolismo hepático (CYP450); aclaramiento extrahepático | Inicio rápido; corta duración; seguro en la disfunción hepática moderada por su rápida redistribución |
| Remifentanilo | Analgesia intraoperatoria | Metabolizado por esterasas plasmáticas no específicas | Control preciso para analgesia; rápida recuperación, ideal para pacientes con función hepática alterada |
| Remimazolam | Sedación consciente y anestesia general | Metabolizado por esterasas plasmáticas | Inicio y recuperación rápidos; acumulación mínima, idóneo para pacientes con disfunción hepática |
| Fentanilo | Analgesia intraoperatoria | Principalmente hepático (CYP3A4), pero aclaramiento lento | Analgesia potente con cautela; mayor duración de la disfunción hepática, pero manejable con dosificación cautelosa |
| Atracurio | Relajante muscular no despolarizante | Degradación por la eliminación de Hofmann y las esterasas plasmáticas | Independiente del metabolismo hepático; seguro de utilizar para insuficiencia hepática y renal |
| Cisatracurio | Relajante muscular no despolarizante | Principalmente por la eliminación de Hofmann y las esterasas plasmáticas | Perfil predecible; liberación de histamina mínima, no dependiente de la función hepática o renal |
| Mivacurio | Relajante muscular no despolarizante de acción corta | Hidrolizado por butirilcolinesterasa plasmática | Duración de acción corta; seguro para pacientes con disfunción hepática, por su metabolismo no hepático |
| Succinilcolina | Intubación rápida | Hidrolizado por butirilcolinesterasa plasmática | Inicio y duración ultracortos; puede utilizarse en pacientes hepáticos si los niveles de potasio y la función renal son normales |
| Rocuronio | Relajante muscular no despolarizante | Metabolismo hepático (excreción renal menor) | Efecto prolongado en la disfunción hepática, aunque reversible con sugammadex |
| Vecuronio | Relajante muscular no despolarizante | Metabolismo hepático (CYP450) | Efecto prolongado en la disfunción hepática, aunque reversible con sugammadex; se requiere cautela |
| Clevidipina | Control agudo de la presión arterial | Metabolizado por esterasas sanguíneas y tisulares | Inicio rápido; duración corta y controlable; independiente del metabolismo hepático |
| Esmolol | Control agudo de la frecuencia cardíaca y la presión arterial | Metabolizado por esterasas eritrocíticas | Vida media ultracorta; control rápido y reversible de frecuencia cardíaca y presión arterial, independiente del metabolismo hepático |
| Ketamina | Inducción y analgesia | Metabolismo hepático (CYP450) | Inducción hemodinámicamente estable, pero cautela por su metabolismo hepático; utilizar en disfunción hepática leve |
| Dexmedetomidina | Sedación y analgesia | Metabolismo hepático (CYP2A6) | Aporta sedación sin depresión respiratoria significativa, aunque puede acumularse en la disfunción hepática grave |
| Midazolam | Sedación e inducción | Metabolismo hepático (CYP450) | Sedación prolongada en insuficiencia hepática; utilizar con cautela u optar por alternativas como remimazolam en pacientes hepáticos |
| Óxido nitroso | Adjunto anestésico | Exhalación sin cambios | Uso seguro en pacientes hepáticos debido a su carga metabólica mínima |
| Desflurano | Mantenimiento de la anestesia | <0,02% metabolismo hepático | Metabolismo hepático mínimo; eliminación rápida mediante exhalación, siendo ideal para pacientes con trastorno hepático |
| Isoflurano | Mantenimiento de la anestesia | <0,2% metabolismo hepático | Metabolismo hepático bajo; seguro para utilizar en pacientes con disfunción hepática; amplio uso y estable |
| Sevoflurano | Mantenimiento de la anestesia | ∼5% metabolismo hepático | Metabolismo hepático limitado; generalmente seguro, pero debe usarse con cautela en el trastorno hepático grave debido a su acumulación potencial |
| Terlipresina | Vasopresor para control hemodinámico | Eliminación hepática y renal | Efectiva para neutralizar la vasodilatación esplácnica en la enfermedad hepática; mejora la hemodinámica sistémica |
| Vasopresina | Vasopresor para control hemodinámico | Metabolismo hepático | Útil en la enfermedad hepática debido a su mínimo metabolismo hepático directo; ayuda a manejar la vasodilatación |
| Norepinefrina | Vasopresor para control hemodinámico | Eliminación hepática y renal | Efectiva para incrementar el tono vascular en pacientes hepáticos, pero requiere supervisión estrecha en la disfunción grave |
| Fenilefrina | Vasopresor para control hemodinámico | Metabolismo hepático (sulfatación) | Incrementa el tono vascular y la presión arterial con efectos cardíacos limitados; usar con cautela en disfunción hepática grave |
| Dobutamina | Soporte inotrópico para insuficiencia cardíaca | Metabolismo hepático (CYP450) y excreción renal | Mejora el gasto cardíaco, pero requiere cautela en la enfermedad hepática debido a acumulación potencial y arritmias |
| Lidocaína | Anestesia local, antiarrítmico | Metabolismo hepático (CYP450) | Requiere ajustar la dosis en la enfermedad hepática; efecto prolongado en trastornos hepáticos, pero es segura si se ajusta la dosis |
| Bupivacaína | Anestesia local | Metabolismo hepático (CYP450) | Anestésico local potente; usar con cautela en la enfermedad hepática por su acumulación potencial y toxicidad sistémica |
| Ropivacaína | Anestesia local | Metabolismo hepático (CYP450) | Menos cardiotóxica que bupivacaína, pero sigue requiriendo cautela y ajuste de dosis en pacientes con disfunción hepática |
| Mepivacaína | Anestesia local | Metabolismo hepático | Similar a lidocaína, pero con duración mayor; requiere dosificación cautelosa en la disfunción hepática para evitar la toxicidad |
Se recomienda utilizar monitorización neuromuscular cuantitativa TOF en el abductor corto del pulgar siempre que se utilice bloqueo neuromuscular a lo largo de la cirugía, desde la inducción a la extubación. Una ratio TOF normalizada>90% es el criterio para la extubación.
Ketamina, a pesar de utilizarse comúnmente en pacientes hemodinámicamente inestables, deberá administrarse con precaución en los pacientes con disfunción hepática. Aunque aporta estimulación cardiovascular, que puede ser beneficiosa en algunas formas de SCH, su amplio metabolismo hepático suscita preocupación acerca de los tiempos de recuperación prolongados y el incremento de la presión intracraneal en ciertos contextos. Por tanto, ketamina puede ser más adecuada en pacientes con disfunción hepática de leve a moderada, debiendo evitarse en el SCH de tipo iii, donde los fallos hepático y renal son prevalentes.
Etomidato es a menudo el anestésico de primera elección en los pacientes con enfermedades hepáticas, dado su metabolismo hepático mínimo y su rápido aclaramiento. Sin embargo, su potencial para suprimir la función adrenal, particularmente a través de 11β-hidroxilasa, necesita una consideración detenida. Este riesgo es particularmente importante en los pacientes con SCH de tipo iii, quienes pueden presentar ya insuficiencia adrenal, aunque esta puede mitigarse mediante la administración de corticosteroides perioperatorios. Un régimen recomendado podría incluir la administración de 50-100mg IV de hidrocortisona en la inducción, seguida de 50mg cada 6-8h durante 24-48h. Este enfoque soporta la función adrenal y minimiza el riesgo de inestabilidad hemodinámica.
Propofol, a pesar de metabolizarse en el hígado, es normalmente seguro en los pacientes con disfunción moderada debido a su rápida redistribución, aunque deberá utilizarse con cautela en los casos de alteración hepática grave.
Remimazolam ofrece ventajas significativas en los pacientes hepaticocomprometidos debido a su metabolismo único, que se basa principalmente en las esterasas tisulares en lugar de las vías hepáticas. Esto conduce a una farmacocinética predecible y minimiza el riesgo de acumulación de fármacos en los pacientes con deterioro de la función hepática. Su inicio rápido, duración de acción breve y recuperación predecible lo convierten en idóneo para sedación procedimental y anestesia general en esta población.
En los pacientes con enfermedades hepáticas, es normal realizar ajustes de las dosis para la sedación procedimental. Para la anestesia general, puede considerarse un bolo inicial de 6-12mg, seguido de una infusión de mantenimiento a una tasa reducida (es decir, 1-2mg/kg/h) para justificar la sensibilidad alterada. Siempre habrá que ajustarlo según la respuesta del paciente, y monitorizarlo detenidamente para evitar la sobresedación25.
Además de las opciones farmacológicas, el manejo hemodinámico es esencial en estos pacientes. Dada la alteración del tono vascular y el incremento del gasto cardíaco que se observa a menudo en el SCH de tipo iv, los vasoconstrictores estándar como norepinefrina pueden ser menos efectivos. Las alternativas como terlipresina y vasopresina proporcionan una vasoconstricción más selectiva en la circulación esplácnica, y redistribuyen el flujo sanguíneo a los órganos vitales tales como los riñones y el cerebro, que a menudo se ven comprometidos debido al fenómeno de robo esplácnico13,26,27.
Para el manejo hemodinámico, esmolol y clevidipina, que evitan el metabolismo hepático y ofrecen una acción corta o ultracorta, han demostrado ser beneficiosos, particularmente en la anestesia cardiotorácica y vascular28. Dichos agentes ayudan a mantener un control preciso de la presión arterial y la frecuencia cardíaca, a la vez que minimizan el compromiso hepático, haciendo que sean idóneos para pacientes de SCH de alto riesgo.
En la enfermedad hepática crónica (SCH de tipo iv), deberá reemplazarse la albúmina si sus niveles descienden por debajo de 3g/dl, con un objetivo de 3,5g/dl o más, mientras se considera la fracción de eyección ventricular izquierda para prevenir el edema pulmonar y los resultados postoperatorios adversos. El episodio quirúrgico puede considerarse una descompensación «predicha» de la enfermedad hepática, por lo que la administración preoperatoria de albúmina puede considerarse preventiva, debiendo disponerse fácilmente de terlipresina y midodrina29.
Dentro del marco ERAS, la optimización preoperatoria de los pacientes con hepatopatía crónica sometidos a cirugía no hepática es esencial para mejorar los resultados y reducir la morbilidad perioperatoria. La optimización nutricional es uno de los fundamentos de ERAS. Para los pacientes hepatópatas, esto implica abordar la malnutrición con intervenciones dietéticas personalizadas ricas en aminoácidos de cadena ramificada, para soportar la función hepática y mejorar la recuperación. ERAS promueve también estrategias tales como la minimización del ayuno preoperatorio y la implementación de cargas de carbohidratos, que deben ajustarse detenidamente en los pacientes hepatopáticos para prevenir la hipoglucemia y la encefalopatía. El objetivo de los protocolos de manejo de los líquidos de ERAS es mantener la euvolemia y evitar la sobrecarga de líquidos, reduciendo por tanto el riesgo de exacerbación de la ascitis o de precipitación de la descompensación hepática.
Integrando estas consideraciones hepatoespecíficas en las rutas ERAS, los clínicos pueden mitigar efectivamente los riesgos perioperatorios, acortar las estancias hospitalarias y mejorar los resultados globales del paciente21.
ConclusionesGestionar a los pacientes con SCH requiere una evaluación del riesgo detenida y un manejo anestésico personalizado. Utilizar puntuaciones del riesgo tales como Child-Pugh y MELD, junto con fármacos hepatoseguros y protocolos ERAS, ayuda a reducir las complicaciones y mejorar los resultados. Es esencial el enfoque multidisciplinar para garantizar la seguridad del paciente en este grupo de alto riesgo. La investigación futura y la colaboración clínica son fundamentales para refinar las herramientas de evaluación del riesgo y los protocolos de manejo para esta población de alto riesgo, y mejorar los resultados del paciente.
AutoríaAE, AM y JRM concibieron y prepararon la versión inicial del documento. YAS y MJ contribuyeron al enfoque perioperatorio en cirugía cardíaca. AE, AM, RNP, AAG y MJ contribuyeron a la preparación de las tablas y figuras y al enfoque de anestesia cardíaca. AE, AM, RA y AAG contribuyeron a la sección centrada en la fisiopatología y consideraciones gastroenterológicas globales. Todos los autores han contribuido a la revisión interna y cambios generales del documento.
Conflicto de interesesNinguno de los autores ha reportado conflicto de intereses.