En pacientes hiperlipémicos resultan frecuentes los procesos trombóticos, en los que las plaquetas desempeñan un papel decisivo. La presencia de plaquetas activadas circulantes, descrito en un trabajo anterior, constituye un importante factor de riesgo trombótico, por lo que resulta de gran interés disponer de un fármaco hipolipemiante que, además de normalizar los lípidos plasmáticos, también disminuya la activación de las plaquetas circulantes.
Los principales objetivos del presente estudio son valorar si la mayor activación plaquetaria de los pacientes hipercolesterolémicos se acompaña de cambios en la movilización del calcio libre citoplasmático plaquetario y si dichas alteraciones se normalizan mediante la medicación con atorvastatina.
Material y métodosPara alcanzar éstos objetivos se estudian 30 pacientes hipercolesterolémicos y 40 controles normolipémicos. En sangre anticoagulada con citrato, se determina el porcentaje plaquetas CD62+, el número de microagregados plaquetarios formados espontáneamente (MAP/5.000 plaquetas) y la movilización del calcio libre citoplasmático. Para ello, se utiliza un citómetro EPICS-XL, y los anticuerpos y fluorocromos CD61.PE, CD62.FITC y FURA3-AM. Los pacientes se estudian antes y después de 2 meses de tratamiento con atorvastatina (20mg/día).
ResultadosLos resultados obtenidos indican que el tratamiento con atorvastatina disminuye significativamente la concentración de colesterol total, colesterol unido a lipoproteínas de baja densidad (cLDL) y triglicéridos. En paralelo se observa una disminución del % plaquetas circulantes CD62+ (2,41±1,55% a 1,45±1,06%; p<0,05) y del número de MAP (390±43 a 322±48; p<0,05). Estos cambios se acompañan de la normalización de la movilización del Ca2+ libre citoplasmático plaquetario.
ConclusionesComo conclusión, se observa que la citometría de flujo de sangre entera constituye una técnica útil para abordar temas tales como los planteados en el presente trabajo. Los pacientes hipercolesterolémicos presentan mayor activación plaquetaria, que se acompaña de la formación de microagregados plaquetarios y de cambios en la movilización del Ca2+, que se normalizan mediante el tratamiento con atorvastatina, hecho que no se ha comunicado previamente en la bibliografía revisada.
Thrombotic events are common in hyperlipemic patients in which platelet activation play a decisive role. The presence of activated platelets, as described in a previous paper, is a major risk factor for thrombosis in patients with a high plasma cholesterol and it is therefore of great interest to have a lipid lowering drug that, in addition to normalising plasma lipids, also decreases this activation of circulating platelets. The main aims of this study are to assess whether the increased platelet activation in hypercholesterolemic patients is accompanied by changes in cytoplasmic free calcium mobilisation in platelets and the formation of platelet microaggregates, and whether these changes are normalised by treatment with atorvastatin.
Material and methodsTo achieve these aims 30 hypercholesterolemia patients and 40 normolipemic controls were recruited. The percentage of CD62 positive platelets, the number of spontaneously formed platelet microaggregates (MAP/5000 platelets) and the free calcium mobilization in platelets were evaluated in citrated blood . An EPICS-XL flow cytometer and the antibodies and fluorochromes CD61.PE, CD62.FITC and FLUO3-AM were used for this study. The patients were evaluated before and after two months of atorvastatin (20mg/day) treatment.
ResultsThe results show that atorvastatin treatment significantly decreases the plasma concentration of total and LDL-Cholesterol and triglycerides. In parallel a decrease was noted in the percentage of activated circulating CD62 positive platelets (2.41±1.55% to 1.45±1.06%, P<0.05) and also in the number of spontaneously formed MAP (390±43 to 322±48, P<0.05). These changes were accompanied by the normalization in the free calcium mobilization in platelets.
ConclusionsAs a conclusion it is noted that the flow cytometry of whole blood is a useful technique for evaluating aspects such as those raised in this study. Hypercholesterolemia patients showed more spontaneous platelet activation, which was accompanied by the formation of platelet microaggregates and changes in the cytoplasmic free calcium mobilization, which were normalised by treatment with atorvastatin, which has not been previously reported in the literature.
La activación y agregación plaquetaria parecen estar aumentadas en la hipercolesterolemia1–3, lo que puede constituir un importante factor de riesgo en la patogenia de las lesiones ateroscleróticas y de la enfermedad cardíaca coronaria, dado el papel que las plaquetas desempeñan en el desarrollo de estos eventos. Diversos autores han establecido que las lipoproteínas influyen en la funcionalidad plaquetaria4–6 y que el colesterol unido a lipoproteínas de baja densidad (cLDL) estimula la movilización del calcio intraplaquetario7. En general, los estudios de estos grupos de trabajo están realizados utilizando plaquetas lavadas o plasma rico en plaquetas. En ambos casos, la respuesta funcional es poco fisiológica, al estar las plaquetas fuera de su medio natural, sin el resto de las células sanguíneas, y también al poder resultar traumatizadas y activadas in vitro artificialmente, por la manipulación que estas técnicas comportan. En otros casos, la función plaquetaria se valora indirectamente, mediante la determinación en plasma de productos de secreción plaquetaria, indicadores de activación8,9. Con estos métodos no se puede valorar la existencia de subpoblaciones plaquetarias con alteraciones en su función, que pueden tener gran importancia en el proceso aterotrombótico, ni determinar directamente la presencia de marcadores plaquetarios específicos de activación. Adicionalmente, en la mayoría de estos estudios se observa el fenómeno final de la agregación plaquetaria, sin poder estudiar los mecanismos de activación-inhibición que intervienen en dicho proceso, y que permiten entenderlo y actuar más eficazmente sobre éste.
Los cambios lipídicos pueden actuar sobre la función plaquetaria a través de los intercambios lipoproteína-plaqueta que activan la vía de las fosfolipasas que, a su vez, inician una serie de reacciones encadenadas que conducen a la activación final de la plaqueta. Por ejemplo, se ha comunicado la correlación existente entre la concentración de colesterol plasmático y los marcadores de activación plaquetaria CD62 y CD6310. La lipemia alimentaria inducida con dieta parece aumentar significativamente en el período posprandial el porcentaje de plaquetas que expresan CD62 en su membrana, tanto in vivo como después de estimulación con ADP in vitro11. Otros autores han comunicado que las plaquetas de los pacientes hipercolesterolémicos son más sensibles a la estimulación con adenosín difosfato (ADP)12.
Con independencia de los mecanismos involucrados en el proceso de activación plaquetaria, nuestro grupo observó, en un trabajo anterior, que los pacientes hipercolesterolémicos presentaban mayor expresión del complejo GPIIb/IIIa en su forma activa, mayor exposición de CD62 y mayor expresión de fosfatidilserina que los sujetos normolipémicos13. Adicionalmente se comunicó que la atorvastatina, un inhibidor de la 3-hidroxi-3metilglutaril-coenzima A (HMGCoA) reductasa, normalizaba significativamente dichas alteraciones plaquetarias. Estos cambios en la función plaquetaria se correlacionaban con la concentración plasmática de colesterol total y cLDL13, lo que sugiere que la normalización de la hiperfunción plaquetaria en los pacientes hipercolesterolémicos podría ser atribuida a los cambios que produce la atorvastatina en los lípidos plasmáticos.
Sin embargo, dado que la activación plaquetaria está condicionada, en gran medida, por cambios en la concentración de Ca2+ libre citoplasmático, resulta interesante valorar si en la hipercolesterolemia se producen cambios en la cinética del Ca2+ por movilización de los depósitos internos de calcio y/o por la entrada desde el medio extracelular, y si la atorvastatina normaliza esta cinética de calcio libre citoplasmático intraplaquetario. Resulta de interés valorar la movilización de Ca2+, porque de la concentración de dicho ión depende directamente la activación de la plaqueta y la formación de micropartículas y microagregados de origen plaquetario. Este posible efecto de la atorvastatina en la movilización del calcio libre citoplasmático no ha sido abordado en ninguno de los trabajos publicados en la bibliografía revisada, por lo que se ha considerado de interés la realización del presente estudio.
Material y métodosEn este estudio piloto prospectivo, a simple ciego, se han incluido 30 pacientes hipercolesterolémicos consecutivos (16 varones, 14 mujeres), de edad 53,8±11,3 años e índice de masa corporal 25,9±3,3kg/m2. Ninguno de los pacientes reclutados era diabético, 2 presentaban hipertensión arterial controlada mediante fármacos, 7 eran fumadores de menos de 10 cigarrillos/día, ninguno era bebedor de más de 30g alcohol/día y 2 practicaban habitualmente ejercicio físico intenso. Ninguno de los pacientes presentaba historia clínica personal de episodio trombótico previo, pero el 35% tenía historia familiar con este tipo de enfermedad. Los pacientes fueron reclutados después de un período de 6 semanas sin tratamiento farmacológico y con dieta hipolipemiante adecuada. Los pacientes fueron evaluados en situación basal (inmediatamente antes de iniciar la medicación) y después de 2 meses de tratamiento con atorvastatina (20mg/día). Durante todo el estudio, los pacientes mantuvieron su estilo de vida habitual y no se sometieron a ningún otro tipo de tratamiento adicional. Cuarenta voluntarios normolipémicos, comparables a los pacientes en edad, sexo y factores de riesgo añadidos, fueron elegidos como grupo control. Ninguno de los controles presentaba historia personal ni familiar de enfermedad trombótica. Los criterios de exclusión fueron: enfermedad de base orgánica conocida (riñón, hígado, corazón), cáncer, enfermedades infecciosas o inflamatorias, tratamiento con medicamentos antiplaquetarios, embarazo, obesidad y tratamiento concomitante con otros fármacos hipolipemiantes o antiplaquetarios. Los pacientes y controles fueron estudiados en paralelo y fueron incluidos en el estudio después de dar su consentimiento por escrito, de acuerdo con la declaración de Helsinki, después de la aprobación del estudio por el comité ético del Hospital Clínico Universitario de Valencia.
Los parámetros bioquímicos de rutina fueron determinados en un autoanalizador Olympus AU-5400 (Mishima, Japón). Los análisis hematológicos se valoraron en un autoanalizador Sysmex XE-2100 (Kobe, Japón) y los hemostáticos en un ACL-TOP (Instrumentation Laboratory, Lexington, MA, EE.UU.).
Las muestras de sangre anticoaguladas con citrato (129mmol/l; 9:1, v/v) se obtuvieron después de un ayuno de 12h en tubos de vidrio siliconizados mediante punción venosa de la vena antecubital, evitando al máximo la estasis y desechando el primer tubo. Dado que las plaquetas se activan fácilmente in vitro, los análisis plaquetarios se iniciaron antes de los 30min siguientes a su extracción, sin agitar, a temperatura ambiente y en tubos de polipropileno.
Métodos citométricosTodos los análisis citométricos se efectuaron en un EPICS XL.MCL Flow Cytometer (Beckman-Coulter, FL, EE.UU.). El citómetro se preparó para registrar forward y side scatter, y para medir las intensidades de la fluorescencia de CD61-PE, CD62-FITC (Immunotech, Marsella, Francia) y Fluo3-AM (Fluo-3-AM, Molecular Probes, Leiden, Países Bajos), que se recogieron como histogramas en escala logarítmica. Los anticuerpos conjugados con fluorocromos utilizados en el presente estudio pertenecían al mismo lote. Las muestras se analizaron por duplicado después de comprobar el alineamiento del citómetro de flujo con Immunocheck Beads (Beckman-Coulter, FL, EE.UU.). La adquisición de datos se realizó mediante el programa System II (Beckman-Coulter, FL, EE.UU.). Los resultados se presentan como valor medio±desviación estándar (DE). La estadística se valoró mediante el análisis de la varianza (ANOVA) y las correlaciones se establecieron mediante los coeficientes de correlación de Pearson (SPSS for Windows Statistical Software, Chicago, IL, EE.UU.). La significación estadística se estableció para un valor de p<0,05.
En el presente estudio se valoró la exposición de CD62 por medio de un método citométrico de doble color descrito previamente14. Las micropartículas y microagregados se distinguieron de las plaquetas en función de sus valores de forward y side scatter, que se relacionan respectivamente con el tamaño y complejidad de la membrana celular. De acuerdo con Matzdorff et al15, utilizando muestras de voluntarios sanos, se definió arbitrariamente, en función del valor forward, una región que incluía el 90% de los eventos CD61 positivos. Esta región se definió como “región de las plaquetas”. Inmediatamente por debajo de la misma se estableció otra región, que incluía el 5% de los eventos CD61 positivos, que se definió como “región de micropartículas” y por encima se definió otra región que incluía el 5% de eventos de mayor tamaño, que incluía los microagregados plaquetarios. Una vez establecidas estas regiones con muestras de voluntarios sanos, se analizaron las muestras de los pacientes y controles incluidos en el estudio. Los resultados de micropartículas y microagregados se expresan como su número por 5.000 plaquetas analizadas.
Para evaluar la movilización del calcio libre citoplasmático en plaquetas, de acuerdo con Do Ceu et al16 con algunas modificaciones, se diluyeron 5μl de sangre anticoagulada con citrato en 100μl en tampón HEPES (Sigma-Aldrich, Mo, EE.UU.) y se incubó con 3μl de fluo-3-acetoximetilester 250μM en dimetil sulfóxido y 5μl de CD61-PE. La mezcla se incubó durante 30min en oscuridad y temperatura ambiente. A continuación se diluyó con 4ml de tampón HEPES. La intensidad de la fluorescencia basal del FLUO 3-AM (FL1 log) se midió, utilizando una alícuota de 1ml de la mezcla, durante 15s en la población plaquetaria, identificada en la región FS log/SS log como episodios CD61-positivos. La aspiración de las células en el citómetro se interrumpió brevemente, la mezcla se estimuló con trombina (concentración final 0,1U/ml) e inmediatamente se reinició la adquisición de datos en el citómetro. Los cambios con el tiempo de la fluorescencia Fluo-3 AM se registraron durante 2min. En estas condiciones, se obtuvieron 3 datos. Una lectura de fluorescencia inicial, relacionada con la concentración basal de Ca2+ libre citoplasmático, un rápido y pasajero aumento de fluorescencia por acción de la trombina, relacionado con la “activabilidad” de la célula, seguido de una progresiva disminución de fluorescencia, relacionada con la capacidad de la plaqueta para recuperar sus valores iniciales de calcio. Los valores de la fluorescencia se expresaron como unidades arbitrarias de fluorescencia (UAF). Con los datos fluorescencia-tiempo se trazó una línea de regresión, de la que se calculó el valor de la pendiente m, utilizando el programa Microsoft Excel.
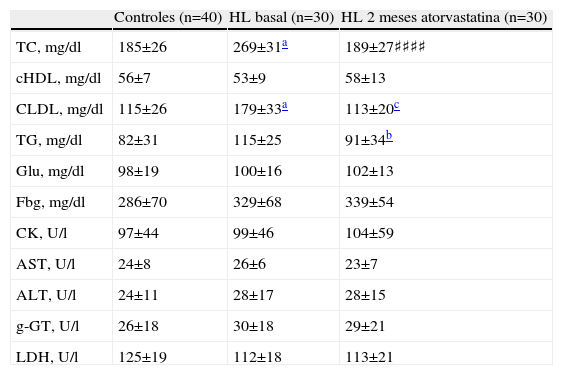
ResultadosNingún paciente tuvo que abandonar el estudio debido a algún efecto secundario de suficiente entidad. En los análisis rutinarios de hematología y hemostasia no se detectó ningún cambio indeseable que justificara la interrupción de la medicación (resultados no mostrados). Los principales parámetros bioquímicos se resumen en la tabla 1, donde se aprecia que los pacientes, en situación basal, presentan cifras significativamente mayores de colesterol total y cLDL que el grupo control (269±31mg/dl y 179±33mg/dl frente a 185±26mg/dl y 115±26mg/dl, respectivamente). El tratamiento con atorvastatina disminuye significativamente ambas concentraciones, con unas cifras finales de 189±27mg/dl y 113±20mg/dl, respectivamente (p<0,001). También se observa una disminución significativa en la concentración de triglicéridos plasmáticos, de 115±25mg/dl a 91±34mg/dl (p<0,05).
Valor medio, desviación estándar y significación estadística de los parámetros analíticos en controles y pacientes, antes y después del tratamiento con atorvastatina
| Controles (n=40) | HL basal (n=30) | HL 2 meses atorvastatina (n=30) | |
| TC, mg/dl | 185±26 | 269±31a | 189±27♯♯♯♯ |
| cHDL, mg/dl | 56±7 | 53±9 | 58±13 |
| CLDL, mg/dl | 115±26 | 179±33a | 113±20c |
| TG, mg/dl | 82±31 | 115±25 | 91±34b |
| Glu, mg/dl | 98±19 | 100±16 | 102±13 |
| Fbg, mg/dl | 286±70 | 329±68 | 339±54 |
| CK, U/l | 97±44 | 99±46 | 104±59 |
| AST, U/l | 24±8 | 26±6 | 23±7 |
| ALT, U/l | 24±11 | 28±17 | 28±15 |
| g-GT, U/l | 26±18 | 30±18 | 29±21 |
| LDH, U/l | 125±19 | 112±18 | 113±21 |
HL: pacientes hiperlipémicos; ator: atorvastatina.
En la tabla 2 puede apreciarse que no existe diferencia significativa en el porcentaje de plaquetas circulantes con expresión de CD62 en su superficie al comparar los pacientes, antes del tratamiento, y el grupo control. El tratamiento con atorvastatina consigue disminuir significativamente el porcentaje de plaquetas circulantes espontáneamente activas, que disminuye de 2,41±1,55% (situación basal) a 1,45±1,06% (tras 2 meses de tratamiento; p<0,05). En cuanto a la sensibilidad al ADP, se observa una cierta tendencia, no estadísticamente significativa, a que los pacientes en situación basal presentan una mayor respuesta que los controles, lo que se normaliza a los dos meses de medicación.
Porcentaje de plaquetas CD62 positivas activadas espontáneamente y por acción del ADP en controles y pacientes antes y después del tratamiento con atorvastatina
| %CD62+espontáneas | %CD62+ADP 2,5μM | %CD62+ADP 5,0μM | |
| HL basal (n=30) | 2,41±1,55 (ns) | 42,91±10,08 (ns) | 43,16±11,16 (ns) |
| HL 2 meses atorvastatina (n=30) | 1,45±1,06* | 36,48±11,56 (NS) | 37,56±11,28 (NS) |
| Grupo control (n=40) | 1,99±1,69 | 39,99±14,04 | 40,35±14,93 |
Ator.: atorvastatina; HL: pacientes hiperlipémicos; m: meses; ns: no significativo frente a control; NS: no significativo frente a basal.
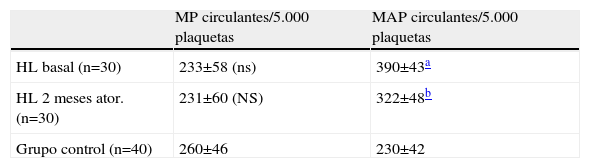
En relación con el número de micropartículas (MP) circulantes, formadas espontáneamente, en la tabla 3 puede observarse que no existen diferencias significativas entre controles y pacientes, ni parece que el tratamiento con atorvastatina modifique su formación. Por el contrario, en la tabla 3 se aprecia que los pacientes hipercolesterolémicos presentan, en situación basal, un mayor número de microagregados plaquetarios circulantes (MAP) que los controles (390±43 por 50.000 plaquetas frente a 230±42; p<0,01). El número de MAP disminuye significativamente con el tratamiento aplicado a los pacientes, disminuyendo hasta 322±48 por 5.000 plaquetas (p<0,05).
Micropartículas y microagregados plaquetarios circulantes en controles y pacientes antes y después del tratamiento con atorvastatina
| MP circulantes/5.000 plaquetas | MAP circulantes/5.000 plaquetas | |
| HL basal (n=30) | 233±58 (ns) | 390±43a |
| HL 2 meses ator. (n=30) | 231±60 (NS) | 322±48b |
| Grupo control (n=40) | 260±46 | 230±42 |
HL: pacientes hiperlipémicos; ator.: atorvastatina; m: meses; MP: micropartículas de plaquetas; MAP: microagregados plaquetarios; ns: no significativo frente a control; NS: no significativo frente a basal.
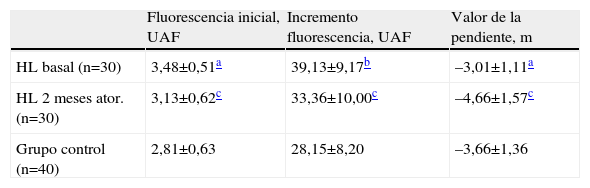
En la tabla 4 se resumen los datos correspondientes a la cinética del Ca2+ libre citoplasmático. Puede apreciarse que, en situación basal, los pacientes hipercolesterolémicos parecen presentar una mayor concentración de Ca2+ que los controles, ya que su fluorescencia inicial es mayor (3,48±0,51 frente a 2,81±0,63UAF; p<0,05). Esta mayor fluorescencia disminuye significativamente hasta 3,13±0,62UAF, tras 2 meses de tratamiento con atorvastatina (p<0,05). El incremento de fluorescencia debido a la estimulación con trombina es mayor en los pacientes en situación basal (39,13±9,17UAF) que en los controles (28,15±8,20UAF), diferencia que es estadísticamente muy significativa (p<0,001). Esta mayor sensibilidad plaquetaria a la acción del agonista tiende a normalizarse significativamente (p<0,05) a los 2 meses de medicación con atorvastatina, con incrementos de fluorescencia de 33,36±10,00UAF. Otro de los cambios observados en la cinética del calcio libre citoplasmático, es el indicado por el valor de la pendiente de la recta de regresión, mayor en los controles que en los pacientes sin tratamiento −3,66±1,36 frente a −3,01±1,11; p<0,05). El valor de dicha pendiente aumenta significativamente en los pacientes bajo tratamiento con atorvastatina, con valores finales de –4,66±1,57, significativamente mayores que los valores basales (p<0,05).
Movilización del Ca2+ libre citoplasmático por trombina (0,1U/ml) en controles y en pacientes hiperlipémicos antes y después del tratamiento con atorvastatina
| Fluorescencia inicial, UAF | Incremento fluorescencia, UAF | Valor de la pendiente, m | |
| HL basal (n=30) | 3,48±0,51a | 39,13±9,17b | –3,01±1,11a |
| HL 2 meses ator. (n=30) | 3,13±0,62c | 33,36±10,00c | –4,66±1,57c |
| Grupo control (n=40) | 2,81±0,63 | 28,15±8,20 | –3,66±1,36 |
Ator: atorvastatina; HL: pacientes hiperlipémicos; UAF: unidades arbitrarias de fluorescencia.
Al efectuar el estudio de correlaciones entre los cambios observados en la cinética del Ca2+ y la concentración de cLDL, se observa que existe una correlación estadísticamente significativa entre el incremento de fluorescencia debida a la estimulación con trombina y la concentración plasmática de cLDL (r de Pearson=0,444; p=0,009).
DiscusiónLos resultados obtenidos en el presente estudio relacionados con la eficacia de la atorvastatina como hipolipemiante y a su seguridad y falta de efectos secundarios confirman datos previos publicados por nuestro grupo y por otros autores13,17–19. En efecto, en todos los pacientes estudiados, la atorvastatina disminuye significativamente el nivel de colesterol total y LDL, sin efectos secundarios indeseables.
En el presente trabajo se observa que la atorvastatina reduce el porcentaje de plaquetas circulantes CD62-positivas, lo que también ha sido comunicado por otros investigadores20,21, que lo relacionan con la acción de la atorvastatina sobre los receptores plaquetarios de las LDL oxidadas, con la consiguiente disminución de la activación plaquetaria. Es sabido que el cLDL aumenta la producción de anión superóxido (O2–), mediante la activación de la fosfolipasa A2 y las enzimas NADH/NADPH. La atorvastatina puede reducir la producción de O2– por las plaquetas, debido, en parte, a su acción sobre el cLDL y, por otra parte, debido a otros posibles mecanismos que serían responsables de la actividad antioxidante de dicho fármaco9,20. Otros grupos sugieren que la atorvastatina puede inhibir directamente la activación plaquetaria mediante un mecanismo no bien conocido, relacionado con el receptor PAR-1 de la trombina22. Sin embargo, dado que en un trabajo anterior de nuestro grupo se observó una correlación directa entre las concentraciones de colesterol total y cLDL y la expresión de marcadores de activación plaquetaria, en pacientes hipercolesterolémicos tratados con atorvastatina13, se podría especular que dicho fármaco ejerce su acción sobre las lipoproteínas y estas, a su vez, modifican la activación plaquetaria.
Las micropartículas derivadas de plaquetas (MP) y los MAP se consideran marcadores de activación plaquetaria. La coagulación dependiente de la membrana plaquetaria desempeña un papel importante cuando aumenta significativamente el número de MP debido a la formación del complejo protrombinasa (fosfatidilserina-Ca2+-Fva-Fxa) sobre la superficie de las MP, lo que estimula la formación de trombina23. Nuestros resultados indican que la hiperlipemia no modifica el número de MP, lo que resulta congruente con lo publicado por Olivotti et al24, por lo que no parece que los pacientes estudiados presenten un estado de hipercoagulabilidad atribuible a un incremento en la formación del complejo protrombinasa. Por otro lado, la administración de atorvastatina no modifica el número de dichas MP, lo que sugiere que dicho fármaco no modificaría un hipotético estado de hipercoagulabilidad debido a un aumento de MP.
En el presente estudio se observa un mayor número de MAP circulantes en los pacientes antes de iniciar el tratamiento que en los controles. Esta observación sugiere que en la hipercolesterolemia, una subpoblación de plaquetas circula en estado activado, lo que facilita la formación de agregados plaqueta-plaqueta, tal como han comunicado otros autores25. Dado que la presencia espontánea de dichos MAP constituye un factor de riesgo de eventos cardiovasculares26 y que los microagregados formados poseen potencial para formar trombos mayores que producirán oclusiones vasculares27, la población con hipercolesterolemia sin controlar, puede considerarse, desde este punto de vista, como una población con riesgo de trombosis. Esta situación tiende a normalizarse tras dos meses de tratamiento con atorvastatina, lo que puede significar un interesante efecto añadido, que no ha sido comunicado previamente por ninguno de los autores consultados.
Los resultados del presente estudio indican que los pacientes hipercolesterolémicos presentan mayor concentración de Ca2+ basal que los controles, lo que concuerda con lo publicado por Bochkov et al28. Este hecho puede atribuirse al influjo de Ca2+ debido a la elevada concentración plasmática de cLDL, y a la activación del ciclo fosfatidil-inositol en las plaquetas7. Según nuestros resultados, los pacientes con mayores cifras de colesterol total y cLDL muestran mayor movilización del calcio libre citoplasmático, lo que resulta coherente con lo publicado por otros autores7. La mayor respuesta a la trombina, que presentan las plaquetas de pacientes con elevadas concentraciones de cLDL, puede explicarse a través de diversos mecanismos no bien establecidos. Uno de tales mecanismos es la activación de la vía de las fosfolipasas C y A2 que, a su vez, movilizan los depósitos internos del ión Ca2+ que, junto a la entrada del calcio extracelular y la activación de la proteincinasa C, inicia la exposición de receptores del fibrinógeno y la reacción de secreción plaquetaria29. Los resultados del presente estudio indican que la atorvastatina normaliza la cinética del calcio libre citoplasmático intraplaquetario, lo que coincide, en general, con lo comunicado por otros autores que han utilizado técnicas diferentes30. En cuanto a la capacidad de las plaquetas para recuperar su concentración inicial de calcio después de ser activadas con trombina (indicada por el valor de la pendiente m de la recta de regresión fluorescencia-tiempo), nuestros resultados muestran que es menor en los pacientes hipercolesterolémicos que en los controles. Resulta difícil comparar este aspecto de la cinética del calcio plaquetario con lo publicado por otros grupos de trabajo, dada la falta de datos en la bibliografía consultada. Este aspecto puede resultar relevante, ya que una menor pendiente de normalización, obtenida con nuestra técnica cinética, significa que la plaqueta, después de ser estimulada, mantiene durante más tiempo una concentración elevada de Ca2+ , con lo que ello implica sobre la activación plaquetaria. El hecho observado de que dicha pendiente aumenta significativamente mediante el tratamiento con atorvastatina podría suponer un interesante efecto beneficioso añadido, descrito por primera vez en la literatura científica.
De todo lo expuesto, parece razonable pensar que el desequilibrio de lipoproteínas, característico de la hipercolesterolemia, puede afectar alguna de las vías de activación plaquetaria, lo que podría explicar los cambios observados en la mayor activación y reactividad que presentan las plaquetas de los pacientes hipercolesterolémicos sin tratamiento. Sin embargo, los resultados obtenidos permiten especular que, además del mecanismo indirecto lípidos-plaquetas, la atorvastatina puede actuar directamente sobre la activación plaquetaria a través de su efecto sobre la movilización del calcio libre intraplaquetario.
Está bien establecido que la atorvastatina presenta un amplio rango de efectos pleiotrópicos que contribuyen a su capacidad para disminuir el riesgo cardiovascular, incluyendo la estabilización de la placa, mejora de la función endotelial, inhibición de la proliferación y migración celular de la musculatura lisa, reducción de la expresión de moléculas de adhesión, prevención de la esterificación y acumulación de colesterol, reducción de la formación de factores trombogénicos y, tal como se describe en el presente estudio, una normalización de la actividad plaquetaria y de la movilización de calcio.
La reducción de mortalidad y morbilidad en pacientes hipercolesterolémicos tratados con estatinas ha sido atribuida principalmente a la acción de dichos fármacos sobre la síntesis de colesterol total y cLDL. Sin embargo, nuestros resultados muestran que la acción de la atorvastatina en la activación plaquetaria, la formación de microagregados plaquetarios y la movilización del calcio libre citoplasmático pueden ser considerados como otros importantes efectos pleiotrópicos no descritos en la bibliografía consultada.
Comunicación premiada en el II Congreso Nacional del Laboratorio Clínico celebrado en La Coruña del 4 al 7 de junio de 2008.