El diagnóstico precoz de las fístulas de líquido cefalorraquídeo (LCR) minimiza el riesgo de que los pacientes desarrollen graves complicaciones. Una herramienta diagnóstica es demostrar la presencia de LCR en las secreciones nasales, óticas y heridas quirúrgicas mediante el uso de marcadores bioquímicos específicos. El objetivo del trabajo es evaluar la utilidad de la β2-transferrina (β2-Tr) y la proteína β-traza (p-βT) en el diagnóstico de la fístula de LCR.
Material y métodosSe realizó la detección de β2-Tr y la medición de p-βT en 68 muestras de secreciones nasales, óticas y heridas quirúrgicas, procedentes de 54 pacientes con sospecha de presentar una fístula de LCR. El diagnóstico fue confirmado por criterios clínicos y otras pruebas diagnósticas. Se calcularon la sensibilidad y la especificidad diagnóstica, el valor predictivo positivo (VPP) y negativo (VPN). Para la p-βT se obtuvo el punto de corte óptimo mediante un análisis de curva ROC.
ResultadosPara la β2-Tr se obtuvo una sensibilidad del 83%, especificidad del 96%, VPP del 95% y VPN del 86%. Para la p-βT, se obtuvo un área bajo la curva de 0,981. Para un punto de corte óptimo de 1,14mg/L, se obtuvo una sensibilidad del 92%, especificidad del 95%, VPP del 96% y VPN del 91%. El punto de corte con un VPN del 100% fue de 0,64mg/L.
ConclusionesLa β2-Tr y la p-βT pueden utilizarse como marcadores de la existencia de fístula de LCR por su elevada sensibilidad y especificidad diagnóstica. Se concluye que un valor de p-βT ≥ 1,14mg/L indica fístula de LCR y un valor ≤ 0,64mg/L la descarta. Valores entre 0,64 y 1,14mg/L no son concluyentes y sería necesario realizar la detección de β2-Tr.
Early diagnosis of cerebrospinal fluid (CSF) fistula minimizes the risk of severe complications for patients. A diagnostic approach consists in revealing the presence of CSF in nasal, ear, and surgical wound secretions. The aim of this work is to evaluate the usefulness of β2-transferrin (β2-Tr) and β-trace protein (p-βT) as markers for the diagnosis of a CSF fistula.
Material and methodsA total of 68 samples of nasal, ear, and surgical wound secretions were taken and analysed from 54 patients with clinical suspicion of a CSF fistula. β2-Tr and p-βT were determined in all fluids. The CSF fistula was diagnosed by clinical criteria and other diagnostic procedures. Sensitivity and specificity, as well as positive (PPV) and negative (NPV) predictive values, were calculated. The optimal cut-off point for p-βT was obtained using a ROC curve analysis.
ResultsFor β2-Tr, a sensitivity of 83%, a specificity of 96%, a PPV of 95% and a NPV of 86% were obtained. For the p-βT ROC curve analysis, the area under the curve was 0.981, with an optimal cut-off value of 1.14mg/L. For this cut-off point, a sensitivity of 92%, a specificity of 95%, a PPV of 96%, and a NPV of 91% were calculated. The p-βT cut-off point obtained for 100% NPV was 0.64mg/L.
Conclusionsβ2-Tr and p-βT can be used as CSF fistula markers, since both proteins have high sensitivity and specificity diagnostic values. It is concluded that, ≥ 1.14mg/L p-βT values are indicative of CSF fistula, and values ≤ 0.64mg/L rules it out. Values>0.64 and<1.14mg/L are not conclusive, and in these cases it would be necessary to determine β2-Tr.
Las fístulas de líquido cefalorraquídeo (LCR) se producen tras la rotura de las barreras que separan la cavidad nasal y los senos paranasales de los espacios subaracnoideos. Se clasifican según la etiología en fístulas de origen traumático, no traumático y espontaneas1,2. Las fístulas de origen traumático son en su mayoría secundarias a traumatismos craneales y constituyen un 90% de los casos. De este grupo, el 80% presenta rinorrea y el 20% otorrea. La principal importancia de una fístula de LCR es la de constituir una puerta de entrada hacia el sistema nervioso central para una serie de microorganismos que colonizan la mucosa de las cavidades vecinas a la base del cráneo, pudiendo ocasionar encefalitis o meningitis. Es de vital importancia, por tanto, su identificación inmediata junto con su reparación para evitar la aparición de este tipo de complicaciones potencialmente mortales3,4.
La sospecha diagnóstica de la fístula de LCR se establece inicialmente tras una anamnesis minuciosa, en la que se encuentren síntomas clínicos sugestivos. Los más frecuentes son la rinorrea acuosa unilateral y la cefalea. Posteriormente, se confirma el diagnóstico mediante el uso de diferentes pruebas: la endoscopia endonasal, técnicas de imagen, la administración tópica o intratecal de fluoresceína y la demostración de la presencia de LCR en las muestras procedentes de secreciones de nariz, oído y heridas quirúrgicas mediante el análisis de marcadores bioquímicos específicos5–7.
Las técnicas de imagen son fundamentales para conocer la etiología y la localización de la fístula de LCR8–10. La administración de fluoresceína intratecal se utiliza para la localización exacta de la fístula11 y para la verificación del éxito de cierre de la fístula de forma intraoperatoria. Una vez localizada la fístula, se procede al cierre quirúrgico de la misma con el uso de diferentes técnicas, en la mayoría de las ocasiones a través de un abordaje endoscópico nasosinusal12,13.
La detección de LCR en las diferentes secreciones confirma el diagnóstico y es una de las bases de los algoritmos diagnósticos y de manejo utilizados14,15. Para detectar la presencia de LCR en las secreciones se deben utilizar marcadores bioquímicos específicos, que se localicen exclusivamente en el LCR o que se encuentren en altas concentraciones respecto a otros líquidos biológicos como la sangre16.
Los marcadores utilizados son las proteínas β2-transferrina (β2-Tr) y la proteína β-traza (p-βT). La β2-Tr es la forma desializada de la transferrina. Se encuentra principalmente en el LCR, aunque también está presente en la perilinfa y en los humores acuoso y vítreo. No se detecta habitualmente en el suero ni en otras secreciones5. En el suero, se puede encontrar en pacientes con un consumo crónico y elevado de alcohol, y en ciertas variantes genéticas de baja frecuencia16.
Se considera un marcador de referencia de LCR, con una sensibilidad diagnóstica descrita del 73-93% y una especificidad del 97-100%6,16,17. La principal desventaja de su utilización es que requiere de un método electroforético laborioso para su detección18,19.
La p-βT es una proteína con actividad enzimática (prostaglandina-D2 sintasa), sintetizada principalmente en los plexos coroideos y las leptomeninges20. Es una de las proteínas más abundantes del LCR después de la albúmina. Se encuentra también, aunque en pequeñas concentraciones, en otras secreciones como el humor acuoso y la perilinfa. En el suero, el rango de concentración es de 0,12-1,44mg/L y en el LCR de 11,50-32,60mg/L16. La relación de concentración entre LCR y suero varía entre 30-40 y es la más alta entre las proteínas específicas del LCR16. En las secreciones nasales de personas sanas el rango de concentración es de 0,22-1,69mg/L16.
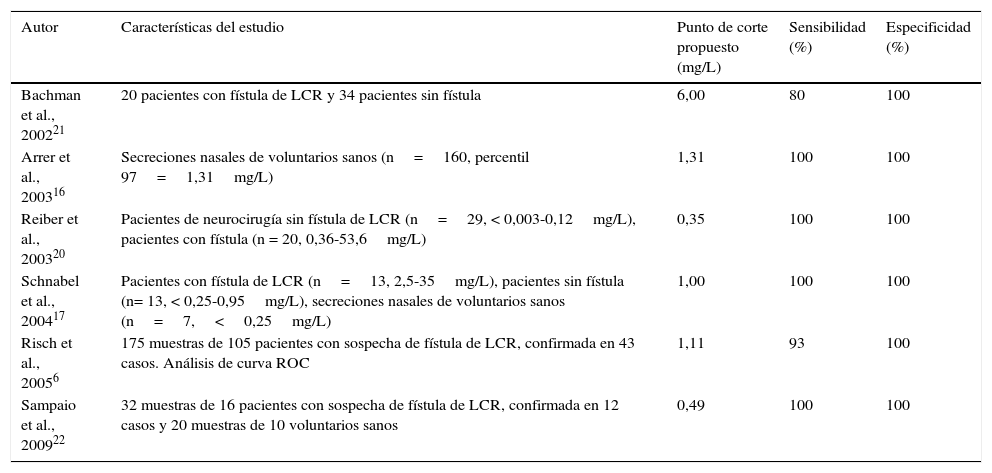
Para la utilización de la p-βT es necesario establecer un punto de corte, a partir del cual el resultado se considera positivo para la presencia de LCR en la muestra analizada. No existe un consenso respecto al punto de corte más adecuado. Los puntos de corte propuestos muestran una amplía dispersión, con un rango que varía entre 0,35 y 6,00mg/L6,16,17,20–23 (tabla 1). Existen además situaciones que dificultan la interpretación de los resultados como son la insuficiencia renal y la meningitis bacteriana, que producen un aumento y una disminución, respectivamente, de las concentraciones de la p-βT en el LCR23,24.
Relación de puntos de corte propuestos para la proteína β-traza, sensibilidad y especificidad diagnóstica
| Autor | Características del estudio | Punto de corte propuesto (mg/L) | Sensibilidad (%) | Especificidad (%) |
|---|---|---|---|---|
| Bachman et al., 200221 | 20 pacientes con fístula de LCR y 34 pacientes sin fístula | 6,00 | 80 | 100 |
| Arrer et al., 200316 | Secreciones nasales de voluntarios sanos (n=160, percentil 97=1,31mg/L) | 1,31 | 100 | 100 |
| Reiber et al., 200320 | Pacientes de neurocirugía sin fístula de LCR (n=29, < 0,003-0,12mg/L), pacientes con fístula (n = 20, 0,36-53,6mg/L) | 0,35 | 100 | 100 |
| Schnabel et al., 200417 | Pacientes con fístula de LCR (n=13, 2,5-35mg/L), pacientes sin fístula (n= 13, < 0,25-0,95mg/L), secreciones nasales de voluntarios sanos (n=7,<0,25mg/L) | 1,00 | 100 | 100 |
| Risch et al., 20056 | 175 muestras de 105 pacientes con sospecha de fístula de LCR, confirmada en 43 casos. Análisis de curva ROC | 1,11 | 93 | 100 |
| Sampaio et al., 200922 | 32 muestras de 16 pacientes con sospecha de fístula de LCR, confirmada en 12 casos y 20 muestras de 10 voluntarios sanos | 0,49 | 100 | 100 |
Los objetivos de este trabajo son evaluar la utilidad de la β2-Tr y de la p-βT en el diagnóstico de fístula de LCR, obtener un punto de corte diagnóstico en la p-βT y establecer un algoritmo de trabajo optimizado en el laboratorio.
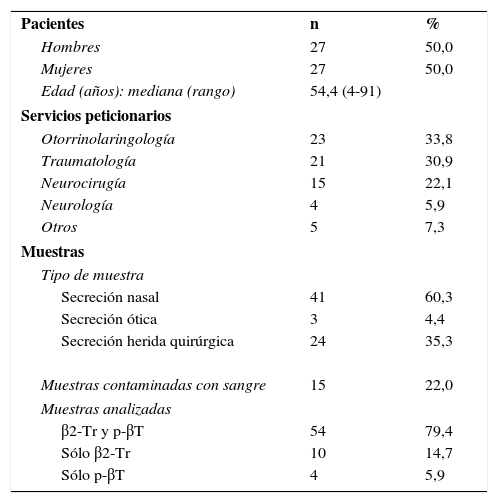
Material y métodosPacientes y muestrasSe realizó el estudio en las muestras remitidas al laboratorio de Análisis Clínicos desde enero del 2010 hasta marzo del 2016, en las que se solicitó la evaluación de la presencia de LCR. En total, se analizaron 68 muestras de secreciones nasales, óticas y de heridas quirúrgicas, procedentes de 54 pacientes con sospecha de fístula de LCR. Los pacientes procedían de los servicios de Otorrinolaringología, Traumatología, Neurocirugía y otros. Las características de los pacientes y de las muestras se describen en la tabla 2.
Características de los pacientes y muestras
| Pacientes | n | % |
| Hombres | 27 | 50,0 |
| Mujeres | 27 | 50,0 |
| Edad (años): mediana (rango) | 54,4 (4-91) | |
| Servicios peticionarios | ||
| Otorrinolaringología | 23 | 33,8 |
| Traumatología | 21 | 30,9 |
| Neurocirugía | 15 | 22,1 |
| Neurología | 4 | 5,9 |
| Otros | 5 | 7,3 |
| Muestras | ||
| Tipo de muestra | ||
| Secreción nasal | 41 | 60,3 |
| Secreción ótica | 3 | 4,4 |
| Secreción herida quirúrgica | 24 | 35,3 |
| Muestras contaminadas con sangre | 15 | 22,0 |
| Muestras analizadas | ||
| β2-Tr y p-βT | 54 | 79,4 |
| Sólo β2-Tr | 10 | 14,7 |
| Sólo p-βT | 4 | 5,9 |
β2-Tr: β2-transferrina; p-βT: proteína β-traza.
El diagnóstico de la fístula de LCR se estableció sobre la base de la exploración clínica, la existencia de antecedentes quirúrgicos y el empleo de una o varias de las siguientes técnicas diagnósticas, en función de las características de cada caso particular: endoscopia endonasal, administración intratecal de fluoresceína, técnicas de imagen (tomografía computarizada de alta resolución, resonancia magnética) y cisternografía isotópica con indio-111. En el diagnóstico de la fístula no se incluyeron los resultados de los marcadores bioquímicos en las muestras biológicas. Tras la revisión de las historias clínicas, los pacientes se clasificaron en 3 grupos en función de si el diagnóstico fue confirmado, descartado o no fue concluyente. Los grupos diagnósticos se refirieron como: diagnóstico de fistula de LCR positivo, diagnóstico de fistula de LCR negativo y diagnóstico no establecido.
En todos los pacientes se investigó la presencia de factores que pudieran influir en los resultados de los marcadores bioquímicos. Se investigó principalmente la función renal disminuida, con un filtrado glomerular (FG)<60mL/min/1,73 m2 y la presencia de meningitis bacteriana, para la p-βT, y el consumo crónico y elevado de alcohol y patología hepática severa, para la β2-Tr. Todos los pacientes incluidos tuvieron un FG>60mL/min/1,73 m2 y ninguna situación clínica que afectara a los resultados. También se descartaron otras situaciones clínicas poco frecuentes, como la hidrocefalia normotensiva, estenosis del canal espinal y defectos congénitos de glicosilación de transferrina.
Las muestras se recogieron en un tubo estéril y sin aditivos, directamente de las secreciones de nariz, oídos y heridas quirúrgicas. Se mantuvieron refrigeradas a 4°C hasta su entrega en el laboratorio. Una vez recibidas, se centrifugaron a 1.300g durante 10 min antes de su procesamiento. La medición de la p-βT se realizó en las 24 h siguientes a su recepción. Para la detección de la β2-Tr, las muestras se mantuvieron congeladas a –20°C hasta su procesamiento. A esa temperatura, la estabilidad descrita de las 2 proteínas es de 14 días19.
Método de inmunofijación para la detección cualitativa de la β2-transferrinaLa detección cualitativa de la β2-Tr se realizó por un método electroforético (Hidragel 3 CFS) en el sistema Hydrasys (Sebia; Evry, Francia). El método separa las formas sializada y desializada de la transferrina (β2-Tr) por su diferente movilidad electroforética. Inicialmente, se realiza una electroforesis en gel de agarosa y posteriormente ambas fracciones son detectadas por inmunofijación, mediante anticuerpos antitransferrina marcados con peroxidasa. El ensayo requiere 10μL de muestra y tarda en realizarse entre 120-150 min. Deben procesarse, en paralelo a las muestras problema, una muestra de LCR como control positivo y una muestra de suero diluido al 1:100, como control negativo. Se considera un resultado positivo cuando se observa la banda más catódica correspondiente a la β2-Tr (fig. 1).
Inmunofijación para la detección cualitativa de la β2-transferrina. En la figura se señalan las bandas correspondientes a la transferrina y a la β2-transferrina.
LCR: muestra de líquido cefalorraquídeo, utilizada como control positivo; Suero: muestra de suero, utilizada como control negativo; 1, 3, 4: muestras de 3 pacientes con resultado negativo; 2: muestra de un paciente con resultado positivo.
La interpretación del resultado se realizó por un facultativo de laboratorio con experiencia en el procedimiento.
Método inmunonefelométrico para la medida de la proteína β-trazaLa p-βT se midió por inmunonefelometría en el analizador BN ProSpec, con el reactivo N-Látex BTP® Beta Trace Protein (Siemens Diagnostics; Marburg, Alemania). El método utiliza como calibrador p-βT procedente de orina humana (N Protein Standard UY, Siemens Diagnostics), con trazabilidad a un preparado de referencia interno del proveedor. El límite de detección del método es de 0,22mg/L.
En las muestras con elevada viscosidad o con volumen escaso se realizó una dilución manual (1:2, 1:10 o 1:20) con suero salino fisiológico (NaCl 0,9%). Posteriormente, se ajustó en el nefelómetro la predilución automática definida, de tal forma que la muestra tuviera una dilución final de 1:100, que era la establecida por el método.
Análisis estadísticoEl análisis estadístico se realizó con el programa estadístico SPSS 15.0.
Para las 2 proteínas se calcularon la sensibilidad y la especificidad diagnóstica, y el valor predictivo positivo (VPP) y negativo (VPN). Para la p-βT, se obtuvo el punto de corte óptimo mediante un análisis de curva ROC. La comparación de las características diagnósticas de ambas proteínas se realizó mediante la prueba de la chi al cuadrado.
ResultadosEl diagnóstico de fístula de LCR se confirmó en 19 pacientes, en 21 pacientes fue negativo y en 14 pacientes no fue establecido.
Se analizaron un total de 68 muestras, de las cuales 26 pertenecían a pacientes con diagnóstico de fístula de LCR positivo, 27 a pacientes con diagnóstico negativo y 15 a pacientes con diagnóstico no establecido. En 15 muestras (22%) se observó diferente grado de contaminación con sangre, evaluada mediante inspección visual.
En un total de 54 muestras se realizó la detección cualitativa de la β2-Tr y la medición de la p-βT. En 10 muestras solo se realizó la detección cualitativa de la β2-Tr y en 4 muestras solo la medición de la p-βT.
La detección cualitativa de la β2-Tr se realizó a un total de 64 muestras. La inmunofijación se pudo interpretar en 63 de ellas, entre las cuales se incluían 14 muestras contaminadas con sangre. En una muestra muy hemática la interpretación presentó dificultad y el resultado fue informado como positivo dudoso. La sensibilidad y la especificidad obtenidas fueron del 83% (intervalo de confianza del 95% [IC95%], 73-94) y del 96% (IC95%, 90-100), respectivamente. El VPP fue del 95% (IC95%, 89-100%) y el VPN del 86% (IC95%, 76-95%). En las muestras del grupo de pacientes con diagnóstico no establecido los resultados de la detección de la β2-Tr fueron negativos.
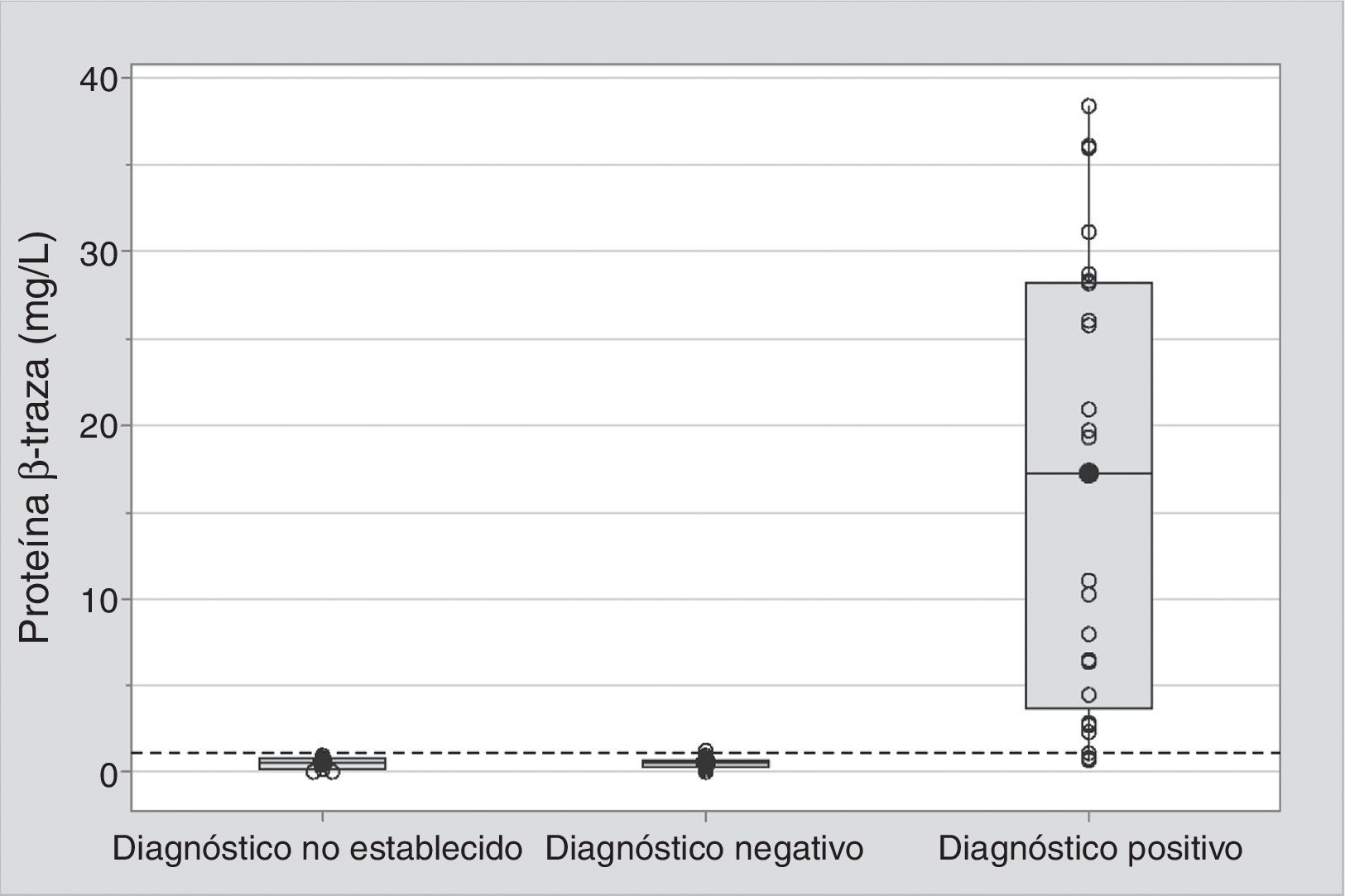
La medición de la p-βT se realizó a un total de 58 muestras. En 10 muestras no fue posible medir la p-βT debido a que la muestra tenía una elevada viscosidad o un volumen insuficiente. Las medianas obtenidas para los diferentes grupos fueron de 17,2mg/L (rango intercuartílico [RIQ] 4,5-28,1) en el grupo con diagnóstico positivo, de 0,50mg/L (RIQ 0,27-0,60) en el grupo con diagnóstico negativo y de 0,49mg/L (RIQ 0,11-0,70) en el grupo con diagnóstico no establecido (fig. 2).
Representación gráfica, mediante un diagrama de caja, de las concentraciones de la proteína β-traza en cada grupo de pacientes. La línea que parte la caja en 2 representa la mediana. Las líneas que delimitan el límite inferior y superior de cada caja se corresponden con los cuartiles 1 y 3, respectivamente, mientras que los bigotes indican para cada grupo los valores de proteína β-traza mínimo y máximo. La línea discontinua marca el punto de corte óptimo obtenido mediante el análisis de curva ROC. Se encontraron diferencias significativas entre el grupo con diagnóstico de fístula positivo y el grupo con diagnóstico negativo (p<0,001).
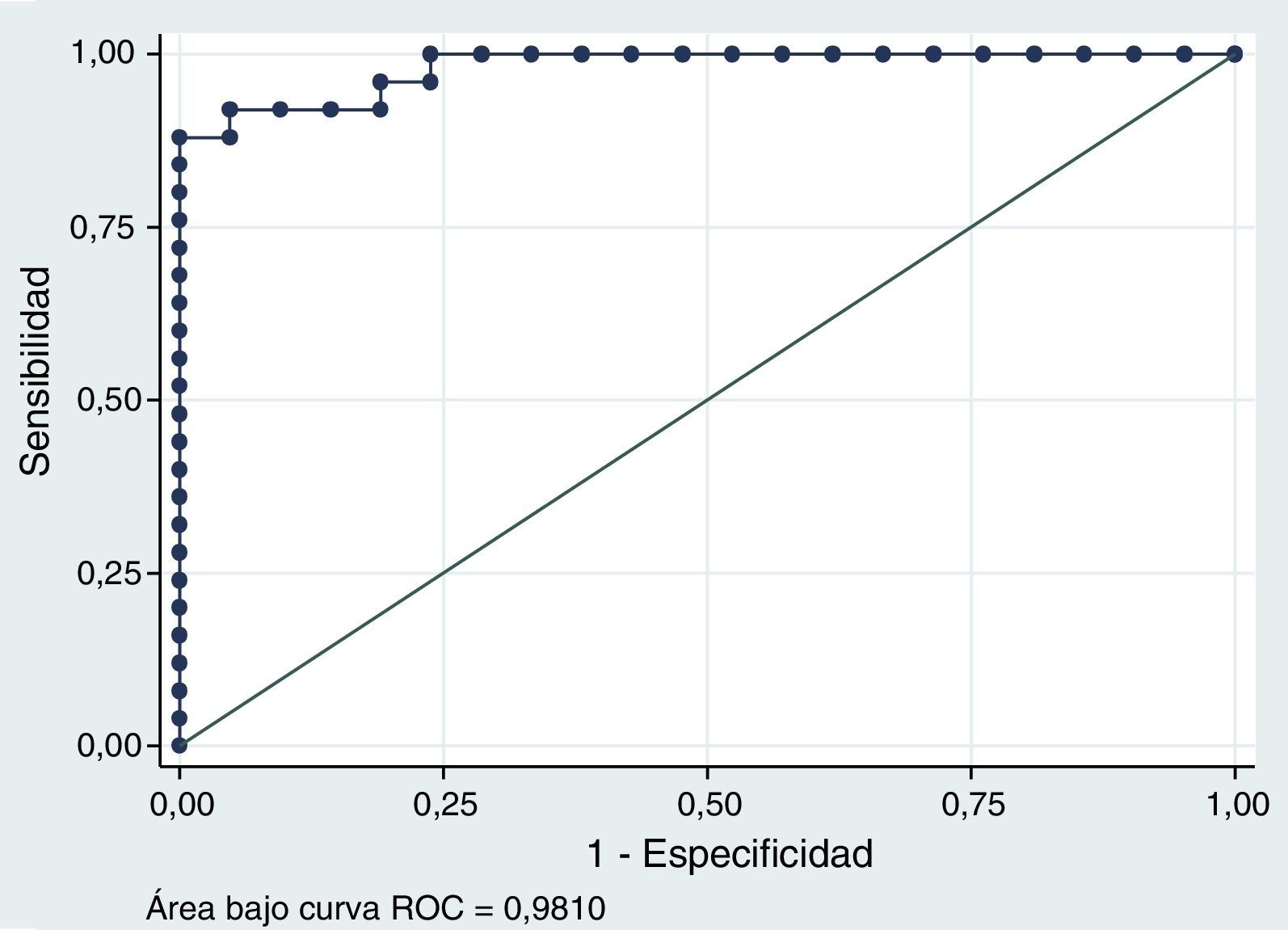
En el análisis de curvas ROC, el área bajo la curva obtenida fue de 0,981 (IC95%, 0,952-1,000) (fig. 3). El punto de corte óptimo fue de 1,14mg/L. Con ese punto de corte, se obtuvo una sensibilidad del 92% (IC95%, 84-100) y una especificidad del 95% (IC95%, 89-100). El VPP obtenido fue del 96% (IC95%, 90-100) y el VPN del 91% (IC95%, 83-99). El punto de corte para un VPN igual a 100% fue de 0,64mg/L, con una especificidad del 77%.
Al realizar el mismo análisis tras la exclusión de 14 muestras contaminadas con sangre, el punto de corte óptimo fue de nuevo de 1,14mg/L. El área bajo la curva fue de 0,989 (IC95%, 0,967-1,000), la sensibilidad del 90% (IC95%, 80-100), la especificidad del 100% (IC95%, 100-100), el valor VPP del 100% (IC95%, 100-100) y el VPN del 88% (IC95%, 74-99). El punto de corte con un VPN igual a 100% también fue de 0,64mg/L, con una especificidad del 86%.
La tabla 3 resume las características diagnósticas obtenidas en los 2 marcadores bioquímicos estudiados. La comparación de las características diagnósticas mostró que los resultados fueron mejores para la p-βT, con un punto de corte de 1,14mg/L, con una diferencia no significativa (p = 0,069).
Características diagnósticas de los marcadores bioquímicos estudiados, β2-transferrina y proteína β-traza
| β2-transferrina | Proteína β-trazaa | |
|---|---|---|
| Sensibilidad (IC95%) | 83% (73-94) | 92% (84-100) |
| Especificidad (IC95%) | 96% (90-100) | 95% (89-100) |
| VPP (IC95%) | 95% (89-100) | 96% (90-100) |
| VPN (IC95%) | 86% (76-95) | 91% (83-99) |
IC95%: intervalo de confianza 95%; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En numerosos pacientes con sospecha de fístula de LCR, la demostración de la presencia de LCR en las secreciones nasales, óticas y heridas quirúrgicas mediante marcadores bioquímicos es la primera herramienta diagnóstica antes de solicitar técnicas de imagen y procedimientos invasivos6. Los marcadores bioquímicos actualmente utilizados, β2-Tr y p-βT, son marcadores sensibles, capaces de indicar la presencia de LCR cuando este se halla en las secreciones en un rango de concentración del 1-2,5%16,19.
En este estudio, se han evaluado ambos marcadores en una población de pacientes con sospecha clínica de fístula de LCR. En la evaluación de la β2-Tr se han obtenido unos resultados de especificidad y sensibilidad comparables con los descritos por otros autores6,16,17. La principal desventaja del uso de este marcador bioquímico son las numerosas dificultades técnicas que poseen los métodos electroforéticos disponibles. Además de ser métodos laboriosos y con un tiempo de realización elevado, el punto de aplicación de la muestra está muy cercano a la zona de migración de la β2-Tr, y dificulta la interpretación del resultado. En el estudio se ha interpretado el resultado en la mayoría de las muestras analizadas, lo que contrasta con los resultados de Schnabel et al.17 que no pudieron interpretar la inmunofijación en un 37% de las muestras. Como ventaja sobre la medición de la p-βT se ha observado que se ha podido realizar el test en un número superior de muestras, ya que el método requiere un volumen muy pequeño de muestra y permite la aplicación de las muestras en el gel aunque tengan un elevado grado de viscosidad.
Se ha descrito que la contaminación sanguínea en las secreciones es frecuente y puede obstaculizar la interpretación de la inmunofijación, aunque una contaminación moderada no suele invalidar la prueba23. Los resultados del estudio indican que cierto grado de contaminación es admisible, ya que se interpretó el resultado en 14 de las 15 muestras hemáticas procesadas.
Respecto a la evaluación de la p-βT, el punto de corte diagnóstico óptimo hallado fue semejante a los valores publicados por Arrer et al.16, Schnabel et al.17 y Risch et al.6, aunque se obtuvo una menor sensibilidad y especificidad. Otros autores proponen puntos de corte inferiores que varían entre 0,35mg/L20 y 0,49mg/L22. La diferencia entre los diferentes puntos de corte propuestos puede ser debida a los distintos protocolos de estudio, ya que en algunos de ellos se han incluido controles sanos para su obtención16,22. El punto de corte obtenido para un VPN del 100%, que nos permite descartar con seguridad el diagnóstico de fístula de LCR, también coincidió con el obtenido por Risch et al., que fue de 0,68mg/L6.
La contaminación sanguínea no afectó al punto de corte óptimo obtenido, ya que este no se modificó tras excluir las muestras contaminadas. Se debe señalar el aumento que se produjo en el VPP, que permitió confirmar con mayor probabilidad la presencia de LCR en la muestra cuando esta no presentaba contaminación por sangre.
Los 2 puntos obtenidos en el estudio permiten confirmar (≥ 1,14mg/L) y descartar (≤ 0,64mg/L) la presencia del LCR con una elevada probabilidad. Como en otros estudios6,16,20,22,24, también se ha encontrado un rango de concentraciones en el que no es posible dar una respuesta concluyente. En estos casos se ha recomendado obtener el cociente entre la concentración de la p-βT en la secreción y en el suero para aumentar la especificidad6, repetir el análisis en otra muestra16 o realizar la detección cualitativa de la β2-Tr23,24.
Los resultados de este estudio apoyan la opción de realizar la detección cualitativa de la β2-Tr, ya que el marcador mostró unas buenas características diagnósticas, el resultado se interpretó en la mayoría de las muestras y los factores que pueden afectar a su resultado son menos frecuentes que los que influyen en la concentración de la p-βT.
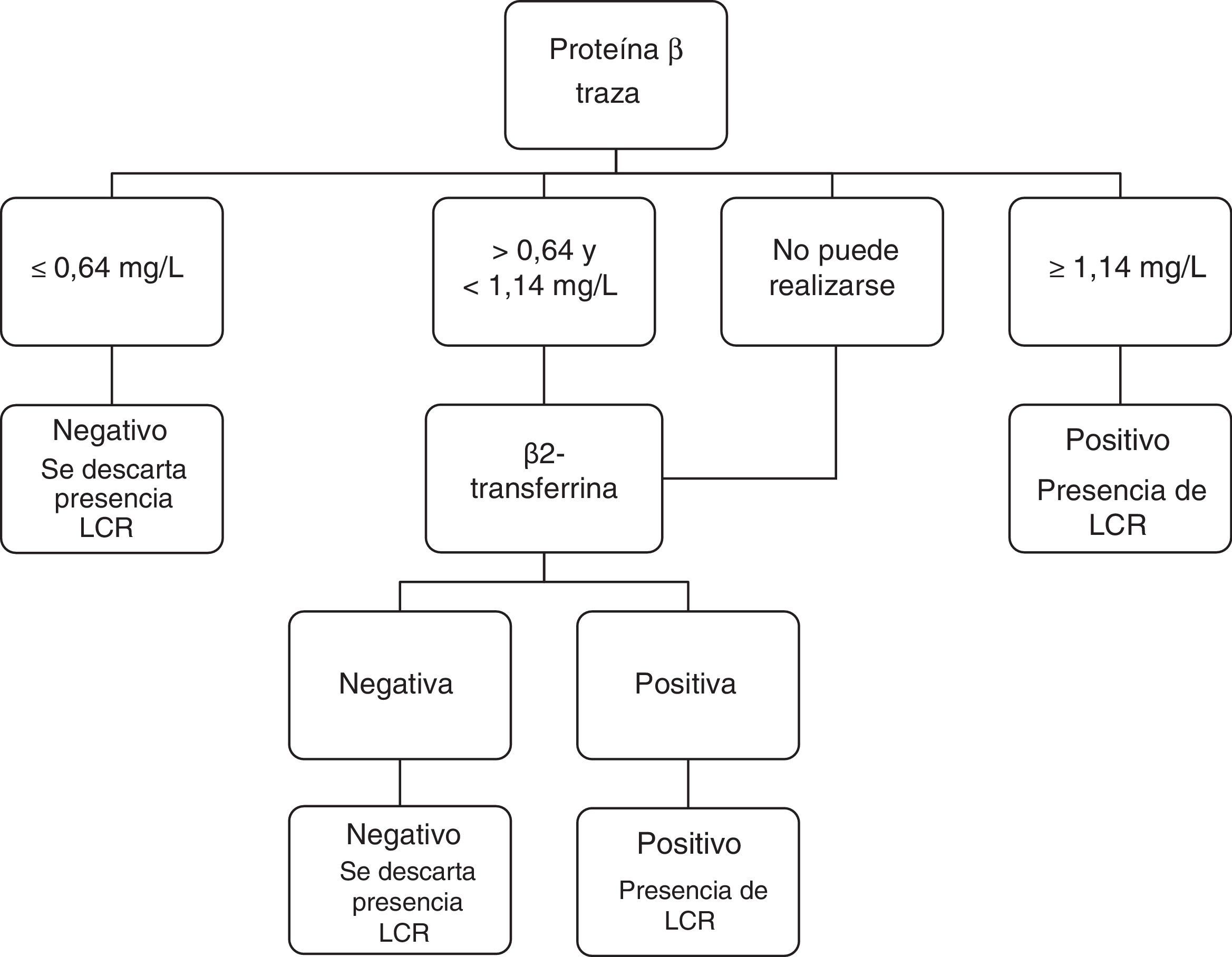
Ante los resultados obtenidos, se propone el siguiente protocolo de trabajo en el laboratorio (fig. 4):
Dada la urgencia e importancia diagnóstica de la prueba solicitada (la valoración de la presencia de LCR), la muestra se procesa el día de su recepción para la medida de la p-βT. En el caso de que el resultado sea ≥ 1,14mg/L, se informa como positivo para la presencia de LCR. Si el resultado es ≤ 0,64mg/L, se informa como negativo para la presencia de LCR. En las muestras con resultados>0,64 y<1,14mg/L se realiza la detección cualitativa de la β2-Tr y se informa en función del resultado obtenido.
Se realiza directamente la detección cualitativa de la β2-Tr cuando la muestra no pueda procesarse para la medición de la p-βT (alta viscosidad o escaso volumen) o cuando el paciente tenga insuficiencia renal o sospecha de meningitis bacteriana.
Se solicita una nueva muestra cuando la sospecha clínica sea muy alta y los resultados de los 2 marcadores bioquímicos sean negativos (falsos negativos por pérdida intermitente o escasa de LCR).
ConclusionesLas proteínas β2-Tr y p-βT pueden utilizarse como marcadores de fístula de LCR, ya que ambas presentan una elevada sensibilidad y especificidad diagnósticas. Es preferible utilizar, siempre que sea posible, como marcador bioquímico la p-βT dado que se mide por un método rápido, automatizado y con buenas prestaciones analíticas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesDeclaramos que no existe conflicto de intereses.
Los autores agradecen a Lourdes Lorenzo García y Olga Ares Vidal el apoyo técnico proporcionado durante la elaboración de este trabajo.