Este artículo describe la eficacia diagnóstica del cribado prenatal combinado del primer trimestre para la detección de anomalías cromosómicas en el Hospital San Juan de la Cruz (Úbeda, Jaén), en el periodo 2010-2013, sobre una población de 4.503 embarazadas. La sensibilidad global obtenida fue del 81%, la especificidad fue de un 96,6%, el VPP 10%, el VPN 99,9% y la tasa global de falsos positivos del 3,38%. En el grupo de gestantes de más de 35 años la tasa de detección es del 92% y la tasa de falsos positivos del 9,01%, mientras que en el grupo de gestantes menores de 35 años la tasa de detección y de falsos positivos obtenida es de un 62,5% y un 1,9% respectivamente. Ante estos resultados, la realización de un screening contingente podría aumentar la tasa de detección entre la mujeres menores de 35 años, y por otro lado disminuir la tasa de falsos positivos en las mujeres de mayor edad, así como el número de pruebas invasivas.
This article describes the diagnostic efficacy with the combined prenatal screening in the first trimester for the detection of chromosomal abnormalities, in the San Juan de la Cruz (Ubeda, Jaén) Hospital, in the period 2010-2013, in a population of 4503 pregnant. The sensitivity was 81%, the specificity was 96.6%, PPV 10%, NPV 99.9% and the false positive rate was 3.38%. The detection rate, in the group of pregnant women over 35 years, was 92% and false positive rate was 9.01%, while in the group of pregnant women under 35 years, the detection rate and false positives was 62.5% and 1.9% respectively. The realization of a contingent screening may increase the detection rate among women younger than 35 years and on the other hand decrease the false positive rate in older women as well as the number of invasive tests to realise.
Las anomalías congénitas son la principal causa de muerte perinatal y discapacidad infantil. Hasta hace pocos años el cribado prenatal de las cromosomopatías fetales más frecuentes dependía exclusivamente de la edad de la madre, de la historia familiar y de antecedentes clínicos. Pero el incremento de la edad en el momento del parto, el alto número de pruebas invasivas necesarias para llevar a cabo el diagnóstico y el riesgo asociado de perder el embarazo hizo desarrollar un método de cribado o screening que disminuyera los procedimientos invasivos en estas mujeres mayores y fuera también aplicable a mujeres más jóvenes, donde se concentran el 70% de los síndromes de Down1.
En los años 80 se desarrollaron los primeros marcadores bioquímicos, que mostraban una asociación entre valores bajos de alfafetoproteína (AFP) en el segundo trimestre y el síndrome de Down2. Posteriormente, en la década de los 90, se produjo un hito en el cribado prenatal al incorporarse a los marcadores bioquímicos la medida de la translucencia nucal (TN), y realizándose entre las semanas 14 y 18 de gestación3. De esta manera, se abandonó la estrategia de indicar pruebas invasivas dependiendo tan solo de la edad materna4,5.
Actualmente el cribado del primer trimestre, realizado entre las semanas 10 y 14, es el que se practica con carácter mayoritario, marcando un antes y un después en el diagnóstico prenatal de aneuploidías, fundamentalmente de la trisomía 216, y el que aplicamos en nuestro centro desde 2008. Se realiza incorporando a las determinaciones bioquímicas, fracción beta libre de la gonadotrofina coriónica humana (fBhCG) y proteína plasmática A asociada al embarazo (PAPPA), el parámetro ecográfico de la TN para el cálculo del riesgo, permitiendo el diagnóstico prenatal de un número creciente de aneuploidías, con una sensibilidad entre el 85-93% y con un 5% de falsos positivos7.
La Sociedad Española de Ginecología y Obstetricia recomienda la realización de una ecografía en el primer trimestre (entre la 10-14 semana de gestación) para fijar la edad gestacional, descartar alteraciones estructurales, y determinar si es gestación única o múltiple. La medida de la TN en estas semanas de gestación supone un importante peso en el cálculo del riesgo prenatal que incluso supera los parámetros bioquímicos, correlacionándose su incremento con la presencia de aneuplodías (fetos afectados de trisomía 21, 13 o 18)8,9. Debido a que esta medida se modifica con el tiempo de gestación, se encuentran mejores resultados expresándolos en múltiplos de la mediana (MoM) para el día en que se realiza la medición. Solo este parámetro brinda una aceptable tasa de detección, pero con un porcentaje alto de falsos positivos.
Respecto a los marcadores bioquímicos, niveles elevados de fBhCG se asocian a mayor riesgo de síndrome de Down (trisomía 21) y niveles disminuidos se asocian a síndrome de Edward (trisomía 18) y Síndrome de Patau (trisomía 13). Mientras concentraciones séricas bajas de PAPPA se asocian a mayor riesgo de síndrome de Down y otras cromosomopatías, como la trisomía 18 y la trisomía 13. Al igual que en la TN, las pruebas bioquímicas presentan variaciones interpoblacionales y con la edad gestacional. Por ello sus resultados también se interpretan en términos de MoM.
El MoM se obtiene dividiendo la concentración sérica del marcador entre una mediana propia del laboratorio, en función de la edad gestacional de la embarazada. Los MoM se corrigen para las características propias de cada gestante (raza, consumo de tabaco, peso, diabetes insulinodependiente). El cut-off seleccionado es 1/250 para trisomía 21 y 1/100 para la trisomía 18. En el caso de obtener en el primer trimeste un riesgo combinado aumentado la confirmación diagnóstica se realiza por cariotipo de una muestra de vellosidad corial o de líquido amniótico, según el periodo de gestación, asumiendo una tasa de pérdida fetal de alrededor del 1%10.
El cribado del segundo trimestre, actualmente minoritario, realizado entre las semanas 14 y 19 con las determinaciones bioquímicas AFP, βhCG, permite a las gestantes que no han podido realizar el cribado del primer trimestre una alternativa diagnóstica, pero con una menor sensibilidad, entre el 65% y el 70%11.
En los últimos años se han descrito varias propuestas de cribado para mejorar los resultados del cribado combinado del primer trimestre, como el screening integrado12,13, presentando sensibilidades entre el 94-96% en la detección del síndrome de Down y con una menor tasa de falsos positivos. Este cribado integrado consiste en la realización de una primera selección de pacientes mediante test combinado del primer trimestre, y realización de un segundo test de cribado consistente en la evaluación de algunos hallazgos ecográficos (presencia/ausencia de hueso nasal, flujo sanguíneo fetal en el ductus venoso, regurgitación triscupídea, etc.) propuesto por Nicolaides14, o en el análisis de marcadores bioquímicos en el segundo trimestre, AFP, fBhCG, uE3 (estriol no conjugado) e inhibina A (test cuádruple). La segunda fase del cribado puede realizarse bien a todas las gestantes (formato cerrado), bien solo a aquellas que en la primera fase obtengan un índice de riesgo inferior a 1 en 50 (formato «paso a paso»), bien solo a aquellas que en la primera fase obtengan un índice de riesgo intermedio, entre 1 en 50 y en 1 en 2.000 (formato contingente). La propuesta contingente es la más extendida en la actualidad, ya que permite obtener un resultado final en el 78% de las gestantes tras la primera fase del cribado, necesitando la realización de una segunda fase tan solo en un 22% de las gestantes15.
El objetivo de nuestro estudio es determinar la sensibilidad, especificidad y valores predictivos para el diagnóstico prenatal de cromosomopatías mediante el cribado combinado del primer trimestre en una muestra de 4.503 gestantes que acudieron desde enero de 2010 a diciembre de 2013, y presentar un proyecto de optimización del cribado combinado del primer trimestre.
Material y métodoSe realiza un estudio observacional, longitudinal y retrospectivo de una población de 4.503 gestantes atendidas en el Hospital San Juan de la Cruz, Úbeda, Jaén, desde enero de 2010 a diciembre de 2013. La metodología empleada fue la denominada en 2 pasos o en 2 tiempos, es decir, se realiza en primer lugar una extracción de sangre, entre las semanas 8-13,6 de gestación, analizándose los parámetros bioquímicos, PAPPA y fBhCG, mediante una técnica de quimioluminiscencia (Inmulite 2000 de Siemens). En un segundo paso, entre las semanas 10 y 14, se realiza una ecografía, utilizando ecógrafos de alta resolución Voulosom 730 Expert (General Electric) y siguiendo los criterios de la Fetal Medicine Foundation, donde se mide la TN y la longitud cráneo caudal (CRL), aceptándose tan solo los fetos con CRL entre 45 y 85mm.
El facultativo del laboratorio comprueba los resultados, calcula y valida el riesgo prenatal combinado mediante el programa informático PRISCA 4.0.15.9 (Typolog Software, Siemens), emitiendo un informe con riesgo expresado como odds ratio, que envía al obstetra, quien informa a la gestante del resultado. A estas pacientes se les explica el significado del resultado del cribado y los riesgos del procedimiento invasivo, y se les proporciona el documento de consentimiento informado. La obtención del cariotipo fetal se realiza mediante amniocentesis o biopsia corial.
Si la paciente acude a la primera visita posterior a semana 14, o por cualquier motivo no se realiza el cribado del primer trimestre, se ofrece el cribado del segundo trimestre, mediante doble test bioquímico (AFP y BhCG). Para comprobar en nuestro estudio si las gestantes con riesgos elevados se habían sometido a una técnica invasiva, conocer el diagnóstico molecular o si habían sufrido aborto, se revisaron las historias clínicas de estas pacientes, previo consentimiento informado. Las amniocentesis son realizadas en nuestro hospital y el cariotipo en líquido amniótico se determina en el laboratorio Reference Laboratory®. Para las biopsias coriales las pacientes se derivan al Hospital Virgen de las Nieves de Granada.
Las variables recogidas fueron: número de cribados realizados, número de cribados positivos informados y de ellos los confirmados mediante cariotipo. Se calculó el porcentaje de positivos informados, así como el valor predictivo positivo (VPP). Para el análisis estadístico de los datos se utilizó el paquete estadístico libre Statistics Package for Social Sciences (SPSS) versión 17.0 para Windows. Se consideraron estadísticamente significativas las diferencias que mostraron valores de p<0,01.
Los falsos negativos se controlan mediante el reconocimiento y posterior seguimiento de los recién nacidos por parte de la UGC de pediatría del área hospitalaria San Juan de la Cruz (distrito Jaén nordeste), y la realización de cariotipos a aquellos niños sospechosos de sufrir alguna alteración cromosómica.
Se han excluido para los cálculos estadísticos del estudio las embarazadas de gestación múltiple y un recién nacido con síndrome de Down cuya madre no se sometió a ningún cribado.
ResultadosDel total de gestantes un 98,2% eran de raza caucásica, 1,5% de raza africana y 0,3% de raza asiática.
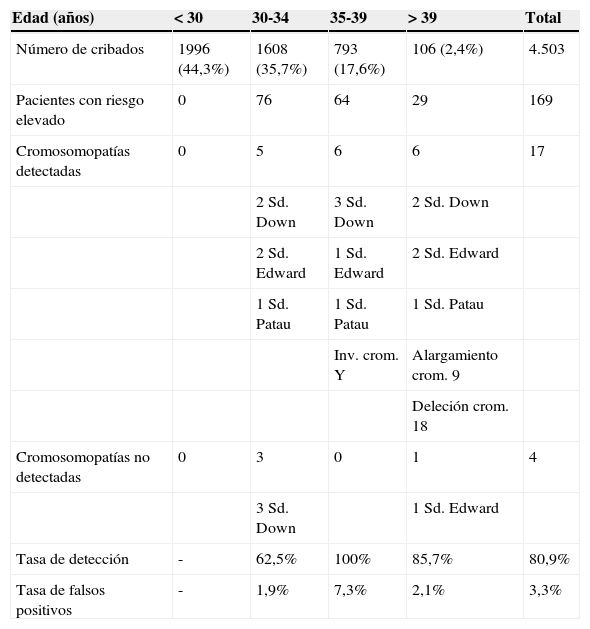
El grupo de estudio lo constituyen gestantes con una edad que oscila entre 13-49 años, siendo la mediana (p25-p75) de 30 años (27-34). El 80% presentaba una edad inferior a 35 años, el 17,6% una edad entre 35 y 38 años y un 2,4% edad igual o superior a 39 años (tabla 1).
Tasa de detección, falsos positivos y tipo de cromosomopatías según los grupos de edad (realizado con SPSS vs 17,0, p<0,01)
| Edad (años) | <30 | 30-34 | 35-39 | >39 | Total |
|---|---|---|---|---|---|
| Número de cribados | 1996 (44,3%) | 1608 (35,7%) | 793 (17,6%) | 106 (2,4%) | 4.503 |
| Pacientes con riesgo elevado | 0 | 76 | 64 | 29 | 169 |
| Cromosomopatías detectadas | 0 | 5 | 6 | 6 | 17 |
| 2 Sd. Down | 3 Sd. Down | 2 Sd. Down | |||
| 2 Sd. Edward | 1 Sd. Edward | 2 Sd. Edward | |||
| 1 Sd. Patau | 1 Sd. Patau | 1 Sd. Patau | |||
| Inv. crom. Y | Alargamiento crom. 9 | ||||
| Deleción crom. 18 | |||||
| Cromosomopatías no detectadas | 0 | 3 | 0 | 1 | 4 |
| 3 Sd. Down | 1 Sd. Edward | ||||
| Tasa de detección | - | 62,5% | 100% | 85,7% | 80,9% |
| Tasa de falsos positivos | - | 1,9% | 7,3% | 2,1% | 3,3% |
En la figura 1 se analizan las semanas de gestación calculada en función de la CRL, en las que se determina la concentración de los parámetros bioquímicos (BhCG libre y PAPPA) y la medición de la TN. Se comprueba que más de la mitad de las gestantes, un 62,6%, realiza la extracción entre las semanas 9 y 10 de gestación, un 20,8% a la semana 8, un 10,1% a la semana 11 y un 6,4% entre las semanas 12 y 13 de gestación. Por otro lado, a la mayoría de las pacientes se les realiza la ecografía a la semana 12 (46,3%), seguido de un 34,4% en la semana 11. El número de cribados en la semana 10 y 13 fueron notablemente inferiores, y en la semana 14 tan solo se realizaron 24 ecografías.
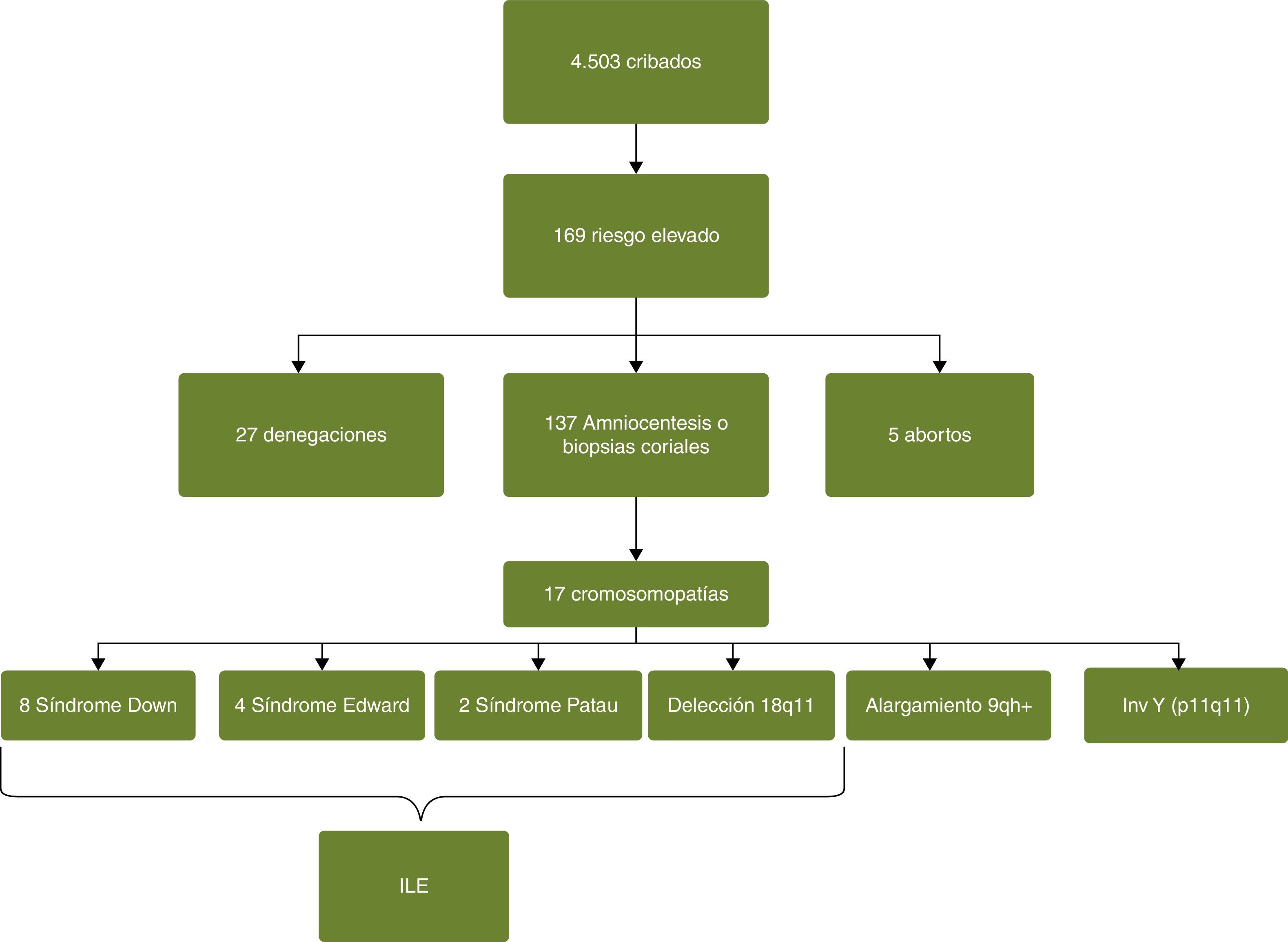
De los 4.503 cribados combinados realizados, 169 dieron un riesgo positivo o elevado (3,7%), bien para trisomía 21, 18 o para ambos. De estas 169 pacientes con riesgo elevado se sometieron a una técnica invasiva 137 (un 81%), 27 pacientes (un 15,9%) tras ser informadas y con su correspondiente documento de denegación, rehusaron hacerse más estudios y hubo 5 abortos de causas desconocidas (2,9%). Con la realización del cariotipo en líquido amniótico o biopsia corial se detectaron un total de 17 casos de cromosomopatías: 8 síndromes de Down, 4 síndromes de Edward, 2 síndromes de Patau, una deleción (18p11), un alargamiento cromosómico (9qh) y una inversión (inv Y, p11q11).
En el presente estudio se constata que el 76,5% de las pacientes diagnosticadas de cromosomopatías (15 de 17) optaron por la interrupción voluntaria de su embarazo (ILE) (fig. 2).
De las 27 pacientes con un cribado de riesgo elevado 27 renunciaron a la prueba invasiva, y se confirmó que no hubo ningún nacimiento ni con síndrome de Down ni de Edwards.
En este periodo se detectaron 3 falsos negativos de síndrome de Down y uno de síndrome de Edwards.
En la tabla 1 se muestra que la tasa de detección global de cromosomopatías fue de 80,9% (17 de 21), con una tasa de falsos positivos (TFP) del 3,3% y 4 casos de falsos negativos (23,5%). La especificidad fue de un 96,6%, el VPP 10% (el número de positivos que se confirman por cariotipo respecto al número de positivos que se informaron) y el VPN 99,9% (número de negativos confirmados respecto al número de cribados negativos informados). Se percibe según la edad materna diferencias significativas en la tasa de detección y en la tasa de falsos positivos (Chi-cuadrado p<0,0000), obteniéndose la sensibilidad más elevada (100%) en gestantes entre 35 y 39 años(n=793), seguida del grupo de mayores de 39 años (n=106), donde se consigue un 85.,7% de sensibilidad y de un 62,5% en las menores de 35 años. En el grupo de mujeres menores de 30 años no hubo ningún verdadero positivo ni ningún falso negativo, no pudiéndose calcular la tasa de detección, de manera que la tasa de detección del 62,5%, en realidad, es la encontrada en mujeres entre 30-34 años.
Del mismo modo, en el grupo de 35-39 años es donde hubo una mayor tasa de falsos positivos (7,3%), seguido de un 2,1% en mayores de 39 años y de un 1,9% en menores de 35 años.
En esta tabla también se indican el tipo de cromosomopatías encontradas por grupo de edad de las gestantes. El 61,9% (13/21) de las alteraciones cromosómicas se presentaron en gestantes mayores de 35 años, y si tenemos en cuenta solo los casos de síndrome de Down comprobamos que el 54,4% (6/11) de los casos de síndrome de Down se dieron en gestantes mayores de 35 años.
En la tabla 2 se detallan los 21 casos de aneuploidías encontradas, describiendo diversos datos clínicos como edad o peso, semanas de gestación (SG) según CRL en la que las gestantes se realizan la determinación de los parámetros bioquímicos y marcadores ecográficos, y riesgo combinado para trisomía 18 y 21. De los 11 casos de síndrome de Down 8 fueron detectados a través de nuestro cribado y 3 no. Los 3 falsos negativos se presentaron en gestantes con edades entre 33 y 34 años en el momento de realizarse el cribado y mostraron un riesgo combinado de 1/943, 1/1499 y 1/2136. De los 8 casos de síndrome de Down detectados a través del cribado, 6 eran gestantes mayores de 35 años.
Descripción de los casos con cromosomopatías encontrados
| Caso | Cariotipo | Edad | Peso | SG seguún extrac | SG según eco | CRL | TN (mm) | TN (MoM) | Riesgo combinado trisomía 21 | Riesgo combinado trisomía 18 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Trisomía 21 | 37,3 | 78 | 9 | 13,2 | 73 | 1,3 | 0,72 | 204 | <10000 |
| 2 | Trisomía 21 | 36,7 | 66 | 9 | 12,1 | 57 | 0,75 | 0,75 | >50 | <10000 |
| 3 | Trisomía 21 | 42 | 59 | 9,5 | 12,6 | 67,78 | 2,49 | 1,45 | >50 | 686 |
| 4 | Trisomía 21 | 36,2 | 75 | 8,1 | 11 | 43,34 | 0,91 | 0,72 | >50 | <10000 |
| 5 | Trisomía 21 | 41,6 | 60,5 | 9 | 11,6 | 55 | 2,73 | 1,88 | >50 | 1467 |
| 6 | Trisomía 21 | 34,5 | 66 | 9,1 | 12,1 | 56,8 | 2,5 | 1,67 | >50 | >50 |
| 7 | Trisomía 21 | 34,7 | 64,5 | 12,2 | 12 | 56 | 0,57 | 0,39 | 223 | <10000 |
| 8 | Trisomía 21 | 37,7 | 78,5 | 9,3 | 12,4 | 62,78 | 4,33 | 2,68 | >50 | >50 |
| 9 | Trisomía 18 | 34,9 | 58,5 | 12 | 12 | 55,84 | 4,46 | 3,03 | >50 | >50 |
| 10 | Trisomía 18 | 41,6 | 69,5 | 8,1 | 11,5 | 52 | 0,95 | 0,68 | 764 | 84 |
| 11 | Trisomía 18 | 43,1 | 79 | 9,5 | 11,5 | 52,34 | 1,27 | 0,91 | 141 | >50 |
| 12 | Trisomía 18 | 32,7 | 59,5 | 13,1 | 11 | 44 | 0,51 | 0,42 | 1836 | >50 |
| 13 | Trisomía13 | 30,2 | 68,5 | 8 | 11,4 | 51,18 | 6 | 4,37 | >50 | >50 |
| 14 | Trisomía 13 | 41,6 | 58,5 | 11,1 | 13,2 | 75,25 | 4,28 | 2,31 | >50 | >50 |
| 15 | 46XX (ALARG.9) | 44 | 62 | 13,1 | 12,6 | 66,53 | 1,44 | 0,85 | 209 | <10000 |
| 16 | 46XX(DELEC.18) | 39,9 | 67,5 | 9,4 | 13,2 | 73 | 0,92 | 0,51 | 598 | >50 |
| 17 | 46XY (INV.Y) | 35,3 | 65 | 9,6 | 11,4 | 50,54 | 3,04 | 2,23 | >50 | >50 |
| 18 | Trisomía 21 | 33,2 | 69 | 8,6 | 14 | 84 | 2,02 | 1,02 | 943 | <10000 |
| 19 | Trisomía 21 | 34,3 | 60 | 10,3 | 12,3 | 61 | 0,82 | 0,52 | 1499 | <10000 |
| 20 | Trisomía 21 | 34,4 | 62,5 | 9,5 | 12,4 | 63,4 | 1,32 | 0,81 | 2136 | <10000 |
| 21 | Trisomía 18 | 39,1 | 60,5 | 11,1 | 12,1 | 57 | 0,9 | 0,36 | 1267 | <10000 |
Respecto a los 5 casos de síndrome de Edward, 3 se dieron en pacientes mayores de 35 años y el falso negativo presentó un riesgo combinado inferior a 1/10.000 para trisomía 18 y 1/1.267 para trisomía 21.
En este período se han registrado 5.186 nacidos vivos, de estos hubo 4 nacidos con síndrome de Down (3 no detectados por el test de primer trimestre y un caso de una gestante que no se realizó ningún tipo de cribado); por lo tanto, la incidencia de síndrome de Down en nuestra área es de 1/1.296 nacidos vivos, pero si tenemos en cuenta además los 8 casos de síndrome de Down en los que se practicó una ILE, la incidencia es de 1/432.
DiscusiónEn los últimos años se está asistiendo a un retraso progresivo en la edad de maternidad que conduciría a un aumento notable en el número de técnicas invasivas en caso de mantener los antiguos criterios de edad, con el consiguiente aumento de pérdidas fetales inherentes a las pruebas diagnósticas.
El cribado combinado para la detección de anomalías cromosómicas en el primer trimestre de la gestación es la estrategia recomendada por diversas sociedades científicas16–19. Ofrece una mayor precocidad y fiabilidad en la selección de pacientes de riesgo, permite la aplicación de técnicas invasivas más tempranas que la amniocentesis, como la biopsia corial, lo cual disminuye el tiempo de espera para el diagnóstico y reduce la morbilidad materna en caso de ILE. Además, también se ha demostrado la utilidad del test combinado para detectar otras alteraciones cromosómicas estructurales además del síndrome de Down y del síndrome de Edwards, y que curiosamente es un hecho no muy constatado en la literatura. Así, nos ha servido en nuestro caso para la detección de 2 síndromes de Patau y de una deleción del cromosoma 18, con repercusión en el fenotipo del feto.
Los resultados obtenidos en nuestro estudio son similares a la mayoría de los publicados en la bibliografía. En nuestro estudio hemos concluido que los falsos positivos fueron de 3,38%, mejorando los valores recomendados por la Sociedad Española de Ginecología y Obstetricia del 5%.
Un aspecto muy importante a tener en cuenta del test combinado del primer trimestre es la reducción del número de técnicas invasivas que su realización conlleva (169 frente a 899 si su indicación hubiera sido solo por edad superior a 35 años). También la reducción del tiempo de espera en obtener información diagnóstica, que conlleva una menor repercusión psicológica y morbilidad materna en caso de la realización de una ILE.
En nuestra población solo el 20% de las gestantes tienen más de 35 años, y en ellas se detectan el 54,5% de los fetos con síndrome de Down, dejando constancia del hecho del mayor riesgo de alteraciones genéticas en gestantes de mayor edad. Si la incidencia global de síndrome de Down se aproxima a uno de cada 700 nacimientos, la frecuencia encontrada en nuestro estudio, teniendo en cuenta los nacidos con síndrome de Down y las ILE realizadas por esta cromosomopatía, es de 1 de 432 o de 2,3 casos por cada 1.000 recién nacidos vivos. Estratificando por edad materna, en pacientes con 35 o más años la incidencia es de uno por cada 150 cribados informados y en menores de 35 años de uno por cada 720 cribados realizados.
Es importante percibir que a medida que aumenta la edad materna, aumenta la tasa de detección y la tasa de falsos positivos. En este sentido, diversos estudios muestran que el cribado contingente es una alternativa eficaz, segura y con la mejor relación coste-efectividad15,20. En nuestra serie, posiblemente disminuiría la tasa de falsos positivos si se ofreciera un segundo test de cribado a las gestantes del grupo de mayor edad, reduciéndose el número de pruebas invasivas y por tanto la morbilidad.
Por otro lado, diferentes estudios sugieren que este test integrado tiene una mayor tasa de detección, con una sensibilidad del 94-96%, especificidad y valor predictivo negativo elevados. En este aspecto, este test secuencial podría ser una herramienta eficaz para mejorar la baja tasa de detección (62,5%) encontrada en gestantes menores de 35 años, que aunque es similar a la que se constata en otras referencias bibliográficas6, habría que incidir y proponer medidas de mejora. Según la literatura, este test contingente sería necesario hacerlo solamente a las gestantes con un riesgo combinado inferior a 2.000, lo que supone un 22% del total de los cribados realizados20. En nuestro caso se plantea incluir una estrategia que no suponga muchos recursos humanos y económicos, enfocada principalmente a mejorar la baja sensibilidad, por lo que se decide acotar la realización de este test solo al grupo de pacientes entre 30-34 años, con un riesgo combinado inferior a 2.200, de forma que solo se realizaría este test a un 8,8% de las pacientes (396). Aunque en la literatura el punto de corte del riesgo combinado para introducir a las gestantes en un test contingente es entre 1/100 y 1/2.000, en nuestro caso se ampliará el cut-off a 2.200, ya que se registró un falso negativo de síndrome de Down con un riesgo combinado de 1/2.136.
Este test tiene varias desventajas, por una parte un mayor coste (evaluación de nuevos hallazgos ecográficos como presencia-ausencia de hueso nasal y test cuádruple de parámetros bioquímicos: AFP, fBhCG, uE3 e inhibina A), las dificultades organizativas en cuanto a la obligada visita de la paciente en 2 momentos diferentes, para que sea posible su realización y también otras de carácter ético, dado que en ocasiones debería aplazarse la información sobre hallazgos significativos, ecográficos o de laboratorio, en el primer trimestre a la espera de completar el cribado en el segundo.
Se plantea implantar esta propuesta contingente durante un año y evaluar y comparar los resultados pasado este periodo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.