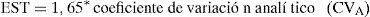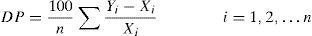Evaluar la estabilidad de las concentraciones de cortisol y 25-hidroxivitamina D (25OH-vit D) en suero y de corticotropina (ACTH) en plasma en función del tiempo de almacenamiento en las condiciones habituales de trabajo para estas muestras y comparar dos protocolos diferentes de centrifugación.
Material y métodoSe obtuvieron muestras de 25 voluntarios sanos (5 hombres y 20 mujeres) para el estudio de cortisol y 25OH-vit D. Para el estudio de ACTH se utilizaron muestras de 15 de estos voluntarios sanos. Las muestras se procesaron en el analizador Liaison® DiaSorin en tiempos comprendidos entre 90 minutos y 7 días desde la toma de la muestra hasta la obtención del resultado.
ResultadosEl cortisol y 25OH-vit D se mantuvieron estables a lo largo de todo el estudio en las condiciones especificadas. La ACTH se mantuvo estable hasta 8 horas a 4°C. En ninguna de las tres magnitudes se observaron diferencias significativas entre los resultados obtenidos en muestras centrifugadas tras su obtención o inmediatamente antes de su procesamiento hasta 6 horas después de la obtención de la muestra.
ConclusionesLas condiciones habituales de manejo de las muestras, 8 horas a temperatura ambiente con o sin centrifugación previa y posteriormente almacenadas a 4°C durante una semana, no comprometen la estabilidad en el caso de cortisol y 25OH-vit D. En el caso de ACTH es preciso congelar las muestras tras su obtención si no van a ser procesadas en un tiempo inferior a 8 horas.
To asses the stability of cortisol, and 25 (OH)-Vitamin D concentrations in serum, and adrenocorticotrophic hormone (ACTH) in plasma samples, according to the storage time under normal working conditions for these samples, and to compare two different centrifugation protocols.
Material and methodThe samples were obtained from 25 healthy volunteers (5 men and 20 women) for the study of cortisol and 25 OH-vit D. For the ACTH only 15 of the 25 samples were used. The samples were processed in the Liaison® DiaSorin analyser at times between 90minutes and 7 days from the time the sample was taken until the result was obtained.
ResultsCortisol and 25 OH-Vit D remained stable during the time of the study under the specified conditions. ACTH remained stable only until the 8th hour at 4° C. There were no significant differences in relation to the time of centrifugation.
ConclusionsThe regular management conditions of the samples, 8hours at room temperature with or without previous centrifugation and later storage at 4° C for a week does not jeopardize the stability of cortisol and 25 OH-vit D. In the case of ACTH the samples have to be frozen after they are obtained if they are not going to be processed in less than 8hours.
Los resultados analíticos de las determinaciones hormonales pueden modificarse en función de distintas variables a lo largo de todo el proceso analítico. La mayoría de los errores en el laboratorio clínico se producen en la fase preanalítica del proceso. La variabilidad dependiente de la fase preanalítica ha cobrado especial importancia en los últimos tiempos debido al cambio al que se han visto sujetos la mayoría de los laboratorios en la organización de su trabajo.
En la actualidad existe una clara tendencia a centralizar la fase analítica en laboratorios que reciben muestras de diferentes centros periféricos más o menos alejados del laboratorio. Esto ha sido posible gracias a la introducción de potentes sistemas automatizados para el tratamiento de las muestras, tanto en la fase preanalítica como en la fase analítica, lo cual permite procesar un elevado número de muestras con un extenso panel de pruebas en un período de tiempo relativamente corto. Esta elevada capacidad permite, así mismo, procesar las muestras y obtener los resultados el mismo día de su obtención en un elevado porcentaje de casos. En este flujo de trabajo de las plataformas automáticas se han introducido gran parte de las pruebas hormonales más frecuentes. Por tanto, es importante conocer la estabilidad de las magnitudes hormonales en las condiciones en las que se procesan las muestras en laboratorios con este nivel de automatización.
Se define la estabilidad de una magnitud como el «período de tiempo en que la magnitud mantiene su valor dentro de unos límites establecidos, conservando la muestra en la que se realiza la medición en unas condiciones específicas»1. Los límites de estabilidad de una magnitud dependen del criterio matemático empleado para calcularlos. La Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC) elaboró un criterio para definir el límite de variación que implique pérdida de estabilidad basándose en una combinación del criterio estadístico, metrológico y biológico2. Además la SEQC definió un protocolo para estudiar la influencia de diferentes variables en la estabilidad de las magnitudes biológicas humanas3. La Comisión de Calidad Extraanalítica de la SEQC propone posteriormente un cambio en la fórmula a aplicar en el cálculo de la estabilidad de una magnitud biológica, cambio que aporta mayor sensibilidad a dicho cálculo4. Siguiendo estos modelos y como continuación de dos estudios previos5,6, se ha realizado un estudio para evaluar el efecto del tiempo transcurrido desde la extracción hasta la obtención del resultado con o sin centrifugación previa de la muestra en la estabilidad de tres magnitudes hormonales.
El objetivo del estudio fue evaluar la estabilidad en suero de cortisol y 25OH-vit. D y de ACTH en plasma siguiendo los protocolos de la SEQC que más se ajustaban a las condiciones de trabajo del laboratorio.
Variables a estudiarSe evaluó el efecto de la variable tiempo en la estabilidad de las tres magnitudes, según el momento de la centrifugación y la temperatura de almacenamiento de las muestras.
Tiempo: intervalo de tiempo desde la extracción hasta la obtención del resultado, con o sin centrifugación previa de la muestra.
Se estudiaron los siguientes tiempos:
- •
T1: 90-120 minutos (15-30 minutos en el caso de ACTH).
- •
T2: 210-240 minutos.
- •
T3: 330-360 minutos.
- •
T4: 450-480 minutos.
- •
T5: 24 horas.
- •
T6: 48 horas.
- •
T7: 7 días.
Las muestras de sangre se obtuvieron de 25 voluntarios sanos (20 mujeres y 5 hombres) con edades comprendidas entre 21 y 60 años. Todas las muestras fueron extraídas en el propio laboratorio entre las 8:00 y las 10:00 de la mañana. A todos los participantes se les informó de los objetivos del estudio y manifestaron por escrito su consentimiento.
ProtocoloA cada sujeto participante en el estudio se le extrajeron 6 tubos en el propio laboratorio (M1, M2, M3) para determinar cortisol y 25OH-vit D en suero y (M4, M5, M6) para determinar ACTH en plasma.
- •
M1. Un tubo BD Vacutainer® SST™ II Advance 8.5mL. Ref. 367955.
- •
M2-M3. Dos tubos BD Vacutainer® SST™ II Advance 5.0mL. Ref. 367955.
- •
M4. Un tubo BD Vacutainer® K2E 18.0mg 10mL. Ref. 367525.
- •
M5-M6. Dos tubos BD Vacutainer® K2E 5.4mg 3mL. Ref.368856.
M1: el tubo se trató como muestra de referencia, se centrifugó a los 30-60 minutos de la extracción a 3.000rpm durante 5 minutos. El tubo primario centrifugado (M1) se analizó en el tiempo T1 (tiempo de referencia) y posteriormente en T2, T3, T4, T5, T6 y T7. Entre los tiempos T1 y T4 la muestra permaneció a una temperatura entre 22-25°C. A partir del tiempo T4 la muestra se almacenó a 4°C hasta los tiempos T5, T6 y T7, condiciones habituales de conservación de estas muestras en el laboratorio. De todas las muestras M1, tras la centrifugación se separó una alícuota de suero (S1c) que se congeló a -20°C y se analizó en el tiempo T7.
M2: el tubo se mantuvo a 22-25°C en el laboratorio y se centrifugó inmediatamente antes de su procesamiento en el tiempo T2.
M3: el tubo se mantuvo en el laboratorio entre 22-25°C y se centrifugó inmediatamente antes de su procesamiento en el tiempo T3.
Todas las muestras se almacenaron tapadas.
ACTH en plasmaA cada sujeto participante en el estudio se le extrajeron tres tubos (M4, M5, M6) en el propio laboratorio.
M4: inmediatamente después de la extracción el tubo se colocó en hielo hasta la centrifugación en frío que se realizó 10-15 minutos después de la extracción. Tras la centrifugación se separaron de este tubo dos alícuotas de plasma, una (P1C) que se congeló a -20°C inmediatamente y se procesó en el tiempo T7 y la otra (P1) se procesó en el tiempo T1 (tiempo de referencia) y posteriormente en los tiempos T2, T3, T4, T5, T6 y T7, manteniendo la muestra a 4°C durante todos estos tiempos.
M5: el tubo se mantuvo en hielo y se centrifugó y separó el plasma (P2) inmediatamente antes de su procesamiento en T2.
M6: el tubo se mantuvo en hielo y se centrifugó y separó el plasma (P3) inmediatamente antes de su procesamiento en T3.
Todas las muestras se almacenaron tapadas.
Análisis de los datosLos datos se analizaron según los criterios de la Sociedad Española de Bioquímica Clínica y Patología Molecular3,4.
Se calculó la estabilidad (EST) según la fórmula:
Se tomaron como datos de coeficiente de variación analítico inter-ensayo los obtenidos en el control de calidad del laboratorio en el período de seis meses anteriores a la realización del estudio.
Para cada magnitud y cada tiempo (T2–T7) se calculó la diferencia porcentual (DP) observada respecto a la muestra de referencia (T1) según la fórmula:
Siendo Yi el resultado de la muestra i en los diferentes tiempos y Xi su correspondiente valor de referencia4.
Se consideró que en un tiempo se sobrepasaba la estabilidad cuando en ese tiempo DP>EST. Si la diferencia calculada era superior al límite de estabilidad propuesto se consideró que la variable estudiada producía pérdida de estabilidad que podría alterar la significación clínica del resultado.
Análisis estadísticoLas variables se describieron mediante la media y la desviación estándar.
Para valorar el efecto del tiempo sobre las concentraciones se utilizó un modelo lineal general de medidas repetidas (ANOVA de medidas repetidas). Para la comparación entre la concentración media de cada tiempo respecto a la muestra de referencia, así como para valorar el efecto de la centrifugación se utilizó la prueba no paramétrica de Wilcoxon. Para estos análisis se utilizó el software estadístico SPSS vs 19.0.
EnsayosLas determinaciones de cortisol, vitamina D (25OH Vit D Total) y ACTH se realizaron por inmunoanálisis de quimioluminiscencia en el analizador LIAISON® de DiaSorin (Saluggia-Vercelli, Italia). La imprecisión interensayo para cortisol, 25OH-vit D y ACTH fue 5,80, 8,6 y 7,69%, respectivamente.
Todas las medidas se realizaron por duplicado.
ResultadosEl estudio de estabilidad de cortisol se llevó a cabo con los resultados de las 25 muestras recogidas. Para la 25OH-vit D se utilizaron solosolo 22 debido a que en tres de las muestras el resultado inicial estaba próximo o era inferior al límite de sensibilidad del ensayo utilizado. El estudio de estabilidad de ACTH se realizó en 15 muestras. Para valorar el efecto de la congelación en ACTH se analizaron los resultados de 14 muestras debido a que en una muestra no fue posible medir ACTH tras congelación.
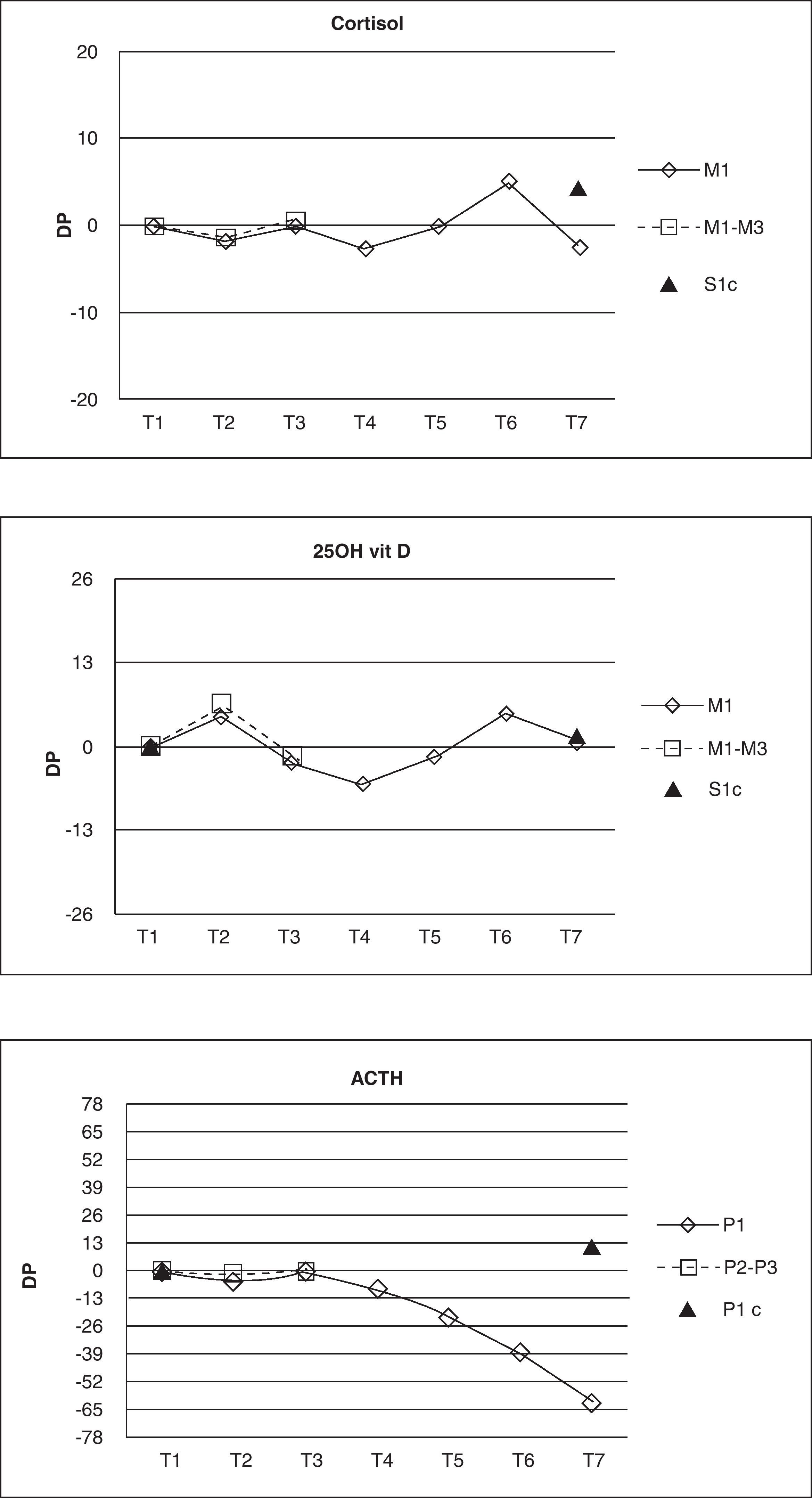
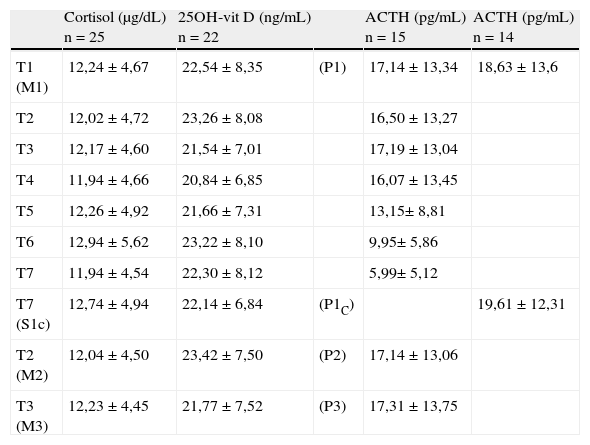
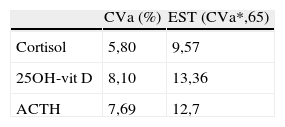
En la tabla 1 se muestran las concentraciones medias (±DS) de las diferentes magnitudes en cada muestra y cada tiempo estudiado.
Concentraciones medias de cortisol, 25OH-vit D y ACTH en los tiempos y muestras estudiadas
| Cortisol (μg/dL) n=25 | 25OH-vit D (ng/mL) n=22 | ACTH (pg/mL) n=15 | ACTH (pg/mL) n=14 | ||
| T1 (M1) | 12,24±4,67 | 22,54±8,35 | (P1) | 17,14±13,34 | 18,63±13,6 |
| T2 | 12,02±4,72 | 23,26±8,08 | 16,50±13,27 | ||
| T3 | 12,17±4,60 | 21,54±7,01 | 17,19±13,04 | ||
| T4 | 11,94±4,66 | 20,84±6,85 | 16,07±13,45 | ||
| T5 | 12,26±4,92 | 21,66±7,31 | 13,15± 8,81 | ||
| T6 | 12,94±5,62 | 23,22±8,10 | 9,95± 5,86 | ||
| T7 | 11,94±4,54 | 22,30±8,12 | 5,99± 5,12 | ||
| T7 (S1c) | 12,74±4,94 | 22,14±6,84 | (P1C) | 19,61±12,31 | |
| T2 (M2) | 12,04±4,50 | 23,42±7,50 | (P2) | 17,14±13,06 | |
| T3 (M3) | 12,23±4,45 | 21,77±7,52 | (P3) | 17,31±13,75 |
El análisis de los resultados se realizó en base a la media obtenida de los duplicados, comparándolas con la media obtenida para la muestra de referencia.
Se calculó el límite de estabilidad a partir de los datos del coeficiente de variación analítico obtenido durante los últimos seis meses en el control de calidad interno del laboratorio para cada una de las magnitudes estudiadas (tabla 2).
Se calculó la diferencia porcentual entre cada tiempo (T2-T7) y el tiempo de referencia (T1) y se comparó con el límite de estabilidad calculado para cada magnitud (tabla 3).
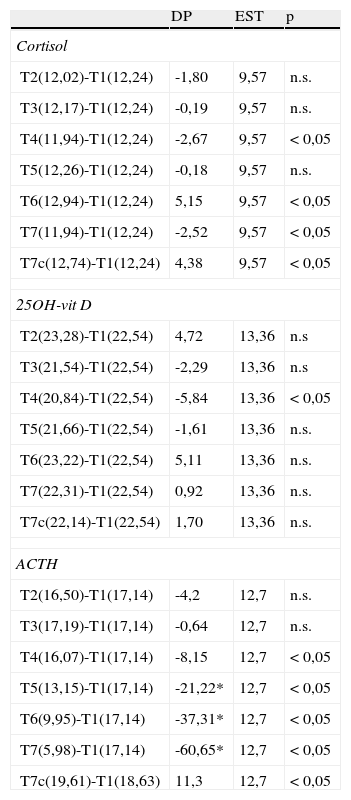
Diferencias porcentuales (DP) entre la concentración media en cada tiempo estudiado y la concentración media de la muestra de referencia. Los valores con * sobrepasan el límite de estabilidad
| DP | EST | p | |
| Cortisol | |||
| T2(12,02)-T1(12,24) | -1,80 | 9,57 | n.s. |
| T3(12,17)-T1(12,24) | -0,19 | 9,57 | n.s. |
| T4(11,94)-T1(12,24) | -2,67 | 9,57 | <0,05 |
| T5(12,26)-T1(12,24) | -0,18 | 9,57 | n.s. |
| T6(12,94)-T1(12,24) | 5,15 | 9,57 | <0,05 |
| T7(11,94)-T1(12,24) | -2,52 | 9,57 | <0,05 |
| T7c(12,74)-T1(12,24) | 4,38 | 9,57 | <0,05 |
| 25OH-vit D | |||
| T2(23,28)-T1(22,54) | 4,72 | 13,36 | n.s |
| T3(21,54)-T1(22,54) | -2,29 | 13,36 | n.s |
| T4(20,84)-T1(22,54) | -5,84 | 13,36 | <0,05 |
| T5(21,66)-T1(22,54) | -1,61 | 13,36 | n.s. |
| T6(23,22)-T1(22,54) | 5,11 | 13,36 | n.s. |
| T7(22,31)-T1(22,54) | 0,92 | 13,36 | n.s. |
| T7c(22,14)-T1(22,54) | 1,70 | 13,36 | n.s. |
| ACTH | |||
| T2(16,50)-T1(17,14) | -4,2 | 12,7 | n.s. |
| T3(17,19)-T1(17,14) | -0,64 | 12,7 | n.s. |
| T4(16,07)-T1(17,14) | -8,15 | 12,7 | <0,05 |
| T5(13,15)-T1(17,14) | -21,22* | 12,7 | <0,05 |
| T6(9,95)-T1(17,14) | -37,31* | 12,7 | <0,05 |
| T7(5,98)-T1(17,14) | -60,65* | 12,7 | <0,05 |
| T7c(19,61)-T1(18,63) | 11,3 | 12,7 | <0,05 |
Los resultados con asterisco muestran una DP que sobrepasa el límite de estabilidad establecido.
Las concentraciones de cortisol, aunque mostraron diferencias estadísticamente significativas en los tiempos T4, T6 y T7 respecto a la muestra de referencia, sin embargo, no sobrepasaron el límite de estabilidad en ninguno de los tiempos estudiados. En el caso de la 25OH-vit D se obtuvo una diferencia significativa en el tiempo T4, pero tampoco se sobrepasó el límite de estabilidad a lo largo de todo el estudio. Los resultados obtenidos para ACTH mostraron diferencias significativas entre los tiempos T4, T5, T6 y T7 respecto a la muestra de referencia, pero solo se sobrepasó el límite de estabilidad establecido a partir del tiempo T5, por lo que se consideró que el ACTH es estable hasta el tiempo T4 en las condiciones del estudio (fig. 1).
Para las tres magnitudes estudiadas no se observa pérdida de estabilidad cuando las muestras se almacenan congeladas a -20°C durante siete días.
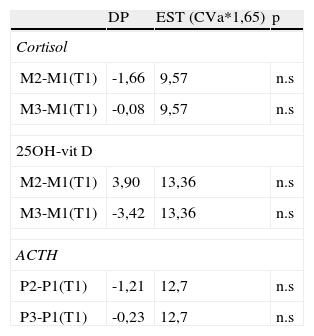
Efecto de la centrifugaciónEn la tabla 4 se muestra la diferencia porcentual (DP) respecto a la muestra de referencia para las muestras M2 y M3 en el caso de cortisol y 25OH-vit D y en las muestras P2 y P3 para ACTH analizadas según el protocolo citado.
Diferencia porcentual (DP) respecto a la muestra de referencia para las muestras M2 y M3 en el caso de cortisol y 25OH-vit D y en las muestras P2 y P3 para ACTH
| DP | EST (CVa*1,65) | p | |
| Cortisol | |||
| M2-M1(T1) | -1,66 | 9,57 | n.s |
| M3-M1(T1) | -0,08 | 9,57 | n.s |
| 25OH-vit D | |||
| M2-M1(T1) | 3,90 | 13,36 | n.s |
| M3-M1(T1) | -3,42 | 13,36 | n.s |
| ACTH | |||
| P2-P1(T1) | -1,21 | 12,7 | n.s |
| P3-P1(T1) | -0,23 | 12,7 | n.s |
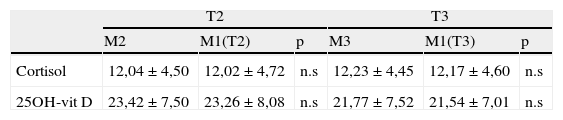
Comparando las muestras analizadas a igualdad de tiempo con centrifugación tras la obtención de la muestra o inmediatamente antes de su procesamiento no se observaron diferencias significativas para ninguna de las tres magnitudes analizadas (tabla 5).
Resultados obtenidos a igualdad de tiempo con y sin centrifugación previa
| T2 | T3 | |||||
| M2 | M1(T2) | p | M3 | M1(T3) | p | |
| Cortisol | 12,04±4,50 | 12,02±4,72 | n.s | 12,23±4,45 | 12,17±4,60 | n.s |
| 25OH-vit D | 23,42±7,50 | 23,26±8,08 | n.s | 21,77±7,52 | 21,54±7,01 | n.s |
| P2 | P1(T2) | p | P3 | P1(T3) | p | |
| ACTH | 17,14±13,06 | 16,50±13,27 | n.s | 17,31±13,75 | 17,19±13,04 | n.s |
Los resultados obtenidos indican que cortisol y 25OH-vit D permanecen estables a 22-25°C sin centrifugar hasta 6 horas. ACTH permanece estable sin centrifugar hasta 6 horas manteniendo la muestra a 4°C.
DiscusiónEn este estudio se valoró el efecto del tiempo transcurrido desde la toma de muestra en unas condiciones de temperatura preestablecidas hasta la obtención del resultado. Así mismo, se valoró el efecto sobre el resultado obtenido del tiempo transcurrido desde la obtención de la muestra hasta su centrifugación. En el caso de cortisol y 25OH-vit D no se superó el límite de estabilidad en ninguno de los tiempos analizados. En la valoración del retraso en el tiempo centrifugación no se observaron diferencias significativas entre las muestras analizadas en los tiempos T2 y T3 con y sin centrifugación previa. Por tanto, para las pruebas cortisol y 25OH-vit D las muestras son estables cuando se centrifugan tras su obtención, se conservan a 4°C y se procesan hasta al menos una semana después. Así mismo, la estabilidad de estas hormonas no se ve afectada durante al menos 6 horas cuando la muestra permanece a temperatura ambiente (22-25°C) sin centrifugar.
Estos resultados coinciden con los publicados en estudios previos. En el estudio de Wielders y Wijnberg7, la 25OH-vit D se mantiene estable durante siete días cuando el suero se almacena a 4°C. En este estudio valoran también el efecto del almacenamiento de la muestra sin centrifugar durante 72 horas a temperatura ambiente encontrando solo una disminución media de un 2,3% en los resultados obtenidos, lo cual les lleva a considerar la vitamina D sólida «como una roca» a temperatura ambiente y bajo las condiciones preanalíticas habituales en los laboratorios clínicos. En el estudio de Schneider et al.8 se conservan las muestras congeladas durante períodos de tiempo más prolongados pero también encuentran que el retraso de 4 horas en la centrifugación de la muestra no afecta a los resultados obtenidos para cortisol.
La disminución en los resultados obtenidos para ACTH para tiempos de almacenamiento superiores a 8 horas cuando la muestra se mantiene a 4°C también coinciden con la mayoría de los estudios publicados y justifica la necesidad de congelar y enviar congeladas todas las muestras que no se procesen en el día de su obtención. En el estudio de Evans et al.9 encontraron disminuciones significativas cuando las muestras para ACTH se conservaron a 4°C durante 24 horas. En el estudio de Ellis et al.10 se encontró una caída significativa de los valores de ACTH cuando las muestras de plasma-EDTA se almacenaron a 4°C durante 18 horas. También encontraron cambios significativos en los valores de ACTH cuando las muestras de plasma se obtuvieron de muestras de sangre mantenidas a 4°C y 24°C sin centrifugar durante 24 horas. En nuestro estudio no se encontraron diferencias cuando la muestra se mantenía a 4°C sin centrifugar pero solo por un período máximo de 6 horas.
Las posibles limitaciones de este estudio se deben al número limitado de muestras analizadas (la SEQC aconseja un mínimo de 30 muestras) y que las muestras proceden de voluntarios sanos. Sería interesante, aunque en la práctica resulta muy costoso, realizar los estudios de estabilidad con un número mayor de muestras e incluyendo muestras patológicas que no necesariamente se comportan como las muestras procedentes de sujetos normales. Además, hay que tener en cuenta que estos resultados solo son válidos para los ensayos a los que nos hemos referido debido principalmente a que la pérdida de estabilidad a veces está relacionada con cambios en la proporción de distintos fragmentos hormonales que no son igualmente detectados por todos los métodos de ensayo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la SEQC su apoyo y colaboración en la financiación de este trabajo.
Así mismo, agradecen a DiaSorin la donación de una parte de los reactivos utilizados en este estudio.