El lupus eritematoso sistémico se puede presentar con un amplio espectro de síntomas que en algunas ocasiones pueden enmascarar complicaciones graves asociadas a la misma enfermedad. Dentro de estas la pancreatitis es una causa poco común, y sin embargo de alta mortalidad, especialmente en pacientes con un tratamiento no oportuno. Reportamos el caso de una paciente que cursa con lupus eritematoso sistémico con compromiso renal y de sistema nervioso central, de reciente aparición, que se asocia a la aparición de pancreatitis y tiroiditis, presentando evolución satisfactoria con esquema terapéutico de ciclofosfamida y prednisolona.
Systemic lupus erythematosus can present with a broad spectrum of symptoms that on some occasions may mask serious complications associated with the same disease. Within these, pancreatitis is an uncommon but high-mortality cause, especially in patients with non-oportune treatment. We report the case of a patient with systemic lupus erythematosus with recent renal and central nervous system involvement that is associated with the onset of pancreatitis and thyroiditis. A satisfactory outcome was obtained with a cyclophosphamide and prednisolone therapeutic regimen.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune con una amplia variedad de síntomas y signos clínicos, que se asocia a una gran cantidad de hallazgos inmunológicos y de laboratorio. A pesar de que la sobrevida de estos pacientes se ha incrementado notablemente en las últimas 6 décadas, a más de 90% a 5 años1, aún la carga de enfermedad y la morbilidad sigue siendo alta. Revisamos el caso de una paciente con LES y nefritis que presentó síntomas de tiroiditis y pancreatitis de forma simultánea.
Caso clínicoSe trata de una paciente de sexo femenino, de raza mestiza, de 18 años de edad, con diagnóstico de LES con antecedente familiar de madre con diagnóstico de LES (sin antecedentes personales, en especial de enfermedad tiroidea o pancreática) con síntomas de inicio 3 meses antes de consultar dados por poliartralgias de grandes y pequeñas articulaciones, fotosensibilidad y caída del cabello, pero sin alopecia cicatricial. Se inició manejo con cloroquina y acetaminofén en otra institución, pero no volvió al seguimiento de reumatología ni de ningún otro servicio médico. La paciente consultó al servicio de urgencias por la presencia de edema en los miembros inferiores, disnea progresiva, astenia, adinamia y pérdida de peso de aproximadamente 10kg en los anteriores 4 meses. Además, se observó anasarca, edema asimétrico de miembros inferiores, taquipnea, taquicardia, con desaturación en la oximetría de pulso sin oxígeno suplementario (86%), pero sin presencia de sobreagregados a la auscultación cardiopulmonar y sin deterioro neurológico. Se decidió hospitalizar porque se evidenció trombosis venosa femoral izquierda y femoropoplítea y tibial posteriores derechas en el doppler de miembros inferiores, por lo que se inició anticoagulación con warfarina. En la química sanguínea se observó leucopenia de 3.160 células por mm3 (valor de referencia [Vr] 4.500-1.0000cél.), linfopenia de 110 células por mm3 (Vr. 1.200-3.400 cél.), anemia con hemoglobina de 8,4g/dl (Vr. 12-16g/dl), sin trombocitopenia ni hemólisis, creatinina de 0,54mg/dl (Vr. 0,6-1,2mg/dl), proteínas en orina de 24h de 3,5g en rango nefrótico (Vr. menor a 150mg/24h) y un uroanálisis con presencia de cilindros céreos, leucocitos de 14-15xc (Vr. 0-5xc), eritrocitos de 4-5xc (Vr.1-3 eritrocitosxc). Otros exámenes de laboratorio obtenidos de la paciente fueron: TSH (por sus siglas en inglés para thyroid stimulating hormone) suprimida en 0,03U/ml (Vr. 0,45 a 4,5U/ml), T4 libre elevada en 2,54ng/dl (Vr. 0,8-2,0ng/dl), anticuerpos antinucleares 1:1.280 de patrón homogéneo, anticuerpos anti ADN de doble cadena 1:1.280, anticardiolipinas IgG e IgM negativas, B2-glucoproteína IgG e IgM negativas, anticoagulante lúpico negativo, complemento C3 de 65mg/dL (Vr. 90-180mg/dl) y C4 de 9,5mg/dl (Vr. 10-40mg/dl).
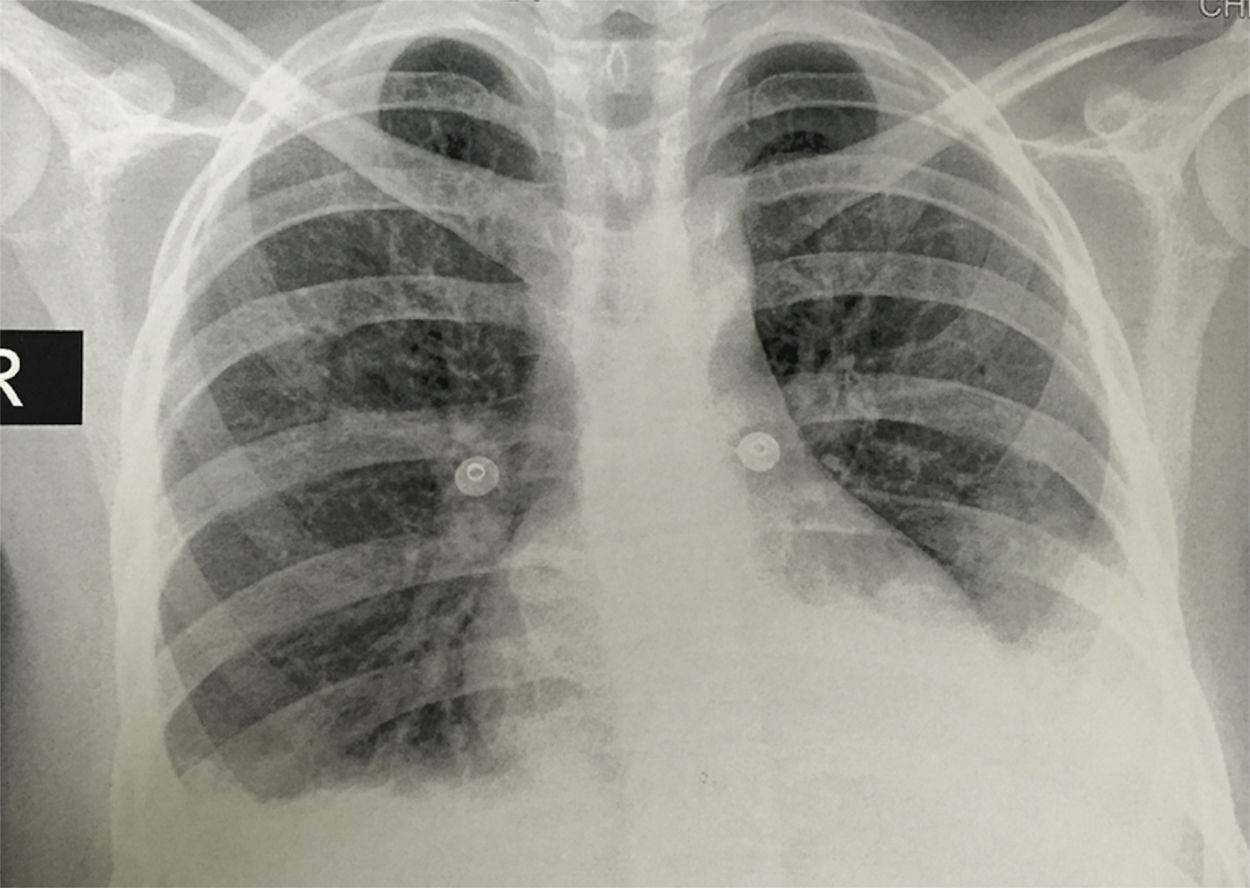
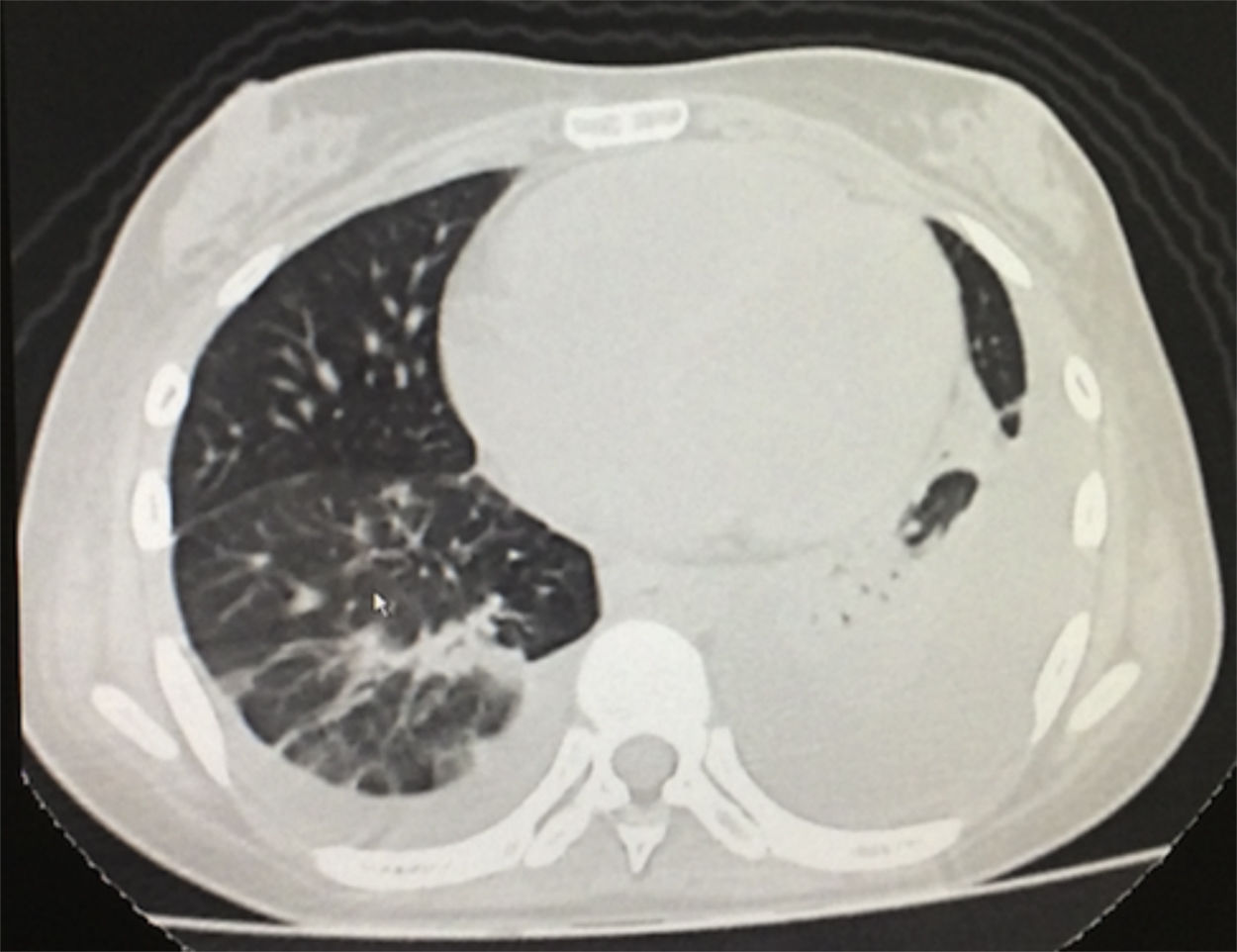
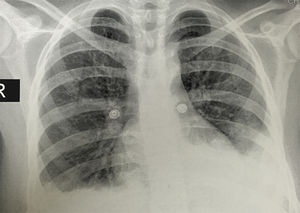
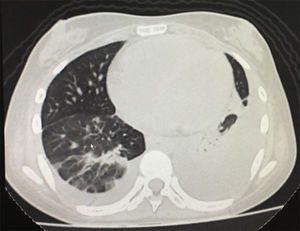
En la radiografía de tórax simple se observó la presencia de derrames pleurales y una imagen sugestiva de consolidación basal izquierda, a pesar de que la paciente no presentaba tos, esputo ni fiebre (fig. 1). En la tomografía simple de tórax se evidenció derrame pleural izquierdo con atelectasia compresiva ipsilateral y bandas parenquimatosas en la base derecha (fig. 2). El ecocardiograma realizado informó de fracción de eyección conservada con una presión sistólica de la arteria pulmonar elevada de 42mmHg (Vr. PsAp menor de 36mmHg). Se calculó el Systemic Disease Activity Index (SLEDAI) en 21 puntos, considerándose una exacerbación del LES severa. Se inició tratamiento con prednisolona a 30mg por día, con lo que presentó mejoría de la disnea y de la saturación de oxígeno.
Durante la segunda semana de la hospitalización presentó un cuadro de dolor abdominal súbito y difuso asociado a náuseas, un reporte de amilasa de 817U/l (27-131U/l) y una ecografía hepatobiliar con aumento difuso de la ecogenicidad hepática, líquido libre en la cavidad peritoneal y sin alteraciones en la vía biliar. Se realizó perfil lipídico que se informó como: colesterol total de 146 (Vr. menor de 200mg/dl), HDL de 37 (Vr. mayor de 50mg/dl para mujeres), LDL de 77mg/dl (Vr. menor de 160mg/dl, valor variable según factores de riesgo cardiovascular) y triglicéridos de 153mg/dl (Vr. menor de 150mg/dl). No se realizó tomografía abdominal por considerase de alto riesgo de nefrotoxicidad por el medio de contraste requerido. Con el diagnóstico de pancreatitis aguda se trató sintomáticamente con meperidina y metoclopramida, con lo que se resolvió el cuadro clínico abdominal en los siguientes 7 días.
Se recibió el reporte de la biopsia renal tomada al ingreso de la hospitalización que informó de la presencia de nefropatía lúpica tipo IV G, de acuerdo con la clasificación de la International Society of Nephrology and Renal Pathology Society 2004 con índice de actividad de 4 puntos y de cronicidad de 5 puntos, no se informó de la presencia de atrofia tubular. Se inició esquema terapéutico para nefritis lúpica con ciclofosfamida (esquema del Instituto Nacional de Salud de Estados Unidos) y bolos intravenosos de metilprednisolona de 500mg por 3 días consecutivos, seguidos por prednisolona oral a 1mg/kg diarios, además de metimazol oral 15mg día, propranolol oral 20mg día por el diagnóstico asociado de tiroiditis, evidenciada en las pruebas de función tiroidea. La paciente presentó adecuada evolución clínica con mejoría progresiva de los edemas, sin deterioro de la función renal, resolución del dolor abdominal con mejoría de la escala de SLEDAI y normalización de la frecuencia cardiaca, por lo que se decide dar alta hospitalaria 4 semanas después de su ingreso. Ambulatoriamente se tomaron pruebas de función tiroidea complementarias que evidenciaron una gammagrafía de tiroides con presencia de bocio hipercaptante homogéneo, sin defectos focales y con un índice de retención de 12,5 (Vr. 2,5-4,5). También se observó, luego de la suplencia de metimazol por 8 semanas, la normalización de las pruebas de función tiroidea con TSH en 2,34IU/ml y T4 libre de 1,09ng/dl.
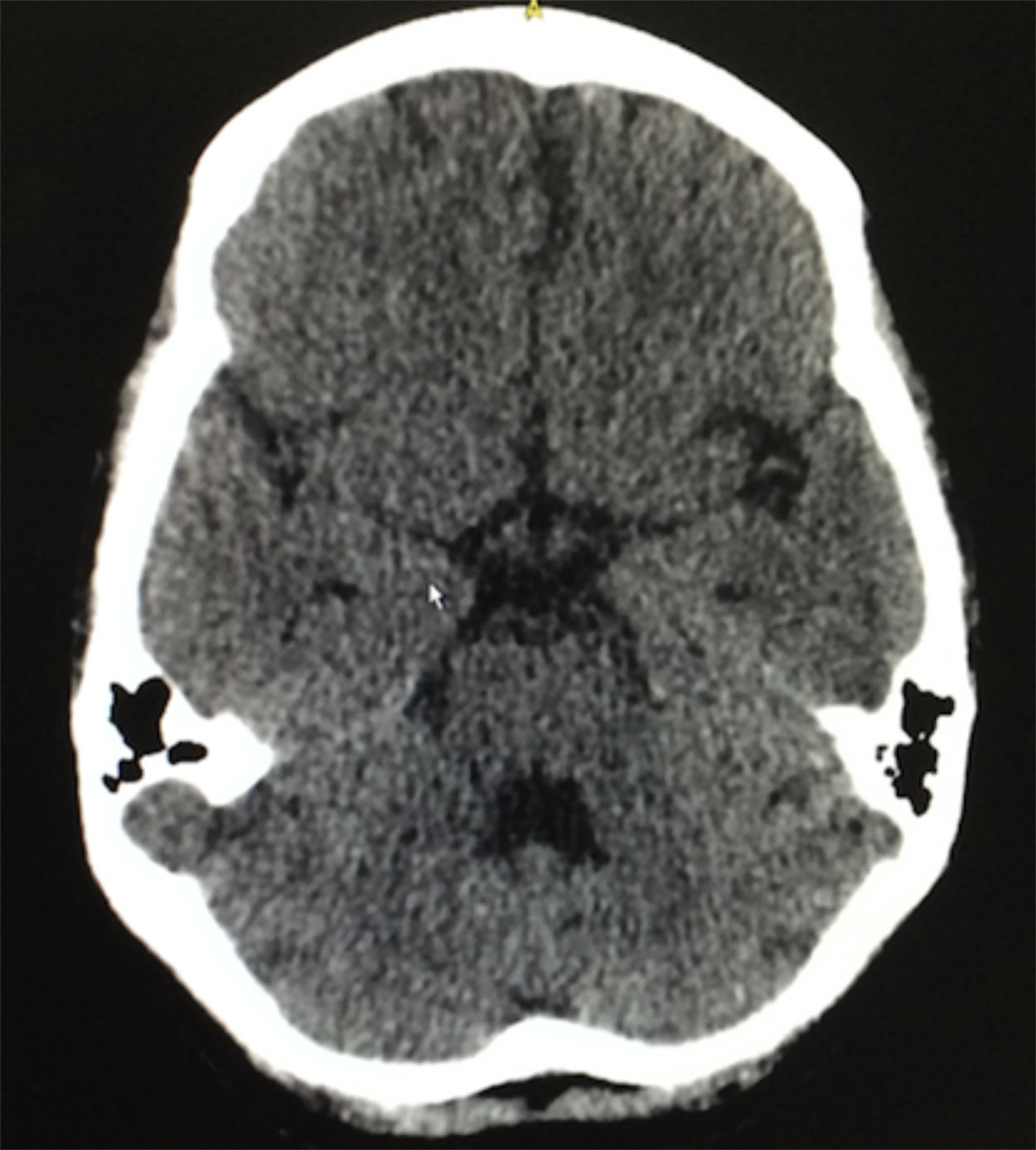
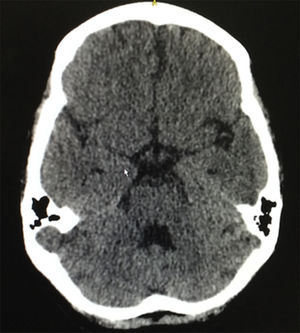
Ocho semanas después del egreso hospitalario presentó 2 episodios convulsivos tónico-clónicos, por lo que consultó otra vez al servicio de urgencias, realizándosele una punción lumbar que descartó neuroinfección, una tomografía cerebral simple que evidenció ligeros cambios atróficos corticales y microangiopáticos de pequeño vaso, además de una ligera dilatación del sistema ventricular (fig. 3). Se documentaron los siguientes resultados de laboratorio: complemento C3 de 77mg/dl, complemento C4 de 18mg/dl, creatinina sérica de 0,62mg/dl, hemoglobina de 10,1g/dl, leucocitos de 3.650 células y linfocitos de 820 células. El SLEDAI calculado en esta nueva hospitalización fue de 23. Se administró un nuevo esquema de metilprednisolona intravenosa de 250mg día por 3 días consecutivos, y posteriormente se continuó el esquema de prednisolona de 1mg/kg por día que venía recibiendo y se decidió no suministrar manejo anticonvulsivante. Tuvo una evolución satisfactoria, sin nuevos episodios convulsivos con normalización clínica de la actividad lúpica y sin deterioro en la función renal, por lo que se dio egreso 10 días después de haber ingresado. Actualmente continúa en tratamiento con prednisolona en disminución progresiva de la dosis y con ciclofosfamida mensual, sin presentar nuevos eventos neurológicos ni episodios de dolor abdominal.
DiscusiónLa asociación de pancreatitis y tiroiditis en el paciente con LES no ha sido reportada en la literatura, posiblemente debido en parte a la falta de sospecha de pancreatitis como diagnóstico diferencial en los pacientes con LES activo que presentan dolor abdominal. Tampoco es habitual el reporte de un compromiso tiroideo en este grupo de pacientes. La no consideración de los síntomas de hipertiroidismo en los pacientes con respuesta inflamatoria sistémica activa, es muy probable también que sea la causa del subregistro de enfermedad tiroidea en este grupo. Esto deriva en que no sea posible identificar en la literatura el perfil clínico de los pacientes con esta combinación de hallazgos o los perfiles clínicos que se han descrito en cada una de las entidades de forma individual.
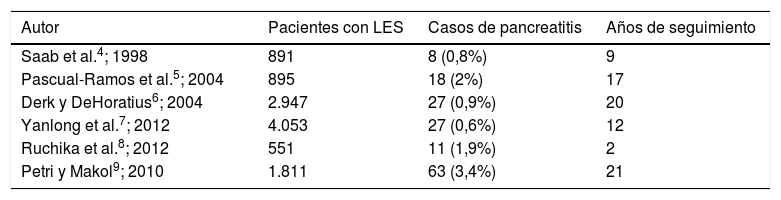
En lo que respecta al compromiso pancreático descrito en el LES, se considera poco común (tabla 1) y se ha observado en distintas series una incidencia aproximada de 0,4 a 1,1 por 1.000 pacientes/año2. La etiología aún no está aclarada por su baja prevalencia, la no existencia de estudios anatomopatológicos ni de modelos animales. Sin embargo, existen hipótesis fisiopatológicas que se han considerado, siendo la vascular la más plausible que sugiere diferentes mecanismos, como el compromiso por vasculitis necrosante, la vasculopatía trombótica secundaria a síndrome antifosfolípido, la proliferación y el engrosamiento intimal; los depósitos de complejos inmunes y la activación del complemento en la pared vascular3.
Casos de pancreatitis en pacientes con lupus eritematoso sistémico según diferentes cohortes
| Autor | Pacientes con LES | Casos de pancreatitis | Años de seguimiento |
|---|---|---|---|
| Saab et al.4; 1998 | 891 | 8 (0,8%) | 9 |
| Pascual-Ramos et al.5; 2004 | 895 | 18 (2%) | 17 |
| Derk y DeHoratius6; 2004 | 2.947 | 27 (0,9%) | 20 |
| Yanlong et al.7; 2012 | 4.053 | 27 (0,6%) | 12 |
| Ruchika et al.8; 2012 | 551 | 11 (1,9%) | 2 |
| Petri y Makol9; 2010 | 1.811 | 63 (3,4%) | 21 |
Hasta en el 41% de los casos en el estudio de Pascual-Ramos5 se consideró una etiología idiopática, identificándose otras posibles etiologías como las mecánicas-obstructivas observadas en el 34% y las tóxico-metabólicas en el 24% de los casos según el mismo estudio5. En el 20% de los casos se reporta en la presentación inicial del LES y otro 60% en los 2 años siguientes5, con una media de 5 años6. La pancreatitis se asocia a una actividad significativa de la enfermedad, sin embargo, en el 10% de los casos asociados a LES no presentó ninguna otra manifestación clínica o de laboratorio4. El 90% restante presentó actividad lúpica significativa con un importante compromiso cutáneo, articular y renal4. Los factores de riesgo identificados para la aparición de pancreatitis en el LES son: pleuritis, psicosis, anemia, hipertrigliceridemia y sin relación con anticuerpos antifosfolípido, anti ADN, anti-Ro ni con el anti-La9.
Los factores de riesgo relacionados con el tratamiento se analizaron de forma completa en 77 casos por Breuer et al.10, observando que los corticoides y la azatioprina rara vez eran identificados como causa de pancreatitis y sin lograr demostrar causalidad de forma clara10, por lo que en la mayoría de casos el tratamiento fue continuado. Pascual-Ramos et al. compararon la frecuencia del uso de esteroides en pacientes con lupus y pancreatitis idiopática no identificando asociación de riesgo5.
Las manifestaciones clínicas más frecuentemente reportadas son: dolor abdominal (80%), náuseas o vómitos (60%), fiebre (50%) y diarrea (9%)10. En la gran mayoría de los casos el diagnóstico se basó en los hallazgos clínicos sumados a una elevación de enzimas pancreáticas, ya sea amilasa o lipasa, aunque se describe que hasta un 30% de pacientes asintomáticos pueden tener estas pruebas positivas. Los anticuerpos antinucleares están presentes en el 98% de los casos, los anticuerpos anti-ADN en el 73% y bajos niveles del complemento en un 75%11. El tratamiento de la pancreatitis asociada al LES casi siempre contempla glucocorticoides, ocasionalmente la adición de azatioprina y en casos más severos ciclofosfamida, plasmaféresis o gammaglobulina. Breuer consideró que las complicaciones (falla respiratoria, derrame pleural, infección, choque y el pseudoquiste pancreático) pueden aparecer si no hay un tratamiento oportuno hasta en un 57%, lo que aumenta la mortalidad drásticamente hasta en el 45%, que es significativamente mayor en comparación con la mortalidad del 3% en los casos sin presencia de complicaciones10. Pascual-Ramos et al. reportaron una mortalidad general del 22%5, mientras que Derk et al., reportaron un 18%6.
La tiroiditis autoinmune crónica (enfermedad de Hashimoto), así como el hipertiroidismo inmunogénico (enfermedad de Graves) se asocian frecuentemente con muchas otras enfermedades autoinmunes, como el síndrome de Sjögren, la anemia hemolítica autoinmune, la anemia perniciosa megaloblástica, la púrpura trombocitopénica inmune, la artritis reumatoide, la diabetes mellitus, la enfermedad de Addison, la enfermedad celíaca y otros trastornos del tejido conectivo tales como el LES y la esclerosis sistémica12. Una gran variedad de estudios han valorado la asociación y la prevalencia de los aspectos clínicos e inmunológicos de hipertiroidismo en pacientes con LES13–22. La prevalencia exacta de hipertiroidismo coexistente con LES no está determinada en la literatura médica, pero se ha estimado hasta en el 8,9%. En pacientes con LES los estudios revelan un mayor riesgo de hipotiroidismo (incluyendo el subclínico), pero sin evidenciarse aumento significativo del riesgo de hipertiroidismo12,17. Se destacan como hallazgos inmunológicos la presencia de anticuerpos antinucleares en el 94% de los casos, de antiADN en el 100% e hipocomplementemia en el 66% de los casos. Los hallazgos clínicos de actividad lúpica más frecuentes son la presencia de compromiso articular, renal y cutáneo20.
En el presente caso se evidenció la magnitud y extensión del compromiso sistémico por la presencia de pancreatitis y tiroiditis asociada a otras manifestaciones como la renal, articular, neurológica, de serosas, hematológica, consumo de complemento y producción de autoanticuerpos anti ADN que está en concordancia con lo informado en la literatura acerca de la asociación de pancreatitis y LES. Es notable la presencia de este cuadro en un escenario de factores de riesgo para la presentación de la enfermedad y severidad de la misma como lo son el sexo, la edad, los antecedentes familiares y la raza, suponiendo así una interacción de los mismos en el fenotipo clínico de la paciente. Igualmente llama la atención la presencia de enfermedad tiroidea, que a pesar no haber sido caracterizada inmunoserológicamente (anti TPO, receptor de TSH, antimicrosomales), pone en consideración la coexistencia de enfermedad tiroidea autoinmune, y por lo tanto la posibilidad del diagnóstico sindromático de poliautoinmunidad y en el caso de demostrarse el síndrome antifosfolípido en el seguimiento, el diagnóstico de síndrome de autoinmunidad múltiple. A este último respecto es necesario el resultado del segundo set del perfil antifosfolípido (IgG e IgM anticardiolipina, B2 glucoproteína i y anticoagulante lúpico) para descartar o confirmar el diagnóstico de síndrome antifosfolípido, no considerando necesario realizar otros tipos de serologías (IgA o pruebas de antifosfolípidos totales o diferenciados) por no aportar de forma significativa al diagnóstico23, siendo fundamental la aclaración diagnóstica en el plan terapéutico de anticoagulación y en el pronóstico. La pancreatitis acá reportada presentó un curso benigno, sin identificarse la presencia de factores asociados de riesgo como hipertrigliceridemia, consumo de alcohol o litiasis biliar, y sin documentarse un espectro clínico sugestivo de otra enfermedad pancreática autoinmune (pancreatitis autoinmune), y al igual que lo reportado en la literatura se observó una alta actividad de la enfermedad de base, con una adecuada respuesta inicial al manejo con esteroide oral.
Es importante destacar la adecuada respuesta clínica al manejo inmunosupresor, de corticoides, de antitiroideos y bloqueadores beta junto al tratamiento de soporte para las manifestaciones del cuadro pancreático y tiroideo, sin que se hayan registrado recurrencias posteriores.
ConclusiónEl diagnóstico de pancreatitis y de tiroiditis en el escenario del lupus no es común, y la asociación de estas 2 menos aún; de igual forma se desconoce la interacción en la historia natural y pronóstico de estas con su presentación sincrónica. El caso descrito, al igual que lo reportado en la literatura, indica un perfil clínico y paraclínico de alta actividad lúpica, por lo que puede llevar a un subregistro debido a la sobreposición de los síntomas de estas afecciones con otras manifestaciones del lupus, siendo necesario sospechar estas complicaciones ante escenarios de alta actividad para poder detectarlas y tratarlas de forma oportuna.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNinguno.