Las recaídas de la enfermedad en miopatías inflamatorias idiopáticas (MII) tienen un peso relevante en la carga de la enfermedad. No obstante, los estudios colombianos con seguimientos a largo plazo son escasos.
ObjetivoEstimar la supervivencia libre de recaída de la enfermedad a 10años en pacientes con miopatía inflamatoria idiopática atendidos en un centro médico especializado en enfermedades autoinmunes con presencia en diferentes ciudades de Colombia.
Materiales y métodosSeguimiento retrospectivo a una cohorte basada en registros médicos. Se incluyó a todos los pacientes con diagnóstico de miopatía inflamatoria idiopática atendidos entre enero del 2012 y junio del 2022. Como variable de desenlace se definió el tiempo a la recaída. Adicionalmente, se caracterizaron variables demográficas, clínicas, de laboratorio y de tratamiento. Los análisis se realizaron mediante regresión de supervivencia de Weibull para datos censurados en intervalo.
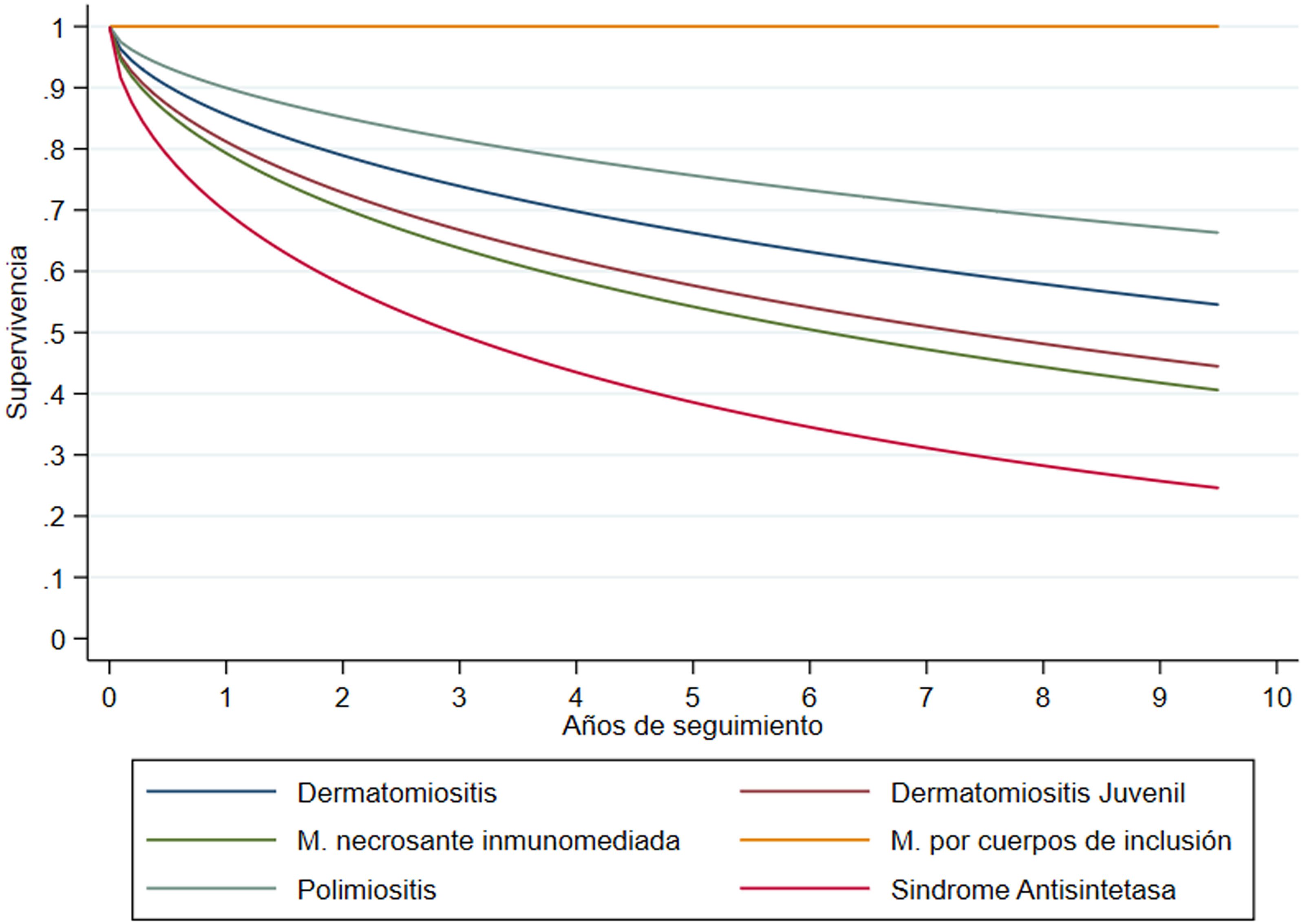
ResultadosSe incluyó a 278 pacientes, seguidos en promedio por 6,60 años, 70,9% mujeres, con edad mediana de 57 años (rango intercuartil 40-66). La dermatomiositis (60,1%) y la polimiositis (28,1%) fueron los fenotipos más frecuentes. La supervivencia libre de recaída a un año fue del 86,3 y a 5años del 68,3%, con una mediana de tiempo libre de recaída de 13,8 años. Por fenotipo, las menores medianas de supervivencia libre de recaída se observaron para síndrome antisintetasa, con 3 años, miopatía necrosante inmunomediada con 6 años y dermatomiositis juvenil con 7,3 años.
ConclusiónLa supervivencia libre de recaída es muy heterogénea, según el fenotipo clínico de la miopatía inflamatoria idiopática; es menor en pacientes con síndrome antisintetasa.
Disease relapses of idiopathic inflammatory myopathies (IIM) play a significant role in the burden of disease. However, Colombian studies with long-term follow-ups are scarce.
ObjectiveTo estimate the ten-year relapse-free survival in patients with idiopathic inflammatory myopathy treated at a specialized medical centre for autoimmune diseases with presence in different cities in Colombia.
MethodThis is a retrospective follow-up study based on medical records. All patients diagnosed with idiopathic inflammatory myopathy treated between January 2012 and June 2022 were included. The time to relapse was defined as the outcome variable. Additionally, demographic, clinical, laboratory, and treatment variables were characterized. Analyses were performed using Weibull survival regression for interval-censored data.
ResultsA total of 278 patients followed for a mean of 6.60 years were included. Of these, 70.9% were women, with a median age of 57 (IQR 40-66) years. Dermatomyositis (60.1%) and polymyositis (28.1%) were the most frequent phenotypes. Relapse-free survival at one year was 86.3%, and at 5years, 68.3%, with a median relapse-free time of 13.8 years. By phenotype, the lowest median relapse-free survival rates were observed for antisynthetase syndrome at 3 years, immune-mediated necrotizing myopathy at 6 years, and juvenile dermatomyositis at 7.3 years.
ConclusionRelapse-free survival is highly heterogeneous according to the clinical phenotype of idiopathic inflammatory myopathy, being lowest in patients with antisynthetase syndrome.
Las miopatías inflamatorias idiopáticas (MII) son un grupo heterogéneo de enfermedades caracterizadas por daño muscular inmunomediado. Este grupo incluye dermatomiositis (DM), polimiositis (PM), miositis de superposición (MS), miositis por cuerpos de inclusión (MCI-IBM) y miopatía necrosante inmunomediada (NAM) [1]. Su incidencia varía entre 2,1 y 7,7 casos por millón de habitantes, con una mortalidad a 10 años del 31%, siendo las enfermedades cardiorrespiratorias y las neoplasias malignas las principales causas de muerte [2]. Al tratarse de una enfermedad crónica, las comorbilidades y las recaídas son frecuentes, lo que aumenta la carga médica y económica [3,4].
La definición de recaída en MII no es clara. En la práctica, se diagnostica una recaída cuando los síntomas recurren o empeoran después de haber mejorado con el tratamiento inicial [5]. Estudios recientes indican que solo entre el 20 y el 40% de los pacientes con PM o DM alcanzan la remisión clínica, mientras que entre el 60 y el 80% experimentan un curso clínico con recaídas recurrentes. Las remisiones sin medicación de control son raras, excepto en la dermatomiositis juvenil (DMJ) [6,7].
Diversos factores se han identificado como predictores de recaídas y desenlaces adversos como muerte, resistencia al tratamiento y progresión de la enfermedad. Entre estos factores se encuentran la edad avanzada, un largo periodo entre el inicio de los síntomas y el tratamiento, afectación cardíaca o pulmonar, presencia de neoplasias malignas subyacentes, afectación cutánea extensa, anticuerpos específicos de miositis, y disfonía y disfagia al momento del diagnóstico. Estos factores se han derivado de estudios con poblaciones heterogéneas y no incluyen datos específicos de la población colombiana [5].
En Colombia, la comprensión de las enfermedades musculares autoinmunes está en sus primeras etapas. Existen algunos estudios que describen la situación en las principales ciudades del país, pero ninguno aborda específicamente el riesgo de recaídas y su evolución en el tiempo.
El objetivo de este estudio fue estimar la supervivencia libre de recaídas a 10años en pacientes MII atendidos en un centro médico especializado en enfermedades autoinmunes con presencia en diferentes ciudades de Colombia.
MetodologíaEl reporte sigue las recomendaciones de la guía STROBE para estudios observacionales [8].
Diseño y contextoSe llevó a cabo un estudio observacional de seguimiento retrospectivo a una cohorte de pacientes con diagnóstico de MII atendidos entre enero del 2012 y junio del 2022 en Armtedica, un centro médico especializado en enfermedades autoinmunes con presencia en 7 ciudades de Colombia: Medellín, Rionegro, Manizales, Pereira, Armenia, Cali y Tunja. El tiempo de seguimiento fue desde el momento del diagnóstico hasta la ocurrencia de la recaída, la fecha de la última valoración o hasta los 10años de seguimiento.
ParticipantesSe incluyó a pacientes con diagnóstico confirmado de miopatía inflamatoria según criterios de Bohan y Peter [9]. Se excluyó a pacientes con diagnóstico de miopatía tóxica, infecciosa, endocrina o metabólicas, así como pacientes con datos incompletos. Se identificaron inicialmente los pacientes potencialmente elegibles mediante el código CIE-10, correspondiente a miopatía inflamatoria (G72.8, M33.0, M33.1, M33.2, M33.9). Posteriormente, 5médicos residentes de medicina interna aplicaron los criterios de inclusión y exclusión mediante el análisis de los registros completos de la historia clínica electrónica.
Variables y fuentes de informaciónLa variable de resultado fue la presentación de recaída determinada por el reumatólogo tratante durante el seguimiento. Adicionalmente, se extrajo información sobre tratamiento, respuesta a tratamiento y necesidad de cambio de tratamiento por refractariedad o recaída, como persistencia de la debilidad muscular y elevación de CK a pesar de tratamiento inmunosupresor, con al menos 2 o más fármacos a dosis máxima tolerada administrados de manera secuencial o concomitante y que fuera identificado por el reumatólogo en la consulta, o la aparición de nuevos síntomas que pudieran estar o no asociados a elevación enzimática, sin otra causa que los explicara [9].
Con relación a las características de los pacientes, se extrajeron variables demográficas (edad, sexo), clínicas (tipo de miopatía, manifestaciones, comorbilidades), paraclínicas (anticuerpos, biopsia) y de tratamiento (medicamentos usados). Se estandarizó un formulario para la recolección de información utilizado por los investigadores.
Sesgos y tamaño de muestraPara mitigar los sesgos de información, los investigadores extrajeron los datos de los registros de historias clínicas empleando un formulario estandarizado en Google Forms. Se llevó a cabo un entrenamiento y una estandarización por parte del grupo de información clínica de la institución. Adicionalmente, se auditó el proceso de extracción de datos. La definición de variables y el proceso de extracción fueron supervisados por un reumatólogo. Para reducir los sesgos de selección, la identificación de los pacientes se realizó en 2etapas: búsqueda de pacientes potencialmente elegibles en los registros administrativos y confirmación de criterios mediante la revisión de las historias clínicas.
Análisis estadísticoEl análisis descriptivo de las características de los pacientes se llevó a cabo mediante frecuencias y porcentajes para las variables categóricas y mediana y rango intercuartil (RIC) para las variables cuantitativas. Estos resultados se presentan según el fenotipo clínico de la MII. La función de supervivencia libre de recaída según fenotipo se modeló por medio de una regresión de supervivencia de Weibull para datos censurados en intervalo. Se presenta la función acumulada de supervivencia mediante gráfica y las medianas de tiempo libre de recaída. Se empleó el modelo de Weibull, dado que obtuvo los mejores indicadores de bondad de ajuste de Akaike y bayesiano. Adicionalmente, se hicieron análisis exploratorios de factores asociados al tiempo libre de recaída, los cuales se expresaron mediante hazard ratio (HR) con intervalo del 95% de confianza (IC del 95%) y valor p. El nivel de significación se estableció en p <0,05. Los análisis se ejecutaron en el programa Stata versión 16.1 (College Station, TX, EE. UU.).
Consideraciones éticasEl protocolo de este estudio fue aprobado por el Comité Institucional de Ética de la Investigación en Seres Humanos de la Universidad CES (AE-960) como investigación sin riesgo, de acuerdo con la Resolución 8430 de 1993. Al ingreso al programa se obtuvo consentimiento informado de los pacientes para el uso en condiciones de confidencialidad y anonimato de sus datos de historia clínica con fines de investigación.
ResultadosParticipantesEntre 460 pacientes potencialmente elegibles, se incluyó a 278 que fueron seguidos por 6,60 años, en promedio. Por municipio de atención, el 66,9% de los pacientes fue de la sede Medellín, el 8,3% de Pereira, el 5,0% de Manizales, el 4,3% de Tunja, el 4,0 de Rionegro, el 3,6 de Armenia, el 3,2% de Montería, el 1,8% de Cali, el 1,4% de Apartadó y el 1,1% de Pasto.
Datos descriptivosDel total de pacientes incluidos, el 70,9% fueron mujeres, la mediana de la edad al diagnóstico fue de 57 años (RIC 40-66). La DM fue el fenotipo clínico más frecuente, observado en el 60,1% de los pacientes, seguida por PM, observado en el 28,1%. Otros fenotipos tuvieron menor frecuencia: DMJ 4,7%, NAM 4,0%, síndrome antisintetasa (SAS) 1,8% y MCI-IBM 1,4%.
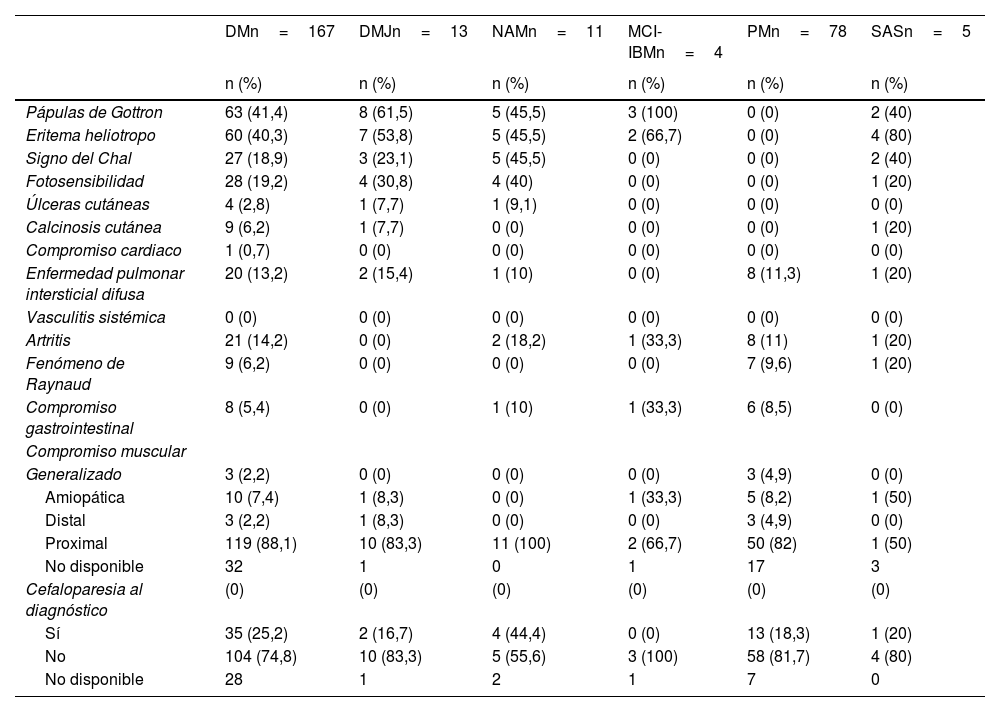
Características clínicasLa tabla 1 presenta las características clínicas según fenotipo clínico. Los signos clínicos más comunes variaron con el fenotipo. La enfermedad pulmonar intersticial se presentó en un 13,2% de los casos de DM y en un 15,4% de los casos de DMJ. En cuanto a la distribución del compromiso muscular, la mayoría de los casos presentaron un compromiso proximal y la cefaloparesia al momento del diagnóstico se observó en un 25,2% de los casos de DM y en un 16,7% de los casos de DMJ.
Características clínicas, según fenotipo de la miopatía inflamatoria idiopática (n=278)
| DMn=167 | DMJn=13 | NAMn=11 | MCI-IBMn=4 | PMn=78 | SASn=5 | |
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| Pápulas de Gottron | 63 (41,4) | 8 (61,5) | 5 (45,5) | 3 (100) | 0 (0) | 2 (40) |
| Eritema heliotropo | 60 (40,3) | 7 (53,8) | 5 (45,5) | 2 (66,7) | 0 (0) | 4 (80) |
| Signo del Chal | 27 (18,9) | 3 (23,1) | 5 (45,5) | 0 (0) | 0 (0) | 2 (40) |
| Fotosensibilidad | 28 (19,2) | 4 (30,8) | 4 (40) | 0 (0) | 0 (0) | 1 (20) |
| Úlceras cutáneas | 4 (2,8) | 1 (7,7) | 1 (9,1) | 0 (0) | 0 (0) | 0 (0) |
| Calcinosis cutánea | 9 (6,2) | 1 (7,7) | 0 (0) | 0 (0) | 0 (0) | 1 (20) |
| Compromiso cardiaco | 1 (0,7) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Enfermedad pulmonar intersticial difusa | 20 (13,2) | 2 (15,4) | 1 (10) | 0 (0) | 8 (11,3) | 1 (20) |
| Vasculitis sistémica | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Artritis | 21 (14,2) | 0 (0) | 2 (18,2) | 1 (33,3) | 8 (11) | 1 (20) |
| Fenómeno de Raynaud | 9 (6,2) | 0 (0) | 0 (0) | 0 (0) | 7 (9,6) | 1 (20) |
| Compromiso gastrointestinal | 8 (5,4) | 0 (0) | 1 (10) | 1 (33,3) | 6 (8,5) | 0 (0) |
| Compromiso muscular | ||||||
| Generalizado | 3 (2,2) | 0 (0) | 0 (0) | 0 (0) | 3 (4,9) | 0 (0) |
| Amiopática | 10 (7,4) | 1 (8,3) | 0 (0) | 1 (33,3) | 5 (8,2) | 1 (50) |
| Distal | 3 (2,2) | 1 (8,3) | 0 (0) | 0 (0) | 3 (4,9) | 0 (0) |
| Proximal | 119 (88,1) | 10 (83,3) | 11 (100) | 2 (66,7) | 50 (82) | 1 (50) |
| No disponible | 32 | 1 | 0 | 1 | 17 | 3 |
| Cefaloparesia al diagnóstico | (0) | (0) | (0) | (0) | (0) | (0) |
| Sí | 35 (25,2) | 2 (16,7) | 4 (44,4) | 0 (0) | 13 (18,3) | 1 (20) |
| No | 104 (74,8) | 10 (83,3) | 5 (55,6) | 3 (100) | 58 (81,7) | 4 (80) |
| No disponible | 28 | 1 | 2 | 1 | 7 | 0 |
Se presentan frecuencias (n) y porcentajes (%) basados en datos completos.
DM: dermatomiositis; DMJ: dermatomiositis juvenil; NAM: miopatía necrosante inmunomediada; MCI-IBM: miopatía por cuerpos de inclusión; PM: polimiositis; SAS: síndrome antisintetasa.
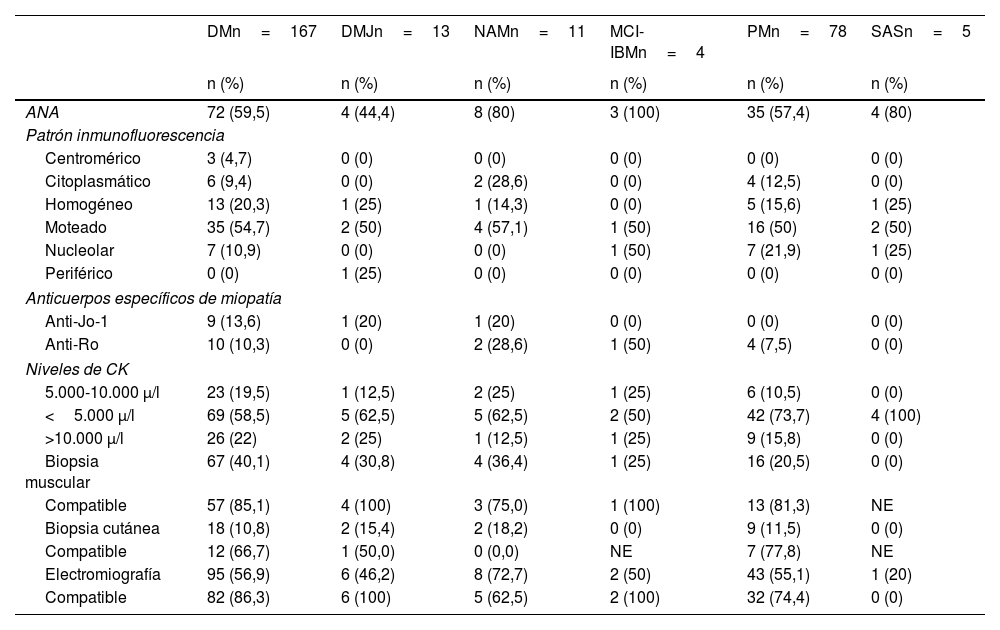
La tabla 2 presenta las características serológicas y otros laboratorios según fenotipo clínico. Los anticuerpos antinucleares (ANA) se detectaron con variabilidad en los diferentes tipos de miopatías: 59,5% en DM, 44,4% en DMJ, 80% en NAM, 100% en MCI-IBM, 57,4% en PM y 80% en SAS. Los patrones de inmunofluorescencia más frecuentes para los ANA fueron «moteado» y «homogéneo».
Características serológicas y otros laboratorios, según fenotipo de la miopatía inflamatoria idiopática (n=278)
| DMn=167 | DMJn=13 | NAMn=11 | MCI-IBMn=4 | PMn=78 | SASn=5 | |
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| ANA | 72 (59,5) | 4 (44,4) | 8 (80) | 3 (100) | 35 (57,4) | 4 (80) |
| Patrón inmunofluorescencia | ||||||
| Centromérico | 3 (4,7) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Citoplasmático | 6 (9,4) | 0 (0) | 2 (28,6) | 0 (0) | 4 (12,5) | 0 (0) |
| Homogéneo | 13 (20,3) | 1 (25) | 1 (14,3) | 0 (0) | 5 (15,6) | 1 (25) |
| Moteado | 35 (54,7) | 2 (50) | 4 (57,1) | 1 (50) | 16 (50) | 2 (50) |
| Nucleolar | 7 (10,9) | 0 (0) | 0 (0) | 1 (50) | 7 (21,9) | 1 (25) |
| Periférico | 0 (0) | 1 (25) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Anticuerpos específicos de miopatía | ||||||
| Anti-Jo-1 | 9 (13,6) | 1 (20) | 1 (20) | 0 (0) | 0 (0) | 0 (0) |
| Anti-Ro | 10 (10,3) | 0 (0) | 2 (28,6) | 1 (50) | 4 (7,5) | 0 (0) |
| Niveles de CK | ||||||
| 5.000-10.000 μ/l | 23 (19,5) | 1 (12,5) | 2 (25) | 1 (25) | 6 (10,5) | 0 (0) |
| <5.000 μ/l | 69 (58,5) | 5 (62,5) | 5 (62,5) | 2 (50) | 42 (73,7) | 4 (100) |
| >10.000 μ/l | 26 (22) | 2 (25) | 1 (12,5) | 1 (25) | 9 (15,8) | 0 (0) |
| Biopsia muscular | 67 (40,1) | 4 (30,8) | 4 (36,4) | 1 (25) | 16 (20,5) | 0 (0) |
| Compatible | 57 (85,1) | 4 (100) | 3 (75,0) | 1 (100) | 13 (81,3) | NE |
| Biopsia cutánea | 18 (10,8) | 2 (15,4) | 2 (18,2) | 0 (0) | 9 (11,5) | 0 (0) |
| Compatible | 12 (66,7) | 1 (50,0) | 0 (0,0) | NE | 7 (77,8) | NE |
| Electromiografía | 95 (56,9) | 6 (46,2) | 8 (72,7) | 2 (50) | 43 (55,1) | 1 (20) |
| Compatible | 82 (86,3) | 6 (100) | 5 (62,5) | 2 (100) | 32 (74,4) | 0 (0) |
Se presentan frecuencias (n) y porcentajes (%) basados en datos completos. Los porcentajes de biopsias y electromiografía compatible son sobre el total de pacientes en quienes se solicitó este examen.
ANA: anticuerpos antinucleares; CK: creatina fosfocinasa; DM: dermatomiositis; DMJ: dermatomiositis juvenil; NAM: miopatía necrosante inmunomediada, MCI-IBM: miopatía por cuerpos de inclusión, PM: polimiositis; SAS: síndrome antisintetasa.
Los niveles de CK mostraron variaciones significativas entre los diferentes tipos de miopatías. Por ejemplo, en DM, el 19,5% de los pacientes tuvo niveles entre 5.000 y 10.000 μ/l, el 58,5% presentó niveles menores a 5.000 μ/l y el 22% tuvo niveles mayores a 10.000 μ/l. Estas proporciones se comparan con la DMJ, donde el 12,5% tuvo niveles entre 5.000 y 10.000 μ/l, el 62,5% tuvo menos de 5.000 μ/l y el 25% más de 10.000 μ/l. En NAM, el 25% tuvo niveles entre 5.000 y 10.000 μ/l, el 62,5% menos de 5.000 μ/l y el 12,5% más de 10.000 μ/l. En MCI-IBM, se observó una distribución uniforme entre las categorías. En PM, el 10,5% tuvo entre 5.000 y 10.000 μ/l, el 73,7% menos de 5.000 μ/l y el 15,8% más de 10.000 μ/l. Finalmente, en el SAS, todos los pacientes presentaron niveles menores a 5.000 μ/l.
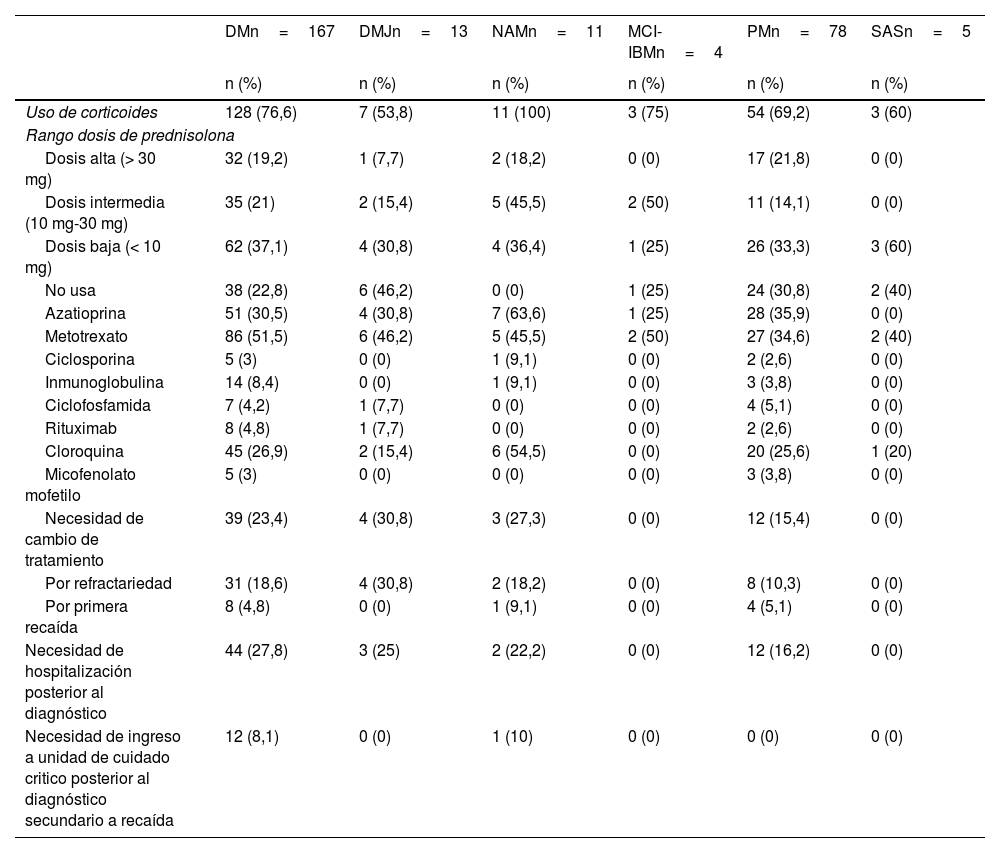
Tratamiento y respuesta al tratamientoLa tabla 3 presenta los datos sobre tratamiento y respuesta según fenotipo clínico. En cuanto al uso de corticoides, se observó una variabilidad en las dosis de prednisolona entre los diferentes tipos de miopatías. En DM, la dosis más comúnmente usada fue la intermedia (en un 37,1% de los casos), seguida por la baja (en un 21%). En relación con los inmunosupresores, la azatioprina fue el medicamento más utilizado en DM y PM. En NAM fue el metotrexato.
Tratamiento y respuesta, según fenotipo de la miopatía inflamatoria idiopática (n=278)
| DMn=167 | DMJn=13 | NAMn=11 | MCI-IBMn=4 | PMn=78 | SASn=5 | |
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| Uso de corticoides | 128 (76,6) | 7 (53,8) | 11 (100) | 3 (75) | 54 (69,2) | 3 (60) |
| Rango dosis de prednisolona | ||||||
| Dosis alta (> 30 mg) | 32 (19,2) | 1 (7,7) | 2 (18,2) | 0 (0) | 17 (21,8) | 0 (0) |
| Dosis intermedia (10 mg-30 mg) | 35 (21) | 2 (15,4) | 5 (45,5) | 2 (50) | 11 (14,1) | 0 (0) |
| Dosis baja (< 10 mg) | 62 (37,1) | 4 (30,8) | 4 (36,4) | 1 (25) | 26 (33,3) | 3 (60) |
| No usa | 38 (22,8) | 6 (46,2) | 0 (0) | 1 (25) | 24 (30,8) | 2 (40) |
| Azatioprina | 51 (30,5) | 4 (30,8) | 7 (63,6) | 1 (25) | 28 (35,9) | 0 (0) |
| Metotrexato | 86 (51,5) | 6 (46,2) | 5 (45,5) | 2 (50) | 27 (34,6) | 2 (40) |
| Ciclosporina | 5 (3) | 0 (0) | 1 (9,1) | 0 (0) | 2 (2,6) | 0 (0) |
| Inmunoglobulina | 14 (8,4) | 0 (0) | 1 (9,1) | 0 (0) | 3 (3,8) | 0 (0) |
| Ciclofosfamida | 7 (4,2) | 1 (7,7) | 0 (0) | 0 (0) | 4 (5,1) | 0 (0) |
| Rituximab | 8 (4,8) | 1 (7,7) | 0 (0) | 0 (0) | 2 (2,6) | 0 (0) |
| Cloroquina | 45 (26,9) | 2 (15,4) | 6 (54,5) | 0 (0) | 20 (25,6) | 1 (20) |
| Micofenolato mofetilo | 5 (3) | 0 (0) | 0 (0) | 0 (0) | 3 (3,8) | 0 (0) |
| Necesidad de cambio de tratamiento | 39 (23,4) | 4 (30,8) | 3 (27,3) | 0 (0) | 12 (15,4) | 0 (0) |
| Por refractariedad | 31 (18,6) | 4 (30,8) | 2 (18,2) | 0 (0) | 8 (10,3) | 0 (0) |
| Por primera recaída | 8 (4,8) | 0 (0) | 1 (9,1) | 0 (0) | 4 (5,1) | 0 (0) |
| Necesidad de hospitalización posterior al diagnóstico | 44 (27,8) | 3 (25) | 2 (22,2) | 0 (0) | 12 (16,2) | 0 (0) |
| Necesidad de ingreso a unidad de cuidado critico posterior al diagnóstico secundario a recaída | 12 (8,1) | 0 (0) | 1 (10) | 0 (0) | 0 (0) | 0 (0) |
Se presentan frecuencias (n) y porcentajes (%) basados en datos completos.
DM: dermatomiositis; DMJ: dermatomiositis juvenil; NAM: miopatía necrosante inmunomediada; MCI-IBM: miopatía por cuerpos de inclusión: PM: polimiositis; SAS: síndrome antisintetasa.
En relación con la necesidad de cambio de tratamiento por refractariedad o recaída, se observaron las siguientes proporciones según el tipo de miopatía: 46,2% en DMJ, 29,3% en DM, 23,1% en PM, 20% en SAS y 18,2% en NAM. En cuanto a la refractariedad al tratamiento, las frecuencias se presentaron en el siguiente orden: 30,8% en DMJ, 18,6% en DM, 18,2% en NAM y 10,3% en PM. En lo referente a la necesidad de hospitalización posterior al diagnóstico, las tasas fueron de 27,8% para DM, 25% para DMJ, 22,2% para NAM y 16,2% para PM.
DesenlaceEn la figura 1 se presenta la supervivencia acumulada por fenotipo clínico de miopatía. La menor mediana de supervivencia libre de recaída se observó para SAS con 3 años, seguido por NAM con 6 años y DMJ con 7,3 años. Para los restantes fenotipos no se había llegado al 50% de supervivencia acumulada a la los 10años de seguimiento. No se observaron casos de recaída entre los 4pacientes con miopatía por cuerpos de inclusión. En todos los pacientes la supervivencia libre de recaída al año se estimó en 86,3% y a 5años en 68,3%, con una mediana de tiempo libre de recaída de 13,8 años.
Análisis exploratoriosAl analizar todos los pacientes con MII incluidos, solo se identificó asociación entre positividad para anticuerpo Jo1 y tiempo a la recaída con HR=2,9 (IC 95%, 1,3-6,7). Al realizar los análisis por subgrupos de fenotipo, se encontraron características adicionales entre los pacientes con DM. En estos pacientes, el tiempo a la recaída fue más rápido entre pacientes con refractariedad (HR=2,0; IC del 95%, 1,1-4,1) y con artritis (HR=2,0; IC del 95%, 1,1-4,4).
DiscusiónEs fundamental destacar la escasez de estudios sobre miopatías en poblaciones latinoamericanas, a pesar de su significativa relevancia clínica y socioeconómica, así como su impacto en los sistemas de salud. Nuestro estudio contribuye a la literatura existente, ofreciendo datos adicionales sobre el seguimiento y las recaídas en estos pacientes [10,11].
En cuanto a las características demográficas de nuestra cohorte, se observó un predominio del sexo femenino del 70,9%, en consonancia con lo reportado en diversas cohortes [12,13]. La DM fue el fenotipo clínico más prevalente, observado en el 60,1%, seguida de la PM con un 28,1%, DMJ con un 4,7%, NAM con un 4,0%, miopatía por cuerpos de inclusión con un 1,4% y SAS con un 1,8%. Este predominio de DM y PM, ampliamente descrito en la literatura, refleja patrones similares de distribución de estos trastornos en poblaciones estudiadas a escala global. Infortunadamente, solo en una minoría de los pacientes se contó con resultados de anticuerpos miositis específicos (AME) para lograr una fenotipificación más precisa todo el espectro de las miopatías inflamatorias, con lo cual se hubiera logrado hacer una diferenciación más precisa de los subtipos de miopatías [14].
Puesto que el diagnóstico de la mayoría de los pacientes se llevó a cabo en una época en la cual la disponibilidad en el país del panel de anticuerpos específicos era muy baja, predominaba el uso de parámetros clínicos, electromiográficos y en menor medida biopsia muscular, por la dificultad en tener oportunidad en su realización, se encontró que en promedio a un 30,5% de los pacientes se les realizó biopsia de músculo, de los cuales el 72,3% fue compatible con alteraciones sugestivas de una miopatía inflamatoria. Sin embargo, la biopsia muscular puede ser negativa por afectación parcheada o el uso previo de glucocorticoides, y su uso no es indispensable ni descarta la enfermedad al ser negativa [15].
La electromiografía se realizó en promedio en el 50% de la población, con hallazgos miopáticos que apoyaron el diagnóstico en el 83,5% de los pacientes, debido a su mayor disponibilidad y sensibilidad para detectar alteraciones musculares como aumento de la actividad de inserción y la actividad espontánea con fibrilaciones, predominantemente sin alteración en la conducción nerviosa, entre otras [16]. De igual manera, se demostró un bajo uso de biopsia de piel, dado que los hallazgos clínicos son muy característicos especialmente en la DM. Sin embargo, los hallazgos histopatológicos compatibles ayudaron a descartar otras enfermedades de similar aspecto cuando se presentó la duda por parte del clínico. En nuestra cohorte de 18 biopsias llevadas a cabo en pacientes con DM, el 33,3% fue compatible con MII.
En nuestro estudio, se observó una supervivencia libre de recaída del 86,3% al año y un 68,3% al cabo de 5años, la mayoría de las veces alrededor de los primeros 3 años. Estos resultados son similares a lo reportado en otras series donde las recaídas varían entre el 35 y el 65% según el periodo observado. Por ejemplo, Agarwal et al. reportaron que, en el seguimiento de 53 pacientes con un promedio de observación de 65±43 meses, el 65% experimentó al menos una recaída y el 32% sufrió múltiples, la primera en un rango entre 3 y 69 meses, con un promedio de 17,5±14,4 meses, luego de iniciado el tratamiento y con una supervivencia libre de recaída para el primer año de alrededor del 85% y a los 5 años cercano al 30%; no obstante, se resalta que la mayoría de los eventos ocurrió en los primeros 2años. Adicionalmente, se menciona que la mayoría de las recaídas (25/33) tuvo lugar durante el desmonte del tratamiento inicial [17].
De manera similar, Ponyi et al. encontraron en su serie de 35 pacientes con seguimiento a 78 meses que el 37,1% presentó al menos una recaída, mientras solo un 2,9% mostró un curso crónico de múltiples. Llamativamente, la supervivencia libre de recaída a los 12 meses nuevamente se encontró alrededor de un 80% y a los 60 meses de un 65%, y la mayoría de las recaídas ocurrió asimismo en los primeros 2años [18]. De forma similar, en la serie de Phillips et al., que incluyó a 50 pacientes donde además se hizo la distinción entre polimiositis, DM y síndrome de sobreposición y con un seguimiento de hasta 13 años con un promedio de 2,4, 4,7 y 4,9 años, respectivamente, se encontró una frecuencia promedio de recaídas del 60%, un poco más de la mitad en los primeros 2años luego de iniciado el tratamiento, pero pueden ocurrir hasta un poco más allá de los 4 años. Un 33% tuvo lugar durante el desmonte de corticoides y el resto se presentó durante la fase estable de la enfermedad o en ausencia de tratamiento [19].
Estos datos reflejan un comportamiento similar al encontrado en nuestra cohorte, pero todos los pacientes recayeron en tratamiento; no obstante, por la naturaleza de la recolección de datos, no se puede determinar si un factor tan importante como lo es la adherencia tuvo implicación. Además, esto resalta la idea de que el periodo de los primeros 4 años tras el diagnóstico quizá sea el más crítico y del cual se debe estar atento por la probabilidad de recaída.
Cuando tomamos como referencia otros estudios con un periodo de seguimiento tan extenso como el nuestro, encontramos la serie de Janardana et al., quienes siguieron a 175 pacientes durante 12 años y reportan una supervivencia libre de recaídas de 10,08 años, la cual es moderadamente inferior a la nuestra que es de 13,8 años; sin embargo, debe aclararse que se trata de una estimación y no un dato tan preciso derivado de los IC de ambos trabajos [7].
Debido al reducido número de eventos encontrados en nuestra cohorte, fue difícil hallar los factores asociados a recaída; solo se encontró la presencia de positividad de anti-Jo1 en el contexto del SAS como factor asociado a mayor riesgo de desarrollar en el tiempo una recaída. Sin embargo, esto es importante dado que se tiene un poco más de claridad con respecto a cuáles son los factores predictores de remisión sostenida en el tiempo más que de recaída. Así, Watanabe et al. muestran que en presencia de AME, dentro de los que se incluyen el anti-MDA5, el anti-NXP2, el anti-SAE, el anti-SRP, el anti-TIF1y y los anticuerpos del SAS (no exclusivamente anti-Jo1), existe una menor probabilidad de cursar con remisión sostenida, fenómeno que observamos en nuestro estudio, aunque solo hubiésemos tenido disponible el resultado del anti-Jo1 y no del resto de los AME [20]. En nuestra cohorte se encontró una baja proporción de pacientes con datos de panel de miopatía, en parte porque la mayoría fueron diagnosticados antes del año 2022, fecha para la cual la disponibilidad de esta ayuda diagnóstica tenía un acceso limitado en la práctica. No obstante, estos hallazgos reflejan la necesidad de aumentar el uso de esta herramienta diagnóstica para una mejor caracterización de los subtipos de miopatía y establecer pronósticos más acertados, inclusive en población ya diagnosticada por criterios clínicos.
El estudio enfrentó varias limitaciones que deben considerarse al interpretar los resultados. La principal limitación es la naturaleza retrospectiva del estudio, ya que los datos se obtuvieron de fuentes secundarias por parte de personal médico entrenado a partir de registros estandarizados de una historia clínica institucional. Además, no se calculó un tamaño de muestra específico, sino que se incluyó a todos los pacientes disponibles en las bases de datos. Debido a la pérdida significativa de datos derivada de la extracción de bases de datos previas, calcular algunas asociaciones estadísticas no hubiera contribuido al propósito del estudio.
Otra limitación es la restringida disponibilidad y el alto costo de los anticuerpos específicos de miositis, lo que impidió que todos los pacientes se sometieran a estas pruebas, afectando con ello potencialmente la precisión del diagnóstico, el pronóstico y el seguimiento. Además, aunque los datos se recolectaron de diferentes centros, todos pertenecían a una misma institución, excluyendo así a otras instituciones del país que también tratan a este tipo de pacientes.
Los análisis exploratorios deben tratarse con precaución por el bajo tamaño de muestra y la cantidad limitada de eventos de recaída. Por último, la adherencia al tratamiento no se monitorizó consistentemente, lo que impide evaluar con certeza su impacto como factor de riesgo en la recaída clínica de los pacientes. Estas limitaciones subrayan la necesidad de interpretar los hallazgos con cautela y sugieren áreas para mejorar en investigaciones futuras.
ConclusionesEste estudio destaca la importancia de comprender el comportamiento a largo plazo de las miopatías inflamatorias en la población colombiana. Se observó que una proporción significativa de pacientes enfrenta recaídas frecuentes, con una mediana de tiempo libre de recaída de 13,8 meses. Los factores descritos, incluyendo características clínicas específicas y la presencia de anticuerpos específicos de miositis, son cruciales para la estratificación del riesgo y la personalización del tratamiento. Además, las recaídas durante el desmonte del tratamiento ponen de relieve la necesidad de estrategias de manejo cuidadosas y una monitorización continua. El presente estudio contribuye a la comprensión de estas enfermedades en contextos locales y subraya la necesidad de una mayor investigación para optimizar los protocolos de tratamiento y mejorar los resultados clínicos en pacientes con miopatías inflamatorias.
AutoríaJCD y NP concibieron el estudio, DFRG realizó los análisis, todos los autores contribuyeron al diseño, adquisición e interpretación de datos; PAG, AEC, MAGD, MMM, y MPR escribieron el primer borrador. Todos los autores aportaron a la revisión crítica del contenido intelectual y aprobaron la versión la versión que se presenta.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
Disponibilidad de datosLos datos son accesibles a través del autor de correspondencia previa autorización de Artmedica y el comité de ética de la investigación de seres humanos de la Universidad CES, previa valoración de las motivaciones y condiciones de uso.