Los bifosfonatos se utilizan para el manejo de enfermedades con incremento de la resorción ósea como la osteoporosis, la enfermedad metastásica ósea y la hipercalcemia maligna, entre otras patologías. En los últimos años se ha reportado que el uso de bifosfonatos intravenosos como el zoledronato y el pamidronato pueden generar efectos adversos oculares, ocasionados por una reacción de fase aguda mediada por la interleucina-6 (IL-6) y factor de necrosis tumoral alfa (TNF-α). Se reportan 2 casos (una mujer de 71años y un hombre de 67años) que entre las 24 a 72h después de recibir terapia con zoledronato presentaron una uveítis anterior.
Bisphosphonates are used in the management of diseases characterized by an increase in bone resorption such as osteoporosis, metatasic bone disease, malignant hypercalcemia among others. It has been reported that the use of IV bisphosphonates as zoledronate and pamidronate generate ocular adverse effects by an acute phase reaction mediated by an increase of interleukin 6 (IL-6) and tumoral necrosis factor (TNF-α). We present 2 cases, a woman 71years old and a 67years old man that received therapy with bisphosphonates and 24 to 72hours later they presented an anterior uveitis.
Los bifosfonatos se han utilizado en sujetos con diagnóstico confirmado de osteoporosis, enfermedad de Paget1, enfermedades neoplásicas con metástasis a hueso, hipercalcemia maligna y otras patologías, como la osteogénesis imperfecta2. En el mundo, la prescripción de esta familia de medicamentos ha aumentado; ejemplo de esto es el que el uso de terapias con bifosfonatos orales de 2002 a 2007 alcanzó 52,7 millones de fórmulas, y en bifosfonatos intravenosos, en Estados Unidos, de 2002 a 2010 se incrementó en 561.000 dosis3. En España también se ha observado un aumento en la prescripción de bifosfonatos de hasta el doble entre 1998 y 20034.
Se ha reportado que el uso de bifosfonatos intravenosos y orales pueden generar efectos adversos oculares por un aumento transitorio de citoquinas pirogénicas y un aumento de producción de interleucina-6 (IL-6) y factor de necrosis tumoral alfa (TNF-α) mediado por linfocitos T γ/δ5. Los efectos adversos más comunes son la uveítis anterior, la epiescleritis, la escleritis y la enfermedad orbital inflamatoria6.
El objetivo de esta publicación es reportar 2 casos de posibles efectos secundarios de los bifosfonatos a nivel ocular, especialmente el ácido zoledrónico.
Presentación de casosCaso #1Mujer de 71 años con presencia de una fosfatasa alcalina ósea elevada a pesar de corrección de la deficiencia de 25 OH-vitaminaD, calcemia normal, fosfatemia normal, 1,25 dihidroxivitaminaD normal, PTH normal, aporte de calcio dietario y suplementado, descartándose clínica y radiológicamente una osteomalacia y considerándose otra enfermedad metabólica ósea. Con densitometría DXA compatible con osteoporosis por criterios de la Organización Mundial de la Salud (OMS), se le prescribió ácido zoledrónico, 5mg intravenoso, para aplicar en 15min. A las 48h de haber recibido la infusión, la paciente presentó dolor ocular derecho acompañado de hiperemia conjuntival con dilatación de vasos epiesclerales. Al examen oftalmológico la paciente presentó Tyndall y Flare positivo (++), esclerosis nuclear y una disminución de la agudeza visual en el ojo derecho 20/200. En el fondo del ojo se observaron papilas ovales excavadas, una mácula con leve disminución del brillo sin presencia de focos de infección y una presión ocular de 12mmHg; se diagnosticó uveítis anterior aguda (UAA) del ojo derecho y se prescribió acetato de prednisolona, tropicamida y gotas de hidroxipropilmetil-celulosa. La sintomatología mejoró después del tratamiento en los siguientes 8días y no dejó secuelas.
Como antecedentes relevantes, la paciente presenta hipertensión arterial controlada, hipertiroidismo por bocio multinodular tóxico manejado con yodo 131mCI con respuesta exitosa, tumor neuroendocrino gástrico tipo1 con grado histológico 2, de acuerdo con la clasificación de la OMS, recidivante asociado a autoinmunidad manejado con gastrectomía subtotal; displasia monostótica con compromiso de hueso frontal que requirió manejo con osteosíntesis; manchas café con leche; y en este contexto se sospecha de síndrome de McCune-Albright, con una mutación para el gen GNAS negativa, a la cual está pendiente realizar la secuenciación completa del gen. La paciente ha presentado alergia medicamentosa a la dapsona. Como medicación concomitante la paciente estaba recibiendo levotiroxina, colecalciferol y carbonato de calcio. Después del evento adverso, la paciente fue llevada a junta médica, donde se decide controlar la disminución de la masa ósea con denosumab 60mg subcutáneo, cada 6meses, pero la paciente no aceptó; en el momento sigue bajo vigilancia estrecha con fosfatasa alcalina ósea, densitometrías y examen clínico.
Caso #2Hombre de 67 años que ingresa al servicio de urgencias por un cuadro clínico de 72h de evolución consistente en dolor ocular bilateral, ojo rojo, fotofobia sin alteración de la agudeza visual posterior a la aplicación de ácido zoledrónico (4mg) para manejo de enfermedad poliostótica asociada a carcinoma de próstata. Al examen oftalmológico reportó hiperemia conjuntival generalizada, presión intraocular de 14mmHg, Tyndall y Flare positivo (++/+), papilas redondas de bordes bien definidos y una mácula sana. Adicionalmente, reportó hipertermia de 38grados durante 2días, disnea, mialgias y artralgias con limitación del movimiento, inestabilidad para la marcha y postración que se extendió durante un mes. Se le diagnosticó una UAA bilateral y se le prescribió ciclopentolato y prednisolonaF tópicas. El paciente se recuperó en el transcurso del mes sin secuelas.
Como antecedentes relevantes el paciente presenta un carcinoma de próstata estadioiv, diagnosticado en octubre del 2014, con compromiso metastásico a hueso (columna y cadera) manejado con bloqueo hormonal, faquectomía bilateral con lentes intraoculares, desprendimiento de retina del ojo izquierdo, hipotiroidismo primario, baja masa ósea y dislipidemia. Como medicación concomitante el paciente estaba recibiendo colecalciferol y acetato de goserelina. El paciente no tiene historia de alergias a ningún medicamento. Después del evento adverso se le cambió la prescripción por denosumab, en parte por negativa del paciente a usar el medicamento de nuevo.
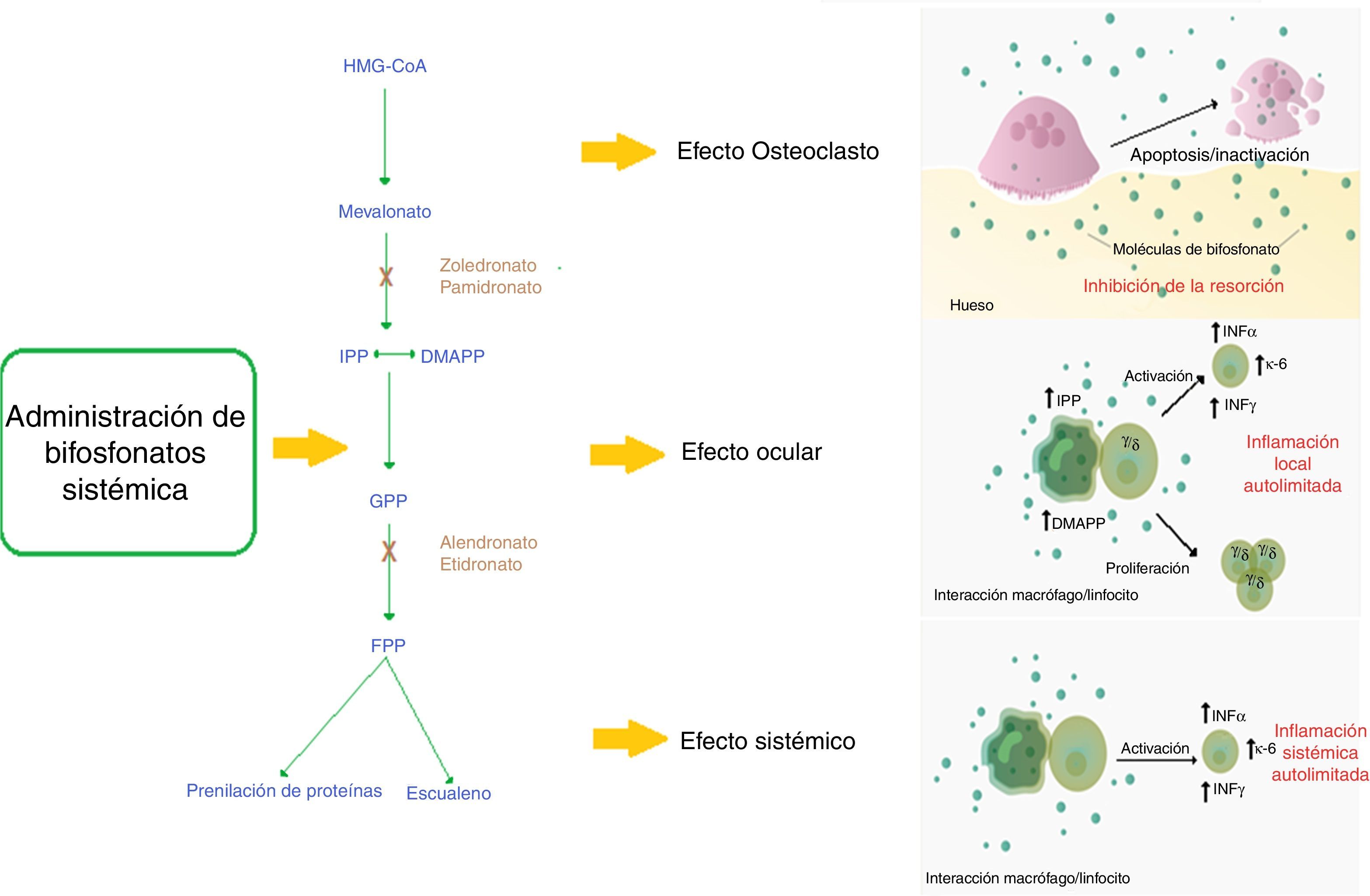
DiscusiónLos bifosfonatos disminuyen el ritmo de resorción ósea y retardan la pérdida ósea7 por 2 mecanismos: 1)Los bifosfonatos no nitrogenados tienen similitud al pirofosfato, incorporándose en la molécula de adenosina trifosfato (ATP), produciendo ATP no hidrolizable el cual se acumula inhibiendo múltiples procesos celulares dependientes de ATP y, finalmente, produciendo toxicidad. 2)Los bifosfonatos nitrogenados inhiben la enzima farnesil pirofosfato (FPP) sintasa que se encuentra involucrada en la vía del mevalonato, la cual es necesaria para la construcción del citoesqueleto y la sobrevida del osteoclasto8.
Dentro de las opciones de manejo con bifosfonatos han surgido los bifosfonatos intravenosos como una opción interesante por su posología y su potencia9-11. El ácido zoledrónico es uno de los bifosfonatos intravenosos más utilizado, acompañado de pamidronato, alendronato y risedronato, para el manejo de osteoporosis3,9. El mecanismo de acción de esta familia de bifosfonatos con grupo nitrogenado es la inhibición de la enzima FPP sintasa que se encuentra involucrada en la vía del mavelonato. Esta vía es crítica para la producción de esteroles, como el colesterol y lípidos isoprenoides. Estos esteroles son esenciales para realizar modificaciones postraduccionales a proteínas. Ejemplo de esto son las modificaciones a las proteínas unidas a guanosina-trifosfato como el Rab, Rac y Rho. Estas proteínas se encuentran implicadas en procesos centrales de regulación de actividades celulares del osteoclasto como el montaje de fibras, el plegamiento membranal y su supervivencia. La alteración de estas genera, finalmente, la apoptosis del osteoclasto y previene la resorción ósea8.
Se ha observado que en ciertos pacientes la utilización de bifosfonatos genera una reacción de fase aguda (RFA) mediada por el aumento en la producción de IL-6 y TNF-α mediado por linfocitos T γ/δ5,12. Esta reacción genera síntomas sistémicos como fiebre, mialgias y artralgias, parecidos a un episodio gripal6,11. La activación de estos linfocitos se encuentra mediada por monocitos que en presencia del medicamento acumulan isopentinil difosfato (IPP) y dimetilalil difosfato (DMAPP), activando directamente por contacto a los linfocitos γ/δ13.
A través de la RFA, los bifosfonatos pueden producir serios efectos adversos oculares14,15. Los bifosfonatos más asociados son los intravenosos, como el pamidronato y el zoledronato16; sin embargo, es importante resaltar que algunos bifosfonatos no nitrogenados, como el clodronato, también pueden generar efectos adversos oculares17. Las patologías oculares más comúnmente reportadas son la escleritis, la conjuntivitis y la uveítis14menos frecuente la blefaritis, las sinequias, la hemorragia subconjuntival33, la hipertensión intraocular, y la neuropatía óptica isquémica34. A nivel de imágenes oculares con ultrasonografía, resonancia magnética o tomografía computarizada se puede apreciar inflamación orbitaria y miositis34. Estos efectos adversos pueden afectar los ojos de forma bilateral o unilateral, generalmente con una severidad leve a moderada; hay reversibilidad sin secuelas dentro del primer mes si se realiza un manejo oportuno. Con la utilización de los bifosfonatos intravenosos la toxicidad se presenta generalmente dentro de las 48 a 72h después de la aplicación del medicamento, pero en ciertos casos el efecto adverso puede aparecer después de 2 semanas. Con el uso de bifosfonato oral la toxicidad ocular puede presentarse entre los 2 y 3 meses de uso15. Todavía no es claro por qué esta RFA afecta principalmente los ojos. Un estudio in vitro de células de retina humana (hRPE) demostró que, en presencia de alendronato y etidronato, estas células aumentan la producción de citoquinas inflamatorias como IL-6 e IL-8 y disminuyen factores angiogénicos como la eotaxina y el factor de crecimiento básico de fibroblastos (bFGF)18. Sin embargo, la plausibilidad biológica todavía no es clara y se deben hacer más estudios al respecto. Adicionalmente, se ha observado que los pacientes en terapia con bifosfonatos pueden presentar leucopenia y elevación de la proteína C reactiva (PCR), factores que pueden promover el desarrollo de estos efectos adversos (fig. 1)19.
Mecanismo de acción de bifosfonatos nitrogenados y su relación con el evento adverso ocular.
Los bifosfonatos nitrogenados sistémicos conllevan a alteración en la vía del mevalonato generando la apoptosis del osteoclasto, lo cual tiene como efecto óseo la inhibición de la resorción ósea que es el efecto terapéutico esperado.
Mecanismo presumido de la reacción de fase aguda: la utilización de bifosfonatos genera una inflamación sistémica autolimitada mediada por el aumento sérico de IL-6, IFN-γ y TNF-α. Se describe que las poblaciones celulares probablemente implicadas en el mecanismo de acción son los monocitos/macrófagos y los linfocitos T.
Mecanismo presumido del efecto adverso ocular: La utilización de los bifosfonatos nitrogenados genera la sensibilización de monocitos circulantes por la acumulación de isopentinil pirofosfato (IPP) y dimetilalil pirofosfato (DMAPP), que por un mecanismo de contacto directo activa una subpoblación de linfocitos T (γ/δ) que produce una inflamación local autolimitada en el ojo mediada por IL-6, TNF-α e IFN-γ.
DMAPP: dimetilalil pirofosfato; FPP: farnesil pirofosfato; GPP: geranil pirofosfato; HMG-CoA: 3-hidroxi-3 metilgualil coenzima A; IFN-γ: interferón gamma; IL-6: interleucina 6; IPP: isopentinil pirofosfato; TNF-α: factor de necrosis tumoral alfa.
Entre los signos y síntomas oculares encontrados en múltiples reportes los más comunes son quemosis conjuntival, hiperemia conjuntival, edema del lente, déficit en la motilidad ocular, uveítis anterior, escleritis anterior, proptosis, visión borrosa, diplopía y dolor16,20,21.
En un estudio de cohorte retrospectivo se observó que los bifosfonatos intravenosos y los orales nitrogenados pueden producir efectos adversos oculares, y se estima que la incidencia de UAA en los usuarios es de 29casos/100.000 personas, con un riesgo relativo (RR) de tener la condición por su uso de 1,45 (IC95%: 1,25-1,68)22.
Un estudio clínico prospectivo, doble enmascarado controlado con placebo se observó que la incidencia de UAA fue de 0,8% aplicando 5mg de ácido zoledrónico en pacientes posmenopáusicas (n=2.001) con baja masa ósea. Sin embargo, los autores refieren que la verdadera incidencia puede ser mucho mayor, ya que los datos obtenidos son solo de pacientes que consultaron al oftalmólogo15. Un nuevo estudio prospectivo doble enmascarado, controlado con placebo para prevención de fractura vertebral con 1.054 mujeres posmenopáusicas y en vigilancia activa de los eventos adversos oculares se encontró que la incidencia de UAA fue del 1,1% con 5 mg de ácido zoledrónico, 1/13 mujeres tenia p-ANCA positivo, 1/13 mujeres tuvo ANA positivo (sin embargo, ENA negativo) y 3/13 mujeres tuvieron HLA-27 positivo33.
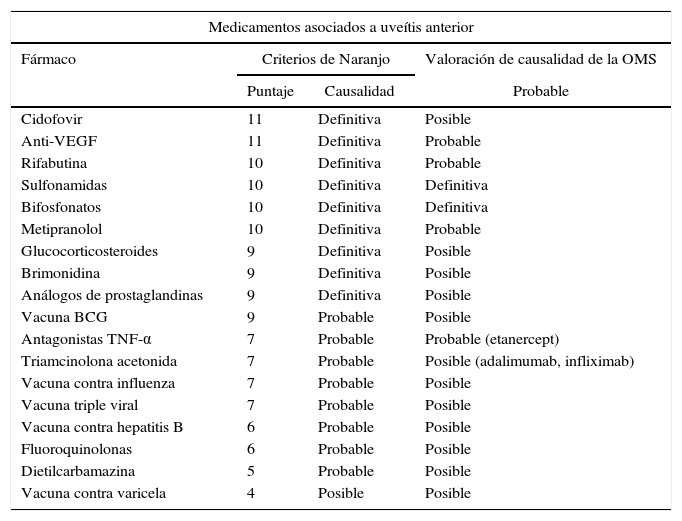
Los pacientes con osteoporosis o enfermedades poliostóticas generalmente tienen polifarmacia, y es importante resaltar que los bifosfonatos no son los únicos medicamentos que producen eventos adversos oculares. Otros fármacos con asociación reconocida son el cidofivir, agentes anti-factor de crecimiento del endotelio vascular (VEGF), rifabutina, sulfonamidas, metipranolol, brimonidina, entre otros (tabla 1)16. Por tal motivo existe la valoración por la OMS23,24 y los criterios de Naranjo et al.25 que cuantifican la probabilidad de que un efecto adverso sea por el medicamento y no por algo diferente. En estudios de uveítis inducida por fármacos se observa que los bifosfonatos son de los pocos medicamentos que tienen un puntaje de 10 en la escala de Naranjo y cumplen con todos los requisitos de causalidad de la OMS, demostrando su asociación definitiva al efecto adverso16,19. En los 2 casos expuestos no se pudo cumplir con el criterio de la exposición múltiple al medicamento debido a que no se repitió la dosis de la medicación; sin embargo, el patrón descrito y la ausencia de otras explicaciones sugieren que la uveítis se relacionó con el uso de ácido zoledrónico, sin desconocer que los pacientes tienen otras condiciones que favorecen el riesgo de tener este efecto adverso.
Medicamentos con causalidad confirmada de uveítis anterior tanto por criterios de Naranjo como por valoración de causalidad por la OMS
| Medicamentos asociados a uveítis anterior | |||
|---|---|---|---|
| Fármaco | Criterios de Naranjo | Valoración de causalidad de la OMS | |
| Puntaje | Causalidad | Probable | |
| Cidofovir | 11 | Definitiva | Posible |
| Anti-VEGF | 11 | Definitiva | Probable |
| Rifabutina | 10 | Definitiva | Probable |
| Sulfonamidas | 10 | Definitiva | Definitiva |
| Bifosfonatos | 10 | Definitiva | Definitiva |
| Metipranolol | 10 | Definitiva | Probable |
| Glucocorticosteroides | 9 | Definitiva | Posible |
| Brimonidina | 9 | Definitiva | Posible |
| Análogos de prostaglandinas | 9 | Definitiva | Posible |
| Vacuna BCG | 9 | Probable | Posible |
| Antagonistas TNF-α | 7 | Probable | Probable (etanercept) |
| Triamcinolona acetonida | 7 | Probable | Posible (adalimumab, infliximab) |
| Vacuna contra influenza | 7 | Probable | Posible |
| Vacuna triple viral | 7 | Probable | Posible |
| Vacuna contra hepatitis B | 6 | Probable | Posible |
| Fluoroquinolonas | 6 | Probable | Posible |
| Dietilcarbamazina | 5 | Probable | Posible |
| Vacuna contra varicela | 4 | Posible | Posible |
Tomado y modificado de Cordero-Coma et al.16.
En los reportes de casos descritos en la literatura, un importante número de sujetos que presentan eventos adversos oculares asociados a bifosfonatos tienen comorbilidades de base autoinmune como la diabetes mellitus tipo 1, la espondilitis anquilosante, la enfermedad intestinal inflamatoria o la sarcoidosis22,26,27. Se han descrito como factores de riesgo para la RFA los siguientes: edad de 60 a 70años, dolor de espalda activo, ser fumador, utilización de calcitonina, ser un asiático no japonés o de las islas del Pacífico y la utilización previa de bifosfonatos27. Sin embargo, no se ha descrito la posible asociación entre la autoinmunidad y la uveítis. Es importante, entonces, realizar estudios poblacionales para definir si una enfermedad autoinmune, variantes polimórficas del complejo mayor de histocompatibilidad HLA o las citoquinas que participan en la cascada inflamatoria constituyen factores de riesgo para presentar efectos adversos oculares. En nuestros 2 casos, los sujetos están entre los 60 y 70años y tienen hipotiroidismo, que es una enfermedad generalmente autoinmune.
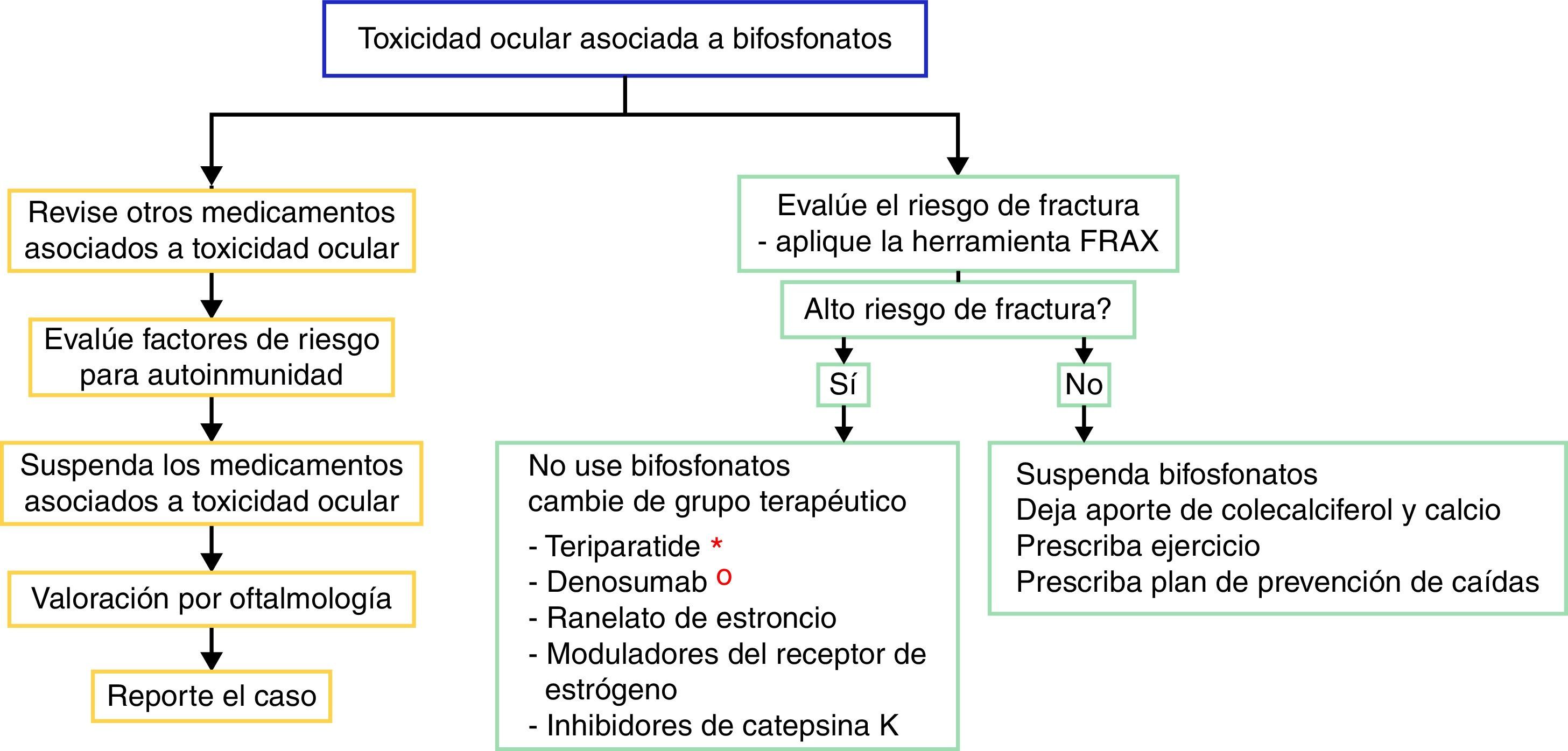
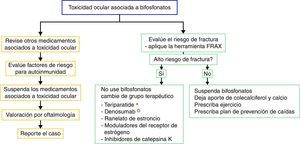
No existe evidencia sólida relacionada con el manejo de un evento adverso ocular debido a que los reportes son muy escasos; sin embargo, recomendamos educar al paciente ante los posibles efectos secundarios oculares y discutir el cambio de mecanismo de acción del fármaco para la osteoporosis, por la posible recidiva de los efectos secundarios oftalmológicos. Sin embargo, no todos los pacientes que se re-exponen al fármaco presentan recidiva de la alteración oftalmológica28. En caso de suspender el uso de bifosfonato, la alternativa es cambiar de grupo terapéutico si el paciente tiene un riesgo de fractura alto. En la actualidad se dispone de varias opciones, como los análogos de la hormona paratiroidea (teriparatida), que son útiles en el paciente con fracturas por uso de corticoides; el denosumab (anticuerpo contra el ligando RANK-L), que es una opción en el paciente con cáncer; el ranelato de estroncio, los moduladores del receptor de estrógenos y los inhibidores de la catepsinaK29. Los pacientes con riesgo de fractura bajo se pueden manejar con aporte de colecalciferol y calcio dietario o suplementado acompañado de ejercicio y un plan de prevención de caídas.
Para el manejo del efecto adverso ocular se recomienda suspender el tratamiento, revisar si el paciente tiene medicamentos concomitantes asociados con toxicidad ocular, evaluar los factores de riesgo (entre ellos la autoinmunidad) y realizar la evaluación oftalmológica y el manejo sintomático con esteroides tópicos y ciclopléjicos, por unas semanas, para controlar la inflamación y mejorar la visión (fig. 2). En algunos casos severos se plantea la necesidad de utilizar esteroides sistémicos o agentes inmunosupresores basados en la severidad del proceso inflamatorio16.
Algoritmo propuesto para la evaluación del efecto adverso ocular y para el manejo terapéutico de pacientes con alto o bajo riesgo de fractura que presentan efectos adversos oculares a los bifosfonatos. En el flujograma izquierdo se recomienda establecer causalidad y en el flujograma derecho se recomienda evaluar el riesgo de fractura y definir si requiere terapia activa para osteoporosis o la enfermedad que amerita el uso de bifosfonatos.
* En el contexto de osteoporosis por glucocorticoides se plantea el uso de teriparatida.
° En el contexto de enfermedad poliostótica en tumor sólido se plantea el uso de denosumab.
La seguridad y la eficacia de la terapia con bifosfonatos están bien documentadas11,30-32. Sin embargo, el aumento del uso de bifosfonatos intravenosos y su posible asociación con efectos adversos oculares reversibles requiere de estudios poblacionales al respecto y la evaluación prospectiva de los casos reportados para definir el mejor manejo y las secuelas a largo plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación al momento de la redacción y publicación del manuscrito.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses al momento de la redacción del manuscrito.