La perniosis lúpica es una variante del lupus crónico que se manifiesta con poca frecuencia, su aparición puede ser esporádica o hereditaria, asociada con una mutación autosómica dominante, en tanto que su diagnóstico es clínico e histopatológico. Se reporta el caso de una mujer con lupus eritematoso sistémico con manifestación de perniosis lúpica y compromiso ungueal, a pesar del uso de antimaláricos e inmunomoduladores.
Chilblain lupus is a rarely manifested variant of chronic lupus. Its appearance can be sporadic or hereditary associated with an autosomal dominant mutation. The diagnosis is clinical and histopathological. The case is presented of a patient with systemic lupus erythematosus presenting with chilblain lupus and nail involvement, despite the use of antimalarials and immunomodulators.
La perniosis lúpica es una forma poco frecuente de presentación del lupus eritematoso cutáneo (LEC). La primera descripción la realizó Jonathan Hutchinson en 1888, luego de observar lesiones en manos, pies y orejas, secundarias a la exposición a bajas temperaturas en pacientes con lupus eritematoso1,2. En series de LEC la perniosis lúpica correspondió a entre el 3 y el 11% de los casos, mientras que en el seguimiento a largo plazo cerca del 18% cumplió criterios de lupus eritematoso sistémico (LES)2.
Los términos pernio, perniosis, eritema pernio y sabañón describen lesiones de piel que aparecen después de la exposición al frío sin una enfermedad subyacente asociada, y corresponden al término anglosajón chilblain3. El lupus eritematoso tiene una variante clínica de aspecto similar al eritema pernio (perniosis lúpica), pero se diferencia con la histología3. Cabe aclarar la confusión semántica con el lupus pernio, que es una manifestación cutánea de sarcoidosis y no tiene relación con el lupus eritematoso o con los cambios de temperatura3,4. Hasta el 2008 se habían reportado 70 casos de perniosis lúpica, la mayoría con presentación esporádica, pero hay descripción de asociación genética en dos familias5.
Presentación del casoUna mujer de 57 años consultó a urgencias por cuadro de 3 meses de evolución, de aparición simultánea de lesiones eritematosas, nodulares y dolorosas en las manos, las orejas y el cuero cabelludo, de aumento progresivo en tamaño durante el último mes, y con desarrollo de úlceras en algunas de las lesiones. Asociado con esto presentó astenia, adinamia, caída del cabello, xeroftalmia, poliartralgias, edema asimétrico de miembros inferiores y episodios de fiebre de hasta 39° C. Tiene diagnóstico de LES, artritis reumatoide, síndrome nefrótico y enfermedad renal crónica estadio 2, secundario a nefropatía lúpica clase IV. La paciente, que sigue un tratamiento crónico con cloroquina fosfato 250 mg/día y losartán 50 mg/día, consultó el mes anterior a Dermatología por la sintomatología descrita y allí le adicionaron hidrocortisona al 1% tópica, micofenolato mofetilo 250 mg/día y prednisolona 5 mg/día.
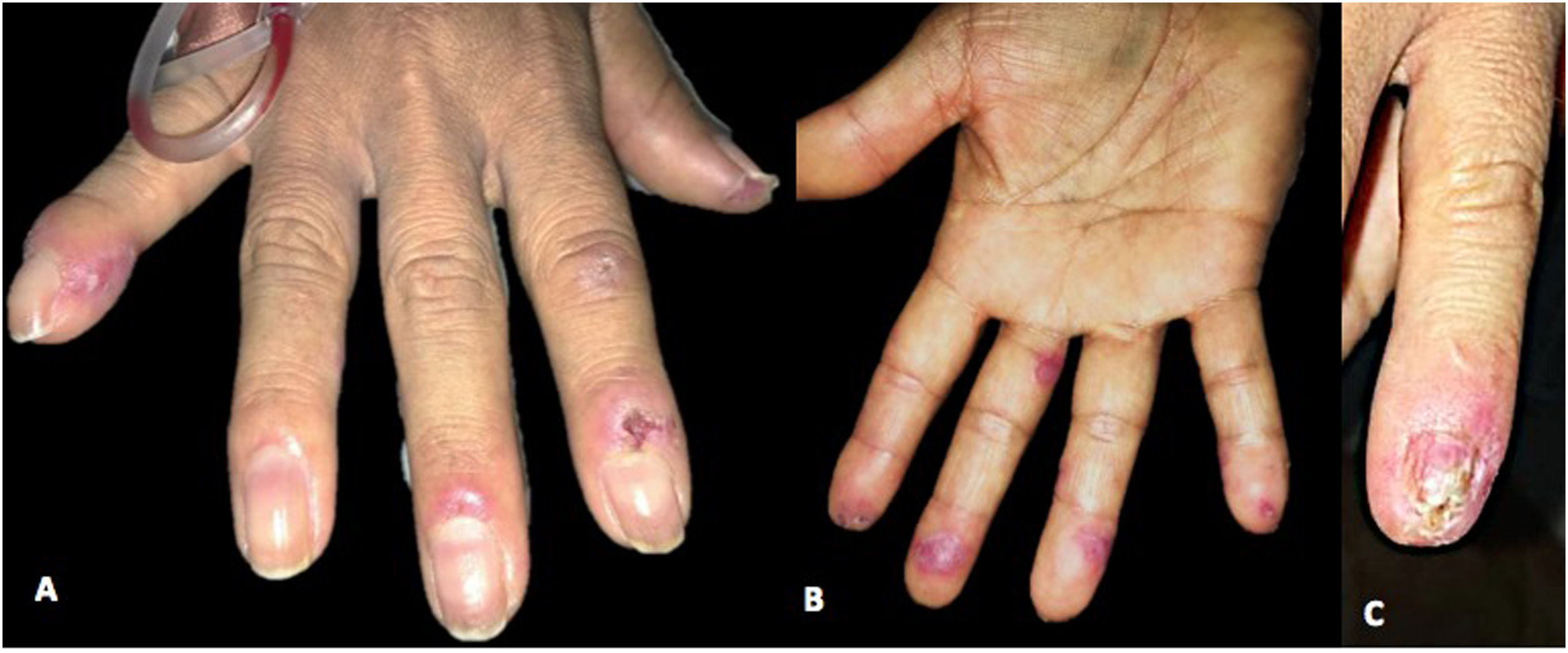
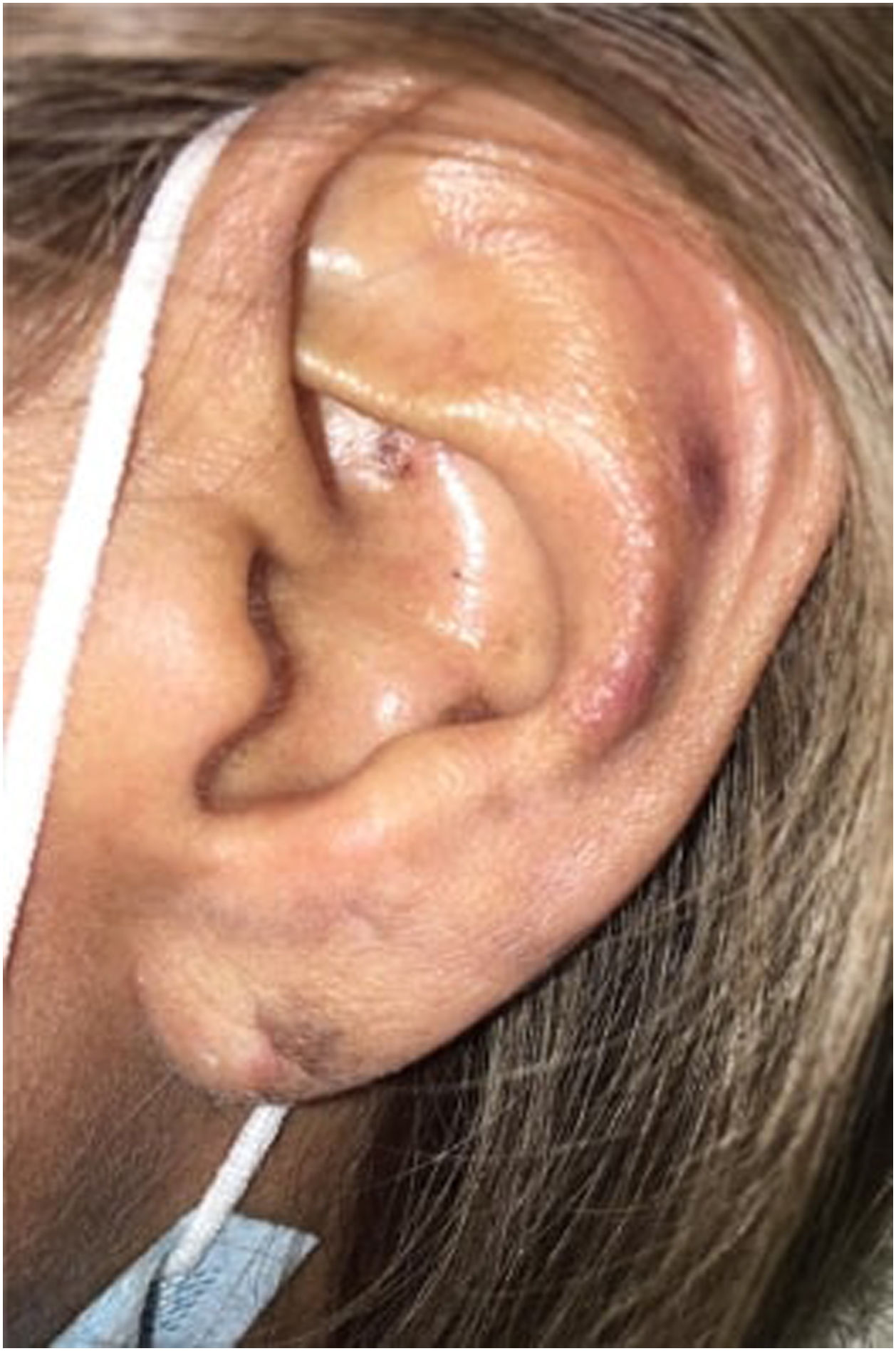
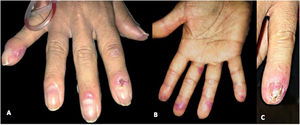
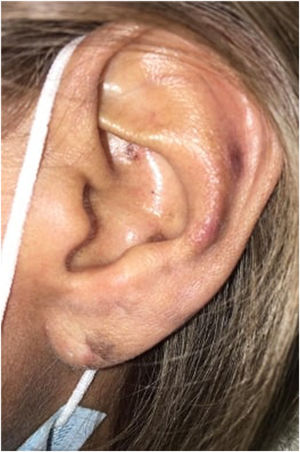
Al examen físico, la paciente presentó placas eritematovioláceas de bordes irregulares bien definidos en región frontal, parietal izquierda, occipital de cuero cabelludo y oreja izquierda, pulpejos y pliegue ungueal proximal de ambas manos y pulpejos en los dedos de los pies. Además, presentó una ulceración en configuración estrellada sobre el pliegue ungueal proximal del segundo dedo de la mano derecha, cambios de onicólisis y distrofia de lámina ungueal en el quinto dedo de la mano izquierda, así como múltiples hemorragias en astilla en la lámina ungueal de todos los dedos de ambas manos y un nódulo indurado eritematovioláceo en la oreja izquierda (figs. 1 y 2).
A y B) En pliegues ungueales proximales, laterales, pulpejos y cara palmar de mano izquierda, placas eritematovioláceas de bordes irregulares mal definidos. C) En quinta uña de mano izquierda, sobre pliegue ungueal proximal, placa eritematoviolácea, distrofia ungueal del 100% de la lámina ungueal, onicólisis distal y hemorragias en astilla.
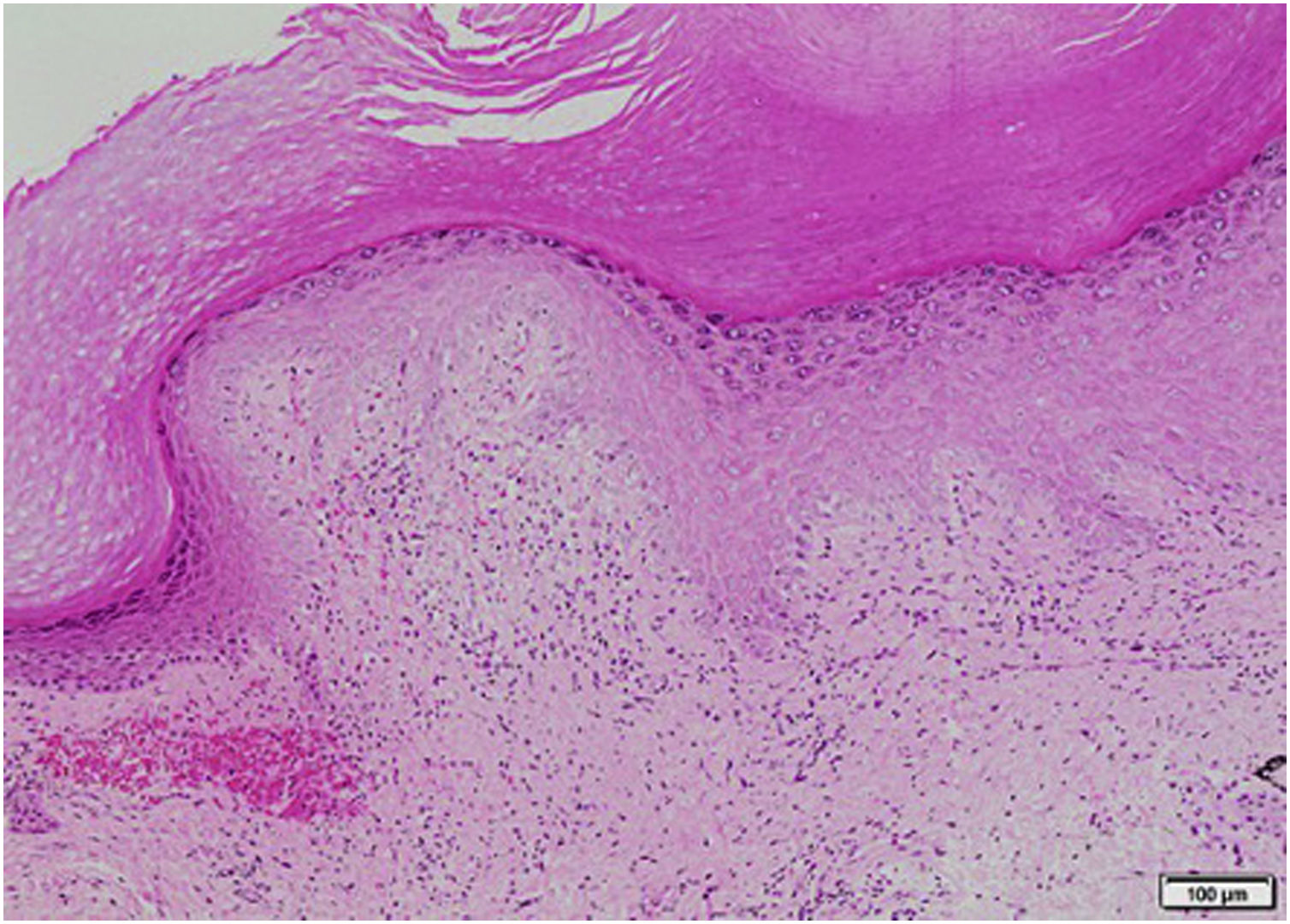
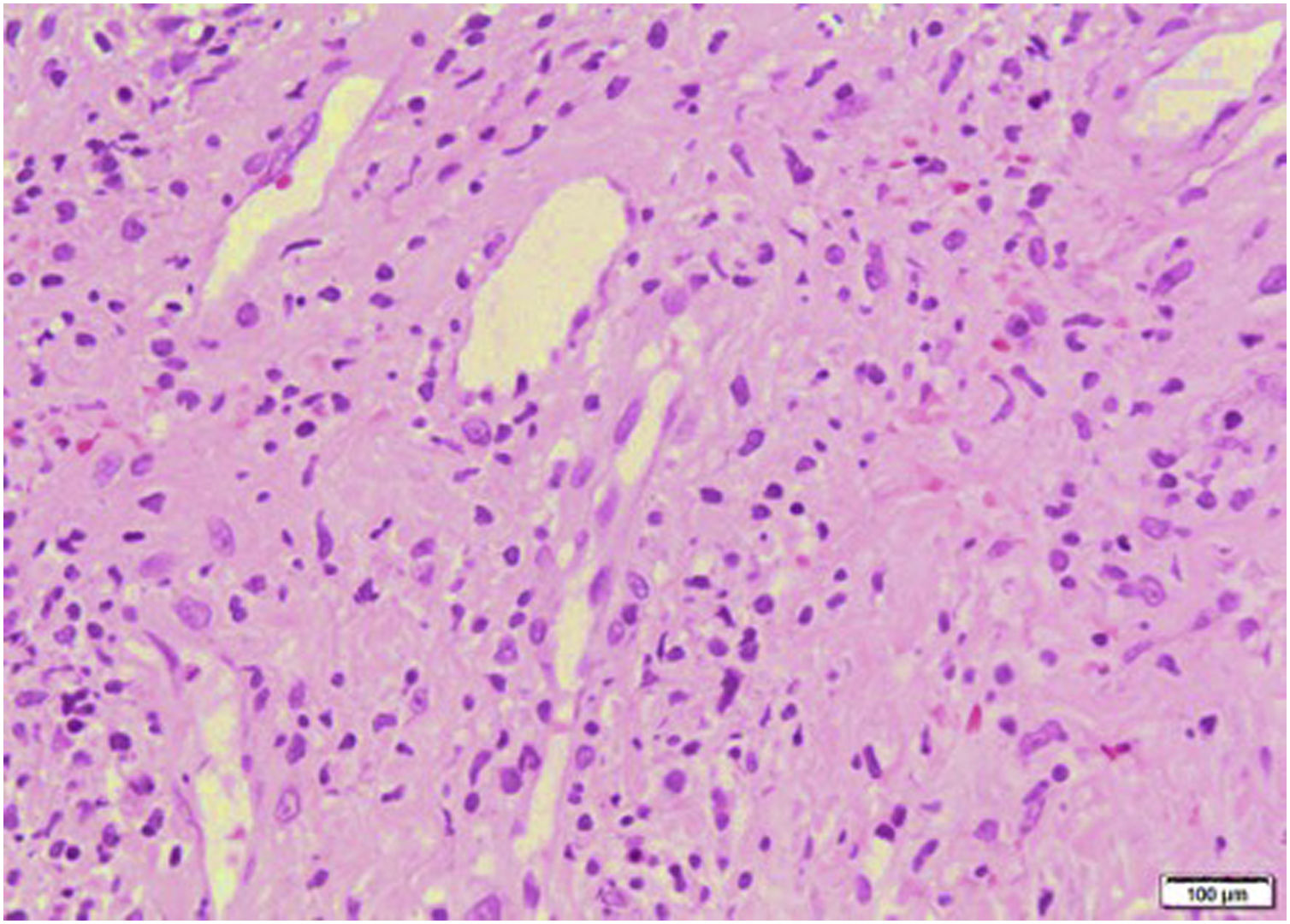
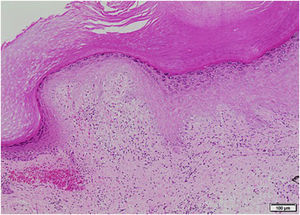
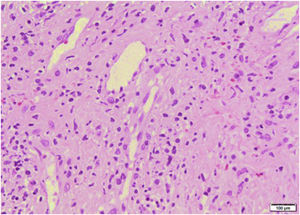
Los resultados paraclínicos se pueden apreciar en la tabla 1. El análisis Doppler de miembros inferiores demostró una trombosis venosa profunda aguda en vena poplítea izquierda. Se realizaron paraclínicos para síndrome antifosfolípidos, con resultados negativos, y se inició anticoagulación con enoxaparina y posteriormente warfarina. Se tomaron biopsias de piel de oreja y mano izquierda, que reportaron hallazgos sugestivos de daño de interfase dermoepidérmica e infiltrados linfoides perivasculares (figs. 3 y 4). La inmunofluorescencia directa demostró depósitos granulares de IgM, C3 y C1Q en la membrana basal. Los hallazgos clínicos e histológicos fueron compatibles con perniosis lúpica, de acuerdo con los criterios de la Clínica Mayo6. Se aumentó la dosis de prednisolona oral a 1 mg/kg/día, con adecuada respuesta y remisión de las lesiones cutáneas.
Exámenes de laboratorio
| Hemograma | Leucocitos: 2.500/mm3, neutrófilos: 1.400/mm3 (55%), linfocitos: 800/mm3 (33%), hemoglobina: 13,3 g/dL, VCM: 91,3 fL, HCM: 30,9 pg, plaquetas: 129.200/mm3 |
| Función renal | Creatinina 0,79 mg/dL, nitrógeno uréico 16,7 mg/dL, uroanálisis: pH 7,0, densidad 1.015, proteínas negativas, leucocitos negativos, sangre negativa |
| Electrolitos | Sodio,137 mmol/L; potasio, 3,7 mmol/L; cloro, 101 mmol/L; calcio no ionizado, 8,4 mmol/L |
| Perfil autoinmune | ANAS: 1/320 patrón homogéneo, ENAS: negativosComplemento: C3 43,4 mg/dL (88-165 mg/dL), C4 10,1 mg/dL (14-44 mg/dL)Anticoagulante lúpico: negativoAnticuerpos Ig G anti-β2 glicoproteína: negativoAnticuerpos Ig M anti-β2 glicoproteína: negativoAnticuerpos Ig G anticardiolipinas: negativoAnticuerpos Ig M anticardiolipinas: negativoCrioaglutininas: negativo |
| Otros | BNP: 59,8 pg/mL CK: 36 u/L, albúmina 3,2 g/dL, hemocultivos aerobios y anaerobios: negativos |
ANAS: Anticuerpos antinucleares; ENAS: Anticuerpos antinucleares extraíbles del núcleo; Ig: Inmunoglobulina; BNP: Péptino natriurético atrial; CK: Creatina fosfocinasa.
Biopsia de piel en palma de mano. En la dermis superficial tuvo edema, telangiectasias y extravasación de eritrocitos. Se identificaron infiltrados linfoides perivasculares con linfocitos que permeaban la pared de vasos sanguíneos y evidencia de reactividad endotelial, pero sin necrosis. Tinción hematoxilina-eosina.
El lupus eritematoso está asociado con gran variedad de patologías cutáneas. El espectro del LEC es heterogéneo, por lo que Gilliam et al. proponen una clasificación basada en la estratificación de pacientes con características clínicas e histológicas en común y que expresen respuesta similar al tratamiento7. Dicha clasificación comprende 3 grupos morfológicos: agudo, subagudo y crónico, siendo el último el de menor relación con el compromiso sistémico de la enfermedad8. Dentro del grupo de LEC crónico se encuentran el lupus discoide, el tumidus, el hipertrófico, el mucoso, el profundo y la perniosis lúpica9–11. No obstante, la clasificación de Gillian tenía varias limitaciones, como que las lesiones de lupus cutáneo crónico podrían no ser clasificadas histológicamente en ninguno de los tipos morfológicos. Debido a ello, Lipsker planteó una nueva clasificación que dividía las manifestaciones clínicas del lupus en específicas y no específicas11.
Las características histológicas de las lesiones específicas de lupus son la presencia de dermatitis de interfase, en presencia de vacuolización y necrosis de los queratinocitos basales, engrosamiento de la membrana basal, incontinencia de pigmento e infiltrado linfocítico en la unión dermoepidérmica7. Los signos específicos de LEC se subdividen según el nivel de compromiso histológico. El lupus cutáneo agudo, el subagudo, el crónico y el vesiculoampolloso se caracterizan por compromiso dermoepidérmico. El lupus tumido, el infiltrado linfocítico de Jessner y la mucinosis reticular eritematosa y pápulo-nodular secundaria a lupus eritematoso se caracterizan por compromiso dérmico, mientras que la paniculitis lúpica se caracteriza por compromiso del tejido celular subcutáneo11,12.
Los signos no específicos de lupus también se clasifican según su patogenia: por ejemplo, signos indicativos de vasculopatía trombótica como las pápulas de Degos, la livedo racemosa, la atrofia blanca, la púrpura, las hemorragias en astilla, la necrosis cutánea, el anetoderma y la tromboflebitis; y manifestaciones neutrofílicas cutáneas de lupus eritematoso, como el lupus ampolloso, la vasculitis urticarial de lupus eritematoso y las dermatosis neutrofílicas (incluyendo la pustulosis amicrobiana de los pliegues, la dermatosis urticarial neutrofílica, el síndrome de Sweet y el pioderma gangrenoso). Por último, hay patologías con significado patogénico incierto, como los son los nódulos reumatoideos, la dermatitis granulomatosa intersticial y los fibromas eruptivos11,12.
La perniosis lúpica es una forma infrecuente de LEC crónico que se caracteriza por lesiones en áreas acrales expuestas a bajas temperaturas. Dichas lesiones ocasionan vasoconstricción y lesión microvascular10, la mayoría de los casos son esporádicos y afecta con mayor frecuencia a mujeres de mediana edad13. Se ha descrito asociación con bajo índice de masa corporal y con anticuerpos anti-Ro positivos13–15. La fisiopatología no está totalmente esclarecida, pero es de naturaleza autoinmune y se relaciona con alteración de la microcirculación, estasis y oclusión vascular precipitada por bajas temperaturas. Hay hipótesis sobre la migración del antígeno Ro desde el núcleo hacia la membrana del queratinocito por el estímulo físico del frío14,15.
Se han descrito casos familiares en los cuales la perniosis lúpica es conocida como una genodermatosis con patrón de herencia autosómico dominante16. Se incluyen genes causales que codifican nucleasas intracelulares como TREX1, SAMHD1 y STING3,16, que producen la activación del interferón tipo 1, el cual, por su parte, conlleva el reconocimiento inmune de ácidos nucleicos no metabolizados5,16,17. En el patrón hereditario, las lesiones también son inducidas por el frío, asociadas con artralgias, ANAS positivos o linfopenia3.
Las lesiones clínicas características son máculas, placas y nódulos eritematovioláceos, dolorosos y usualmente en áreas expuestas, como el dorso de la mano y los pulpejos de los dedos de manos o pies, y raramente en la punta nasal o las orejas5. Puede haber erosiones centrales o ulceraciones9,10. De forma infrecuente se puede observar hiperqueratosis con fisuras en plantas y palmas14. Se han descrito casos de compromiso de la uña con producción de distrofia o pérdida de lámina ungueal que indican cambios de cronicidad, como lo observado en el caso clínico aquí descrito14. Además, los pacientes con perniosis lúpica pueden presentar hipergammaglobulinemia (2/3 de los casos), elevación de factor reumatoideo, anticuerpos antinucleares (ANA) y anti-Ro5,10. Existe asociación con el aumento de glóbulos rojos, lo que podría ocasionar viscosidad y estasis sanguínea, y en estudios con angiorresonancia magnética se ha demostrado disminución de perfusión en las falanges de los casos de perniosis lúpica5.
Los criterios diagnósticos para esta entidad propuestos por Su et al.6 (tabla 2) incluyen la presencia de dos criterios mayores y al menos un criterio menor. La histopatología de la perniosis lúpica se caracteriza por atrofia epidérmica, vacuolización de interfase, y en la dermis edema papilar e infiltrado mononuclear perivascular10. La inmunofluorescencia directa muestra depósito de IgM, IgA o C3 en la unión dermoepidérmica y depósitos perivasculares de C3 y fibrinógeno5,16. La presencia de distribución perianexial ecrina de infiltrado linfocitario se observa en la forma idiopática no relacionada con lupus y ayuda a la diferenciación3. El caso reportado tiene hallazgos histológicos característicos y cumple criterios diagnósticos6 de perniosis lúpica.
Criterios diagnósticos de la Clínica Mayo6
| Paciente reportado | ||
|---|---|---|
| Criterios mayores | Lesiones acrales de la piel inducidas por la exposición a frío o a descensos de temperatura | Presentó lesiones acrales (manos, pies y orejas) inducidas por la exposición a frío |
| Evidencia de lesiones en piel secundarias a lupus eritematoso, determinado por evaluación histopatológica (hiperqueratosis, membrana basal vacuolada e infiltrado de predominio linfocítico perivascular o perianexial; en casos crónicos, epidermis atrófica y engrosamiento de membrana basal) o inmunofluorescencia directa(depósito granular de IgM, C3 o IgG en la membrana basal) | La biopsia de piel fue compatible con atrofia epidérmica con daño vacuolar de la interfase dermoepidérmica y disqueratositos. Además, presencia de edema e infiltrados linfoides perivasculares con linfocitos permeando la pared de vasos sanguíneos, sin evidencia de necrosis | |
| Criterios menores | Coexistencia de lupus eritematoso sistémico u otras lesiones de piel de lupus eritematoso discoide | Contaba con ANAS positivos en 1:320 diluciones, patrón moteado, complemento consumido y antecedente de nefropatía lúpica confirmada por biopsia renal |
| Respuesta a tratamiento para lupus eritematoso | Presentó adecuada respuesta a prednisolona a dosis de 1 mg/kg/día | |
| Pruebas negativas de crioglobulinas y aglutininas frías | Resultado negativo para crioglobulinas |
El tratamiento de la perniosis lúpica no se encuentra estandarizado. La primera línea de tratamiento descrita para LEC localizado son los esteroides tópicos de alta potencia, como el clobetasol al 0,05%, y sumado a esto se deben tomar medidas físicas para evitar el frío9,18. En algunos casos se han obtenido resultados en pacientes tratados con bloqueadores de canales de calcio, como el nifedipino a 60 mg/día, para contrarrestar el fenómeno de vasoconstricción5,18. Se puede considerar la utilización de cloroquina o hidroxicloroquina, pero la respuesta solo se logra aproximadamente en uno de cada 3 pacientes18,19. Otra alternativa de tratamiento es el uso de pimecrolimus o tacrolimus tópico. Se han reportado casos de inducción de mejoría de las lesiones con el uso de micofenolato mofetilo a dosis de 2-3 g/día en pacientes con empeoramiento clínico, a pesar de uso de hidroxicloroquina, prednisona y otros agentes tópicos20,21. En caso de lesiones extensas o refractarias a tratamiento tópico, se sugiere el uso de esteroides sistémicos, cloroquina o hidroxicloroquina5,9. En el caso reportado la dosis de micofenolato mofetilo fue menor a la sugerida20,21, y esto se asoció con la progresión de las lesiones, por lo que el tratamiento de elección fue prednisolona a 1 mg/kg al día para lograr remisión clínica.
Los medicamentos biológicos han sido utilizados para el manejo del lupus eritematoso. En pacientes con LES la proporción de células B precursoras, transicionales, de memoria y plasmoblastos está aumentada, así como la expresión de moléculas coestimuladoras como el CD86 en células CD19+22–25. Estas células tienen un rol central en la fisiopatología, por la pérdida de tolerancia celular y la producción de anticuerpos contra los complejos nucleares DNA y nucleosoma26. El rituximab es un anticuerpo monoclonal quimérico contra la molécula CD20 en la superficie de los linfocitos B e induce respuesta en pacientes con nefritis lúpica y en manifestaciones no renales refractarias al tratamiento sistémico27–29. Vital et al. realizaron un estudio prospectivo con 26 pacientes, en el cual se demostró una respuesta del 42,6% en pacientes con lupus cutáneo agudo29. Sin embargo, no hubo respuesta en pacientes con lupus cutáneo crónico, y, paradójicamente, nueve pacientes sin manifestaciones cutáneas desarrollaron en el seguimiento lupus cutáneo subagudo después de la administración del rituximab29. Esto podría sugerir los diferentes roles de la célula B en la patogénesis de los distintos tipos de lupus25,27–29.
Otro medicamento biológico utilizado para el tratamiento de las manifestaciones cutáneas de lupus es el belimumab, un anticuerpo monoclonal que inhibe la citoquina inmunomoduladora, la cual estimula la diferenciación y la supervivencia de linfocitos B (BLyS o BAFF)25. Un análisis combinado de dos ensayos de fase III de belimumab (BLISS-52 y BLISS-76) a dosis de 1 y 10 mg/kg aplicado los días 0, 14 y 28, y después cada 4 semanas, en comparación con la terapia estándar, demostró mejoría de manifestaciones mucocutáneas (rash, úlceras mucosas y alopecia) en pacientes con LES27. La definición de mejoría fue la recuperación mayor al 50% de las lesiones y el descenso de la dosis esteroides en un 25%, y se logró en 43 y 52% de los pacientes con manifestación mucocutánea, a los 3 y 6 meses, respectivamente28. Otro estudio reciente de 50 pacientes con lupus eritematoso sistémico con indicación de manejo con belimumab a dosis de 10 mg/kg halló una probabilidad a 12 meses de lograr estado de baja actividad de la enfermedad de 58,1% y de remisión de 37,1%30. En este último, el 10% de la población tenía lupus cutáneo activo en la variante de eritema pernio30. Para la perniosis lúpica familiar con mutación heterogénea de gen STING se ha descrito el tratamiento con tofacitinib, un inhibidor JAK sintético de pequeña molécula que suprime la señalización del interferón 1, con lo que se ha reportado disminución del dolor y lesiones en un esquema de dosis de 5 mg cada 12 horas por 17 días17.
ConclusiónSe reportó un caso en el cual el diagnóstico y el tratamiento de LES precedieron a la manifestación cutánea de perniosis lúpica con compromiso ungueal. La paciente respondió favorablemente al manejo con esteroides sistémicos y se logró la remisión de las lesiones cutáneas en el seguimiento. Aunque la perniosis en lupus eritematoso no responde bien a los antimaláricos, las medidas físicas de evitar el frío, el uso de bloqueadores de canales de calcio, esteroides tópicos o sistémicos pueden mostrar buenos resultados. En casos refractarios se pueden considerar otros inmunomoduladores, como es el caso del micofenolato mofetilo o biológicos.
Consideraciones éticasLos autores declaran que este trabajo recibió la aprobación del Comité de Investigaciones y Ética Institucional de la Facultad de Medicina de la Pontificia Universidad Javeriana. Asímismo, los autores confirman que se obtuvo el consentimiento informado de los pacientes y que en todo momento han preservado la confidencialidad de sus datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.