El virus linfotrópico humano de células T tipo I (HTLV-1) es un retrovirus que causa impacto en la salud del ser humano debido al tropismo para infectar a linfocitos T. Está distribuido mundialmente, pero es más prevalente en regiones tropicales. La mayoría de las personas afectadas permanecen asintomáticas, sin embargo, al manifestarse puede causar complicaciones como uveítis, mielopatía y leucemia, entre otras. Su diagnóstico se hace mediante la determinación de anticuerpos anti-HTLV y prueba confirmatoria (Western Blot o carga proviral). No tiene tratamiento específico, las medidas están dirigidas a la prevención y el manejo de las afecciones secundarias. Se describen tres pacientes en edad pediátrica con diagnóstico de infección por HTLV-1 y manifestaciones autoinmunes.
HTLV-1 is a retrovirus that has an impact on human health due to its T-lymphocyte tropism. It occurs worldwide, but is more prevalent in tropical regions. Although most infected individuals will remain asymptomatic, the infection may manifest with complications such as uveitis, myelopathy, and leukaemia, among others. The diagnosis is achieved by the detection of anti-HTLV antibodies and a confirmatory test (Western Blot or proviral load). Although there is no specific treatment, medical treatments are aimed towards the management of secondary diseases. Three cases are described of paediatric patients diagnosed with HTLV-1 infection and associated autoimmune manifestations.
El virus linfotrópico de células T del humano tipo I (HTLV-1 por sus siglas en inglés), es un retrovirus perteneciente a la familia Retroviridae y a la subfamilia Oncoviridae que tiene la particularidad de infectar al ser humano1. Uno de los primeros casos descritos ocurrió en 1980. En aquella ocasión se documentó el caso de un varón con linfoma de células T cutáneas, asociado a la presencia de partículas de HTLV-1, en la Unidad de Oncología de la Administración de Veteranos del Instituto Nacional de Cáncer de los Estados Unidos2.
En la actualidad también existen otros tres tipos del virus linfotrópico de células T del humano, conocidos como HTLV tipos II, III y IV, sin embargo, no hay evidencia clara que indique una relación de patogenicidad en los seres humanos3. Este retrovirus es conocido por estar asociado con el desarrollo de neoplasias malignas linfoproliferativas tipo leucemia o linfoma de células T adultas (ATLL), así como con el desarrollo de mielopatía asociada al HTLV-1 o la paraparesia espástica tropical (HAM/TSP). El HTVL-1 está directamente asociado con problemas infecciosos dermatológicos, uveítis y otros desórdenes de tipo inflamatorio4. Sin embargo, no todas las personas infectadas con el virus llegan a desarrollar algún tipo de manifestación patológica. De hecho, el 90% de estos portadores permanecen asintomáticos durante toda su vida1.
Se estima que el HTLV-1 está presente, aproximadamente, en cinco a diez millones de personas alrededor de todo el mundo. En la actualidad existen muchas áreas endémicas, entre las cuales se encuentran: suroeste de Japón, África subsahariana, el Caribe, el Oriente Medio, la Australomelanesia y gran parte de América del Sur. Epidemiológicamente, este virus tiene un comportamiento endémico local, es decir, se ha acentuado en pequeñas poblaciones y permanece en ellas con una alta tasa de transmisión. A pesar de la gran cifra de personas infectadas alrededor del mundo, la prevalencia real de HTLV-1 sigue siendo muy poco conocida, esto se debe a factores tales como áreas aisladas en las que no se ha identificado la infección, pruebas serológicas con baja especificidad, los identificados no son parte de la población general y las zonas endémicas de HTLV-1 no se distribuyen de manera5 homogénea.
Al no contar con una prevalencia real del virus no se logran conocer los alcances de las consecuencias, a pesar de que se describe que la mayoría de los portadores permanecen asintomáticos. La prevalencia varía según la edad, género y nivel socioeconómico de la población, en la mayoría de las zonas consideradas endémicas. En dichas áreas se han observado muy pocas sustituciones de nucleótidos, lo que hace que el genoma del virus sea muy estable (a diferencia del genoma del virus de inmunodeficiencia humana o HIV (por sus siglas en inglés). Por eso, geográficamente se han descrito cuatro subtipos: el subtipo A Cosmopolitan, el subtipo B centroafricano, el subtipo D de África central/pigmeos y el subtipo C Australomelanesio. De todos, el que mayor compromiso severo geográficamente ha representado es el subtipo A Cosmopolitan5.
En Europa, donde se ha hecho más investigación sobre el tema es en el Reino Unido, que reporta que al menos el 80% de las personas infectadas por HTLV-1 son niños o descendientes de inmigrantes, provenientes de un área endémica. Ello concuerda con datos de España y Francia, pero en este caso la población infectada se relaciona con el alto porcentaje de latinoamericanos que emigran a estos dos países anualmente. Por otro lado, en Suramérica, Brasil y Perú son los países que mayores áreas endémicas tienen en la actualidad5. En Perú, en un estudio publicado en el 2010, se reportó que el mayor porcentaje de personas con HTLV-1 seropositivas correspondía a trabajadores sexuales, grupo al que le seguían las mujeres gestantes. De toda la población estudiada un tercio contaba con un familiar cercano con tamizaje seropositivo1.
En Colombia se describen casos en el área pacífica, específicamente en la región de Tumaco en el departamento de Nariño, una zona muy conocida por la alta prevalencia de HAM/TSP. La tasa de prevalencia general de HTLV-1 fue de 2,8%5. Por otro lado, en un estudio publicado en la ciudad de Cali encontraron que, entre el 2008 y el 2014, de 77.117 registros de donantes en la Fundación Valle del Lili, el 0,24% presentó seroprevalencia, y de ese acumulado el 39% eran hombres, mientras que el 61% correspondía a personas del género femenino. En Bogotá, se registraron 0,07% de resultados positivos, lo cual podría estar explicado porque se incluyeron ocho bancos de sangre6.
PatogénesisLa organización genómica del HTLV es similar a la de otros retrovirus. Sin embargo, se destaca la presencia de una única región denominada pX, la cual codifica para un número de proteínas reguladoras implicadas en la patogénesis viral, debido a las acciones activadoras y supresoras, respectivamente, lo que deriva en la expresión transitoria de productos genéticos virales y la consecuente evasión de la respuesta inmune del huésped7.
Se destaca que el HTLV-1 infecta a los linfocitos TCD4 y el HTLV-2 a los linfocitos TCD8. No obstante, la principal entrada del virus a la célula ocurre por contacto directo entre célula y célula. Además, es llamativo que el margen de infección de estos virus se extiende hacia otro tipo de células: células dendríticas, monocitos, macrófagos, fibroblastos e incluso linfocitos B8.
En el HTLV-1 se destacan características importantes con respecto a mecanismos replicativos y patogenia, por ende su impacto en el desarrollo de enfermedades en el ser humano, como por ejemplo: baja tasa de replicación viral (lo que se traduce en una carga viral relativamente baja y la conservación de la estabilidad genética, evadiéndose de esta forma la respuesta inmune), inducción a proliferación y transformación de las células T sin llevarlas a su muerte9.
Los anticuerpos cumplen un rol en la patogénesis de la enfermedad, teniendo en cuenta que niveles elevados de estos pueden asociarse con mayor susceptibilidad a enfermedades asociadas con la infección por HTLV-1, como la HAM/TSP. Adicionalmente, el recuento de linfocitos T citotóxicos específicos para HTLV se relaciona, asimismo, con alta frecuencia de las enfermedades relacionadas con este virus, incluso en portadores asintomáticos, lo cual permite evaluar de forma más fehaciente el control viral de la enfermedad8.
TransmisiónEntre las vías de transmisión del HTLV-1 se encuentran:
- •
Transmisión sexual: vía de transmisión frecuente, pero aún no se ha estimado el porcentaje de transmisión exacto. Sin embargo, en un resumen de estudios en torno a la frecuencia de HTLV-1 en población de trabajadores sexuales en el Perú, se estimó un porcentaje de seropositividad del 21,8% en el departamento de Callao y Loreto1.
- •
Lactancia materna: hay antígenos de HTLV-1 en la leche materna cuya transmisión se debe a la presencia de los linfocitos T. Estos antígenos tienen un estimado de concentración entre 16 y 30% que se incrementa de manera directamente proporcional a la duración de la lactancia3.
- •
Transfusiones sanguíneas: mediante células infectadas, pero no plasma, con una posibilidad de seroconversión de 40-60%. Sin embargo, la seroprevalencia de HTLV-1 en donantes de sangre es mucho menor que en la población general4.
En la población pediátrica, la revisión sistemática de HTLV-1 permite describir casos en los cuales se reporta desarrollo de enfermedades que se presentan en adultos como la dermatitis infecciosa, la forma juvenil de HAM/TSP e incluso leucemia o el desarrollo de linfoma de células T. La dificultad se presenta porque la descripción del desarrollo de la patogénesis es a largo plazo, es decir, con el paso de los años, además de que los pediátricos también permanecen asintomáticos10.
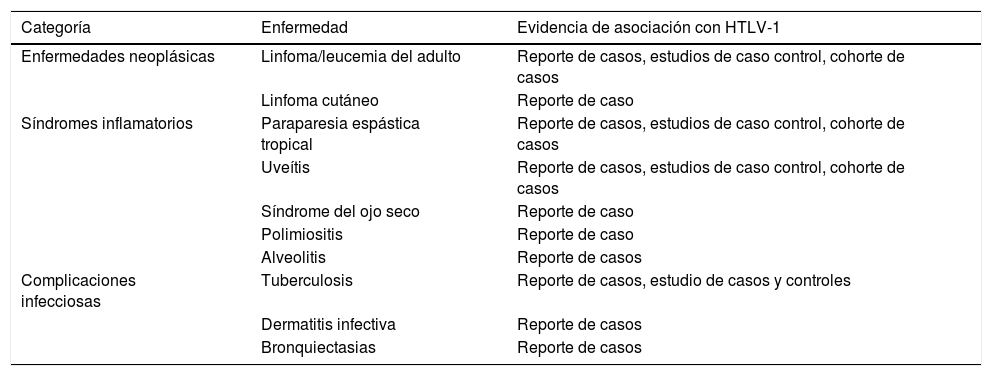
En un artículo publicado en Lima, Perú, en el año 20101, se describió una clasificación del espectro clínico de la infección por el virus en tres grupos importantes que están representados en la tabla 1.
Enfermedades asociadas con HTLV-1
| Categoría | Enfermedad | Evidencia de asociación con HTLV-1 |
|---|---|---|
| Enfermedades neoplásicas | Linfoma/leucemia del adulto | Reporte de casos, estudios de caso control, cohorte de casos |
| Linfoma cutáneo | Reporte de caso | |
| Síndromes inflamatorios | Paraparesia espástica tropical | Reporte de casos, estudios de caso control, cohorte de casos |
| Uveítis | Reporte de casos, estudios de caso control, cohorte de casos | |
| Síndrome del ojo seco | Reporte de caso | |
| Polimiositis | Reporte de caso | |
| Alveolitis | Reporte de casos | |
| Complicaciones infecciosas | Tuberculosis | Reporte de casos, estudio de casos y controles |
| Dermatitis infectiva | Reporte de casos | |
| Bronquiectasias | Reporte de casos |
Tabla adaptada de Gotuzzo Herencia et al.1.
El diagnóstico se realiza mediante la detección de anticuerpos anti-HTLV 1 y 2 en plasma, mediante técnicas de tamizaje como Elisa, aglutinación de partículas de gelatina y quimioluminiscencia. Las pruebas reactivas deberán ser confirmadas por una técnica adicional específica como el Western Blot (WB), en tanto que en los casos indeterminados o HTLV sin tipificar por WB se deberá realizar una reacción en cadena polimerasa anidada (n-PCR) para confirmar la infección. Recientemente se ha implementado otro tipo de herramienta diagnóstica, como lo es la cuantificación de la carga proviral (CPV) de HTLV 1-2 a partir de células de pacientes infectados, empleando la técnica de PCR en tiempo real (RT-PCR), con el fin de hacer una indicación sobre el curso de la enfermedad y valorar la propensión al desarrollo de patologías asociadas con la infección por este virus, principalmente por el HTLV-1. Sin embargo, esta herramienta diagnóstica presenta su efectividad predominante en la monitorización biológica de la eficacia de los tratamientos quimioterapéuticos o antirretrovirales11.
Descripción del caso 1Paciente masculino afrodescendiente, de seis años de edad, procedente de Tumaco, Nariño, que acude al servicio de consulta externa de gastroenterología pediátrica con un cuadro clínico prolongado de deposiciones diarreicas Bristol 6-7, con moco, sin sangre, asociadas con fiebre intermitente y lesiones anales con secreción purulenta. Como antecedentes alimentarios recibió lactancia materna exclusiva hasta el primer año de vida. Con respecto a los antecedentes familiares, una tía paterna padece lupus eritematoso sistémico. El paciente presenta, asimismo, antecedente de múltiples hospitalizaciones por diarrea crónica, con reporte de calprotectina elevada (1.948 μg/g; valor normal < 50 μg/g), hipoalbuminemia, deficiencia de vitamina D, rectosigmoidoscopia con lesiones ulcerativas y erosivas en la mucosa y biopsia de colon que reporta colitis aguda erosiva focal. Por ende, se le diagnostica enfermedad inflamatoria intestinal sugestiva de enfermedad de Crohn. Debido al alivio de los síntomas se le da egreso con sulfazalacina; no obstante, los síntomas gastrointestinales persisten.
En el examen físico inicial se encuentran los siguientes datos patológicos: estado de desnutrición global crónica, fistula con secreción serosa en la región anal y xerodermia marcada en la piel. Ante la sospecha de enfermedad inflamatoria intestinal se solicita un sistema automatizado de detección por reacción en cadena de polimerasa multiplex anidada por sistema FilmArray®Gastrointestinal panel (Biomérieux, FilmArrayTM 2.0, Marcy-L’étoile, Francia), un método de amplificación, detección y análisis de ácidos nucleicos en un sistema cerrado, mediante el cual se identifica E. coli enterotoxigénica. Además, el paciente presenta coproscópico positivo para E. histolytica, por lo que es manejado con ceftriaxona y metronidazol.
Por parte de gastroenterología, se indica tratamiento con el biológico infliximab. Posteriormente, se realiza una endoscopia de vías digestivas altas que reporta gastritis crónica superficial de cuerpo y fondo, así como una colonoscopia que reporta ileopancolitis severa.
Dentro de los estudios realizados en búsqueda intencionada de inmunodeficiencias se reportan anticuerpos HTLV-1 positivos. Se lleva a cabo la prueba confirmatoria por medio de WB que es igualmente positiva. El paciente es valorado por oftalmología, como resultado de lo cual se descarta la uveítis.
Descripción del caso 2Paciente femenina, afrodescendiente, de 12 años de edad, proveniente de Cali, Colombia. Ingresa por cuadro clínico de nueve días de evolución consistente en fiebre, otalgia intensa, rinorrea, inyección conjuntival y malestar general. Al examen físico de ingreso no se encuentran signos clínicos infecciosos que expliquen la fiebre, por lo que se decide hospitalizarla.
Se indican estudios hematológicos, inmunológicos e imagenológicos que identifican: cuadro hemático con reporte de normalidad; proteína C reactiva elevada (31,49 mg/L; valores de referencia: 0,00 mg/L-5,00 mg/L); procalcitonina negativa; uroanálisis no infeccioso; antígenos para influenza A y B negativos; pruebas para dengue, leptospira, toxoplasma, virus herpes simplex tipo I y II negativos; radiografía de tórax AP sin alteraciones y tomografía de senos paranasales sin hallazgos patológicos de importancia. Llama la atención que la paciente posteriormente ingresa en periodo afebril, pero manifestando disminución repentina de la agudeza visual hasta el grado de presentar amaurosis.
El área de neurología infantil valora a la paciente y encuentra alteración del examen neurológico debido a pérdida de visión de predominio central y de color, de forma bilateral. Por tal razón, se realiza punción lumbar y se identifica en citoquímico de líquido cefalorraquídeo (LCR) pleocitosis a expensas de los linfocitos, proteinorraquia, hipoglucorraquia y coloración de Gram en la que no se observan gérmenes. Se le realiza examen FilmArray® Meningitis/Encephalitis panel, en el que no se le detectan microorganismos.
Debido a la falta de signos clínicos que expliquen la disminución de la agudeza visual, la paciente es valorada por oftalmología y retinología infantil y se le encuentran signos compatibles con uveítis posterior bilateral, por lo que se inicia manejo con atropina, prednisolona oftálmica y terapia de inmunomodulación con ciclofosfamida. Dentro de los paraclínicos de extensión se toman anticuerpos contra HTLV tipos 1 y 2 que arrojan resultados positivos, con prueba confirmatoria a través de WB positiva para HTLV-1, como consecuencia de lo cual se diagnostica infección por este virus.
Descripción del caso 3Paciente masculino de 15 meses, procedente de Chachajo, San Juan de Buenaventura, departamento del Chocó, Colombia, perteneciente a la comunidad indígena wounaan, que ingresa remitido con historia clínica previa de hospitalización por tres meses en otra institución por trombocitopenia persistente sin mejoría. Tuvo manejo con transfusión de plaquetas e inmunoglobulina G endovenosa (solo una dosis previamente a la llegada a nuestra institución) y sospecha de infección por virus HTLV-1 y 2 debido a reporte de anticuerpos positivos para este microorganismo. Adicionalmente, presenta historia de infecciones respiratorias repetitivas.
En el examen físico se observa aspecto crónicamente enfermo, con desnutrición global y retraso en el neurodesarrollo. Como hallazgos patológicos adicionales se observan dedos en palillo de tambor, en tanto que a la palpación abdominal se encuentra hepatoesplenomegalia que se confirma por ecografía abdominal.
El paciente es valorado por el área de hematología pediátrica, que considera que se encuentra cursando con trombocitopenia secundaria a hepatoesplenomegalia e infección por virus del HTLV-1, por lo que se decide aspirado y biopsia de médula ósea e inicio de inmunoglobulina G endovenosa. Se obtiene reporte de citometría de flujo negativo para leucemia y mielograma normocelular sin infiltración leucémica, con trombocitopenia marcada y biopsia de médula ósea negativa para infiltración neoplásica. Sin embargo, presenta respuesta parcial ante el manejo pautado con inmunoglobulina G endovenosa.
Debido al compromiso pulmonar, al paciente se le realiza fibrobroncoscopía y toma de lavado broncoalveolar y se encuentran signos de neumopatía asociada con HTLV-1 y 2. Posteriormente, se obtiene reporte de prueba confirmatoria Western Blot para HTLV-1 positiva. Por persistencia de trombocitopenia severa se decide, en conjunto con infectología, hematología y reumatología pediátrica, inicio de pulsos de metilprednisolona (15 mg/kg/día durante dos días), con posterior cambio a prednisolona (2 mg/kg/día).
DiscusiónLa infección por HTLV-1 es común en América Latina5. Sus manifestaciones clínicas y enfermedades asociadas han sido mayormente reportadas en poblaciones adultas. Dada la historia natural de la enfermedad, aquellos pacientes que desarrollan síntomas suelen hacerlo décadas después de la infección. En este reporte de casos aportamos al conocimiento de las manifestaciones autoinmunes asociadas con esta enfermedad en tres pacientes pediátricos.
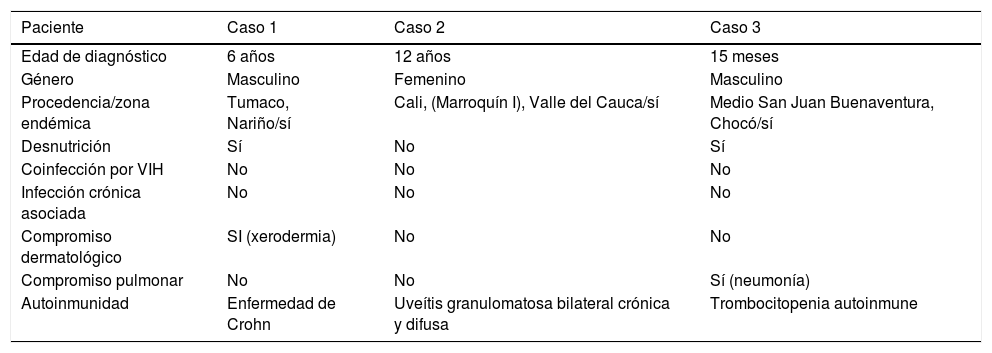
Existen factores de riesgo que incrementan la susceptibilidad a infección por HTLV-1, durante el embarazo o la lactancia, que se pueden relacionar con los pacientes valorados. Entre ellos se encuentran el lugar de nacimiento, la raza, un bajo nivel educacional y socioeconómico, antecedentes familiares de leucemia o linfoma, antecedentes de transfusiones tanto en la madre como en el recién nacido, entre otros12. Los datos pertinentes de los tres pacientes presentados están plasmados en la tabla 2.
Descripción de casos clínicos
| Paciente | Caso 1 | Caso 2 | Caso 3 |
|---|---|---|---|
| Edad de diagnóstico | 6 años | 12 años | 15 meses |
| Género | Masculino | Femenino | Masculino |
| Procedencia/zona endémica | Tumaco, Nariño/sí | Cali, (Marroquín I), Valle del Cauca/sí | Medio San Juan Buenaventura, Chocó/sí |
| Desnutrición | Sí | No | Sí |
| Coinfección por VIH | No | No | No |
| Infección crónica asociada | No | No | No |
| Compromiso dermatológico | SI (xerodermia) | No | No |
| Compromiso pulmonar | No | No | Sí (neumonía) |
| Autoinmunidad | Enfermedad de Crohn | Uveítis granulomatosa bilateral crónica y difusa | Trombocitopenia autoinmune |
Elaboración propia.
Los tres pacientes son procedentes de la zona pacífica colombiana, identificada como zona endémica para HTLV-1, dos pacientes afrodescendientes y uno indígena.
Los tres pacientes con padres de bajo nivel de escolaridad y estrato socioeconómico. El caso 1 proviene de Tumaco, Nariño, donde los estudios estiman una prevalencia del 3% mediante pruebas serológicas13. El caso 2 procede de Cali y el tercer paciente pertenece a la etnia indígena en el departamento de Choco, donde se reporta una tasa de reactividad veinte veces mayor que el promedio nacional14. Se ha reportado una prevalencia aumentada en afrodescendientes y poblaciones indígenas, asociada con bajos niveles económicos, a través de toda Latinoamérica15. En el caso de los pacientes reportados se describen algunas de sus características demográficas.
De acuerdo con la información recopilada, los casos 1 y 3 recibieron lactancia materna por más de seis meses, incluso alcanzaron a recibir lactancia materna exclusiva por mínimo doce meses, lo que incrementa el riesgo de infección. Se considera que la infección en estos tres pacientes muy probablemente se asocia con transmisión por lactancia materna.
La medida más eficaz que se ha instaurado en países desarrollados, como Japón, para prevenir la transmisión vertical madre a hijo por lactancia materna es suspender la administración de esta e iniciar nutrición con fórmula. Sin embargo, los contextos socioculturales, epidemiológicos y económicos colombianos y de otros países en vías de desarrollo hacen que esta medida sea potencialmente contraproducente16.
Dos de los pacientes presentaron alteraciones nutricionales, con peso y talla para la edad por debajo del percentil 5 para la edad, en estado de desnutrición (casos 1 y 3). Montano et al., en un estudio acerca del neurodesarrollo temprano en niños con HTLV-1, reportaron un índice de malnutrición crónica en pacientes seropositivos del 30%, comparado con un 8% en el grupo seronegativo17. Los estudios acerca del estado nutricional de niños con HTLV-1 son limitados. En adultos se ha encontrado prevalencia aumentada de desórdenes nutricionales, tanto desnutrición como obesidad, al igual que inseguridad en cuanto acceso a comida en pacientes adultos con HTLV-118.
Se debe tener presente que los pacientes de los casos 1 y 3, ambos con problemas nutricionales, residen en áreas rurales, distantes de áreas urbanas, con recursos limitados, tanto económicos como humanos, médicos y educacionales, lo que agrava su condición.
En los casos reportados en este estudio se encontró que los pacientes presentaban afectaciones diversas. En el caso 1, el paciente presentó manifestaciones dermatológicas de xerodermia marcada. En el caso 3 presentó lesiones costrosas y máculas hipo- e hiperpigmentadas en troncos y extremidades asociadas con prurito. La paciente del caso 2 no presentó lesiones dermatológicas. Schierhout et al. describieron la relación entre infección por HTLV1 y enfermedades asociadas, encontraron riesgo relativo elevado para enfermedades inflamatorias como dermatitis seborreica en niños y adultos, eccema en niños, síndrome de Sjögren, bronquiectasias, bronquitis o bronquiolitis, asma, fibromialgia, artritis reumatoide; condiciones infecciosas como tuberculosis, neumonía adquirida en la comunidad, síndrome de hiperinfección por Strongyloides stercoralis; condiciones cancerosas como cáncer cervical, hepático y linfomas16. Se encontró un factor protector para desarrollar cáncer gástrico19.
Maloney et al. identificaron la hiperreflexia en niños como una manifestación temprana21. Por otro lado, reportó promedios de hemoglobina similares en pacientes infectados y no infectados, con un riesgo relativo incrementado en niños infectados para desarrollar anemia severa21. En los pacientes aquí reportados se encontró que los casos 1 y 3 presentaron anemia de volúmenes bajos que requirieron transfusión de glóbulos rojos.
Se han reportado casos de asociación entre la infección por HTLV-1 y el desarrollo de enfermedades autoinmunes como la mielopatía o la paraparesia espástica tropical (disfunciones inmunológicas que incluyen la proliferación espontanea de linfocitos T CD4+ infectados por HTLV-1 y producción incrementada de citocinas proinflamatoiras) y enfermedades autoinmunes como el síndrome de Sjögren, artropatías y uveítis22. Este reporte de casos se enfoca en las manifestaciones autoinmunes asociadas con la infección por HTLV y crea conciencia en torno a su variedad, pero su valor agregado se encuentra en que la población en la que se reportan es pediátrica.
Varias teorías intentan explicar el proceso mediante el cual se desarrolla la autoinmunidad ante la infección por algún patógeno. En general, los virus pueden inducir autoinmunidad activando la autorreactividad de células T mediante el incremento en la regulación de citoquinas tipo Th-1 o de otras moléculas selectivas; la infección o destrucción preferencial de un subset de células T CD4+: la producción de superantígenos virales; de novo por autoepítopes liberados secundariamente a daño mediado por células T, de manera específica por virus, y reactividad cruzada con epítopes virales.
En el caso de los virus se proponen tres principales teorías. Primero, la mímica molecular, en la que se encuentran estructuras similares que son compartidas por moléculas de distintos genes, huésped y virus23. De esta manera, se pueden tener segmentos de alineaciones de aminoácidos similares, de cada especie, y ser proteínas distintas. Una vez se crea una respuesta inmune en contra del determinante compartido, tanto del huésped como del virus, se puede evocar una respuesta inmune específica a un tejido que puede llevar a destrucción celular y del tejido subyacente23,24. Los dos mecanismos más probables que llevan al daño tisular son la creación de anticuerpos que reconocen determinantes específicos en células diana o la reactividad cruzada citotóxica de linfocitos efectores23.
La segunda teoría es la activación (bystander) transeúnte, que se da posteriormente a la activación de células T autorreactivas, inmaduras, por parte de una célula presentadora de antígenos activada, lo que puede llevar a autoinmunidad24.
Por último, la tercera teoría es una infección viral persistente que provoca una respuesta inmune persistente24. También se ha registrado que la infección de linfocitos T CD4+ ha causado alteraciones en las cascadas de señalización y factores de transcripción que alteran su función celular, lo que termina en una desregulación favorecedora de una respuesta inmune mediada por Th1 (que se ha asociado al desarrollo de artritis reumática), mientras que la desregulación que favorece la expresión de Th2 se ha asociado con el desarrollo de lupus eritematoso sistémico22. Es de destacar que los cambios previamente descritos a nivel inmunológico ocurrieron en pacientes aparentemente asintomáticos25.
Las revisiones sobre HTLV en poblaciones pediátricas se han enfocado principalmente en los métodos de transmisión y las instauraciones de protocolos que prevengan la infección mediante la lactancia materna. Las enfermedades autoinmunes secundarias a infección por HTLV-1 y 2 han sido mayormente reportadas en poblaciones adultas, lo que posiblemente se deba a que los síntomas no se manifiestan sino décadas después la infección. Los pacientes pediátricos también suelen cursar de forma asintomática. No obstante, entre las afectaciones más comunes se encuentran la dermatitis infectiva, la disfunción inmune con infecciones bacterianas superpuestas de piel, bronquiectasias crónicas, infestación por Strongyloides stercolaris, hipergammaglobulinemia y activación de células T con recuentos elevados de CD4.
En estudios y reportes de casos se ha encontrado una asociación entre la infección por HTLV y el desarrollo de manifestaciones neurológicas y disfunciones cognitivas26,27. Las afectaciones autoinmunes mayormente reportadas en niños son la mielopatía asociada a HTLV/paraparesia espástica tropical (HAM/TSP), el linfoma/leucemia de células T del adulto y uveítis10,28,29. Otras afectaciones autoinmunes reportadas incluyen el síndrome de Sjögren, artritis reumatoide, lupus eritematoso, tiroiditis autoinmune y polimiositis, entre otras13,30-32.
Paradójicamente, según la revisión de la literatura, algunos estudios reportan que en pacientes con enfermedades autoinmunes de base como lupus eritematoso, polimiositis y otras enfermedades del tejido conectivo, en los cuales se pretendía determinar la prevalencia de infección por HTLV, no se logró encontrar infección activa por el retrovirus33,34. En el estudio en el que incluían pacientes con enfermedades del tejido conectivo se concluyó que las enfermedades reumatológicas están asociadas con el HTLV-1 de manera geográfica y no etiológica. Otros estudios han demostrado que la reacción en cadena de polimerasa no identifica al HTLV-1 como agente causal en enfermedades reumatológicas, aunque una minoría de esos pacientes posee anticuerpos que tienen reacción cruzada débil con antígenos retrovirales35.
Se encontró que cada uno de los tres pacientes reportados en este estudio desarrolló una manifestación autoinmune distinta, dos de ellos con manifestaciones raramente reportadas, menos aún en este grupo etario. El primer paciente presentó cuadros diarreicos crónicos durante los últimos cinco años. En la literatura se ha reportado ampliamente coinfección por Strongyloides stercolaris19; sin embargo, ello no se identificó en este paciente, el cual fue diagnosticado con enfermedad de Crohn asociada con HTLV-1.
En la literatura se han descrito manifestaciones gastrointestinales asociadas con la infección por HTLV-1, como colitis ulcerativa y enfermedad de Cronh, en zonas endémicas36. Sin embargo, en su mayoría han sido diagnosticadas como colitis ulcerativas asociadas o no con infección por Strongyloides stercolaris en poblaciones adultas. Este sería el primer caso en la literatura, de conocimiento propio, en el cual se reporta esta asociación en cualquier población. Llama la atención la extensión de las lesiones ya que llevaron a recomendar manejo con colectomía total, lo que describe un proceso altamente agresivo. Previamente se han reportado casos de linfomas y linfosarcomas de colon que imitan colitis ulcerativas y enfermedades de Cronh, todos estos en pacientes adultos37,38. Sin embargo, por la evolución clínica agresiva vista en este paciente se debe considerar el seguimiento a largo plazo.
La segunda paciente presentó uveítis. Se ha reportado una asociación de la infección con HTLV-1 y esta entidad, más frecuentemente en mujeres. Esta condición se manifiesta con visión borrosa y afecta de forma bilateral a casi la mitad de las personas que la padecen. Algunos de los signos oculares que pueden presentar son iritis, opacidades del vítreo, vasculitis de la retina, hemorragias de la retina y exudados. Se ha visto una buena respuesta terapéutica al uso de corticoesteroides tópicos o sistémicos18. En un reporte de casos de Kihara et al.29 se describen los casos de cinco niños que desarrollaron uveítis secundaria a HTLV-1, con síntomas clásicos de uveítis en adultos; sin embargo, todos los pacientes presentaron uveítis unilateral. La paciente de este reporte evolucionó hasta desarrollar una amaurosis bilateral, lo que concuerda con la mayor parte de la literatura, respondió favorablemente a la administración de corticoesteroides, pero con las secuelas descritas.
El tercer paciente presentó púrpura idiopática trombocitopénica (PTI). En el estudio de Matsushita et al. se encontró una prevalencia mayor de HTVL-1 en pacientes con PTI que en pacientes sanos, además, los pacientes con PTI y con infección por HTLV tuvieron una respuesta deficiente a la terapia con prednisolona. Aunque algunos obtuvieron un aumento transitorio del recuento de plaquetas muy pocos obtuvieron respuesta completas o parciales. Los autores llegaron a la conclusión de que en estas personas se debe considerar la esplenectomía si no hay respuesta a la terapia convencional20. Esto se evidenció en el paciente 3, el cual tenía como antecedente PTI con pobre respuesta a terapia con esteroides, por lo que se llegó a considerar la esplenectomía.
De esta manera, se pone en evidencia que los pacientes pediátricos pueden presentar distintas sintomatologías asociadas con HTLV-1, lo que demanda una atención médica minuciosa. Desde el punto de vista epidemiológico, es posible establecer que las manifestaciones más severas por la infección por HTLV 1 o 2 tienden a expresarse décadas después de la infección. Sin embargo, aunque la literatura es escasa, debemos ser conscientes de que los pacientes en edades pediátricas, positivos para HTLV 1 y 2, pueden presentar gran variedad de manifestaciones clínicas, con coinfecciones asociadas en muchos de los casos. En lo que atañe a este reporte, se debe tener en cuenta la aparente facilidad con la cual se forma una respuesta autoinmune secundaria, con independencia de qué teoría pueda explicarla, debido a que las consecuencias a corto, mediano y largo plazo son graves, yendo desde hospitalizaciones continuas y prolongadas hasta cirugías altamente invasivas o posibles discapacidades físicas. Dada la corta edad de los pacientes, la agresividad de las manifestaciones clínicas y las complicaciones asociadas a largo plazo, se debe hacer un seguimiento médico estricto.
Debido a que la población es estudio es de menores de edad, sin antecedentes de transfusiones, trasplantes, uso de drogas endovenosas, ni de haber iniciado conducta sexual, es dable inferir que la posible vía de contagio en estos pacientes corresponda, con alta probabilidad, a la lactancia materna, en relación con los datos proporcionados en la historia clínica y mencionados anteriormente, además de la revisión de la literatura realizada.
ConclusionesLa literatura académica acerca de las manifestaciones autoinmunes en pacientes pediátricos es escasa.
Las enfermedades autoinmunes secundarias a HTLV-1 mayormente reportadas en niños son la mielopatía asociada a HTLV/paraparesia espástica tropical (HAM/TSP), el linfoma/leucemia de células T del adulto y uveítis. Sin embargo, pueden presentarse manifestaciones como trombocitopenia, purpura idiopática o enfermedad de Crohn.
Este es el primer reporte de caso en la literatura, de conocimiento propio, en el que se presenta un paciente pediátrico con diagnóstico de enfermedad de Crohn asociada con HTLV-1.
Las enfermedades reumatológicas se asocian con infección por HTLV-1 en zonas endémicas.
Se debe tener particular cuidado con las manifestaciones gastrointestinales tipo colitis ulcerativa o enfermedad de Crohn por el riesgo de imitar linfomas o linfosarcomas.
El paciente que presentó uveítis secundaria a infección por HTLV-1 respondió favorablemente a la administración de corticoesteroides. Sin embargo, esta no es todavía una indicación clara dentro del tratamiento; se debe individualizar cada caso.
Se debe hacer un seguimiento clínico estricto en pacientes positivos para HTLV-1, especialmente si desarrollan manifestaciones neurológicas o autoinmunes.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.