La artritis reumatoide (AR) es una enfermedad inflamatoria de origen autoinmune, caracterizada por inflamación de múltiples articulaciones que lleva a destrucción del cartílago y del hueso yuxta articular, con el tiempo genera deformidad, discapacidad y deterioro de la calidad de vida. El metotrexato (MTX), reporta un índice de respuesta del 33 al 65%, esta variabilidad puede ser explicada por las variaciones genéticas (polimorfismos) en la ruta metabólica de este fármaco.
ObjetivoEvaluar las posibles asociaciones entre los polimorfismos de la ruta metabólica del MTX y su respuesta en pacientes con AR.
MetodologíaRevisión sistemática de la literatura cualitativa (integrative review). Se realizó una búsqueda sistemática de la literatura, 29 estudios fueron incluidos por texto completo y por calidad metodológica para alcanzar el objetivo del estudio, estos estudios evaluaron polimorfismos en la ruta metabólica del MTX.
ResultadosDe los 29 estudios, cinco fueron revisiones sistemáticas o metaanálisis, tres ensayos clínicos de los cuales ninguno fue triple ciego y solo uno fue doble ciego, seis fueron cohortes, siete fueron casos y controles y ocho de corte transversal. Se identificaron los polimorfismos de metiltetrahidofolato reductasa, dihidrofolato reductasa, timidilato sintetasa, 5-aminoimidazol-4- carboxamida ribonucleótido formiltransferasa (AICAR formiltransferasa), 5-aminoimidazol-4- carboxamida ribonucleótido formiltransferasa/IMP ciclohidrolasa (ATIC), transportadores de casete unidos a ATP (ABC ATP-binding cassette), folilglutamato sintetasa, glutamil hidrolasa, transportador de folato reducido (RFC-SLC10A1). Los polimorfismos metiltetrahidofolato reductasa y dihidrofolato reductasa demostraron estar asociados con un aumento en la toxicidad del MTX; los polimorfismos RFC y C677T están asociados a una mejor eficacia del MTX.
ConclusionesLos polimorfismos de metiltetrahidofolato reductasa C677T y RFC1 - G80A generan aumento de eficacia y toxicidad en pacientes tratados con MTX. Sin embargo, para los demás polimorfismos, aunque los estudios muestran asociaciones estadísticamente significativas, no son concluyentes y algunos son contradictorios. Lo anterior justifica la realización de estudios de carácter multicéntrico, para evaluar la presencia y asociación, con la eficacia o toxicidad en los pacientes con artritis reumatoide tratados con MTX.
Rheumatoid arthritis (RA) is an inflammatory autoimmune disease characterised by inflammation of multiple joints, leading to destruction of cartilage and juxta articular bone. It eventually leads to deformity, disability, and impaired quality of life. Methotrexate (MTX), has a reported response rate of 33 to 65%, and this variability may be explained by genetic variations (polymorphisms) in the metabolic pathway of this drug.
To evaluate possible relationships between polymorphisms in the metabolic pathway and response to MTX in patients with RA.
MethodologyA systematic search and review of the literature was conducted. A total of 29 studies that evaluated polymorphisms in the metabolic pathway of MTX were included, due to their full text and methodological quality.
ResultsOf the 29 studies, five were systematic reviews and/or meta-analyses, three of which clinical trials none was triple blind and only one was double-blind, six were cohort, seven were case-control, and eight cross sectional. The polymorphism identified were: methylene tetrahydrofolate reductase, dihydrofolate reductase, thymidylate synthase, 5-amino-imidazole-4- carboxamide ribonucleotide formyl transferase (AICAR formyltransferase), 5-aminoimidazole-4- carboxamide polymorphisms formyltransferase/IMP cyclohydrolase ribonucleotide (ATIC) identified conveyors attached to ATP cassette (ABC ATP-binding cassette), folylpoly-glutamate, glutamyl hydrolase, reduced folate carrier (RFC-SLC10A1). The dihydrofolate reductase and methylene tetrahydrofolate reductase polymorphism were shown to be associated with increased MTX toxicity. RFC and C677T polymorphisms are associated with better efficacy of MTX.
ConclusionsThe polymorphisms of methylene tetrahydrofolate reductase, C677T and RFC1 - G80A generate increased efficacy and toxicity in patients treated with MTX. However, for the other polymorphisms, although studies show statistically significant associations, they are not conclusive and some are contradictory. This justifies conducting multicentre studies to assess the presence and association with the effectiveness or toxicity in patients with RA treated with MTX.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica de origen autoinmune, caracterizada por la inflamación de múltiples articulaciones. Con el tiempo lleva a grados variables de destrucción del cartílago articular y del hueso yuxta articular, generando deformidad progresiva y con ello discapacidad, alteración de la calidad de vida y disminución de la expectativa de vida1. En el tratamiento se incluyen los medicamentos antiinflamatorios no esteroideos (AINES), medicamentos modificadores de la artritis reumatoide (DMARD) sintéticos y biológicos, analgésicos y medidas no farmacológicas que buscan aliviar el dolor, disminuir el daño y preservar la función articular2.
Los DMARD son por definición medicamentos asociados a la reducción del daño articular y óseo causado por la enfermedad. Dentro de los DMARD, el más utilizado ha sido el metotrexato (MTX). Este medicamento fue descubierto en 1948 e indicado inicialmente para el tratamiento de enfermedades neoplásicas. En 1951, se usó por primera vez para el tratamiento de la artritis psoriásica. En 1980 comenzó su utilización para el tratamiento de AR, mostrando buena respuesta y un perfil adecuado de seguridad. A partir de los años 90, el MTX se convirtió en el DMARD de primera elección3,4. Un porcentaje importante de pacientes no responden clínicamente al tratamiento. Por el resultado limitado de la monoterapia con este fármaco, se utilizan las combinaciones del MTX con otros DMARD tradicionales para incrementar el porcentaje de respuesta en el tratamiento de la AR5.
El MTX es un análogo de ácido fólico, diseñado originalmente para inhibir la actividad de la enzima dihidrofolato reductasa (DHFR), encargada de convertir dihidrofolatos a tetrahidrofolatos, implicados en la transferencia de un átomo de carbono en las vías metabólicas intracelulares, tales como la síntesis de novo de purinas, pirimidinas y poliaminas, como también la transmetilación de fosfolípidos y proteínas. El MTX tiene adicionalmente propiedades inmunosupresoras y antiinflamatorias.
En cuanto a la actividad inmunosupresora, inhibe la proliferación de linfocitos CD3 - CD4 y otras células inmunocompetentes como los monocitos, macrófagos y neutrófilos polimorfonucleares. El MTX también modula citocinas como interleucina 4 (IL–4) e interleucina 10 (IL-10), interferón alfa y la interleucina 2 (IL-2), generando así acciones antiinflamatorias e inmunorreguladoras.
Una vez dentro de la célula, los poliglutamatos de MTX se unen de forma competitiva y con mayor afinidad que la dihidrofolato, a varias enzimas e inhiben su función: DHFR, TYMS y AICAR formiltransferasa6. Al inhibir la AICAR formiltransferasa, se genera acumulación intracelular de AICAR, que conduce a mayor liberación de adenosina en la sangre. Este mediador activa receptores extracelulares A2a, A2b y A3 en los monocitos y los macrófagos, inhibe la producción de factor de necrosis tumoral alfa (TNFα), IL-6 e IL-8, promueve la transcripción de ARNm para el receptor antagonista de IL-1 y aumenta la secreción IL-10, potente antiinflamatorio7. La activación de los receptores de adenosina sobre las células endoteliales humanas inhibe la producción de IL-6 e IL-8 y disminuye la expresión de E-selectina en la superficie celular. Lo anterior explica el importante papel de la adenosina en la respuesta antiinflamatoria8,9.
El MTX entra a la célula a través del transportador de folato RFC1-SLC19A1. La salida del fármaco desde la célula está controlada por los miembros de la familia de transportadores de casete unidos a ATP (ABC ATP-binding cassette), predominantemente ABCC1 y ABCG2, también conocidos como proteínas resistentes a múltiples fármacos10. Dentro de la célula, por acción de la enzima folilglutamato sintetasa (FPGS), el MTX se convierte en formas de poliglutamato conocidas como MTXPG, este proceso puede ser revertido por la enzima γ glutamil hidrolasa (GGH). Los MTXPG inhiben la DHFR, enzima que reduce la dihidrofolato a tetrahidrofolato. La conversión de tetrahidrofolato en una forma de 5–metil, ocurre gracias a la metionina sintasa, e implica la síntesis de un metabolito intermedio denominado 5,10-metil-tetrahidrofolato (por la enzima serina hidroximetiltransferasa (SHMT1). El producto resultante 5 metil tetrahidrofotalo es una fracción biológicamente importante ya que actúa como donador de un carbón en reacciones celulares como la conversión de homocisteína a metionina4.
Además de la inhibición de la vía del folato, los MTXPGs también influyen en la síntesis de novo de las pirimidinas mediante la inhibición de la TYMS, que convierte desoxiuridilato en deoxitimidilato. Los MTXPGs inhiben la enzima AICAR transformilasa, también conocida como proteína bifuncional de biosíntesis de purina (PURH), codificada por ATIC, que conduce a la acumulación intracelular del ribonucleótido adenosina carboxamida aminoimidazol. Este producto y sus metabolitos inhiben dos enzimas importantes en el metabolismo de la adenosina, la adenosina desaminasa y AMP deaminasa, causando acumulación intracelular de los nucleótidos de adenosina, que al desfosforilarse, generan acumulación de adenosina extracelular, potente agente antiinflamatorio11.
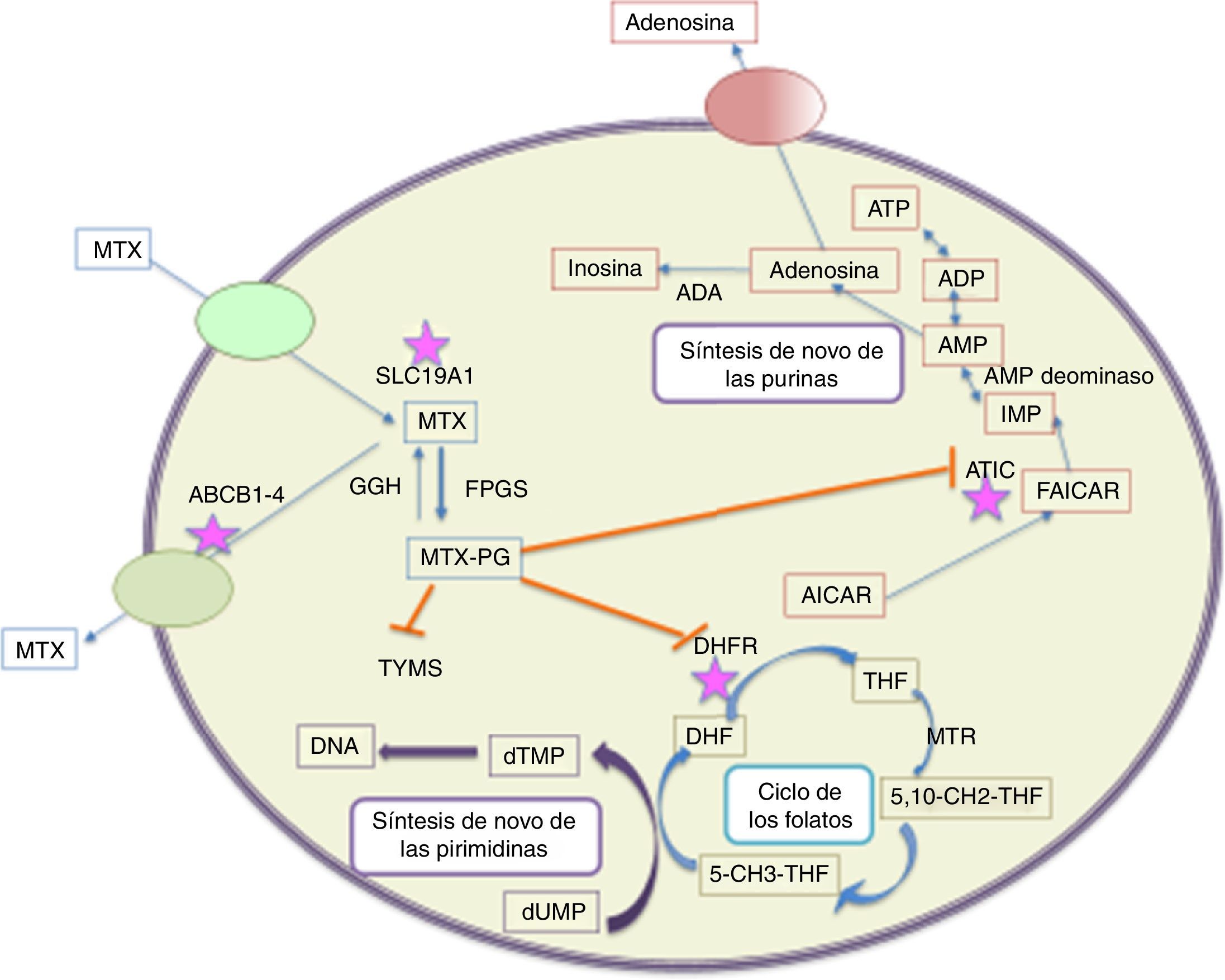
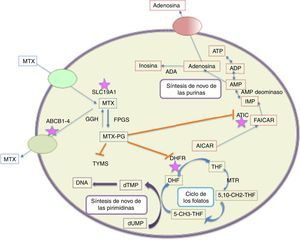
Se han descrito tres rutas metabólicas del MTX; la primera en la que el fármaco es sintetizado por las bacterias intestinales en ácido 4-amino-desoxi- N10-metil. Este metabolito representa menos del 5% de la dosis administrada y es rara su detección en plasma o en orina. La segunda ruta metabólica ocurre en el hígado, donde se convierte a 7 hidroxi MTX12, considerado un inhibidor de la dihidrofolato reductasa, 10 veces menos potente que los poliglutamatos de MTX. La tercera y más importante de la rutas metabólicas, es la conversión intracelular de MTX a poliglutamatos. En esta última ruta se concentra su mecanismo de acción13. Dentro de las células que más convierten el MTX a derivados poliglutamílicos (forma en la que se almacena) se encuentran: los eritrocitos, fibroblastos, precursores mieloides en la médula ósea, queratinocitos, membrana sinovial, hueso cortical y hueso trabecular. De allí se deriva su efecto farmacológico sobre la disminución de población de linfocitos y los eventos adversos a nivel gastrointestinal, piel y mucosas14 (fig. 1).
Rutas metabólicas del metabolismo intracelular el MTX. MTX entra activamente a las células a través de la SLC19A1, mientras el flujo de salida se realiza a través de la membrana celular mediada por varios transportadores (ABC 1-4). Una vez dentro de la célula se realiza la poliglutaminación (MTX-PG) mediante la enzima FPGS, reacción revertida por la GGH. MTXPG inhibe varias enzimas importantes en el metabolismo del folato, tales como dihidrofolato reductasa (DHFR), que resulta en el agotamiento del tetrahidrofolato (THF) (precursor del cofactor folato 5 - CH3- THF). La inhibición de TYMS por MTX-PG, e indirectamente a través de agotamiento de THF, conduce a la inhibición de la biosíntesis de pirimidina. La disminución en la síntesis de los compuestos de folato también conduce a la inhibición de la biosíntesis de las purinas. MTX-PG inhibe ATIC, causando la acumulación intracelular de AICAR, conduciendo eventualmente a la generación de adenosina. Los asteriscos indican las proteínas en las cuales los polimorfismos se han visto más asociados a las alteraciones en la respuesta al metotrexato en diferentes poblaciones.
ABCB1-4:trasportadores de ABC de ATP del 1 al 4; ADA:adenosina deaminasa; AICAR:ribonucleótido 5-aminoimidazol-4-carboxamida; AMPD: monofosfato de adenosina desaminasa; ATIC:bifuncional proteína biosíntesis de purina; 5 - CH3-THF:5 -metil tetrahidrofolato; 5,10- CH2-THF:5,10-metil tetrahidrofolato de metil; DHF:dihidrofolato; DHFR:dihidrofolato reductasa; dTMP, desoxitimidina monofosfato; FAICAR:10 -formil- 5 - aminoimidazol - 4 - carboxamida; FPGS:sintetasa folilpoliglutamato; GGH:gama-glutamil hidrolasa; IMP:inosina - 5 - monofosfato; MTHFR:metilentetrahidrofolato reductasa; MTR:tetrahidrofolato reductasa metilo; MTRR:metionina sintasa reductasa; MTX:MTX; MTX-PG:poliglutamato de MTX; SLC19A1, portador de soluto 19A1; THF:tetrahidrofolato; TYMS:timidilato sintasa.
Los eventos adversos derivados del MTX, se relacionan con la cantidad y frecuencia de la dosis administrada. La mayoría de estos eventos se pueden detectar de forma temprana y son reversibles. Los mismos se pueden dividir de acuerdo con el sistema afectado en: gastrointestinales como vómito, diarrea o estomatitis que pueden llevar a deshidratación. Hematológicos como depresión de la médula ósea con anemia aplásica, pancitopenia, leucopenia, neutropenia o trombocitopenia. Hepático/biliar/pancreático: hepatotoxicidad aguda y crónica. Aguda, con elevación de las enzimas hepáticas, generalmente transitoria y asintomática. La toxicidad crónica es potencialmente mortal; después de uso prolongado, anomalías persistentes en las pruebas de función hepática pueden preceder la aparición de cirrosis.
Variabilidad en la respuesta al MTX. A pesar de ser el DMARD más utilizado debido a su eficacia y seguridad a largo plazo, su respuesta tiene gran variabilidad entre los pacientes. Esto se atribuye a diferentes factores como: el sexo, la edad, la duración de la enfermedad, la proteína C reactiva, los niveles de factor reumatoide y las variaciones genéticas. Entre ellos, los factores genéticos se consideran de gran importancia y por esto se han estudiado, apoyándose de la farmacogenética para la búsqueda y el análisis de las variaciones genéticas del individuo (polimorfismos) asociados a la eficacia y seguridad terapéutica al tratamiento con MTX15-18.
En la ruta metabólica de este medicamento se pueden encontrar diversos polimorfismos que afectan la respuesta y toxicidad (fig. 2). ABCs, SLC10A1. ABC (ABC ATP-binding cassette) y RFC (transportador de folato reducido), en especial SLC19A1/RFC1, son transportadores del MTX que influyen en su absorción celular y en el flujo de salida19.
-Polimorfismos en enzimas que intervienen en la poliglutamación del MTX: FPGS y GGH. La cantidad de poliglutamatos MTX intracelular depende de la tasa de poliglutamación, que está determinada por las actividades de las enzimas FPGS y GGH. Los PMF en estas enzimas pueden generar cambios en eficacia o toxicidad.
DHFR. La dihidrofolato reductasa es uno de los objetivos terapéuticos del MTX. Los polimorfismos que resaltan son rs12517451, rs10072026 y rs1643657 por una mayor asociación con eventos adversos; el SNP DHFR 317AG (rs70991108) se asocia con mayor respuesta al MTX, y los pacientes con genotipo 317AA con menor respuesta20,21.
TYMS. Esta enzima, necesaria para la síntesis de novo de timidilato, se inhibe directamente por MTXPG. Los PMF en el gen que codifica esta enzima incluye repetición en tándem (dos o tres repeticiones de una unidad de 28 pb) en la región potenciadora en el 5’-UTR. Los pacientes homocigotos para la triple (3R) repetición de alelo de TYMS, presentan aumento en la expresión ARNm TYMS y mayor actividad enzimática en comparación con aquellos con el alelo 2R22.
ATIC. Es un gen importante en la vía de adenosina; este gen codifica la enzima implicada en la liberación de adenosina extracelular que tiene propiedades antiinflamatorias23.
Polimorfismos en el MTHFR. Es de los polimorfismos más ampliamente estudiados y juega un papel importante en la respuesta al tratamiento ya que afecta la actividad enzimática y el metabolismo del MTX, dentro de estos PMF se encuentran; C677T (rs1801133) y A1298C (rs1801131)24,25.
Materiales y métodosSe realizó una revisión sistemática cualitativa (integrative review) de la literatura de estudios experimentales (ensayos clínicos aleatorizados, ensayos clínicos), estudios observacionales analíticos (cohortes casos y controles) y de corte transversal con el fin de evaluar el efecto de los polimorfismos MTHFR, ATIC, DHFR, ATYM, FPGS, GGH SLC10A1 y ABC sobre la efectividad y seguridad terapéutica del MTX en el manejo de la AR. Se realizó una búsqueda de estudios primarios, revisiones sistemáticas y metaanálisis en las más importantes bases de datos científicas utilizando términos MeSH y términos all fields para cada uno de los componentes de la pregunta PICOT (población, intervención, control, desenlace y tipo de estudio).
Tipo de estudiosFueron incluidos ensayos clínicos controlados aleatorizados, estudios de cohorte, casos y controles y de corte transversal publicados y no publicados, que estudian la relación entre la presencia de polimorfismos genéticos y la efectividad clínica del MTX en el manejo de la AR. En todos los casos el número de pacientes estudiados fue mayor de 10. Para los estudios experimentales se tuvieron en cuenta los estudios que contemplaron la aleatorización. En los estudios analíticos se incluyeron todos los que contemplaban la exposición, la población objeto y estrategias de control de sesgos.
Tipo de participantesAdultos (edad mayor de 18 años) con diagnóstico de AR y tratamiento con MTX.
Tipo de intervenciónPolimorfismos en MTHFR, ATIC, DHFR, ATYM, FPGS, GGH, SLC10A1 y ABC.
Tipo de desenlacesEficacia del MTX en la progresión de la enfermedad mediante criterios de respuesta ACR 20%. Seguridad del MTX estimando el número de efectos adversos en términos de frecuencia y severidad de dichos eventos.
Búsqueda electrónicaPara identificar los estudios a incluir en esta revisión, se realizó una búsqueda en las bases de datos utilizando la misma estrategia. La búsqueda contempló una combinación de palabras clave y los filtros recomendados de PubMed Central. Se realizó búsqueda manual en referencias relacionadas y autores clave. Se limitó la búsqueda a los idiomas inglés y español.
Términos de búsquedaFiltro: («arthritis, rheumatoid» [MeSH Terms] OR («arthritis» [All Fields] AND «rheumatoid» [All Fields]) OR «rheumatoid arthritis» [All Fields] OR («rheumatoid» [All Fields] AND «arthritis» [All Fields])) AND («pharmacogenetics» [MeSH Terms] OR «pharmacogenetics» [All Fields]) AND («methotrexate» [MeSH Terms] OR «methotrexate» [All Fields]) AND («Polymorphism») [MeSH Terms].
Bases de datos- •
Cochrane Library.
- •
Cochrane Controlled Trials Register: Cochrane Library.
- •
ScienceCitationIndex (1981 - 2015).
- •
MEDLINE (1966-2015).
- •
CINAHL (1982-2015).
- •
SIGLE (1980-2015).
- •
LILACS (1982-2015).
- •
Scielo (2005-2015).
- •
Center of Reviews and Disemination of United Kindom.
- •
Clinical Trials.gov.
Los resúmenes de los artículos encontrados en la búsqueda se revisaron para eliminar los artículos irrelevantes. Posteriormente los artículos relevantes fueron revisados por tres personas independientes para verificar que cumplieran los criterios de inclusión. Las diferencias fueron resueltas por consenso.
Extracción de los datosLos estudios que cumplieron los criterios de inclusión fueron analizados para la extracción de datos. Los datos fueron extraídos independientemente por dos personas (reumatólogo y farmacólogo clínico) expertos en metodología y los resultados fueron reevaluados (epidemiólogo clínico-PhD) para ver la consistencia basados en el formato de recolección de datos diseñado y validado para tal fin. Los datos que se incluyeron fueron: número de pacientes, población, edad, sexo, dosis de MTX, polimorfismo evaluado, desenlace (eficacia–toxicidad), el número de eventos, medidas de frecuencia y asociación, intervalos de confianza y significación estadística.
Medidas del efecto
No se realizó análisis tipo metaanálisis debido a la alta heterogeneidad en los estudios. Por lo tanto se decidió realizar un análisis narrativo de los resultados de los estudios. Los datos fueron recolectados en una tabla de evidencia.
Datos faltantesAlgunos estudios no reportaron medidas de frecuencia o asociación, por lo que se tomó la significación estadística y se comparó con los resultados directos del estudio.
Sesgo de publicaciónSe realizo búsqueda de la literatura en todas las bases de datos relevantes de manera exhaustiva. Se buscó de manera manual información local en la Revista Colombiana de Reumatología, Memorias de la red «Global Arthritis Research Network y del Meeting and Bio-Rheumatology International Congress.
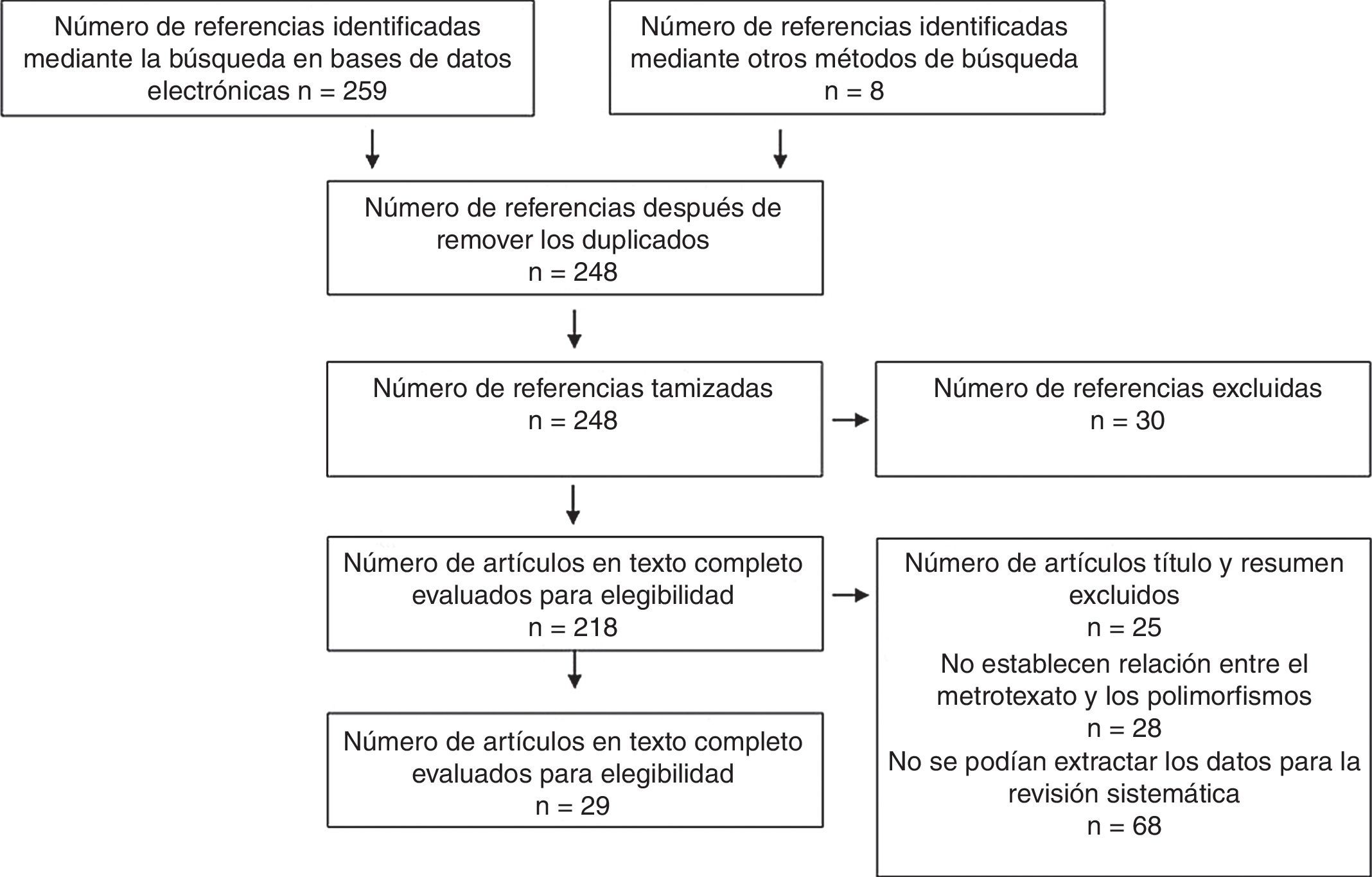
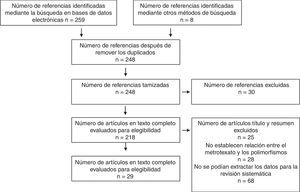
ResultadosFueron identificadas con los términos de búsqueda, un total de 267 referencias. De ellas 215 fueron excluidas después de aplicar los criterios de elegibilidad de sus títulos o resúmenes, con la exclusión de los duplicados. De los 52 estudios restantes, 23 fueron descartados por falta de un grupo control, de aleatorización, claridad en el método de evaluación de los resultados. Finalmente se incluyeron un total de 29 estudios. Todos los estudios elegibles fueron en idioma inglés (figs. 3 y 4).
De los 29 estudios, cinco fueron revisiones sistemáticas o metaanálisis, tres ensayos clínicos de los cuales ninguno fue triple ciego y solo uno fue doble ciego, seis fueron cohortes, siete fueron casos y controles y ocho de corte transversal (tablas 1 y 2).
Estudios de cohorte
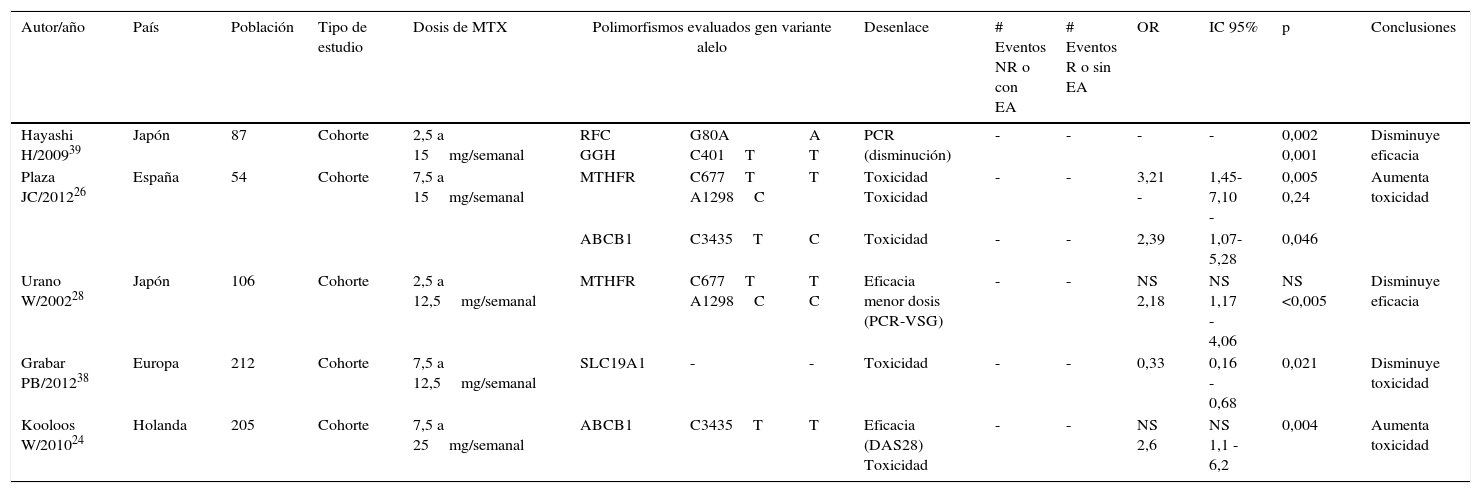
| Autor/año | País | Población | Tipo de estudio | Dosis de MTX | Polimorfismos evaluados gen variante alelo | Desenlace | # Eventos NR o con EA | # Eventos R o sin EA | OR | IC 95% | p | Conclusiones | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hayashi H/200939 | Japón | 87 | Cohorte | 2,5 a 15mg/semanal | RFC GGH | G80A C401T | A T | PCR (disminución) | - | - | - | - | 0,002 0,001 | Disminuye eficacia |
| Plaza JC/201226 | España | 54 | Cohorte | 7,5 a 15mg/semanal | MTHFR | C677T A1298C | T | Toxicidad Toxicidad | - | - | 3,21 - | 1,45-7,10 - | 0,005 0,24 | Aumenta toxicidad |
| ABCB1 | C3435T | C | Toxicidad | - | - | 2,39 | 1,07-5,28 | 0,046 | ||||||
| Urano W/200228 | Japón | 106 | Cohorte | 2,5 a 12,5mg/semanal | MTHFR | C677T A1298C | T C | Eficacia menor dosis (PCR-VSG) | - | - | NS 2,18 | NS 1,17 - 4,06 | NS <0,005 | Disminuye eficacia |
| Grabar PB/201238 | Europa | 212 | Cohorte | 7,5 a 12,5mg/semanal | SLC19A1 | - | - | Toxicidad | - | - | 0,33 | 0,16 - 0,68 | 0,021 | Disminuye toxicidad |
| Kooloos W/201024 | Holanda | 205 | Cohorte | 7,5 a 25mg/semanal | ABCB1 | C3435T | T | Eficacia (DAS28) Toxicidad | - | - | NS 2,6 | NS 1,1 - 6,2 | 0,004 | Aumenta toxicidad |
| Estudios de casos y controles | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor/año | País | Población | Tipo de estudio | Dosis de MTX | Polimorfismos evaluados gen variante alelo | Desenlace | # Eventos NR o con EA | # Eventos R o sin EA | OR | IC 95% | p | Conclusiones | ||
| Mena JP/201129 | México | 70 | Casos y controles | 7,5 a 15mg/semanal | MTHFR | C677T A1298C | C T A C | Aumento de transaminasas | - | - | 1,1 0, 0,36 2,5 | 0,46-2,61 0,38-2,14 0,14-0,89 1,11-6,75 | 0,821 0,821 0,023 0,023 | Aumenta toxicidad |
| Jekic B/201322 | Belgrado | 184 | Casos y controles | 10 a 12,5mg/semanal | TYMS GGH | 3RG/3RC G354T | 3RG/3RG GG | DAS 28 (disminución) Mielosupresión | NR 38 MS 8 | R 146 176 | 5,4 --- | 1,4-21,1 --- | 0,002 0,003 | Disminuye eficacia |
| Aggarwal P/200630 | India | 150 | Casos y controles | 7,5 a 15mg/semanal | MTHFR | C677T | T | Eficacia (DAS28) | 64 | - | No diferencias | No relación | ||
| Takatori R/200627 | Japón | 124 | Casos y controles | 6mg/semanal | ABCB1 | C3435T | C | Eficacia (CA, VSG,PCR) Toxicidad | - | - | 8,78 NS | 1,13 - 68,5 NS | 0,038 NS | Aumenta toxicidad |
| ATIC RFC1 TYMS | C347G G80A | - | - | - | NS | NS | NS | No relación | ||||||
| Hayashi H/201343 | Japón | 170 | Casos y controles | 2 - 12MG/semanal | RFC1 | G80A | AA | Eficacia | - | - | 2,27 | 1,35 - 3,84 | 0,0018 | Disminuye eficacia |
| Pawlik A/200731 | Polonia | 50 | Casos y controles | 7,5 a 15mg/semanal | MTHFR | C677T A1298C | T C | Eficacia | - | - | 2,3 1,15 | 0,76 -7,01 0,45 - 2,91 | NS | No relación |
| Estudios de corte transversal | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor/año | País | Población | Tipo de estudio | Dosis de MTX | Polimorfismos evaluados gen variante alelo | Desenlace | # Eventos NR o con EA | # Eventos R o sin EA | OR | IC 95% | p | Conclusiones | ||
| Dervieux T/200440 | EE. UU. | 226 | Corte transversal | 5 a 25mg/semanal | RFC GGH | G80A C401T | A T | Aumento de concentración de MTX | - | - | 4,8 3,4 | 1,8 - 13 1,4 - 8,4 | 0,002 0,007 | Aumenta eficacia |
| Owen SA/201320 | UK | 309 | Corte transversal | 5 a 15mg/semanal | ATIC SLC19A1 | C347G | - | Eficacia | - | - | 1,65 1,86 | 1,13 - 2,42 1,26- 2,74 | 0,01 0,001 | Disminuye Eficacia |
| Weisman M/200632 | EE. UU. | 214 | Corte transversal | 7,5 a 15mg/semanal | MTHFR TSER ATIC SHMT1 | C677T G347G C1420C | - | Toxicidad | - | - | 3,3 5,38 2,97 2,38 | 1,72 - 6,45 3,05 - 9,49 1,64 - 5,36 1,19 - 4,77 | 0,01 <0,01 <0,01 <0,05 | Aumenta toxicidad |
| Drozdzik M/200741 | EE. UU. | 174 | Corte transversal | 7,5 a 15mg/semanal | RFC1 | G80A | AA | Aumento de MTX, eficacia y transaminasas | - | - | 3,32 | 1,26 - 8,79 | 0,021 | Aumenta eficacia |
| Berkun Y/200435 | - | 93 | Corte transversal | 7,5 a 15mg/semanal | MTHFR | A1298C | AA | Disminución de eventos adversos | - | - | 5,24 | 1,38 - 20 | 0,03 | Disminuye EA y eficacia |
| Kim SK/200633 | Korea | 385 | Corte transversal | 7,5 a 15mg/semanal | MTHFR | C677T | T | Toxicidad | - | - | 3,8 | 2,29 - 6,33 | <0,05 | Aumenta toxicidad |
| Kurzawski M/200744 | Polonia | 174 | Corte transversal | 7,5 a 15mg/semanal | MTHFR | C677T A1298C | T C | Eficicia Toxicidad | - | - | 2,61 1,93 | 1,35 - 5,04 1,19 - 3,77 | - | Aumentan la frecuencia de remisión |
| Tanigushi A/200734 | Tokio | 208 | Corte transversal | 6mg/semanal | MTHFR | C677T | T | Aumento de transaminasas | - | - | 2,4 | 1,29 - 4,55 | 0,003 | Aumenta toxicidad |
| Ensayos clinicos controlados | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor/año | País | Población | Tipo de estudio | Dosis de MTX | Polimorfismos evaluados gen gariante alelo | Desenlace | # Eventos NR o con EA | # Eventos R o sin EA | OR | IC 95% | p | Conclusiones | ||
| van Ede A/200136 | EE. UU. | 236 | Ensayo clínico | 7,5 a 25mg/semanal | MTHFR | C677T | T | Aumento de transaminasas | - | - | 2,27 | 1,06 - 5,34 | - | Aumenta toxicidad |
| Wessels J/200637 | EE. UU. | 247 | Ensayo clínico | 7,5 a 15mg/semanal | MTHFR | C677T A1298C | T C | Eficicia | - | - | 2,23 | 1,18 - 4,41 | 0,014 | Aumenta eficacia |
| MTHFR | A1298C | C | Toxicidad | - | - | 2,5 | 1,32 - 4,72 | 0,005 | Aumenta toxicidad | |||||
| Wessels J/200645 | EE. UU. | 247 | Ensayo clínico | 7,5 a 15mg/semanal | AMPD1 ATIC ITP4 | C34T C347G C94A | - | Eficacia (DAS) | - | - | 2,1 2,5 2,7 | 1 - 4,5 1,3 - 4,7 1,1 - 8,1 | NS <0,05 NS | Aumenta eficacia |
Revisiones sistemáticas y metaanálisis
| Autor/año | Tipo de estudio | N.° de estudios | Tipos de estudios primarios | Población | Polimorfismos incluidos | Desenlace | OR | IC | Observaciones |
|---|---|---|---|---|---|---|---|---|---|
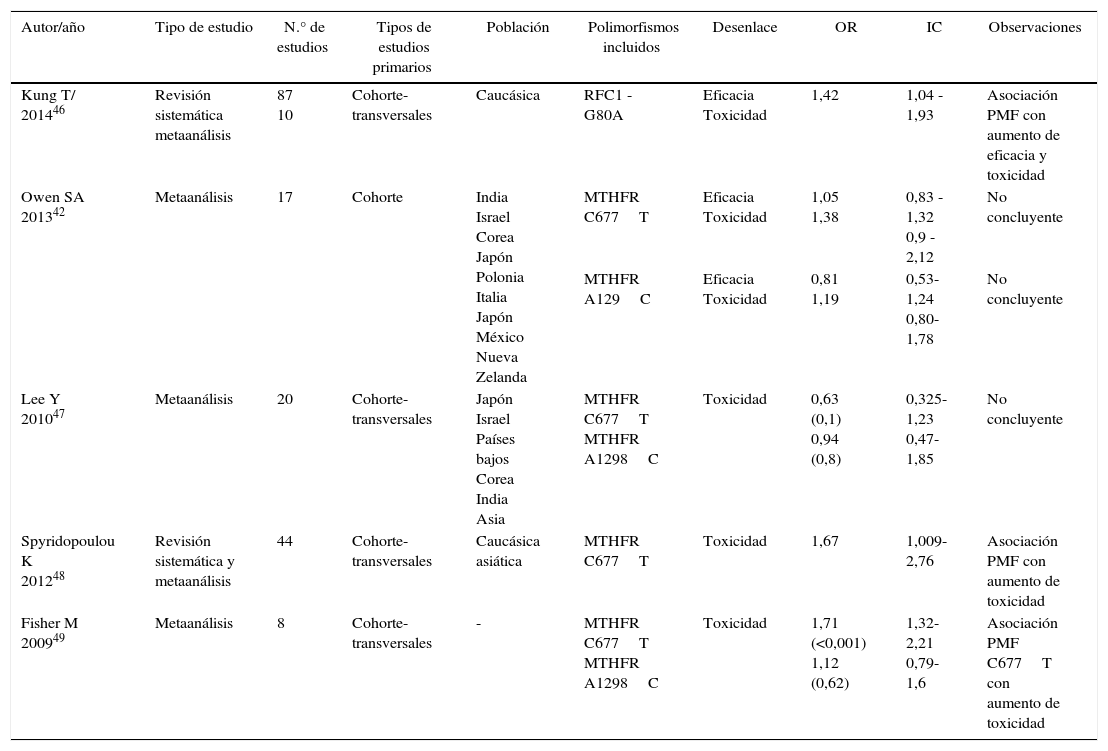
| Kung T/ 201446 | Revisión sistemática metaanálisis | 87 10 | Cohorte-transversales | Caucásica | RFC1 - G80A | Eficacia Toxicidad | 1,42 | 1,04 - 1,93 | Asociación PMF con aumento de eficacia y toxicidad |
| Owen SA 201342 | Metaanálisis | 17 | Cohorte | India Israel Corea Japón Polonia Italia Japón México Nueva Zelanda | MTHFR C677T | Eficacia Toxicidad | 1,05 1,38 | 0,83 - 1,32 0,9 - 2,12 | No concluyente |
| MTHFR A129C | Eficacia Toxicidad | 0,81 1,19 | 0,53-1,24 0,80-1,78 | No concluyente | |||||
| Lee Y 201047 | Metaanálisis | 20 | Cohorte-transversales | Japón Israel Países bajos Corea India Asia | MTHFR C677T MTHFR A1298C | Toxicidad | 0,63 (0,1) 0,94 (0,8) | 0,325-1,23 0,47-1,85 | No concluyente |
| Spyridopoulou K 201248 | Revisión sistemática y metaanálisis | 44 | Cohorte-transversales | Caucásica asiática | MTHFR C677T | Toxicidad | 1,67 | 1,009-2,76 | Asociación PMF con aumento de toxicidad |
| Fisher M 200949 | Metaanálisis | 8 | Cohorte-transversales | - | MTHFR C677T MTHFR A1298C | Toxicidad | 1,71 (<0,001) 1,12 (0,62) | 1,32-2,21 0,79-1,6 | Asociación PMF C677T con aumento de toxicidad |
Tres estudios evaluaron la presencia del polimorfsmo ABCB1, dos estudios de cohorte y un estudio de casos y controles. Los estudios de Plaza et al., 2012 y Kooloos et al., 2010, evidencian una asociación clara entre la presencia del polimorfismo ABCB1 y el aumento de la toxicidad por el MTX con OR 2,39 IC95% (1,07-5,28) y OR 2,6 IC95% (1,1–6,2) respectivamente24,26. El estudio de casos y controles publicado por Takatori et al., 2006, también reportó una asociación, estadísticamente significativa entre la presencia del polimorfismo y el aumento de la toxicidad del MTX, OR 8,78 IC95% (1,13-68,5)27.
Polimorfismo MTHFRDoce estudios fueron identificados para la evaluación del polimorfismo MTHFR. Los diseños de estudio fueron 2 estudios de cohorte, 3 estudios de casos y controles, 5 estudios de corte transversal y 2 ensayos clínicos controlados.
Estudios de cohorte. En los estudios de cohorte se estableció una relación entre el polimorfismo y la disminución de la efectividad del MTX, el estudio de Plaza et al.26, 2012 estableció que presenta una asociación de riesgo de toxicidad con el MTX, OR 3,21 IC95% (1,45–7,10), en el estudio de Urano et al.28, 2002 se estableció una relación para la disminución de la efectividad del MTX para el control de la enfermedad, OR 2,18 IC 95% (1,17-4,06). En los estudios de casos y controles la asociación no es consistente. En el estudio publicado por Mena et al.29, 2001 se estableció la relación entre la presencia del polimorfismo de MTHFR y el aumento de toxicidad del MTX para todos los alelos evaluados C677T y A1298C, sin embargo solo para el alelo A1298C esta relación fue estadísticamente significativa para el aumento de la toxicidad con el MTX, OR 2.75 IC95% (1,11-6,75). Los estudios de Aggarwal et al.30, 2006 y Pawik et al.31, 2007 no pudieron establecer una clara asociación entre la presencia del polimorfismo y el comportamiento terapéutico del MTX.
En los estudios de corte transversal la evidencia no es consistente. Los estudios de Weisman et al.32, 2006, Kim et al.33, 2006, y Tanigushi et al.34, 2007 reportaron para el polimorfismo con el alelo C677T, una asociación con el aumento de toxicidad del MTX, OR 3,3 IC95% (1,72–6,45); OR 3,8 IC95% (2,29-6,33) y OR 2,4 IC95% (1,29–4,55) respectivamente. El estudio de Berkun et al.35, 2004 reportó una relación estadísticamente significativa entre la presencia de este polimorfismo y la disminución en el número de eventos adversos, OR 5,24 IC95% (1,38-20) (tabla 1). Dos ensayos clínicos controlados reportaron la asociación entre la presencia del polimorfismo con el gen C677T para dos desenlaces opuestos. El estudio de van Ede et al.36, 2001 estableció una asociación de riesgo entre la presencia del polimorfismo y el aumento de toxicidad con MTX, OR 2,27 IC95% (1,06-5,34) y el estudio de Wessels et al.37, 2006 que estableció una asociación con mejora de la eficacia del MTX en individuos con presencia de este polimorfismo, OR 2,23 IC95% (1,18-4,41).
Polimorfismo SLC19A1Solo un estudio de cohorte, que evaluara la asociación de este polimorfismo y el comportamiento del MTX, se incluyó en esta revisión sistemática. El estudio de Grabar et al.38, 2012 estableció que la presencia de este polimorfismo disminuye la toxicidad por MTX, OR 0,33 IC95% (0,16–0,68).
Polimorfismo RFCCinco estudios evaluaron la presencia de este polimorfismo y el comportamiento terapéutico del MTX. Un estudio de cohorte, dos estudios de casos y controles y dos estudios de corte transversal fueron incluidos en esta revisión sistemática para la evaluación de este polimorfismo. En el estudio de cohorte realizado por Hayashi et al.39, 2009 se evidenció una asociación entre la disminución de la eficacia del MTX y la presencia de este polimorfismo; el mismo autor publicó en el año 2013 un estudio de casos y controles donde evaluaron la asociación entre la presencia del polimorfismo RFC1 y la efectividad del MTX el cual evidenció que esta asociación disminuye la efectividad del MTX, OR 2,27 IC95% (1,35–3,84). Otro estudio de casos y controles, publicado por Takatori et al.27, 2006, no estableció relación entre la presencia de este polimorfismo y la efectividad del MTX y toxicidad. En dos estudios de corte transversal, Dervieux et al.40, 2004 y Drozdzik et al.41, 2007 establecieron una asociación entre la presencia del polimorfismo y el aumento de la eficacia del MTX, OR 4,8 IC95% (1,8–13) y OR 3,32 IC95% (1,26-8,79) respectivamente.
Otros polimorfismosLos polimorfismos GGH, ATIC, TSER han sido explorados por diferentes autores, en esta revisión el estudio de Dervieux et al.40, 2004 establece que la presencia del polimorfismo GGH aumenta la eficacia del MTX, OR 3,4 IC95% (1,4–8,4). Owen et al.20,42, 2013 encontraron una asociación entre la presencia del polimorfismo ATIC y la disminución de la efectividad del MTX, OR 1,65 IC 95% 1,13–2,42; otro autor, Weissman et al., 2006, evidenció para el mismo polimorfismo una asociación con el aumento de toxicidad OR 2,97 IC95% (1,64–5,36). Este mismo autor exploró la relación de aumento de la toxicidad del MTX y la presencia del polimorfismo TSER estableciendo un OR de 5,38 IC95% (3,05–9,49)32.
Características poblacionales, polimorfismos y genotiposEl efecto de la variación genética de la ruta metabólica del MTX está dada por polimorfismos en enzimas como la MTHFR, algunos transportadores de MTX a través de la membrana celular y enzimas influyentes de la ruta metabólica. Diferentes SNP han sido ligados a los efectos adversos o a la respuesta terapéutica de este fármaco: C677T y A1298C estudiados en poblaciones caucásica y japonesa28,50. Así mismo, polimorfismos relacionados con el transportador de folato reducido RFC1-G80A y ATIC-C347G han sido estudiados en poblaciones caucásica, asiática, africana y mexicana10,51.
Un estudio realizado en población mestiza de México reportó diferentes PMF, encontrándose que el genotipo de riesgo MTHFR C677T presentó una elevada prevalencia del 33% genotipo TT, el genotipo de riesgo AA MTHFD1 G1958A en los mestizos fue de 34% y para los amerindios de 58%, a diferencia de las poblaciones con ascendencia asiática y africana en donde la frecuencia de AA fue baja (4%), demostrando que existe una distribución geográfica diferencial de las variantes de riesgo en la vía metabólica del folato/homocisteína en relación con el origen étnico51,52.
Han sido descritos polimorfismos de ABC B1, como el C3435T (rs1045642) que se asocia de forma positiva con la respuesta al tratamiento con MTX para AR y en algunos casos con aumento de la toxicidad. Otro de los PMF es el rs4793665 del ABC C3 con asociación positiva en cuanto a efectividad al tratamiento26,53. En RFC/SLC19A1, los pacientes que portan el alelo G en G80A (rs1051266) tienen una captación intracelular de MTX menor en comparación con los que portan el alelo A, lo cual llevaría a menor eficacia17,43. Un estudio reciente realizado en población portuguesa sugiere mayor toxicidad gastrointestinal temprana en los portadores del alelo G, la cual se reduce significativamente con el suplemento de ácido fólico54. En un estudio realizado con población del Treatment of Early Aggressive Rheumatoid Arthritis se encontró asociación de variantes en el gen SLC22A2 con una mejor respuesta al MTX55.
En pacientes con genotipo AA o AG de FPGS 2572CT (rs1544105) y con AR se ha encontrado pobre respuesta al MTX y en pacientes con genotipo SNP 63942342CT (rs12681874) del GGH, se ha encontrado asociación con mayor eficacia56. El genotipo no TT de GGH T16C (rs1800909) se asoció con mayor riesgo de disfunción hepática y el polimorfismo-354T GGH-G se relacionó con mayor riesgo de mielosupresión20,22.
En estudios con el gen TYMS se ha encontrado que el genotipo 3G/3G del alelo 3R se asocia con mala respuesta al MTX en pacientes con AR22. En pacientes con el SNP ATIC 26293TC (rs12995526) se encontró asociación con inadecuada respuesta al tratamiento con MTX y las variantes rs3821353, rs7563206 y rs16853834 se han asociado con mayor eficacia23.
Para el polimorfismo C677T de la MTHFR se reportaron asociaciones negativas en cuanto a toxicidad24,25. Sin embargo en pacientes con AR con el genotipo CT o TT se ha encontrado mayor riesgo de efectos adversos que aquellos con el genotipo CC57, estos estudios han sugerido una asociación entre C677T y toxicidad del MTX en caucásicos y en asiáticos. No se ha encontrado asociación positiva entre polimorfismo C677T y la efectividad terapéutica58,59.
En cuanto al PMF A1298C de MTHFR, hay estudios que reportan asociación con efectividad y toxicidad y otros que no la encuentran significativa. La variante rs1801131C prevalece en el grupo que responde al MTX, pacientes con genotipos CC o CA tienen mayor respuesta clínica que aquellos con genotipo AA; además, A1298C se ha asociado con elevación de las transaminasas29.
En las revisiones sistemáticas y metaanálisis (tabla 2) es evidente que el polimorfismo de RFC1 - G80A se asocia con aumento de eficacia y toxicidad y el PMF del gen MTHFR C677T se asocia con toxicidad en pacientes tratados con MTX.
Discusión y conclusionesNo cabe duda acerca de la importancia del MTX en el tratamiento de los pacientes con AR. Todas las guías publicadas por organismos internacionales coinciden en que debe ser el fármaco de primera línea. Su bajo costo y su buen perfil de seguridad así lo justifican. El MTX es actualmente el medicamento más utilizado en el tratamiento de la AR en todo el mundo60 y ha resultado ser más efectivo que otros DMARD61. Sin embargo, la respuesta terapéutica medida por el constructo ACR 20% es alcanzada en promedio por el 45% de pacientes62. El número considerable de pacientes con falla terapéutica se debe a la eficacia limitada y la toxicidad de la monoterapia, representada en efectos adversos frecuentes producto de la variabilidad individual en la respuesta14. Han sido hasta el momento muchas las variantes genéticas estudiadas y los resultados son contradictorios. La mayoría de los autores coinciden en el potencial de la farmacogenética en reumatología, pero hacen énfasis en que con los datos obtenidos en los diferentes estudios realizados a la fecha, no existe información lo suficientemente robusta para recomendar el uso de alguna de estas pruebas genéticas en la práctica clínica.
Este estudio presenta limitaciones inherentes al diseño. Se presenta posible sesgo de publicación debido a que no se buscó información en bases de datos específicas de reumatología solo memorias de congresos y la Revista Colombiana de Reumatología. Así mismo se limitó la búsqueda solo a los idiomas español e inglés. No se pudo realizar metaanálisis debido al reporte diferencial de los diferentes desenlaces clínicos. Los resultados de esta revisión sistemática se deben realizar con precaución.
En esta revisión es claro que existen dos polimorfismos que los metaanálisis han demostrado aumentar la eficacia y toxicidad del MTX: en el gen RFC1 - G80A y el del gen MTHFR C677T. Sin embargo, otras variantes genéticas han mostrado asociación en estudios individuales. El estudio de estas variantes es importante en población colombiana para lograr una mejor compresión de la variabilidad interindividual y racial. El objetivo final para el médico y el paciente será establecer una terapia personalizada que lleve a una mejor y pronta respuesta en los pacientes con AR con la correspondiente disminución de eventos adversos.
De acuerdo con la revisión, en Colombia y Sudamérica no hay estudios que estimen la prevalencia de estos polimorfismos en pacientes con AR que reciben tratamiento con MTX, más aún teniendo en cuenta la prevalencia y el impacto que esta enfermedad tiene en la población y el sistema de salud51,63,64. Esto hace necesario determinar en la población mestiza colombiana, mezcla del blanco europeo con el negro africano y el indígena precolombino, la presencia de variaciones genéticas que condicionen la repuesta al tratamiento con MTX.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.