La artritis reumatoide (AR) es una enfermedad de alto costo, que permite clasificar a los pacientes en fase temprana o establecida.
ObjetivoEl propósito de este trabajo fue hacer un análisis de costo-efectividad, comparando ambas fases con datos de pacientes a un horizonte temporal de 6 meses, desde la perspectiva del tercer pagador.
Materiales y métodosSe delimitó la población. Se estimaron los costos y las efectividades de cada una de las fases. Se desarrolló un modelo de evaluación económica de tipo árbol de decisión y se calculó la razón incremental costo-efectividad (RICE) con sus respectivos análisis de sensibilidad, tanto determinístico como probabilístico.
ResultadosEn términos de costos, se encontró que, para una efectividad en metas, el costo fue 85% mayor en la fase establecida que en la fase temprana. Igualmente, para una efectividad en no metas, el costo fue 77% mayor en la fase establecida que en la fase temprana. Por otra parte, los resultados de efectividad salieron a favor de esta última en comparación con la fase establecida. Con respecto a la RICE, se determinó que el abordaje en fase temprana ahorra $2.326.389 pesos colombianos moneda corriente (COPcte) por paciente en metas a los seis meses de tratamiento, en contraste con el abordaje en la fase establecida.
ConclusiónEl abordaje clínico de la AR en la fase temprana es una alternativa menos costosa y más efectiva vs. la fase establecida, ya que genera ahorros para el tercer pagador en un horizonte temporal de seis meses, desde su perspectiva.
Rheumatoid arthritis (RA) is a high-cost disease, which allows patients to be classified into early or established phase approaches.
ObjectiveThe purpose of this work was to perform a cost-effectiveness analysis comparing both phases with patient data at a 6-month time horizon from a third-party payer perspective.
Materials and methodsThe population was delimited. The costs and effectiveness of each of the phases were estimated. A decision tree-type economic evaluation model was developed, and the Incremental Cost-Effectiveness Ratio (ICER) was calculated with the respective sensitivity analyses, both deterministic and probabilistic.
ResultsIn terms of costs, it was found that for effectiveness in goals, the cost was 85% higher in the established than in the early phase. Similarly, for non-target effectiveness, the cost was 77% higher in the established than in the early phase. On the other hand, the effectiveness results were better in the early phase compared to the established phase. Regarding the ICER, it was determined that the early phase approach saves $2,326,389 COPcte (colombian pesos current currency) per patient in goals at 6 months of treatment, compared to the established phase approach.
ConclusionThe clinical approach to early-stage rheumatoid arthritis is a less costly and more effective alternative vs. the established phase, as it generates savings for the third-party payer over a 6-month time horizon, from a third-party payer perspective.
La artritis reumatoide (AR) es una enfermedad crónica inflamatoria sistémica que, sin tratamiento, genera discapacidad, dolor, reducción de la calidad de vida y mortalidad prematura1. Según el Fondo Colombiano de Enfermedades de Alto Costo (CAC), si bien la prevalencia mundial de AR es baja (0,2 – 5%), en Colombia para el 2018 fue de 0,23 casos por 100 habitantes y la incidencia de 13,78 por 100.000 habitantes. Además, las entidades territoriales colombianas con mayor prevalencia en el 2018 fueron Bogotá D.C., Risaralda, Caldas y Antioquia; igualmente, la media de la edad de los pacientes reportados fue de 57,8 años, con una razón hombre mujer de 1:5, y el rango de edad promedio de diagnóstico de AR fue de 36 a 64 años2.
Por otra parte, los pacientes con AR pueden clasificarse en fase temprana o fase establecida3–7. Según la temporalidad, la primera se define como ≤ 12 meses desde que comienzan los síntomas hasta el inicio del tratamiento con fármacos modificadores de la enfermedad (FARME), y la fase establecida corresponde a >12 meses de que empiezan los síntomas hasta el inicio del FARME5. Además, las dos fases son mutuamente excluyentes y no consecutivas, es decir, una vez un paciente esté clasificado en una de las fases, nunca estará en la otra, debido a que existe un único primer tiempo de inicio de los síntomas y del tratamiento en la vida de la persona3,5,7.
Ahora bien, en el curso temprano de la enfermedad, la AR presenta un fenotipo con alteraciones inmunorreguladoras que pueden ser temporal o definitivamente bloqueadas. Por tanto, su tratamiento en fase temprana es más favorable para los pacientes, ya que se puede prevenir el daño articular a largo plazo y es posible mejorar de manera acumulativa la calidad de vida de estos8. Asociado a lo anterior, en el reporte de la CAC al 2018, se expuso con preocupación que los indicadores de oportunidad se calificaron como «de bajo cumplimiento». Dichos indicadores son: el tiempo transcurrido entre el inicio de los síntomas y la atención por el especialista; la relación entre el tiempo transcurrido entre el inicio de los síntomas y el diagnóstico; y el tiempo transcurrido entre el inicio de los síntomas y el tratamiento con FARME2.
También, es importante abordar el concepto de los niveles de actividad de la AR, los cuales son, según su puntuación del Disease Activity Score-28 (DAS28): remisión (DAS28 < 2,4), leve (≥ 2,4 DAS28 < 3,6), moderada (≥ 3,6 DAS28 < 5,5) y severa (DAS28 ≥ 5,5)8. En ese sentido, cuando un paciente está en alguno de los primeros dos niveles (remisión o leve), se clasifica en «metas», por lo cual, estaría en «no metas» si la actividad de su enfermedad se clasifica como moderada o severa9. De este modo, a escala internacional, incluyendo a Colombia, se han determinado como objetivo terapéutico los niveles de remisión o baja actividad de la enfermedad para prevenir complicaciones propias de esta o discapacidad y mejorar la calidad de vida de los pacientes9,10. Además, este es un objetivo terapéutico que se puede alcanzar a corto plazo; por ello, a los seis meses se puede clasificar al sujeto en metas o no metas10. Si se contextualiza este concepto en Colombia, la CAC informó que al 2018, de los pacientes que iniciaron en nivel de actividad alta, tan solo 44% pasó a remisión y 69% terminó en alta, lo cual es preocupante y requiere atención, dado que la mayoría no alcanzó el objetivo terapéutico deseado2.
Por otra parte, la AR se clasifica como una enfermedad de alto costo debido al elevado consumo de recursos por disminución de la productividad laboral del paciente, complicaciones médicas, gasto de bolsillo, medicamentos, hospitalizaciones, cirugías y asistencia profesional interdisciplinaria1,5,8. De este modo, con base en el reporte de la CAC al 2018, el costo estimado promedio semestral por paciente en remisión fue de $15.885.885 millones pesos colombianos moneda corriente (COPcte)2, por lo cual, si todos los pacientes del periodo evaluado en ese reporte (79.199)2 hubieran alcanzado remisión al 2018, el costo de su manejo hubiera sido de 1,2 billones de pesos, aproximadamente. Lo anterior nos llevó a preguntarnos: ¿cómo podríamos aportar desde la farmacoeconomía para que, como país, logremos que todos nuestros pacientes, o al menos la mayoría, logren «metas», y a un costo mucho menor?
Asimismo, surgió la pregunta: ¿existe un análisis de costo-efectividad que compare el abordaje clínico de la AR en fase temprana vs. fase establecida en Colombia? Dicha pregunta tuvo una notoria relevancia en el Hospital Universitario de la Fundación Santa Fe de Bogotá (HUFSFB, institución prestadora de servicios de salud de cuarto nivel de Colombia), porque un amplio número de sus pacientes eran remitidos por la Entidad Promotora de Salud (EPS) al especialista después de 12 meses del inicio de los síntomas, de manera que terminaban clasificados en fase establecida. Por consiguiente, se hizo la búsqueda de investigaciones que permitieran evaluar, en el contexto colombiano, la costo-efectividad del abordaje en una cohorte real de pacientes con AR, para lo cual se comparó la fase temprana con la establecida para dimensionar a nivel económico la importancia de otorgar viabilidad al desarrollo de programas de salud que promuevan el diagnóstico y el tratamiento temprano de la AR. Sin embargo, no se encontraron publicados estudios de costo-efectividad que los soportaran.
En ese sentido, el propósito de esta investigación fue llevar a cabo una evaluación económica de costo-efectividad que comparara el abordaje entre las dos fases y que respondiera a la pregunta: ¿qué tan costoso y efectivo es tratar a los pacientes en fase temprana, en comparación con la fase establecida? Para buscar una respuesta, los objetivos principales de esta investigación fueron determinar y analizar la costo-efectividad del abordaje de AR en una cohorte de pacientes en fase temprana vs. en fase establecida. Por tanto, se formularon como objetivos específicos identificar los costos de las dos en pacientes con AR; establecer la efectividad del abordaje de la fase temprana y la efectividad del abordaje de la fase establecida en dichos pacientes; y, por último, estimar la razón incremental costo-efectividad (RICE).
A partir de lo anterior, se generó nuevo conocimiento en el contexto nacional colombiano que permitió conocer y evaluar la pertinencia del abordaje en fase temprana vs. en fase establecida en el manejo de la AR. De esa manera, las entidades administradoras de planes de beneficios podrán definir políticas en salud, de acuerdo con el costo incremental por unidad de efectividad y con base en datos no simulados, sino provenientes de una cohorte real. Asimismo, quien se disponga a estudiar este tema con mayor profundidad, encontrará aquí una base para su investigación que contribuya a conocer el impacto presupuestal a escala nacional del abordaje de la fase temprana vs. la fase establecida, de manera que los programas de manejo de la AR en Colombia sean cada vez mejores.
Materiales y métodosDelimitación de la población en estudio y problema de investigaciónDe conformidad con los parámetros de la pregunta PICOT, la cual se compone de cinco partes: Patient, Intervention, Comparison, Outcome y Time, se seleccionaron como población de estudio pacientes adultos con diagnóstico AR; como intervención de interés, el abordaje en fase temprana (entiéndase «intervención» como el momento en el tiempo cuando el paciente con AR inicia el abordaje clínico); como comparador, el abordaje en fase establecida; como desenlace por evaluar, el nivel de la enfermedad clasificado en «metas»11; y como horizonte temporal, seis meses ± un mes de seguimiento, tanto para costos como para efectividades. Con respecto al horizonte temporal, no se eligió exactamente el de seis meses, debido a que no todos los pacientes asistieron a un seguimiento a sus primeros seis meses de tratamiento10–15.
Recolección de la informaciónSegún el HUFSFB, los datos del abordaje clínico de los pacientes fueron consignados en historias clínicas5. Posteriormente, por medio de minería de datos se extrajo por parte del HUFSFB la información hacia la base de datos de tal forma que aseguraron su validez5.
Ahora bien, para esta investigación, se determinó que no podía haber diferencia de fondo entre el abordaje clínico que se ofrece tanto para los pacientes de la fase temprana como para los de la fase establecida, de modo que se pudo analizar si hay discrepancia en los costos y las efectividades a causa de la fase de la enfermedad. Con el fin de garantizar que no hubiera diferencias en el abordaje clínico, se escogieron los datos del HUFSFB específicos, por varias razones. En primera instancia, el abordaje clínico en el HUFSFB es un protocolo de tratamiento basado en un modelo de atención integral que se ciñe a las guías de práctica clínica nacionales, y es estandarizado (los criterios de remisión por parte de la EPS al modelo, el ingreso del paciente, el examen físico y los exámenes paraclínicos; estos últimos se toman y analizan en un mismo centro)5. Segundo, el modelo de atención está monitoreado internamente, de modo que la entidad garantiza la adherencia por parte de los profesionales de la salud al protocolo de atención definido por en el HUFSFB5. Tercero, el modelo del HUFSFB permite hacer la comparación entre los momentos del abordaje, ya sea en fase temprana o en fase establecida, puesto que el modelo de atención no tiene diferentes rutas de atención según la fase5. En ese sentido, se disminuyó el sesgo de que el abordaje clínico fuera diferente para cada una de las fases5. Por último, en este modelo no hay una restricción en la prescripción de recursos, es decir, se receta lo que el paciente requiera, según lo que necesite para abordar la enfermedad, sin que sea determinante la fase para limitar de antemano la prescripción5. Por tanto, el modelo de atención integral del HUFSFB resulta fundamental, dado que permite evaluar si el diferencial de costos se debe a la fase en que se encuentra el paciente5.
Descripción de la cohorte y diseño de la muestraLa base de datos recibida desde el HUFSFB tenía registros de pacientes y sus prescripciones desde mayo del 2013 hasta diciembre del 2018, para un total de 971 sujetos (181 en fase temprana y 790 en fase establecida). La selección se llevó a cabo mediante un procedimiento no probabilístico que consistió en incluir a todos los pacientes de la base de datos que cumplían con los siguientes criterios de inclusión y exclusión5:
Criterios de inclusión
- a)
Registro de datos completos y consistentes con las historias clínicas
- b)
Confirmación del diagnóstico de AR
- c)
Tener al menos un seguimiento
- d)
Hombres y mujeres mayores de 18 años
- e)
Sin otras enfermedades inmunológicas
Criterio de exclusión: seguimientos duplicados por fecha de atención.
Posteriormente, se llevó a cabo un análisis univariado y se realizó un emparejamiento por Propensity Score16. Por último, se seleccionaron los pacientes que cumplían con el horizonte temporal de seis meses ± un mes de seguimiento.
CostosSe estimaron los costos médicos directos semestrales bajo los parámetros PICOT mencionados. Así, dado que la base de datos no contenía el costo del abordaje, se procedió a identificar, cuantificar y valorar los eventos generadores de costo, con el supuesto de que lo prescrito fue lo dispensado, y también lo consumido por los pacientes. No se aplicó tasa de descuento16,17.
En relación con la direccionalidad de los costos, la recopilación del uso de los eventos generadores de costo se hizo de abajo hacia arriba, hasta llegar a la obtención del costo total de la intervención para los pacientes de cada fase según su efectividad final, metas o no metas18. Por otra parte, la técnica de asociación de los costos se basó en actividades, siendo estas los medicamentos, los laboratorios clínicos, las hospitalizaciones y las consultas17. Asimismo, la unidad de medida de los costos fue COPcte.
Con respecto a la identificación de los costos18, el código para los medicamentos fue el Código de Clasificación Anatómica-Terapéutica-Química (ATC) y para los demás eventos generadores de costo fue el código Seguro Obligatorio de Accidentes de Tránsito (SOAT)18. Acerca del proceso de cuantificación de los costos, se realizó un conteo de la cantidad de los eventos generadores de costo identificados, de modo que se calculó el porcentaje de uso para cada evento generador de costo18.
En cuanto a lo que refiere a la valoración de los eventos generadores de costo, las fuentes utilizadas fueron el Sistema de Información de Precios de Medicamentos 201819, el Manual tarifario SOAT20 y la Circular 04 del 2018 de la Comisión Nacional de Precios de Medicamentos y Dispositivos Médicos21. Además, los valores unitarios utilizados fueron los del 2018 para todos los pacientes, independientemente de en qué momento del periodo comprendido entre mayo 2013 y diciembre 2018 hayan tenido sus seis ± un mes de seguimiento.
Con respecto a los eventos adversos a medicamentos18, se comparó el número de pacientes en metas en ambas fases y se calcularon los valores p, pero no se encontró diferencia en cuanto a la proporción de sujetos que presentaron evento adverso. Por tanto, en el modelo no se incluyeron las probabilidades de evento adverso. En la base de datos entregada y autorizada para esta evaluación solo había datos del número de pacientes con evento adverso, y se especificaba a qué medicamento estaba asociado, pero faltaba información detallada acerca del tipo de evento; sin embargo, la HUFSFB explicó que, según las historias clínicas confidenciales, se trató de eventos menores que se manejaron con disminución de dosis del medicamento o con el retiro de este.
Para el costeo que se expondrá en el análisis, se calculó el costo promedio semestral de un paciente por evento generador de costo entre los sujetos que usaron el evento, de la siguiente manera: la cantidad del evento se multiplicó por su valor unitario y se dividió entre el número de pacientes que utilizaron el evento; luego, se totalizaron estos resultados por actividad correspondiente (medicamentos, laboratorios clínicos, internaciones hospitalarias y consultas). Los costos ingresados en el modelo se calcularon con la siguiente diferencia: se multiplicó la cantidad por el valor unitario de cada evento generador de costo, se totalizó, y luego se dividió por el número total de pacientes del subgrupo correspondiente (entiéndase fase temprana metas, temprana no metas, establecida metas, establecida no metas), de manera que solidariamente se asumió el costo entre todos los pacientes del subgrupo. Esto se determinó de tal manera, dado que las probabilidades de efectividad usadas en el modelo eran únicas por subgrupo.
EfectividadEn esta evaluación económica se escogió como medida de efectividad18 para el caso base, el porcentaje de pacientes de cada fase que estaban en metas10 al horizonte temporal de los primeros seis meses ± un mes de seguimiento. Se calculó el dato de la efectividad mínima restando 10% a la efectividad del caso base; asimismo, el dato de la efectividad máxima se obtuvo después de sumar 10%.
ModeloSe diseñó un modelo analítico de árbol de decisión que refleja los costos y la efectividad entre el abordaje de la AR en fase temprana y su comparador, el abordaje en fase establecida. Con base en el horizonte temporal definido para el estudio y el tipo de desenlace, se consideró que ese era el mejor modelo siguiendo las buenas prácticas de modelamiento22–25. De esa manera, el modelo se desarrolló en Excel®.
Razón incremental de costo-efectividadSe calculó la RICE en Excel®26.
Ecuación 1: RICE
Análisis de sensibilidadSe hicieron los análisis de sensibilidad determinístico y probabilístico en Excel® para evaluar el impacto de la incertidumbre de las variables en el RICE27-29.
Estrategias de control de errores y sesgosNo se descartaron pacientes según su nivel de actividad en el tiempo cero, dado que podía cambiar al horizonte temporal. Asimismo, el nivel de actividad se incluyó en el emparejamiento para garantizar que los pacientes en metas y no metas estuvieran balanceados en ambos grupos al tiempo cero.
ResultadosAnálisis estadístico descriptivoPara la caracterización de la población (971 pacientes, 181 en fase temprana y 790 en fase establecida), se revisó la base de datos y se encontraron variables sociodemográficas y clínicas. En las primeras estaban la edad, la escolaridad, el estado civil, el grupo poblacional y el género. En relación con las variables clínicas se encontraron las siguientes: el índice de masa corporal (IMC), tabaquismo (TBQ), factor reumatoide (FR), anticuerpos de péptido cíclico citrulinado (CCP), velocidad de sedimentación globular (VSG), proteína C-reactiva (PCR), DAS28 (determinar el nivel de actividad de la AR), el Health Assessment Questionnaire (HAQ) y el consumo activo de alcohol.
A los registros de estos pacientes se les aplicaron los criterios de inclusión y exclusión descritos en la metodología. Como resultado, quedaron 128 en fase temprana y 551 en fase establecida. Además, se llevó a cabo un análisis univariado y se encontraron diferencias entre las dos fases para las variables edad, TBQ, HAQ, nivel de actividad de la enfermedad en metas y consumo activo de alcohol. Estas variaciones se encontraron por medio del valor p, por ser menor al nivel de significancia de 0,05 (tabla 1).
EmparejamientoDebido a las diferencias entre las variables mencionadas con anterioridad, se decidió hacer un emparejamiento por el método de Propensity Score por el vecino más cercano, para asegurar una homogeneidad entre los pacientes en fase temprana y en fase establecida30. Por último, las variables mencionadas con diferencias estadísticas, según la literatura31–37, estaban correlacionadas con el desenlace de efectividad por evaluar (actividad de la enfermedad); por tanto, debían incluirse en el emparejamiento.
Método Propensity Score MatchingEn el emparejamiento, los casos fueron los pacientes de la fase temprana, mientras que los controles fueron aquellos de la fase establecida, puesto que la fase temprana es la de interés y la que tiene menor número de personas. Se determinó el uso de dos controles para darle más robustez al procedimiento: reducir el sesgo y mejorar el tamaño de muestra38. Así, se obtuvieron 128 tríos, como número total de pacientes en fase temprana (casos) 128, y como número de sujetos en fase establecida (controles) 256. Del mismo modo, el emparejamiento produjo como resultado una reducción positiva entre 81 y 17% en todas las diferencias de las medias de las variables entre el grupo de pacientes de la fase temprana y el grupo de la fase establecida con respecto a no emparejar (tabla 2).
Análisis univariado postemparejamientoNo se encontraron diferencias entre la fase temprana y la fase establecida para las variables edad, TBQ, HAQ y el nivel de actividad de la enfermedad en metas y no metas. No se corrigió el valor p del alcoholismo activo, sin embargo, el n es bajo (nueve pacientes en fase temprana y cinco en fase establecida) y no es representativo, lo cual se considera que no tiene ninguna influencia en los resultados posteriores al estudio (tabla 3).
Aplicación del horizonte temporalAl aplicar el horizonte temporal a los pacientes que resultaron del emparejamiento, los tríos que tenían seguimiento igual o mayor a seis meses (± 1 mes) fueron 103. Por tanto, dado que por cada paciente en fase temprana había dos en fase establecida, el número de pacientes en fase temprana fue 103 y en fase establecida de 206.
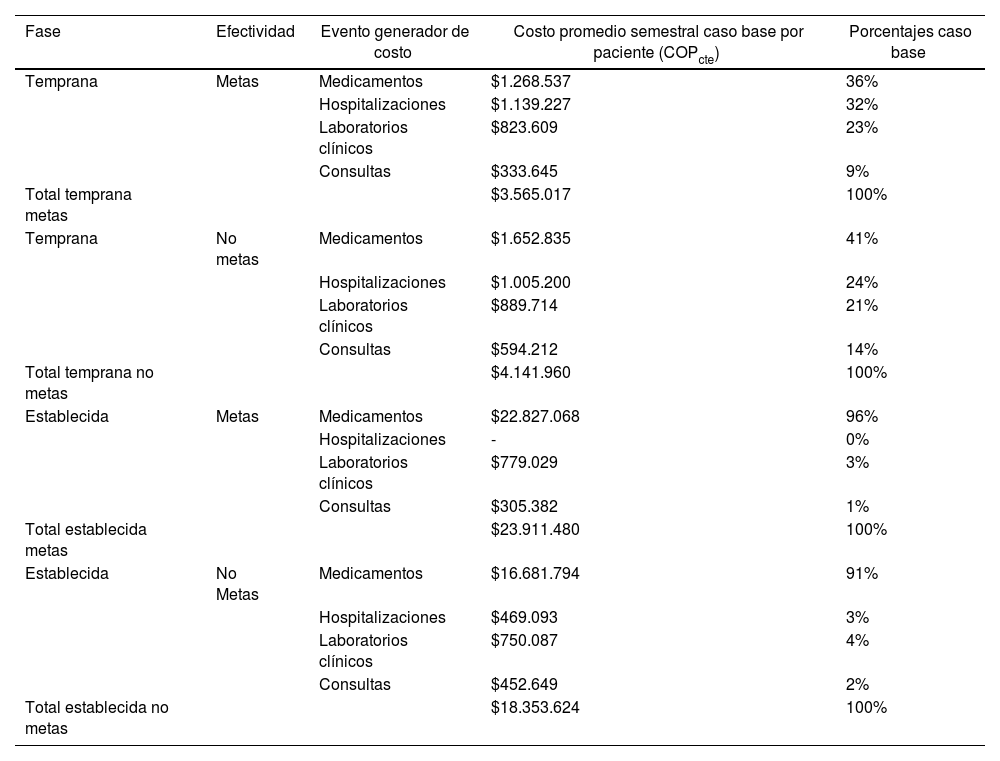
CostosSegún lo referido en la tabla 4, en la fase temprana metas, los costos fueron mayores en medicamentos en un porcentaje de 36%, seguidos de hospitalizaciones en 32%, laboratorios clínicos en 23% y consultas en 9%. De esa manera, el costo promedio semestral por paciente en metas fue de $3.565.017 COPcte. Asimismo, en la fase temprana no metas, los costos fueron mayores en medicamentos en 41%, seguidos de hospitalizaciones en 24%, laboratorios clínicos en 21% y consultas en 14%. Así, el costo promedio semestral por paciente en no metas fue de $4.141.960 COPcte. Por tanto, la diferencia en costo promedio semestral por persona al comparar la fase temprana entre metas y no metas es de 14 puntos porcentuales menos en metas, lo que equivale a $576.943 COPcte, de manera que fue más costoso el sujeto en no metas, dado que el porcentaje de uso de los medicamentos fue mayor en fase temprana no metas. En la fase temprana, tanto en metas como en no metas, ningún paciente recibió FARME biológicos. Algunos de los medicamentos no biológicos usados en fase temprana fueron prednisolona, ácido fólico, metotrexato, cloroquina, sulfasalazina, leflunomida, azatioprina y ciclosporina.
Resumen de costos
| Fase | Efectividad | Evento generador de costo | Costo promedio semestral caso base por paciente (COPcte) | Porcentajes caso base |
|---|---|---|---|---|
| Temprana | Metas | Medicamentos | $1.268.537 | 36% |
| Hospitalizaciones | $1.139.227 | 32% | ||
| Laboratorios clínicos | $823.609 | 23% | ||
| Consultas | $333.645 | 9% | ||
| Total temprana metas | $3.565.017 | 100% | ||
| Temprana | No metas | Medicamentos | $1.652.835 | 41% |
| Hospitalizaciones | $1.005.200 | 24% | ||
| Laboratorios clínicos | $889.714 | 21% | ||
| Consultas | $594.212 | 14% | ||
| Total temprana no metas | $4.141.960 | 100% | ||
| Establecida | Metas | Medicamentos | $22.827.068 | 96% |
| Hospitalizaciones | - | 0% | ||
| Laboratorios clínicos | $779.029 | 3% | ||
| Consultas | $305.382 | 1% | ||
| Total establecida metas | $23.911.480 | 100% | ||
| Establecida | No Metas | Medicamentos | $16.681.794 | 91% |
| Hospitalizaciones | $469.093 | 3% | ||
| Laboratorios clínicos | $750.087 | 4% | ||
| Consultas | $452.649 | 2% | ||
| Total establecida no metas | $18.353.624 | 100% |
COPcte: pesos colombianos moneda corriente.
Ahora bien, en la fase establecida metas, los costos fueron mayores en medicamentos en un porcentaje de 96%, seguidos de laboratorios clínicos en 3%, consultas en 1% y hospitalizaciones en 0%. Así, el costo promedio semestral paciente en metas fue de $23.911.480 COPcte. Por otra parte, en la fase establecida no metas, los costos fueron mayores en medicamentos en un porcentaje de 91%, seguidos de laboratorios clínicos en 4%, hospitalizaciones en 3% y consultas en 2%. Por ello, el costo promedio semestral del paciente en no metas fue de $18.353.624 COPcte. En ese sentido, la diferencia en costo promedio semestral por persona al comparar fase establecida entre metas y no metas fue de 23,2 puntos porcentuales mayor en metas respecto a no metas, que equivale a $5.557.856 COPcte, de manera que fue más costoso el sujeto en metas. Además, esta diferencia se debe a un mayor uso de medicamentos en el grupo de metas porque se usaron los fármacos biológicos etanercept en un porcentaje del 2,29% y adalimumab en 0,76%.
Si se tiene en cuenta el análisis anterior, la diferencia en costo promedio semestral por paciente entre la fase temprana y la fase establecida fue la siguiente: para una efectividad en metas el costo fue 85% mayor en establecida que en temprana, de manera que fue más costoso un paciente en metas de fase establecida que uno en metas de fase temprana. Igualmente, la diferencia en costo promedio semestral por paciente en no metas entre la fase temprana y la fase establecida es de 77%, de manera que fue más costoso en establecida no metas que en temprana no metas. Por tanto, los pacientes en fase temprana son menos costosos en comparación con la fase establecida, con independencia de que alcancen o no alcancen metas (fig. 1).
EfectividadSegún se describe en la tabla 5, a los seis meses de seguimiento, 75,7% de los pacientes de fase temprana alcanzaron metas, y en fase establecida 63,6%. La diferencia entre estas dos proporciones obtuvo un valor p de 0,043. Por lo anterior, con un nivel de significancia del 0,05, se concluyó que existen diferencias estadísticamente significativas en término de efectividad11.
ModeloCon relación al modelo, se diseñó un árbol de decisión24,25 (fig. 2), dado que en el caso de la AR no hay interacción entre los individuos, las fases son mutuamente excluyentes y no es una enfermedad contagiosa. Asimismo, para este caso se requirió comparar dos cohortes y se asumió que no hay restricción de recursos para la atención del paciente. De tal forma, al modelo se ingresaron los datos de probabilidad de eficacia metas y los costos correspondientes, según las fases, lo cual permitió obtener los resultados de la RICE.
Razón incremental de costo-efectividadEn cuanto al plano de costo-efectividad de la figura 3, en el caso base, se encontró una RICE dominante de -$2.326.389 COPcte (ahorro) por cada paciente en metas que se aborda en fase temprana, en lugar de fase establecida.
Análisis de sensibilidad determinísticoDe acuerdo con el diagrama de tornado (fig. 4), las tres variables que más incertidumbre aportaron al modelo fueron «costo metas temprana», «costo metas establecida» y «costo no metas temprana». Además, las únicas dos variables que cambian la conclusión del caso base en una sección de sus RICE son «costo metas temprana», y «costo no metas temprana» (fig. 5), puesto que, cuando el costo del abordaje en metas temprana es superior a $1.500.000 COPcte, aproximadamente, la RICE es positiva, y cuando el costo del abordaje en no metas temprana es superior a $2.650.000 COPcte, aproximadamente, la RICE es positiva (fig. 5)27.
Análisis de sensibilidad probabilísticoPara analizar el comportamiento de los RICE en torno a una disposición a pagar, la CAC reportó que el costo anual de FARME no Plan Básico en Salud (PBS) fue de $5.783.292 COPcte, y el costo anual de la atención fue de $2.585.497 COPcte2. Por tanto, se determinó que la disposición a pagar sería el costo semestral de $4.184.395 COPcte (umbral). De este modo, según la figura 6, para el primer cuadrante, 1,2% de los RICE quedó por encima del umbral (no costoefectivos) y 9,2% está por debajo (costoefectivos). En segundo lugar, 88,6% está en el cuarto cuadrante; de allí que abordar un paciente en fase temprana es, en 88,6%, dominante (menos costoso y más efectivo) sobre la fase establecida. Adicionalmente, 0,1% de los RICE calculados está en el segundo cuadrante. En ese sentido, en 0,1% de los resultados la fase temprana es dominada por la fase establecida. Por consiguiente, 97,8% de los RICE está por debajo de la disposición a pagar escogida, siendo costoefectivos a favor de la fase temprana1.
Curva de aceptabilidadSegún la figura 7, cuando la disposición a pagar es cero pesos, existe una probabilidad de 88,7% de que el abordaje sea costoefectivo en la fase temprana, y de 11,3% de que lo sea en la fase establecida. Asimismo, la curva de aceptabilidad permite inferir que, con una disponibilidad a pagar de $4.184.395 COPcte (umbral - punto rojo), el abordaje de los pacientes en fase temprana vs. fase establecida tendría una probabilidad de costo-efectividad de 98,7%.
DiscusiónEn esta investigación se hizo un detallado análisis de costo-efectividad y se obtuvo como resultado principal que el abordaje de la fase temprana es menos costoso y más efectivo que en la fase establecida. Infortunadamente, dado a que no hay estudios previos de costo-efectividad que comparen el abordaje en las dos fases, no se pudieron contrastar los resultados aquí obtenidos con otras investigaciones similares. Sin embargo, consideramos que el tipo de evaluación económica fue idóneo dado que nos permitió realizar los diferenciales de costos y efectividades para así conocer el costo incremental por unidad de efectividad y evaluarlo con una disposición a pagar39.
Asimismo, conceptuamos que esta investigación es relevante para las políticas de salud nacional, puesto que evidencia la importancia de generar estrategias que garanticen el acceso oportuno a un servicio experto para el abordaje de la AR en fase temprana. En segunda instancia, también es destacado en la práctica clínica porque el abordaje temprano lleva a los pacientes a un mejor pronóstico, e inclusive, según la experiencia clínica reportada por el HUFSFB, algunos pacientes pueden llegar a remisión sostenida libre de FARME biológicos, lo que no sucede en la fase establecida5,40. También, es pertinente mencionar que los buenos resultados de esta investigación se pueden deber al modelo de atención integral estandarizado del HUFSFB5, lo cual es importante promover junto con protocolos de priorización de atención oportuna.
En adición a lo anterior, debido al ahorro para el tercer pagador, un tomador de decisiones podría estar interesado en el retorno de la inversión que recibirá a largo plazo a causa del abordaje temprano8,41,42. Por otra parte, si bien los resultados de esta investigación son solo para el contexto del tercer pagador, la cohorte estudiada y el modelo de atención específico del HUFSFB, resulta importante llegar a pensar que, si el costo promedio semestral por paciente en remisión pasa de $15.885.885 COPcte2 a $3.565.017 (calculado en esta investigación), y toda la prevalencia del 2018 hubiera alcanzado metas, el costo total pudo reducirse de $1,2 billones a $282.345 millones COPcte, a grandes rasgos. Todo ello indicaría que la priorización de la atención en fase temprana podría marcar una diferencia en temas de costos para el tratamiento de la AR en Colombia.
ConclusiónLos costos promedio semestre por paciente con AR en fase temprana metas fueron $3.565.017 COPcte, en fase temprana no metas fueron de $4.141.960 COPcte, en fase establecida metas fueron de $23.911.480 COPcte, y en fase establecida no metas fueron de $18.353.624 COPcte.
El valor de la efectividad medida como los pacientes que alcanzan las metas a los seis meses de seguimiento fue de 75,7% para la fase temprana y de 63,6% para la fase establecida.
El abordaje clínico a pacientes diagnosticados de AR es menos costoso y más efectivo en fase temprana que en fase establecida, puesto que, en el caso base, la RICE resultó en ahorro de dinero con un valor de -$2.326.389 COPcte por cada paciente que alcanza metas en fase temprana, en comparación con la fase establecida con costos al 2018, a un horizonte temporal de seis meses ± un mes de seguimiento en las cohortes. Se debe aclarar que en el modelo no se incluyen las probabilidades de eventos adversos por la no diferencia entre las dos cohortes, y que el emparejamiento no corrigió el valor p del alcoholismo activo por el n no representativo en la población total que tenía esta condición clínica.
Estudios previos de costo-efectividadSe llevó a cabo una revisión de la literatura en las bases de datos LILACS, SCIELO, Redalyc, Web of Science, Google Académico, PubMed y SCOPUS, en la que se introdujeron los términos de la revisión «cost effectiveness», «early arthritis», «established arthritis», y se aplicó el término booleano «AND», para encontrar estudios previos de costo-efectividad que compararan la fase temprana con la fase establecida. Asimismo, la búsqueda se limitó a artículos/estudios clínicos de cohorte publicados en inglés y español realizados hasta el 2018, dado que los datos por analizar eran hasta el 2018. Sin embargo, para fines de esta publicación, tampoco se encuentra publicado un estudio de características similares entre el 2022 y el 2023 que compare la fase temprana y la fase establecida en términos de costo-efectividad.
Consideraciones éticasEl HUFSFB recibió el consentimiento informado de los pacientes para participar en la investigación. La investigación cumple con la normativa vigente en investigación bioética y obtuvo la autorización del comité de ética tanto del HUFSFB como de la Universidad Nacional de Colombia.
FinanciaciónEl HUFSFB participó en la recolección de los datos. El diseño del estudio, el análisis, la interpretación de los datos, la redacción del artículo y la decisión de enviar el artículo para su publicación fueron realizados por los autores del artículo bajo el modo de tesis de maestría en ciencias-farmacología27. El trabajo no recibió financiación durante su desarrollo, pero sí concursó en el Premio Nacional de Reumatología 2020 en el marco del congreso de la Asociación Colombiana de Reumatología donde obtuvo el segundo puesto y recibió un incentivo económico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Jorge Augusto Díaz Rojas, Jairo Alexander Moreno Calderón, José Ricardo Urrego Novoa, Douglas Jair Castiblanco Ángel, Julián Mauricio Cruz, Jorge Bruce Flórez, Jhon Jairo Arévalo Vargas, Universidad Nacional de Colombia, Fundación Santa Fe de Bogotá, Seminario Farmacoeconomía Universidad Nacional de Colombia – Grupo de Evaluación de Tecnologías en Salud (GETS), Seminario - Grupo de Investigación Reumavance, Paul Méndez.