El escleromixedema es una fibromucinosis cutánea de etiología desconocida. Se asocia a discrasias hematológicas y a manifestaciones sistémicas muy diversas. El compromiso vascular pulmonar es poco frecuente y requiere un abordaje de diagnóstico diferencial con la esclerosis sistémica. Se describe el caso de un paciente con escleromixedema con manifestación extracutánea pulmonar.
Scleromyxoedema is a cutaneous fibromucinosis of unknown aetiology. It is associated with haematological dyscrasias and quite diverse manifestations. Pulmonary vascular involvement is rare and requires a differential diagnosis approach with systemic sclerosis. The case of a patient with scleromyxoedema with an extracutaneous pulmonary manifestation is described.
El escleromixedema (EM), también conocido como liquen esclerodermoide, mixedematoso o síndrome de Arndt-Gottron, es una enfermedad idiopática y sistémica de curso crónico, progresiva, rara e impredecible, a veces letal, caracterizada por una erupción papular generalizada y esclerodermiforme que se acompaña de gammapatía monoclonal y que presenta depósito de mucina, proliferación de fibroblastos y fibrosis en la histopatología1–3.
Esta enfermedad afecta principalmente a adultos entre la quinta y la sexta década de la vida, sin distinción entre sexos o etnia4–7. Se asocia a discrasias hematológicas y a manifestaciones sistémicas muy diversas. Alrededor del 70% de los pacientes presentan manifestaciones extracutáneas6–8. El 17% de los casos tienen afección pulmonar (con patrones restrictivos u obstructivos), siendo la hipertensión arterial pulmonar una manifestación excepcional9,10. Por el momento no existe un tratamiento específico consensuado. A continuación se describe el caso de un paciente con escleromixedema con manifestación extracutánea pulmonar.
Presentación de casoPaciente masculino de 64 años, procedente de Cali (Colombia), con antecedente de hipertensión arterial e historia de siete años de evolución de lesiones papulares generalizadas asociadas a engrosamiento cutáneo distal con esclerodactilia y compromiso proximal de la piel de las extremidades, el tronco y la cara, de curso progresivo en manejo con azatioprina y colchicina. Al momento de la admisión presentaba desde hacía tres meses disfagia mixta, regurgitación nasal y disnea, especialmente de esfuerzo. En el examen físico se encontró un importante compromiso cutáneo (fig. 1).
Lesiones en piel de paciente con escleromixedema. A) Piel brillante e indurada de manera difusa en el rostro. En región frontal, glabelar, ciliar y dorso nasal se observan pápulas céreas, confluentes y algunos nódulos subcutáneos. Pliegue longitudinal profundo en región glabelar, madarosis. Facies leonina. B y C) Región posterior de ambos pabellones auriculares con pápulas monomorfas, eucrómicas, de consistencia firme, en forma de cúpula y dispuestas linealmente. D) Esclerodactilia sin fenómeno de Raynaud con piel de aspecto brillante y contracturas fijas en flexión.
Se realizó una tomografía axial computarizada de tórax que descartó una enfermedad pulmonar intersticial u otro tipo de lesiones. Sin embargo, se evidenció un crecimiento del tronco de la arteria pulmonar, y el ecocardiograma transtorácico mostró la presencia de remodelado concéntrico del ventrículo izquierdo con paredes levemente engrosadas, probabilidad alta de hipertensión pulmonar (presión sistólica pulmonar 58mmHg), velocidad máxima de regurgitación tricúspidea (TR Vmáx) de 3,47 m/s y un gradiente de presión (TR PGmáx) de 48,16mmHg. No se evidenció deterioro de la función ventricular (fracción de eyección del ventrículo izquierdo 60-65%).
Se realizó la prueba de caminata de seis min (6minute walk test [6MWT]), en la cual el paciente recorrió una distancia de 270 m (53% del valor predicho), para un valor predicho de normalidad 504 m. Durante la prueba, el paciente presentó desaturación pero al final tuvo una SpO2 95% con FC 67 latidos por minuto, lo que correspondió al 42% de la frecuencia cardiaca máxima, percepción de disnea 0 (nada) y fatiga MMII 2 (leve). La espirometría reportó un patrón restrictivo y alteración moderada en la capacidad de difusión de monóxido de carbono (DLCO). Fue llevado a cateterismo cardiaco derecho con parámetros hemodinámicos con presión de cuña pulmonar (PCWP) normal, resistencia vascular pulmonar elevada y presión arterial pulmonar media (PAPm) elevada, compatible con hipertensión pulmonar del grupo I (presión de arterial pulmonar sistólica (PAPs) 63mmHg, presión de arterial pulmonar diastólica (PAPD) 22mmHg, presión de arteria pulmonar media (PAPm) 35,7mmHg, resistencia vascular pulmonar 247,6dyn/s/cm5 – 3,1 unidades Wood, gradiente transpulmonar (GTP) 21,7mmHg).
Además, se confirmó el déficit en el control oral motor, con formación inadecuada del bolo en cavidad oral, propulsión lingual y contracción faríngea reducidas durante la deglución con sólidos.
Los estudios de laboratorio de autoinmunidad fueron: complemento c3 125,59mg/dl y c4 23,99mg/dl, anticuerpos antinucleares (ANAS) negativos, factor reumatoideo 73,8 UI/mL, anticitrulina 5,2 U/mL, IgG cardiolipina 2,2 GLP-U/mL, IgM cardiolipina 1,4 MPL-U/mL, IgG β2 glicoproteína I 1,4 U/mL, IgM β2 glicoproteína I 1,7 U/mL, anti-SSA (Ro) 2 U/mL, anti-SSB (La) <0,1 U/mL, anti-Sm 3,9 U/mL, anti-RNP 1,1 U/mL, antiproteinasa 3 1,3 U/mL, antimieloperoxidasa 1,2 U/mL, anti-DNA 11,5 IU/mL por enzimoinmunoanálisis y negativo por inmunofluorescencia indirecta, anti-Scl 70 3,2 U/mL. En la electroforesis de proteínas se identificó para la región gama un pequeño pico monoclonal que corresponde al 4,2%. La inmunofijación de proteínas en suero sugirió la presencia de gammapatía monoclonal tipo IgG lambda. Se realizó un aspirado-biopsia de médula ósea en el que se detectó el 0,06% de células plasmáticas con fenotipo patológico, compatibles con neoplasia de células plasmáticas, por lo que se consideró que el paciente presentaba una gammapatía monoclonal de significado incierto (MGUS).
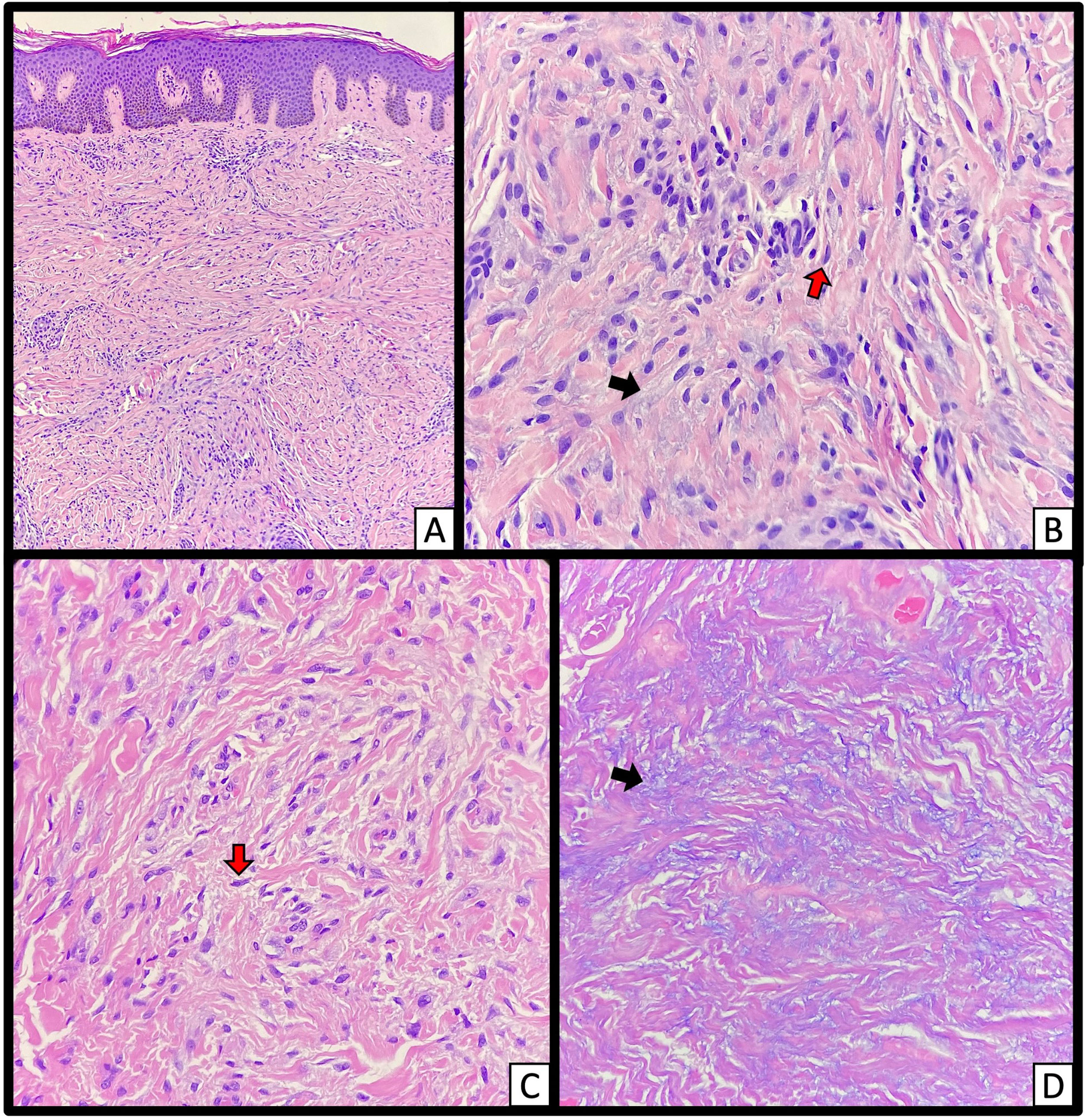
Finalmente, se tomaron biopsias cutáneas del pabellón auricular izquierdo y de la mano ipsilateral, donde se confirmó la presencia de depósito de mucina, proliferación de fibroblastos y fibrosis consistente con el diagnóstico de escleromixedema (fig. 2).
Tríada típica en histopatología de piel en escleromixedema. A y B) Hematoxilina y eosina - pápula en pabellón auricular izquierdo: fibrosis, proliferación de fibroblastos con aspecto alargado o estrellado (flechas rojas), dispuestos de forma irregular y depósitos intersticiales de mucina en la dermis reticular superior y media (flechas negras). Imágenes tomadas en 4X (A) y en 40X (B). C) Hematoxilina y eosina - piel de mano izquierda en 40X. D) Alcian Blue mostrando depósito intersticial de mucina en medio de las fibras de colágeno (flechas negras) en 40X.
Se inició manejo farmacológico con ambrisentan (10mg día), sildenafilo (50mg dos veces al día) y ciclofosfamida (500mg mensual). A los dos años de seguimiento en la unidad de reumatología, el paciente permanece sin deterioro clínico.
DiscusiónPresentamos un caso de escleromixedema con manifestación extracutánea pulmonar de presentación poco frecuente. El paciente presentó las lesiones cutáneas típicas del escleromixedema en ausencia de enfermedad tiroidea, y se obtuvo una muestra histopatológica de la piel, en la que se observó la tríada microscópica típica (depósito difuso de mucina de intensidad variable entre las fibras de colágeno de la dermis reticular superior y media, proliferación de fibroblastos dispuestos de forma irregular con núcleos grandes en forma de estrella, y fibrosis con aumento del depósito de colágeno).
Múltiples entidades asociadas con la fibrosis dérmica pueden imitar el compromiso cutáneo del escleromixedema. En el caso de nuestro paciente, el principal diagnóstico diferencial se llevó a cabo con la esclerosis sistémica dado el compromiso cutáneo, gastrointestinal, neoplásico y pulmonar (tabla 1).
Diagnóstico diferencial de las manifestaciones sistémicas del escleromixedema y de la esclerosis sistémica
| Manifestaciones | Escleromixedema | Esclerosis sistémica |
|---|---|---|
| Cutáneas | Pápulas firmes y céreas en cara, cabeza, pabellones auriculares, cuello, manos, antebrazos, tronco superior y muslosSurcos profundos y longitudinales en glabela (cara leonina) y en tronco o extremidades («signo de Shar-Pei»)Vello escaso en cejas, axilas y genitalesDepósitos de mucina en la dermis y proliferación de fibroblastos en la dermis reticular con un infiltrado inflamatorio perivascular leve a moderado | Piel engrosada, brillante e indurada en dedos, manos, extremidades, cara y tóraxHiperpigmentación, hipopigmentación o parches de despigmentación con conservación de la pigmentación perifolicular (aspecto de «sal y pimienta»), generalmente en la cara, los brazos y el tronco. Bronceado general de la piel en ausencia de exposición al solDermis engrosada con colágeno, matriz extracelular y tejido conectivo denso. El infiltrado inflamatorio linfocítico perivascular es mínimoMucina ausente o muy escasa |
| Gastrointestinales | Disfagia, dismotilidad esofágica, aperistalsis, esofagitis, regurgitación nasal | Disfagia, dismotilidad esofágica, enfermedad de reflujo gastroesofágico, pirosis, estenosis esofágica, esófago de Barrett, gastroparesia, dispepsia, ectasia vascular del antro gástrico, hipomotilidad intestinal, estreñimiento, proliferación bacteriana, diarrea |
| Inmunológicas | Poco comunes | AnticentrómeroAntitopoisomerasa I o Scl70 Anti-ARN-polimerasa III |
| Neoplásicas | Mieloma múltiple, gammapatía monoclonal, linfoma de Hodgkin o no Hodgkin, enfermedad de Waldenström y leucemia | Mayor riesgo de malignidad con la positividad de la ARN-polimerasa III |
| Pulmonares | Disnea de esfuerzo, compromiso restrictivo u obstructivo, disminución de la DLCO, derrame pleural, ronquera, broncoaspiración, hipertensión arterial pulmonar (excepcional) | Enfermedad pulmonar intersticial, hipertensión arterial pulmonar, disminución de la DLCO |
DLCO: capacidad de difusión de monóxido de carbono.
En la piel, la presencia de pápulas diseminadas, especialmente en disposición lineal, es un signo clínico muy útil para distinguir el escleromixedema. Las pápulas pueden evolucionar a placas endurecidas, con marcada esclerosis y endurecimiento de la piel en cara, cuello, tronco, manos y extremidades11. Las mucosas y el cuero cabelludo suelen estar respetados12. El depósito de mucina dentro de la dermis es responsable de hallazgos cutáneos tales como una facies leonina, dada por la presencia de induración papular en glabela, y el signo de Sharpei, dado por surcos profundos y longitudinales en el tronco o las extremidades6,8. La distribución del compromiso cutáneo en nuestro paciente es congruente con lo descrito en la literatura6,7.
A medida que avanza la enfermedad, se observa engrosamiento y rigidez de la piel con esclerodactilia que lleva a la disminución de la movilidad de las articulaciones y dificultad para la apertura oral13. La piel en el escleromixedema se mueve sobre el tejido subcutáneo, a diferencia de la esclerodermia14. Las telangiectasias en pliegues ungueales y la calcinosis como se observa en la esclerosis sistémica, están ausentes en nuestro paciente.
Con respecto al compromiso gastrointestinal, la disfagia es una manifestación sistémica compartida tanto para el escleromixedema como para la esclerosis sistémica. Después de la piel, el tracto gastrointestinal es el órgano más afectado en la esclerosis sistémica, con una frecuencia del 75 al 90%15. La disfagia no siempre está asociada a estenosis y cuando es intermitente indica enfermedad por reflujo gastroesofágico, como manifestación de hipomotilidad16. En el caso de nuestro paciente, la disfagia está anclada a la dismotilidad esofágica predominantemente en el esófago superior6,11,12.
Por definición, se ha descrito que el escleromixedema se asocia en casi todos los pacientes con el desarrollo de una discrasia hematológica. Estos trastornos incluyen MGUS, mieloma múltiple, macroglobulinemia de Waldenström, enfermedades de cadena pesada, plasmocitoma y amiloidosis primaria. La gammapatía monoclonal es habitualmente IgG y las cadenas ligeras son, con mayor frecuencia, lambda (λ), aunque puede observarse una plasmocitosis leve en las biopsias de médula ósea, como lo presentado en nuestro paciente. En la actualidad se desconoce la patogenia del escleromixedema. La hipótesis más aceptada es que las citoquinas circulantes como IL-1, TNF-α y TGF-β estimulan la síntesis de glicosaminoglicanos y la proliferación de fibroblastos. El suero in vitro de pacientes con escleromixedema puede estimular la síntesis de ADN por parte de los fibroblastos. La gammapatía monoclonal se observa con mayor frecuencia en pacientes con enfermedad diseminada, y las concentraciones de la paraproteína no se correlacionan con la extensión ni con la progresión de la enfermedad17. Además, el depósito de mucina tisular en las autopsias no se correlaciona con los hallazgos clínicos. Alrededor del 10% de los pacientes con escleromixedema progresan a un mieloma sintomático, por lo cual el seguimiento es fundamental5,18–20.
El mayor reto diagnóstico en nuestro paciente fue dado por el compromiso pulmonar, consistente en hipertensión pulmonar del grupo I, confirmado por cateterismo cardiaco derecho. La afectación pulmonar en la esclerosis sistémica consiste con mayor frecuencia en fibrosis intersticial y enfermedad vascular pulmonar que conduce a hipertensión arterial pulmonar. La prevalencia de enfermedad pulmonar intersticial (EPI) en pacientes con esclerosis sistémica varía según el método de diagnóstico (100% en una serie de autopsias, 90% por tomografía computarizada de alta resolución y entre el 40-75% por pruebas de función pulmonar). La EPI ocurre con más frecuencia en el fenotipo esclerosis sistémica difusa que en la esclerosis sistémica limitada (42% vs. 22%, p <0,001). La prevalencia de hipertensión arterial pulmonar en la esclerosis sistémica también varía según el método de detección que se utilice (entre 13% y 35% por ecocardiograma transtorácico y entre 12% y 16% por cateterismo cardiaco derecho). La hipertensión arterial pulmonar asociada a EPI es el subfenotipo más común (79,4%) en la esclerosis sistémica21. Nuestro paciente no presentó compromiso del parénquima pulmonar. Hasta el momento, se desconoce la prevalencia de la hipertensión arterial pulmonar en el escleromixedema.
La hipertensión arterial pulmonar, definida por una presión arterial pulmonar media de ≥ 25mmHg en reposo22, puede ocurrir en pacientes con neoplasias mieloproliferativas y otras condiciones paraneoplásicas como en el caso de nuestro paciente. Kreidy et al.22 describieron un caso de hipertensión pulmonar severa pero reversible en escleromixedema y discrasia de células plasmáticas. Se ha descrito que las células vasculares pulmonares de los pacientes con hipertensión arterial pulmonar tienen un metabolismo desregulado, con una mayor proliferación celular y resistencia a la apoptosis23,24. Múltiples reportes de casos han informado que existe una respuesta favorable al tratamiento con inmunosupresores y antiproliferativos con mejoría en los parámetros hemodinámicos18,19.
Hasta el momento no hay un tratamiento definitivo específico a pesar de su carácter crónico y pronóstico reservado5,6,17,25. El tratamiento del escleromixedema tiene una respuesta variable. En la literatura se han descrito terapias con ciclofosfamida, metotrexato, talidomida, prednisolona, corticosteroides intralesionales y fototerapia con mejoría, pero no una resolución completa de los hallazgos cutáneos6,7. Se ha demostrado que el tratamiento dirigido a la gammapatía monoclonal con melfalán, bortezomib y trasplante autólogo de células madre hematopoyéticas induce la remisión clínica18,19. El escleromixedema suele responder bien a la inmunoglobulina intravenosa cuando se asocia con manifestaciones sistémicas25. El paciente recibió manejo con ciclofosfamida asociado a ambrisentan y sildenafilo, sin evidencia de progresión de la enfermedad durante el seguimiento realizado en la unidad de reumatología. Se necesitan estudios aleatorizados, registros multicéntricos y grupos más grandes de pacientes para optimizar el manejo inmunosupresor en este tipo de pacientes y así mejorar su calidad de vida y disminuir su morbimortalidad.
ConclusionesEl compromiso vascular pulmonar en el escleromixedema es poco frecuente. El manejo farmacológico con ciclofosfamida logró evitar la progresión de la enfermedad multisistémica durante el seguimiento. Se necesita más información sobre cómo manejar estos casos para disminuir la morbimortalidad y mejorar la calidad de vida de estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaramos que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaramos que hemos seguido los protocolos del centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado del paciente referido en el artículo. Este documento obra en poder del autor de correspondencia.
Declaración de consentimiento informadoConfirmo que he obtenido todos los consentimientos requeridos por la legislación vigente para la publicación de cualquier dato personal o imágenes de pacientes, sujetos de investigación u otras personas que aparecen en los materiales enviados a Elsevier. He conservado una copia escrita de todos los consentimientos y, en caso de que Elsevier lo solicite, acepto proporcionar las copias o pruebas de que de dichos consentimientos han sido obtenidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.