Evaluar los niveles séricos de vitamina D en pacientes trasplantados renales, la relación con la tasa de filtración glomerular y la correlación con diversas variables clínicas y de laboratorio que podrían afectarlos.
MétodosPacientes con más de un año de trasplante renal, mayores de 18 años. En ellos se evaluaron variables demográficas, antropométricas, grado de exposición solar, etiología de la enfermedad renal crónica pretrasplante, osteodensitometría y variables de laboratorio relacionadas con desórdenes óseos y minerales.
EstudioAnalítico de corte transversal con revisión de historias clínicas. Se utilizaron métodos estadísticos descriptivos como medidas de tendencia central, de dispersión (media, desviación estándar), frecuencias absolutas y relativas. Para determinar la correlación entre los niveles de vitamina D con cada una de las pruebas de laboratorio incluidas, especialmente con la tasa de filtración glomerular (TFG), se utilizó el método de regresión lineal.
ResultadosCincuenta y seis pacientes cumplieron los criterios de inclusión, 29 hombres y 27 mujeres, edad media de 44,8±12,4 años, la mayoría mestizos (57,1%), principal etiología de enfermedad renal crónica (ERC) desconocida (55,3%). Solo el 35,7% de los pacientes tenían niveles normales de vitamina D y el 64,3%, insuficientes; ninguno de los pacientes tenía niveles en rango de déficit. Al analizar los resultados de la vitamina D y el estadio de ERC, se encontró que no existían diferencias significativas entre ellos. Se encontró relación inversa entre los niveles de vitamina D y las pruebas de creatinina, calcio, fósforo, Ca×P, albúmina, fosfatasa alcalina y proteínas en orina de 24 h. Mientras que para la TFG y la hormona paratiroidea intacta la relación fue positiva, aunque en todas las pruebas la relación es muy débil. Los resultados de la osteodensitometría mostraron valores normales para el 41,07% de los pacientes, osteopenia el 46,43% y osteoporosis el 12,5%. No se encontró correlación entre los niveles de vitamina D y el grado de alteración ósea.
ConclusionesEn pacientes trasplantados renales es frecuente detectar niveles insuficientes de vitamina D, independientemente de la TFG que tengan.
To assess serum levels of vitamin D in renal transplant patients, and if the glomerular filtration rate affects them.
MethodsThe study included patients older than 18 years with a kidney transplant for more than 1 year. Demographic, anthropometric, solar exposure, aetiology of chronic pre-transplant renal disease (CKD), bone densitometry, and laboratory variables related to bone and mineral disorders were evaluated.
StudyCross-sectional analytical study with review of medical records. Descriptive statistical methods were used to measure central tendency, dispersion (mean, standard deviation), and absolute and relative frequencies. A lineal regression method was used to determine the correlation between vitamin D levels with each of the laboratory tests included, especially with GFR.
ResultsA total of 56 patients met the inclusion criteria, 29 men and 27 women, mean age 44.8+/- 12.4 years, mostly of mixed race (57.1%), main aetiology of CKD unknown (55.3%). Only 35.7% of the patients had normal levels of vitamin D, and 64.3% had insufficient levels. None of the patients had levels in the deficit range. No significant differences were found between the vitamin D results and the stage of CKD. An inverse relationship was found between vitamin D levels and creatinine, calcium, phosphorus, CaxP, albumin, and alkaline phosphatase. The ratio was positive for 24 hour urine protein, GFR and PTHi, although the ratio is very weak in all of them. The bone density results were within the normal range in 41.07% of patients, with 46.43% osteopenia, and 12.5% osteoporosis. No correlation was found between vitamin D levels and the degree of bone alteration.
ConclusionsIn renal transplant patients it is common to detect insufficient levels of vitamin D, regardless of the GFR.
El trasplante renal constituye la mejor alternativa terapéutica para los pacientes con enfermedad renal crónica (ERC), puesto que mejora la sobrevida a largo plazo, genera menor morbilidad y complicaciones cardiovasculares. También proporciona mayor calidad de vida y reduce los costos al sistema de salud en comparación con los pacientes en terapia dialítica1,2. Los pacientes trasplantados renales son incluidos según las recientes recomendaciones de la guías KDIGO3 en el grupo de pacientes con ERC, en diversos estadios de acuerdo con su tasa de filtración glomerular (TFG), adicionándoles el sufijo T (ERCT), y la mayoría de ellos en el postrasplante renal inmediato tiene una TFG cercana a solo 70ml/min.
En este grupo de pacientes la terapia inmunosupresora para evitar el rechazo del órgano trasplantado se ha asociado a cáncer de piel, siendo la recomendación general para los pacientes en el postrasplante que reduzcan la exposición solar, con el fin de disminuir la incidencia de cáncer de piel4.
La luz ultravioleta aportada por la exposición solar es necesaria para la síntesis de vitamina D activa (1,25[OH]2D o calcitriol), proceso que se inicia en la piel a partir del 7-dehidrocolesterol que, en presencia de luz ultravioleta, genera previtamina D3, la cual luego experimenta isomerización térmica, siendo convertida a vitamina D3. Esta última en el hígado, por acción de la enzima CYP2R1, da lugar a 25 hidroxivitamina D3 (calcidiol [25(OH)D3]), la cual es filtrada en los glomérulos, reabsorbida por las células del túbulo contorneado proximal y expuesta a la enzima mitocondrial CYP27B1 (1 alfa hidroxilasa), generándose la forma activa5. La vitamina D activa es necesaria para una óptima absorción intestinal de calcio y fósforo, reabsorción tubular renal distal de calcio e inhibición de la secreción de hormona paratiroidea (PTH). Bajos niveles de vitamina D dan lugar a hipocalcemia, activando la producción y la liberación de PTH, aumentando la resorción ósea de calcio, generándose osteomalacia y osteoporosis.
Recientemente, nosotros logramos establecer que en una población de pacientes con ERC estadio 2 a 5, radicada en la ciudad de Manizales, Caldas, Colombia, América del Sur, ubicada a 2.200 m sobre el nivel del mar, la prevalencia de niveles bajos de calcidiol afectaba a cerca del 78,80% de la población estudiada6, encontrándose además que a más baja TFG, valores más bajos de vitamina D.
Los pacientes trasplantados renales se consideran que tienen ERCT, y baja exposición solar, factores que los predisponen a desarrollar niveles insuficientes de vitamina D. El objetivo de nuestro estudio fue determinar, en un grupo de pacientes trasplantados renales con diversas TFG, cómo se encontraban los niveles séricos de vitamina D y su correlación con diversas variables clínicas y de laboratorio que podrían afectarlos.
Materiales y métodosSe incluyó en el estudio a pacientes mayores de 18 años, residentes en diversas ciudades del departamento de Caldas, Colombia, América del Sur, trasplantados renales, cubiertos por el plan obligatorio de salud y atendidos en el programa de consulta externa postrasplante renal por el servicio de Medicina Interna-Nefrología de la universidad de Caldas, Manizales, y el Servicio de Terapia Renal (RTS) sucursal Caldas. El periodo de inclusión de los pacientes y la recolección de datos se efectuó entre el 19 de agosto del 2015 y el 19 de junio del 2017. El análisis estadístico se practicó en el mes de julio del año 2017.
Los criterios de exclusión fueron: trasplante renal en un periodo menor a un año, recibir dosis de prednisona superior a 10mg por día o pulsos de esteroides intravenosos en los últimos 12 meses, haber modificado su terapia inmunosupresora en los últimos 6 meses, paratiroidectomía, hiperparatiroidismo primario confirmado por ecografía de cuello y gammagrafía con sestamibi, enfermedad hepática, hiperfosfaturia, hipercalcemia hipocalciúrica, hospitalización en los últimos 2 meses, infección activa, haber recibido terapia con vitamina D nativa en los últimos 12 meses y exposición solar en exceso en los últimos 30 días.
No se requirió consentimiento informado puesto que en RTS sucursal Caldas desde el año 2013 se estableció como práctica habitual en los pacientes trasplantados renales, y basados en las guías KDIGO para desordenes óseos y minerales del año 20097, solicitar cada mes creatinina, cada 3 meses calcio y fósforo, cada 6 meses fosfatasa alcalina y cada año niveles de vitamina D, PTH, albumina sérica, proteínas en orina de 24 h y osteodensitometría.
Las variables demográficas, antropométricas y clínicas recolectadas fueron respectivamente: sexo, edad, grupo étnico, peso, talla, índice de masa corporal (IMC), grado de exposición solar, etiología de la ERC pretrasplante, estadio de ERCT y tiempo desde el trasplante renal.
Se interrogó y confirmó por examen físico, el grado de exposición solar en manos, cara y brazos, y se clasificó en 3 niveles: nivel 1 (bajo) menos de 1 h por semana, nivel 2 (moderado) entre 1 a 3 h por semana y nivel 3 (adecuado) más de 3 h por semana8.
El IMC se obtuvo al aplicar la fórmula: IMC=peso (en kg)/altura (en m2), y se definió así: delgadez o bajo peso menor a 18,49, normal 18,5 a 24,99, sobrepeso 25,00 a 29,99, y obeso mayor de 30,00.
Las variables de laboratorio recolectadas fueron: creatinina, TFG calculada por fórmula MDRD9, calcio, fósforo, producto calcio×fósforo (Ca×P), albumina, PTH intacta (PTHi), fosfatasa alcalina, proteínas en orina de 24 h y niveles de vitamina D nativa (25 [OH]D o calcidiol) totales; estos últimos se determinaron con la técnica de electroquimioluminiscencia. También se anotó el resultado de la osteodensitometría registrado dentro del año de cuantificación de los niveles de vitamina D.
La ERC fue definida según los criterios de las Guías KDIGO del año 20133 y se clasificó en estadios de acuerdo con la TFG estimada; los valores, expresados en mililitro/minuto fueron: 1: mayor a 90, 2: 60 a 90, 3a: 45 a 59, 3b: 30 a 44, 4: 15 a 29, y 5: menos de 15.
Los niveles de vitamina D nativa (25[OH]D) totales se definieron de acuerdo con la relación entre los niveles séricos de vitamina D, PTH y transporte intestinal de calcio según lo referenciado por la International Osteoporosis Foundation y National Osteoporosis Foundation 2005 y 201010,11, respectivamente, American Geriatrics Society Consensus12 y National Osteoporosis Society13. Se consideraron valores normales: mayores a 30 ng/ml, insuficientes: entre 10 a 30 ng/ml, y deficientes: menores a 10 ng/ml.
Un valor de PTH mayor de 70 pg/ml se consideró compatible con hiperparatiroidismo secundario.
El informe de la osteodensitometría fue reportado de acuerdo con el T score en: normal (–1,0 o superior), osteopenia (entre –1,0 y –2,5) y osteoporosis (–2,5 o menor), de acuerdo con las recomendaciones de World Health Organization y NBHAWG14,15.
Se anotaron los medicamentos que recibía el paciente en ese momento para su inmunosupresión, prevención y tratamiento de osteoporosis.
El proyecto fue aprobado por el Comité de Bioética de la Universidad de Caldas, vicerrectoría académica y comités de ética e investigación de RTS para Colombia. Se consideró sin riesgo según el artículo 11, capítulo 1 de la resolución N.° 008430 de 1993, del Ministerio de Salud de la República de Colombia, la cual establece las normas científicas, técnicas y administrativas para la investigación en salud.
Tipo de estudioAnalítico de corte transversal con revisión de historias clínicas.
Análisis estadísticoLa información se recolectó en una base de datos diseñada en Excel, la cual fue diligenciada por los investigadores y su análisis estadístico se llevó a cabo con el programa estadístico SPSS 15.0v en español con licencia para la Universidad de Caldas.
Se incluyeron todos los pacientes atendidos en el programa postrasplante renal que cumplieran los criterios de inclusión y, por lo tanto, no se consideró necesario establecer muestreo.
Para dar cumplimiento a los objetivos, se utilizaron métodos estadísticos descriptivos como medidas de tendencia central, de dispersión (media, desviación estándar), frecuencias absolutas y relativas; el resumen de la información se presenta en cuadros o gráficos. Para establecer asociación entre los valores de la vitamina D con los de laboratorio se utilizó la distribución de probabilidad F, y el criterio para determinar diferencias estadísticamente significativas fue el valor p de la prueba menor a 0,05; y para determinar la correlación se utilizó el método estadístico de regresión lineal, con su correspondiente coeficiente de correlación de Pearson.
ResultadosSe evaluaron 62 pacientes, de los cuales 6 se excluyeron por no cumplir con los criterios de inclusión. De los 56 restantes, 29 (51,8%) eran hombres y 27 (48,2%) mujeres; el promedio de edad fue de 44,8±12,4 años. Se obtuvo un promedio de peso de 66,1±14,6 kg; un promedio de talla de 1,6 m±0,1 m y un promedio del IMC de 24,9±4,8. Con relación a la etnia, 32 (57,1%) pacientes eran mestizos, 22 (39,2%) de raza blanca y solo 2 (3,57%) de raza negra.
El tiempo en años transcurrido desde el trasplante fue en promedio de 10,5 años con una desviación estándar de 6,1 años.
El grado de exposición solar fue predominantemente de «nivel 1», 40 (71,4%) pacientes clasificaron en esta categoría, en el «nivel 2» se reportaron 15 (26,8%) pacientes y solo uno (1,79%) en «nivel 3».
Las principales etiologías que dieron lugar a la ERC previa al trasplante fueron: desconocida en 29 (55,3%) pacientes, nefropatía lúpica 7 (12,5%), nefropatía hipertensiva 5 (8,9%) y nefropatía diabética 4 (7,1%) pacientes. Veinte (35,7%) pacientes tenían ERCT estadio 2 y 15 (26,8%) estadio 3a; el resto, estadios 1, 3b y 4 (tabla 1).
Características demográficas, antropométricas y de laboratorio de pacientes con ERCT
| Variables | Estadio 1, n=8 | Estadio 2, n=20 | Estadio 3a, n=15 | Estadio 3b, n=10 | Estadio 4, n=3 | Prueba F | Valor p | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media | DE | Media | DE | Media | DE | Media | DE | Media | DE | |||
| Edad | 31,6 | 14,7 | 46,8 | 10,9 | 45,1 | 10,9 | 48,1 | 10,3 | 55,0 | 10,3 | 3,66 | 0,01 |
| Talla | 1,61 | 0,12 | 1,61 | 0,09 | 1,63 | 0,08 | 1,7 | 0,07 | 1,6 | 0,06 | 1,95 | 0,11 |
| Peso | 58,7 | 12,92 | 64,4 | 12,1 | 66,1 | 15,1 | 72,4 | 18,9 | 76,1 | 7,4 | 1,45 | 0,23 |
| IMC | 22,2 | 4,14 | 24,7 | 3,5 | 24,9 | 5,7 | 25,7 | 5,6 | 30,8 | 0,8 | 1,99 | 0,11 |
| Laboratorios | ||||||||||||
| Creatinina (mg/dl) | 0,95 | 0,24 | 1,05 | 0,16 | 1,35 | 0,19 | 1,72 | 0,34 | 2,95 | 0,36 | 27,08 | 0,00 |
| Calcio (mg/dl) | 9,96 | 0,47 | 9,76 | 0,61 | 9,59 | 0,65 | 9,15 | 0,67 | 7,71 | 0,19 | 2,38 | 0,08 |
| Fósforo (mg/dl) | 3,46 | 0,73 | 3,46 | 0,64 | 3,42 | 0,88 | 3,67 | 0,83 | 3,47 | 0,61 | 0,56 | 0,64 |
| Ca×P | 34,68 | 8,3 | 32,5 | 6,62 | 32,8 | 8,74 | 33,91 | 9,0 | 33,6 | 5,3 | 0,16 | 0,9 |
| Albúmina (g/dl) | 4,57 | 0,42 | 4,46 | 0,34 | 4,44 | 0,33 | 4,07 | 0,21 | 4,08 | 0,4 | 4,66 | 0,005 |
| Fosfatasa alcalina | 98,39 | 64,4 | 78,2 | 18,36 | 82,25 | 39,14 | 133,4 | 89,0 | 62,1 | 9,75 | 3,09 | 0,35 |
| Proteína orina 24 h | 0,18 | 0,18 | 0,17 | 0,2 | 0,25 | 0,44 | 0,34 | 0,43 | 1,61 | 1,21 | 2,12 | 0,11 |
| Niveles 25(OH)D ng/ml | 27,8 | 9,0 | 28,3 | 11,7 | 27,8 | 18,8 | 23,6 | 8,97 | 26,4 | 11,5 | 0,23 | 0,92 |
| TFG (ml/min) | 94,21 | 24,66 | 72,0 | 10,11 | 53,8 | 4,92 | 39,18 | 5,0 | 19,67 | 2,2 | 41,14 | 0,00 |
| PTHi | 49,51 | 14,84 | 62,19 | 30,15 | 68,6 | 37,7 | 81,2 | 61,69 | 127,7 | 87,93 | 0,95 | 0,42 |
| Etnia | N.° | % | N.° | % | N.° | % | N.° | % | N.° | % | χ2 | Valor p |
| Mestizo | 5 | 62,5 | 9 | 45,0 | 10 | 66,7 | 5 | 50,0 | 3 | 100,0 | 4,31 | 0,36 |
| Blanco | 2 | 25,0 | 11 | 55,0 | 5 | 33,3 | 4 | 40,0 | 0 | 0,0 | 2,82 | 0,42 |
| Negro | 1 | 12,5 | 0 | 0,0 | 0 | 0,0 | 1 | 10,0 | 0 | 0,0 | ||
La evaluación de los medicamentos utilizados evidenció que el 100% de los pacientes recibía un esteroide a baja dosis (prednisona o deflazacort), por lo tanto no se pudo aplicar análisis estadístico. Para los otros medicamentos se encontró que los pacientes recibían: 12 (21,4%) azatioprina, 22 (39,3%) micofenolato mofetilo, y 20 (35,7%) micofenolato sódico. Con respecto a los mTOR, solo 3 (5,3%) pacientes recibían sirolimús y 7 (12,5%) everolimús. Para inhibidores de calcineurina, 16 (28,6%) ciclosporina y 26 (46,4%) tacrolimús. No se encontró asociación entre el tipo de medicamento inmunosupresor que recibían los pacientes y los niveles séricos de vitamina D.
Los resultados de los valores de vitamina D arrojaron que del total de los pacientes analizados, 20 (35,7%) tenían niveles normales de vitamina D, 36 (64,3%) niveles insuficientes y ninguno presentó déficit.
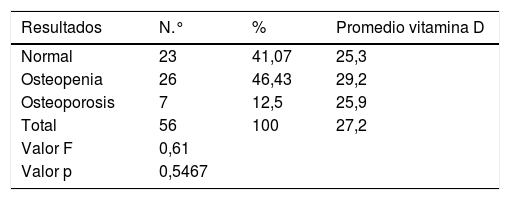
Solo para los pacientes con estadio 1 de ERCT se observó que el porcentaje de pacientes con niveles normales superaba el de los pacientes con niveles insuficientes (tabla 2), aunque al identificar la asociación de los resultados de la vitamina D con el estadio de ERCT se encontró que no existían diferencias estadísticamente significativas entre ellos, puesto que el valor p que arrojó esta prueba fue de 0,9207. Para la creatinina, TFG y albúmina, sí se encontró asociación, con diferencias estadísticamente significativas para los estadios (tabla 3).
Clasificación de niveles de vitamina D según estadios
| Estadio | Normal>30 ng/ml | Insuficiente 11-29 ng/ml | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N.°. | % | Media | N.° | % | Media | N.° | % | Media | |
| 1 | 5 | 62,5 | 33,67 | 3 | 37,5 | 18,00 | 8 | 100,0 | 27,79 |
| 2 | 8 | 40,0 | 38,44 | 12 | 60,0 | 22,63 | 20 | 100,0 | 28,33 |
| 3a | 3 | 20,0 | 55,33 | 12 | 80,0 | 20,88 | 15 | 100,0 | 27,77 |
| 3b | 3 | 30,0 | 34,72 | 7 | 70,0 | 18,90 | 10 | 100,0 | 23,64 |
| 4 | 1 | 33,3 | 2 | 66,7 | 20,70 | 3 | 100,0 | 26,37 | |
| Total | 20 | 35,7 | 39,20 | 36 | 64,3 | 20,80 | 56 | 100,0 | 27,20 |
Déficit: cero casos.
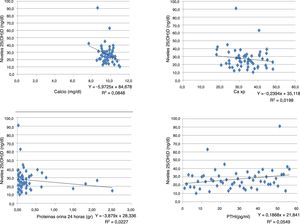
Correlación entre los niveles de vitamina D y las pruebas de laboratorios de las personas con enfermedad renal crónica
| Prueba laboratorio | Correlación Pearson | Sig (Bilateral) | N.° |
|---|---|---|---|
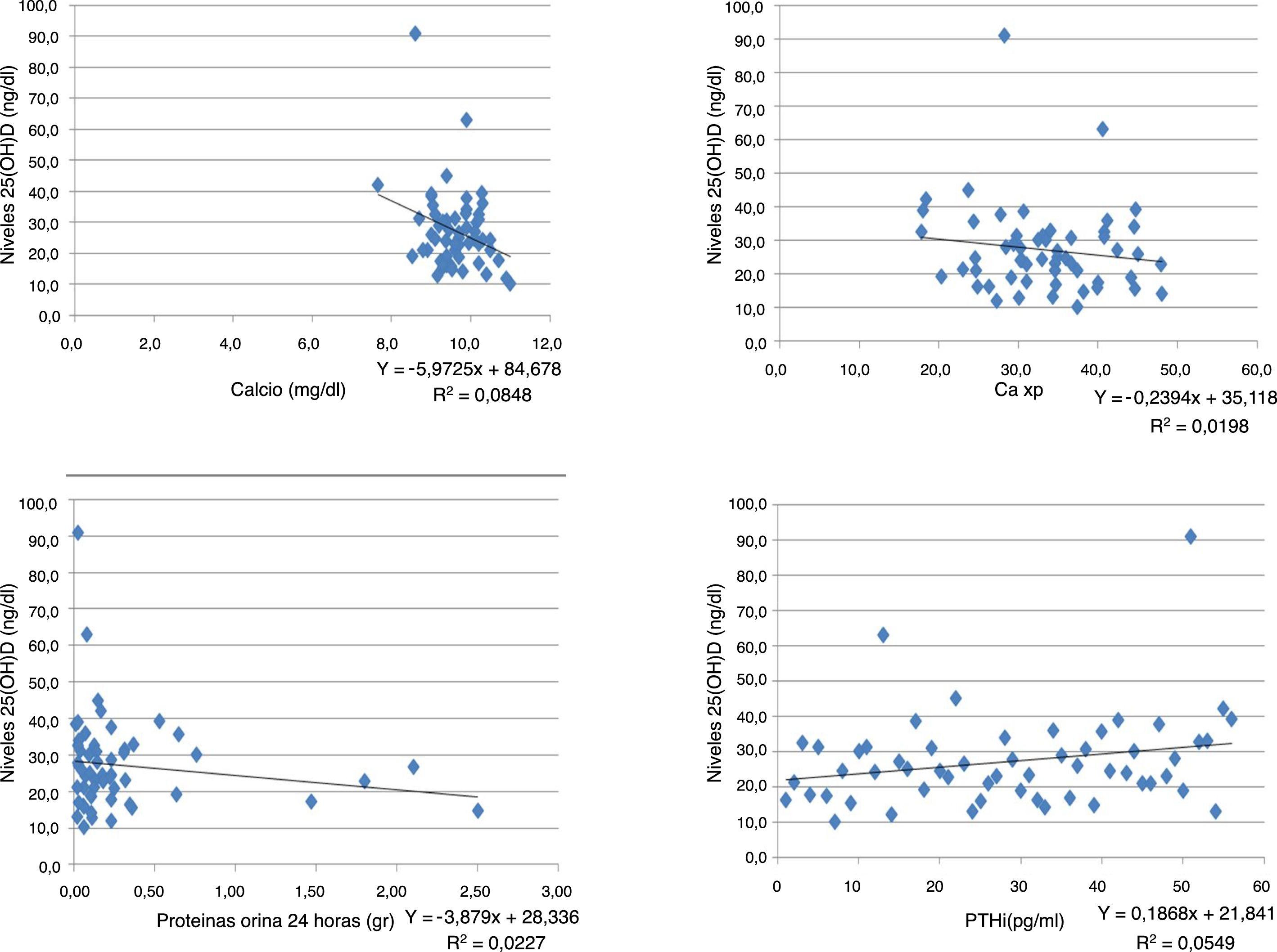
| Creatinina | –0,031 | 0,818 | 56 |
| Calcio | –0,289 | 0,031 | 56 |
| Fósforo | –0,079 | 0,56 | 56 |
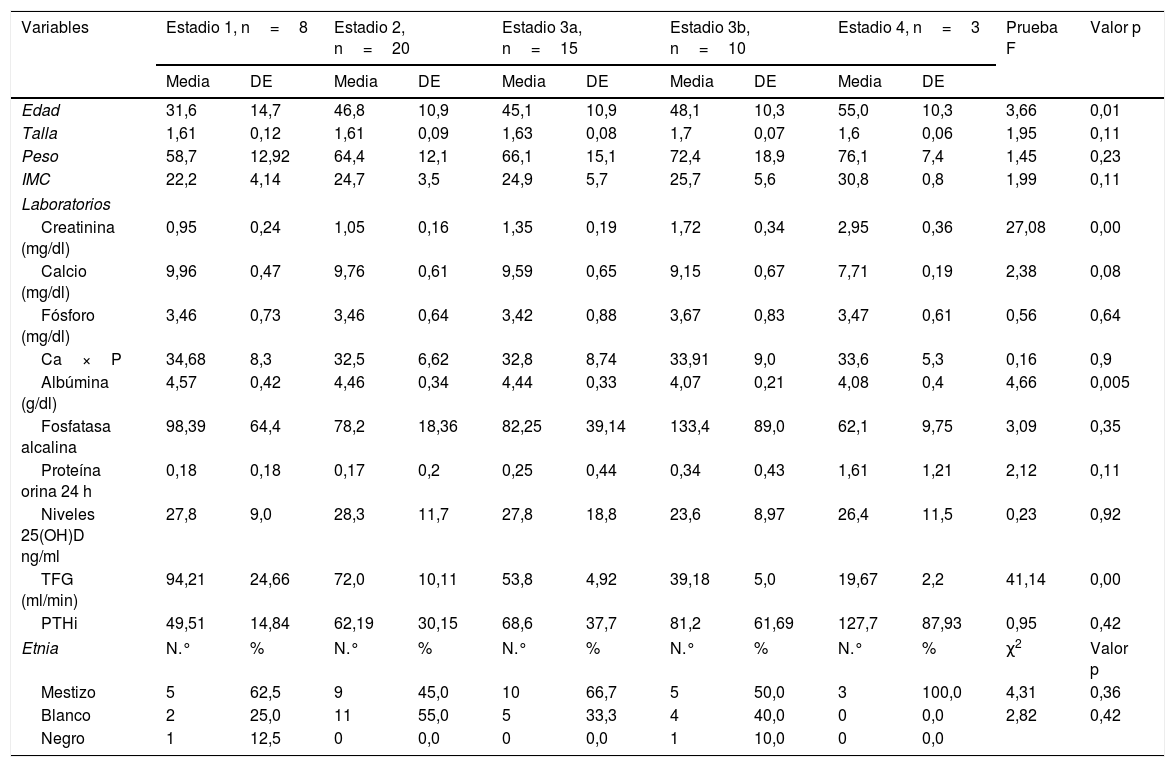
| Ca×P | –0,139 | 0,305 | 56 |
| Albúmina | –0,076 | 0,577 | 56 |
| Fosfatasa alcalina | –0,093 | 0,494 | 56 |
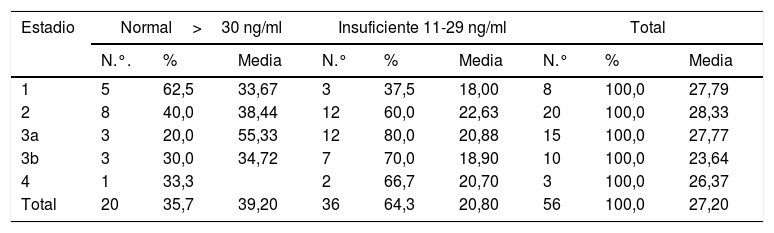
| Proteínas orina 24 h | –0,151 | 0,355 | 56 |
| TFG por MDRD | 0,068 | 0,617 | 56 |
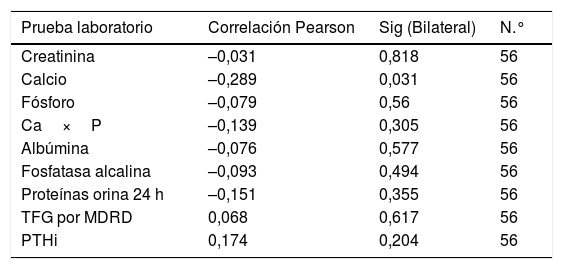
| PTHi | 0,174 | 0,204 | 56 |
Se encontró una correlación inversa entre los niveles de vitamina D y las pruebas de creatinina, calcio, fósforo, Ca×P, albúmina, fosfatasa alcalina y proteínas en orina de 24 h. Mientras que para la TFG y PTHi la correlación fue positiva, aunque en todas las pruebas la correlación es muy débil puesto que sus coeficientes son muy bajos (tabla 3) (fig. 1).
Con respecto a la exposición solar, no se encontraron diferencias significativas entre los promedios de los niveles de vitamina D y los grados de exposición, teniendo presente que la mayoría de los pacientes se encontraban en el nivel 1 (71,4%). Similar situación ocurrió entre los resultados de la osteodensitometría. No se encontró correlación entre el grado de alteración ósea con los niveles de vitamina D, ya que los resultados arrojaron un valor superior al 5% (tabla 4).
Solo en 5 (8,9%) pacientes se detectó terapia específica para la osteoporosis, en todos los casos con alendronato y por pocos meses de inicio. Para profilaxis de osteoporosis, se observó que 21 (37,5%) pacientes no recibían terapia, 5 (8,9%) recibían carbonato de calcio, 12 (21,4%) calcitriol y 18 (32,1%) la combinación de carbonato de calcio+calcitriol.
DiscusiónValores normales de 25 hidroxivitamina D (25[OH]D) o calcidiol son muy importantes en pacientes trasplantados renales para la adecuada generación renal de la forma activa de la vitamina D, el calcitriol5. Los niveles séricos normales son aquellos necesarios para inhibir la secreción de PTH y fluctúan entre 30 a 40 ng/ml10,11. Bajos niveles de vitamina D son un factor de riesgo en la población general para osteoporosis, hipertensión arterial, enfermedad cardiovascular, diabetes mellitus, infecciones, enfermedades autoinmunes, raquitismo, algunos tipos de cáncer y mayor mortalidad16-21.
En pacientes trasplantados renales también se ha observado que bajos niveles de vitamina D constituyen un factor de riesgo para diversas complicaciones entre las cuales resaltamos: 1) retraso en la función del injerto e incremento en el riesgo de rechazos agudos con pérdida acelerada en la función renal, fibrosis intersticial, atrofia tubular y baja TFG un año postrasplante22-25. La vitamina D puede afectar a la respuesta inmunitaria adaptativa e innata, modulando la respuesta alogénica26, y posiblemente promueve la tolerancia por inducir células T reguladoras27-29. 2) Mayor tendencia a infecciones virales oportunistas tipo poliomavirus BK30,31, e infecciones bacterianas (principalmente las que afectan al tracto urinario)32, pero no micóticas33. A lo anterior puede colaborar el efecto estimulante de la vitamina D en las actividades antimicrobianas de los macrófagos34-36. 3) Mayor presencia de síntomas depresivos y fatiga37,38. 4) Persistencia de hiperparatiroidismo secundario, con incremento en el riesgo de pérdida mineral ósea y fracturas39,40. 5) Diabetes mellitus postrasplante como consecuencia de reducción en la secreción de insulina por las células beta, las cuales expresan receptores a la vitamina D41. 6) Riesgo de cáncer42,43.
Los niveles séricos de vitamina D nativa han sido evaluados en diversos grupos poblacionales de pacientes trasplantados renales. Sus niveles se han reportado bajos en el 97% de ellos en Alemania, España, Inglaterra y Dinamarca44-47, estudios que fueron ejecutados en latitudes del norte donde la exposición solar es baja, por lo cual generalizar estos hallazgos a regiones tropicales es inapropiado. En Brasil, una región tropical, se observó hipovitaminosis D en el 65% de los pacientes trasplantados renales (53% insuficientes y 12% en déficit), afectando más a mujeres obesas48. En otro estudio en ese mismo país la cifra fue del 80,7% en 83 pacientes estudiados49. En Israel se detectaron niveles de vitamina D inadecuados en el 75% de 103 pacientes trasplantados renales, 52,4% en rango de insuficiencia y 23% en déficit50. En Corea en 25 pacientes trasplantados renales los niveles de vitamina D nativa fueron bajos en el 40% de los pacientes51. Ausencia de modificación estacional en los niveles de vitamina D se describe en Irán en 96 trasplantados renales, pero en verano los pacientes evitaron la alta exposición solar y utilizaron protectores solares52. En India en 51 trasplantados renales solo un 8% tuvo niveles adecuados de calcidiol, 33% insuficientes, 51% en déficit y 8% en déficit severo53.
Los factores que a la fecha se consideran principalmente implicados en la detección de bajos niveles de vitamina D en pacientes trasplantados renales son: baja exposición solar, bajo consumo de alimentos ricos en vitamina D y el tipo de terapia inmunosupresora administrada. La baja exposición solar obedece a la recomendación general que se les da a estos pacientes de evitarla ante el riesgo de aparición de neoplasias de piel, principalmente con el consumo de terapia citostática representada por azatioprina y micofenolato54-57.
El bajo consumo de alimentos ricos en vitamina D radica en que la mayoría de los pacientes trasplantados tienen ERC, recomendándoseles bajo consumo de proteínas.
El tipo de inmunosupresión puede resultar importante en el metabolismo de la vitamina D. Los esteroides, por su capacidad de incrementar la actividad de la 24 hidroxilasa, pueden dar lugar a bajos niveles de vitamina D58. Este último grupo de medicamentos ejerce efecto tóxico directo sobre los osteoblastos y osteocitos al inducir apoptosis e incrementar la actividad osteoclástica al elevar los niveles de RANK-L, y además reducen la absorción intestinal y tubular renal de calcio59-61. El micofenolato y la azatioprina tienen efecto neutro sobre el metabolismo óseo y la vitamina D. Hay controversia con los inhibidores de calcineurina62-65, aunque pueden generar supresión del receptor renal de la vitamina D, aumentando las pérdidas urinarias de calcio64. Los inhibidores mTOR no se ha visto que afecten a los niveles séricos de vitamina D64,66.
En nuestro estudio, la prevalencia de niveles insuficientes de calcidiol fueron altos, excepto para los pacientes en estadio 1 de ERCT. Lo anterior está muy probablemente en relación con un menor tiempo postrasplante renal y más alta exposición solar pretrasplante, puesto que los efectos de la baja exposición solar y los efectos colaterales de la medicación inmunosupresora se hacen evidentes a largo plazo ante la vida media prolongada del calcidiol. La elevación progresiva de la PTH a medida que la TFG cae, y reducción en la albumina sérica pueden ser consecuencia de factores nutricionales, baja excreción renal de fosfatos, hipocalcemia y niveles insuficientes de vitamina D. Llama la atención la ausencia de correlación entre los niveles de vitamina D y los hallazgos en la osteodensitometría, lo que refleja las dificultades en su interpretación en pacientes con ERC, en los cuales en presencia de PTH alta es difícil concluir si los hallazgos son consecuencia de osteodistrofia renal con sus variedades o de una real osteoporosis.
Nuestro estudio cuenta con la fortaleza de ser el primer informe que se da en nuestro país de los hallazgos relatados. Limitaciones son el bajo número de pacientes y la carencia de seguimiento a largo plazo.
ConclusionesBajos niveles de vitamina D se presentan en un alto porcentaje de pacientes trasplantados renales, en todos los estadios de su ERCT, y podrían ser un factor muy importante en la generación de osteoporosis e hiperparatiroidismo secundario. Se recomienda que, a todos los pacientes trasplantados renales, se les evalúen los niveles de 25(OH)D, independientemente de su TFG.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.