La vitaminaD y los polimorfismos en el receptor de vitaminaD (VDR) se asocian con enfermedades autoinmunes, incluido el lupus eritematoso sistémico (LES). El objetivo de este estudio es analizar la asociación genética entre los polimorfismos de VDR (TaqI, ApaI, BsmI y FokI) y la susceptibilidad al LES, así como su relación con los niveles séricos de vitaminaD en población del Caribe colombiano.
MetodologíaEstudio de casos y controles. Se incluyeron 133 pacientes adultos con diagnóstico de LES y 100 individuos sanos. Los polimorfismos VDR fueron genotipados por RT-PCR y sondas Taqman®. Se estimaron asociaciones alélicas, genotípicas y haplotípicas. Las concentraciones séricas de vitaminaD fueron cuantificadas por Elisa. Se establecieron valores de 30 a 100ng/ml como rango normal de referencia. Valores p<0,05 fueron considerados estadísticamente significativos.
ResultadosSe observó una alta prevalencia de LES en pacientes femeninas (94%) y se asoció a mayor riesgo de LES (OR: 10,8; IC95%: 4,7-24,6; p<0,05). Se evidenció mayor riesgo de LES en individuos con polimorfismo FokI del gen VDR [rs2228570] (OR: 1,58; IC95%: 1,05-2,36) en modelos alélicos. El haplotipo ACCA de los polimorfismos TaqI, ApaI, BsmI y FokI se asoció a mayor riesgo de LES (OR: 2,28, IC95%: 1,12-4,66; psim<0,01). Se evidenció deficiencia de vitaminaD en el 11,3% de los pacientes.
ConclusiónEn este estudio, el polimorfismo VDR rs2228570 y el haplotipo ACCA se asociaron a mayor riesgo de LES en población adolescente.
Vitamin D and vitaminD receptor (VDR) polymorphisms are associated with autoimmune diseases including systemic lupus erythematosus (SLE). The aim of this study is to assess the genetic association between VDR polymorphisms: TaqI, ApaI, BsmI and FokI, and SLE with serum levels of vitaminD in the Colombian Caribbean population.
MethodsCase and control study. One hundred and thirty-three patients with SLE and 100 healthy individuals were included. VDR polymorphism were genotyped by RT-PCR and Taqman® probes. Allelic, genotypic and haplotype associations were estimated. Serum vitaminD concentrations were quantified by Elisa. Values of 30 to 100ng/ml were established as a normal reference range. P values <.05 were considered statistically significant.
ResultsA high prevalence of SLE was observed in women (94%) and was associated with a higher risk of SLE (OR: 10.8; 95%CI: 4.7-24.6; P<.05). Moreover, higher risk of SLE was observed in individuals with FokIVDR [rs2228570] (OR: 1.58; 95%CI: 1.05-2.36) in allelic models. The ACCA Haplotype of TaqI/ApaI/BsmI/FokI polymorphisms was associated with higher risk of SLE (OR: 2.28; 95%CI: 1.12-4.66; psim<.01). Vitamin D deficiency was evidenced in 11.3% of the patients.
ConclusionIn this study, the VDR rs2228570 polymorphism and ACCA haplotype were associated with higher SLE risk in an adolescent population.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune crónica que se caracteriza por su amplia heterogeneidad epidemiológica, clínica e inmunológica1. La fisiopatología se asocia a factores inmunológicos, hormonales, genéticos y ambientales1-3. Diversos estudios han reportado los efectos de polimorfismos de nucleótido único (SNP) en la susceptibilidad al LES4-6, incluido el gen del receptor de vitaminaD (VDR); sin embargo, sus efectos sobre la actividad del VDR aún no se conocen bien7-9.
El VDR es el mediador de la actividad biológica de la vitaminaD. Se localiza en el núcleo de las células diana, incluidas las células inmunitarias (células presentadoras de antígenos, células natural killer y linfocitosB yT)9-11. El gen VDR se ubica en el cromosoma 12q13.11 y regula la expresión de genes en varios tejidos que responden a la vitamina D10,12.
Además de la regulación de la homeostasis mineral ósea, la 1,25-dihidroxivitamina D3 [1,25(OH)2D3] también participa en la inhibición de la interleucina (IL)2, la modulación de los fenotipos de célulasT13,14, el incremento en el desarrollo de célulasT reguladoras15,16 y la producción de inmunoglobulinas17. La 1,25(OH)2D3 inhibe la secreción de interferón y regula la expresión de IL-12 y el factor nuclear kappa-B11,18. Un estudio in vitro demostró que la 1,25(OH)2D3 tiene un efecto protector en enfermedades autoinmunes19. Por lo tanto, la vitaminaD3 se considera un regulador del sistema inmunológico11,20.
Se han estudiado varios marcadores polimórficos de consecuencia funcional desconocida dentro del gen VDR por su papel potencial en el riesgo de LES. Existen cuatro polimorfismos importantes del gen VDR: TaqI (rs731236), ubicado en el exón 9; ApaI (rs7975232) en el intrón 8, BsmI (rs1544410) en el intrón 9 y FokI (rs10735810) en el codón de inicio8,9,21-23.
Sin embargo, los resultados de la asociación entre estos polimorfismos del gen VDR y el riesgo de LES son inconsistentes en diferentes estudios realizados en varios grupos de población, principalmente debido a diferentes coeficientes de desequilibrio de ligamiento y bloques de haplotipos en las poblaciones, así como a diferencias en el tamaño de la muestra, estratificación de la población y variación de los factores ambientales entre áreas geográficamente separadas8.
Estudios basados en poblaciones han demostrado que los pacientes con LES tienen niveles séricos significativamente bajos de vitaminaD18,24; así mismo, polimorfismos del gen VDR están asociados a mayores índices de actividad/cronicidad y mayor riesgo de daño orgánico9,18,25.
El objetivo de este estudio es analizar la asociación genética entre los polimorfismos de VDR (TaqI, ApaI, BsmI y FokI) y la susceptibilidad al LES, así como su relación con los niveles séricos de vitaminaD en población del Caribe colombiano.
MetodologíaEstudio de casos y controles. Se incluyeron 133 pacientes con diagnóstico de LES y 100 individuos sanos, en etapa de adolescencia (10 a 19años), grupo etario según la Organización Mundial de la Salud (OMS), procedentes de la ciudad de Barranquilla, en la Costa Caribe colombiana. El diagnóstico de LES se realizó por la presencia de al menos 4 de los 11 criterios según el American College of Rheumatology (ACR)26. Los pacientes fueron evaluados tanto por consulta especializada como en una institución de cuarto nivel de la ciudad de Barranquilla, Colombia.
Los pacientes no tenían antecedentes de enfermedades sistémicas, otras enfermedades reumáticas, infecciones o malignidades. El grupo control con prueba de ANA negativa no tenía antecedentes de enfermedades autoinmunes ni relación familiar con pacientes con LES.
Consideraciones éticasTodos los pacientes y los controles aprobaron por escrito mediante asentimiento o consentimiento informado según eran menores o mayores de edad en su participación voluntaria en el estudio. El presente estudio fue aprobado por el comité de ética institucional de la Universidad del Norte (Resolución N.° 05).
Extracción de ADN genómicoUn equipo compuesto por flebotomistas, investigadores y médicos se encargó de recolectar 10ml de sangre venosa periférica en tubos Vacutainer®, tanto con serum separator tube (SST) como con EDTA dipotásico (Beckton Dickinson & Company, Franklin Lakes, EE. UU. Ref: 367856) por cada participante, para la obtención de suero y la posterior extracción de ADN genómico, respectivamente.
El ADN se extrajo a partir de buffycoat (fracción leucoplaquetaria) de sangre anticoagulada y usando el protocolo de salting out modificado y precipitación con perclorato de sodio27. La concentración y calidad del ADN se midió mediante el espectrofotómetro Nanodrop 2000/2000c (Thermo Scientific, Waltham, MA, EE. UU.). Las muestras de ADN genómico y suero se dividieron en alícuotas y se almacenaron a −70°C hasta su posterior análisis.
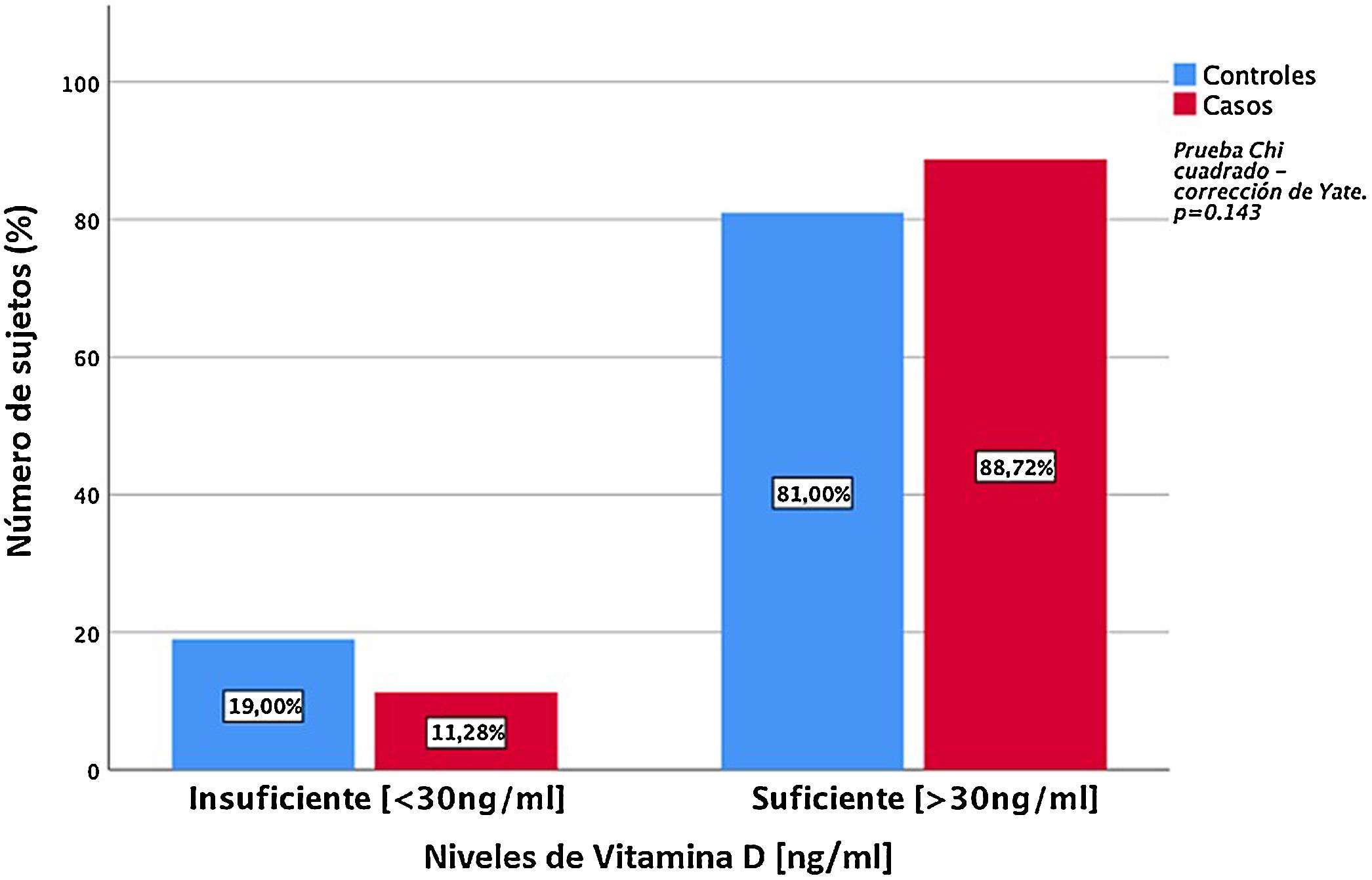
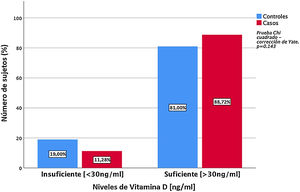
Concentraciones séricas de vitamina DLas concentraciones séricas de 25-hidroxivitaminaD se midieron mediante técnicas de inmunoanálisis enzimático: IDS-iSYS 25-Hydroxy VitaminD (Immunodiagnosis Systems Ltd. Boldon, Tyne & Wear, Reino Unido). Los valores de referencia se establecieron según los criterios del Institute of Medicine (IOM), donde <10ng/ml de 25(OH)D corresponde a niveles deficientes; 10ng/ml a <30 ng/ml, vitamina D insuficiente; ≥30 a <100ng/ml, vitaminaD suficiente, y ≥100ng/ml, posible intoxicación de vitaminaD28.
Genotipificación de SNPLos polimorfismos del gen VDR (TaqI [rs731236 A/G], ApaI [rs7975232 A/C], FokI [rs2228570 A/G] y BsmI [rs1544410C/T]) fueron genotipificados mediante PCR en tiempo real (RT-PCR), utilizando estuches disponibles comercialmente: TaqMan® SNP Genotyping (Assay ID: C__16021387_20, C___2404008_10; C__28977635_10; C__12060045_20 y C___8716062_10; respectivamente [Applied Biosystems, Foster City, CA, EE.UU.]).
Los ensayos de genotipificación se realizaron en un equipo de RT-PCR ABI Prism 7300, de Applied Biosystems, utilizando un volumen total por reacción de 5μl (2,4μl de DNA a una concentración aproximada de 10ng/μl, 2,5μl de Master Mix-2x y 0,125μl de sondas Taqman Genotyping-40× específicas de cada SNP).
Todas las reacciones de PCR se realizaron por duplicado. El programa de ciclado consistió en un paso inicial de 10min a 95°C, seguido por 40 ciclos de 15s a 92°C y 1min a 60°C por ciclo. La asignación genotípica se realizó automáticamente mediante la aplicación de Allelic Discrimination del sistema Applied Biosystems, la cual tuvo en cuenta una calidad de amplificación ≥90% por muestra.
Análisis estadísticoSe estimaron las frecuencias alélicas, genotípicas y haplotípicas en los grupos de estudio. En este estudio se realizó un muestreo no probabilístico por conveniencia. Las frecuencias alélicas fueron usadas para estimar el equilibrio genético de Hardy-Weinberg; además, se llevó a cabo el análisis de asociación genética con LES a nivel de alelos mediante el software Arlequin v3.5.
El análisis de asociación a nivel de genotipos se realizó mediante la prueba de χ2 de Pearson, con corrección de Bonferroni del valor de p, en el software estadístico SPSS v20 (IBM® SPSS® Statistics 20; IBM Corp., EE.UU.). Para estos dos análisis se estimó además el riesgo de LES asociado a cada genotipo o alelo, dependiendo del caso, mediante el cálculo de odd ratios (OR) y sus correspondientes intervalos de confianza del 95%, usando modelos de regresión logística ajustados por la variable género.
Los análisis de asociación entre los polimorfismos y las concentraciones séricas de vitaminaD (datos cuantitativos) se realizaron mediante las pruebas de U de Mann-Whitney y Kruskal Wallis, según el caso, expresando los valores de media ±desviación estándar (DE). Por otra parte, los análisis con los datos categóricos de vitaminaD se realizaron mediante la prueba de χ2 de Pearson o la prueba exacta de Fisher en los casos con valores esperados <5, con corrección de Bonferroni del valor de p.
Para el análisis de asociación por haplotipos se empleó el paquete estadístico «Haplo.stats v1.6.8» (R versión 3.0.2; http://www.r-project.org)29; con este paquete se emplearon las funciones Haplo.cc (Modelos de regresión logística para la estimación de riesgo: OR [IC95%], excluyendo haplotipos con frecuencias <1%) y, además, se ejecutaron 10.000 simulaciones para el refinamiento del valor de p, representado como [psim]) y Haplo.glm (Modelo de regresión lineal generalizado para la estimación de asociaciones con rasgos numéricos). La significancia estadística fue interpretada como p<0,05.
ResultadosEn la muestra estudiada, la edad promedio fue de 16,19±3,48 años; el 94% (n=125) fueron pacientes femeninas. El sexo femenino se asoció como factor de riesgo para LES (OR: 10,8; IC95%: 4,7-24,6).
La distribución del equilibrio de Hardy-Weinberg demostró que los polimorfismos VDR: ApaI [rs7975232] y BsmI [rs1544410] no se encontraron en equilibrio genético para los grupos de controles y casos, respectivamente (p<0,05) (tabla 1).
Comparación de la frecuencia genotípica y alélica de los polimorfismos del receptor de vitaminaD en pacientes con lupus eritematoso sistémico y grupo control
| VDR | Casos | H-W | Controles | H-W | OR | IC95% | pa |
|---|---|---|---|---|---|---|---|
| (n=133) | (n=100) | ||||||
| FokI [rs2228570] | |||||||
| AA, n (%) | 20 (18) | 12 (12) | 2,12 | (0,9-4,8) | 0,081 | ||
| AG, n (%) | 51 (45,9) | 37 (37) | 1,75 | (0,9-3,17) | |||
| GG, n (%) | 40 (36) | 51 (51) | 0,47 | (0,20-1,07) | |||
| A, n (%) | 91 (41) | 1,00 | 61 (30,5) | 1,00 | 1,58 | (1,05-2,36) | 0,025* |
| G, n (%) | 131 (59) | 139 (69,5) | 0,63 | (0,42-0,94) | |||
| ApaI [rs7975232] | |||||||
| AA, n (%) | 25 (22,5) | 24 (24) | 0,61 | (0,2-1,4) | 0,317 | ||
| AC, n (%) | 59 (53,2) | 60 (60) | 0,58 | (0,2-1,1) | |||
| CC, n (%) | 27 (24,3) | 16 (16) | 1,62 | (0,7-3,7) | |||
| A, n (%) | 109 (49,1) | 1,00 | 108 (54) | 0,03* | 0,82 | (0,56-1,20) | 0,314 |
| C, n (%) | 113 (50,9) | 92 (46) | 1,21 | (0,83-1,78) | |||
| TaqI [rs731236] | |||||||
| AA, n (%) | 67 (60,4) | 56 (56) | 2,39 | (0,6-8,3) | 0,371 | ||
| AG, n (%) | 40 (36) | 36 (36) | 2,22 | (0,6-8,0) | |||
| GG, n (%) | 4 (3,6) | 8 (8) | 0,41 | (0,1-1,46) | |||
| A, n (%) | 174 (78,4) | 1,00 | 148 (74) | 1,00 | 1,27 | (0,81-1,99) | 0,291 |
| G, n (%) | 48 (21,6) | 52 (26) | 0,78 | (0,5-1,23) | |||
| BsmI [rs1544410] | |||||||
| CC, n (%) | 55 (49,5) | 55 (55) | 2,33 | (0,5-9,4) | 0,169 | ||
| CT, n (%) | 53 (47,7) | 38 (38) | 3,25 | (0,7-13,4) | |||
| TT, n (%) | 3 (2,7) | 7 (7) | 0,42 | (0,1-1,7) | |||
| C, n (%) | 163 (73,4) | 0,04* | 148 (74) | 1,00 | 0,97 | (0,62-1,49) | 0,893 |
| T, n (%) | 59 (26,6) | 52 (26) | 1,03 | (0,6-1,59) | |||
H-W: test de equilibrio de Hardy-Weinberg, mejorado con 100.000 pasos de la cadena Markov.
OR [IC 95%]: modelos de regresión logística.
Al comparar las frecuencias genotípica y alélica de los polimorfismos de VDR en pacientes con LES y grupo control, se evidenció una frecuencia del aleloA del polimorfismo FokI [rs2228570] significativamente más alta en los casos que en los controles (41 vs. 30%), asociado a un riesgo 1,58 veces mayor de LES (OR: 1,58; IC95%: 1,05-2,36; p=0,025) (tabla 1).
El análisis por haplotipo demostró que, en el locusVDR, el haplotipo ACCA de los polimorfismos TaqI/ApaI/BsmI/FokI se asoció a un riesgo 2,28 veces mayor de LES (OR: 2,28; IC95%: 1,12-4,66; p=0,0) (tabla 2).
Análisis de haplotipos de los polimorfismos del receptor de vitaminaD en pacientes con lupus eritematoso sistémico y grupo de control
| TaqI [rs731236] | ApaI [rs7975232] | BsmI [rs1544410] | FokI [rs2228570] | Controles(n=100) (%) | Casos(n=133) (%) | pa | p simuladob | ORc | IC 95% |
|---|---|---|---|---|---|---|---|---|---|
| A | A | C | G | 0,23 | 0,158 | 0,052 | 0,058 | 0,90 | (0,4-1,7) |
| G | A | T | G | 0,13 | 0,107 | 0,114 | 0,107 | 0,95 | (0,4-2,2) |
| A | C | C | G | 0,298 | 0,215 | 0,135 | 0,137 | 1 | — |
| G | A | T | A | 0,103 | 0,0726 | 0,666 | 0,669 | 0,94 | (0,4-2,2) |
| A | A | C | A | 0,0601 | 0,0642 | 0,593 | 0,600 | 1,28 | (0,4-3,6) |
| A | C | C | A | 0,14 | 0,259 | 0,00* | 0,00* | 2,28 | (1,12-4,66) |
| A | A | T | G | 0,0094 | 0,0575 | 0,00* | 0,00* | 14,7 | (0,2-767) |
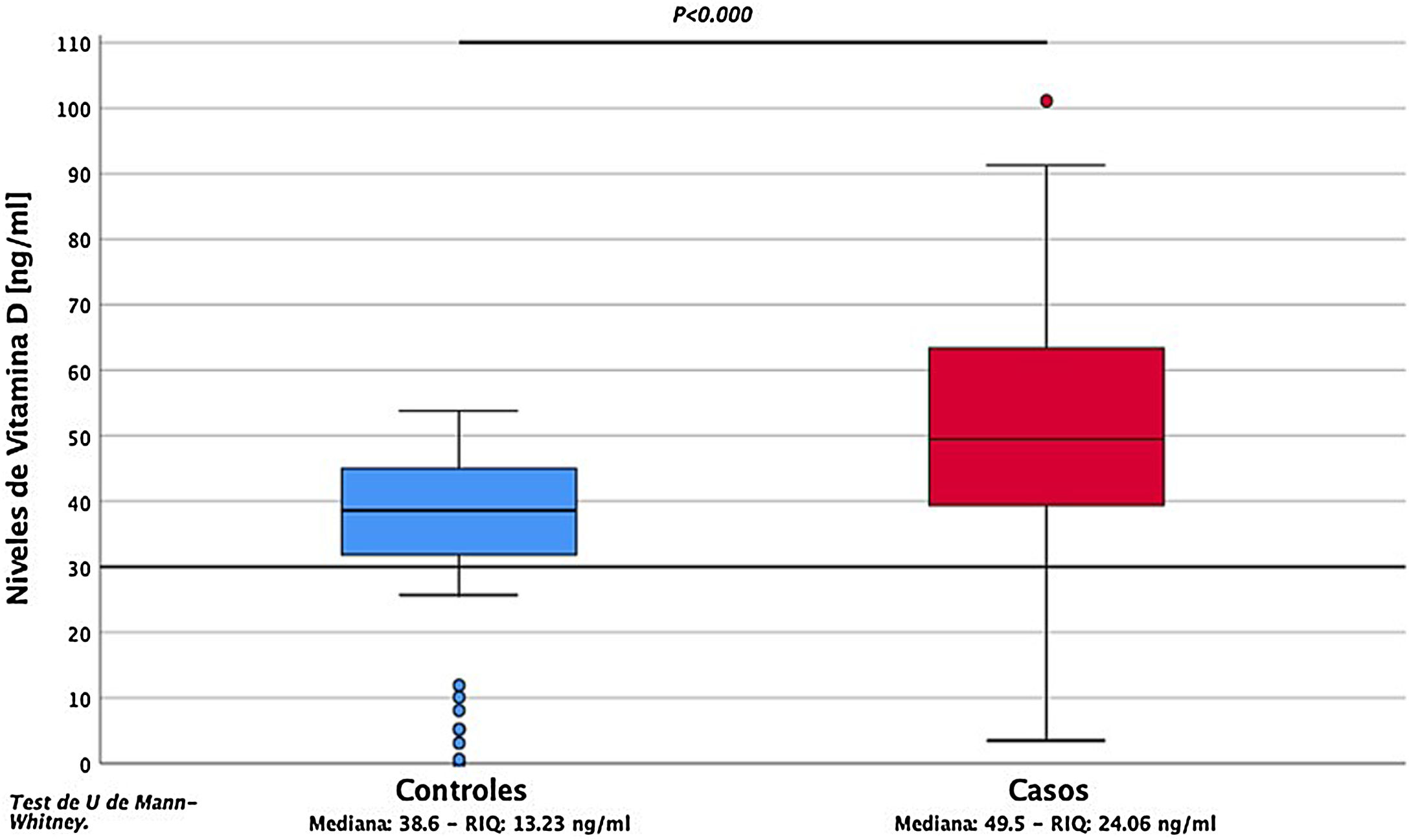
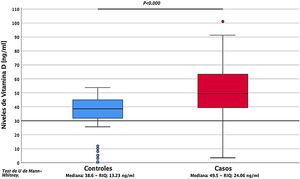
Al analizar la expresión sérica de vitaminaD se encontró que los casos evidenciaron concentraciones séricas significativamente mayores, en comparación con los controles (49,5 ±24,06ng/ml vs. 38,6 ±13,23ng/ml) (p=0,00) (fig. 1). Se evidenció deficiencia de vitaminaD en 11,3% de los pacientes (fig. 2).
En el presente estudio se observó una mayor frecuencia del alelo A del polimorfismo FokI [rs2228570] en los casos, lo que estuvo asociado a un riesgo mayor de LES. No hubo significancia estadística entre los polimorfismos ApaI [rs7975232], TaqI [rs731236] y BsmI [rs1544410] y LES en los modelos codominantes, ni tampoco en los alélicos. El haplotipo ACCA de los polimorfismos TaqI, ApaI, BsmI y FokI se asoció a mayor riesgo de LES. Adicionalmente, los individuos con LES presentaron concentraciones séricas significativamente mayores de vitaminaD.
El LES está asociado a la sobreproducción de citocinas. Los cambios en el equilibrio de la secreción de citocinas Th1 y Th2 hacia la sobreproducción de citocinas Th2 median la hiperactividad de las célulasB, las cuales promueven la diferenciación de las células plasmáticas y la producción de anticuerpos30-32. El incremento en la generación de autoanticuerpos y el depósito de complejos inmunes son la piedra angular de las manifestaciones clínicas del LES, como la nefritis lúpica, las citopenias y las artralgias33-35.
La vitamina D permite una mayor tolerancia al limitar la producción de citocinas proinflamatorias como la IL-12, la cual es una citocina polarizante de célulasT en célulasTh1 y aumenta la producción de citocinas antiinflamatorias como la IL-10. Por consiguiente, disminuye la autorreactividad y es uno de los muchos mecanismos por los cuales la vitaminaD puede disminuir la expresión de enfermedades autoinmunes9,10,36.
Abou-Raya et al.37 evaluaron los efectos de la suplementación con vitaminaD sobre citocinas inflamatorias (IL-1, IL-6 y factor de necrosis tumoral alfa), así como la producción de anti-dsDNA y anti-Sm en pacientes con LES con insuficiencia de vitaminaD. Los niveles de IL-1, IL-6 y factor de necrosis tumoral alfa disminuyeron significativamente y mejoraron las puntuaciones del Systemic Lupus Erythematosus Activity Index (Sledai)38 en pacientes con LES que recibieron suplementos de vitaminaD, en comparación con el grupo placebo37. Se resalta el papel inmunomodulador de la vitaminaD, lo que demuestra que la deficiencia está asociada a mayores índices de actividad en enfermedades autoinmunes, incluido el LES9,10,36.
Los efectos de la vitamina D están mediados por la unión de alta afinidad del VDR que se une a la forma activa de la vitaminaD 1,25(OH)2D3 y se distribuye en diversos tejidos17,36. El gen VDR es muy polimórfico; sin embargo, los polimorfismos rs7975232 y rs7975232 en el intrón8, rs731236 en el exón9 y rs2228570 en el codón de inicio son las variantes más estudiadas39. En los últimos años, diferentes estudios han arrojado resultados contradictorios sobre la asociación entre los polimorfismos del gen VDR y el riesgo de LES9,10,23,40,41. Las posibles razones de esta disparidad pueden ser tamaños de muestra pequeños, bajo poder estadístico o heterogeneidad clínica8.
Un metaanálisis incluyó 11 estudios con 1.621 casos y 1.883 controles que asociaron los polimorfismos BsmI, FokI, ApaI o TaqI del gen VDR con el riesgo de LES41. Se observó una asociación entre el alelo BsmIB y la aparición de LES en las poblaciones en general (OR: 1,726; IC95%: 1,214-2,455) y asiáticos (OR: 1,952; IC95%: 1,135-3,355). Los polimorfismos FokIT/C y TaqI no se asociaron con el riesgo de LES en el caso de los caucásicos. No hubo asociación significativa entre el polimorfismo ApaI y el riesgo de LES para las poblaciones en general, asiáticos y caucásicos41. En un estudio llevado a cabo por Monticielo et al.42 los polimorfismos VDR rs1544410 y rs2228570 no se relacionaron con LES en la población europea, pero se evidenciaron concentraciones más altas de 1,25(OH)2D3 en pacientes portadores del genotipo rs2228570 ff42.
En nuestra población no se encontraron asociaciones significativas entre los polimorfismos BsmI, ApaI y TaqI y el riesgo de LES. Sin embargo, sí se evidenció una mayor susceptibilidad mediante el polimorfismo FokI en modelos alélicos, solamente en concordancia con series en población árabe, tales como las descritas por Imam et al.43 y Emerah y El-Shal40, con riesgos de susceptibilidad a LES de OR: 1,617; IC95%: 1,282-2,041; p<0,000, y OR: 1,948; IC95%: 1,330-2,853; p<0,001, respectivamente.
Emerah y El-Shal40 llevaron a cabo un estudio para evaluar los polimorfismos y haplotipos del gen VDR (ApaI, BsmI y FokI) como factores de riesgo o marcadores de actividad del LES, y encontraron que el genotipo ApaIAA, el alelo BsmIB, los genotipos Bb, BB, el alelo FokIF y el genotipo FF de VDR aumentaron en el grupo LES. Además, los niveles séricos de la vitaminaD 1,25(OH)2D3 aumentaron en los pacientes con LES portadores del genotipo FokIff en comparación con los pacientes portadores del genotipoFF.
En otro metaanálisis (13 estudios), Zhou et al.44 observaron la asociación entre los alelos rs1544410B y rs2228570f y la susceptibilidad al LES en la población general, asiáticos y africanos, pero no en los caucásicos. En africanos, los genotipos rs1544410 BB/bb, rs2228570ff y rs7975232AA/aa se asociaron con LES. Sin embargo, no hubo una asociación significativa entre VDR rs1544410, rs2228570, rs7975232 y rs731236 y susceptibilidad al LES en caucásicos.
La exposición a la luz solar en el LES tiene un doble efecto, ya que los rayos ultravioletaB son esenciales para la síntesis cutánea de vitaminaD y, al mismo tiempo, un posible desencadenante de un brote de LES45,46. Los niños con LES son propensos a la deficiencia de vitaminaD, puesto que evitan la luz solar debido a la fotosensibilidad, el uso de protector solar, la inactividad física secundaria al dolor o la fatiga y el uso crónico de medicamentos como corticosteroides y antipalúdicos que pueden mejorar la depuración de vitaminaD47-51.
La hipovitaminosis D está asociada a mayor consumo del complemento y mayores índices de actividad de la enfermedad. Ospina-Caicedo et al.24, en un estudio transversal de 69 pacientes con LES, encontraron que el 36,2% de los pacientes tenían bajos niveles de vitaminaD, lo cual fue superior a nuestro estudio (11,3%); los niveles más bajos se encontraron en pacientes con actividad moderada a severa por puntaje Sledai. Además, se evidenció mayor consumo de proteínas del complemento y altos títulos de anti-dsDNA (p=0,006). Los pacientes que recibieron esteroides (0,5-1mg/kg) tenían niveles promedios de vitaminaD inferiores, comparados con los que no recibieron corticoterapia (p=0,048). Por lo tanto, se considera importante evaluar la suplementación de vitaminaD en pacientes con LES, especialmente cuando reciben corticoterapia.
Azab et al.51 evidenciaron que la hipovitaminosisD es altamente prevalente (57%) entre los niños y adolescentes egipcios con LES. Por su parte, Yap et al.50 detectaron una deficiencia de vitaminaD en más de una cuarta parte de los pacientes australianos adultos con LES, con una alta proporción de caucásicos en su cohorte. Un estudio francés multicéntrico realizado por Schoindre et al.49 informó hallazgos similares, y los autores concluyeron que se observó un estado subóptimo de vitaminaD en más del 80% de los pacientes con LES. Sin embargo, contrariamente a la mayoría de los reportes, en nuestro estudio se evidenciaron mayores niveles de vitaminaD en los casos con LES que en los controles, lo cual sugiere que nuestra población reside en áreas que se benefician de suficiente luz solar; asimismo, es señal de un adecuado esquema de suplementación de vitaminaD en corticoterapia y, además, podría sugerir una menor presencia de anticuerpos anti-vitamina D entre los casos, lo cual requiere evaluación en estudios futuros52.
En conclusión, el presente estudio demostró la asociación entre el polimorfismo VDRFokI rs2228570 en modelos alélicos y el haplotipo ACCA de los polimorfismos TaqI, ApaI, BsmI y FokI y un mayor riesgo de LES en población adolescente. Son necesarios más estudios para evaluar los efectos de estos polimorfismos en el LES, especialmente sus manifestaciones funcionales en otros grupos étnicos con tamaños de muestra más grandes para confirmar o refutar nuestros hallazgos.
LimitacionesEn nuestro conocimiento, este es el primer estudio que evalúa los polimorfismos del gen VDR en adolescentes con LES del Caribe colombiano. Sin embargo, existen algunas limitaciones en nuestro estudio que pueden afectar los resultados. Una de tales limitaciones fue la no obtención de variables clínicas e inmunológicas que limitaran establecer asociaciones entre los niveles de vitaminaD, los polimorfismos del gen VDR y la actividad del LES; además, el tamaño de muestra fue relativamente pequeño. Debido a que los resultados de la asociación entre polimorfismos VDR y LES han sido diferentes en distintas razas y etnias, se necesitan más investigaciones que permitan distinguir tales variables en nuestra región.
FinanciaciónEl estudio fue cofinanciado por Minciencias, Universidad Simón Bolívar y Universidad del Norte, a través del proyecto N̊ 840 de 2017, convocatoria 777 en la ciudad de Barranquilla, Colombia.
Conflicto de interesesNinguno.
AgradecimientosLos autores desean expresar agradecimiento a la Universidad Simón Bolívar y a la Universidad del Norte por la financiación del presente estudio. Deseamos expresar además nuestros agradecimientos a todos los pacientes participantes del estudio.