La poliarteritis nudosa (PAN) es una vasculitis necrosante, rara en la infancia, caracterizada por el compromiso de vasos pequeños/medianos y de múltiples órganos. Presentamos a una paciente que inició a los 4 años con síndrome febril prolongado, dolor abdominal crónico, mialgias incapacitantes y compromiso en la piel, quien luego de 2 años de cuadro clínico completa criterios clínicos para PAN. Recibió tratamiento con corticoide sistémico por vía oral e intravenosa, 6 meses de ciclofosfamida por vía intravenosa y manejo de mantenimiento con inmunosupresores convencionales sin respuesta adecuada, logrando control de la enfermedad únicamente con ciclofosfamida por vía oral y corticoide a largo plazo. Luego de 5 años y de recibir una dosis alta acumulada de ciclofosfamida, inicia con cuadros de hematuria macroscópica. Se evaluaron, entre otras causas, la toxicidad por ciclofosfamida y la actividad de la enfermedad. El estudio incluyó biopsia vesical, con hallazgo de vasculitis necrosante de paredes vesicales. La vasculitis vesical es raramente reportada en la literatura (3-5 casos en adultos) y en lo consultado no hay reportes en niños. Se describe, en nuestro conocimiento, el primer caso de compromiso vesical asociado a vasculitis sistémica reportado en la edad pediátrica.
Polyarteritis nodosa (PAN) is a necrotising vasculitis, rare in childhood, and characterised by the inflammation of small and medium vessels and multiple organ involvement. The case is presented of a 4 year old girl with prolonged febrile syndrome, chronic abdominal pain, disabling myalgia, and skin involvement. After 2years of symptoms, she met clinical criteria for PAN. She received treatment with oral and intravenous systemic corticosteroids, 6months of intravenous cyclophosphamide and maintenance with conventional immunosuppressants without an adequate response. However, she showed clinical improvement with oral cyclophosphamide and long-term corticosteroids. She had several relapses during follow-up visits due to irregular treatment requiring a high cumulative dose of cyclophosphamide. Five years later she presented with macroscopic haematuria, and was assessed for, among other causes, cyclophosphamide toxicity and disease activity. The workup included cystoscopy and bladder biopsy with finding of necrotising vasculitis of bladder wall. Bladder vasculitis is rarely reported in the literature (3-5 cases in adults) and in that consulted there are no reports in children. To our knowledge, this is the first case of bladder involvement associated with systemic vasculitis reported in the paediatric age.
La poliarteritis nudosa (PAN) fue descrita por primera vez por Kussmaul y Maier en 18661. Se define como una vasculitis necrosante de vasos de tamaño mediano/pequeño, sin vasculitis en arteriolas, vénulas y capilares, no asociada con anticuerpos citoplásmicos antineutrófilo (ANCA)2. Es la tercera vasculitis más común en niños, después de la vasculitis IgA/púrpura de Henoch-Schönlein y la enfermedad de Kawasaki3. En adultos, la incidencia de PAN es de alrededor de 0,0-1,6 casos, mientras que su prevalencia es de aproximadamente 31 casos por millón4; es menos frecuente en la infancia, aunque los datos epidemiológicos son escasos en niños5. Presenta un pico de edad de inicio en los niños de 9-10 años y ambos géneros son igualmente afectados6,7. La PAN del adulto con frecuencia se asocia a infecciones por virus hepatotropos, mientras que en la edad pediátrica el estreptococo y algunos virus han sido postulados como posibles desencadenantes, sin evidencia concluyente8,9.
Hay 2 presentaciones de la PAN en la infancia. La PAN cutánea, autolimitada en la mayoría de los casos, que puede manifestarse con livedo reticularis, púrpura, hemorragias en astilla, isquemia digital, nódulos dolorosos, artritis, y miositis; en general, los órganos internos no se ven afectados8. La PAN sistémica tiene un espectro de presentación más grave y, además de las manifestaciones de la PAN cutánea, los pacientes pueden presentar dolor abdominal y angina intestinal, que en algunos casos progresan a hemorragia intestinal, infarto y perforación intestinal3,8. La afectación de los vasos renales conduce a hipertensión e insuficiencia renal, raramente también ocurren el dolor y el infarto testicular; a nivel neurológico el sistema nervioso periférico suele comprometerse en forma de mononeuritis múltiple, mientras que el sistema nervioso central suele no tener afectación. También se ha descrito compromiso ocular, mientras que a nivel pulmonar, en general, no hay compromiso, lo que ayuda a diferenciarla de otros tipos de vasculitis.
La mortalidad por PAN es baja (alrededor de 4%) y el curso puede ser de remisión completa o recaída-remisión3,6-8.
Las pruebas de laboratorio son inespecíficas; durante la actividad de la enfermedad se pueden encontrar leucocitosis, trombocitosis y elevación de reactantes de fase aguda. Los autoanticuerpos generalmente son negativos, incluidos los ANCA10.
La PAN infantil se clasifica de acuerdo con los criterios EULAR/PRINTO/PRES revisados en 201011; cabe resaltar que estos son criterios de clasificación y no diagnósticos; en estos, la histopatología típica de vasculitis necrosante o las anomalías angiográficas son esenciales en el diagnóstico, con una sensibilidad del 84 y el 81%, respectivamente, y una especificidad de 99% para las 211. Los hallazgos clínicos incluyen compromiso en la piel (livedo reticularis, nódulos subcutáneos, infartos superficiales y profundos, cambios isquémicos menores, necrosis/gangrena), dolor o sensibilidad muscular, hipertensión (presión arterial sistólica/diastólica > percentil 95), neuropatía periférica sensorial o mononeuritis y compromiso renal dado por proteinuria, hematuria y alteración en la tasa de filtración glomerular11.
Aunque la angiografía convencional sigue siendo el «estándar de oro» y tiene la sensibilidad más alta para detectar estenosis en la vasculatura más pequeña y microaneurismas, es una técnica invasiva con una significativa exposición a altas dosis de radiación. Es por eso por lo que la angiografía por resonancia magnética y la angiografía tomográfica computarizada se utilizan cada vez más en niños11,12.
La mayoría de los tratamientos para niños se extrapolan de ensayos en adultos13. Se utiliza tratamiento de inducción con glucocorticoides y ciclofosfamida (CYC) y de mantenimiento con azatioprina (AZA) por vía oral, metotrexato o leflunomida. El uso de agentes biológicos en cohortes retrospectivas ha mostrado ser eficaz y seguro en niños con vasculitis sistémica primaria. No obstante, aún se requieren protocolos de tratamiento y ensayos clínicos14,15.
Caso clínicoPaciente femenina de 4 años, previamente sana, sin antecedentes patológicos relevantes, con cuadro inicial de fiebre y odinofagia y diagnóstico de amigdalitis bacteriana (no se confirma infección por Streptococcus); recibió manejo antibiótico convencional de manera ambulatoria.
Durante los 6 meses siguientes consulta en múltiples ocasiones a urgencias por cuadros de fiebre de 3-4 días de duración, de 38-39°C, asociado en su mayoría a dolor abdominal posprandial y dolor en miembros inferiores, en ocasiones incapacitante. Los estudios de primera línea realizados son normales, ocasionalmente hay en el hemograma leucocitosis leve y trombocitosis, elevación de reactantes de fase aguda, principalmente VSG, sin compromiso franco del estado clínico, por lo que recibía manejo ambulatorio.
Luego de 8 meses del cuadro inicial presentó fiebre prolongada de 22 días de duración, acompañada de dolor abdominal posprandial y agudización de mialgias intensas, que impedían de manera intermitente la deambulación, por lo que requirió hospitalización. En el examen físico se encontraron fenómeno de Raynaud de reciente aparición y livedo reticularis como únicos hallazgos.
Se realizó un estudio de extensión completo, descartando causas infecciosas comunes y no comunes; malignidad con estudio de médula ósea, que fue negativo para células blásticas, tumorales y hemofagocitos, biopsia de piel compatible con livedo reticularis y estudio inmunológico con anticuerpos negativos y complemento normal. Luego de 26 días de estudios dentro de la normalidad, dada la resolución de la fiebre y el adecuado estado clínico de la paciente se continuaron estudios de manera ambulatoria que también fueron negativos.
Luego de un año de seguimiento irregular con episodios de fiebre de 1 a 2 por mes, presentó disminución de agudeza visual en el ojo derecho, con hallazgo de atrofia del nervio óptico por Oftalmología. Los estudios para autoinmunidad fueron nuevamente negativos.
Dos meses después, asiste a urgencias con cuadro de fiebre, dolor abdominal y cefalea con urgencia hipertensiva, que requiere manejo en la Unidad de Cuidado Intensivo (UCI) por varios días por hipertensión arterial (HTA) de difícil manejo (estudio para causas secundarias de HTA normales). Paraclínicos con leucocitosis, trombocitosis y elevación importante de reactantes de fase aguda (VSG y PCR). Durante la estancia en la UCI presenta angina mesentérica (no fue posible toma de angiografía por la condición clínica del paciente). El análisis de las manifestaciones clínicas y la severa respuesta inflamatoria sistémica permitieron considerar como opción diagnóstica una vasculitis sistémica tipo PAN. Se inició manejo con glucocorticoide en pulsos (número de 3) y se continuó a 1mg/k/día asociado al manejo de HTA con 2 medicamentos dado el difícil control de cifras tensionales.
Durante el seguimiento, la paciente recibe tratamiento con esteroides a dosis de 1mg/k/día, presentando una actividad leve persistente, con reactivaciones; en una de ellas, compromiso renal, por lo que se decidió inicio de CYC por vía intravenosa; recibió 6 dosis mensuales y prednisolona a dosis altas (2mg/k/día), con lo cual se logra llevar a remisión. El tratamiento de mantenimiento tuvo dificultades debido a la adherencia, la intolerancia a metotrexato y falla a AZA, por lo cual es llevada a junta de Reumatología Pediátrica y se decide iniciar CYC por vía oral (2mg/kg/día), logrando el control de la enfermedad.
Luego de 5 años desde el inicio de la enfermedad (9 años de edad), el seguimiento es irregular por problemas psicosociales (condiciones económicas, trámites administrativos, mala adherencia, etc.). Recibe CYC por vía oral de forma discontinua y dosis variables de prednisolona, sin lograr descenso efectivo. En este momento la paciente inicia cuadros de hematuria y síntomas irritativos urinarios bajos. El estudio para hematuria indica etiología no glomerular y compromiso bajo; la ecografía renal es normal. Dado el antecedente de uso prolongado de CYC por vía oral (aunque con dudas sobre adherencia), a una dosis acumulada de 100 g en 5 años, y el riesgo de efectos secundarios relacionados con la CYC (cistitis hemorrágica [CH]), se decide suspender la CYC, reiniciar AZA y evaluar la respuesta.
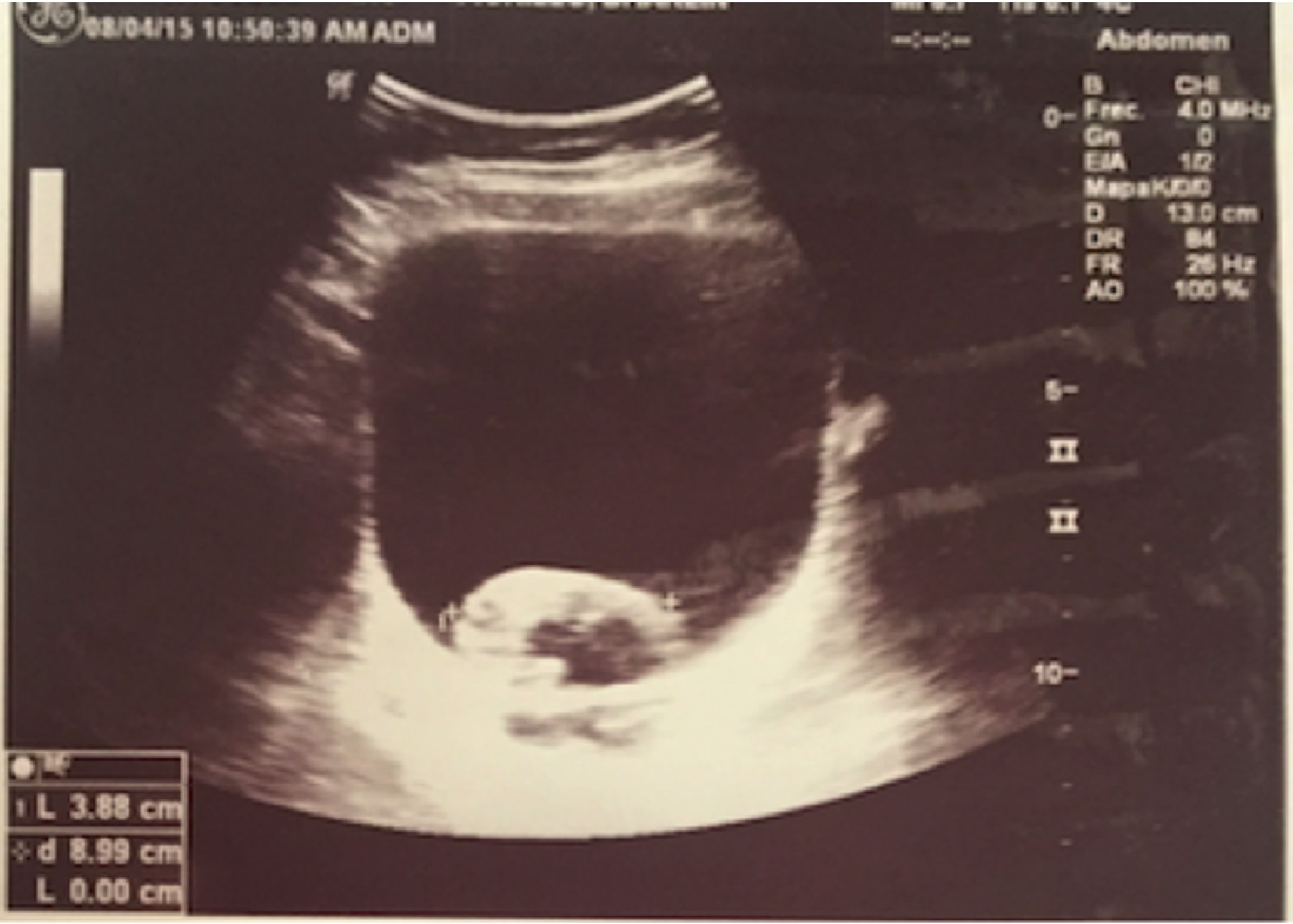
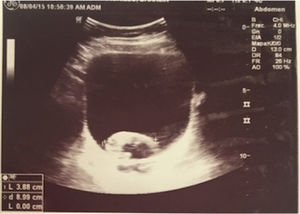
A pesar de la suspensión de CYC, luego de 8 meses, continúan los episodios recurrentes de hematuria, uno de ellos severo, que compromete el estado hemodinámico de la paciente, con disminución de hemoglobina hasta 7 g/dl y presencia de un gran coágulo intravesical (fig. 1). Se ampliaron los estudios por Nefrología y Urología pediátrica para otras causas de hematuria persistente, entre ellos poliomavirus, adenovirus, micobacterias, nefritis intersticial, cistitis eosinofílica, etc., los cuales fueron negativos. La uro-TAC documentó engrosamiento leve y difuso de las paredes de la vejiga; teniendo el estudio negativo para infección y persistencia de la sintomatología, se decidió realizar una cistoscopia, en la que se observó una mucosa hiperémica con vasculitis generalizada de la mucosa vesical.
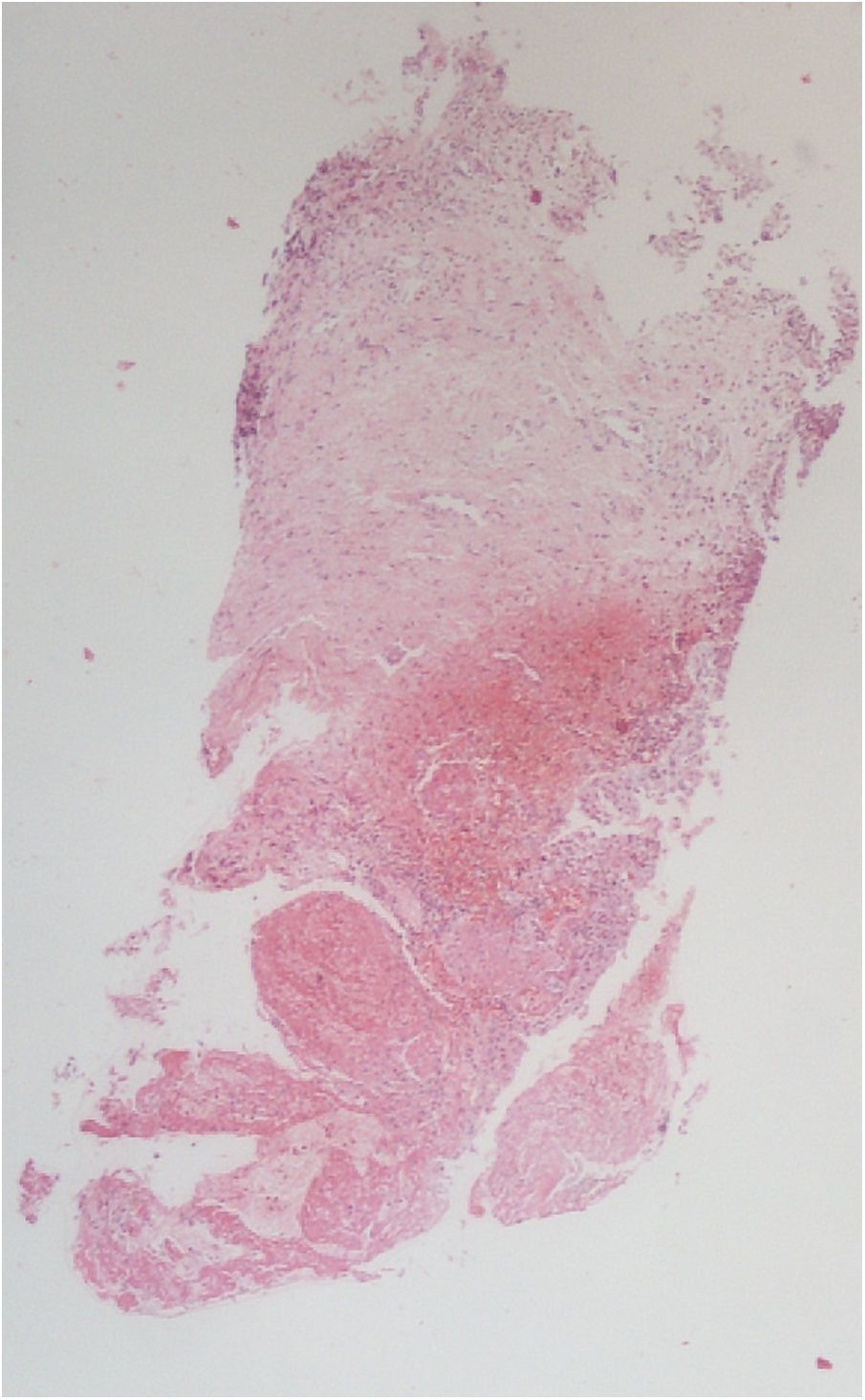
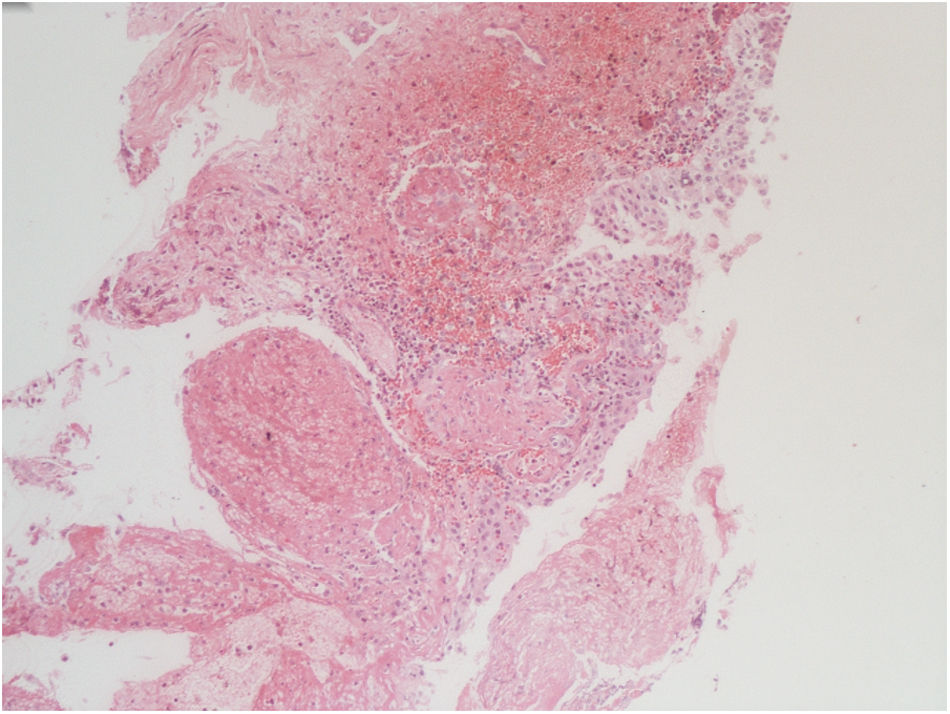
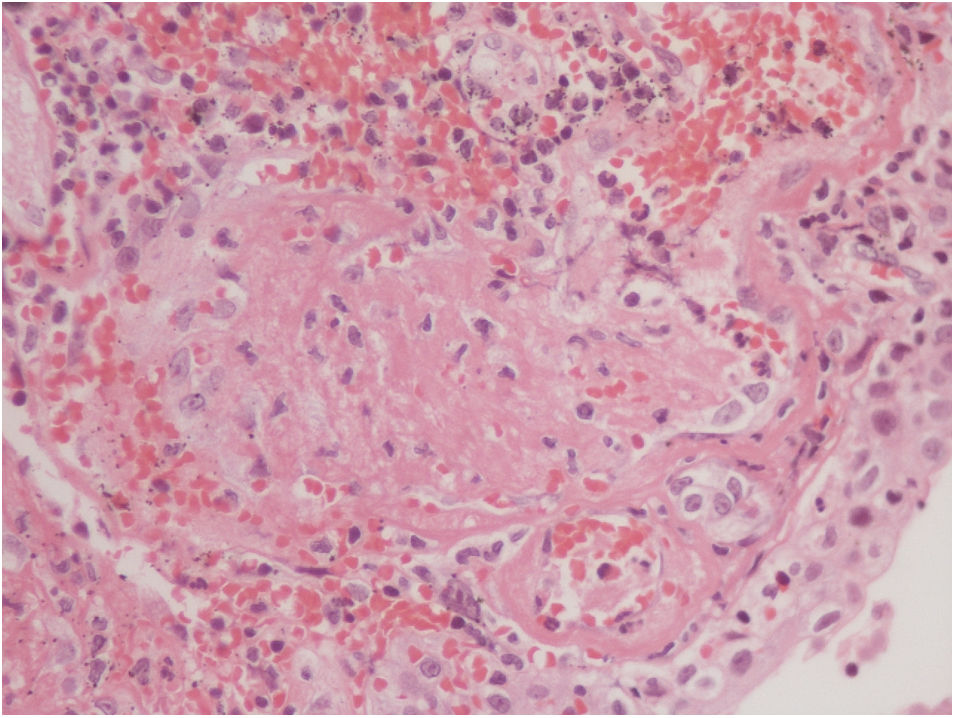
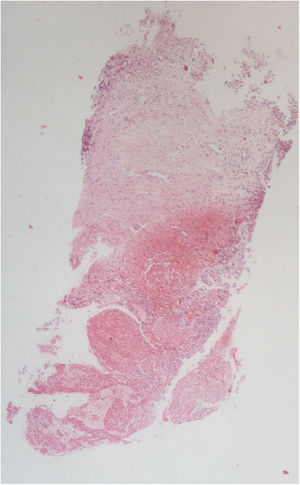
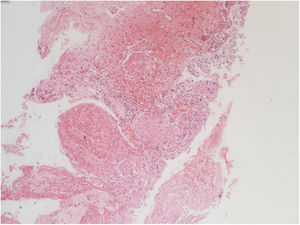
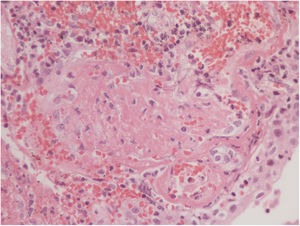
La histopatología vesical mostró un patrón predominante de daño vasculítico (figs. 2 y 3), con necrosis de las paredes vasculares, con edema endotelial asociado y marcada respuesta inflamatoria secundaria, leucocitoclástica, hemorragia y necrosis (fig. 4).
El compromiso inusual y severo en paciente con refractariedad a otros tratamientos y un tiempo prolongado de esteroides replanteó el manejo terapéutico; nuevamente, en junta de Reumatología, apoyados por la literatura (aunque escasa), se inició manejo con rituximab a dosis de 750mg/m2 en las semanas 0 y 2, asociado a CYC 500mg por vía intravenosa y glucocorticoide, con lo cual se logró el control de la complicación y se alcanzó la remisión.
Actualmente, a sus 16 años, la evolución de la paciente ha sido favorable, ha tolerado la terapia de mantenimiento con AZA, sin nuevos episodios de hematuria, con mejor adherencia, entendimiento y control de su enfermedad, y permitió la disminución progresiva de la dosis de esteroide, hasta la suspensión en la actualidad.
DiscusiónLa PAN es considerada un diagnóstico de exclusión, caracterizado por presentar compromiso multisistémico, con síntomas comunes a otras afecciones (infección, malignidad, etc.)16, requiere un alto índice de sospecha y representa un verdadero desafío diagnóstico para los clínicos.
Las características de la presentación difieren de acuerdo con los órganos involucrados7, aunque cualquier sistema puede estar involucrado. Las características clínicas en la presentación de una cohorte de PAN sistémica en pediatría en 69 niños fueron las siguientes: fiebre (87%), mialgia/sensibilidad muscular (83%), piel (88%), renal (19%), gastrointestinal grave (10%) y afectación neurológica (10%)6. La hipertensión se describe entre un 43 a un 90% en las diferentes cohortes de pacientes pediátricos con PAN y en general es de difícil manejo6,7,17,18.
En Colombia se reportó en 2017 una cohorte de 22 niños19 en la que las manifestaciones más frecuentes al inicio fueron compromiso articular en el 72% de los pacientes, seguido de síntomas constitucionales fiebre y mialgias (68%) y manifestaciones cutáneas; el compromiso orgánico estuvo liderado por el renal y el gastrointestinal, este último con manifestaciones severas, como la angina intestinal.
Los nódulos cutáneos son la manifestación cutánea más común en pacientes con PAN juvenil; se presentan como nódulos eritematosos en las extremidades inferiores, miden de 1 a 5cm de diámetro y pueden unirse para formar grandes áreas de piel endurecida17. La apariencia de livedo se refiere a una característica clínica donde el eritema reticular se extiende sobre un área amplia17; se define como un patrón reticular o moteado de la piel, violáceo, rojo o azul persistente, no reversible con calor, en el tronco, los brazos o las piernas, que consiste en una lesión regular no interrumpida, en general como círculos continuos (livedo reticularis regular) o círculos rotos irregulares (livedo racemosa), este último relacionado con enfermedades como síndrome antifosfolípido, vasculitis y escleroderma, entre otros20. Las ulceraciones cutáneas en las extremidades inferiores tienen un curso más prolongado y están relacionadas con la neuropatía17. La afectación neurológica se ha reportado en la literatura como neuropatía periférica, defectos focales, hemiplejía, pérdida visual, mononeuritis múltiple, parálisis del nervio renal, psicosis orgánica y convulsiones18,21. El compromiso gastrointestinal grave se asoció con un mayor riesgo de recaída y puede manifestarse como infarto o angina mesentérica, perforación, peritonitis, entre otros22. Las manifestaciones oculares pueden ocurrir como primera manifestación en un 10-20% de los pacientes; dentro del ojo hay oclusión de la rama y la arteria retiniana central, retinopatía isquémica, pérdida visual monocular transitoria, proptosis, defecto del campo visual bitemporal, neuropatías ópticas isquémicas anteriores o posteriores y es importante reconocer que el proceso vasculítico no se limita a la circulación retiniana: puede presentarse también como conjuntivitis, escleritis, uveítis o neuritis23; cuando se afecta el suministro vascular del nervio óptico (principalmente los vasos coroidales y las arterias ciliares posteriores) puede causar edema papilar y papilitis, que, a su vez, puede progresar a atrofia del nervio óptico23,24, como en el caso de nuestra paciente.
El diagnóstico es predominantemente clínico, aunque la biopsia de tejido y la arteriografía son herramientas importantes en la mayoría de los pacientes. La presencia de angiografía positiva en el momento del diagnóstico es más frecuente en los adultos que en los niños (81% vs. 40%)25 y muchas veces, como en este caso, los hallazgos en la biopsia y las imágenes se hacen durante el curso y el diagnóstico es puramente presuntivo.
El tratamiento requiere corticoides inicialmente en dosis altas, ya sea por vía oral o intravenosa, que luego se reduce gradualmente durante un período determinado por la respuesta al tratamiento y la gravedad de las manifestaciones clínicas, pero no hay ensayos clínicos que guíen la terapia. Para el tratamiento de inducción a la remisión se utilizan altas dosis de corticoides y CYC entre los primeros 3 a 6 meses; cuando se logra la remisión, la terapia principal de mantenimiento incluye glucocorticoides en dosis bajas (0,2 a 0,4mg/kg/día) y AZA por vía oral en una dosis de 1 a 2mg/kg/día durante 12 a 18 meses adicionales. También puede usarse metotrexato o leflunomida13. Se han descrito algunos casos refractarios manejados con plasmaféresis y otros agentes biológicos, como rituximab, tofacitinib, infliximab y tocilizumab14,15.
Las complicaciones del tratamiento a corto plazo, como las infecciones y los efectos secundarios inducidos por corticoides, continúan siendo una preocupación en los niños con PAN que reciben terapia estándar6; además, las complicaciones tardías asociadas con la terapia con CYC incluyen, con mayor frecuencia, alopecia, toxicidad hematológica y, en menor número, toxicidad urológica, malignidad e infertilidad26 han sido reportadas en cohortes de niños con otras vasculitis27. La CH es una manifestación común de urotoxicidad inducida por CYC en enfermedades reumáticas; algunas revisiones han indicado que la vía oral de administración de CYC y las dosis acumuladas podrían aumentar el riesgo de CH28; no obstante, aún no está claro si existe una dosis de corte que pueda predecir la aparición de CH29. La gravedad de la CH puede variar desde una leve hematuria autolimitada hasta una presentación potencialmente mortal30, el tiempo promedio de resolución de la hematuria es de 7-56 días, los hallazgos patológicos en las fases agudas y subagudas pueden ser edema, atrofia de la mucosa vesical, ulceración y hemorragia, que se extienden por la pared vesical; en casos severos necrosis y cronicidad, se acompaña, además, de cambios fibróticos del estroma.
En las vasculitis sistémicas, si el sistema genitourinario está involucrado, afecta de manera preferencial a los riñones y los testículos; el compromiso de la vejiga urinaria se ha descrito solo en contados informes de casos y ha surgido como un hallazgo incidental tardío en el curso de la enfermedad31. La presentación clínica en general es de síntomas bajos irritativos, los hallazgos radiológicos y en cistoscopia también son inespecíficos, y el diagnóstico se realiza mediante el examen histológico de las biopsias de vejiga, que también sirven para excluir otros diagnósticos diferenciales, especialmente la malignidad32,33.
Este caso clínico es particularmente llamativo porque logra establecer la presentación novedosa e inusual de la poliarteritis no informada previamente en niños relacionada con actividad de la enfermedad, que en nuestra paciente se vio desencadenada por el curso insidioso de la vasculitis y la falta de adherencia al manejo.
ConclusiónEn pacientes con síntomas constitucionales, síndrome febril prolongado y compromiso orgánico, se deben incluir las vasculitis sistémicas en el diagnóstico diferencial. El tratamiento regular es fundamental para la evolución favorable en todas las enfermedades. En esta paciente, una enfermedad severa desde el principio y el tratamiento irregular fueron determinantes de la aparición de una complicación que, por lo conocido hasta el momento, no está descrita en pacientes pediátricos. Requirió igualmente un tratamiento intensivo que incluyó rituximab, medicamento que ha mejorado el pronóstico de pacientes con formas severas de vasculitis.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses y la financiación fue con recursos propios.