El síndrome de Sjögren primario (SSp) es una enfermedad autoinmune, cuyo compromiso se puede ver reflejado en la calidad de vida, incapacidad y progresión a complicaciones en los pacientes. Con el fin de evaluar estos componentes, diversas escalas clinimétricas se han utilizado en el SSp.
MétodosPara describir las escalas de clinimetría más utilizadas en el SSp, se realizó una búsqueda de artículos en las bases de datos Google Scholar, Scielo, Embase, Academic Search Ultimate y Medline. Se empleó Pubmed para la búsqueda en Medline, con los términos MeSH: «Clinimetry»; «Clinimetrics»; «Quality of life»; «Activity index»; «Scales»; «Sjögren's syndrome»; enlazados con el conector booleano AND. Se incluyeron 1.081 artículos publicados hasta mayo de 2018, que luego de la aplicación de los criterios de inclusión, se redujeron a 51 con la mayor relevancia.
ResultadosSe describen las escalas de clinimetría más usadas en la evaluación del compromiso sistémico y de la calidad de vida en los pacientes con SSp.
ConclusiónLos métodos clinimétricos tienen gran utilidad desde el punto de vista de seguimiento, evaluación de respuesta a tratamiento, percepción de la enfermedad por parte de los pacientes y evaluación objetiva de ensayos clínicos en el SSp.
Primary Sjögren's syndrome (pSS) is an autoimmune disease that can affect quality of life, cause disability, including progression to systemic complications in patients. In order to evaluate these components, several clinimetric scales have been used in pSS.
MethodsIn order to describe the most commonly used clinimetric scales in pSS, a systematic search of articles was carried out using Google Scholar, Scielo, Embase, Academic Search Ultimate, and Medline databases. Pubmed was used for the search in Medline, with the MeSH terms: ‘Clinimetry’; ‘Clinimetrics’; ‘Quality of life’; ‘Activity Index’; ‘Scales’; ‘Sjögren's syndrome’; linked with the Boolean connector AND. A total of 1,081 articles published up to May 2018 were reduced to the 51 of the most relevant after application of inclusion criteria.
ResultsThe most commonly used clinimetric scales in the evaluation of systemic involvement and quality of life in patients with pSS are described.
ConclusionClinimetric methods are very useful from the point of view of follow-up, evaluation of response to treatment, perception of the disease by patients, and objective evaluation of clinical trials in pSS.
El síndrome de Sjögren primario (SSp) es una enfermedad sistémica, autoinmune, que se caracteriza por afectación principalmente de las glándulas salivales y lagrimales, inducida por mecanismos inflamatorios linfocitarios y neuroendocrinos, que lleva a la disfunción y destrucción del tejido glandular, derivando en la presentación de síntomas secos1. Sin embargo, este proceso inflamatorio se puede desarrollar en otros órganos, como lo son el riñón, el pulmón, el cerebro, la piel, entre otros. Este síndrome constituye una de las enfermedades reumatológicas más prevalentes, con una incidencia global de 60,8 por cada 100.000 habitantes2. Existen 2 formas de la enfermedad, el SSp y el secundario. En el síndrome de Sjögren secundario, otra enfermedad coexiste con esta, especialmente el lupus eritematoso sistémico (LES) (15-36%), la artritis reumatoide (20-32%) y la esclerosis sistémica (20-32%), entre otras3,4.
Los síntomas principales, que se encuentran en aproximadamente el 80% de los pacientes, son: por un lado, exocrinopatía de glándulas lagrimales y salivales, que resulta en ojo seco y boca seca; y por otro, fatiga y dolor, que son manifestaciones extraglandulares de la enfermedad. Estas tienen un gran impacto en la calidad de vida del paciente, ya que se ha descrito en la literatura que la fatiga puede tornarse incapacitante y se asocia con pérdida o disminución de la productividad laboral5. Clínicamente, las características de la enfermedad del SSp se pueden dividir en 2 grupos: 1) los síntomas benignos pero incapacitantes que percibe el paciente, tales como sequedad, dolor y fatiga; 2) las manifestaciones sistémicas, que son potencialmente severas y afectan al 30-40% de los pacientes4.
Por todo lo anterior, es necesario que el clínico evalúe de forma objetiva el compromiso de la patología. Para este fin se ha creado la clinimetría, rama básica de la medicina que, a través de escalas, se encarga de la identificación, especificación y medición del fenómeno clínico humano6,7. De esta forma, es posible evaluar la actividad de la enfermedad, la respuesta al tratamiento y la percepción de la enfermedad en los pacientes con SSp8,9. Dado que el espectro de afectación del SSp es amplio, desde 1996 se han creado métodos clinimétricos que permiten abordar cada aspecto de forma objetiva10,11.
La presente revisión tiene como objetivo hacer una descripción de los instrumentos más utilizados para la evaluación del SSp en la práctica clínica, tanto en la actividad y severidad de la patología como en calidad de vida.
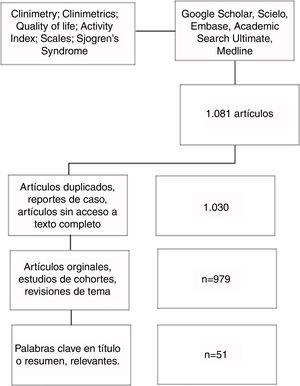
MétodosBúsqueda de la literaturaSe realizó una búsqueda de artículos en las bases de datos Google Scholar, Scielo, Embase, Academic Search Ultimate y Medline. Se empleó Pubmed para la búsqueda en Medline, con los términos MeSH: «Clinimetry»; «Clinimetrics»; «Quality of life»; «Activity index»; «Scales»; «Sjögren's syndrome»; enlazados con el conector booleano AND (fig. 1).
Selección de artículos y extracción de la informaciónEn la búsqueda inicial se encontraron 1.081 artículos, que fueron ingresados en una base de datos de Excel. Tras excluir los artículos duplicados y seleccionar aquellos que cumplieran los criterios de inclusión y que incluyeran las palabras clave en el título o en el resumen, se consideraron relevantes 51 artículos que fueron revisados por 2 autores. El acceso a estos artículos se obtuvo con la ayuda de las bibliotecas de nuestra Universidad y Hospital Universitario.
Criterios de inclusiónArtículos originales, estudios de cohortes, revisiones de tema; publicados hasta el año 2018; escritos en inglés o español.
Criterios de exclusiónReportes de caso; artículos sin acceso a texto completo.
ResultadosSe seleccionaron 51 artículos referentes al síndrome de Sjögren, instrumentos clinimétricos y su uso o aplicabilidad en esta enfermedad; a partir de estos se lleva a cabo la siguiente revisión.
Instrumentos que evalúan compromiso clínico/sistémicoSSDDI, SSDAI y SSDIEn el año 2007 se crean 2 índices: el Índice de Daño de la Enfermedad del SSp (del inglés, Sjögren's Syndrome Disease Damage Index [SSDDI]) y el Índice de Actividad de la Enfermedad del SSp (del inglés, Sjögren's Syndrome Disease Activity Index [SSDAI]). Para este fin se recolectaron datos en 12 centros clínicos de Italia, desde el 2004 hasta el 2006. Se analizaron los pacientes para seleccionar las variables clínicas individuales y la combinación de algunas que representan los predictores más válidos del daño y la actividad de la enfermedad. Cada síntoma, signo y prueba se definió con precisión, como lo especificaba el American College of Rheumatology10,12.
El SSDDI se construyó utilizando variables seleccionadas mediante un modelo de regresión lineal multivariante, en donde el puntaje asignado a cada elemento se derivó del peso que la variable correspondiente tenía en el modelo. El puntaje máximo de 16 puntos consiste en 9 ítems que se tienen en cuenta como predictores del nivel de daño de la enfermedad.
El SSDAI consiste en un modelo de regresión lineal multivariado con 11 variables, en donde la variable dependiente fue la puntuación numérica para la actividad de la enfermedad (0-10) asignada por el investigador, derivada del peso que la variable correspondiente tenía en el modelo.
Finalmente, en el estudio, las variables del SSDDI no estaban o estaban débilmente correlacionadas con el estándar de oro (Evaluación global del médico [PhGA] del estado de enfermedad) para la actividad de la enfermedad, mientras que el SSDAI sí lo hizo. Un puntaje ≥5 puntos en el SSDAI presentaba una sensibilidad del 86,5% y una especificidad del 87,6% para identificar pacientes con enfermedad activa o muy activa, quienes serían candidatos a una terapia farmacológica más intensiva.
La limitación geográfica (un solo país) del desarrollo del SSDDI y el SSDAI planteó dudas sobre su validez10. Estas, al igual que otras que se desarrollaron posteriormente, utilizaron herramientas ya validadas para la evaluación de la actividad en otras enfermedades autoinmunes (principalmente para el LES) basándose en el European Consensus Lupus Activity Measurement (ECLAM)13, dado el compromiso sistémico que se observa en ambas. Esta última medida, sin embargo, presenta marcadas desventajas respecto al SSDAI, ya que las características puntúan si están presentes, mas no establece ninguna distinción entre lo que empeora, mejora o se mantiene; limitando su aplicación en la práctica clínica14.
Posteriormente, el Índice de Daño por Síndrome de Sjögren (SSDI) se desarrolló en el 2008 para evaluar el daño longitudinal en pacientes con SSp, utilizando variables similares a la cohorte que se utilizó para el SSDAI y el SSDDI. Un total de 104 pacientes de 8 hospitales del Reino Unido, quienes cumplían con los criterios del Consenso Americano-Europeo (AECG) del 2002 para SSp12,15, fueron evaluados por reumatólogos en la primera consulta y a los 12 meses siguientes. En cada ocasión se recolectaron los datos respecto a daño, actividad de la enfermedad, además de pruebas bioquímicas, hematológicas e inmunológicas (Anti-SSA/Ro y Anti-SSB/La). Para este proceso, se completaron los cuestionarios SF-36, Sjögren's Systemic Clinical Activity Index (SCAI) y el Perfil de Fatiga y Malestar-Inventario de síntomas Sicca (PROFAD-SSI)16.
El índice proporcionó una evaluación objetiva y adecuada para el uso, por parte de personal especializado o no, de la progresión de la enfermedad. Por ejemplo, una ventaja del SSDI con respecto al SSDDI es que reconoce enfermedades cardiovasculares, gastrointestinales y musculoesqueléticas, con una metodología basada en los índices de daño del LES (SLICC/ACR)17. Esta herramienta consiste en 10 dominios con un puntaje máximo de 27 puntos, que se tiene en cuenta como predictor del nivel de daño de la enfermedad en la población del estudio.
El SSDDI y el SSDI son índices de cronicidad que, aunque se pueden utilizar en la práctica clínica, presentan limitaciones como baja validez externa y validación cruzada; ya que son índices que se desarrollaron en cohortes de una sola nacionalidad, y por lo tanto pueden no cubrir completamente el amplio espectro del SSp18. Además, a pesar de que el SSDAI contaba con la ventaja de ser muy simplificado, la falta de exhaustividad ocasionaba que se subestimaran los pacientes con ciertos grados de actividad de la enfermedad19.
SCAIAnteriormente no existían herramientas para evaluar el compromiso sistémico del SSp, y el tratamiento para presentaciones severas de la enfermedad se realizaba empíricamente con altas dosis de corticosteroides. Dada la necesidad de herramientas de evaluación en ensayos clínicos, se creó el SCAI en el año 2007 utilizando los principios del índice BILAG (British Isles Lupus Activity Group) para LES, modificado para SSp.
Este índice consta de 8 dominios que incluyen: fatiga, síntomas constitucionales, artritis, músculo, cutáneo/vascular, pulmonar, hematológico e inflamación glandular. La mayoría de los ítems se puntúan como 0 cuando es ausente, 1 cuando hay una mejora, 2 cuando permanece igual, 3 cuando empeora, o 4 cuando aparece nuevo, durante las últimas 4 semanas en comparación con la actividad previa de la enfermedad.
Los hallazgos del estudio que permitió su realización sugieren que este índice es de utilidad en estudios terapéuticos del SSp20. Sin embargo, al ser sumamente exhaustivo, se dificulta su aplicación en la práctica clínica diaria19.
ESSDAIEl ESSDAI (del inglés, EULARSjögren's Syndrome Disease Activity Index) fue desarrollado en 2009 por el consenso de un grupo de expertos europeos y norteamericanos, apoyados por el EULAR (European League Against Rheumatism)21, con el propósito de obtener un instrumento estandarizado para la evaluación de la actividad sistémica de la enfermedad, que pudiera ser en la práctica clínica y en ensayos clínicos. Este índice ha sido validado en múltiples estudios, confirmándose que es reproducible22-24. Su uso es cada vez más prevalente, al punto que se considera actualmente el estándar de oro para la medición de actividad de la enfermedad. Adicionalmente, se ha visto correlación con biomarcadores de actividad de los linfocitos B22, así como con el riesgo de linfoma25,26. De hecho, las decisiones en torno al seguimiento, tratamiento y pronóstico de pacientes con mayor grado de actividad de la enfermedad al momento del diagnóstico del SSp se basan en el ESSDAI26, ya que su amplio rango de valores permite discriminar entre pacientes con enfermedad activa e inactiva27.
El ESSDAI incluye 12 dominios, que hacen referencia a los sistemas afectados por la enfermedad (cutáneo, respiratorio, renal, articular, muscular, nervioso central, nervioso periférico, hematológico, glandular, constitucional, linfático y biológico) y cada uno se divide en 3 o 4 grados de actividad28. Para garantizar un puntaje correcto, se debe descartar otra patología diferente al SSp como causal de los signos y síntomas, al igual que excluir las características de daño que son irreversibles (presente por 12 meses o más).
El seguimiento de pacientes con SSp que se encuentran estables clínicamente tiene un valor clínico limitado con esta herramienta29. Sin embargo, se ha descrito un uso de forma acumulativa, es decir, que al aplicarse en estos pacientes, se adiciona valor clínico al describir la severidad de la enfermedad y se calcula sumando el máximo puntaje por dominio que haya alcanzado el individuo en cualquier momento de su vida29.
Aunque se ha visto que el dominio biológico se ve afectado en dos tercios de los pacientes24,26,30 y que las puntuaciones altas en la escala se correlacionan con este dominio y no con las demás manifestaciones de actividad, esto induce falsamente a la asociación entre estos 2 aspectos. Por esto, en 2017 se creó el ClinESSDAI, en el cual se eliminó el dominio biológico31 y se determinó que es capaz de detectar los cambios, con una sensibilidad cercana a la del ESSDAI, por lo que provee una evaluación acertada de la actividad de la enfermedad independiente de los biomarcadores de activación de linfocitos B31,32.
Instrumentos que evalúan los síntomas percibidos por el pacientePhGALa PhGA es un sistema de puntuación realizado por el especialista para recopilar datos de los resultados clínicos y estimar la gravedad de la enfermedad33. Hace parte del conjunto básico de medidas de la actividad de la enfermedad del Colegio Americano de Reumatología, incluyendo tanto la Evaluación Global del Paciente (PGA/PtGA) como la PhGA34.
En estudios clínicos, los médicos evalúan a los pacientes utilizando la PhGA en 2 escalas: una numérica y otra nominal. Para la primera, cada paciente recibe una puntuación para el daño y la actividad de la enfermedad desde 0 (sin daño o sin actividad) hasta 10 (máximo daño o actividad de la enfermedad). Para la segunda, se evalúa el cambio de la actividad de la enfermedad, respondiendo a preguntas como: «¿En comparación con la visita previa, la actividad del SSp de este paciente, ahora cómo se encuentra?». Las respuestas se clasifican en 5 categorías (enfermedad inactiva, actividad baja, moderada, alta y muy alta) y el proceso de evaluación se realiza en al menos 2 visitas a los 3 o 6 meses10,24,35.
Se ha evidenciado que la opinión del médico con respecto al estado de la enfermedad puede diferir de la opinión del paciente36,37, conllevando una correlación baja entre la PhGA y la PGA, donde se pone en manifiesto cómo las variables que son importantes para los médicos no son las mismas que son importantes para los pacientes38.
Suponer que la PhGA o la PGA pueden representar el «estándar de oro» para evaluar un aspecto de la enfermedad, como el daño o la actividad, puede introducir varios sesgos metodológicos ya que, sin importar cómo se formulen las preguntas, siempre incorpora implícitamente su propia opinión en la evaluación de la actividad sistémica y los síntomas del paciente39.
PGAEULAR insiste constantemente en la necesidad de trabajar en conjunto con los pacientes, en particular en las enfermedades reumatológicas40; es por esto que surge la PGA, como medida para disminuir el sesgo en escalas que son evaluadas por los clínicos únicamente41.
Tal como con la PhGA, la PGA se evalúa por medio de escalas numéricas de 0-10 puntos o con escalas análogas visuales, en donde los resultados más altos indican un peor estado de la enfermedad. Sin embargo, otras formulaciones de PGA que se usan en la consulta frecuentemente son: «¿Cómo calcula que se encuentra la actividad de su enfermedad hoy?» y se clasifica y evalúa igual que la PhGA37.
Diferentes estudios han comparado la eficacia de estas evaluaciones en enfermedades diferentes al SSp, encontrando significativas discordancias en las variables consideradas para establecer la evolución global de la enfermedad por parte de los pacientes y médicos42-44; sin embargo, la evidencia en SSp es limitada.
Por ejemplo, los pacientes con discapacidad prolongada pueden informar una buena calidad de vida (a pesar de lo que externamente puede parecer paradójico) debido a factores como la adaptabilidad a la discapacidad, lo que contribuye a la disconcordancia médico-paciente37.
PROFAD-SSILa fatiga en SSp es considerada como un síntoma altamente incapacitante, presente hasta en un 75% de los pacientes y con la capacidad de afectar sustancialmente la calidad de vida45. Por lo tanto, se creó el Perfil de Fatiga y malestar (del inglés, Profile of Fatigue and Discomfort - Sicca Symptoms Inventory [PROFAD-SSI]) y el más reciente: EULAR-SS Índice Informado por el Paciente (del inglés, EULARSjögren's Syndrome Patients Reported Index [ESSPRI])46,47.
En el 2004 se publica el PROFAD-SSI; para el que se recolectaron datos de pacientes con diagnóstico de SSp que cumplían con los criterios de clasificación AECG12, reclutados de diferentes clínicas reumatológicas de Reino Unido48. Fue creada a modo de autoinforme de los pacientes sobre sus síntomas de fatiga, incomodidad y dolor49,50.
Este puntaje consta de 64 preguntas puntuadas en una escala de Likert de 8 puntos (0-7). Su desventaja es que al ser tan largo se torna difícil para los pacientes, particularmente al usarse como evaluación de resultados en ensayos clínicos. Por esto, se desarrolló el PROFAD-SSI-SF (SF: short form), que consta de 19 preguntas agrupadas en los mismos 8 dominios con una puntuación para el PROFAD y otra para el SSI18. Así, el PROFAD tiene 9 elementos divididos en 4 dominios: fatiga física, fatiga mental, artralgia y vascular; y el SSI tiene 10 elementos divididos en 4 dominios: sequedades ocular, oral, vaginal y cutánea. Su ventaja es la distinción de la fatiga en física y mental, así como de los sitios de sequedad, que no siempre aparecen concomitantemente y en la misma intensidad50. Al utilizarlas juntas en varios estudios, se establece un perfil que logra capturar el componente sintomático del SSp14.
ESSPRIEl índice informado por el paciente del síndrome de Sjögren del EULAR (ESSPRI) fue desarrollado en el año 2011 con una colaboración multinacional de pacientes provenientes de países de Europa, Norteamérica y Sudamérica48. Para la realización del estudio, se utilizó como índice comparador la PGA, estándar de oro en su momento. Fue desarrollado con el propósito de evaluar las características de sequedad, fatiga y dolor que afectan la calidad de vida; y ser utilizado tanto en ensayos clínicos como en la práctica clínica rutinaria.
Está compuesto por 3 dominios: sequedad, dolor o disconfort y fatiga. La sequedad incluye 6 componentes que aquejan al paciente con SSp: ocular, oral, cutánea, nasal, traqueal y vaginal. Cada uno se califica del 0 al 10, según la severidad48.
Comparado con métodos clinimétricos previos, el ESSPRI es una herramienta corta y fácil de utilizar que permite medir la severidad de cada síntoma sin perder la validez. Además, tiene en cuenta las características sicca, en orden de importancia puesto que en su estudio la sequedad oral y ocular tiene más importancia que la nasal, traqueal o vaginal48,51. Tiene una sensibilidad para detectar cambio mucho mayor que otros cuestionarios de calidad de vida, como el SSI y el PROFAD. La tabla 1 muestra las herramientas de clinimetría más utilizadas en el SSp y los ítems que evalúa cada una de ellas. La tabla 2 hace un resumen de las escalas.
Ítems que evalúan las herramientas clinimétricas en SSp y cómo se puntúan
| SSDDI | SSDAI | SSDI | PROFAD - SSI - SF | ESSDAI | ESSPRI | |
|---|---|---|---|---|---|---|
| DOMINIOS EVALUADOS | Enfermedad linfoproliferativa | Síntomas constitucionales | Dominio ocular | Necesidad de descansar | Dominio constitucional | Sequedad |
| Daño renal | Síntomas articulares | Dominio oral | Dificultad para iniciar una actividad | Dominio de linfadenopatía y linfoma | Fatiga | |
| Daño ocular | Características hematológicas | Dominio sistémico | Dificultad para continuar con una actividad | Dominio glandular | Dolor | |
| Daño Oral/Salivar | Síntomas pleuropulmonares | Dificultades por sentir falta de fuerza en los músculos o sensación de debilidad | Dominio articular | |||
| Daño pulmonar | Leucopenia / linfopenia | Dificultades por no pensar con claridad o para concentrarse | Dominio cutáneo | |||
| Daño Neurológico | Cambios en vasculitis | Dificultades por olvidar cosas o cometer errores | Dominio pulmonar | |||
| Compromiso renal activo | Molestias en extremidades | Dominio renal | ||||
| Neuropatía periférica | Molestias en dedos o muñecas | Dominio muscular | ||||
| Molestias por manos frías | Dominio de sistema nervioso periférico | |||||
| Molestias por piel seca | Dominio de sistema nervioso central | |||||
| Dificultades por sequedad vaginal | Dominio hematológico | |||||
| Dificultades por ojos sensibles | Dominio biológico | |||||
| Dificultades por ojos irritables | ||||||
| Molestias en la visión | ||||||
| Dificultades para alimentarse | ||||||
| Molestias con la garganta o la nariz seca | ||||||
| Malestar por mal aliento | ||||||
| Necesidad de líquidos para humedecer la boca | ||||||
| Molestias por otros problemas | ||||||
| PUNTAJE | Consta de 6 dominios y 9 ítems distribuidos entre ellos. Cada ítem tiene un puntaje específico de 1, 2 o 5 de acuerdo al peso que le corresponde. | Consta de 8 dominios y 11 ítems distribuidos entre ellos. Cada ítem tiene un puntaje específico de 1, 2, 3 o 4 de acuerdo al peso que le corresponde. | Consta de 27 ítems que se puntúan como 0 si está ausente o 1 si está presente. | Cada pregunta se puntúa de 1-10, el resultado es un promedio. | Cada dominio tiene diferentes puntuaciones dependiendo del grado de actividad. A su vez, cada dominio tiene un peso específico. El resultado se obtiene al multiplicar el grado de actividad por el peso de cada dominio. | Cada pregunta se puntúa de 1-10, el resultado es un promedio. |
ESSDAI: EULARSjögren's Syndrome Disease Activity Index; ESSPRI: Sjögren's Syndrome Patient Reported Index; EULAR: European League Against Rheumatism; PROFAD-SSI-SF: Profile of Fatigue and Discomfort-Sicca Symptoms Inventory Short Form; SSDAI: Sjögren's Syndrome Disease Activity Index; SSDDI: Sjögren's Syndrome Disease Damage Index; SSDI: Sjögren's Syndrome Damage Index; SSp: síndrome de Sjögren primario.
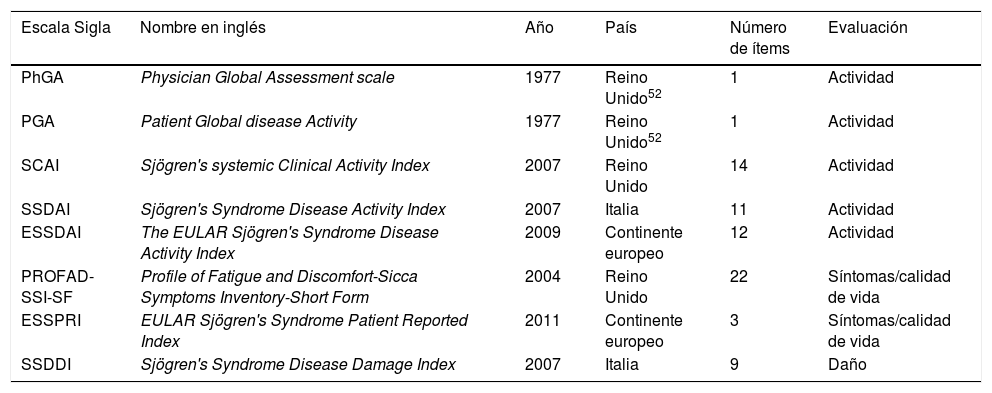
Herramientas clinimétricas en SSp
| Escala Sigla | Nombre en inglés | Año | País | Número de ítems | Evaluación |
|---|---|---|---|---|---|
| PhGA | Physician Global Assessment scale | 1977 | Reino Unido52 | 1 | Actividad |
| PGA | Patient Global disease Activity | 1977 | Reino Unido52 | 1 | Actividad |
| SCAI | Sjögren's systemic Clinical Activity Index | 2007 | Reino Unido | 14 | Actividad |
| SSDAI | Sjögren's Syndrome Disease Activity Index | 2007 | Italia | 11 | Actividad |
| ESSDAI | The EULAR Sjögren's Syndrome Disease Activity Index | 2009 | Continente europeo | 12 | Actividad |
| PROFAD-SSI-SF | Profile of Fatigue and Discomfort-Sicca Symptoms Inventory-Short Form | 2004 | Reino Unido | 22 | Síntomas/calidad de vida |
| ESSPRI | EULAR Sjögren's Syndrome Patient Reported Index | 2011 | Continente europeo | 3 | Síntomas/calidad de vida |
| SSDDI | Sjögren's Syndrome Disease Damage Index | 2007 | Italia | 9 | Daño |
EULAR: European League Against Rheumatism; SSp: síndrome de Sjögren primario.
Durante varios años se ha trabajado en herramientas clinimétricas que permitan hacer una valoración global del paciente con SSp respecto a su patología y que al mismo tiempo sea válida, replicable y sencilla de realizar. Dentro de estas aproximaciones, los métodos clinimétricos para el SSp se han dividido en 2 grandes grupos: los que evalúan el componente clínico de la enfermedad como daño o actividad y los que evalúan la calidad de vida del paciente, lo cual implica el uso de al menos 2 cuestionarios para la evaluación integral del paciente en los controles médicos y en los estudios de investigación.
Sin embargo, en la práctica clínica una de las grandes limitaciones para el uso regular de estas escalas es el tiempo que toma el diligenciamiento, como en el caso del SCAI19,20, por lo que muchas de ellas se han utilizado solamente en el contexto de la investigación.
Desde el punto de vista práctico, el principal interés del clínico durante el seguimiento de pacientes con SSp debe ser la evaluación objetiva de la actividad de la enfermedad. Para esto, el ESSDAI se comporta como una herramienta rigurosa, que abarca las manifestaciones de la enfermedad de forma sistémica y detallada al subdividir cada dominio evaluado en diferentes grados de actividad, lo cual hace que el resultado para cada individuo sea un reflejo real del comportamiento de la enfermedad en el momento de la valoración28. Si bien es confiable, es extensa y la calificación de cada ítem está sujeta a una serie de condiciones que deben tenerse en cuenta22, con el fin de facilitar su aplicación en la clínica y sin necesidad de resultados de laboratorio, se realizó la modificación ClinESSDAI, la cual permite obtener interpretaciones similares al ESSDAI con relación a la actividad de la enfermedad31. La importancia del ESSDAI en la práctica clínica ha llevado a que, en los estudios de investigación destinados a encontrar tratamientos efectivos para el SSp, se incluyan solamente pacientes con ESSDAI superiores a 5 e inferiores a 14, indicando una enfermedad activa32.
Por otro lado, es común en la práctica clínica que exista discordancia entre los hallazgos objetivos, dados por el compromiso de órganos o hallazgos inmunológicos (consumo de complemento, linfopenia, entre otros) y los síntomas expresados por el paciente, donde la fatiga puede ser una de las principales quejas. Dado este aspecto, es fundamental que al mismo tiempo se evalúe el impacto de la enfermedad sobre la calidad de vida del paciente, siendo el ESSPRI un cuestionario de fácil aplicación en la consulta y que facilita un enfoque específico sobre aspectos del SSp (fatiga, sequedad y dolor)48, a diferencia de otros como el PROFAD, en el que hay interrogantes que podrían ser atribuidos a otras causas diferentes a este síndrome18.
En este aspecto, en caso de realizar la valoración objetiva, el ESSDAI es una escala de gran utilidad; mientras que desde el punto de vista subjetivo, el ESSPRI, autoaplicado por el paciente, es una herramienta de gran utilidad por su fácil realización e información de interés sobre los aspectos a mejorar con las intervenciones médicas.
ConclusiónEs importante conocer la utilidad de estas herramientas y la necesidad de reducir las limitaciones de cada una, ya que su aplicación facilita y garantiza el estudio integral de los pacientes con SSp.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.