Determinar el riesgo cardiovascular y la prevalencia de factores de riesgo cardiovascular (RCV) en los pacientes con artritis reumatoide.
Materiales y métodosEstudio observacional, descriptivo y transversal, realizado en el Hospital General de Ciudad Real, entre junio de 2013 y mayo de 2014. Se realizó una analítica completa, se elaboró un perfil clínico, se calculó el SCOREm y se estratificó el RCV. Finalmente, se determinó la presencia de aterosclerosis subclínica mediante la realización de una ecografía carotídea.
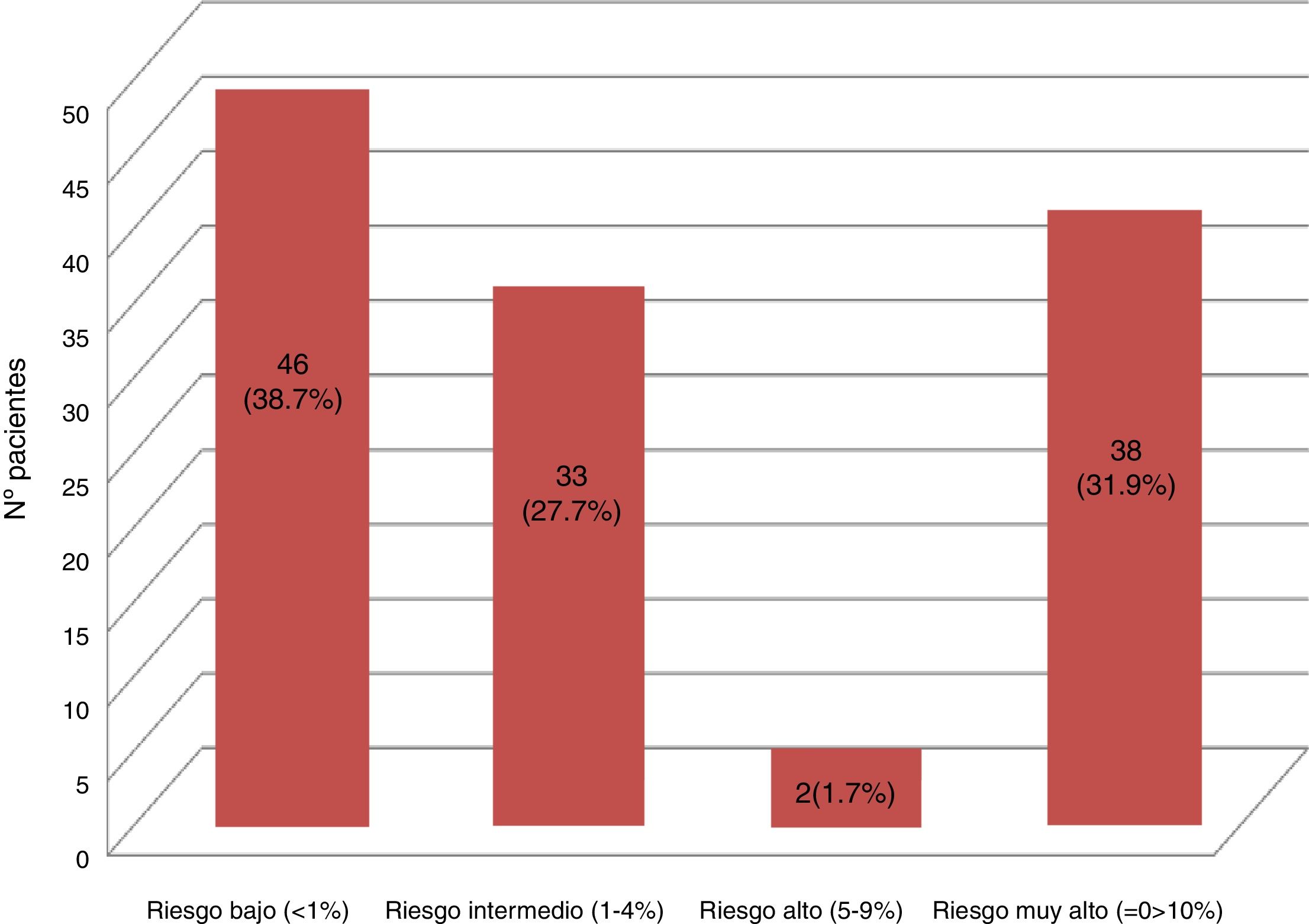
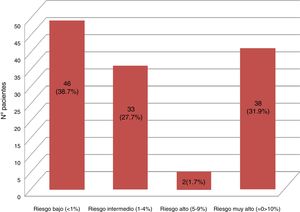
Resultados119 pacientes aceptaron participar en el estudio. Hubo una prevalencia del 73,1% de los factores de riesgo tradicionales, 6,72% había presentado un evento cardiovascular al momento del estudio, 22,68% poseía un infradiagnóstico de diabetes mellitus o nefropatía. La distribución final del RCV fue: riesgo bajo 46 (38,7%), riesgo intermedio 33 (27,7%), riesgo alto 2 (1,7%), riesgo muy alto 38 (31,9%).
ConclusionesExiste una alta prevalencia de factores de RCV y riesgo elevado infradiagnosticado en esta población. Por lo que si bien la artritis reumatoide se manifiesta de forma más aparente a nivel articular, ha de considerarse una enfermedad sistémica asociada a una mayor incidencia de eventos cardiovasculares.
To determine the cardiovascular risk and the prevalence of cardiovascular risk (CVR) factors in patients with rheumatoid arthritis.
Material and methodsObservational, descriptive and cross-sectional study performed in the General Hospital of Ciudad Real from June 2013 to May 2014. A complete laboratory analysis was performed, a clinical profile was prepared, the Systematic COronary Risk Evaluation (SCOREm) was calculated, and the CVR was stratified. Finally, the presence of sub-clinical atherosclerosis was determined by performing a carotid ultrasound.
Results119 patients accepted to participate in the study. There was a prevalence of 73.1% of traditional risk factors; 6.72% having had a cardiovascular event at the time of the study, and 22.68% had an underdiagnosis of diabetes mellitus and/or nephropathy. The final distribution of the CVR was: Low risk 46 (38.7%), intermediate risk 33 (27.7%), high risk 2 (1.7%), very high risk 38 (31.9%).
ConclusionsThere is a high prevalence of CVR factors and an elevated risk of underdiagnosis in the rheumatoid arthritis population. Therefore, although rheumatoid arthritis manifests itself more in the joints, it should be considered a systemic disease associated with a higher incidence of cardiovascular events.
La artritis reumatoide (AR) es una enfermedad inflamatoria, sistémica, crónica, que afecta al 0,5-1% de la población. Ocasiona disminución de la esperanza de vida y presenta una mortalidad de 1,3 a 3 veces superior a la población general, destacando la mortalidad de origen cardiovascular (40-50%)1–3.
Numerosos estudios han puesto de manifiesto el incremento del riesgo de infarto agudo del miocardio (RR: 2,07-3,17) y accidente cerebrovascular (RR: 1,48) en los pacientes con AR4,5, comparable con la descrita en la diabetes mellitus tipo 2 (OR: 2,7-3,11)6,7.
Sin bien los clásicos factores de riesgo cardiovascular (RCV) son importantes en la patogénesis de la aterosclerosis en esta población, estos podrían estar infradiagnosticados e incluso no explicar del todo este incremento de los eventos cardiovasculares8–10. Describiéndose como factores de riesgo no tradicionales el tiempo de evolución, la presencia de serología positiva (factor reumatoide, anti-CCP), factores genéticos como la presencia de alelos HLA-DRB1*0401 y HLA-DRB1*0404, marcadores de inflamación crónica (PCR, VSG, amiloide sérico, etc.), estado de actividad de la enfermedad (DAS28, SDAI, etc.), manifestaciones extraarticulares, el tratamiento crónico con AINE y corticoides, etc. Por todo ello, muchos plantean considerar la enfermedad cardiovascular como una manifestación extraarticular de la AR11–15.
Debido a ello, la «European League Against Rheumatism» (EULAR), propuso por consenso para la valoración del RCV (bajo <1%, moderado 1-4%, alto 5-9% y muy alto ≥10%) el uso del SCORE modificado (SCOREm), que consiste en multiplicar por un factor de conversión de 1,5 al resultado obtenido con el SCORE a los pacientes que reúnan 2 de los siguientes 3 criterios: duración de la enfermedad mayor o igual a 10 años, factor reumatoide (FR) o antipéptido cíclico citrulinado positivo (anti-CCP) y la presencia de manifestaciones extraarticulares16. Sin embargo, se ha observado cómo esta herramienta y los factores tomados en cuenta, subestiman dicho riesgo. Objetivándose hasta un 12-30% de aterosclerosis subclínica por ecografía carotídea y el desarrollo de eventos cardiovasculares a corto-mediano plazo en los pacientes clasificados de riesgo bajo/intermedio17–22.
Objetivo. Determinar el riesgo cardiovascular y la prevalencia de factores de riesgo cardiovascular en los pacientes con AR.
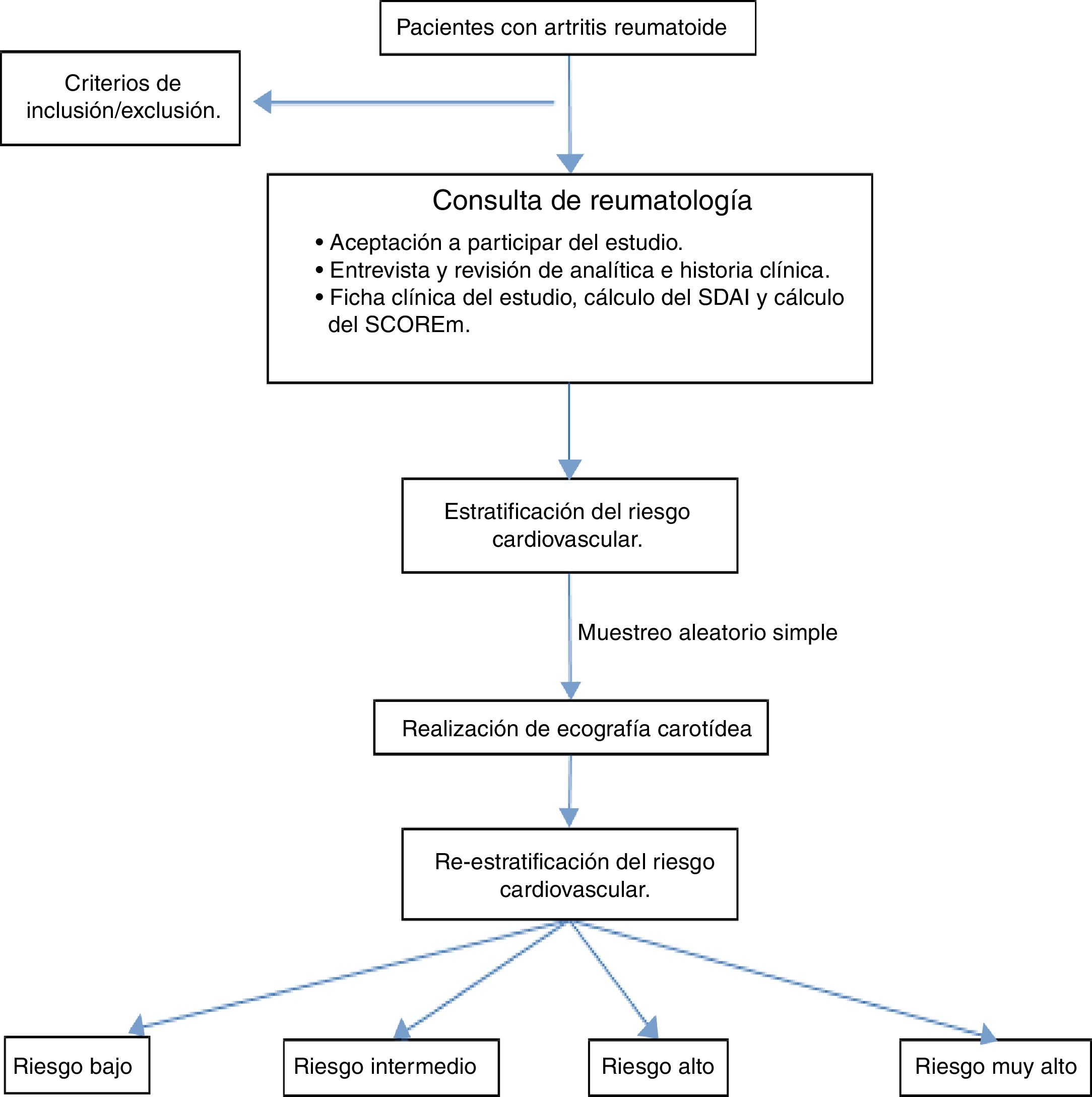
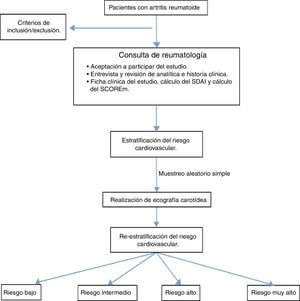
Materiales y métodosSe desarrolló un estudio observacional, descriptivo y transversal en los pacientes mayores de 18 años que cumplieron los criterios internacionales validados por el ACR/EULAR 201023 que se atendieron en la consulta del Hospital General Universitario de Ciudad Real (HGUCR) durante junio de 2013 a mayo de 2014 y que aceptaron participar del estudio mediante la firma del consentimiento informado. Se excluyeron los síndromes de superposición y aquellos que no pudieron realizar la analítica para el cálculo del SCORE (fig. 1). Dada la baja población se realizó el estudio en todos los pacientes que aceptaron participar en el mismo. La información se obtuvo mediante entrevista clínica en la consulta, la historia clínica y una analítica reciente que incluía los marcadores serológicos y de actividad (velocidad de sedimentación globular, proteína C reactiva, factor reumatoide y antipéptido citrulinado) así como un estudio metabólico para la valoración del RCV (glucemia basal, hemoglobina glicada, uricemia, perfil renal, lipídico y tiroideo). Con los resultados se elaboró un perfil clínico, se calculó el SCOREm (edad, sexo, tensión arterial, niveles de colesterol total/HDL, hábito tabáquico y factores de RCV de la AR) y se estratificó el RCV.
A todos los pacientes se les dieron recomendaciones generales de los estilos de vida saludables y a los de riesgo alto/muy alto se les inició tratamiento según su perfil de RCV y seguimiento posterior por su médico de Atención Primaria.
Finalmente, se realizó un muestreo aleatorio simple (nivel de confianza 95,5% y error muestral 5%) para la realización de una ecografía carotídea a cargo de un médico radiólogo que desconoció en todo momento el perfil clínico del paciente. Se empleó un ecógrafo marca Toshiba Aplio XG, modelo Ssa – 790A, transductor lineal de 7 – 10MHz), haciendo hincapié en la medición del grosor íntima – media (GIM), considerándose patológico si GIM > 0,9mm y mediante la presencia de placa ateromatosa, engrosamiento focal > 1,5mm, según protocolo habitual24–27.
La información obtenida se ingresó a una base de datos de Microsoft Excel, se describieron las variables evaluadas usando medidas de frecuencia y medidas de tendencia central/dispersión. Todos los análisis se realizaron con un nivel de confianza del 95% usando STATA 12,0. El protocolo del estudio fue aprobado por el comité ético de investigación clínica del HGUCR.
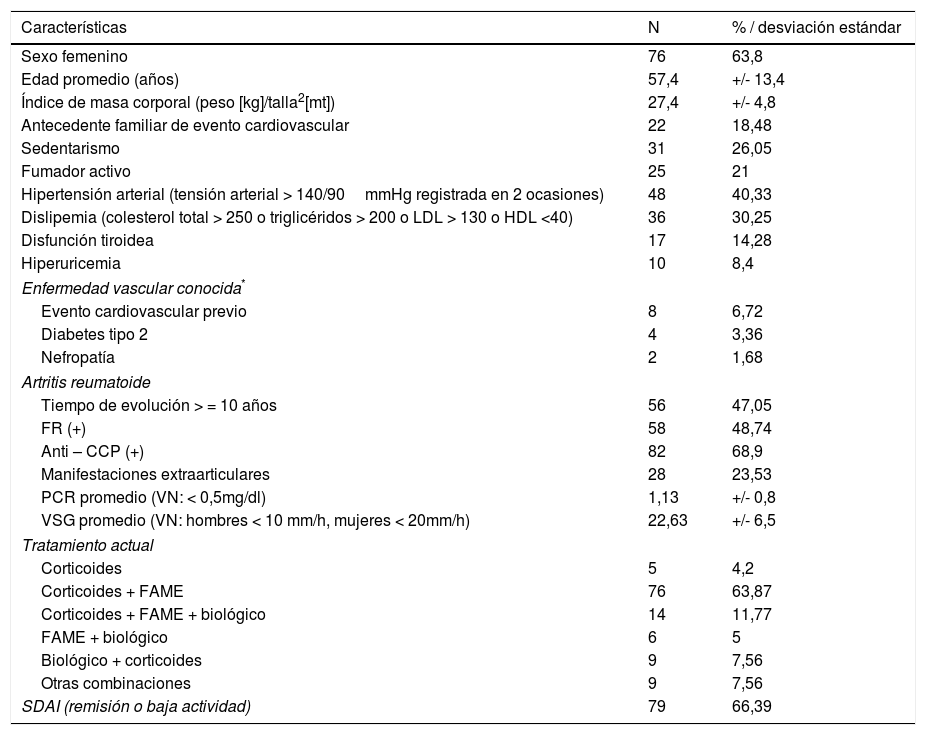
ResultadosDurante el periodo de estudio aceptaron participar un total de 119 pacientes con AR (63,87% femenino, 36,13% masculino) (tabla 1).
Perfil clínico de los 119 pacientes con artritis reumatoide del HGUCR
| Características | N | % / desviación estándar |
|---|---|---|
| Sexo femenino | 76 | 63,8 |
| Edad promedio (años) | 57,4 | +/- 13,4 |
| Índice de masa corporal (peso [kg]/talla2[mt]) | 27,4 | +/- 4,8 |
| Antecedente familiar de evento cardiovascular | 22 | 18,48 |
| Sedentarismo | 31 | 26,05 |
| Fumador activo | 25 | 21 |
| Hipertensión arterial (tensión arterial > 140/90mmHg registrada en 2 ocasiones) | 48 | 40,33 |
| Dislipemia (colesterol total > 250 o triglicéridos > 200 o LDL > 130 o HDL <40) | 36 | 30,25 |
| Disfunción tiroidea | 17 | 14,28 |
| Hiperuricemia | 10 | 8,4 |
| Enfermedad vascular conocida* | ||
| Evento cardiovascular previo | 8 | 6,72 |
| Diabetes tipo 2 | 4 | 3,36 |
| Nefropatía | 2 | 1,68 |
| Artritis reumatoide | ||
| Tiempo de evolución > = 10 años | 56 | 47,05 |
| FR (+) | 58 | 48,74 |
| Anti – CCP (+) | 82 | 68,9 |
| Manifestaciones extraarticulares | 28 | 23,53 |
| PCR promedio (VN: < 0,5mg/dl) | 1,13 | +/- 0,8 |
| VSG promedio (VN: hombres < 10 mm/h, mujeres < 20mm/h) | 22,63 | +/- 6,5 |
| Tratamiento actual | ||
| Corticoides | 5 | 4,2 |
| Corticoides + FAME | 76 | 63,87 |
| Corticoides + FAME + biológico | 14 | 11,77 |
| FAME + biológico | 6 | 5 |
| Biológico + corticoides | 9 | 7,56 |
| Otras combinaciones | 9 | 7,56 |
| SDAI (remisión o baja actividad) | 79 | 66,39 |
Anti – CCP: antipéptido cíclico citrulinado; FAME: fármaco antirreumático modificador de la enfermedad; FR: factor reumatoide; kg: kilogramos; mt: metros; PCR: proteína C reactiva; SDAI: Simplified disease activity index; VN:valor normal; VSG: velocidad de sedimentación globular.
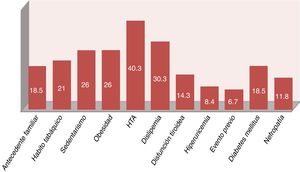
En la población estudiada destacó una prevalencia elevada del 84,87% para la presencia de algún factor de RCV y del 73,1% para los factores clásicos (algunos pacientes presentaron más de un factor). Asimismo, un 6,72% había presentado un evento cardiovascular al momento del estudio.
En cuanto a la AR se observó una prevalencia del 79,83% de marcadores serológicos positivos (FR y/o anti-CCP), así como un tiempo de evolución mayor a 10 años en casi el 50% de nuestra población. Asimismo, un 66% se encontraba con un control adecuado de la enfermedad, tanto de forma global mediante el SDAI así como por la presencia de marcadores biológicos de actividad inflamatoria. El tratamiento más frecuente fue el uso de corticoterapia a dosis 5-10mg/día de prednisona o equivalentes y fármacos modificadores de la enfermedad (FAME) (principalmente metotrexato).
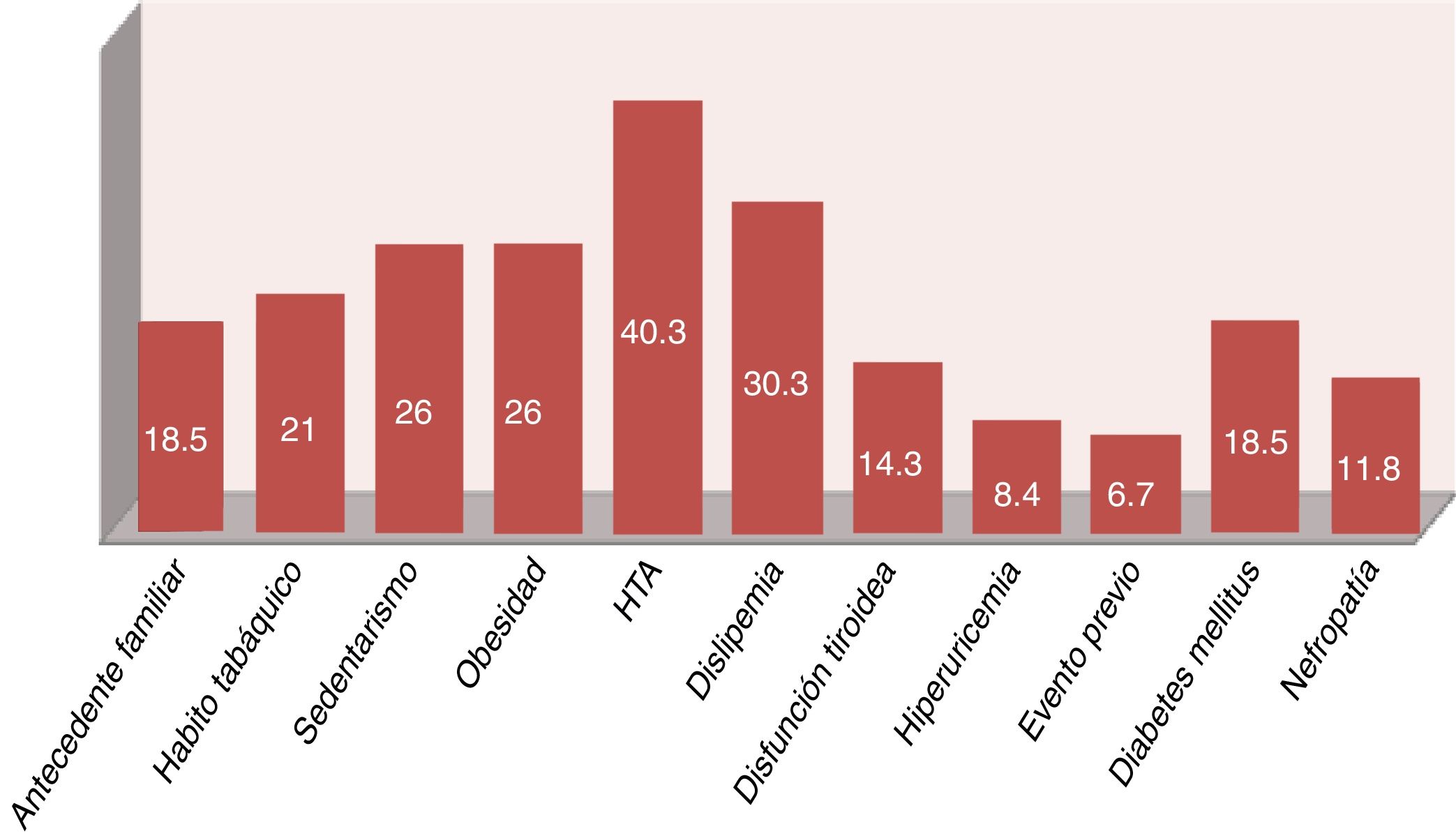
Los 11 pacientes con enfermedad vascular conocida (eventos previos, diabetes mellitus o nefropatías) fueron catalogados de muy alto RCV según lo indican las guías clínicas28. A los 108 pacientes restantes se les realizó el cálculo del SCOREm, estratificándose de la siguiente manera: 48 riesgo bajo, 54 riesgo intermedio, 6 riesgo alto y ninguno de muy alto riesgo. Sin embargo, con los resultados del estudio analítico específico (glucosa basal, perfil lipídico y tiroideo, creatinina, filtrado glomerular, hemoglobina glicada, ácido úrico, reactantes de fase aguda, FR, anti-CCP, etc.) se realizó el diagnóstico reciente en 27 pacientes de diabetes mellitus o nefropatía (18 hemoglobina glicada alterada y 12 filtrado glomerular < 60ml/min, 3 pacientes con ambos hallazgos), lo que elevó la prevalencia de factores de RCV (fig. 2). En la figura 3 se muestra la estratificación final del RCV en nuestra población estudiada.
Se realizó un muestro aleatorio simple de los 119 pacientes (nivel de confianza 95,5% y error muestral del 5%) para la realización de una ecografía carotídea (n= 92), por lo que finalmente se realizó una ecografía carotídea a un total de 98 pacientes. Se objetivó 31 (31,63%) pacientes con presencia de placa ateromatosa y 19 (19,39%) pacientes con un GIM ≥0,90, considerados ambos como datos de aterosclerosis subclínica. La distribución de los hallazgos ecográficos según la estratificación de riesgo por SCOREm se describe en la tabla 2.
Distribución de los hallazgos ecográficos según la estratificación por SCOREm
| Riesgo bajo (n=36) | Riesgo medio (n=29) | Riesgo alto (n=1) | Riesgo muy alto (n=32) | |
|---|---|---|---|---|
| Placa ateromatosa (31) | 11 (30,55%) | 5 (17,24%) | 0 (0%) | 15 (46,87%) |
| GIM >o= 0,9mm (n=19) | 3 (8,33%) | 4 (13,79%) | 0 (0%) | 12 (37,5%) |
GIM: grosor íntima-media.
En nuestro estudio se observó una prevalencia del 84,87% para los factores de RCV (73,1% factores clásicos) y un 6,72% de eventos previos (infarto cardiaco, arteriopatía periférica, etc.) en la población estudiada. Siendo el resultado final para la estratificación un 33,6% de riesgo alto y muy alto. Esta alta prevalencia de factores y RCV se ha descrito en otros estudios realizados sobre la población con AR8–11,15. Incluso se ha llegado a comparar con la descrita en pacientes con diabetes mellitus tipo 26,7. Por todo ello, cada vez es más importante la implicación del médico reumatólogo en el reconocimiento de este importante compromiso y realizar su valoración. Esto obliga a tomar un papel activo y ser el punto de partida y piedra angular en la prevención cardiovascular de esta población. A pesar ello, se observa que en la práctica clínica actual, no se realiza o se infraestima la valoración y estimación del RCV de los pacientes con AR29,30. En algunos países se han creado unidades de cooperación entre Reumatología y Cardiología como la Clínica preventiva Cardio-Reuma del Departamento de Reumatología del Hospital Diakonhjemmet (Noruega) y la Clínica Cardio-reuma de la división de enfermedades cardiovasculares de la Clínica Mayo (Estados Unidos de Norteamérica)31,32 que proporcionan un abordaje integral del paciente con AR. Asimismo, se han planteado estrategias con buenos resultados, como la de incorporar la participación de otros tipos de personal sanitario para la realización de la estimación del RCV mediante tablas y programas predeterminados y de esta forma optimizar la consulta reumatológica33,34.
A pesar de que EULAR recomienda una valoración del RCV anual en los pacientes con AR, se observa que esto no se realiza de forma adecuada, siendo más cercana al de la población sin AR y hasta 12 veces menos frecuente de la que se realiza en los pacientes con diabetes mellitus35. Infraestimándose la determinación de la glucosa basal en 27% y el perfil lipídico en 14%, lo cual puede ser determinante hasta en el 30% de la población por un diagnóstico no conocido o infratratado36,37. En nuestra serie el 22,68% poseía un infradiagnóstico de diabetes mellitus o nefropatía.
Recientemente, un panel de expertos ha propuesto una serie de modificaciones y nuevas recomendaciones con base en las recomendaciones EULAR 2010 para el abordaje y manejo del RCV en los pacientes con AR, destacando las siguientes38:
- •
Se debe realizar la valoración cardiovascular anual a todos los pacientes con AR sin evidencia de ECV conocida, fundamentalmente a: seropositivos, FR (+) o anti-CCP (+), manifestaciones extraarticulares, síndrome metabólico o tiempo de evolución > 10 años.
- •
Realizar, según la experiencia y equipamiento de cada centro, una valoración complementaria mediante ecografía carotídea o índice tobillo/brazo a los pacientes de riesgo bajo/intermedio (SCOREm 0 – 4%).
- •
Mantener estilos saludables de vida. Tratamiento con estatinas para la prevención primaria de eventos cardiovasculares y mantener unos niveles adecuados de LDL en los pacientes de alto riesgo (muy alto riesgo (SCOREm >10%): LDL < 70mg/dl, alto riesgo (SCOREm 5 – 9%): LDL <100mg/dl).
- •
El control de la actividad de la enfermedad y la carga inflamatoria con los FAME están directamente relacionados con una disminución del RCV.
- •
Uso de AINE el menor tiempo posible y de corticoides las dosis más bajas posibles.
Durante los últimos años, se han empleado, modificado y desarrollado distintos algoritmos para una adecuada estratificación del RCV en la población con AR (Framingham, PROCAM, SCORE, Reynolds, QRISK 2)22. Incorporando desde marcadores bioquímicos de inflamación como características clínicas y serológicas propias de la enfermedad (Reynolds, QRISK 2 y SCOREm), sin embargo se ha observado que ninguno de ellos clasifica a los pacientes adecuadamente en grupos de riesgos, presentando una sensibilidad y especificidad más baja de la esperada (68 – 87% y 55 – 76%, respectivamente)22,39, lo que ocasiona que hasta un 32% de los eventos CV puedan ocurrir en la población clasificada de bajo riesgo según estas herramientas40–42. En nuestro estudio observamos la presencia de placas ateromatosas en un 30% de la población catalogada de bajo riesgo según el SCOREm. Lo que determina que un porcentaje no despreciable de pacientes clasificados de bajo riesgo por SCOREm presenten aterosclerosis subclínica. Todo ello expresa una limitación en la capacidad que tienen estos algoritmos de clasificación para detectar los que no tienen la condición buscada (verdaderos negativos). Por lo que, como en el estudio de González-Gay et al.43, se recomienda la utilización de la ecografía carotídea en aquellos pacientes de riesgo bajo/intermedio para su reclasificación.
Por todo ello se puede concluir que existe una prevalencia elevada de factores de RCV clásicos en la población con AR y un 30% de los pacientes catalogados de bajo riesgo por SCOREm presentan datos de aterosclerosis subclínica por ecografía carotídea. Es por ello que recomendamos una mayor participación del médico reumatólogo en el reconocimiento de esta importante y potencialmente mortal afectación para su correcta valoración, estratificación, tratamiento y seguimiento. Así como la realización de la ecografía carotídea en los pacientes con AR que inicialmente no son clasificados como de alto/muy alto riesgo según las tablas de estratificación disponibles. Esto nos permitiría reclasificar a los pacientes y cambiar nuestra actitud clínica, terapéutica y de seguimiento.
Finalmente, si bien la AR se manifiesta de forma más aparente a nivel articular, ha de considerarse una enfermedad sistémica asociada a una mayor incidencia de eventos cardiovasculares.
La principal limitación del estudio es el tamaño muestral. No obstante, el efecto de la baja potencia no ha sido definitivo puesto que hemos obtenido resultados relevantes que refuerzan lo observado en otros estudios de similares características y metodología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosNuestro agradecimiento al apoyo desinteresado de los servicios de Reumatología, Radiodiagnóstico y Análisis clínico del Hospital Universitario de Ciudad Real.