El diagnóstico de lupus eritematoso sistémico neuropsiquiátrico (LES-NP) se basa en las características clínicas, utilizando la nomenclatura y descripción de caso del Colegio Americano de Reumatología 1999; sin embargo, la falta de especificidad de estos síndromes hacen difícil el diagnóstico.
ObjetivoIdentificar moléculas en perfiles proteicos del líquido cefalorraquídeo de pacientes con LES-NP, con expresión diferencial, que podrían utilizarse como biomarcadores para el diagnóstico.
MetodologíaSe utilizaron 26 muestras de líquido cefalorraquídeo de 5 grupos, LES-NP y 4 grupos controles. Las herramientas utilizadas para la ejecución de este trabajo incluyeron electroforesis bidimensional para la obtención de perfiles proteicos, uso del software Image Master Platinum 2D para las comparaciones y el software Graphpad Prism versión 6.0 para el análisis estadístico.
ResultadosAnálisis comparativos y estadísticos revelaron 3 spots con expresión diferencial, al comparar pacientes LES-NP con los otros grupos de estudio.
DiscusiónLas técnicas utilizadas para la ejecución de este trabajo de investigación permitieron la identificación de un blanco de estudio para la búsqueda de biomarcadores en LES-NP, los cuales podrían ser utilizados como ayuda diagnóstica/pronóstica de la enfermedad.
The diagnosis of neuropsychiatric lupus (NP-SLE) is based on clinical features using the nomenclature and description of case of the American College of Rheumatology, 1999. However, the lack of specificity of these syndromes makes the diagnosis difficult.
ObjectiveTo identify molecules in CSF protein profiles of NP-SLE patients with differential expression, which could be used as biomarkers for diagnosis.
MethodologyA total of 26 CSF samples from five groups, one NP-SLE and four control groups were used. The tools used for the execution of this work included two-dimensional electrophoresis to obtain protein profiles, ImageMaster 2D Platinum software for comparative analysis, and statistical analysis using Graphpad Prism Version 6.0.
ResultsStatistical analysis and comparison revealed three spots with differential expression when comparing SLE patients with NP-other study groups.
DiscussionThe techniques used for the implementation of this proposed research allowed the identification of a line of study for finding biomarkers in neuropsychiatric lupus, which could be used as a diagnostic / prognostic disease support.
El lupus eritematoso sistémico (LES) es una enfermedad que puede afectar a todos los órganos, causando así, alteraciones cutáneas, musculoesqueléticas, cardiopulmonares, renales y neuropsiquiátricas (LES-NP), entre otras1. Estas últimas han sido ampliamente relacionadas con la morbilidad y la mortalidad y, por ende, dan cuenta de un pronóstico pobre1.
Para el diagnóstico y clasificación del LES-NP se utiliza la nomenclatura y descripción de caso dados por el Colegio Americano de Reumatología (ACR, en inglés American College of Rheumatology) en 19992; sin embargo, el diagnóstico de esta patología es difícil y ocasionalmente no se realiza de la manera correcta, esto debido a que el LES-NP presenta una etiopatogenia compleja, gran heterogeneidad de presentaciones clínicas, un curso impredecible y, por si fuera poco, las pruebas imaginológicas y de laboratorio realizadas no son contundentes. Finalmente, el diagnóstico dependerá del juicio clínico y de la exclusión de otras causas que puedan explicar los síntomas neurológicos como infección3, hipertensión arterial grave, alteraciones metabólicas o el tratamiento con esteroides, las cuales son capaces de causar las mismas manifestaciones NP, y no es raro que coexistan en pacientes con LES, lo que dificulta aún más el diagnóstico4.
Adicionalmente, en diversos estudios, se ha reportado cómo las manifestaciones NP son una de las principales causas de daño irreversible en este grupo de pacientes5–9. Por todas estas razones, nos planteamos como objetivo general del trabajo buscar biomarcadores proteicos que permitan hacer el diagnóstico más preciso de pacientes con LES-NP10.
Para la búsqueda de posibles biomarcadores, se ha hecho uso de áreas en el estudio de las “ómicas” como la genómica, transcriptómica, metabolómica y proteómica, entre otras. La proteómica ha sido un campo ampliamente investigado en las dos décadas pasadas y se define como el área encargada del estudio del conjunto de proteínas expresadas en un sistema, conocido como proteoma. Dicho proteoma puede ser detectado a partir de diferentes muestras biológicas (tejidos y fluidos corporales).
Para el estudio del proteoma presente en muestras biológicas de alta complejidad han sido implementadas diferentes técnicas, entre ellas, la electroforesis bidimensional (2D), la cual corresponde a una estrategia de separación de proteínas de alta resolución que se realiza en dos pasos; la primera dimensión, conocida como isoelectroenfoque, cuyo principio es la separación por punto isoeléctrico (PI) de dichas moléculas, y una segunda dimensión basada en la separación por peso molecular (MW) de las proteínas que se han de separar.
En LES-NP, el líquido cefalorraquídeo (LCR) es una buena fuente para el estudio de biomarcadores proteicos dado que este se encuentra directamente en contacto con parte del sistema nervioso central (SNC), y permite un intercambio de sustancias, ya que es donde se absorben compuestos bioquímicos útiles o se eliminan de manera selectiva los diferentes compuestos tóxicos para el SNC; además, dicho líquido facilita la regulación del SNC a través de la circulación de neuropéptidos y hormonas, por lo tanto, este fluido corporal refleja el estado bioquímico del sistema tanto en condiciones fisiológicas normales como patológicas. Por ello, puede ser considerado como una excelente fuente para la identificación de biomarcadores de enfermedades con manifestaciones neurológicas11.
Hasta la fecha, han sido reportadas diferentes proteínas presentes en el LCR cuya expresión puede ser usada como marcador biológico de la entidad, entre ellas autoanticuerpos antineuronales12–18 y proteínas como ubiquitina e interleuquinas19–23.
En el presente estudio se detectaron moléculas proteicas con expresión diferencial en muestras de LCR de pacientes con LES-NP; esto fue realizado mediante la evaluación del proteoma del LCR de pacientes con dicha enfermedad, otras condiciones clínicas e individuos controles (IC), aprovechando la técnica de electroforesis bidimensional. Al realizar el análisis comparativo de los perfiles proteicos del LCR de pacientes con LES-NP y los otros grupos de estudio, se encontró la presencia de diferentes spots con expresión diferencial en las muestras de LCR de los pacientes, cuya futura identificación permitirá correlacionar las moléculas relacionadas con la fisiopatología de la enfermedad, estableciendo con ello su posible utilidad como marcador biológico para LES-NP.
MetodologíaPacientesSiendo este un estudio de tipo observacional, el tamaño de la muestra se determinó por conveniencia. Los pacientes fueron captados tanto de la consulta externa como del Servicio de Hospitalización del Hospital Universitario San Vicente Fundación y de la IPS Universitaria, Clínica León XIII; y cumplieron con los criterios de clasificación para LES del ACR24. El consentimiento informado fue obtenido de todos aquellos que voluntariamente desearon participar en el estudio, y en el caso de los pacientes con manifestaciones NP (lúpicas o por otras causas), el consentimiento informado fue firmado por un familiar o un acompañante cuando aquellos no estuvieron en capacidad de hacerlo. Este estudio fue aprobado por el Comité de Bioética de ambas instituciones.
Los grupos de estudio fueron conformados por mujeres adultas, no embarazadas: 5 con LES-NP, 6 con LES sin manifestaciones NP (cumpliendo los criterios de clasificación del ACR), 6 pacientes con manifestaciones NP no lúpicas (NPnoLES), 5 con otras enfermedades autoinmunes (OEA) y 4 IC.
Todos los pacientes del estudio tenían en su historia clínica los resultados de los exámenes de laboratorio básicos que caracterizaron mejor su estado clínico, el grado de actividad de la enfermedad, y corroboraron los criterios de clasificación del ACR para LES y LES-NP.
Criterios de inclusión de manifestaciones neuropsiquiátricas no lúpicas1. Diagnóstico de LES, cumpliendo 4 o más criterios de clasificación del ACR24,25. 2. Presencia de alguna de las manifestaciones NP definidas por la nomenclatura de LES-NP del ACR en 19996. 3. Edad ≥ 18 años. 4. Consentimiento informado firmado por un familiar o acompañante y 2 testigos.
Criterios de inclusión de lupus eritematoso sistémico1. Diagnóstico de LES, cumpliendo 4 o más criterios de clasificación del ACR24,25. 2. Ausencia de manifestaciones NP. 3. Edad ≥ 18 años. 4. Consentimiento informado firmado por el paciente y 2 testigos.
Criterios de inclusión de pacientes con manifestaciones neuropsiquiátricas no lúpicas1. Según criterios de la cuarta edición del Manual de Diagnóstico y Estadístico de Trastornos Mentales. Texto revisado (DSM-IV-TR), y enfermedades neurológicas no autoinmunes confirmadas por un especialista en psiquiatría o neurología. 2. Exclusión de causas secundarias de las manifestaciones NP: infecciosas, tóxicas, metabólicas, tumorales traumáticas y lúpicas. 3. Edad ≥ 18 años. 4. Consentimiento informado firmado por un familiar o acompañante y 2 testigos.
Criterios de inclusión de pacientes con otras enfermedades autoinmunes1. Diagnóstico de otras enfermedades autoinmunes. 2. Edad ≥ 18 años. 3. Consentimiento informado firmado por el paciente y 2 testigos. 4. Ausencia de antecedentes de cualquier trastorno psicótico o neurológico según DSM-IV-TR.
Criterios de inclusión de individuos control1. Exclusión del diagnóstico de LES y de otras enfermedades autoinmunes. 2. Ausencia de antecedentes de cualquier trastorno psicótico o neurológico según DSM-IV-TR. 3. Edad ≥ 18 años. 4. Consentimiento informado firmado por el individuo y 2 testigos.
Laboratorios básicos y medicionesLos datos disponibles fueron tomados de la historia clínica de consulta externa o de hospitalización, lo más cercanamente posible a la fecha de la recolección de la muestra del LCR (aproximadamente 15 días). Se incluyeron los estudios hematológicos, serológicos, inmunológicos, bioquímicos y de LCR. Adicionalmente, se recopilaron los nombres de los medicamentos (específicamente inmunosupresores) que habían recibido los pacientes desde su diagnóstico, lo que se le llama en la descripción demográfica “tratamiento acumulativo”.
Como índice de actividad para LES se utilizó el SLEDAI (Systemic Lupus Erythematosus Disease Activity Index)26.
Se registraron los medicamentos utilizados (corticosteroides, cloroquina, hidroxicloroquina, azatioprina, metotrexato, antiinflamatorios no esteroideos, ciclofosfamida, biológicos, antipsicóticos, antidepresivos, otros), el tiempo de evolución del lupus y la aparición de las manifestaciones NP. De manera análoga, se hizo para los pacientes con manifestaciones NP por otras causas.
Obtención del líquido cefalorraquídeoCon el consentimiento informado diligenciado y firmado, como se describió anteriormente, el médico procedía a la toma de muestra para los análisis clínicos y entregaba una alícuota de 2ml para los estudios de proteómica. Los 2ml se dividían en alícuotas y se marcaban con el código correspondiente a cada paciente. Las alícuotas se guardaban a –70°C hasta su uso. Cabe anotar que durante el procedimiento de toma de muestra y almacenamiento, la muestra de LCR se encontraba en condiciones de esterilidad.
Procesamiento del líquido cefalorraquídeoLa extracción de las proteínas presentes en la muestra de LCR se hizo mediante el método de precipitación con acetona; luego, la cuantificación de estas fue realizada utilizando la técnica del BCA (BCA-kit, BCA™ Protein Assay Kit, Thermo Scientific); posteriormente, se hicieron alícuotas de 20μg de proteína, y por último, se corroboró la eficiencia de estos procedimientos y la integridad de las proteínas por medio de electroforesis unidimensional en geles de poliacrilamida al 12% (1D, SDS-PAGE).
Electroforesis bidimensionalPara la primera dimensión (PI), se resuspendieron 20mg de proteínas en buffer de hidratación (7M/2M urea/tiourea, 4% CHAPS, 100mM DTT y 1% de anfolitos pH 4–7/3–10). Luego, se rehidrató la tirilla de gradientes de pH inmovilizados IPG (IPG, en inglés isoelectric point gel); tirillas de 7cm y rango pH 4–7, Invitrogen®). El corrido de la electroforesis de primera dimensión duró 1h, 40min, con aumento progresivo del voltaje, lo que permitió que se formara el gradiente de pH, de la siguiente manera: 200V-450V-600V-750V-950V durante 5min, 1.200V-1.400V-1.600V por 10min cada uno, y para finalizar, 2.000V durante 45min (ZOOM® IPG Runner™, Invitrogen®). Después de finalizar la primera dimensión, se retiró la tirilla de IPG del soporte y se equilibró con el tampón de corrido (buffer LDS-Invitrogen®) más DTT. Para la segunda dimensión (MW), la tirilla se colocó en el gel preformado (4–12% poliacrilamida Bis-Tris, NuPAGE-gel, Invitrogen®) y se corrió a 200 voltios (XCell SureLokc™, Invitrogen®) con buffer MES SDS 1X (Invitrogen®) por 45min.
Visualización de los spots en el gelPara la visualización de las proteínas en geles de poliacrilamida, se utilizó la técnica de tinción con plata. Específicamente para el revelado e identificación de proteínas en los geles 2D, se utilizó plata compatible con espectrometría de masas (SilverQuest™ Staining Kit, Invitrogen®, Carlsbad-Estados Unidos). El protocolo usado fue el recomendado por el fabricante.
Plan de análisisAnálisis de electroforesis bidimensional y selección de los spots de interésInicialmente, se hizo un análisis por simple observación directa de los geles teñidos. Luego, las imágenes de los geles fueron obtenidas con el Image Scanner A3 10000XL (Epson) y se analizaron por medio del software Image Master 2D Platinum 7.0 (GE Healthcare). Con posterioridad, se realizó la detección de los puntos con una prominencia (saliency) de 300, y como punto de referencia (landmark) se definió un spot presente en todos los geles. Se ubicaron tanto los marcadores de MW como los puntos extremos del isoelectroenfoque (pH 4–7). Se crearon 5 grupos (denominados clases para el software) con los 26 geles. De cada clase se seleccionó un gel referente con el cual se cotejaron los otros 4. Finalmente, con las clases definidas, se realizó el análisis interclases, obteniendo del software un listado de spots con su respectivo resultado estadístico (p, análisis de la varianza de una vía). Se seleccionaron aquellos puntos con p<0,05 y se revisaron uno por uno en la pantalla con el fin de seleccionar los que se consideraron que correspondían realmente a spots claramente definidos.
Análisis estadísticoSe definió un análisis de varianza no paramétrico; a los datos de intensidad de los spots seleccionados se les evaluó la normalidad por medio del test de Shapiro-Wilk. Teniendo en cuenta estos resultados se les aplicó la prueba no paramétrica de Kruskal-Wallis con valor p<0,05 para la significancia estadística, y se les realizó una corrección post hoc con la prueba de múltiples comparaciones de Dunn; con el software Graphpad Prism versión 6.0 (Graphpad Software, San Diego, California, EE.UU.).
ResultadosDescripción demográfica y clínica de individuos en el estudioLos individuos participantes en el estudio fueron captados en las dos instituciones anteriormente mencionadas. La condición clínica de los individuos, así como sus características demográficas están resumidas en la tabla 1. Es de resaltar que el 100% de los individuos de los grupos LES-NP y LES son de sexo femenino, y que el 60% de las pacientes con LES-NP presentan psicosis. Los esquemas de tratamiento entre los grupos de pacientes con LES-NP, LES y OEA fueron similares.
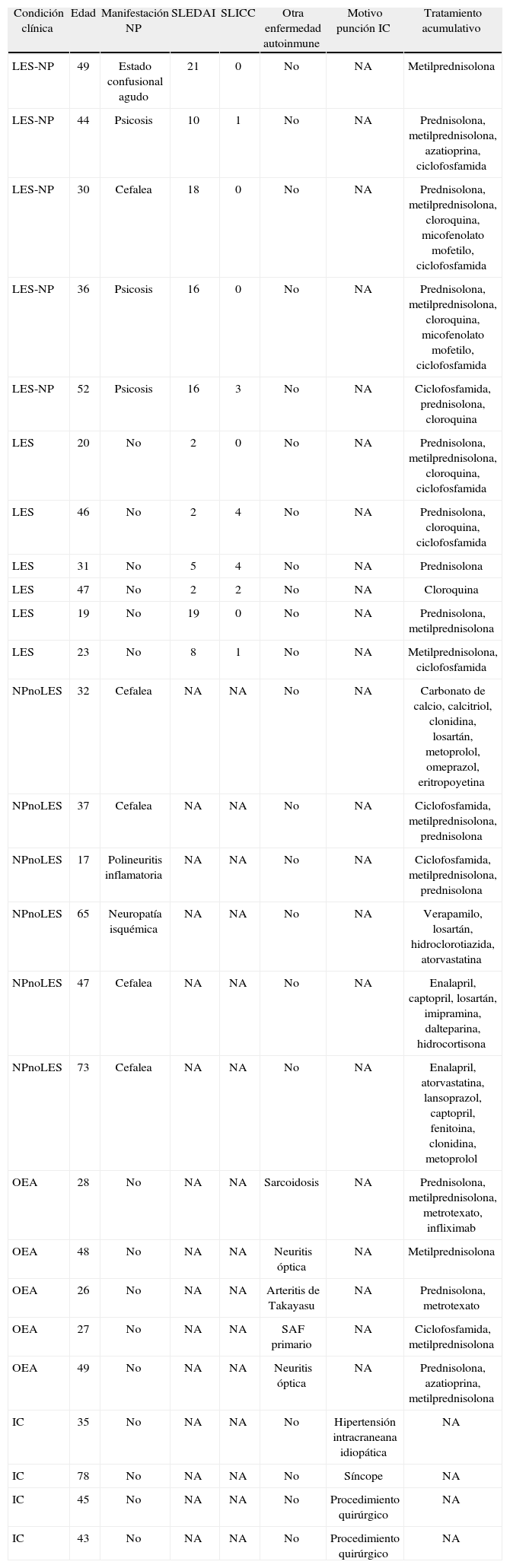
Características demográficas y clínicas de los individuos participantes en el estudio, se incluye: edad, manifestación neuropsiquiátrica, índice de actividad de la enfermedad, índice de daño, enfermedad autoinmune presente, motivo por el cual se le realiza la punción lumbar y tratamiento acumulativo según aplique.
| Condición clínica | Edad | Manifestación NP | SLEDAI | SLICC | Otra enfermedad autoinmune | Motivo punción IC | Tratamiento acumulativo |
| LES-NP | 49 | Estado confusional agudo | 21 | 0 | No | NA | Metilprednisolona |
| LES-NP | 44 | Psicosis | 10 | 1 | No | NA | Prednisolona, metilprednisolona, azatioprina, ciclofosfamida |
| LES-NP | 30 | Cefalea | 18 | 0 | No | NA | Prednisolona, metilprednisolona, cloroquina, micofenolato mofetilo, ciclofosfamida |
| LES-NP | 36 | Psicosis | 16 | 0 | No | NA | Prednisolona, metilprednisolona, cloroquina, micofenolato mofetilo, ciclofosfamida |
| LES-NP | 52 | Psicosis | 16 | 3 | No | NA | Ciclofosfamida, prednisolona, cloroquina |
| LES | 20 | No | 2 | 0 | No | NA | Prednisolona, metilprednisolona, cloroquina, ciclofosfamida |
| LES | 46 | No | 2 | 4 | No | NA | Prednisolona, cloroquina, ciclofosfamida |
| LES | 31 | No | 5 | 4 | No | NA | Prednisolona |
| LES | 47 | No | 2 | 2 | No | NA | Cloroquina |
| LES | 19 | No | 19 | 0 | No | NA | Prednisolona, metilprednisolona |
| LES | 23 | No | 8 | 1 | No | NA | Metilprednisolona, ciclofosfamida |
| NPnoLES | 32 | Cefalea | NA | NA | No | NA | Carbonato de calcio, calcitriol, clonidina, losartán, metoprolol, omeprazol, eritropoyetina |
| NPnoLES | 37 | Cefalea | NA | NA | No | NA | Ciclofosfamida, metilprednisolona, prednisolona |
| NPnoLES | 17 | Polineuritis inflamatoria | NA | NA | No | NA | Ciclofosfamida, metilprednisolona, prednisolona |
| NPnoLES | 65 | Neuropatía isquémica | NA | NA | No | NA | Verapamilo, losartán, hidroclorotiazida, atorvastatina |
| NPnoLES | 47 | Cefalea | NA | NA | No | NA | Enalapril, captopril, losartán, imipramina, dalteparina, hidrocortisona |
| NPnoLES | 73 | Cefalea | NA | NA | No | NA | Enalapril, atorvastatina, lansoprazol, captopril, fenitoina, clonidina, metoprolol |
| OEA | 28 | No | NA | NA | Sarcoidosis | NA | Prednisolona, metilprednisolona, metrotexato, infliximab |
| OEA | 48 | No | NA | NA | Neuritis óptica | NA | Metilprednisolona |
| OEA | 26 | No | NA | NA | Arteritis de Takayasu | NA | Prednisolona, metrotexato |
| OEA | 27 | No | NA | NA | SAF primario | NA | Ciclofosfamida, metilprednisolona |
| OEA | 49 | No | NA | NA | Neuritis óptica | NA | Prednisolona, azatioprina, metilprednisolona |
| IC | 35 | No | NA | NA | No | Hipertensión intracraneana idiopática | NA |
| IC | 78 | No | NA | NA | No | Síncope | NA |
| IC | 45 | No | NA | NA | No | Procedimiento quirúrgico | NA |
| IC | 43 | No | NA | NA | No | Procedimiento quirúrgico | NA |
IC: individuos controles: LES: lupus eritematoso sistémico; LES-NP: lupus eritematoso sistémico neuropsiquiátrico; NPnoLES: manifestaciones neuropsiquiátricas no lúpicas; OEA: otras enfermedades autoinmunes; SLEDAI: índice de actividad de la enfermedad; SLICC: índice de daño.
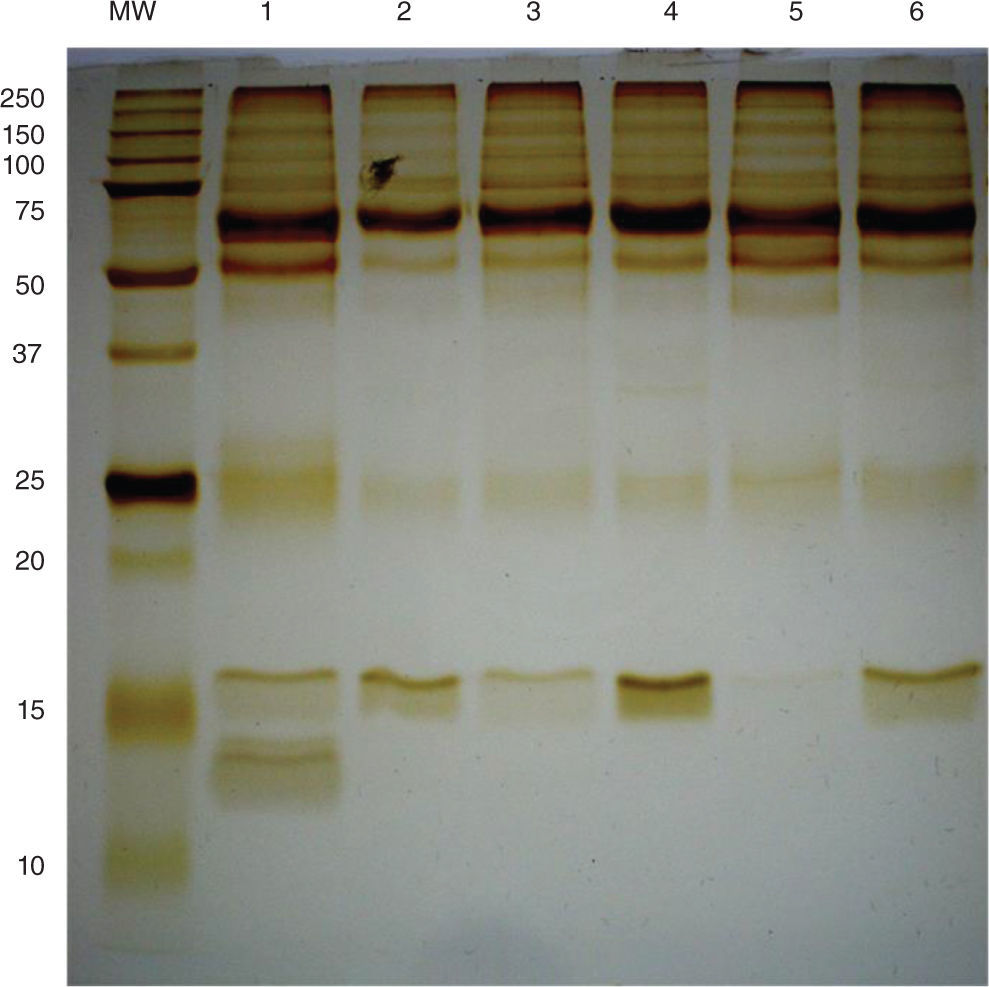
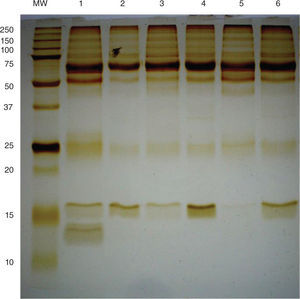
Los resultados de la cuantificación de proteínas extraídas de las muestras de LCR a través del método de ácido bicinconínico presentaron que la concentración de estas se encuentra entre 0,3-5,0μg/μl. La electroforesis 1-DE mostró bandas claramente definidas, indicando así que la manipulación de las muestras de LCR y la obtención de proteínas por dicho método no causó degradación de las moléculas (fig. 1).
Evaluación de integridad de proteínas extraídas: gel SDS PAGE al 12%. Peso molecular: marcador de peso molecular; carril 1: lupus eritematoso sistémico neuropsiquiátrico; carril 2–3: lupus eritematoso sistémico; carril 4: manifestaciones neuropsiquiátricas no lúpicas; carril 5: otras enfermedades autoinmunes, y carril 6: individuos controles. Las proteínas se visualizaron mediante tinción de plata, tiempo de revelado de 2 minutos.
Los perfiles proteicos en las 2D mostraron buena resolución y reproducibilidad intraexperimental. Se muestra un gel representativo de los diferentes grupos de estudio; cada gel muestra el perfil proteico del LCR de un individuo, separado por electroforesis 2D; la separación de la primera dimensión se hizo en tirillas de 7cm y PI (pH 4–7), y la segunda en geles preformados de 4–12% de poliacrilamida; asimismo, la tinción mostrada es plata compatible con masas (fig. 2).
Geles bidimensionales, gel de poliacrilamida SDS-PAGE representativo de cada grupo de estudio: lupus eritematoso sistémico neuropsiquiátrico, lupus eritematoso sistémico, manifestaciones neuropsiquiátricas no lúpicas, otras enfermedades autoinmunes e individuos controles. Primera dimensión: tirilla de 7cm y punto isoeléctrico 4–7, y segunda dimensión: poliacrilamida de 4–12%, tinción de plata compatible con masas, tiempo de revelado de 6 minutos. El protocolo de corrido corresponde al descrito previamente en metodología.
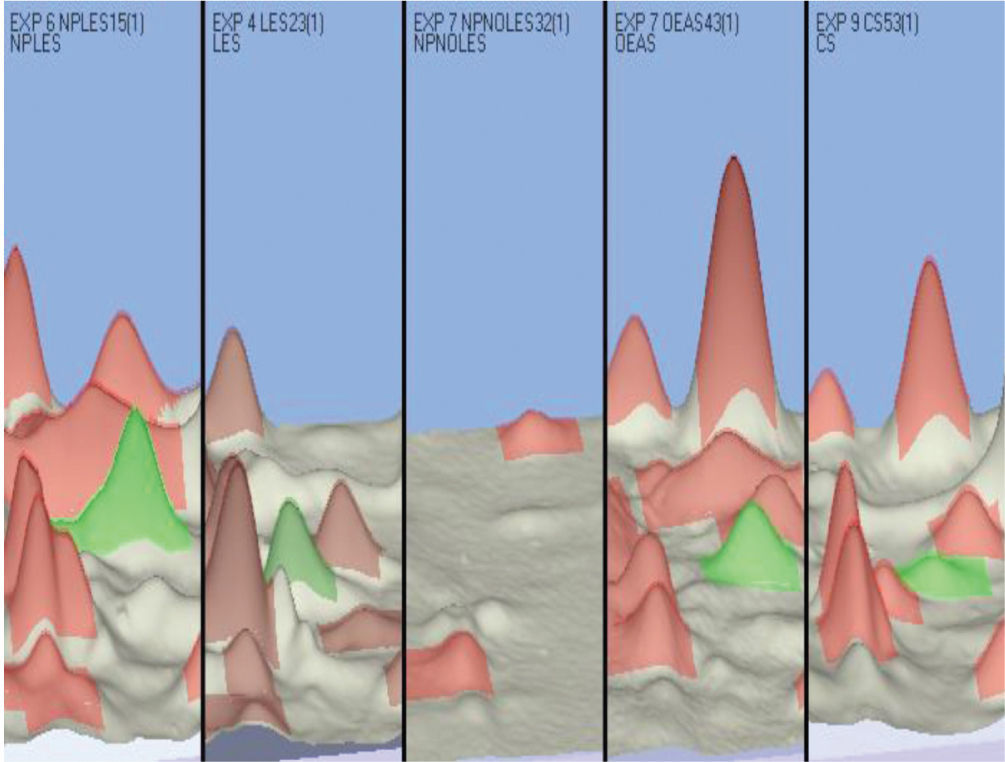
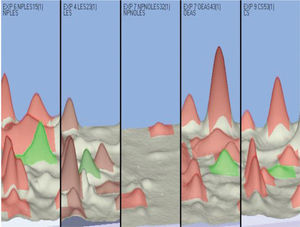
Los análisis comparativos fueron realizados utilizando el software Image Master 2D Platinum 7.0 (GE Healthcare), los parámetros de análisis fueron los siguientes: valor de prominencia (saliency) 300, smooth 2 y área mínima 5, y fue tenido en cuenta un punto de referencia (landmark), cuya ubicación en el gel corresponde a un MW aproximado de 15 kDa y un PI de 5,5. Al realizar los análisis entre los diferentes grupos, se encontraron 3 spots con expresión diferencial en términos de aumento/disminución (números: 16, 19 y 68). Se presenta una gráfica 3D de uno de los spots cuya expresión diferencial fue determinada a través de los análisis comparativos realizados con el software Image Master (fig. 3).
Imagen 3D del spot 16: gráfica obtenida del software Image master platinum 7.0. Se presenta el spot 16 (pico verde) cuya expresión diferencial aumentada es evidente en pacientes con lupus eritematoso sistémico neuropsiquiátrico (primera columna de izquierda a derecha) al ser comparada con los grupos controles, en el orden, lupus eritematoso sistémico, manifestaciones neuropsiquiátricas no lúpicas, otras enfermedades autoinmunes e individuos controles, 4 columnas siguientes de izquierda a derecha, en las cuales el pico verde resulta de menor tamaño, o incluso en el grupo de pacientes con manifestaciones neuropsiquiátricas no lúpicas, en el que no se encuentra expresión detectable. Los picos observados en rosa corresponden a otros spots que no fueron de interés.
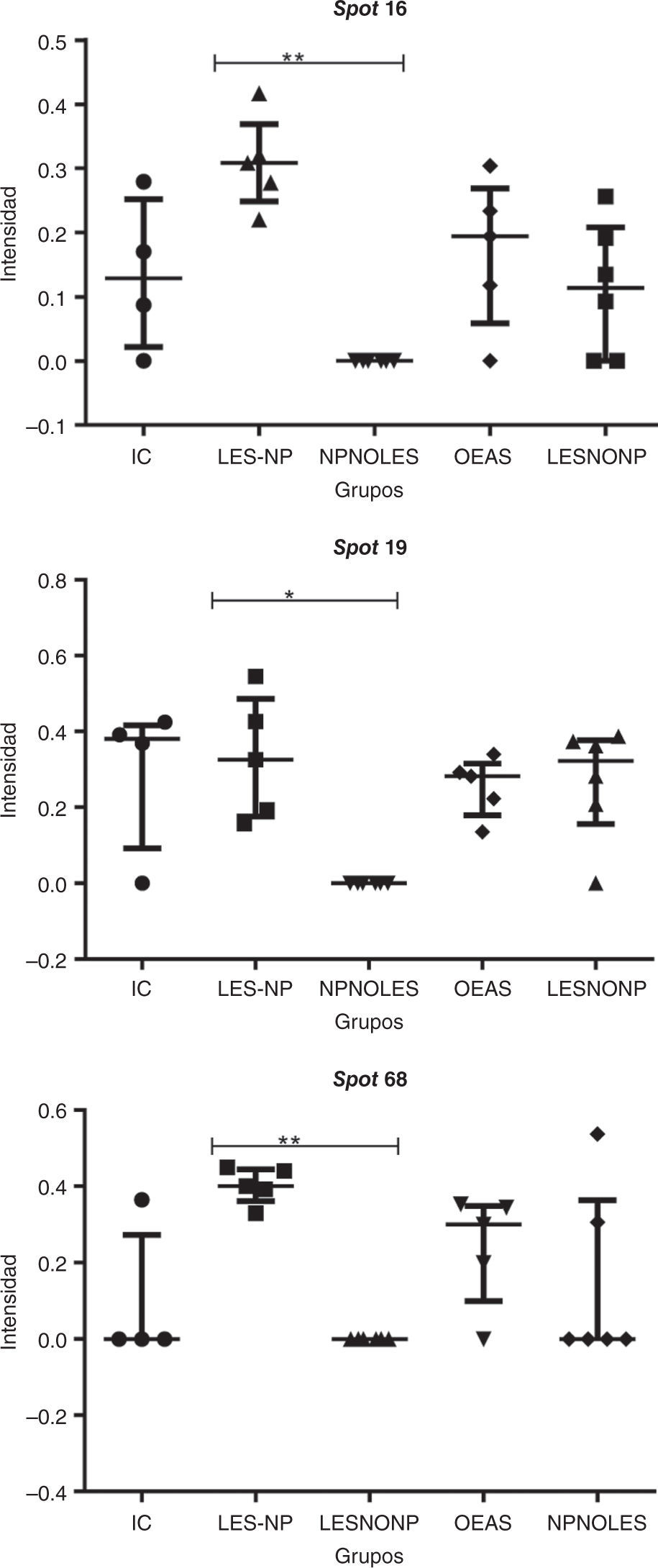
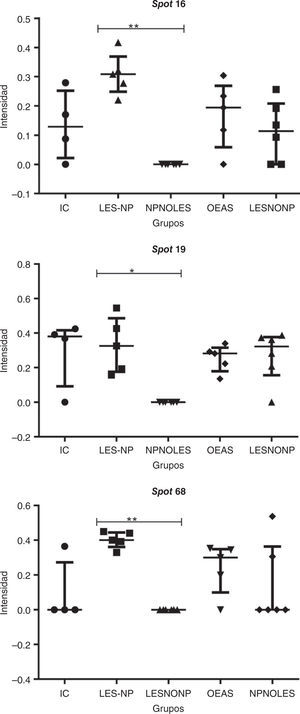
Los datos de intensidad (unidades de intensidad) y los resultados obtenidos a partir de la prueba de Kruskal-Wallis y la prueba de Dunn aplicadas se muestran en la figura 4. Las pruebas estadísticas revelan diferencias significativas al comparar el grupo de estudio, LES-NP, con los grupos controles. La prueba de comparaciones múltiples permite determinar diferencias muy significativas (p<0,01), al comparar LES-NP vs. NPnoLES en los spots 16 y 19, y LES-NP vs. LES en el spot 68.
Tanto los spots de interés como el punto de referencia en el gel 2D son señalados en la figura 5.
Spots seleccionados del perfil proteico de pacientes con lupus eritematoso sistémico neuropsiquiátrico. Gel SDS-PAGE 4–12% de poliacrilamida. El triángulo azul corresponde al punto de referencia (landmark) usado para el análisis comparativo; en círculos rojos se observan los spots con expresión diferencial en muestras de líquido cefalorraquídeo de pacientes con lupus eritematoso sistémico neuropsiquiátrico comparados con los otros grupos de estudio.
Múltiples estudios han evaluado posibles marcadores biológicos para el diagnóstico, actividad y recidivas del LES-NP; sin embargo, existen diversas falencias, tales como: la presencia de estas proteínas en las muestras biológicas de pacientes con otras enfermedades autoinmunes y enfermedades NP no lúpicas, hallazgos contradictorios que muestran variabilidad en los niveles durante el desarrollo del LES o durante la presencia de las manifestaciones NP, es decir, expresión variable en el tiempo; y además, el comportamiento de la enfermedad es diferente entre individuos, es decir, variación interindividual. Todo esto ha hecho difícil establecer una proteína como biomarcador para LES-NP15,17,20,22,27,28.
Dentro de las técnicas de proteómica utilizadas para la obtención de estos resultados se tuvieron herramientas de separación de proteínas como geles de poliacrilamida de 1D y 2D; la electroforesis 2D permite la obtención de perfiles proteicos a partir de un proteoma específico, como en nuestro caso en muestras de LCR de pacientes con LES-NP. Es de resaltar la versatilidad de esta técnica, dado que permite una amplia variedad de aplicaciones, entre ellas la detección de modificaciones postraduccionales.
Una de estas modificaciones es la metilación; específicamente en lupus se ha demostrado que no solo juega un papel en la vía de activación del receptor clonotípico de las células T, sino que actúa también sobre otros receptores ampliamente involucrados en la fisiopatología de la enfermedad, como en el receptor de célula B y los receptores tipo Toll presentes en células presentadoras de antígenos.
Otras modificaciones postraduccionales han sido ampliamente correlacionadas con la fisiopatología del lupus, entre ellas la fosforilación de algunas proteínas como ERK 1, ERK 2 y otras proteínas involucradas en la vía de señalización de las MAP quinasas.
Las modificaciones postraduccionales alteran notablemente el proteoma, no solo en términos estructurales, sino en términos de actividad. Esta ganancia o pérdida de actividad puede influir en la fisiopatología de la enfermedad autoinmune, de ahí que puede ser de gran utilidad la identificación de proteínas con modificaciones postraduccionales que tengan un papel en el LES-NP y que, por lo tanto, puedan constituir posibles biomarcadores para la enfermedad.
La electroforesis 2D no solo permite identificar dichas modificaciones, sino que de manera más frecuente con esta técnica se pueden determinar cambios en un proteoma en términos de aumento/disminución o presencia/ausencia en la expresión de una proteína, lo que favorece la búsqueda de biomarcadores por medio de esta estrategia.
Aunque, con el fin de mejorar la sensibilidad y especificidad de la técnica han sido realizadas diferentes modificaciones, entre ellas la depleción de proteínas de expresión abundante como la albumina y las inmunoglobulinas, con el fin de visualizar mejor el perfil proteico correspondiente a proteínas de baja abundancia29,30, esta modificación ha sido ampliamente realizada en muestras de suero de individuos con diferentes condiciones clínicas. En el caso particular del proteoma de LCR no es posible realizarle este ajuste a la técnica ya que la concentración de proteínas extraídas a partir de esta muestra es relativamente baja, debido a que el volumen recolectado en muchas ocasiones es ≤ 500μl; esto puede constituir una dificultad adicional en la búsqueda de biomarcadores a partir de esta muestra biológica.
Aunque la técnica ha demostrado ser muy versátil, algunos autores discuten las limitaciones de esta, entre las que enumeran: la resolución, reproducibilidad, detección de proteínas de baja abundancia y de proteínas integrales de membrana.
Sin embargo, diferentes modificaciones han permitido el mejoramiento de la técnica, en concreto la resolución fue dramáticamente mejorada por O’Farrell en 197531, quien introdujo el uso de agentes caotrópicos y detergentes para la solubilización de la muestra previa a las separaciones de primera y segunda dimensión. Posteriormente, Gasparic et al. desarrollaron los IPG. En los geles IPG, el gradiente es generado por las llamadas “inmobilinas”, las cuales están copolimerizadas con la matriz de acrilamida del gel. Este sistema ha permitido mejorar la resolución y reproducibilidad de los geles, así como aumentar la cantidad de proteína que puede ser cargada.
Las modificaciones realizadas con la técnica de 2D y el uso de la tinción de plata compatible con masas permitieron mejorar la sensibilidad del método y obtener así los perfiles proteicos de las muestras de LCR de los pacientes con LES-NP y de los IC (LES, NPnoLES, OEA e IC), los cuales fueron comparados con el software Image Master Platinum 7.0 de General Electric, con el fin de determinar proteínas con expresión diferencial. Como resultado se lograron definir 4 spots con expresión aumentada en el LCR de pacientes con LES-NP; estos spots, conocidos en los resultados como 16, 19 y 68, presentan un PI entre 5–6 y un MW de entre 20–25 KDa en los 2 primeros, y de aproximadamente 59 KDa en el spot 68. Para su posterior identificación, se requieren estudios de proteómica como los de espectrometría de masas.
Diferentes autores han establecido que la búsqueda de marcadores biológicos corresponde a un procedimiento sistemático que consta de cinco fases: estudios preclínicos exploratorios, caracterización clínica, ensayos de validación, asociación clínica (estudios retrospectivos), asociación clínica (estudios prospectivos) y control de la enfermedad; teniendo en cuenta las etapas propuestas por los autores, es necesario mencionar que esto corresponde a un estudio preliminar cuyo objetivo principal fue la estandarización de la técnica de electroforesis 2D para establecer la presencia de blancos proteicos dentro de los cuales puedan ser identificadas moléculas con función de biomarcador en pacientes con LES-NP32.
Conclusiones y perspectivasLa electroforesis 2D permitió establecer la diferencia en los perfiles proteicos de los cinco grupos de individuos estudiados, y la posible expresión diferencial de tres proteínas en el grupo de los pacientes con LES-NP. Hallazgo que debe confirmarse con un mayor número de individuos. Adicionalmente, permite generar como perspectivas del trabajo abundar sobre la identificación de las proteínas correspondientes a los spots y la validación de los resultados actuales, con técnicas como espectrometría de masas para su identificación e inmunoensayos para su validación.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónAgradecemos a la Asociación Colombiana de Reumatología la financiación recibida en la “convocatoria para la presentación de proyectos de investigación de la Asociación Colombiana de Reumatología” en el año 2011. Así mismo, agradecemos al programa de sostenibilidad de la Universidad de Antioquia, CODI, 2013–2014.
Además, agradecemos al Grupo de investigación en Inmunología Celular e Inmunogenética y al Programa de Estudio y Control de Enfermedades Tropicales por la financiación dada para la ejecución del proyecto y el uso de la herramienta de análisis de imágenes “Image Master Platinum 7.0”, respectivamente.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Agradecemos a las instituciones IPS Universitaria Clínica León XIII, al Hospital Universitario San Vicente Fundación y a los pacientes participantes que nos permitieron realizar la toma de muestras en dichas instituciones.