La enfermedad de Alzheimer es una entidad neurodegenerativa más prevalente en el mundo. Los tratamientos actualmente disponibles son escasos y tienen efectos discretos. Se ha demostrado que el litio disminuye el deterioro cognitivo de las personas con trastorno afectivo bipolar. Sin embargo, los estudios que evalúan el litio para el deterioro cognitivo en la enfermedad de Alzheimer continúan en controversia.
MétodosSe llevó a cabo una búsqueda sistemática de la literatura en PubMed, EMBASE, la Biblioteca Cochrane, LILACS y Google Scholar, entre el 30 de abril y el 10 de mayo de 2021. Se incluyeron ensayos clínicos controlados y aleatorizados (ECCA) que evaluaron la eficacia y la seguridad del litio como tratamiento del deterioro cognitivo en personas con demencia y deterioro cognitivo leve por enfermedad de Alzheimer. El desenlace primario fue la diferencia en el funcionamiento cognitivo al final del estudio. Dos autores seleccionaron los estudios y extrajeron los datos. Se calcularon las diferencias de medias estandarizadas (DME) en las variables continuas y el riesgo relativo (RR) en las variables dicotómicas. Para el procesamiento de los datos, se utilizó el software Review Manager 5.4.
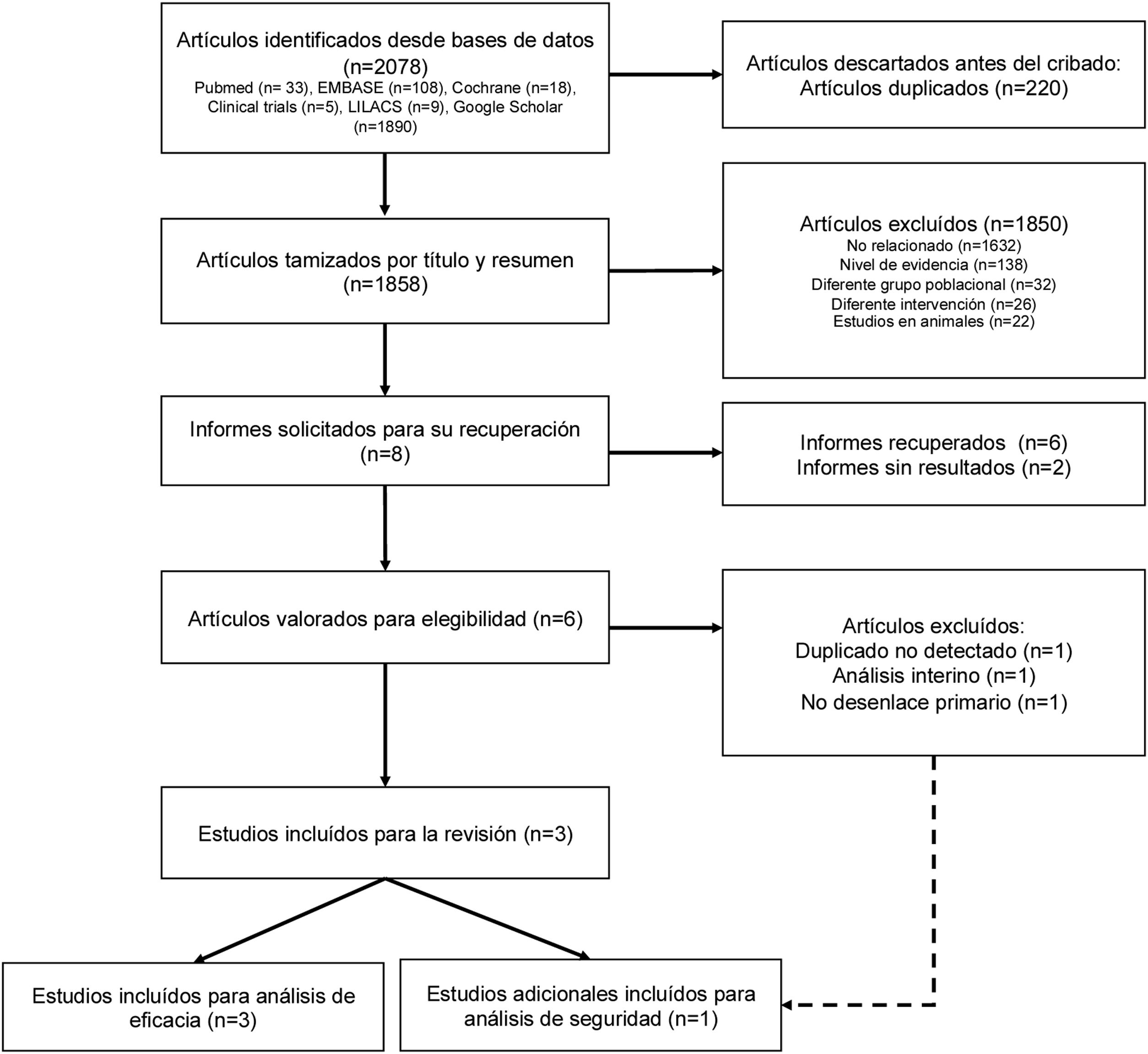
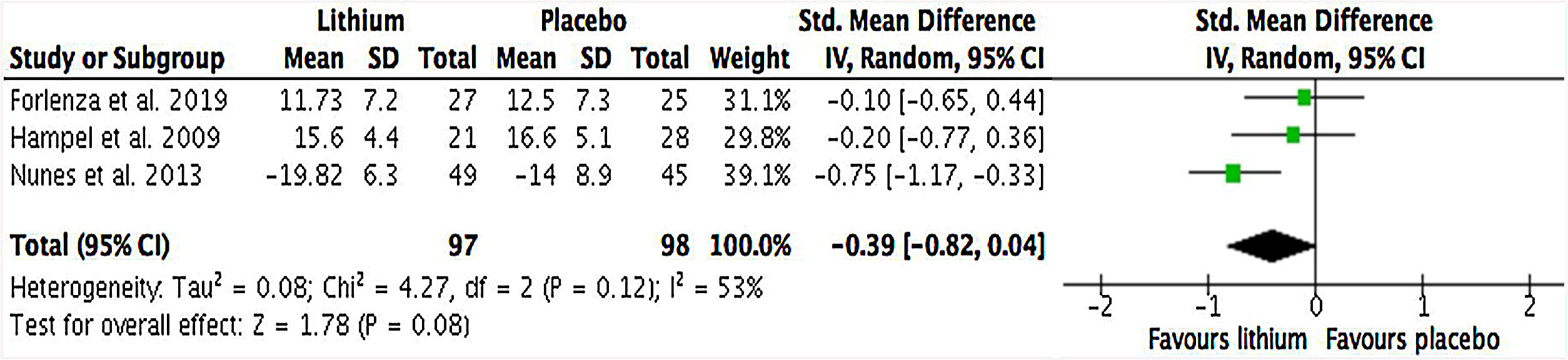
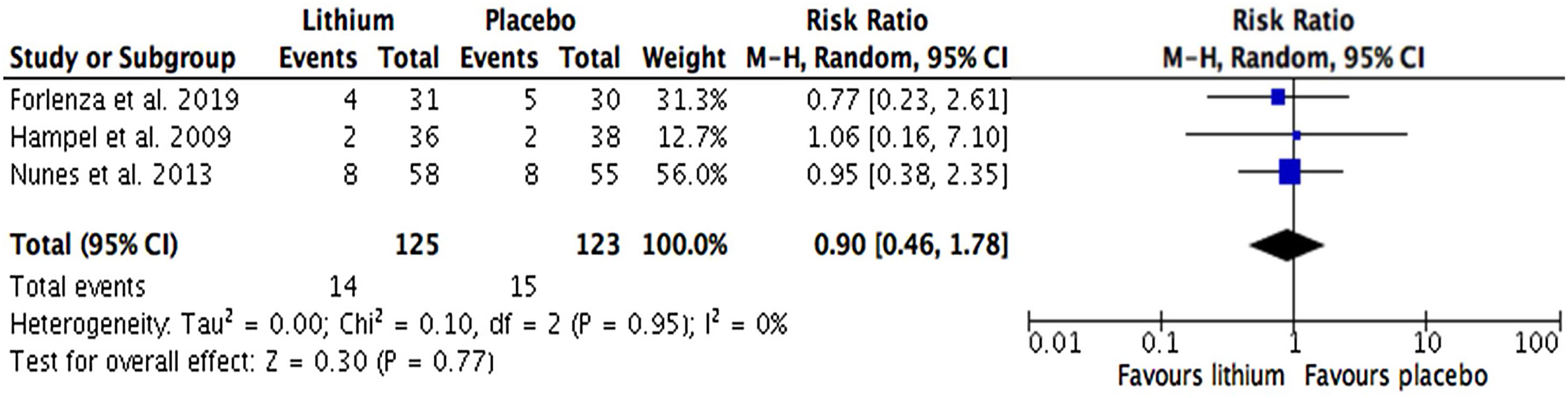
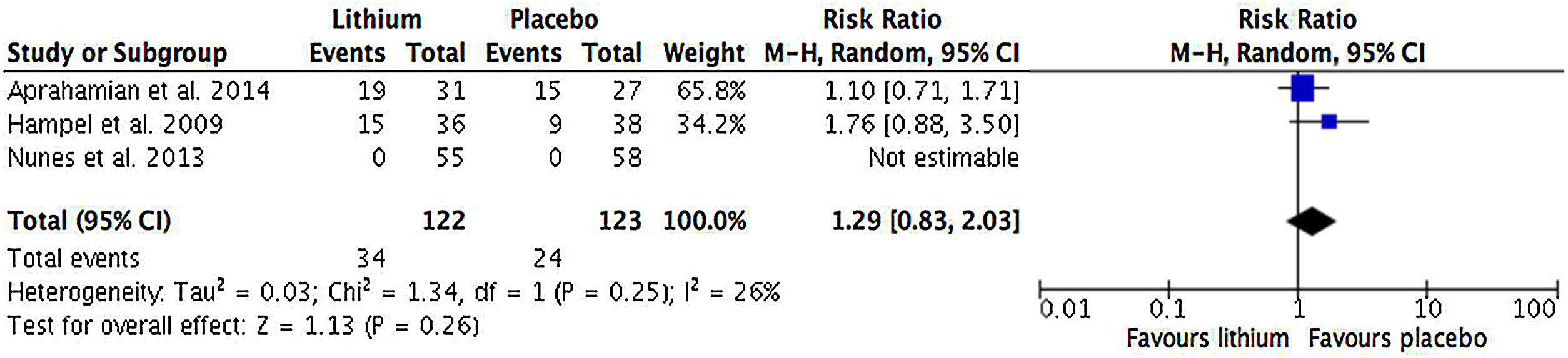
ResultadosSe identificaron 2.078 reportes y se incluyeron 3 estudios con datos de 248 participantes. Un cuarto reporte se incluyó para el análisis de seguridad. Comparado con placebo, no se encontró una diferencia significativa en el desempeño cognitivo de los pacientes con deterioro cognitivo leve o demencia por enfermedad de Alzheimer que recibieron tratamiento con litio (SMD=–0,39; IC95%, –0,82 a 0,04; I2=53%; n=195). No hubo diferencias en la tasa de interrupción por cualquier causa (RR=0,90, IC95%, 0,46-1,78; I2=0%) y la tasa de efectos adversos entre el litio y placebo (RR=1,29, IC95%, 0,83-2,03; I2=0%).
ConclusionesLa evidencia actual es insuficiente para asumir algún efecto del litio como tratamiento del deterioro cognitivo en la demencia por enfermedad de Alzheimer. Es necesario diseñar más estudios de mejor calidad para justificar la prescripción de litio para esta población en la práctica clínica. Dada la toxicidad del litio, debe garantizarse una adecuada preselección de los pacientes y un estrecho seguimiento.
Alzheimer's disease is the most prevalent neurodegenerative disease worldwide. Currently available treatments are scarce and have modest effects. Lithium has been shown to decrease cognitive impairment in people with bipolar affective disorder. However, studies evaluating lithium for cognitive impairment in Alzheimer's disease remain controversial.
MethodsWe conducted a systematic search of the literature using PubMed, EMBASE, the Cochrane Library, LILACS, and Google Scholar between 30 April and 10 May 2021. Randomised controlled clinical trials (RCTs) conducted to evaluate the efficacy and safety of lithium as a treatment for cognitive impairment in people with dementia and mild cognitive impairment due to Alzheimer's disease were included. The primary outcome was the difference in cognitive functioning at the end of the study. Two authors selected the studies and extracted the data. We calculated the standardised mean differences (SMD) for continuous variables and the relative risk (RR) for dichotomous variables. Review Manager 5.4 software was used for data processing.
Results2,078 reports were identified and 3 studies with data from 248 participants were included. A fourth report was included for safety analysis. Compared to placebo, no significant difference was found in the cognitive performance of patients with mild cognitive impairment or dementia due to Alzheimer's disease receiving lithium treatment (SMD=–0.39; 95%CI, –0.82 to 0.04; I2=53%; n=195). Also, significant differences were not found in the rate of discontinuation for any cause (RR=0.90; 95%CI, 0.46-1.78; I2=0%), and the rate of adverse effects between lithium and placebo (RR=1.29; 95%CI, 0.83-2.03; I2=0%).
ConclusionsThe current evidence is insufficient to assume any effect of lithium as a treatment for cognitive impairment in Alzheimer's disease dementia. It is necessary to continue building better quality studies to justify the use of lithium in this population in clinical practice. Given the toxicity of lithium, adequate pre-selection of patients and close monitoring should be ensured.
La enfermedad de Alzheimer (EA) es una entidad neurodegenerativa muy prevalente y caracterizada por un inicio insidioso y un deterioro progresivo de las funciones cognitivas1. Su progresión clínica abarca un espectro de gravedad que va desde cambios cerebrales que pasan inadvertidos (etapa presintomática o preclínica), seguidos de síntomas cognitivos observables que no afectan al funcionamiento de la persona (deterioro cognitivo leve [DCL]), a una marcada discapacidad cognitiva y conductual asociada con un declive del funcionamiento habitual de las personas, reconocida como demencia o trastorno neurocognitivo mayor2. Actualmente la EA es la causa más común de demencia y DCL en el mundo y tiene un impacto sustancial no solo en los pacientes, sus cuidadores y familiares, sino también social y económico que amenaza la salud pública2.
A pesar de que en las últimas décadas se han invertido incontables esfuerzos para entender la EA y brindar un tratamiento efectivo para esta población, su tratamiento se limita a un escaso número de medicamentos que no modifican de modo contundente el curso de la enfermedad y brindan exclusivamente un alivio sintomático y transitorio3,4, salvo algunas novedosas excepciones de alto costo5,6. Por eso numerosos tratamientos, como las sales de litio, hoy se encuentran en estudio como alterativas de tratamiento para las personas EA7,8.
El litio es un medicamento de bajo costo9 que se utiliza ampliamente en el tratamiento del trastorno afectivo bipolar8. Este tratamiento con litio a largo plazo se ha asociado no solo con menores tasas de demencia10, sino también con una mayor densidad de la materia gris y una mejor integridad metabólica del tejido cerebral11. Aunque el mecanismo de acción del litio todavía no se ha dilucidado completamente, la evidencia actual postula que, a través de la inhibición de la glucógeno sintetasa cinasa-3β (GSK-3β) y la vía de la inositol monofosfatasa (IMP), este medicamento puede inducir efectos neurotróficos, modular la función mitocondrial y los procesos de neuroinflamación y reducir el impacto del estrés oxidativo en las células12. A través de estos mecanismos, el litio podría atenuar la EA disminuyendo la hiperfosforilación de la proteína Tau13–15 y protegiendo las neuronas del efecto neurotóxico de los péptidos de amiloides característicos de la enfermedad16.
En las últimas décadas se han publicado diferentes ensayos clínicos controlados y aleatorizados (ECCA) que advierten sobre el posible impacto benéfico del tratamiento con litio en pacientes con EA17–20. En 2015, Matsunaga et al. realizaron el primer metanálisis para abordar este importante tema y consolidaron una potencial eficacia del litio para el tratamiento del deterioro cognitivo de las personas con EA21. Sin embargo, esta evidencia proviene de unos pocos estudios que integraban poblaciones muy heterogéneas y muestras insuficientes21. Ante la ausencia de tratamientos eficaces para el tratamiento de la EA, es esencial continuar acumulando y actualizando la evidencia sobre las potenciales estrategias terapéuticas que podrían impactar en el desempeño cognitivo y funcional de estas personas. Por este motivo se ha realizado una revisión sistemática y metanálisis basados en un protocolo registrado en PROSPERO (CRD42021200450) y de acuerdo con las pautas acordadas por las guías PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses), para evaluar la eficacia y la seguridad del litio como tratamiento del deterioro cognitivo en personas con demencia y DCL por EA.
MétodosEstrategia de búsquedaSe llevó a cabo una búsqueda de literatura computarizada utilizando PubMed, EMBASE, la Biblioteca Cochrane, LILACS y Google Scholar para identificar los artículos relevantes. La búsqueda tuvo lugar entre el 30 de abril y el 10 de mayo de 2021. La estrategia general fue combinar sinónimos de demencia y DCL por EA con sinónimos de litio como intervención principal, sin filtros por idioma o fecha. Para ubicar literatura no publicada, se buscaron artículos en la base de datos de Open Gray. Las revisiones recientes sobre el tema se revisaron manualmente para encontrar estudios elegibles adicionales. Además, se realizó una búsqueda del material relacionado en congresos de alto impacto como el de la American Psychiatry Association (APA), el de la European Academy of Neurology (EAN) y la Alzheimer's Association International Conference. Cuando se encontraron estudios registrados pero aun no publicados, se contactó con los autores para recabar mayor información. No obstante, los autores contactados declararon no tener información preliminar22,23. La estrategia de búsqueda completa se informa en tabla 1 del material adicional.
Criterios de inclusión y exclusiónSe incluyeron todos los ECCA que evaluaron la administración de litio a pacientes con DCL y demencia por EA comparados con placebo y que aportaron como desenlace escalas de evaluación de su función cognitiva. Se excluyeron los estudios realizados en pacientes con demencia por EA en estadios graves, estudios en otros tipos de demencia, como la frontotemporal, por cuerpos de Lewy y la vascular. Además se excluyeron los estudios que evaluaron la función cognitiva en pacientes con trastorno afectivo bipolar en tratamiento con sales de litio.
Dos de los autores (MR, DR) se encargaron de la selección de títulos, resúmenes y textos completos de cada artículo, cada uno a ciegas de las calificaciones del otro. Donde hubo desacuerdo sobre la inclusión del estudio, se revisó el artículo completo y se llegó a un acuerdo según los criterios de inclusión y exclusión previamente plasmados en el protocolo. En ningún caso fue necesario un tercer evaluador para llegar a un acuerdo. Se utilizó el software Eppi Reviewer para la gestión de referencias y la selección de elegibilidad de los estudios.
Extracción de datos y valoración de la calidad de la evidenciaLa extracción de datos se realizó en formularios estructurados basados en la hoja de recolección de datos otorgada por Cochrane para ensayos clínicos controlados24. Uno de los autores ingresó los datos (MR) y luego un segundo autor (DR) aseguró la precisión de cada dato mediante una verificación cruzada contra la fuente original. De cada uno de los estudios incluidos se obtuvo la siguiente información: apellido del primer autor, año de publicación, periodo de estudio, diseño del estudio, media de edad de los participantes, porcentaje de mujeres, número de participantes en cada grupo, descripción de la intervención, métodos para diagnosticar el trastorno neurocognitivo, métodos para medir la función cognitiva del trastorno neurocognitivo, estimaciones del efecto como cambios en la función cognitiva de los participantes entre la basal y la final (media± desviación estándar), las pérdidas durante el seguimiento, las tasas o el número de efectos adversos en cada grupo y el tipo de patrocinador.
Las evaluaciones de la calidad metodológica de los estudios incluidos se realizaron de manera independiente por 2 investigadores utilizando la escala de Jadad25, la cual incluye 5 ítems que evalúan la asignación aleatorizada, el enmascaramiento y los retiros y abandonos durante el seguimiento. La puntuación total de cada artículo oscila entre 0 y 5, según la puntuación de cada elemento. Los estudios de baja calidad obtienen puntuaciones de 0 a 3, y los de alta calidad reportan puntuaciones >325.
Evaluación del riesgo de sesgosInicialmente 2 autores (MR y DR) evaluaron de forma independiente los sesgos de los estudios incluidos. Después se hizo una evaluación conjunta en la que se dirimieron las diferencias entre ambos autores y se acordó una evaluación de riesgos de sesgos común. El riesgo de sesgos de los ECCA se evaluó según el Manual Cochrane para revisiones sistemáticas de intervenciones24. Específicamente, se evaluaron los sesgos de acuerdo con el instrumento ROB-2, que incluye los siguientes dominios: sesgos que surgen del proceso de aleatorización, sesgos por desviación de la intervenciones intencionadas, sesgos por ausencia de información del desenlace, sesgos en la medición del desenlace y sesgos en la selección de los resultados reportados24. Para cada dominio, se describieron los procedimientos realizados en cada estudio incluyendo citas textuales. Según la información extraída, los estudios se calificaron desde bajo riesgo a alto riesgo24. Se utilizó el instrumento robvis para la graficación del riesgo de sesgos26.
Análisis estadístico y valoración de heterogeneidadSe llevó a cabo un metanálisis cuando los datos de 2 o más estudios estaban disponibles para cada comparación principal: la eficacia respecto al funcionamiento cognitivo y la seguridad del tratamiento. Para la eficacia, los principales resultados fueron el cambio en la puntuación de la función cognitiva y el funcionamiento diario desde los basales hasta el final del seguimiento de ambos grupos. Para la evaluación de seguridad, se tomó la tasa de efectos adversos y la interrupción del tratamiento por cualquier causa por eventos sucedidos luego de la aleatorización.
Los análisis estadísticos se realizaron con el programa RevMan 5.4. Los análisis se basaron en el modelo por protocolo utilizado originalmente por los ensayos clínicos incluidos. Para combinar los estudios, se utilizó el modelo de efectos aleatorios por resultar en estimaciones más conservadoras y su bondad en caso de heterogeneidad. Los datos continuos de eficacia se presentaron como una diferencia de medias estandarizada con sus intervalos de confianza del 95% (IC95%), mientras los datos de seguridad dicotómicos se presentaron como riesgo relativo (RR). Asimismo, las inconcordancias (heterogeneidad) entre los estudios incluidos se evaluaron mediante la valoración de los forest plot y la I2 estadística. Se consideró heterogeneidad estadística baja si I2 ≤ 40%, moderada si I2=30-60%, sustancial si I2=50-90% y considerable si I2=75-100%24.
ResultadosSe identificaron 2.078 registros mediante la recuperación computarizada en bases de datos. De estos se excluyeron 220 duplicados. Después de revisar los títulos y resúmenes, se excluyeron 1.858. Posteriormente se solicitaron los textos completos de 8 artículos completos, de los que 6 se evaluaron para elegibilidad, pues no se pudo recabar 2 referencias de sus respectivos autores porque aún no contaban con una publicación oficial ni tenían información preliminar22,23. Uno de ellos se excluyó por tratarse de un análisis interino de un estudio ulterior; otro se excluyó por ser un duplicado no detectado, y un último artículo se excluyó porque no evaluaba el desenlace primario. Únicamente 3 estudios cumplieron los criterios de inclusión para la revisión sistemática. Sin embargo, se incluyó para el análisis de los datos un artículo adicional, pues se trataba del análisis de seguridad de uno de los estudios incluidos que se había publicado en un artículo diferente. Los detalles del proceso de selección de estudios se muestran en la figura 1.
La tabla 1 muestra el resumen de las características de los estudios incluidos tras la revisión de texto completo según criterios de inclusión y exclusión. De estos 3 ensayos, que incluyeron a 248 participantes, todos informaron cambios en la puntuación de la función cognitiva desde el inicio hasta el final del seguimiento utilizando la Alzheimer's Disease Assessment Scale (ADAS-Cog) y/o el Minimental Test Examination (MMSE). Dos de los estudios informaron cambios en biomarcadores del líquido cefalorraquídeo desde el inicio hasta el seguimiento final del estudio17,19. Solo el estudio de Forlenza et al. reportó cambios en el estado de funcionamiento diario a través de la Clinical Dementia Rating Scale (CDR)27, incluyendo el puntaje de la suma de casillas17. La calidad metodológica de los estudios según la escala de Jadad fue alta en el estudio de Forlenza et al. y baja en los demás. La calificación completa con la escala de Jadad de cada estudio puede verse en la tabla 2 del material adicional.
Ensayos clínicos de litio en la enfemedad de Alzheimer con función cognitiva como desenlace
| Estudio | Participantes | Diseño | Intervención | Desenlaces | Calidad/riesgo de sesgos | Resultados de desenlaces cognitivos | Desenlaces de resultados relacionados |
|---|---|---|---|---|---|---|---|
| Forleza et al., 2019 (Brasil)No industria | 61 pacientes; edad ≥ 60 años con DCL amnésico según criterios de Clínica MayoSeleccionados para intervención con litio (n=31) o placebo (n=30). Media de edad del grupo de intervención, 71,2±5,4) y del grupo de placebo, 74,4±6,1 | Ensayo clínico controlado y aleatorizado a doble ciego. Valoración cognitiva a 12 y 24 meses. Seguimiento adicional a simple ciego por 24 meses adicionales | Dosis iniciales de 150 mg de litio con titulación semanal hasta alcanzar concentración plasmática de 0,25-0,5 mEq/l | Primarios: CDR, ADAS-Cog, evocación retardada, evocación de figura, secuencia de letras y números, TMT-A, TMT-B; niveles de biomarcadores en LCR. Secundarios: conversión a demencia por enfermedad de Alzheimer, seguridad y tolerabilidad de la intervención | Alta/algunas preocupaciones | Litio> placebo: CDR-SoB, ADAS-cog, TMT-A. Litio=placebo: evocación retardada, evocación de figura, secuencia de letras y números, TMT-B | Litio> PLA: Niveles de Aβ1−42. en LCR. Litio=placebo: tau total y p-tau |
| Aprahamian et al., 2014 (Brasil)No industria | 61 pacientes de edad ≥ 60 años con DCL amnésico según criterios de Clínica MayoSeleccionados para intervención con litio (n=31) o placebo (n=30). Edad media del grupo de intervención, 71,2±5,4 años; del grupo de placebo, 74,4±6,1 años | Ensayo clínico controlado y aleatorizado a doble ciego. Valoración cognitiva a 12 y 24 meses. Seguimiento adicional a simple ciego por 24 meses adicionales | Dosis iniciales de 150mg de litio con titulación semanal hasta alcanzar concentración plasmática de 0,25-0,5 mEq/l | Detección de cualquier efecto adverso o daño de órgano con intervalo de 3 meses | Alta/algunas preocupaciones | No aplica | Litio> PLA: diabetes mellitus, arritmia cardiaca, aumento de peso. Litio=PLA: niveles plasmáticos de creatinina, aMDRD |
| Nunes et al., 2013 (Brasil)No industria | 113 pacientes con diagnóstico de demencia por enfermedad de Alzheimer según los criterios NINCDS-ADRDA y DSM-IV. Se incluyó a los pacientes según puntajes del MMSE entre 9 y 21 (educación> 4 años) o MMSE 12-24 (educación <4 años)Seleccionados para intervención con litio (n=58) o placebo (n=55). Edad media de los participantes del grupo de intervención, 78±0,76 años y del grupo de placebo, 78±0,97 años | Ensayo clínico controlado y aleatorizado a doble ciego. Valoración cognitiva trimestral tras inicio de intervención por 5 trimestres finalizando a los 15 meses | Litio 300 μg administrados 1 vez al día en forma de gluconato o carbonato de litio | Primario: MMSE | Baja/alto | Litio> PLA: MMSE | No reportan otros desenlaces |
| Hampel et al., 2009 (Alemania)Industria | 74 pacientes con demencia por enfermedad de Alzheimer probable según criterios de NINCDS-ADRDA y DSM-IV-TR, con MMSE 21-26 y edad ≥ 50-85 añosSeleccionados para intervención con litio (n=36) o placebo (n=38). Edad de los participantes del grupo de intervención, 68±7,4 años y del de placebo, 68,9±8,3 | Ensayo clínico controlado y aleatorizado a simple ciego. Valoración de función cognitiva basal y a las 10 semanas | Fase de titulación por 6 semanas hasta alcanzar 0,5-0,8 mEq/l en plasma | Primarios: determinación de p-tau y actividad de GSK-3 en LCR. Secundarios: determinación de tau total y Aβ1-42 en LCR, MMSE, ADAS-Cog, NPI | Baja/alto | Litio=placebo en medidas de MMSE, ADAS-cog y NPI | Litio=PLA: actividad de GSK-3 en linfocitos, P-tau 181, P-tau 231, T-tau y Aβ1–42 en LCR, Aβ1-42 en plasma |
ADAs: Alzheimer's Disease Assessment Scale; aMDRD: abbreviated Modification of Diet in Renal Disease;Aβ1-42: betaamiloide 1-42; CDR: Clinical Dementia Rating Scale; DCL: deterioro cognitivo leve; DSM-IV: Diagnostic Statistical Manual version IV; GSK-3: glucógeno sintetasa-3; LCR: líquido cefalorraquídeo; MMSE: Minimental test examination; NINCDS-ADRDA: Criterios diagnósticos de enfermedad de Alzheimer según el National Institute of Neurological and Communicative Disorders and the Alzheimer's Disease and Related disorders Association; NPI: neuropsychiatric inventory; P-tau: proteína Tau; TMT-A: Trail Making Test.
El estudio de Hampel et al. incluyó a 61 participantes con demencia leve por EA según los puntajes del MMSE entre 21-26. Si bien los desenlaces primarios de este estudio estaban enfocados en los valores de p-τ y la actividad de la GSK-3, también se evaluó como desenlace secundario la eficacia del litio durante 10 semanas en relación con el funcionamiento cognitivo según el ADAS-cog y el MMSE. Sin embargo, de 36 pacientes en el grupo de litio y 38 pacientes del grupo placebo, solo se reportó el puntaje del ADA-Cog y el MMSE al final del estudio de 21 y 28 participantes respectivamente, sin reportar el porqué de las pérdidas. En términos de función cognitiva, no se demostraron diferencias signficativas en el grupo de intervención comparadas con el placebo19. El puntaje del MMSE al final del tratamiento demostró una media de 22,6± 3,5 comparada con 23,2±2,7 en el grupo de placebo (p=0,47). Para el ADAS-Cog al final del tratamiento se reportó una media de 15,6±4,4, mientras que el grupo de placebo tuvo una media de 16,6±5,1. Debe resaltarse que el 28% (6/21) de los pacientes en el grupo de litio mostró una mejoría de 4 o más puntos en la escala ADAS-cog, frente al 14,3% (4/28) del grupo de placebo, lo que podría corresponder a una mejoría clínicamente significativa pero que no se reflejó en significación estadística (p=0,11). En terminos de seguridad, el 45,5% de los pacientes con litio reportaron al menos 1 evento adverso, frente al 28,9% del grupo de placebo (p=0,15); sin embargo, los efectos adversos potencialmente relacionados con el medicamento (temblor y síntomas gastrointestinales) fueron significativamente más frecuentes en el brazo del tratamiento con litio (p=0,01). Los eventos adversos graves o que llevaron a interrumpir la intervención no se diferenciaron entre los 2 grupos. Solo se excluyó por un evento adverso grave a 1 paciente del grupo de litio, una neoplasia cerebral no relacionada con el medicamento19.
Nunes et al., en un estudio publicado en 2013, estudiaron los efectos de la microdosis de litio (300μg/día) en el desempeño cognitivo de 113 pacientes con demencia por EA (puntajes de MMSE entre 9-21 si educación> 4 años o entre 12-24 si educación<4 años). En este estudio se hicieron evaluaciones trimestrales con el MMSE antes y después de la intervención con litio o placebo. De 113 pacientes (58 en el grupo de litio y 55 en el de placebo) que iniciaron el estudio, solo 94 (49 en el grupo de litio y 45 en el de placebo) finalizaron el estudio, con una pérdida del 17% de la muestra inicial; el motivo de estas pérdidas no se especificó. Sin embargo, Nunes et al. demostraron una diferencia significativa en el puntaje del MMSE en el grupo de tratamiento con litio, que mostró superioridad de las sales de litio sobre el placebo en personas con demencia por EA (19,82±0,9 frente a 14±1,32; p <0,001). No se reportaron efectos adversos en ninguno de los 2 grupos y no se registró muerte alguna durante el tiempo del estudio20.
Forlenza et al., en un estudio que incluyó a 61 pacientes con DCL amnésico según los criterios de la clínica Mayo, demostraron la superioridad del litio sobre el placebo en relación con el funcionamiento cognitivo de estos pacientes en un seguimiento a 2 años. Respecto al grupo de placebo, los pacientes que recibieron litio tuvieron un mejor desempeño en el ADAS-cog y el TMT-A (p <0,05) al final del seguimiento. Asimismo estos pacientes tuvieron una estabilidad de la escala de funcionamiento diario CDR. El número de conversión de DCL amnésico a demencia fue menor en el grupo de litio, pero con solo una tendencia a la significación estadística17. El análisis de tolerancia y seguridad del estudio de Forlenza et al. se publicó en un artículo diferente por Aprahaim et al., que reportaron que tras 2 años de tratamiento con litio el 40% de los pacientes habían contraído dislipemia; el 20%, gastritis aguda (no significativa); el 28%, diabetes mellitus (p=0,037), y el 20%, arritmias (p=0,028), y que el 25% había aumentado de peso significativamente, 5,5 kg en promedio (p=0,015)28. El estudio de Aprahaim et al. fue incluido únicamente para el análisis de seguridad. La fase de extensión abierta, a simple ciego, del estudio de Forlenza et al. que evalúo a los pacientes a los 4 años de tratamiento con litio frente a placebo no se tuvo en cuenta para el análisis ni para la evaluación del riesgo de sesgos.
Síntesis de los datos y análisis estadísticoSe incluyeron en el metanálisis 3 ECCA; un cuarto estudio se incluyó para el análisis de seguridad17,19,20,28. El desenlace primario de eficacia se midió a través de la función cognitiva, evaluada mediante el ADAS-cog y el MMSE29,30. Las mediciones de seguridad incluyeron la interrupción del tratamiento por cualquier causa, la suspensión del medicamento por efectos adversos y los efectos adversos reportados. Como parte de los desenlaces secundarios, se incluyeron los cambios en los biomarcadores en el líquido cefalorraquídeo —tau fosforilada (P-τ 181), tau total (T-τ) y AB 42— reportados por 2 estudios17,19.
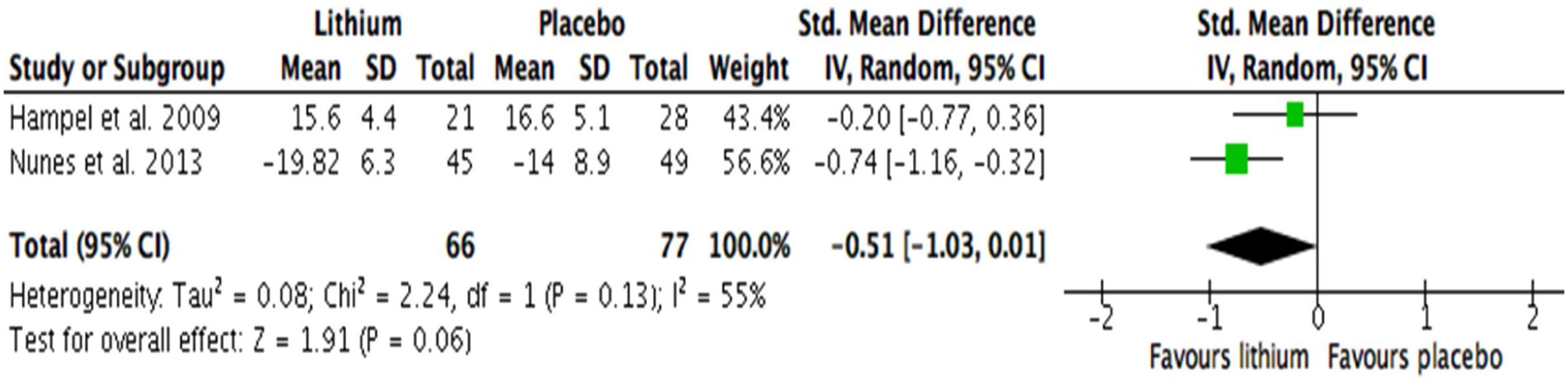
Desenlace primarioSegún los datos extraídos para el metanálisis, no hubo una diferencia significativa en el desempeño cognitivo de los pacientes con demencia por EA o deterioro cognitivo amnésico que recibieron tratamiento con sales de litio frente a quienes recibieron placebo (SMD=–0,39; IC95%, –0,82 a 0,04; I2=53%; n=195) (fig. 2). Asimismo, en el análisis de subgrupos realizado según demencia y deterioro cognitivo leve amnésico, no se encontró una diferencia significativa en el desempeño cognitivo a favor del tratamiento con litio (SDM=–0,51; IC95%, –1,03 a 0,01; I2=55%; n=143) (fig. 3). En ambos análisis se encontró una heterogeneidad estadística sustancial entre los estudios: I2> 50%. Solo 1 estudio evaluó a pacientes con DLC amnésica (SMD=–0,10; IC95%, –0,65 a 0,44; I2 no estimable; n=52).
Desenlaces secundariosNo hubo diferencias significativas en la tasa de interrupción por cualquier entre los grupos de litio y de placebo (SMD=0,90; IC95%, 0,46-1,78; I2=0%) (fig. 4). La tasa de efectos adversos reportados fue similar en tre los grupos de litio y de placebo (SMD=1,19; IC95%, 0,83-2,03; I2=0%) (fig. 5). Solo el estudio de Forlenza et al. reportó la interrupción de un paciente por fallecer durante el estudio.
En cuanto al análisis de biomarcadores en líquido cefalorraquídeo, no se logró un análisis actualizado porque el estudio de Forlenza et al. no reportó los valores brutos en el seguimiento a 2 años del artículo original y el autor no pudo darlos. Sin embargo, se reportan aquí los análisis para los biomarcadores dados en el análisis interino (seguimiento a 12 meses) de dicho estudio, donde se describen las medidas necesarias. En las concentraciones de Aβ1-42 en líquido cefalorraquídeo no se encontraron diferencias significativas entre los grupos de litio y de placebo (MD, –30,05; –94,57 a 34,47; I2=0; n=110). Tampoco se encontraron diferencias significativas entre ambos grupos en la concentración de la proteína tau fosforilada (MD, 4,35; –21,11-29,81; I2=72; n=110) (figuras 1 y 2 de material adicional).
Evaluación del riesgo de sesgosEl riesgo de sesgos se consideró según las recomendaciones de la Colaboración Cochrane a través del instrumento ROB-224. Las figuras 3 y 4 del material adicional muestran el riesgo de sesgos de cada estudio y el riesgo de sesgos total respectivamente. Los estudios de Hampel et al. y Nunes et al. tuvieron un riesgo de sesgos alto, mientras que el de Forleza et al. mostró un riesgo de sesgos intermedio basado en las posibles preocupaciones en la selección de los resultados reportados.
En el estudio de Hampel et al. se evidenció un riesgo de sesgos alto a expensas de las desviaciones en la intervención prevista, los datos faltantes sobre el desenlace y su medición, principalmente porque los evaluadores no estaban enmascarados y conocían la intervención asignada a los participanes. Además hubo una pérdida importante de sujetos para el desenlace de función cognitiva19.
El estudio de Nunes et al. también se consideró en alto riesgo de sesgos principalmente por una pérdida de aproximadamente el 17% de los individuos a lo largo de las evaluaciones y por un sesgo en las mediciones del desenlace. Haber utilizado un mismo instrumento (el MMSE) para evaluar trimestralmente la función cognitiva de los participantes podría haber motivado un efecto de aprendizaje, con lo que se podría sobrevalorar los efectos de la intervención. Además no se aportó una adecuada descripción de la aleatorización y el enmascaramiento20.
Por otra parte, el estudio de Forlenza et al. mostró solo alguna preocupación en cuanto al riesgo de sesgos. Haber tenido tan numerosos instrumentos para evaluar un mismo desenlace podría generar alguna cuestión sobre la selección de los resultados. Asimismo, haber utilizado el análisis interino de este mismo estudio podría hacer sospechar que los resultados numéricos fueron el producto de múltiples análisis de los datos17.
DiscusiónMediante una búsqueda exhaustiva, se identificaron únicamente 3 ECCA con placebo que valoraron la función cognitiva de personas con DCL o demencia por EA publicados entre 2009 y 201917,19,20. Los hallazgos generales sobre las características metodológicas y de resultados de cada estudio evidencian variaciones sustanciales en la localización geográfica, la dosis del medicamento evaluado y la etapa de la enfermedad en que se encontraban los participantes. Todos los estudios confirmaron una valoración ética formal y el requisito de consentimiento informado.
Eficacia del litio en demencia y DCL por EAA diferencia de un metanálisis previo sobre el tema, el principal resultado de este estudio indica que las sales de litio no se asocian significativamente con un retraso de la progresión del deterioro cognitivo de las personas con DLC amnésica y demencia por EA comparadas con placebo (DME=–0,39; IC95%, –0,82 a 0,04; I2=53%). Aun cuando se realizó el análisis de subgrupo según demencia y DCL amnésico, no se encontraron diferencias entre los grupos en cuanto al desempeño cognitivo de las personas con demencia por EA (DME=–0,51; IC95%, –1,03 a 0,01; I2=55%). Sin embargo, los estudios incluidos para el análisis de eficacia no solo tenían poblaciones heterogéneas en cuanto al funcionamiento cognitivo, sino que también evaluaron periodos de tiempo y dosis de la intervención notablemente diferentes17,19,20. Aunque los estudios de Forlenza et al. y Nunes et al. indican que la administración de litio a personas con DLC amnésica y demencia por EA puede tener un beneficio en el desempeño cognitivo, la suma de la evidencia actual debe ser descrita como equívoca y controvertida.
La dosis y la duración del tratamiento con litio parecen tener una relación con la estabilidad del desempeño cognitivo en la población estudiada. Como se ve en la tabla 1, los estudios con menores dosis de litio y mayor tiempo de administración demostraron una estabilidad en el funcionamiento cognitivo de los pacientes, mientras que el estudio que utilizó dosis más altas por corto tiempo no evidenció una diferencia significativa entre los grupos. Esto va en la misma línea que el estudio de Gerhard et al., donde el uso continuo de litio en pacientes bipolares entre 301 y 365 días se asoció con una reducción del riesgo de demencia (hazard ratio [HR]=0,77; IC95%, 0,66-0,99), mientras la exposición a litio por tiempos más cortos no tuvieron esta asociación31. Es interesante que, en la fase de extensión open-label para completar 4 años de seguimiento, Forlenza et al. notaran que 5 de 31 sujetos con DCL amnésica en el grupo de litio y 9 de 30 en el de placebo habían progresado a demencia, con lo que disminuye a casi la mitad el riesgo de transición de DCL amnésica a demencia17. De forma similar, múltiples estudios demuestran una disminución del riesgo de demencia en personas con trastorno bipolar tratadas con litio durante tiempos de exposición prolongados como tratamiento estándar de la enfermedad32. Sin embargo, se debe tener en cuenta que el estudio de Forlenza et al. no alcanzó el tamaño de muestra propuesto (n=80) desde el comienzo del estudio y que los pacientes del grupo de placebo eran levemente mayores (74,4 frente a 71,2 años)17.
En cuanto a la dosis más adecuada, Duthie et al. determinaron en 2019 que las dosis de litio para bloquear la GSK-3 en pacientes con DCL estarían entre 0,33 y 0,54 mEq/l, similares a la utilizada en el estudio de Forlenza (0,25-0,5 mEq/l), pero diferentes de las utilizadas en los demás estudios incluidos. Sin embargo, este estudio no logró el resultado deseado de establecer un panel de biomarcadores para GSK-3 que pudiera utilizarse para rastrear la enfermedad temprana o la respuesta al fármaco33. No obstante, esta es aún una pregunta que está por resolverse pues, como se ha visto en estudios poblacionales y se encontró en el estudio de Nunes et al., dosis más bajas de litio, incluso las encontradas en agua potable, se han asociado significativamente con disminución del riesgo de demencia34,35.
Por otra parte, actualmente no existen estudios frente a frente que comparen la eficacia terapéutica de los inhibidores de las colinesterasas (ICH) y el litio en el tratamiento de pacientes con DCL o demencia por EA. En un reciente metanálisis que incluyó 41 ECCA, los ICH mostraron superioridad comparados con placebo, con un tamaño de efecto entre leve y moderado en demencia por EA leve a moderada (galantamina 32mg/día, SMD=–0,51; IC95%, –0,67 a –0,35; galantamina 24mg/día, SMD=–0,50; IC95%, –0,61 a –0,40; donepezilo 10mg/día, SMD=–0,40; IC95%, –0,51 a –0,29) y un tamaño de efecto aun mayor al combinarse con memantina en etapas moderadas a graves (memantina 20mg+donepezilo 10mg, SMD=0,76; IC95%, 0,39-1,11)4. Estos hallazgos respaldan la administración de ICH en etapas leves a moderadas de la demencia por EA con un buen tamaño de efecto y una mejor evidencia que la actual para el tratamiento con litio, donde aún los estudios son escasos y no se encontró un efecto significativo (DME=–0,51; IC95%, –1,03 a 0,01; I2=55%). Sin embargo, los ICH en DCL y etapas preclínicas de la enfermedad continua en controversia. Un metanálisis reciente de Matsunaga et al., que incluyó 14 ECA sobre los ICH en la DCL, encontró que no producían un beneficio significativo en las medidas de cognición, pero sí una menor incidencia de progresión a demencia comparados con placebo (RR=0,76; IC95%, 0,66-0,88)36. Este hallazgo es comparable con los del estudio de Forlenza et al., donde se evidenció una importante disminución del riesgo de conversión a demencia en un seguimiento a 4 años37.
Tolerancia y seguridadDe los estudios incluidos, solo el de Hampel et al. reportó directamente el análisis de seguridad, mientras que el análisis de seguridad del estudio de Forlenza et al. se publicó en una extensión de Aprahamiam et al.28. En el estudio de Nunes et al., no se describen efectos adversos durante su estudio, pero los autores afirman que, luego de 15 meses de tratamiento con microdosis de litio, los pacientes no sufrieron efectos tóxicos ni disfunción renal ni tiroidea20. En el estudio de Hampel et al., los efectos adversos más frecuentes relacionados con la intervención fueron trastornos gastrointestinales, temblor, náuseas, hipopotasemia e hiperhidrosis; solo los síntomas gastrointestinales fueron significativamente mayores en el grupo de litio que en el grupo de placebo (p=0,01). Por otra parte, el análisis de seguridad del estudio de Forlenza et al. reportó un aumento significativo en las tasas de aumento de peso, aparición de diabetes mellitus y arritmias en los pacientes que recibieron tratamiento con litio comparados con el grupo de placebo luego de 2 años de seguimiento, sin asociación con cambios significativos en la función renal28. A diferencia de los hallazgos de Aprahaim et al., un estudio observacional38 con seguimiento a 6 años que incluyó a 110 adultos mayores en tratamiento con litio demostró, tras un análisis de regresión múltiple controlado por edad y sexo, un efecto significativo entre la duración del tratamiento y la tasa de filtrado glomerular de estos pacientes, que presentaron un declive anual acelerado de 2,3ml/min/1,73 m2. Asimismo, un estudio transversal que incluyó a 2.480 pacientes tratados con litio de edad ≥ 70 años encontró que la toma de litio> 2 años es uno de los factores independientes asociados con enfermedad renal crónica, junto con hipertensión arterial, diabetes mellitus y cardiopatía isquémica39.
Así, en los estudios incluidos para el metanálisis de desenlaces de seguridad, no se encontraron diferencias significativas en la aparición de efectos adversos entre el grupo de litio y el de placebo (RR=1,29; IC95%, 0,83-2,03; I2=0%). Sin embargo, el hecho de que el estudio de Nunes et al. no reportaran un análisis de seguridad completo puede haber subestimado este desenlace20. De igual forma, por los hallazgos de estudios anteriores en adultos mayores usuarios de litio, es necesario continuar considerando la necesidad de una estrecha vigilancia de este tratamiento y ampliar la evidencia sobre su seguridad, pues puede asociarse con una mayor incidencia de enfermedad renal crónica, aumento de peso, diabetes mellitus y arritmias, lo cual podría empeorar el curso del funcionamiento cognitivo de estos pacientes40.
Biomarcadores de la EA en líquido cefalorraquídeo durante el tratamiento con litioEn los estudios incluidos para el análisis, no se encontraron diferencias entre las concentraciones de Aβ1-42 en líquido cefalorraquídeo del grupo con litio y el de placebo (MD, –30,05; –94,57; 34,47; I2=0). Tampoco se encontraron diferencias significativas entre ambos grupos en la concentración de la proteína tau fosforilada (MD, 4,35; –21,11; 29,81; I2=72%). Aun cuando se ha demostrado una acción relevante del litio en la neuropatología de la EA, al disminuir la acumulación del betaamiloide y la fosforilación de la proteína tau13,15, este efecto no parece reflejarse aun en el desenlace clínico de los pacientes, pero se debe tener en cuenta varios aspectos.
Por ejemplo, tras 3 años de tratamiento en el estudio de Forlenza et al., se encontró un patrón distintivo de cambio en los biomarcadores del líquido cefalorraquídeo: los pacientes del grupo de litio tuvieron un aumento estadísticamente significativo del 30% en las concentraciones de Aβ1-42, probablemente asociado con la exposición prolongada a la intervención, pues este cambio no se había notado a los 12 meses de seguimiento17. Así, se ha señalado que la exposición prolongada, al igual que se ha documentado en el riesgo de demencia, podría promover mecanismos relacionados con la eliminación del péptido Aβ del cerebro12. En cambio, la disminución de las concentraciones de tau fosforilado en el líquido cefalorraquídeo inducida por el litio después de 12 meses de tratamiento no se mantuvo a los 36 meses17. No obstante, de confirmarse estos hallazgos, se podría justificar el tratamiento crónico con litio a bajas dosis para promover la eliminación de amiloide.
Por otra parte, es importante considerar otros biomarcadores de interés para futuras investigaciones. En un subconjunto de la muestra del estudio de Hampel et al. en el que se evaluó la influencia de litio en la concentración sérica de BDNF, se encontró que los pacientes con demencia por EA tratados con litio tuvieron un aumento significativo de la concentración sérica de BDNF junto con una disminición significativa de la suma de la ADAS-Cog. La disminución del deterioro cognitivo se correlacionó inversamente con la concentración sérica de litio19.
LimitacionesLa interpretación de esta revisión sistemática y metanálisis debe tener en cuenta varias limitaciones, empezando por el bajo número de estudios y participantes incluidos, además de la heterogeneidad y un alto riesgo de sesgos general. Solo uno de los estudios incluyo a pacientes con DCL amnésica, mientras que 2 incluyeron a pacientes con diagnóstico de demencia por EA pero con amplias diferencias metodológicas entre ellos (dosis de litio, duración del estudio, medición de la función cognitiva, etc.)19,20. Además, hay una extensa heterogeinedad entre los participantes de los estudios, no solo circunscrita a la considerada a priori entre los pacientes con DCL y demencia, sino también entre los pacientes con diagnóstico de demencia valorados en los estudios de Hampel et al. y Nunes et al. Una limitación adicional es que en esta revisión sistemática se consideró la DCL amnésica como sinónimo de DLC por EA, lo que podría significar que algunos pacientes no tuviesen una EA subyacente41.
Otra limitación es que no se logró realizar un análisis del funcionamiento diario de los participantes, pues solo 1 estudio evaluó este desenlace. Una limitación adicional es la imposibilidad de realizar un funnel plot por el escaso número de estudios incluidos. Por otra parte, hay una limitación de información al no poderse recabar los datos brutos de los biomarcadores del estudio de Forlenza et al. en el seguimiento a 2 años.
Recomendaciones para estudios futurosLas demencias o trastornos neurocognitivos mayores son actualmente uno de los desafíos de la medicina y la salud pública. Con los actuales criterios diagnósticos de la EA, el reconocimiento de esta puede hacerse en etapas más tempranas, lo que posibilita intervenciones precoces dirigidas a la enfermedad. Conociendo los potenciales beneficios neuroprotectores del litio vistos en estudios con animales, pacientes con trastorno afectivo bipolar y población general, el tratamiento con sales de litio podría encontrar aquí un nicho en estudios de prevención.
Por otra parte, para los pacientes que ya tienen DCL amnésica o demencia por EA instauradas, los ensayos clínicos se podrían beneficiar de garantizar un tiempo de seguimiento suficiente (mínimo 6 meses), aplicar una dosis estandarizada a través de la concentración plasmática de litio y definir la evaluación del desempeño cognitivo con instrumentos estandarizados que más se ajusten al perfil de los pacientes con EA como el ADAS-Cog29,42. Además, dado que la demencia se refiere a un deterioro del funcionamiento habitual a expensas de fallas cognitivas, sería indispensable que se evalúe el desempeño funcional de los pacientes en actividades de la vida diaria, básicas e instrumentales para definir cómo impacta el tratamiento con litio en la vida de estas personas27. Es indispensable que se garanticen estudios frente a frente con los medicamentos actualmente aprobados para el tratamiento de la demencia por EA.
Dado que el litio se ha utilizado ampliamente en trastornos psiquiátricos por sus propiedades de estabilización afectiva, se esperaría que este tipo de desenlaces se hubiesen considerado en todos los estudios incluidos. Sin embargo, solo el estudio de Hampel et al. reportó la medición de síntomas neuropsiquiátricos (depresión/disforia) según el NPI, sin que se demostrase un cambio significativo entre los grupos19. Para estudios futuros, debería garantizarse la medición de síntomas neuropsiquiátricos en estos pacientes, ya que el litio se ha demostrado útil como estabilizador de ánimo en personas con trastorno afectivo bipolar, pero en el tratamiento de síntomas neuropsiquiátricos de la demencia por EA es aún un campo abierto de investigación43.
ConclusionesEl deterioro cognitivo y funcional de las personas con EA sigue siendo hasta la fecha uno de los retos más importantes de la práctica clínica neuropsiquiátrica. Según los estudios analizados en esta revisión sistemática y metanálisis, la evidencia actual es insuficiente para concluir un efecto positivo del litio como tratamiento del deterioro cognitivo en la DCL o la demencia por EA. Sin embargo, pueden estar justificadas futuras investigaciones que aborden el litio como tratamiento modificador de la enfermedad, no solo para evaluar su eficacia en la demencia y DCL por EA, sino también para responder en qué momento y con qué dosis podría ser más beneficiosa. Dada la toxicidad del litio, debe garantizarse una adecuada preselección de los pacientes y una estrecha vigilancia.