Número especial: Avances y retos en la psiquiatría regional en Latinoamérica
Más datosEl presente trabajo se plantea como objetivo recopilar la evidencia científica disponible respecto a los síndromes tardíos (ST), su fenomenología, su diagnóstico y su tratamiento. Se realizó una revisión sistemática de la literatura mediante la búsqueda en bases de datos indexadas (PsycINFO, OvidMEDLINE, PubMed, EMBASE y Scielo) de artículos publicados entre enero de 2009 y marzo de 2020. Los ST son un grupo de trastornos del movimiento causados por exposición prolongada a medicamentos bloqueadores de los receptores de dopamina (BRD). Aparecen típicamente varios meses e incluso años después de tomar la medicación y persiste al menos 1 mes tras su suspensión. Clásicamente se han descrito las discinesias orobucolinguales, pero el espectro fenomenológico es amplio e incluye distonía, corea, tics, mioclonías y acatisia, entre otros. El tratamiento está indicado cuando los síntomas interfieren con las actividades de la vida diaria. Se debe retirar el medicamento causante mientras las afecciones de base lo permitan, cambiar a otro neuroléptico o considerar el tratamiento farmacológico. En casos refractarios al tratamiento convencional, se ha demostrado la eficacia de la cirugía funcional con estimulación cerebral profunda del globo pálido para la distonía tardía, aunque con poca evidencia.
Our aim with this study was to compile the available scientific evidence on tardive syndromes, their phenomenology, diagnosis and treatment. For this, a systematic review of the literature was carried out by searching indexed databases (PsycINFO, OvidMEDLINE, PubMed, EMBASE, and Scielo), for articles published from January 2009 to March 2020. Tardive syndromes are a group of movement disorders caused by prolonged exposure to dopamine receptor blocking drugs. They typically appear several months and even years after starting the medication and persist for at least one month after discontinuing the drug. Orofacial dyskinesias have classically been described, but the phenomenological spectrum is wide, including dystonia, chorea, tics, myoclonus and akathisia. Treatment is indicated when symptoms interfere with activities of daily living, including withdrawing the offending drug, while the underlying pathologies allow it, changing to another neuroleptic, or considering pharmacological management. In cases refractory to conventional treatment, functional surgery with globus pallidus deep brain stimulation has shown efficacy for tardive dystonia, although with limited evidence.
Las discinesias tardías son un grupo de trastornos iatrogénicos del movimiento con fenomenología variable, causados por la exposición prolongada a antipsicóticos bloqueadores de los receptores de dopamina (ABRD); se describieron por primera vez alrededor de 5 años después de la introducción de estos en 1950 para el tratamiento de la esquizofrenia y otros trastornos psiquiátricos1. En 1964, Faurbye introdujo por primera vez el término discinesia tardía, y destacó la tardanza entre el inicio del fármaco causante y la aparición del movimiento anormal2, que por lo general ocurre hasta 1-2 años de la toma del medicamento y nunca antes de 3 meses (por ello, tardío)3. El término se emplea actualmente para definir cualquier trastorno del movimiento tardío, como estereotipias, acatisia, distonía, temblor, tics, mioclonías y corea, lo cual ha causado confusión en la literatura médica; por esto se considera reservar el término discinesias tardías exclusivamente para las estereotipias orobucolinguales, «discinesia tardía clásica» (DTC) y utilizar el término síndrome tardío (ST) al referirse a todos los trastornos manifestados por cualquier combinación de movimientos hipocinéticos o hipercinéticos como síntoma cardinal que puede ser fenomenológicamente diferente pero con el mismo fondo etiológico (toma prolongada de ABRD)1.
DefiniciónLos ST comprenden un amplio espectro de movimientos anormales debidos a la exposición crónica de ABRD, los cuales típicamente aparecen después de varios meses o años de la toma de la medicación y persisten al menos 1 mes tras haberla suspendido4. En el DSM-V se definen separadamente discinesia tardía, distonía tardía y acatisia tardía, con énfasis en que son movimientos involuntarios ocasionados por el consumo de un neuroléptico durante al menos unos meses, aunque también pueden aparecer tras la suspensión o después de la modificación de la dosis del medicamento. En los adultos mayores, pueden aparecer con tomas más breves. Respecto a los demás síndromes tardíos, se pueden diferenciar por su aparición tardía durante el tratamiento y su posible persistencia durante meses o años, incluso con la suspensión o disminución de la dosis de los medicamentos neurolépticos5.
Epidemiología y factores de riesgoLa prevalencia de ST está alrededor del 20-50% de todos los pacientes con exposición crónica a antipsicóticos1, con variaciones según el grupo de edad y un incremento de la incidencia en mayores de 45 años 5-6 veces la de los más jóvenes; la mayor edad se considera un factor crítico del riesgo de ST6. También son más frecuentes en mujeres, más del 30% tras la exposición acumulada de 1 año1. En la tabla 1 se muestran otros factores de riesgo3.
Factores de riesgo de síndromes tardíos3,4
| Edad avanzada (jóvenes en el caso de distonía tardía) |
| Sexo femenino |
| Población afroamericana |
| Antipsicótico típico |
| Neuroléptico a altas dosis y largo tiempo |
| Preexistencia de trastornos del ánimo |
| Deterioro cognitivo |
| Presencia de síntomas negativos |
| Toma de agentes antiparkinsonianos y litio |
| Abuso de licor y de otras sustancias psicoactivas |
| Síntomas extrapiramidales tempranos |
| Diabetes |
| Infección por virus de la inmunodeficiencia humana |
Los receptores de dopamina se clasifican con base en la genética en 5 subtipos (D1, D2, D3, D4 y D5)7. Los receptores D1 y D5 se conocían previamente como D1, y los D2, D3 y D4 estaban agrupados como D24. Los receptores D1 y D2 se encuentran principalmente en el estriado y el núcleo accumbens; pero también en la sustancia negra (SN), la amígdala, la corteza cingular y el área entorrinal, y están ausentes en el cerebelo. El lóbulo anterior de la hipófisis solo contiene D2 y en el tálamo, la corteza fuera al cíngulo y el área entorrinal solo hay D18. La afinidad de los ABRD con D2 se correlaciona con las propiedades antipsicóticas y antieméticas; además con la aparición del ST y otros trastornos del movimiento inducidos por neurolépticos4.
El receptor D3 es otro objetivo de los ABRD y se encuentra principalmente en áreas mesolímbicas; se asocia con comportamiento emocional y aparición de acatisia tardía. El receptor D4 se encuentra en la corteza frontal y el D5, en el hipocampo4.
Los antipsicóticos de primera generación o típicos (haloperidol, clorpromazina, pipotiazina, levomepromazina), tienen gran afinidad por los receptores D2, a diferencia de los de segunda o tercera generación llamados atípicos (risperidona, clozapina, quetiapina, aripiprazol, olanzapina), por lo cual con los primeros hay mayor riesgo de ST1. De los atípicos, la clozapina y la quetiapina tienen menor afinidad por los receptores D2, por lo que son menos frecuentes los efectos extrapiramidales como los ST, aunque la acción bloqueadora en D2 se incrementa con dosis altas; diferente que la olanzapina y la risperidona, también antipsicóticos atípicos, con mayor afinidad por D2, por lo cual aumentan los efectos extrapiramidales4.
Con menor frecuencia se han observado trastornos del movimiento clínicamente indistinguibles de los inducidos por ABRD con antidepresivos del tipo inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores selectivos de la recaptación de serotonina y noradrenalina (IRSN). El mecanismo por el cual se generan no es claro, pero algunos autores han planteado que las altas concentraciones de serotonina podrían inhibir las neuronas estriatales y producir un efecto antidopaminérgico similar al de los ABRD9,10. Con la melatonina, se han reportado casos de discinesia asociada a acatisia tras la interrupción de toma crónica11 (tabla 2).
Medicamentos comúnmente asociados con síndromes tardíos4
| Fenotiacinas | Clorpromazina |
| Triflupromazina | |
| Tioridazina | |
| Mesoridazina | |
| Proclorperazina | |
| Perfenazina | |
| Perazina | |
| Trifluoperazina | |
| Fluperazina | |
| Tioxantinas | Cloprotixeno |
| Tiotixeno | |
| Butiferonas | Haloperidol |
| Droperidol | |
| Difenilbutiferona | Pimozida |
| Dibenzoacepina | Loxapina |
| Dibenzodiacepina | Clozapina |
| Quetiapina | |
| Tienobenzodiacepina | Olanzapina |
| Sustituto de benzamida | Metoclopramida |
| Tiaprida | |
| Sulpirida | |
| Cleboprida | |
| Remoxiprida | |
| Veraliprida | |
| Indolonas | Molindona |
| Pirimidiona | Risperidona |
| Antidepresivos tricíclicos | Amoxapina |
| Antagonistas del calcio | Flunarizina |
| Cinarizina | |
| Inhibidores de la recaptación de serotonina e inhibidores de la recaptación de serotonina y noradrenalina | Duloxetina |
| Citalopram | |
| N-acetil-4-metoxitriptamina | Melatonina |
| Interferón alfa | Interferon alfa 2b pergilado |
Comúnmente los ST se han atribuido a la hipersensibilidad o sobrerregulación de dopamina, en particular de los receptores D2, tras la exposición crónica a ABRD; sin embargo, es poco pobable que sea la única explicación, por lo que se han propuesto diferentes hipotesis12,13.
Un movimiento normal requiere un equilibrio entre las vías directa e indirecta de los ganglios basales. La activación de la vía directa resulta en facilitación del movimiento, mientras que la activación de la indirecta resulta en reducción de la velocidad y amplitud del movimiento. Los receptores D2 expresados en el estriado son inhibidores de la vía indirecta, y una hipersensibilidad de D2 causaría hipercinesia; esta teoría se confirmaba en un modelo animal de «movimientos de masticación con boca vacía» inducidos por la exposición prolongada al haloperidol y un estudio en humanos que mostró incremento de la unión de receptores D2 en la tomografía por emisión de positrones (PET) de pacientes con exposición prolongada a los ABRD14,15.
Tambien se ha propuesto la insuficiencia de ácido gamma aminobutírico (GABA) como otro posible mecanismo, ya que se han encontrado valores de este neurotransmisor disminuidos en la SN y el globo pálido interno (Gpi) en modelos animales y en el líquido cefalorraquídeo de pacientes con ST13. Una hipótesis un poco más reciente involucra la plasticidad sináptica, en la cual el bloqueo crónico de los receptores D2 y la consecuente hipersensibilización causan una plasticidad maladaptativa en la transmisión corticoestriatal que resulta en un desequilibrio entre las vías directa e indirecta. Esta podría ser la causa de la perpetuación del movimiento anormal a pesar de la interrupción del ABRD, debido a la incapacidad de desaprender el programa motor mal codificado15.
Una hipótesis alternativa es el resultado de la neurodegeneración de las interneuronas estriatales por estrés oxidativo. Este se da por el bloqueo crónico de los receptores de dopamina, lo que incrementa su reposición y, en consecuencia, la generación de peróxido de hidrógeno y radicales libres, que causan neurotoxicidad13,15,16.
Fenomenología de los síndromes tardíosEl término ST se refiere a todos los trastornos manifestados por cualquier combinación de movimientos hipocinéticos o hipercinéticos, fenomenológicamente diferentes pero con el mismo fondo etiológico (toma de ABRD prolongada)1. Diferentes trastornos del movimiento hipercinéticos se han descrito como parte de los ST, pero se reserva el término «discinesia tardia clásica» a los movimientos discinéticos OBL12 y se aplica una terminología más específica basada en la fenomenología de cada subtipo (acatisia, distonía, temblor, tics y mioclonías tardías)3. Fenomenológicamente, los ST a menudo pueden ser simultáneos en un mismo paciente12.
Discinesia tardía clásicaEs el efecto adverso más común de la toma crónica de ABRD19. El principal sitio afectado es la cara, particularmente alrededor de la boca, por lo cual también se las llama discinesias OBL, caracterizadas por un patrón repetitivo, coordinado, rítmico y estereotipado de movimientos complejos de masticación, en ocasiones con chasquido y apertura de boca, protrusión de la lengua, fruncimiento de labios y movimientos de succión4. El paciente voluntariamente los suprime rápidamente al masticar o hablar3,4. La afección de las extremidades se limita a la parte distal, con movimientos repetitivos lentos de los dedos de las manos que semejan tocar el piano o la guitarra y golpeteo de los pies. Cuando se afectan el diafragma y los músculos respiratorios, pueden resultar una respiración ruidosa, hiperventilación, gruñido o distorsión del habla12.
Distonía tardíaLa distonía es un movimiento involuntario caracterizado por la contracción persistente de músculos antagonistas que afecta a una o más partes del cuerpo y causa frecuentes movimiento repetitivos y posturas anormales. La DT tiene una prevalencia de un 2-16% de los pacientes en tratamiento con antipsicóticos, predomina en jóvenes y afecta por igual a ambos sexos3. La fenomenología de la DT puede ser indistinguible de la idiopática, hasta la mejoría con trucos sensoriales4. Puede ser focal, segmentaria o generalizada, y a menudo coexiste con otros ST12. Afectan principalmente a los músculos faciales (blefaroespasmo, movimientos oculogiros, protrusión de lengua, distonía oromandibular en cierre o apertura de boca y retracción de labios) y del cuello (especialmente retrocolis), pero también a los del tronco (hiperextensión que resulta en opistótonos) y las extremidades (rotación interna del brazo, extensión de codos y flexión de muñeca)4,12.
Acatisia tardíaLa acatisia es un síndrome de inquietud motora consistente en una sensación subjetiva de incomodidad muscular, malestar y necesidad de moverse asociado con disforia, que puede llegar a ser incapacitante y puede aparecer espontáneamenet por la exposición prolongada a ABRD o coincidir con el incremento de dosis o el cambio a un ABRD más potente17,18. Estos pacientes tienen movimientos repetitivos estereotipados sin aparente propósito e intermitentes, tales como cruzar y descruzar los brazos, balancear las piernas, tocarse repetitivamente la cara y el cuero cabelludo, cambiar el peso corporal de un pie a otro mientras están parados o caminar de lado a lado1. Presentan alivio al moverse y, por el contrario, empeoran al quedarse quietos18.
Síndrome emergente por retiradaCondición clásicamente descrita en niños y adolescentes que, al retirárseles abruptamente los antipsicóticos tras toma prolongada, presentan movimientos coreicos generalizados que involucran sobre todo a las extremidades, el cuello y el tronco. A diferencia de la DTC, rara vez afecta al tercio inferior de la cara y tiene un curso autolimitado a semanas o meses tras la suspensión de los ABRD4. Todos los pacientes mejoran del síndrome: el 67,1% sin medicación y el 31,2% al reiniciar el antipsicótico19. Por ser una entidad autolimitada, frecuentemente no requiere tratamiento pero, para una recuperación más rápida o si el trastorno del movimiento es muy incómodo para el paciente, el ABRD puede reiniciarse y después se debe llevar a cabo una retirada gradual1.
Touretismo tardíoComplicación rara de la toma crónica de antipsicóticos caracterizada por múltiples tics tanto motores como verbales. También se ha reportado con la toma de anticonvulsivos, antidepresivos y estimulantes (metilfenidato)20. Clínicamente, los tics tardíos son indistinguibles de los observados en el síndrome de Tourette, pero la edad de inicio suele ser mucho más avanzada1.
Mioclonías tardíasLas mioclonías son contracciones abruptas, vigorosas, repetitivas e involuntarias de un grupo muscular axial o apendicular que pueden ser sincrónicas o asincrónicas. Las mioclonías tardías son poco frecuentes, típicamente son posturales espontáneas o sensibles a estímulos y afectan a las extremidades superiores12.
Síndrome del conejoSe caracteriza por movimientos involuntarios, rítmicos, finos y rápidos de los músculos orales y masticatorios a lo largo de un eje vertical, respetando siempre la lengua, que reproduce los movimientos de masticación del conejo21,22.
Temblor tardíoMovimientos oscilatorios rítmicos que típicamente involucran a todas las extremidades, tanto posturales como en reposo, de alta amplitud y con una frecuencia de 3-5 Hz, sin relación con signos parkinsonianos3,12. Aparece durante la exposición crónica a los ABRD y puede agravarse y/o persistir después de interrumpirlos. Responde marcadamente al tratamiento con tetrabenazina23.
Parkinsonismo tardíoEl bloqueo de los receptores de dopamina, ya sea por medicamentos antagonistas o consumidores de dopamina (tetrabenazina), puede semejar una enfermedad de Parkinson. Todos los ABRD pueden inducir parkinsonismo, pero es excepcional con clozapina y quetiapina a dosis altas. El parkinsonismo inducido por neurolépticos típicamente es reversible cuando la medicación se reduce o se suspende, aunque puede tomar varios meses, incluso más de 18 meses4. El parkinsonismo tardío es una entidad en controversia, y para algunos autores es cuestionable1,3. Los síntomas parkinsonianos (bradicinesia, rigidez y temblor en reposo) pueden persistir varios meses, años o indefinidamente después del cese de la terapia con ABRD. En algunos pacientes con parkinsonismo clínico que no mejoraron tras la suspensión de la medicación, se encontró déficit presináptico de dopamina evidenciado en la redución de la densidad del transportador de dopamina (DAT) en la tomografía computarizada por emisión monofotónica (SPECT) con 123I-ioflupano, lo cual indica enfermedad de Parkinson que se desenmascaró o se volvió sintomática tras la exposición a los ABRD1.
Por esta razón, son 3 los posibles contextos en el parkinsonismo relacionado con exposición a ABRD: a) parkinsonismo presente durante la exposición a los ABRD que se resuelve semanas después de interrumpirla (parkinsonismo inducido por medicamentos); b) parkinsonismo que persiste indefinidamente tras interrumpir el ABRD con DAT-SPECT anormal (enfermedad de Parkinson desenmascarada por la toma de ABRD), y c) parkinsonismo durante el tratamiento con ABRD que persiste años después de su suspensión con DAT-SPECT normal (parkinsonismo tardío). Los anticolinérgicos pueden ser efectivos para reducir la intensidad del parkinsonismo inducido por ABRD, mientras que la medicación dopaminérgica (levodopa, agonistas dopaminérgicos, apomorfina) que actúan en receptores dopaminérgicos es ineficaz, probablemente porque no puede desplazar al ABRD que se encuentra unido al receptor4.
Diagnósticos diferencialesLa aparición de discinecias en pacientes con enfermedad psiquiátrica suele atribuirse la toma de neurolépticos, pero también se han observado casos de discinecias OBL en quienes nunca se han expuesto a estos agentes. La prevalencia de las discinecias OBL espontáneas es alrededor del 3,7%, con mayor frecuencia en pacientes con dispositivos dentales mal adaptados, dolor en la cavidad oral y mala higiene dental4.
Las discinecias pueden producirse en varias enfermedades. Se han descrito algunas claves que pueden ayudar a sospechar un diagnóstico alternativo, como: a) un deterioro rápido; b) constante unilateralidad; c) presencia de otros signos neurológicos, como demencia, anormalidades sensitivas o incontinencia urinaria, y d) otros signos y síntomas al examen físico como fiebre, ictericia, etc.3.
DiscusiónLos ST comprenden un amplio espectro de movimientos anormales debido a la exposición crónica a ABRD. Aparecen típicamente después de varios meses o años de tomar la medicación y pueden persistir al menos 1 mes después suspender el fármaco causante.
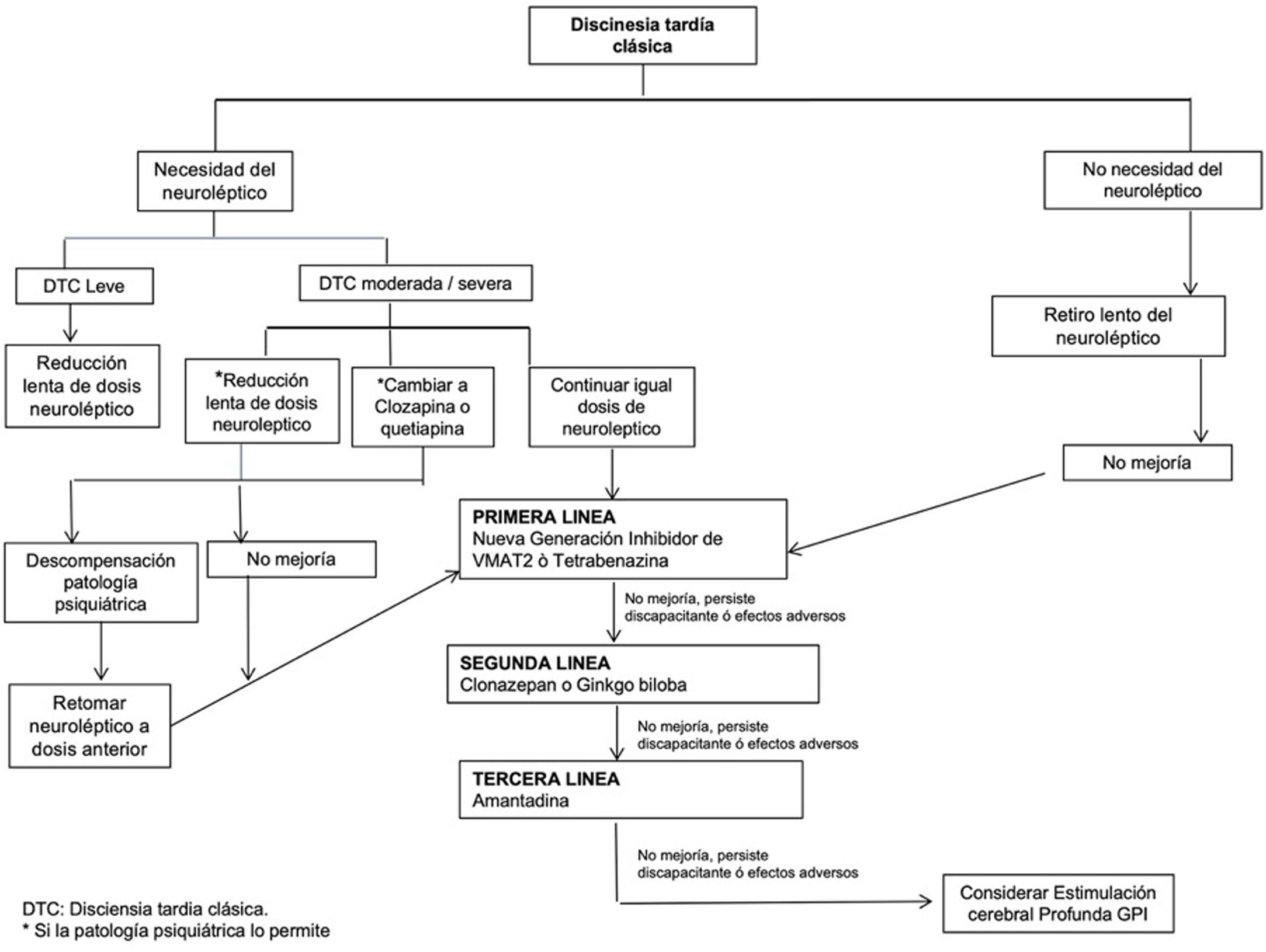
Una vez se identifica el ST, la reducción o interrupción del agente etiológico se debe considerar seriamente3,12, puesto que es mayor la probabilidad de remisión24. Desafortunadamente en la mayoría de los casos, estos medicamentos son el mejor tratamiento para muchos trastornos psiquiátricos y está indicada la prescripción a largo plazo, y reducir la dosis a la menor efectiva generalmente es el siguiente paso recomendado3. Algunos clínicos han recomendado los anticolinérgicos como profilaxis para reacciones extrapiramidales y ST en pacientes con ABRD crónicos, práctica que puede empeorar el estado cognitivo de pacientes con esquizofrenia25, por lo cual no se debe fomentar. Además, no se ha demostrado que estos medicamentos reduzcan la incidencia de ST, pero sí pueden empeorar los síntomas de las discinesias OBL ya establecidas12 (fig. 1).
Los antipsicóticos de primera generación o típicos tienen gran afinidad por los receptores D2, por lo cual implican mayor riesgo de ST. Por otra parte, los antipsicóticos atípicos son menos propensos a inducir efectos adversos extrapiramidales como los ST, ya que tienen menor afinidad por los receptores D2, aunque la acción bloqueadora en D2 se incrementa con dosis altas. La clozapina y la quetiapina son fuertes candidatos para este grupo y un poco menos la olanzapina y la risperidona4,13. Estos medicamentos se han utilizado en el tratamiento de ST, con eficacia y seguridad desconocida a largo plazo, por lo cual no se consideran como un agente terapéutico adecuado. A pesar de esto en pacientes con enfermedad psiquiátrica que no pueden suspender el neuroléptico, el cambio a un antipsicótico atípico u otro menos potente puede ser de ayuda13, pero con evidencia insuficiente que lo respalde o lo contraindique26.
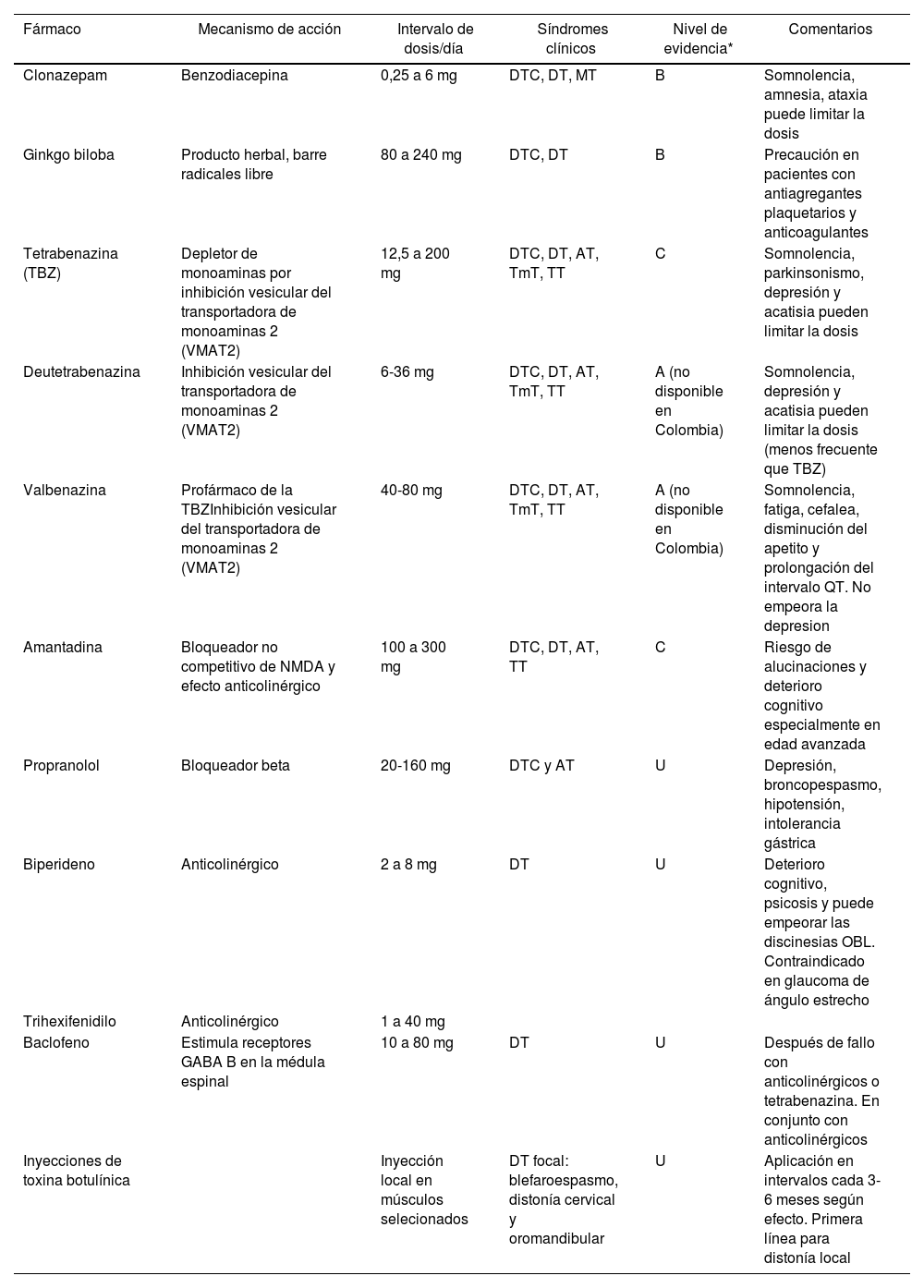
En la tabla 3 se describen los principales medicamentos descritos para el tratamiento sintomático de los ST con su nivel de evidencia26,27.
Fármacos para el tratamiento de los síndromes tardíos28,32,34,35
| Fármaco | Mecanismo de acción | Intervalo de dosis/día | Síndromes clínicos | Nivel de evidencia* | Comentarios |
|---|---|---|---|---|---|
| Clonazepam | Benzodiacepina | 0,25 a 6 mg | DTC, DT, MT | B | Somnolencia, amnesia, ataxia puede limitar la dosis |
| Ginkgo biloba | Producto herbal, barre radicales libre | 80 a 240 mg | DTC, DT | B | Precaución en pacientes con antiagregantes plaquetarios y anticoagulantes |
| Tetrabenazina (TBZ) | Depletor de monoaminas por inhibición vesicular del transportadora de monoaminas 2 (VMAT2) | 12,5 a 200 mg | DTC, DT, AT, TmT, TT | C | Somnolencia, parkinsonismo, depresión y acatisia pueden limitar la dosis |
| Deutetrabenazina | Inhibición vesicular del transportadora de monoaminas 2 (VMAT2) | 6-36 mg | DTC, DT, AT, TmT, TT | A (no disponible en Colombia) | Somnolencia, depresión y acatisia pueden limitar la dosis (menos frecuente que TBZ) |
| Valbenazina | Profármaco de la TBZInhibición vesicular del transportadora de monoaminas 2 (VMAT2) | 40-80 mg | DTC, DT, AT, TmT, TT | A (no disponible en Colombia) | Somnolencia, fatiga, cefalea, disminución del apetito y prolongación del intervalo QT. No empeora la depresion |
| Amantadina | Bloqueador no competitivo de NMDA y efecto anticolinérgico | 100 a 300 mg | DTC, DT, AT, TT | C | Riesgo de alucinaciones y deterioro cognitivo especialmente en edad avanzada |
| Propranolol | Bloqueador beta | 20-160 mg | DTC y AT | U | Depresión, broncopespasmo, hipotensión, intolerancia gástrica |
| Biperideno | Anticolinérgico | 2 a 8 mg | DT | U | Deterioro cognitivo, psicosis y puede empeorar las discinesias OBL. Contraindicado en glaucoma de ángulo estrecho |
| Trihexifenidilo | Anticolinérgico | 1 a 40 mg | |||
| Baclofeno | Estimula receptores GABA B en la médula espinal | 10 a 80 mg | DT | U | Después de fallo con anticolinérgicos o tetrabenazina. En conjunto con anticolinérgicos |
| Inyecciones de toxina botulínica | Inyección local en músculos selecionados | DT focal: blefaroespasmo, distonía cervical y oromandibular | U | Aplicación en intervalos cada 3-6 meses según efecto. Primera línea para distonía local |
AT: acatisia tardía; DT: distonía tardia; DTC: discinesia tardía clásica; MT: mioclonías tardías; TmT: tourettismo tardío; TT: temblor tardío.
Los ST son trastornos iatrogénicos secundarios a la exposición a ABRD, por lo que el mejor tratamiento es la prevención3. Los pacientes deben ser informados acerca del inherente riesgo de sufrirlos y cuando se prescribe esta medicación se debe evaluar periódicamente la necesidad de mantenerlos12. Una vez se identifica el ST, se debe considerar seriamente reducir o interrumpir el agente etiológico3,12, ya que es mayor la probabilidad de remisión24. Por desgracia, en la mayoría de los casos estos medicamentos son el mejor tratamiento para muchos trastornos psiquiátricos y están indicados a largo plazo. La reducción de la dosis a la menor efectiva generalmente es el siguiente paso recomendado3.
En cuanto al tratamiento farmacológico, los anticolinérgicos como profilaxis para reacciones extrapiramidales y ST en pacientes ABRD crónicos puede tener efectos cognitivos deletéreos, no influye en la incidencia de ST y puede empeorar los síntomas de las discinesias OBL ya establecidas. En algunas ocasiones es necesaria la combinación de anticolinérgicos y medicamentos depletores de dopamina (TBZ). Con clonazepam también se ha reportado beneficio, especialmente en distonías con predominio de síntomas bucolinguomandibulares23. El baclofeno suele reservarse para cuando fallan los anticolinérgicos y la TBZ y puede utilizarse como terapia adjunta12. La aplicación local de toxina botulínica tipo A tiene una efectividad establecida en distonías focales primarias tales como blefaroespasmo y tortícolis23, por lo cual también se ha considerado su utilidad en la DT, pues se ha encontrado una respuesta similar1.
Respecto a otras opciones terapéuticas, se han publicado multiples estudios acerca de la intervención quirúrgica en pacientes con ST, especialmente en DT con un grado de mejoría similar a los pacientes con distonía generalizada DYT-1 positivo20. El objetivo quirúrgico tanto para lesión como para estimulación cerebral profunda (ECP) es el GPi3,28. A pesar de esto, la evidencia de ECP GPi para DTC es de posible eficacia (nivel de evidencia C) y para DT sigue siendo insuficiente (nivel de evidencia U)27.
En lo concerniente al pronóstico, se ha reportado una amplia variabilidad en las tasas de remisión (1-62%); se han identificado multiples factores asociados con la resolución o disminución de los síntomas, los cuales dependen de la edad del paciente, el diagnóstico psiquiátrico, el curso de la enfermedad psiquiátrica y el tiempo de exposición al ABRD13. Los principales factores asociados con la persistencia del ST son la edad avanzada y las discinesias OBL. Con frecuencia los síntomas son leves y no lo bastante molestos para el paciente, por lo que en ocasiones son los familiares quienes se perturban29.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.