Las lesiones del cartílago articular son una de las principales causas de atención en los sistemas de salud y se han convertido en un problema real de salud pública, especialmente en países en los cuales la esperanza de vida y, consecuentemente, la patología articular han incrementado. El cartílago articular es un tejido altamente especializado que proporciona una superficie de unión en el extremo final de las articulaciones de los huesos que forman el cartílago. El único tipo celular del cartílago articular es el condrocito, el cual es una célula altamente diferenciada que tiene capacidad limitada de proliferación y migración, además de carecer de aporte sanguíneo, tejido nervioso y vasos linfáticos, lo que condiciona un bajo potencial de reparación. Las lesiones de cartílago articular generalmente conducen a degeneración progresiva de las articulaciones. A pesar de los grandes avances en ciencias básicas, ingeniería genética y de tejidos, estas lesiones siguen siendo un problema complejo ya que en la actualidad no existe ningún tratamiento que garantice plenamente resultados satisfactorios en el paciente a medio y largo plazos. El implante de condrocitos autólogos (ICA) es una opción terapéutica prometedora y eficaz para el manejo de lesiones del cartílago hialino, con buenos y, principalmente, duraderos resultados funcionales en el momento de compararlo con otras opciones terapéuticas. La obtención y expansión de condrocitos humanos son procedimientos iniciales para el posterior ICA, lo cual proveería de una fuente de reemplazo articular y regenerativa que evitaría la incapacidad de pacientes con lesiones condrales.
Nivel de evidencia clínicaNivel IV
Articular cartilage injuries are one of the major causes of care in health systems, becoming a real public health problem, especially in countries where life expectancy and consequently joint pathology have increased. Articular cartilage is a highly specialized tissue that covers the articular surfaces of the bones forming a joint. The only cell type within cartilage is the chondrocyte, which is a highly differentiated cell that has a limited capacity for proliferation and migration; in addition the chondrocyte lacks a blood, nerve and lymph supply, and therefore has poor repair potential. Articular cartilage injuries usually lead to progressive joint degeneration. Despite the great advances in basic science, tissue engineering and gene therapy these lesions remain being a complex problem, because currently there is no treatment that achieves satisfactory outcomes at medium and long term. Autologous chondrocyte implantation (ACI) is a promising and effective treatment option for the management of hyaline cartilage injuries with a long-lasting good functional outcomes compared with other treatment options. The obtainment and expansion of human chondrocytes are the initial procedures for the subsequent ACI, which will provide a source of joint replacement avoiding the disability that causes chondral damage.
Evidence levelIV
Las lesiones del cartílago articular son, actualmente, una de las principales causas de atención en los sistemas de salud a nivel mundial y se han convertido en un problema real de salud pública, especialmente en países en que la esperanza de vida se ha incrementado y consecuentemente la patología articular ha aumentado. Si a lo anterior añadimos el hecho de que la actividad deportiva regular se ha convertido en una constante entre ciertos grupos poblacionales desde etapas tempranas de la niñez hasta la población adulta, no es de extrañar que la patología articular de tipo traumático o por microtraumatismo repetitivo se añada a la patología degenerativa predominante hasta hace algunos años1.
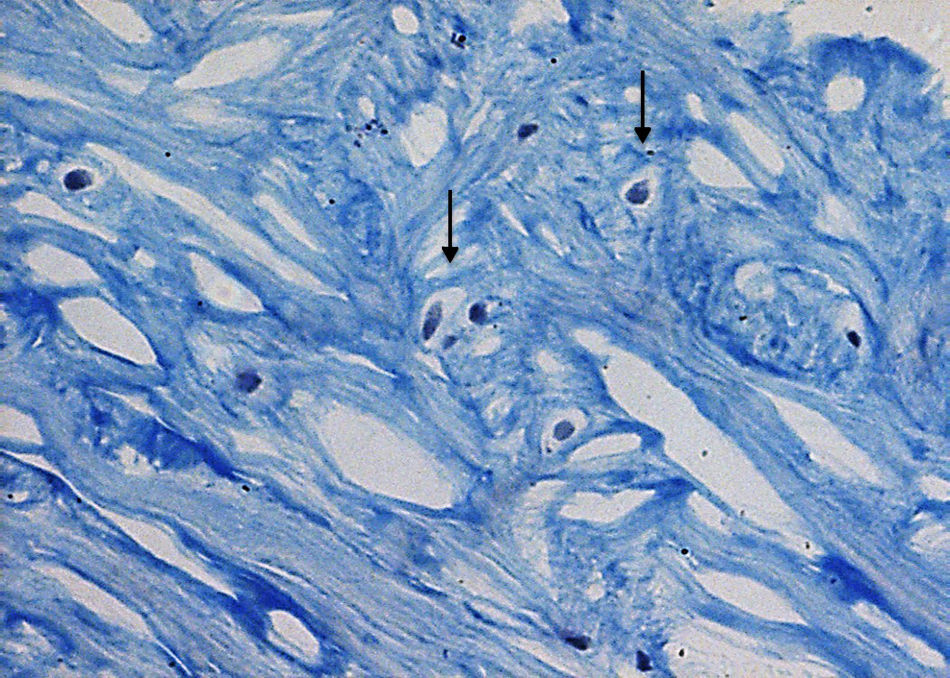
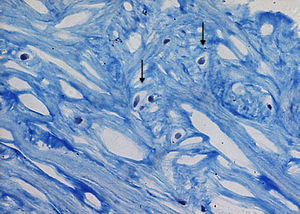
El cartílago articular es un tejido altamente especializado que sirve para proporcionar una superficie de unión y de fricción en el extremo final de las articulaciones de los huesos que forman el cartílago2. El único tipo celular del cartílago articular es el condrocito, el cual es una célula altamente diferenciada que tiene capacidad limitada de proliferación y migración al estar encerrado dentro del tejido (fig. 1), así como para aumentar la síntesis de matriz3, además de carecer de aporte sanguíneo, tejido nervioso y vasos linfáticos, nutriéndose únicamente del líquido sinovial, lo que condiciona un bajo potencial de reparación2.
El cartílago articular, por su propia naturaleza y en respuesta a demandas funcionales, puede acomodar cargas de impacto únicas o múltiples moderadas, pero una fuerza única excesiva de alto impacto puede causar daño al cartílago sin romper la superficie, lo que puede provocar la muerte de condrocitos, daño en la matriz, fisuras en la superficie, daño del hueso subyacente y engrosamiento de la región de la «marca de agua». A cierto umbral de carga de impacto, el cartílago puede ser separado del hueso subcondral antes que se produzca la lesión ósea masiva3.
El principal componente estructural del cartílago articular es el colágeno y se encuentran al menos cinco diferentes tipos de éste (II, VI, IX, X y XI), siendo el 80 a 90% colágeno tipo II. Cada uno de los tipos de colágeno contribuye a la composición del cartílago y le da su forma, resistencia y rigidez a la tracción. Aunque el colágeno tipo II es el más abundante y es el responsable primario de la fuerza extensible y forma del cartílago, la función de los demás no resulta nada despreciable. El colágeno tipo VI es considerado el responsable de la unión de los condrocitos a la matriz, el tipo IX es el encargado de la unión de las fibras de colágeno entre sí y el tipo XI asiste en la regulación del tamaño de las fibras4–6. Para que el cartílago funcione normalmente y proporcione protección al hueso y una superficie esencialmente sin fricción de la articulación, cada uno de estos componentes debe estar presente en las cantidades adecuadas. Los condrocitos son responsables de supervisar las concentraciones y el estado de los componentes extracelulares y mantener el equilibrio entre la síntesis y la degradación.
El cartílago articular se encuentra dividido en cuatro zonas morfológicamente distintas. La zona superficial, que contiene condrocitos aplanados y en forma de huso, que sintetizan una matriz con alto contenido de colágeno y agua, es la zona con una disposición de fibras de colágeno que proporciona una rigidez extrema a las fuerzas de tensión, además de evitar pérdida de líquido intersticial. La zona transicional, donde la función y la morfología celular son intermedias entre la anterior y la zona radial, y esta última ocupa el 95% del cartílago, con mayor contenido de proteoglicanos en la porción superior, otorgando mayor resistencia a las fuerzas de compresión. En la porción inferior de esta zona, las fibras de colágeno se encuentran dispuestas perpendicularmente al hueso subcondral, lo que facilita el anclaje a la zona más profunda, que es la zona calcificada del cartílago, que a su vez se une con el hueso subcondral y representa el frente de mineralización. Cuando se presenta una lesión o se produce artrosis, el frente de mineralización avanza y provoca adelgazamiento del cartílago articular7.
Clasificación de lesiones del cartílago articularLas lesiones del cartílago articular pueden ocurrir como resultado de impactos agudos y repetitivos, traumatismo o carga conjunta de torsión, la cual se produce durante la participación en deportes o degeneración mecánica progresiva, producto de diferentes actividades. En algunos casos, este daño de la superficie articular conduce a degeneración progresiva de las articulaciones.
Una de las clasificaciones para lesiones condrales es en relación con su profundidad. Encontramos primero las lesiones que se limitan a la zona superficial y media, luego lesiones que se extienden al hueso subcondral sin penetrar en la médula y, por último, lesiones que llegan hasta la médula5.
Además de la profundidad de la lesión, otros factores, como la edad, condiciones traumáticas o degenerativas asociadas, inestabilidad articular y predisposición genética, afectan el potencial de curación del cartílago8.
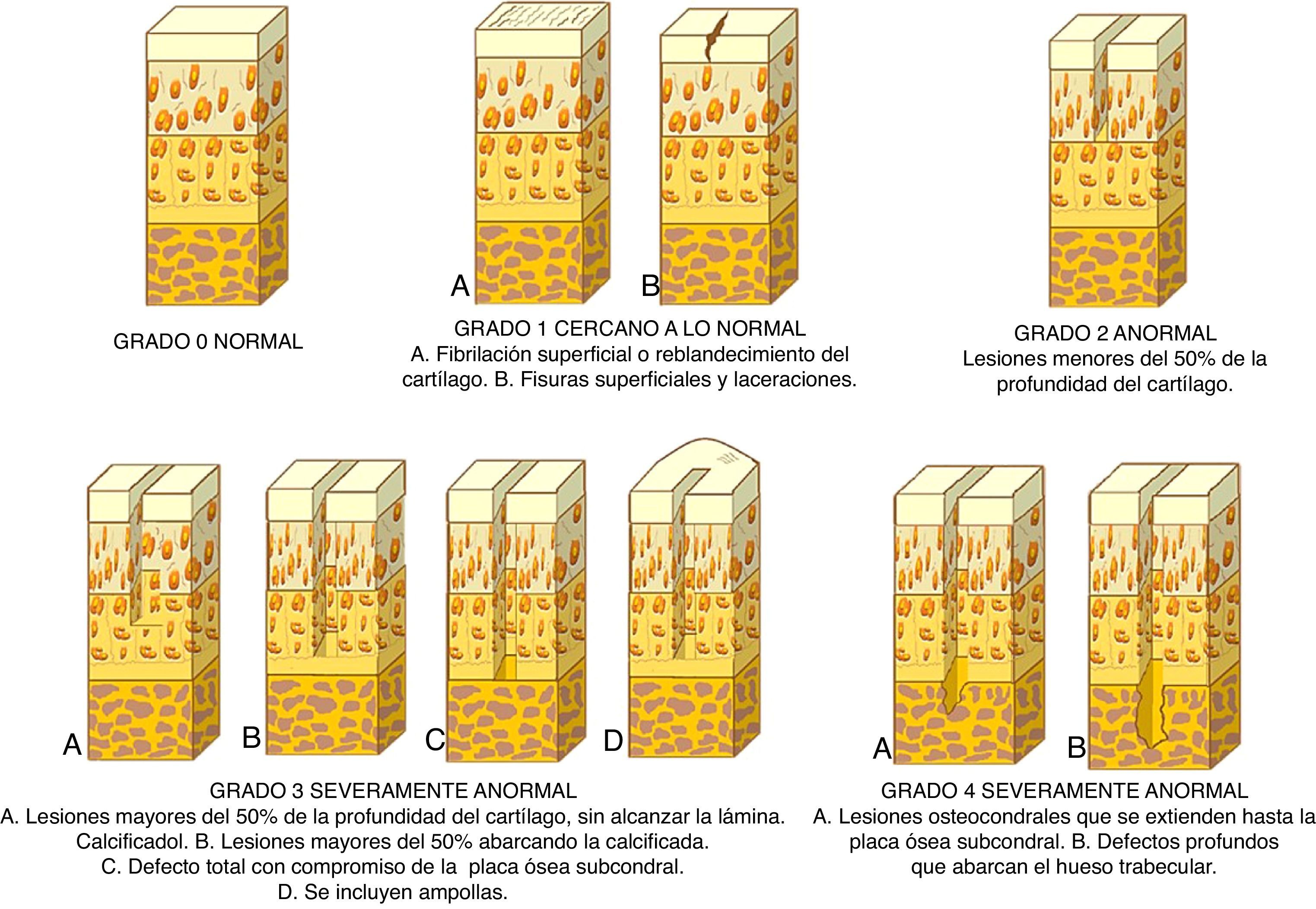
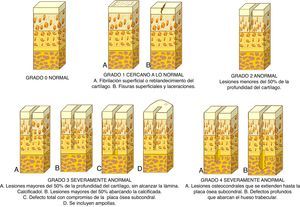
Anteriormente, la clasificación de las lesiones del cartílago articular más empleada era el sistema ideado por Outerbridge9. Sin embargo, actualmente se utiliza otra clasificación clínicamente útil en la práctica diaria para comprender la profundidad de la lesión y determinar un tratamiento adecuado y es el sistema de clasificación de la Sociedad Internacional para la Reparación del Cartílago (ICRS; fig. 2)10.
En los seres humanos, el daño al cartílago articular tiene una limitada capacidad de reparación. Dentro de los factores que limitan la respuesta del cartílago a la lesión se encuentra la falta de vasos sanguíneos, que impide la llegada de nuevas células a la zona del daño, ausencia de una población de células mesenquimatosas indiferenciadas, que evita que el cartílago inicie una respuesta de cicatrización intrínseca de la misma forma que otros tejidos y presencia de una densa matriz extracelular que evita la migración celular.
Si se tiene en cuenta que el cartílago articular es avascular, las lesiones que lo rompen sin que se presente rotura hasta el hueso subcondral tienen un potencial de reparación casi nulo. Los condrocitos suelen responder proliferando y aumentando la síntesis de macromoléculas en la matriz. Sin embargo, esa respuesta proliferativa dura poco y no suele llenar el defecto tisular, motivo por el cual en la superficie articular quedará el defecto permanente. Al contrario de lo que ocurre con las lesiones limitadas al cartílago articular, las que se extienden al hueso subcondral producen hemorragia, coágulos de fibrina y una respuesta inflamatoria11. Sin embargo, el tejido de reparación condral no tendrá una composición ni una estructura elaborada como la del cartílago articular normal ya que se forma fibrocartílago, un tipo de tejido de reparación funcional que tiene diferente composición bioquímica y propiedades biomecánicas inferiores a las del cartílago articular hialino y posiblemente llegue a degenerar12.
Además, cuando la lesión del cartílago penetra en la región subcondral vascularizada, pueden llegar células que reparen los defectos tisulares (reparación extrínseca). Sin embargo, estas células no reparan consistentemente el daño con un tejido que tenga composición, estructura y propiedades únicas de la matriz del cartílago articular normal. Sólo el cartílago entre los tejidos musculoesqueléticos principales (hueso, tejido fibroso denso y cartílago articular) tiene un marco macromolecular de matriz extracelular formado principalmente por colágeno fibrilar tipo II, proteoglicanos grandes y proteínas no colágenas específicas del cartílago.
Tratamiento de lesiones del cartílago articularEl tratamiento de lesiones condrales depende de las actividades físicas del paciente, así como de la edad, etiología, grado y calidad de la lesión. Las opciones de tratamiento varían desde conservador, hasta intervención artroscópica o procedimiento quirúrgico abierto. A pesar de los grandes avances en ciencias básicas, ingeniería genética y de tejidos, las lesiones del cartílago articular continúan siendo un problema complejo ya que en la actualidad no existe un tratamiento que garantice plenamente resultados satisfactorios en el paciente a medio y largo plazos. Los principales tratamientos son los que se citan a continuación.
Tratamiento conservadorLos tratamientos conservadores se esfuerzan en controlar los síntomas sin llegar a ofrecer una curación y/o regeneración de la lesión. Es importante mencionar que este tipo de tratamiento es considerado en casos sintomáticos leves o bien en casos con lesiones pequeñas en que la cirugía podría hacer más daño que beneficio. Dentro de este tipo de tratamientos se considera la medicación con antiinflamatorios, analgésicos, condroprotectores (glucosamina condroitina-fosfato, metilsulfonilmetano y omega 3), hormonas e inyecciones intraarticulares (esteroides y viscosuplementación); radiofrecuencia; terapia física; pérdida de peso, y uso de apoyos mecánicos como bastones, ortesis y aparatos ortopédicos para intentar retrasar la progresión de cambios degenerativos asociados. Sin embargo, a fecha de hoy no hay evidencias en que se presente una mejora estructural con estas modalidades conservadoras13.
Tratamiento quirúrgicoExiste un número considerable de procedimientos quirúrgicos para el manejo de lesiones condrales. El empleo de éstos depende de la localización del defecto, forma y profundidad, edad del paciente y nivel de actividad. El propósito de la cirugía es regenerar los defectos osteocondrales en cuanto a aspectos estructurales y biomecánicos del cartílago hialino. A grandes rasgos, los tratamientos quirúrgicos se pueden dividir en métodos reparadores, métodos reconstructivos y métodos regenerativos.
- •
Métodos reparadores. Su objetivo es ayudar a formar nuevo tejido fibrocartilaginoso y facilitar el acceso de vasos y células osteoprogenitoras. Entre ellos se describen los siguientes:
- 1.
Lavado por artroscopia. En 1935 Burman señaló que el lavado de las articulaciones sinoviales lesionadas había demostrado ser el mejor tratamiento de primera línea de lesiones condrales. Esta técnica hace desaparecer mediadores de inflamación, cartílagos sueltos y restos de colágeno que se pueden albergar en la sinovial y causar sinovitis y derrame.
- 2.
Desbridamiento. Comúnmente se ha utilizado en el tratamiento de osteoartrosis, pero también puede ser utilizado para tratar defectos condrales. Magnuson estableció esta técnica en 1941. El procedimiento utilizado consiste en la extracción de fragmentos condrales inestables, osteofitos, exceso de membrana sinovial, meniscos degenerados y ligamentos desgarrados. Aunque se ha visto que el desbridamiento facilita un alivio del dolor y la mejora de los síntomas, se puede esperar que éstos regresen con el tiempo14. Las investigaciones actuales han demostrado que los mejores candidatos para desbridamiento y lavado son los que sufren de síntomas mecánicos (sensación de captura o de bloqueo al intentar doblar o enderezar la rodilla), que pueden ser causados por un desgarro del menisco o cuerpo suelto15.
- 3.
Abrasión. Esta técnica fue popularizada en la década de 1980 por Johnson y se encuentra indicada en lesiones artríticas degenerativas sin mala alineación femorotibial o altas demandas locomotoras. El objetivo es desbridar los límites del defecto del cartílago articular para sostener un borde uniformemente contorneado de colágeno fresco, capaz de adherirse a un coágulo de fibrina. Entonces, el hueso subcondral se rompe y permite a la sangre perfundir para la formación de un coágulo de fibrina. Sin embargo, los resultados de la abrasión no exhiben una regeneración.
- 4.
Microfracturas. Steadman et al. propusieron esta técnica, en la cual se crean perforaciones de 3-4mm de distancia, que tienen como finalidad estimular la médula ósea con la intención de promover la formación de un coágulo de células mesenquimatosas provenientes de la médula, las cuales repararían el defecto condral subyacente. Esta técnica se realiza por artroscopia y una de sus ventajas es que es relativamente sencilla, con buena relación entre coste y beneficio y principalmente no interfiere con futuros procedimientos. El resultado típico es el llenado parcial de la lesión con fibrocartílago (principalmente colágeno tipo I), el cual muestra reducción en su dureza y resistencia cuando se compara con cartílago hialino (principalmente colágeno tipo II)16. Los resultados clínicos de microfracturas dependen en gran medida de la edad del paciente y del tamaño del defecto del cartílago16.
- 1.
- •
Métodos reconstructivos. Buscan rellenar el defecto con tejido autólogo o aloinjertos, combinando la artroscopia con miniartrotomía, como los siguientes:
- 1.
Trasplante de aloinjerto osteocondral. Implica el implante de un injerto osteocondral de cadáver en el defecto del cartílago. En esta técnica se realiza una pequeña artrotomía para exponer el defecto del cartílago y se hace coincidir en el contorno del defecto un tapón de aloinjerto osteocondral. Este procedimiento se utiliza para defectos del cartílago medianos y grandes.
- 2.
Mosaicoplastia. Hangody et al. desarrollaron la técnica de mosaicoplastia, denominada también trasplante osteocondral autólogo; esta técnica es un procedimiento artroscópico que emplea cilindros de 5 a 12mm de diámetro y de 15 a 20mm de longitud, cosechados de áreas de no carga de las articulaciones para tratar defectos de tamaño pequeño y mediano. Al ser cartílago hialino, el implantado no requiere ningún proceso de maduración y, tan pronto como se implanta, adopta las propiedades biomecánicas del entorno. Las desventajas son principalmente la enfermedad del sitio donador que depende del número y el tamaño de los cilindros tomados además del hecho de que en algunas ocasiones no se consigue integración de la porción cartilaginosa del implante. Los autores que concibieron la técnica sugirieron que podría ser indicado para defectos osteocondrales de 1 a 4cm2. Sin embargo, cuanto más grande es el defecto, mayor es el área eliminada de la zona donante, lo que limita la posibilidad de indicar esta técnica para defectos grandes, por lo que se recomienda para lesiones de menos de 3cm2. Asimismo, la tasa de éxito disminuye significativamente entre los pacientes mayores de 50 años. Otra limitación se halla entre los cilindros osteocondrales transferidos, pues hay áreas vacías sin reparación cartilaginosa que pueden causar morbilidad en la zona donante17.
- 1.
- •
Métodos regenerativos. Se caracterizan por aprovechar técnicas de bioingeniería para desarrollar un tejido de cartílago hialino, como el implante de condrocitos autólogos (ICA), el cual se detalla a continuación, o el implante de células madre mesenquimatosas (MSC), del cual los reportes clínicos en seres humanos son limitados hasta el momento, sin que se hayan encontrado resultados significativos al compararlo con el ICA18.
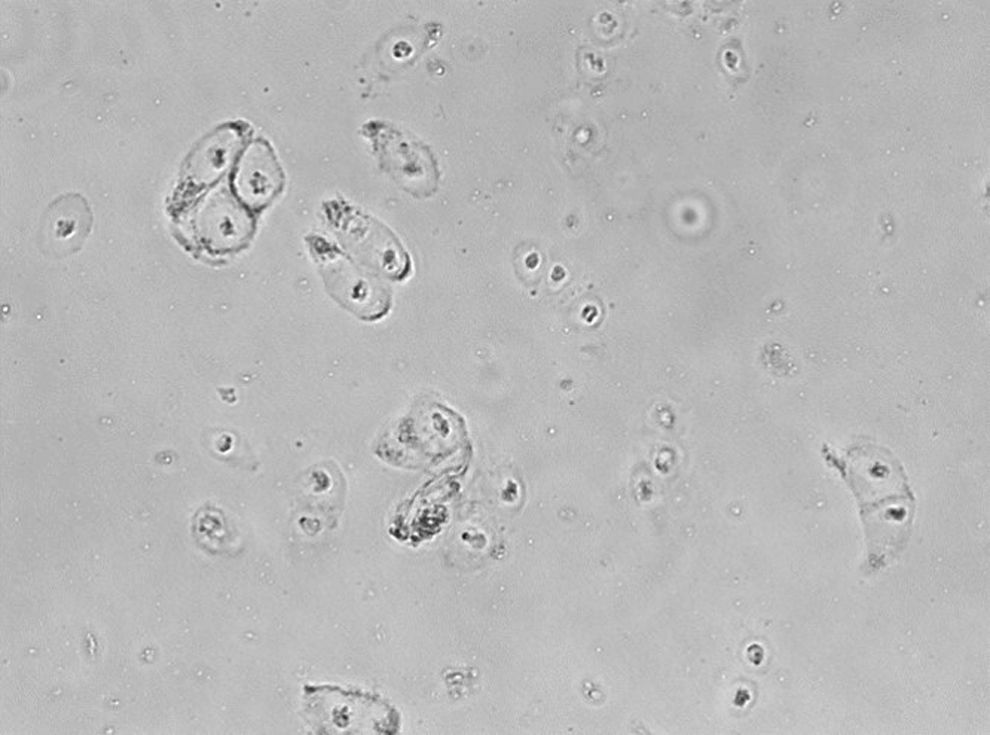
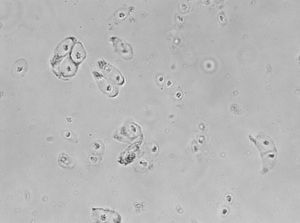
El ICA se introdujo en 1987 en Suecia por parte de Brittberg y Peterson para el tratamiento de defectos condrales graves de rodilla19. El proceso se lleva a cabo en varias etapas. El primer paso es la artroscopia diagnóstica y cosecha del cartílago. En segundo lugar, el cultivo de condrocitos para su propagación (fig. 3) durante 6 semanas y, en tercer lugar, la cirugía de implantación, para la cual generalmente se produce un desbridamiento del tamaño del defecto de cartílago, recolección de la solapa del periostio de la tibia proximal adecuada para el tamaño del defecto, fijación de la aleta e inyección de condrocitos cultivados antes del cierre de la última sutura9. El ICA es una técnica que está indicada para la reparación de defectos del cartílago sintomáticos del fémur distal en pacientes que han tenido una respuesta inadecuada a una artroscopia previa o procedimiento de reparación quirúrgica (desbridamiento, microfractura, perforación, artroplastia de abrasión o trasplante de injerto osteocondral autólogo/aloinjerto)20.
Reporte de algunos estudios del ICADesde el desarrollo de esta técnica por Peterson, muchos estudios se han realizado con la finalidad de comparar la morfología radiológica y microscópica, la funcionalidad a lo largo del tiempo y en diferentes padecimientos, así como su comparación con otras técnicas, como mosaicoplastia y microfracturas; de acuerdo con los resultados obtenidos, se han generado otros estudios respecto a las variables encontradas, como sexo e índice de masa corporal, con la finalidad de establecer un patrón de indicaciones para la implementación de esta técnica. Peterson et al. han hecho un seguimiento de los pacientes que han tratado con ICA desde octubre de 1987. En el último reporte, publicado en 2010, incluían resultados clínicos de 224 de los 590 pacientes operados hasta 1998. Por término medio, los pacientes llevaban 12,8 años desde la implantación (9,3-20,7 años). A los participantes se les aplicaron cuestionarios: Lysholm, Tegner Walgren, Cincinnati modificado (Noyes), Brittberg-Peterson y el KOOS. Se les preguntó, además, cómo clasificarían su estado: mejor, peor o sin cambios. El 74% de los pacientes refirió estar mejor o igual que en los últimos años y el 26% refirió estar peor. El 92% de los pacientes se refirió satisfecho y manifestó que se volvería a operar si fuera necesario. Los cuestionarios aplicados demostraron mejoría significativa del estado funcional de los pacientes, así como del alivio de los síntomas. El análisis de los subgrupos demostró un resultado final inferior en aquellos pacientes con lesiones bipolares (principalmente femoropatelares) incluso cuando se les comparaba con los pacientes con lesiones múltiples unipolares. Los pacientes con lesiones condrales secundarias a osteocondritis disecante presentaron mejores resultados clínicos probablemente porque se trataba de pacientes más jóvenes (39,7 años) con mayor potencial de recuperación. Los autores concluyeron que el ICA al parecer es una solución efectiva y duradera en el tratamiento de lesiones grandes de espesor total del cartílago de la rodilla21. Desafortunadamente, el grupo de Peterson nunca incluyó controles o grupos de comparación con diferentes procedimientos. Sin embargo, muchos autores con muestras más pequeñas y seguimientos menos prolongados han diseñado diversos estudios comparativos con otras opciones terapéuticas.
Asimismo, Bentley et al. en 2003 compararon los resultados del manejo de las lesiones condrales de rodilla mediante mosaicoplastia (n=42) e ICA (n=58). Las evaluaciones funcionales se llevaron a cabo basándose en las escalas de Cincinnati y Stanmore. Obtuvieron resultados excelentes o buenos en el 88% con ICA comparados con el 69% de los tratados mediante mosaicoplastia (p=0,277). Reportaron resultados más pobres en los pacientes con lesiones rotulianas. Un año después del manejo inicial se realizaron artroscopias de control en pacientes de ambos grupos y se tomaron biopsias de los sitios de reparación. Encontraron mejores índices de maduración en pacientes manejados con ICA, quienes consiguieron reparaciones de grado 1 o 2 del IRCA en el 82%, comparados con sólo el 34% de los pacientes sometidos a mosaicoplastia. Un hallazgo relevante del estudio fue que en las artroscopias de control del grupo del ICA casi la totalidad de los sitios donadores estaban cubiertos nuevamente por fibrocartílago. A uno de los pacientes manejado mediante ICA, en el cual la biopsia del primer año postoperatorio reportó la presencia de fibrocartílago mezclado con cartílago hialino, se le realizó una segunda biopsia a los 2 años postoperatorios y sólo se reportó la presencia de cartílago hialino. Los autores creen que los implantes pueden madurar con el tiempo, como lo planteó el grupo de colaboradores de Peterson anteriormente22.
En un estudio prospectivo aleatorizado multicéntrico, dirigido por Dieter van Assche et al., donde los principales centros de referencia fueron el Hospital Universitario de Utrecht en los Países Bajos y el Hospital Universitario de Lovaina en Bélgica, incluyó a 67 pacientes jóvenes (18-50 años) con una lesión del cartílago única y sintomática en alguno de los cóndilos femorales (1–5cm2), y los distribuyó aleatoriamente en dos grupos de tratamiento: microfracturas (n=34) e ICA (n=33). Posterior al manejo quirúrgico, ambos grupos iniciaron un esquema de rehabilitación estrictamente supervisado. Al final de la rehabilitación fueron evaluados los resultados funcionales considerando tres parámetros principales: movilidad, fuerza muscular y potencia para saltar. La misma evaluación se repitió a los 6, 9, 12 y 24 meses posoperatorios. El hallazgo más importante del presente estudio fue el hecho de que la recuperación funcional para ambos grupos a los 2 años de la cirugía fue similar23.
Knutsen et al. diseñaron un estudio multicéntrico en 2004, donde incluyeron a 80 pacientes con lesión condral única, sintomática, localizada en los cóndilos femorales, con una duración media de los síntomas de 36 meses, en el cual el 94% de los pacientes ya había sido manejado quirúrgicamente en, al menos, una ocasión. Los pacientes fueron asignados aleatoriamente a uno de los dos grupos de tratamiento, microfracturas (n=40) e ICA (n=40). Un observador independiente realizó las evaluaciones clínicas a los 12 y 24 meses. Asimismo, a los 24 meses se realizó una segunda artroscopia con toma de biopsia del sitio reparado, que también se evaluó por parte de observadores independientes que además fueron cegados respecto al grupo de tratamiento. Los resultados clínicos finales fueron similares en ambos grupos, pues se obtuvieron resultados funcionales similares, con una disminución del dolor en el 76% de los pacientes a los 2 años de la cirugía. En la evaluación macroscópica realizada en la segunda artroscopia en ambos grupos, la mayoría se clasificó casi normal. Los resultados histopatológicos fueron similares de la misma manera. Sin embargo, el ICA consiguió apenas un poco más de cartílago hialino de reparación24.
Kreuz et al. evaluaron clínicamente y mediante resonancia magnética a pacientes con lesiones condrales manejados mediante ICA con la finalidad de establecer si el sexo influía en el resultado final del procedimiento. Encontraron que los pacientes masculinos obtuvieron mejores puntuaciones postoperatorias en la escala de Lysholm durante todo el seguimiento (6,12 y 24 meses) y en el IKDC a los 6 y 12 meses postoperatorios comparado con las pacientes femeninas. En la evaluación por resonancia magnética no encontraron diferencias significativas en la cobertura de los defectos a los 48 meses de la cirugía. Los autores no pudieron concluir la razón por la cual las mujeres tenían peores resultados finales25.
Jaiswal et al. (2012) determinaron la influencia del índice de masa corporal en el resultado final posterior al ICA en el manejo de lesiones del cartílago hialino de rodilla. Los pacientes con peso corporal ideal obtuvieron resultados postoperatorios significativamente más altos mediante la puntuación modificada de Cincinnati (MCS) en comparación con pacientes con sobrepeso (IMC de 25–30kg/m2) u obesidad (IMC>30kg/m2). Además, se demostró que en pacientes obesos a los 2 años de seguimiento no existía mejoría alguna en las puntuaciones del MCS. El 82% de los pacientes con peso ideal presentó resultados buenos o excelentes desde los 6 meses postoperatorios, comparado con el 49% de pacientes con sobrepeso y solo el 5,5% de obesos. Los resultados pobres obtenidos en pacientes con obesidad pueden ser explicados por el incremento de las fuerzas mecánicas que atraviesan la articulación y la predisponen a su degeneración26.
Complicaciones y consideraciones del ICAAlgunas complicaciones de las cuales ha informado recientemente la Food and Drug Administration (FDA) son insuficiencia del injerto, deslaminación del injerto, hipertrofia del tejido, condromalacia, adherencias, cuerpos libres y artrofibrosis, entre otras. Sin embargo, algunas de estas complicaciones se han mitigado con la implementación de nuevas estrategias, como la cubierta de colágeno de la membrana (CACI) en el sitio del ICA, con lo que la incidencia de la hipertrofia sintomática se ha reducido.
Además, en una revisión extensa realizada por Harris et al. publicada en 201120, cuya finalidad era demostrar las causas por las cuales los ICA fallaban, se complicaban o ameritaban reintervención, encontraron que fallaban más los implantes de primera generación (cubiertos con parches de periostio autólogo o con colágeno porcino) a diferencia de cuando todo el procedimiento era artroscópico. Demostraron que las fallas van disminuyendo conforme la evolución de las generaciones del implante y son del 7,7% en la primera generación, el 3,3% en la segunda y el 1,5% en la última generación. Un hallazgo importante del estudio es el hecho de que en general hasta una tercera parte de los pacientes sometidos a ICA amerita reintervención en algún momento de su evolución aunque en algunas ocasiones sea solamente un procedimiento de vigilancia (second look). La hipertrofia del parche de periostio en implantes de primera generación y del implante de segunda generación fueron las complicaciones más frecuentemente documentadas, que representan además la principal causa de reoperaciones (rasurado de la porción hipertrófica). Reportaron como poco frecuentes las infecciones superficiales y profundas, así como la trombosis venosa profunda. Además se reportó menor incidencia de artrofibrosis y adherencias en procedimientos artroscópicos puros comparados con miniartrotomías.
En algunos otros estudios se ha intentado determinar cuáles son los factores relacionados con el paciente que intervienen en su evolución postoperatoria. Niemeyer et al. investigaron la influencia de la calidad de las células en los resultados clínicos después del ICA. Los autores encontraron mejores resultados funcionales relacionados con mayor expresión del CD44, del colágeno y la viabilidad celular, y no encontraron ninguna relación con la expresión de agrecano27.
ConclusionesLa obtención y expansión de condrocitos humanos son procedimientos iniciales para el posterior ICA, lo cual proveería de una fuente de reemplazo articular y regenerativa, y evitaría la incapacidad de pacientes con lesiones condrales, así como la reducción de altos costos que implican los tratamientos médicos y quirúrgicos utilizados actualmente, los cuales no ofrecen regeneración y alivian únicamente síntomas secundarios al desgaste articular.
El implante de condrocitos autólogos es una opción terapéutica prometedora y eficaz para el manejo de lesiones del cartílago hialino, con buenos y principalmente duraderos resultados funcionales en el momento de compararlo con otros tratamientos, lo que fortalece las futuras herramientas terapéuticas para artropatías que impactan a nivel institucional y social.
Conflicto de interesesLos autores no hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de ninguna entidad comercial. Además, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas ni otras organizaciones sin ánimo de lucro a las que estemos afiliados.
El trabajo fue apoyado por el Programa Presupuestario A022-2014.