La ecografía se ha convertido en una herramienta diagnóstica y terapéutica en situaciones críticas. Este artículo revisa la evolución de la ecografía en eventos críticos y su impacto a través de la disminución de morbimortalidad en trauma abdominal y torácico, en el reconocimiento de causas reversibles en actividad eléctrica sin pulso, en la toma de decisiones en falla ventilatoria aguda, en predicción de supervivencia y en la disminución de complicaciones en procedimientos invasivos. Se revisa cómo la ecografía realizada por no expertos con mínimo entrenamiento enfocado al reconocimiento de situaciones específicas tiene una adecuada correlación con el experto. Se revisan algunos protocolos de ecografía en reanimación descritos en la literatura y se hace una descripción de las variables más relevantes en situaciones críticas como la función ventricular izquierda, respuesta a volumen, taponamiento cardíaco, dilatación del ventrículo derecho y la evaluación pulmonar.
Ultrasound has become a diagnostic and therapeutic tool for critical situations. This article reviews the development of ultrasound with respect to critical events and its impact on reducing morbidity and mortality from abdominal and chest trauma, on the recognition of reversible causes of pulseless electrical activity, on decision-making in acute respiratory failure, and on predicting survival and reducing complications associated with invasive procedures. We revised how ultrasounds performed by non-experts with a minimum of training and focused on recognizing specific situations have a good degree of correlation with expert conducted ultrasounds. Some protocols of ultrasound in resuscitation described in the literature are reviewed and a description is made of the most relevant variables in critical situations, including left ventricular function, volume responsiveness, cardiac tamponade, right ventricular dilatation, and pulmonary evaluation.
La ecografía se ha convertido en una de las herramientas diagnósticas y terapéuticas más útiles en nuestro tiempo, cuando deja de ser exclusivo de los radiólogos para ser utilizado por los departamentos de emergencias y unidades de cuidados intensivos, llegando al quirófano donde actualmente es una herramienta para el cuidado perioperatorio, anestesia regional y accesos vasculares.
En los años 70 la ecocardiografía en la unidad de cuidados intensivos se limitaba a evaluar el volumen sistólico y el gasto cardíaco1 y rápidamente evolucionó entre los años 80 y 90 hacía la identificación de eventos agudos como taponamiento cardíaco2, complicaciones del infarto miocárdico3, valoraciones hemodinámicas en hipotensión4, sepsis5 y detección de aneurismas aórticos rotos6.
En trauma, el uso de la ecografía se inició en 1980 en Europa y Japón7, y en 1992 en EE. UU. para detectar hemoperitoneo en trauma abdominal cerrado8. Rozycki et al. demostraron la eficacia de la ecografía para la detección de derrame pericárdico y líquido intraperitoneal con un 81% de sensibilidad y un 99% de especificidad, describiendo el acrónimo «FAST» (Focused Abdominal Sonography for Trauma) para la evaluación del trauma abdominal9. En 1997 un consenso internacional cambia la A de «Abdominal» por la A «Assessment» y se incluye en el ATLS10. Adicionalmente aparecen una gran cantidad de estudios sobre la utilidad de la ecografía en otros escenarios como neumotórax11, hemotórax12, falla ventilatoria13, embolismo pulmonar14 y accesos vasculares15.
Gracias a estas descripciones, se publican múltiples algoritmos para utilización de la ecografía en reanimación (Focus Assessed Transthoracic Echocardiographic [FATE], CAUSE, Rapid Ultrasound in Shock [RUSH]), y en 2004 el American College of Emergency Physicians considera que la ecografía a la cabecera del paciente debe ser integrada a su práctica rutinaria. En 2010 las guías de la American Heart Association para soporte vital avanzado, recomiendan la ecocardiografía para diagnosticar causas tratables de un paro cardíaco no desfibrilable y para orientar el tratamiento16.
¿Cómo ha impactado la ecografía en la reanimación?Su impacto se ha dado a través de la disminución de morbimortalidad en trauma, el reconocimiento de causas potencialmente reversibles en paro cardíaco no desfibrilable y choque, en la predicción de supervivencia, en la toma de decisiones en falla ventilatoria aguda y en la disminución de complicaciones en procedimientos invasivos.
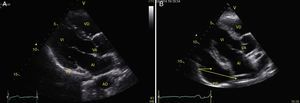
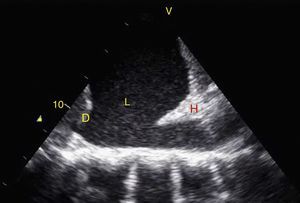
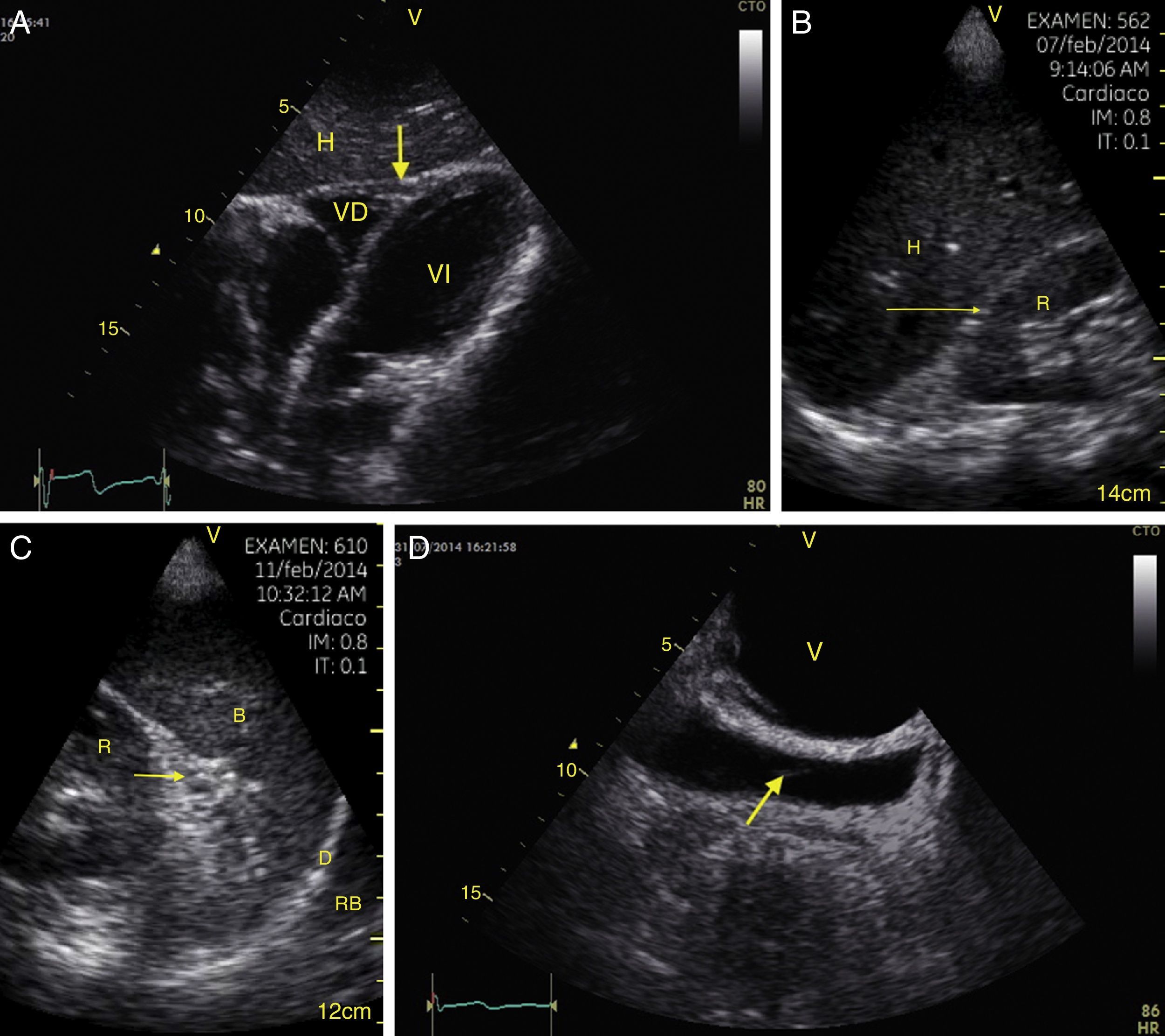
TraumaEl FAST consiste en la valoración de 4 puntos (pericárdico, perihepático, periesplénico y pélvico (fig. 1) para detectar imágenes hipoecoicas relacionadas con líquido libre pericárdico e intraabdominal de hasta 100ml (fig. 2) con una sensibilidad del 50-88%, y su aplicación ha logrado disminuir la mortalidad del trauma cardíaco y abdominal17. Su extensión al tórax (EFAST) para detección de neumotórax y hemotórax ha sido muy importante18, en primer lugar porque es más sensible que la radiografía para el diagnóstico del neumotórax (48 vs. 20%)17, una dolencia que se calcula oculta en el 5% de todos los traumas19 y hasta en un 55% en traumas severos20. En segundo lugar, la ecografía detecta volúmenes de líquido de 20ml comparados con los 200ml de la radiografía21, teniendo una sensibilidad y especificidad superior para la detección del hemotórax22.
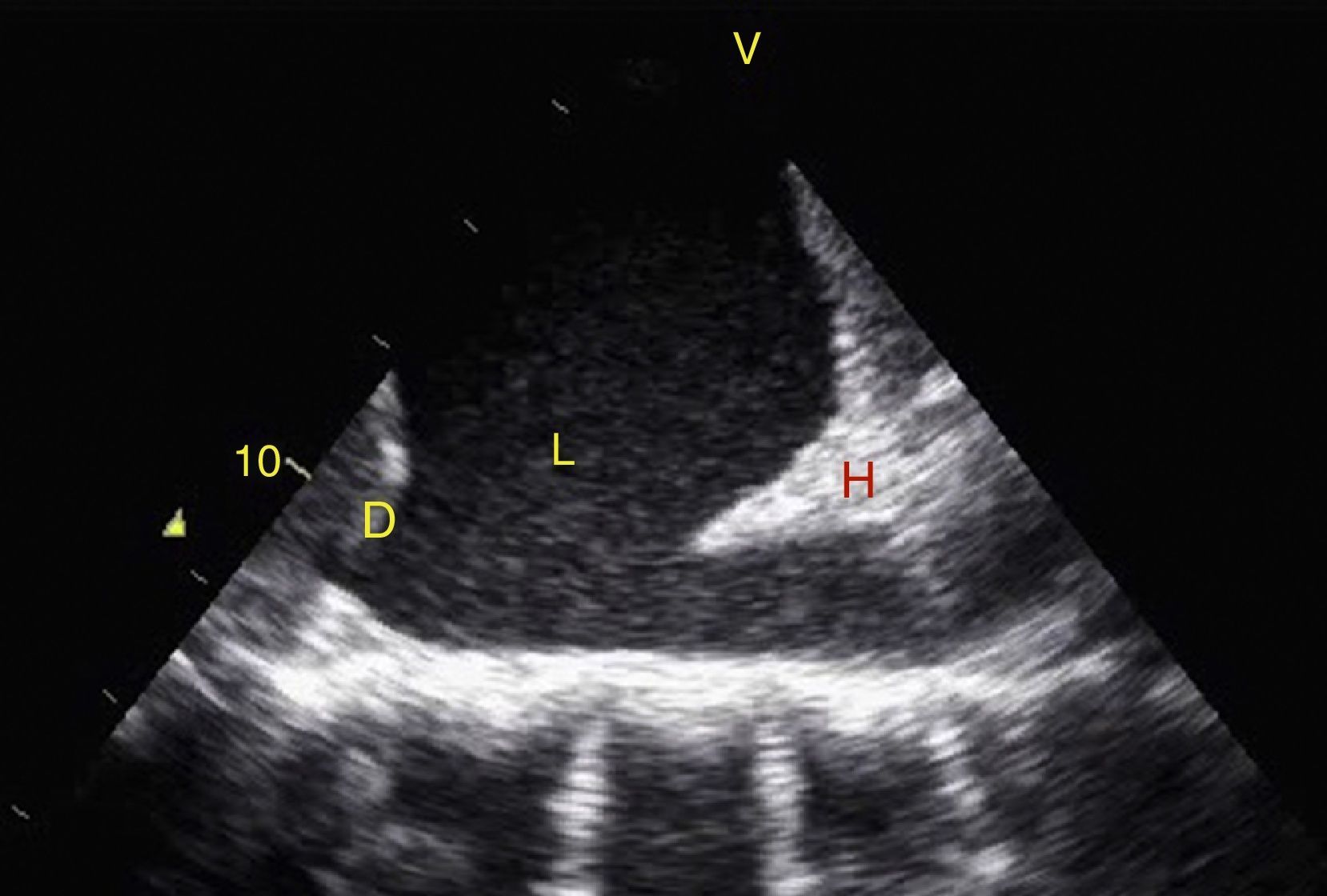
Visión de las 4 P del FAST. A) Pericárdico en ventana subxifoidea 4 cámaras. Observe que no hay líquido entre H, la hoja anterior del pericardio (flecha) y el VD. B) Perihepático en cuadrante superior derecho del abdomen. Observe el espacio de Morrison (flecha) entre H y R ausente de líquido. C) Periesplénico en cuadrante superior izquierdo del abdomen. Observe la ausencia de líquido (flecha) entre B y R. También observe el reflejo normal del bazo por encima del diafragma (RB). D) Pélvico. Observe la imagen hipoecoica más anterior correspondiente a la vejiga y líquido libre más posterior (flecha). B: bazo; D: diafragma; H: hígado; R: riñón; VD: ventrículo derecho; V: vejiga; VI: ventrículo izquierdo.
Fuente: autores.
La supervivencia en actividad eléctrica sin pulso (AESP) y asistolia es mucho menor que la de los otros ritmos de paro y probablemente se deba a que depende de la correcta identificación y rápido tratamiento de las causas subyacentes16. De estas causas, solo la hipoxemia, la hipotermia e hipo/hiperpotasemia son diagnosticadas fácilmente23. Además, solo el 45% de los médicos diagnostican correctamente la ausencia de pulso en un paro cardíaco sin diferenciar entre una AESP y una seudo-AESP, pudiendo no dar un tratamiento a una causa reversible23.
En choque, la morbimortalidad también depende de la duración y el tratamiento rápido de la causa, sin embargo, la diferenciación clínica entre choque hipovolémico, distributivo, cardiogénico u obstructivo no siempre puede realizarse correctamente24, pues el examen físico solo detecta el 57% de las anomalías cardíacas25.
La ecografía tiene un papel importante en estos escenarios de paro cardíaco no desfibrilable y choque, pues permite excluir rápidamente causas potencialmente reversibles como choque cardiogénico, hipovolemia, taponamiento cardíaco, neumotórax y hemotórax23–25. Además, aumenta la exactitud del examen físico cardíaco del 60% al 90% en derrame pericárdico, función ventricular izquierda y cardiomegalia26, y ayuda a diferenciar una seudo-AESP de una verdadera para cambiar la conducta hasta en el 78% de los casos27.
Predicción de supervivenciaLa ecografía se ha mostrado como herramienta para detener la reanimación, pues cuando no se evidencia contractilidad miocárdica la probabilidad de tener retorno a la circulación espontánea es del 3% en AESP28 y la probabilidad de supervivencia es del 2% en trauma29.
Falla ventilatoria agudaLa adecuada toma de decisiones en este escenario se documentó en 2008 con el protocolo BLUE, un estudio observacional que evalúa criterios como deslizamiento pleural, consolidación y la presencia de líneas A o B en 3 zonas del tórax llamadas: zona 1 (anterior), zona 2 (lateral) y zona 3 (posterolateral), cada una dividida en mitades para un total de 6 áreas de investigación. Tomando como base estos hallazgos se establecieron 6 perfiles (A, A’, B, B’, AB, C), lo que comparado con el diagnóstico final tiene una sensibilidad y especificidad mayor al 80% y al 90% respectivamente para detectar EPOC, asma, neumotórax, edema pulmonar, neumonía y tromboembolismo pulmonar30.
Adicionalmente, la ecografía tiene una alta concordancia con la radiografía en varias enfermedades pulmonares agudas (derrames, consolidación, edema) y tiene un tiempo de realización mucho menor31.
Procedimientos invasivosEn la colocación de catéter venoso central disminuye las complicaciones mecánicas y el tiempo de colocación especialmente en yugular interno32. Además, determina la adecuada ubicación de la punta del catéter venoso central con una sensibilidad del 70% y una especificidad del 100% con la prueba de solución salina33. Para toracentesis, la ecografía aumenta probabilidad de éxito y reduce el riesgo de punción de órganos34. Para pericardiocentesis, la incidencia de complicaciones se disminuye de un 50% a un 4,7%35.
¿Qué necesita un no experto para entrenarse y qué tan confiable es?La Sociedad Americana de Ecocardiografía (ASE) determina que el uso principal de la ecografía portátil es extender la exactitud del examen físico y debe ser guiado por objetivos. Para esto se requiere mínimo un nivel básico de formación que incluye la realización de 75 exámenes y la interpretación de 15036.
El Council of Emergency Medicine Residency Directors recomienda que los programas de entrenamiento en Emergencias tengan dedicación de 2 semanas/80h, 150 valoraciones en situaciones críticas, incluyendo 40 exámenes FAST, 30 de trombosis venosa profunda (TVP) y 10 de procedimientos37.
Los programas de cuidado intensivo recomiendan la formación en conceptos generales que incluyan pleura, tórax, vascular y abdomen, además de ecocardiografía básica para reconocer volemia, función biventricular, taponamiento cardíaco, e insuficiencia valvular aguda severa38. Se recomiendan 10h de entrenamiento teórico en cada módulo y 30 ecocardiogramas transtorácicos39.
Varios estudios han mostrado la correlación de personal no experto con experto en situaciones específicas. Niendorff et al.40 evaluaron a residentes que recibieron entrenamiento en ventana subcostal para reconocer taponamiento cardíaco, embolismo pulmonar, hipovolemia y disminución de la contractilidad con una concordancia del 80% en escenarios de AESP en 7min. Otro estudio realizado en residentes con 100 casos de entrenamiento encontró una correlación fuerte en la evaluación de la función ventricular izquierda, derrame pleural y pericárdico y moderada para cuantificar vena cava e insuficiencia valvular en 6min41.
¿Cómo realizar una evaluación con ecografía en reanimación?Existen muchos protocolos descritos en la literatura que incluyen ecocardiografía, EFAST, pulmón, aorta, cava, TVP y embarazo ectópico, entre otros. Por ejemplo, el consenso del American College of Emergency Physicians sobre ecocardiograma a la cabecera del paciente se enfoca en derrame pericárdico, función sistólica, crecimiento ventricular derecho, volumen intravascular y confirmación de marcapasos transvenoso42. El protocolo FATE centra su evaluación en el derrame pericárdico, el grosor y dimensiones de las cámaras cardíacas, la contractilidad y la pleura43. El protocolo RUSH establece un enfoque para diferenciar entre choque hipovolémico, cardiogénico, distributivo y obstructivo basado en 3 variables: 1. La bomba (derrame pericárdico, contractilidad ventricular izquierda y dilatación del ventrículo derecho [VD]); 2. El tanque (cava inferior para hipovolemia, EFAST o edema pulmonar para evaluar fugas y neumotórax para compresión); y 3. La tubería (aneurisma aórtico y TVP)24.
De estas variables debemos escoger las más relevantes para la evaluación de eventos críticos en salas de cirugía como choque de etiología no clara, paro cardiorrespiratorio con ritmo no desfibrilable e hipoxemia. La evaluación debe ser organizada y dirigida según la situación clínica e incluir: función ventricular izquierda para descartar disfunción miocárdica; respuesta a volumen para evaluar hipovolemia; derrame pericárdico para taponamiento cardíaco; dilatación del VD para embolismo pulmonar; y ecografía pulmonar para descartar neumotórax, hemotórax y edema pulmonar.
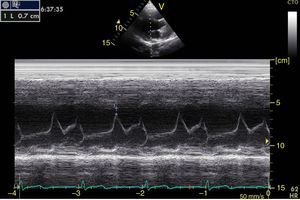
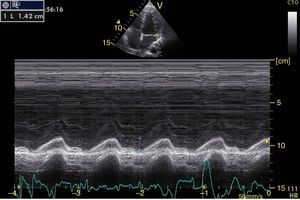
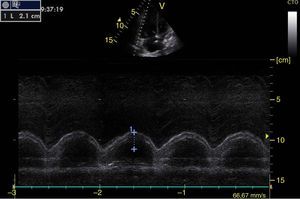
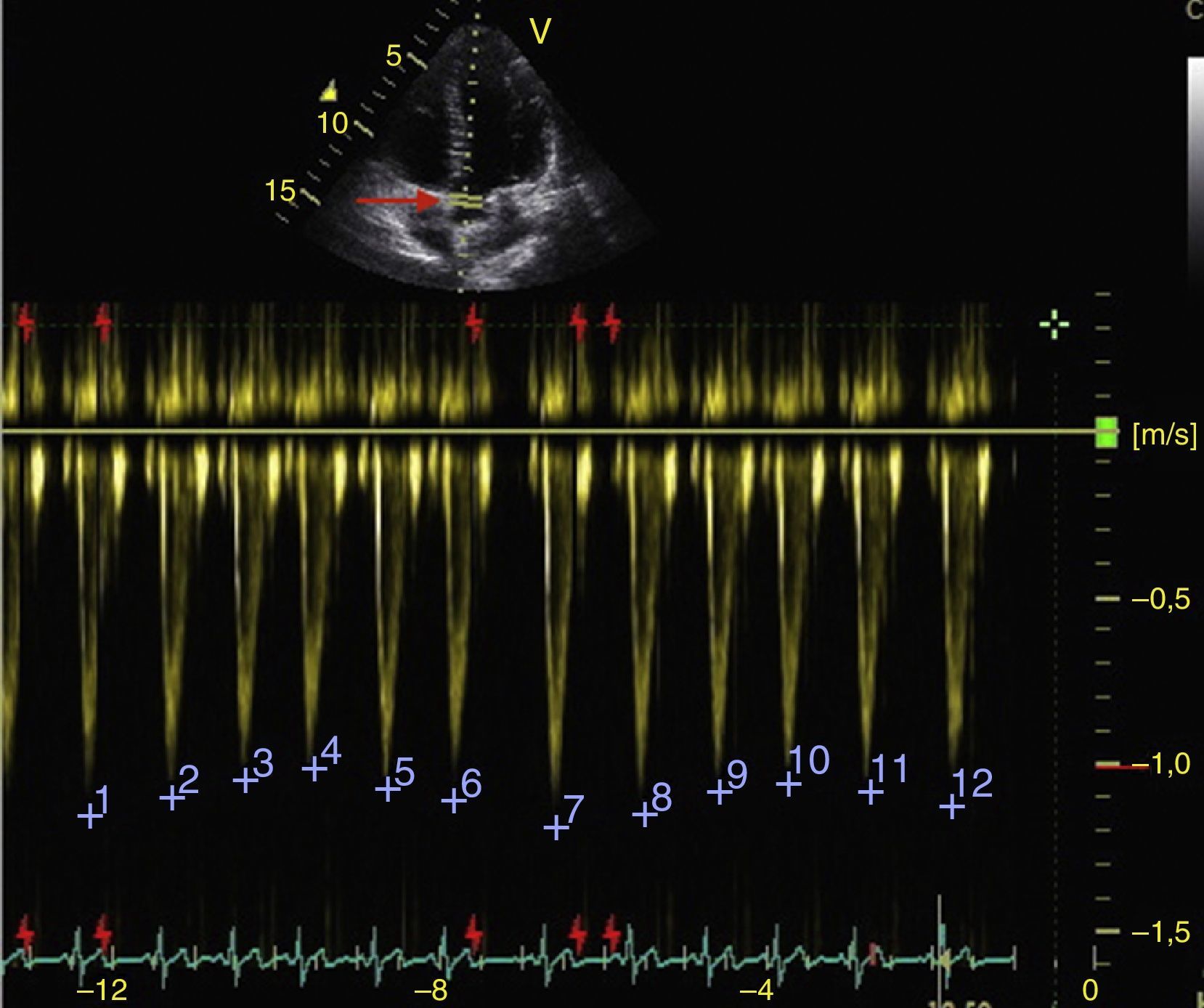
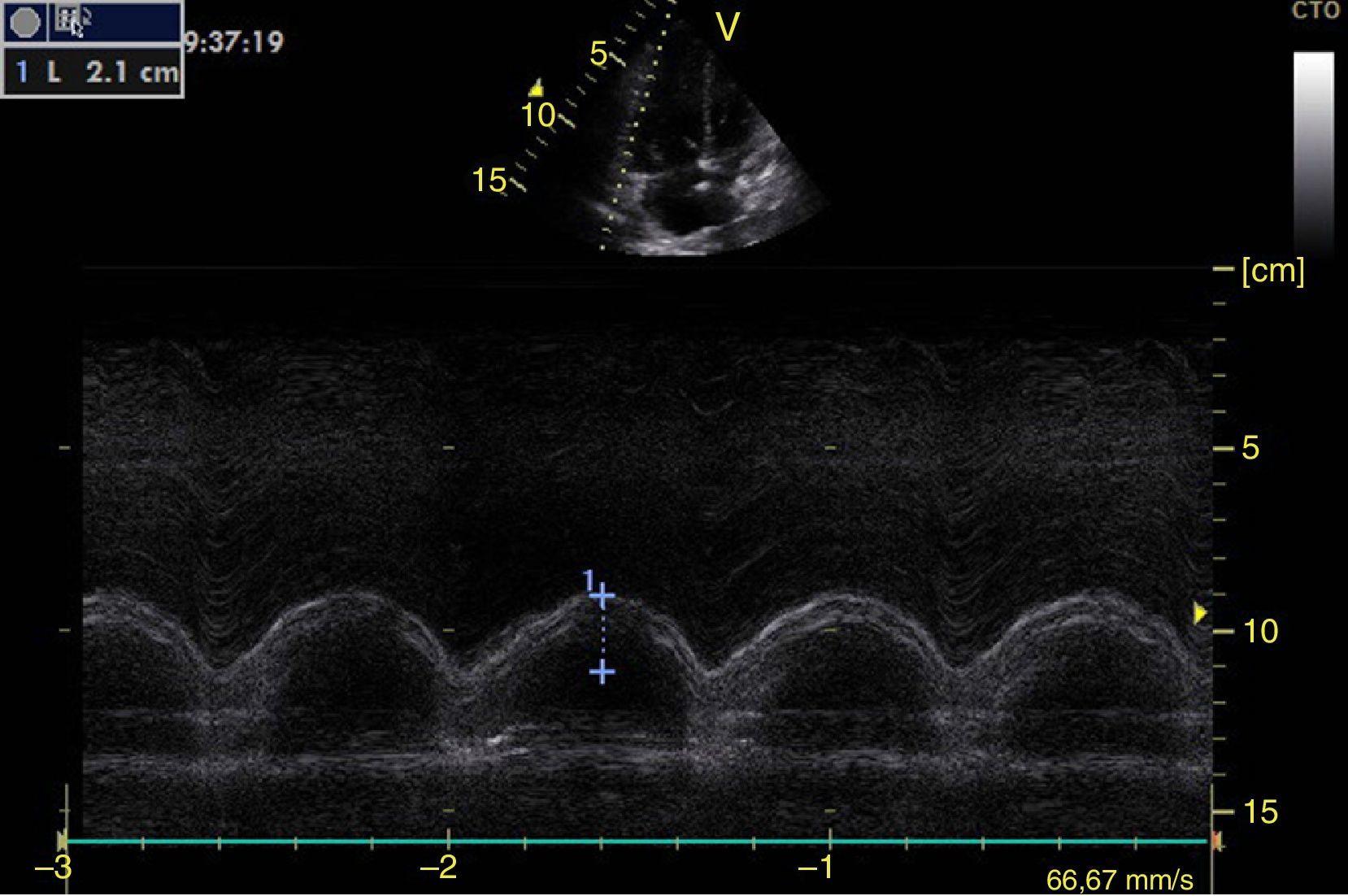
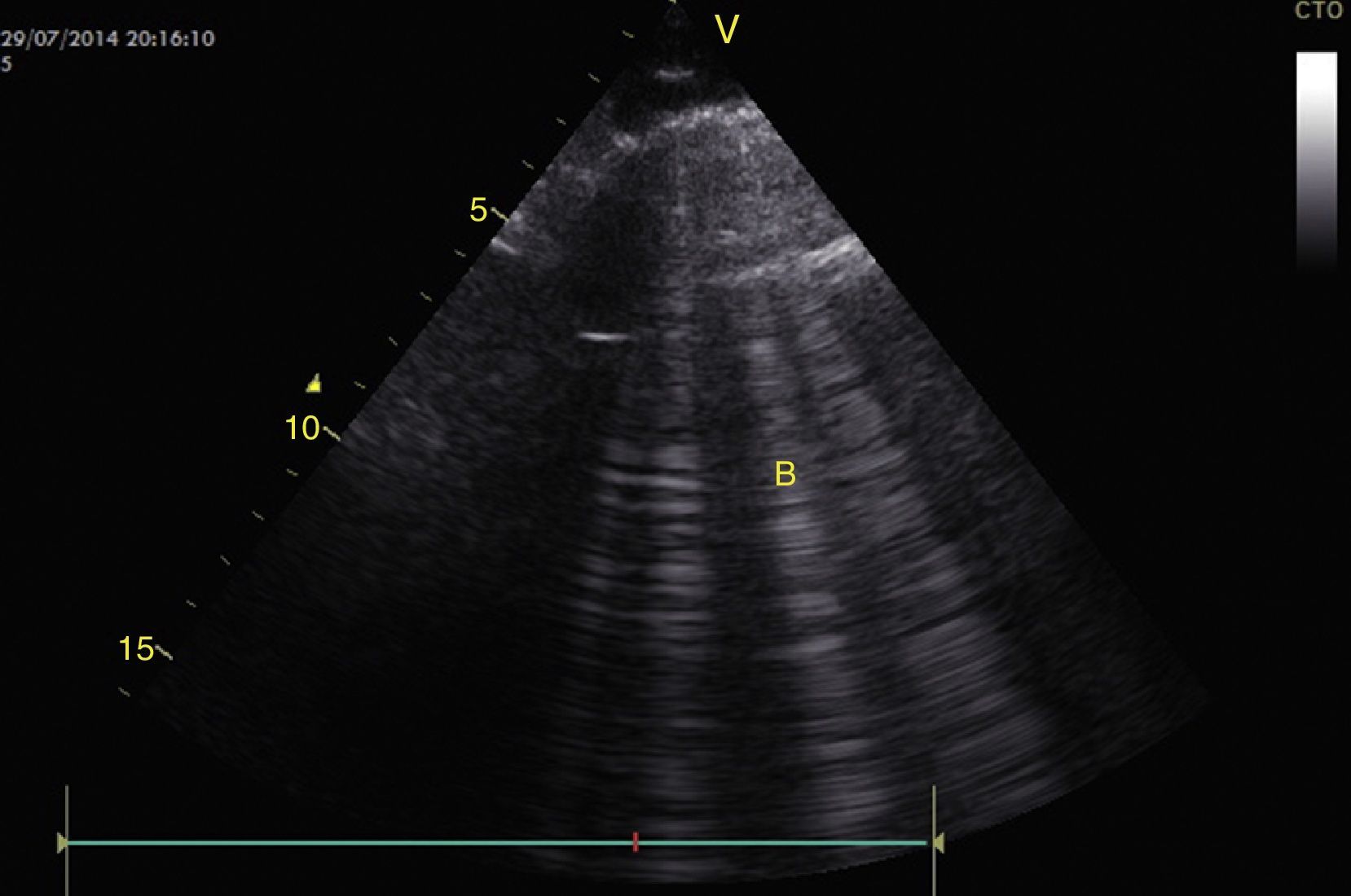
Función sistólica ventricular izquierdaLa contractilidad puede evaluarse cualitativamente y de manera rápida con el engrosamiento del endocardio para diferenciar entre normal y disfunción severa. Esta aproximación nos sirve para determinar un choque cardiogénico y guiarnos en el uso de inotrópicos/vasopresores o líquidos intravenosos44. La evaluación cuantitativa estándar es el cálculo de la fracción de eyección por método de Simpson, sin embargo, este requiere 2 planos (apical 4 cámaras y 2 cámaras) y un cálculo avanzado del que no siempre se dispone en estos escenarios45. El modo M (movimiento en el tiempo) es un método más sencillo utilizado en el protocolo FATE y permite calcular la fracción de acortamiento (normal: >25%) (fig. 3) y la aproximación de la valva anterior mitral al septum interventricular (normal: <1cm) en el eje largo paraesternal (fig. 4)43. Debe considerarse que este método no es apropiado en alteraciones de la contractilidad segmentaria45. El modo M también evalúa la función sistólica con la excursión sistólica del anillo mitral (MAPSE) en apical 4 cámaras (normal: >15mm) (fig. 5)43. Otro método es el cálculo del volumen sistólico (normal: 45±13ml) con el modo Doppler a través de la formula Pi×R2×VTI (integral tiempo velocidad) del tracto de salida del ventrículo izquierdo (LVOT) donde R es el radio del LVOT. El VTI también es indicativo de la función sistólica donde 18-20cm es normal y menor de 12cm es considerado como choque45.
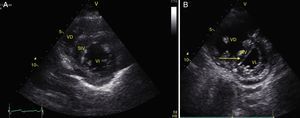
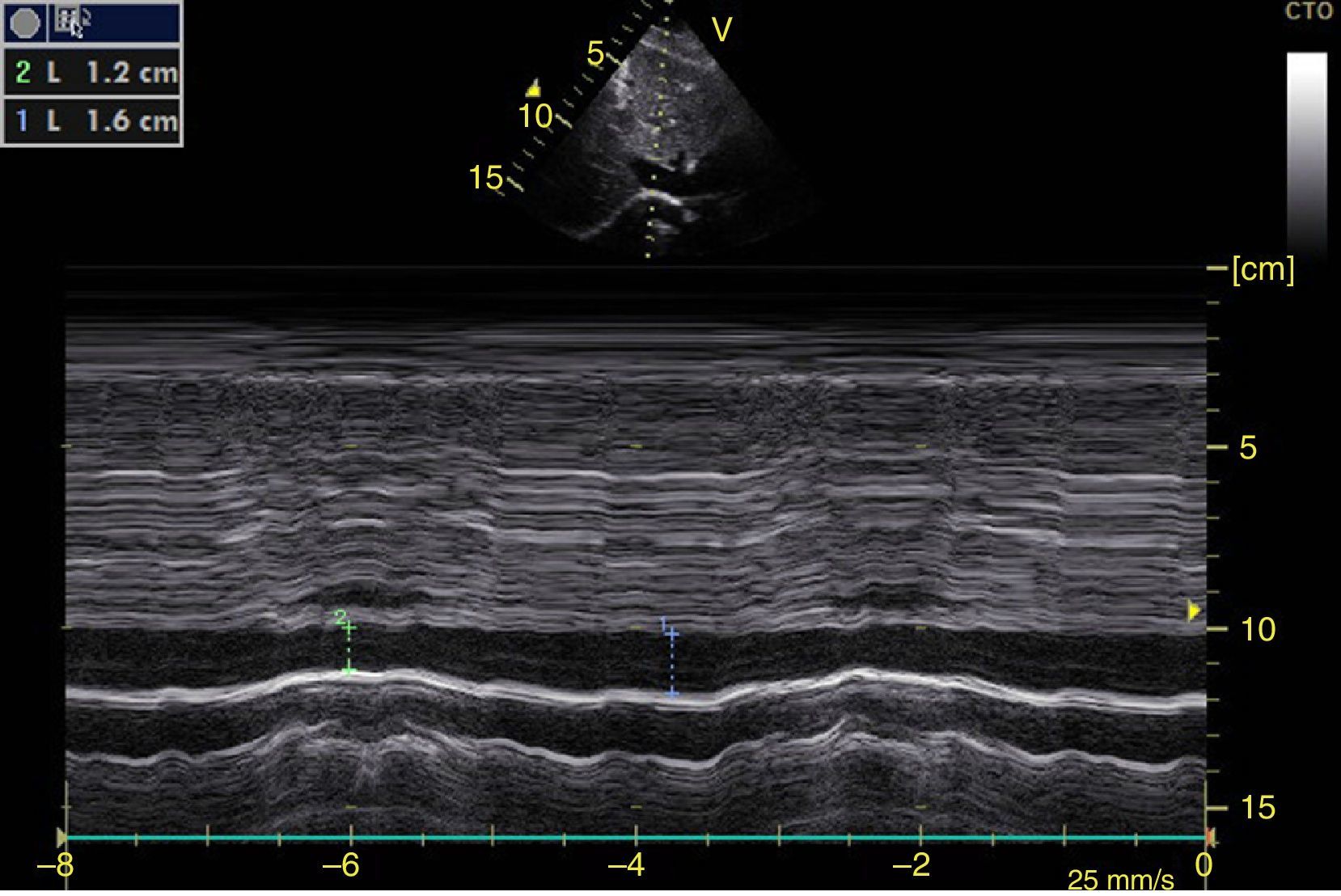
La obliteración sistólica del ventrículo izquierdo (signo del beso de los músculos papilares) puede relacionarse con hipovolemia, aunque otros parámetros han mostrado mejor predicción de respuesta al volumen como los cambios respiratorios en el diámetro de la vena cava (índice vena cava, IVC) (fig. 6) y en la velocidad máxima del volumen sistólico. En pacientes con ventilación mecánica invasiva, un IVC inferior >15%46 y un IVC superior >36% se considera respondedor a volumen47. En ventilación espontánea no se ha logrado una adecuada correlación con la respuesta al volumen48 pero sí con los valores de presión venosa central (PVC); así un IVC inferior >50% con diámetro<2,1cm se correlaciona con PVC<5cm H2O; si es<50% con diámetro>2,1cm con PVC>10cm H2O; y si no cumple ninguno, con PVC 5-10cm H2O49.
Ventana subxifoidea vena cava inferior en modo M. Índice cava inferior=(DM−Dm/DM)×100. En ventilación mecánica un valor>15% se considera respondedor a volumen. En ventilación espontánea un valor>50% con diámetro <2,1 cm se correlaciona con PVC<5 cm H2O. Si es<50% con diámetro>2,1cm con PVC>10cm H2O. Si tiene diámetro<2,1 cm con<50% o diámetro>2,1cm con>50% se correlaciona con PVC entre 5-10cm H2O. DM: diámetro mayor (línea azul); Dm: diámetro menor (línea verde); PVC: presión venosa central.
Fuente: autores.
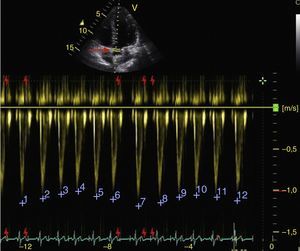
Los cambios respiratorios en la velocidad máxima del volumen sistólico en el LVOT deben ser mayores al 12% para responder a volumen (fig. 7)50.
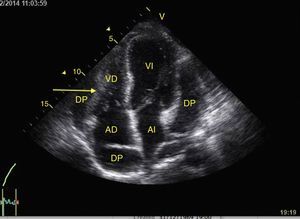
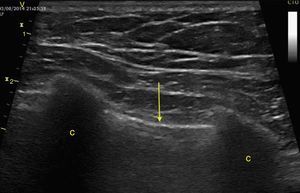
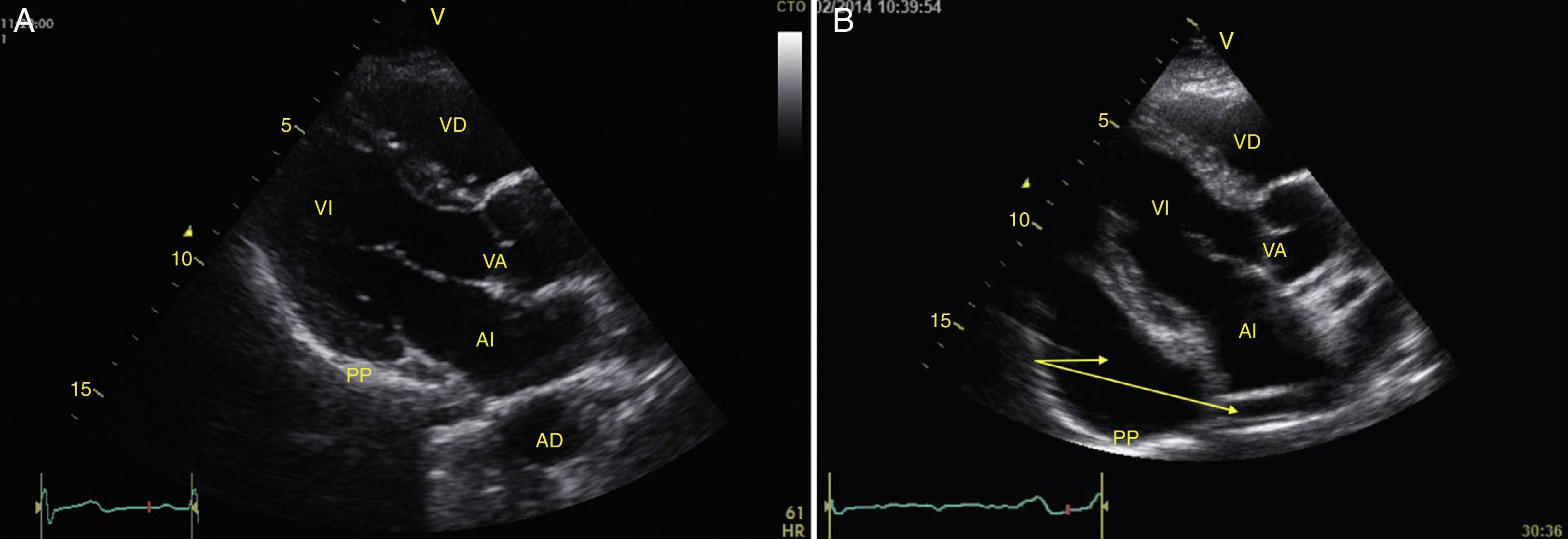
Taponamiento cardíacoEl derrame pericárdico se identifica como una imagen hipoecoica entre las hojas pericárdicas hiperecoicas (fig. 8) y luego se determina si contribuye a la inestabilidad del paciente. Como el taponamiento cardíaco se produce cuando la presión dentro del pericardio impide el llenado durante la fase de relajación, se debe buscar el colapso diastólico inicialmente en las cavidades derechas por ser las de menor presión (fig. 9)24,51. El espectro de presentación del taponamiento puede ir desde una desviación hacia dentro de la aurícula o ventrículo hasta una completa compresión de la cámara en diástole51. Adicionalmente, se puede observar una cava inferior distendida como parte del diagnóstico24.
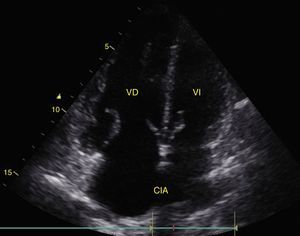
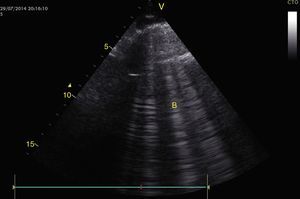
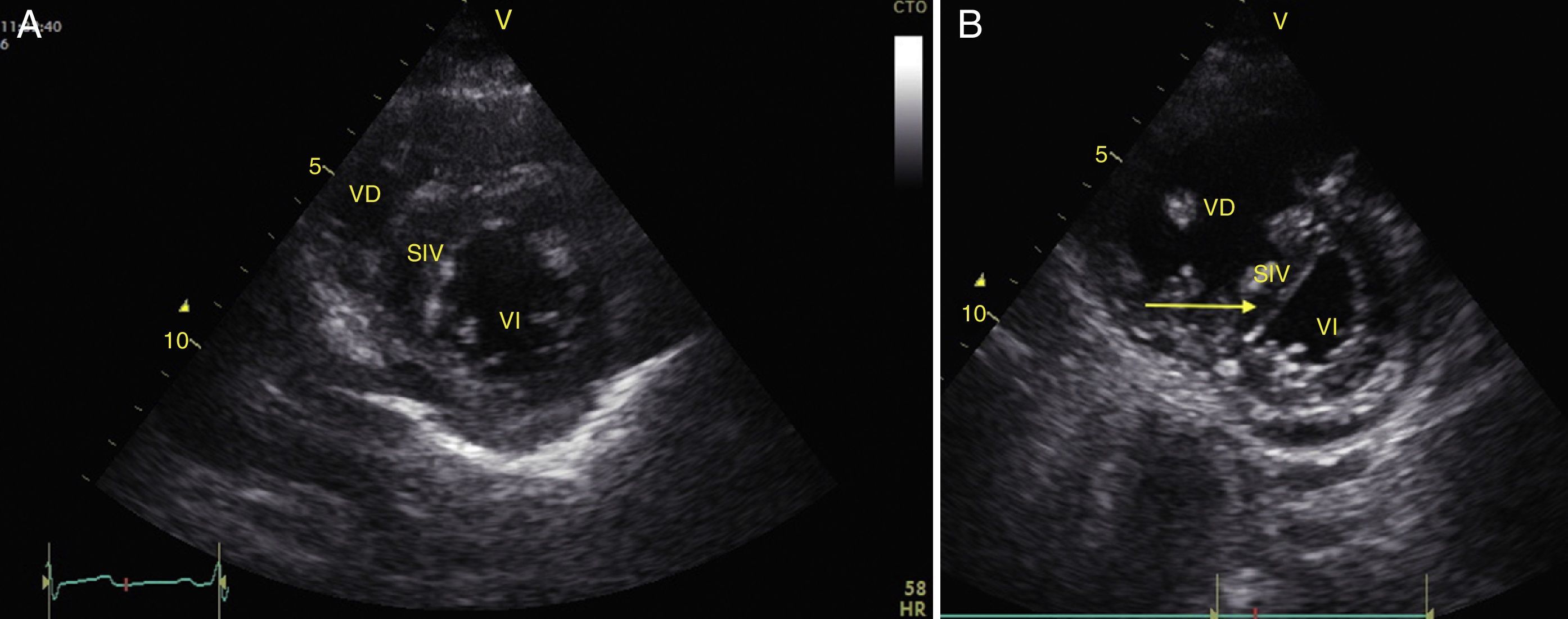
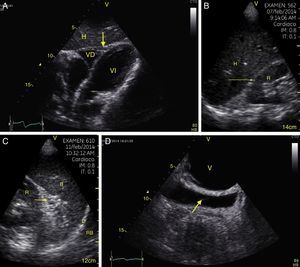
Cualquier condición que aumente súbitamente la resistencia vascular pulmonar puede resultar en la dilatación aguda del VD. La principal causa de esta condición es el embolismo pulmonar24. Este evento puede observarse con deformación y dilatación del VD cuya relación normal con el ventrículo izquierdo es del 66% y se observa mejor en 4 cámaras apical o paraesternal eje corto (fig. 10)49. Otro signo indicativo de aumento de la presión en el VD es el movimiento paradójico del septum interventricular (fig. 11)24. Algunos han reportado una sensibilidad y especificidad de la ecografía para detectar embolismo pulmonar del 55% y del 69% respectivamente52 mientras que en el protocolo BLUE un examen pulmonar normal con evidencia de TVP indica TEP con sensibilidad del 81% y especificidad del 99%28.
A) Ventana paraesternal eje corto. Observe la relación normal entre el VD y el VI. B) Aplanamiento del SIV (flecha) durante la sístole o movimiento paradójico, hace que el VI tome forma de D y es indicativo de sobrecarga de presión. Observe también el aumento de tamaño del VD respecto al VI. SIV: septum interventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
Fuente: autores.
La función ventricular derecha también se puede valorar en modo M en la ventana apical 4 cámaras con la excursión sistólica del anillo tricuspídeo (TAPSE) que debe ser>15mm (fig. 12)49. El cambio de área fraccional (área fin diástole-área fin sístole/área fin diástole×100)>35% es indicativo de función sistólica normal49.
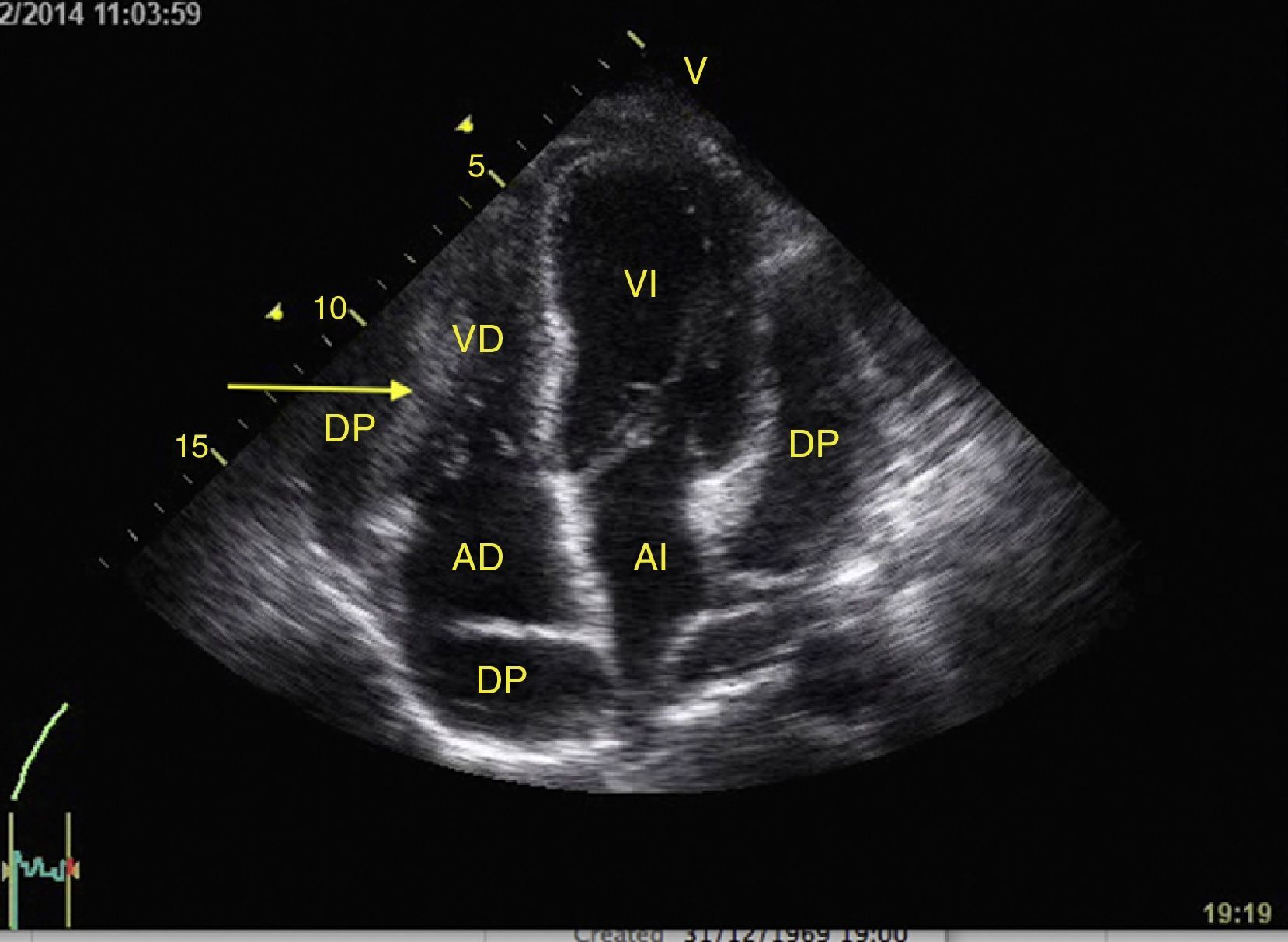
PulmónPara descartar neumotórax, edema pulmonar, consolidación y derrame pleural en el paciente con hipoxemia o choque, debemos buscar el deslizamiento pleural y las líneas A o B en los 6 cuadrantes descritos en el protocolo BLUE así como los signos de derrame pleural28.
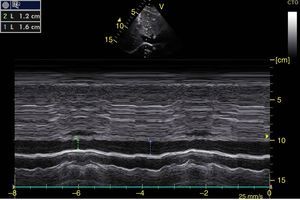
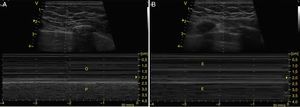
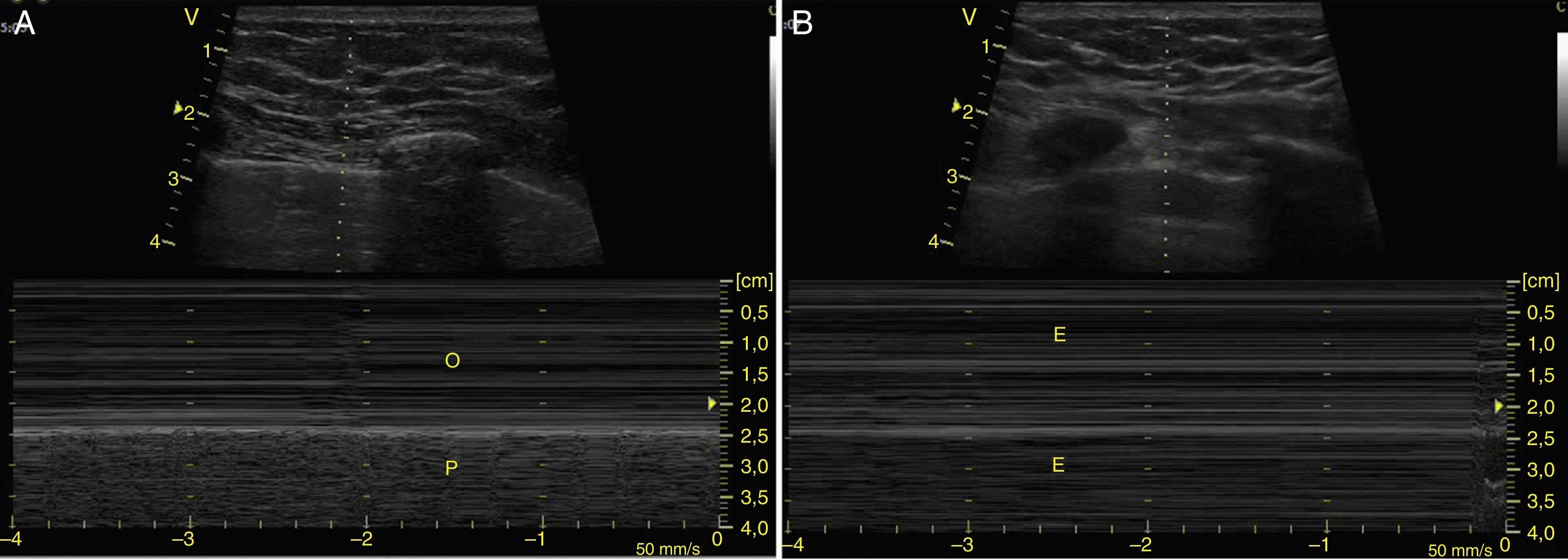
Para determinar neumotórax, con el paciente en supino y entre el 3-5 espacio intercostal anterior, se ubica la línea pleural (línea hiperecogénica entre las costillas) y el movimiento de sus 2 hojas (deslizamiento pleural) debe estar ausente24. El deslizamiento también se puede observar en modo M como el signo de la playa (figs. 13 y 14). Además, se deben buscar las líneas A, que representan artefactos horizontales y son el reflejo de la interfase tejido/aire que causa reverberación entre el transductor y el pulmón. Es clave que las líneas A estén acompañadas de ausencia de deslizamiento (perfil A’) para el diagnóstico de neumotórax, porque estas líneas se pueden encontrar en paciente con EPOC, asma o sanos (perfil A)28,53,54.
A) Deslizamiento pleural observado en modo M como el signo de la playa, la pared torácica que está sin movimiento representa las olas (O) y el deslizamiento pleural representa la playa (P). B) Modo M con signo de estratosfera, representa todas las estructuras sin movimiento (E).
Fuente: autores.
Para establecer el edema pulmonar, se deben buscar las líneas B que son artefactos verticales de reverberación dentro del pulmón que inician en la pleura hasta el fondo de la pantalla sin desvanecerse y se mueven con el deslizamiento pleural. Estas líneas B con deslizamiento pleural forman el síndrome intersticial (perfil B) y se asocia con aumento del agua intersticial (fig. 15)28,53,54. Sin deslizamiento pleural, las líneas B se asocian con neumonía, atelectasia o contusión pulmonar (perfil B’)28,53,54.
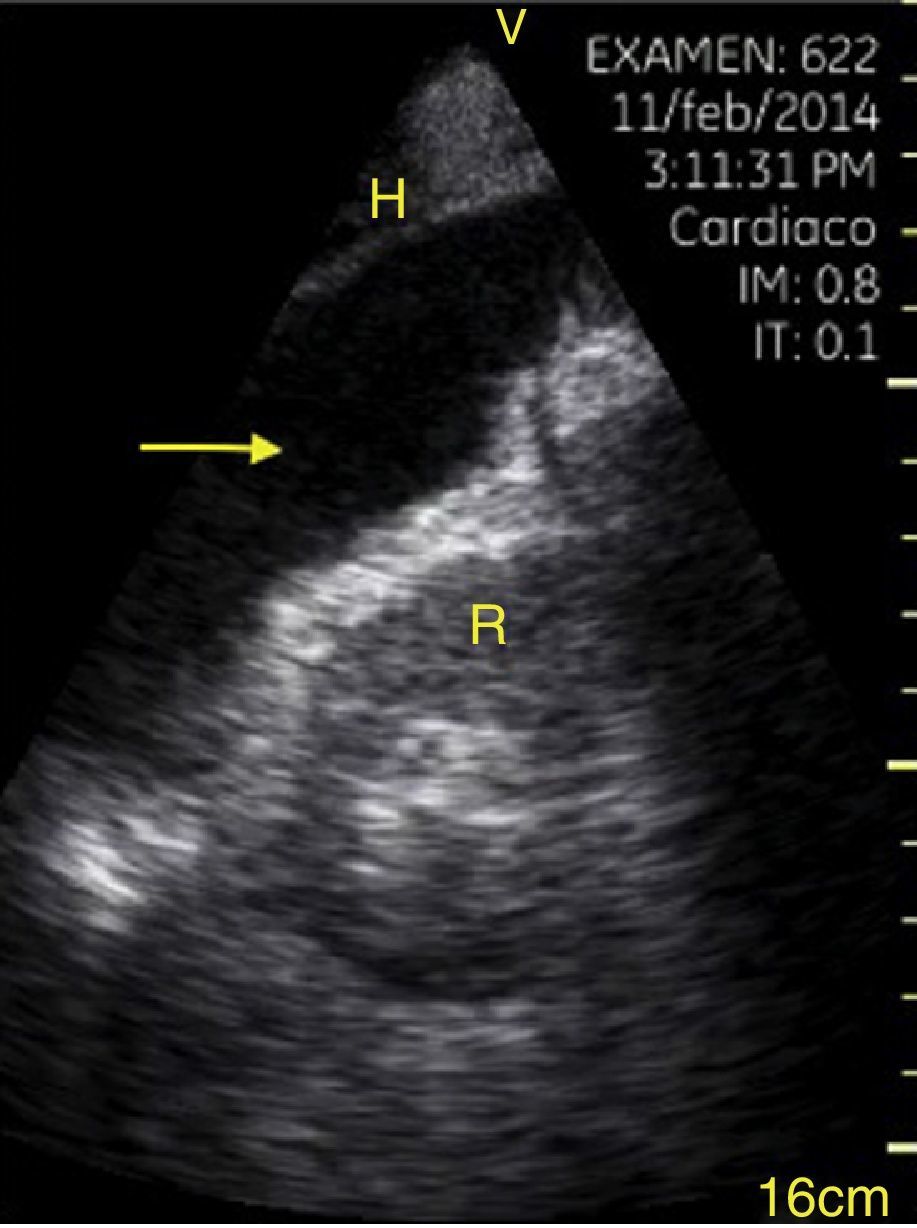
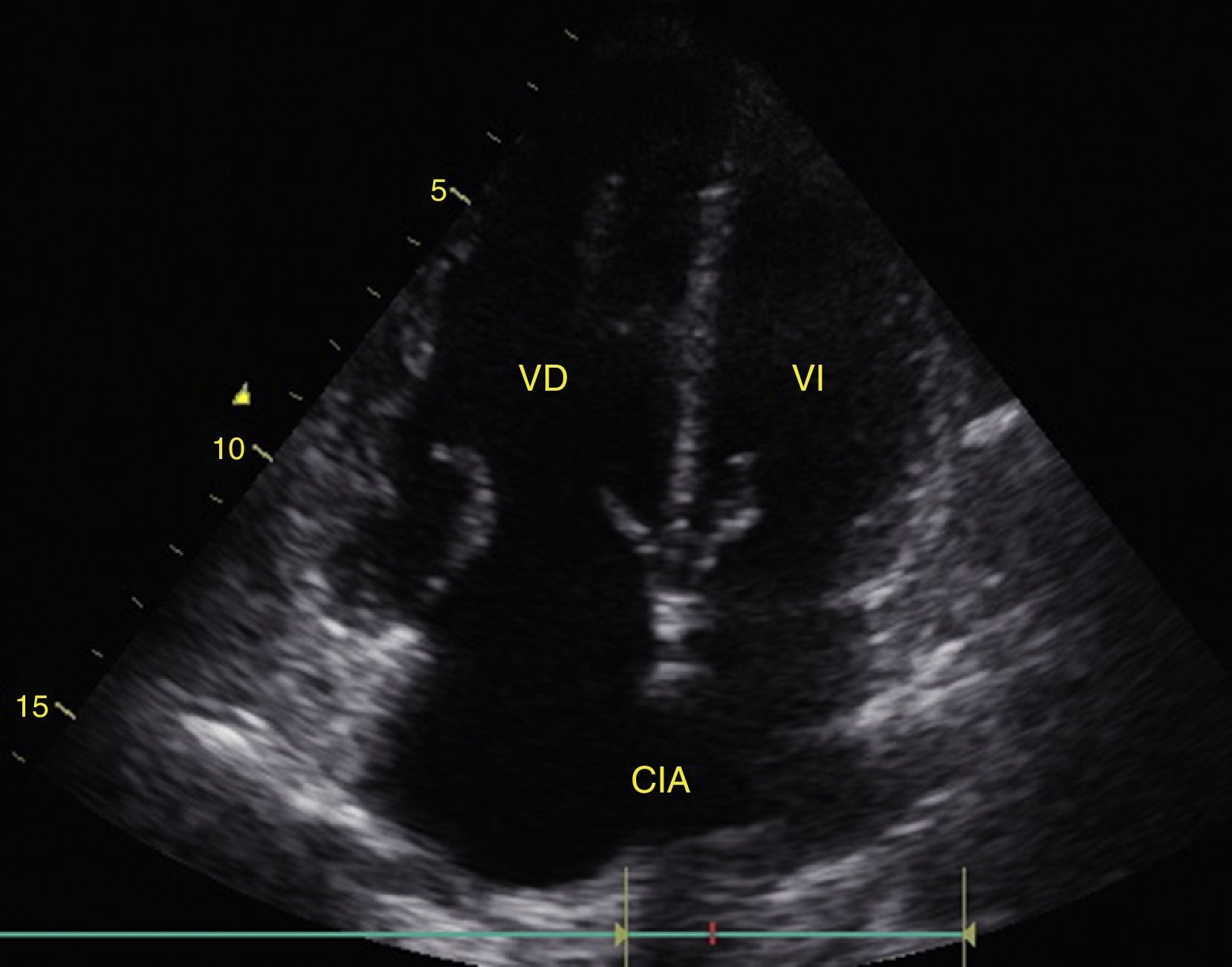
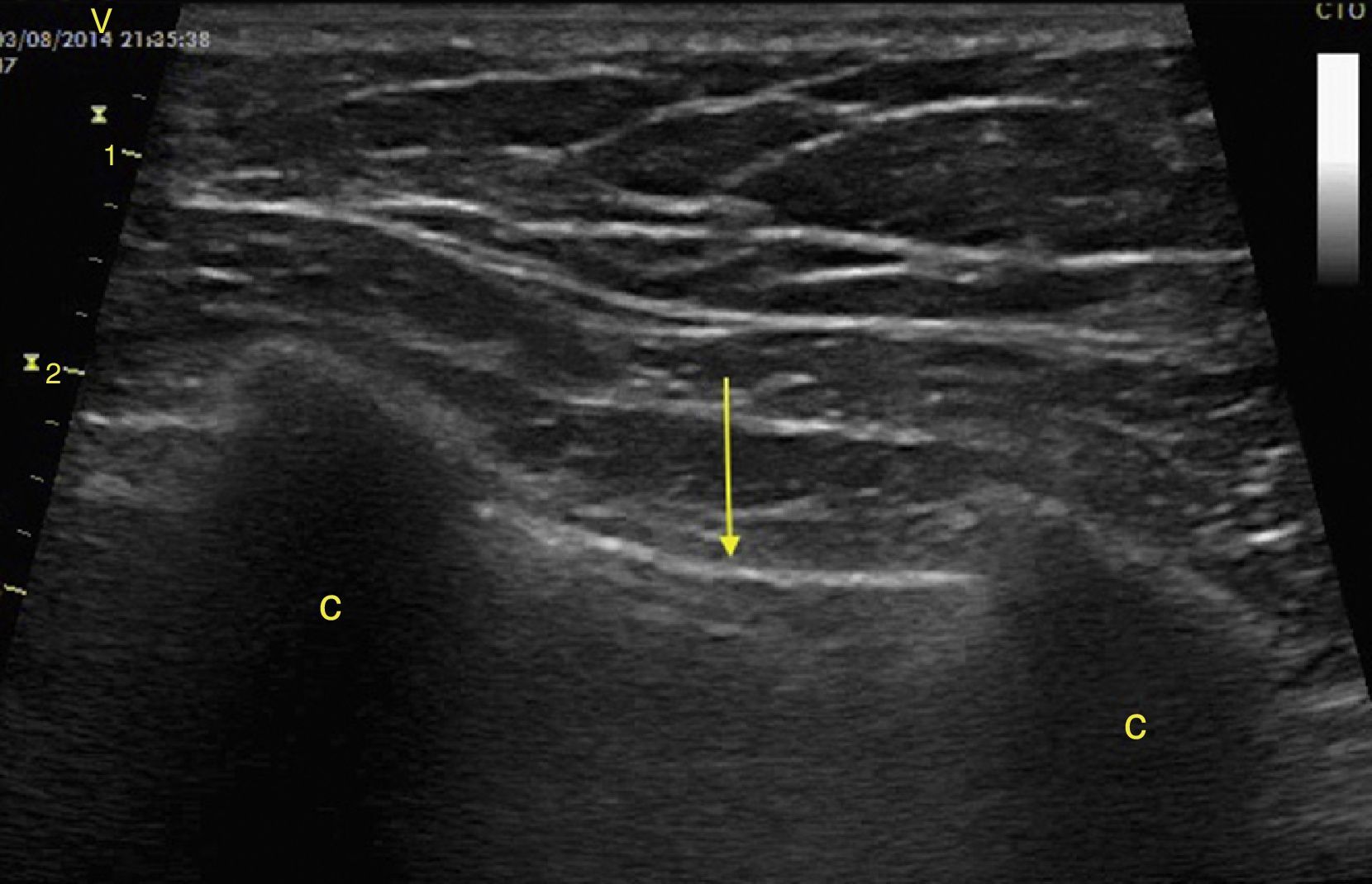
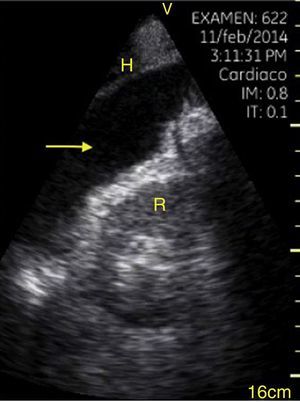
El derrame pleural se debe buscar en los cuadrantes periesplénico y perihepático del EFAST desplazándose 2 espacios intercostales hacia cefálico para ubicar el diafragma24. Normalmente hacia cefálico del diafragma hay un reflejo del bazo o hígado (fig. 1C) mientras que ante la presencia de derrame pleural se observa una imagen hipoecoica y se comprime el pulmón dándole la apariencia de órgano sólido (hepatización del pulmón) (fig. 16)24.
ConclusiónLa ecografía es una herramienta importante para el diagnóstico y manejo de eventos críticos, disminución de morbimortalidad y predicción de supervivencia en trauma y AESP, disminución de complicaciones de procedimientos invasivos y mejora de toma de decisiones en paro cardíaco y falla ventilatoria aguda. La ecografía realizada por no expertos con un mínimo entrenamiento enfocado al reconocimiento de situaciones específicas tiene una adecuada correlación con el experto. Las variables de evaluación con ecografía más relevantes en situaciones críticas en salas de cirugía son la función ventricular izquierda, respuesta al volumen, dilatación ventricular derecha, taponamiento cardíaco y la evaluación pulmonar.
FinanciamientoNo existen fuentes de financiacio¿n
Conflicto de interesesNo hay conflicto de intereses


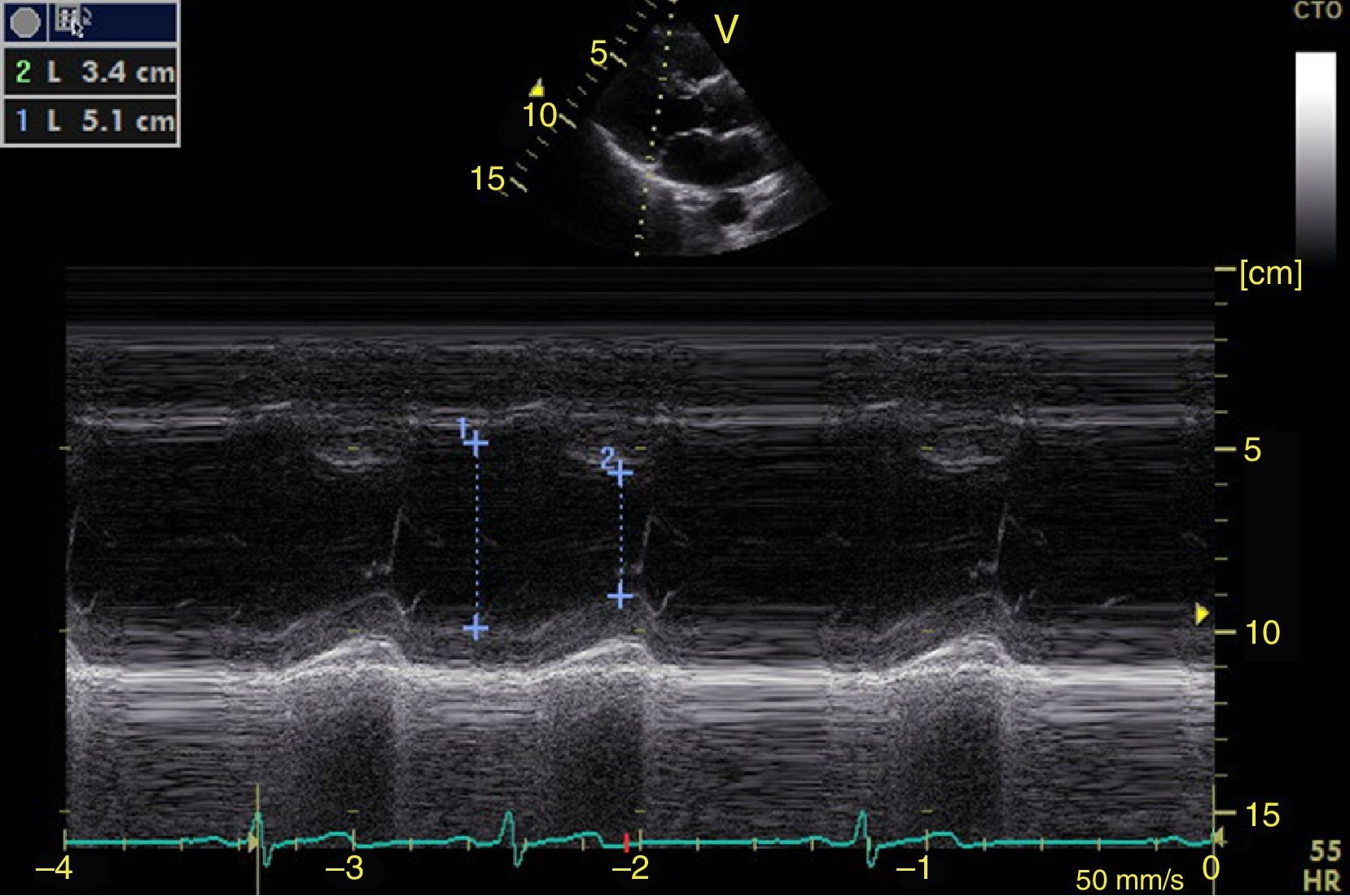
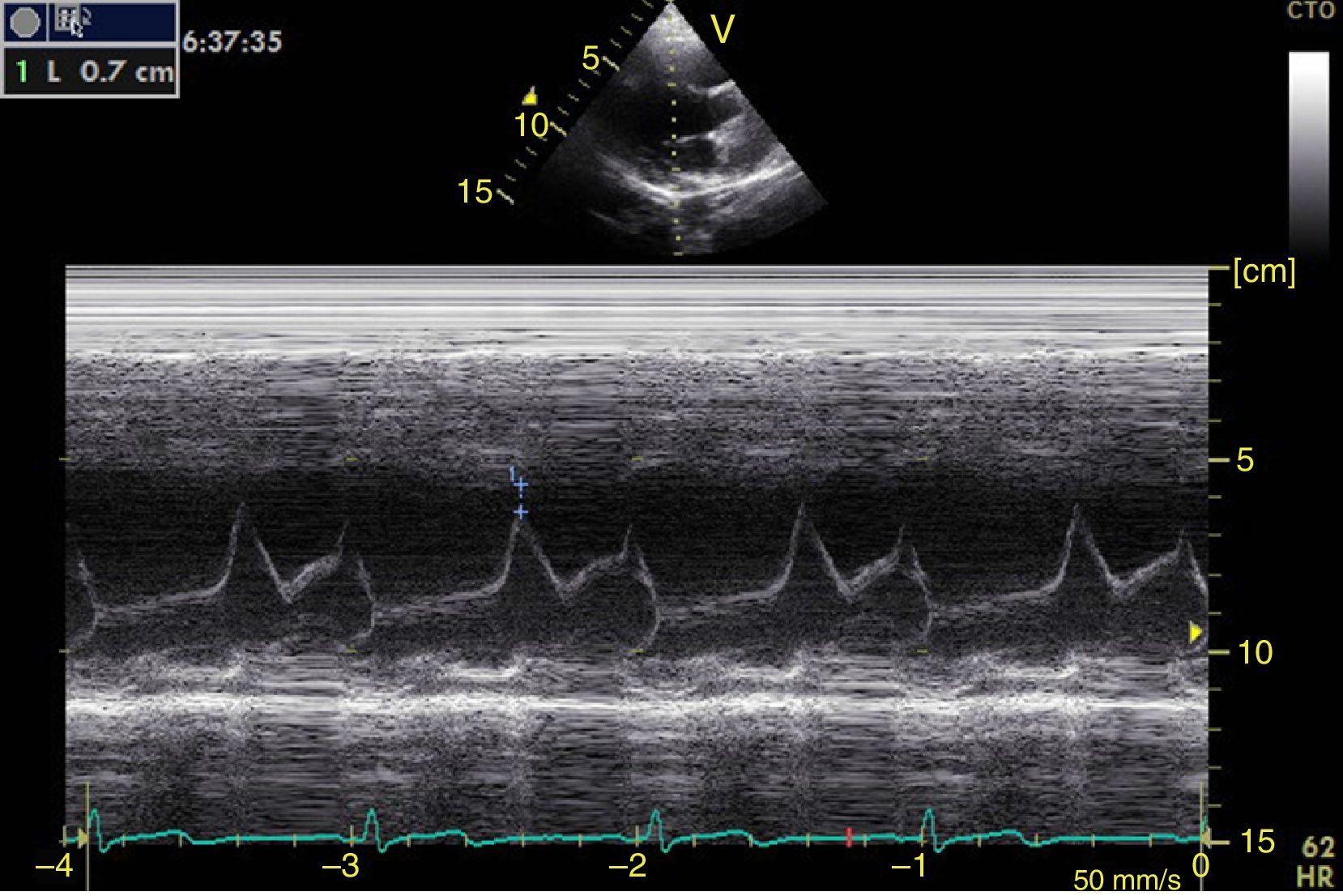
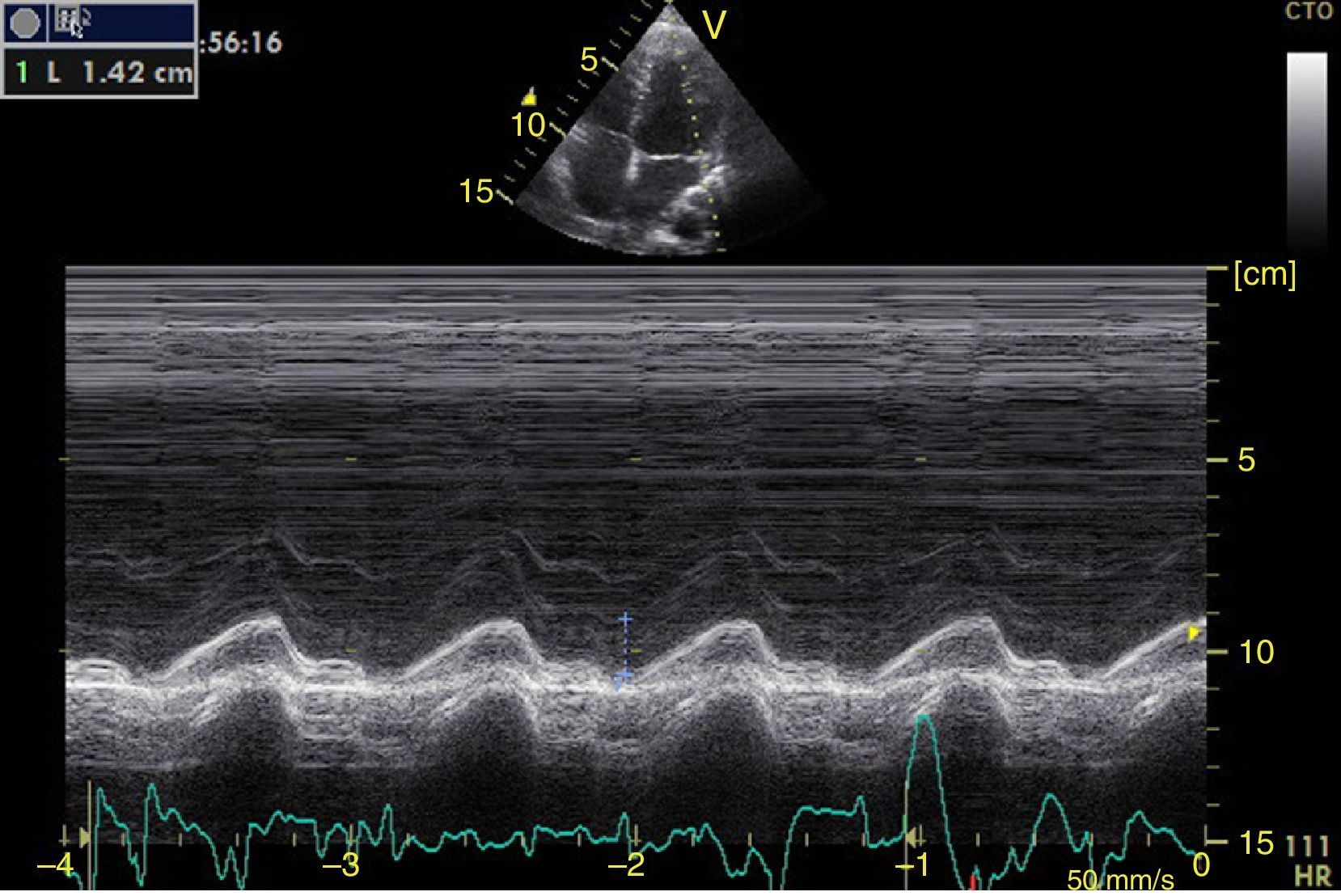
![Ventana paraesternal eje largo en modo M. Fracción de acortamiento= [DM−Dm/DM]×100. Valor normal>25%. DM: diámetro mayor (línea azul 1), Dm: diámetro menor (línea azul 2). Fuente: autores. Ventana paraesternal eje largo en modo M. Fracción de acortamiento= [DM−Dm/DM]×100. Valor normal>25%. DM: diámetro mayor (línea azul 1), Dm: diámetro menor (línea azul 2). Fuente: autores.](https://static.elsevier.es/multimedia/01203347/0000004300000004/v1_201510300044/S012033471500043X/v1_201510300044/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)