La levadura Candida fukuyamaensis RCL-3 presenta la capacidad de disminuir la concentración de cobre presente en un medio de cultivo. Observamos que la presencia de altas concentraciones de cobre cambia el color de las células de blanco/crema a marrón. La coloración desaparece cuando las células son tratadas KCN o cuando crecen en un medio sin adición de iones sulfato. Estos resultados se corresponden con la probable formación de biominerales de CuS sobre la superficie de las células. En este informe ponemos en evidencia que la mineralización sería un mecanismo utilizado por la levadura estudiada para biorremediar el cobre.
Candida fukuyamaensis RCL-3 yeast has the ability to decrease copper concentration in a culture medium. High copper concentrations change the cell color from white/cream to brown. The effect of color change ceases with the addition of KCN or when cells are grown in a culture medium without sulfate ions. These results could be associated with CuS bioaccumulation in the cell surface. This report revealed that mineralization would be a mechanism used by this yeast for copper bioremediation.
En un trabajo previo se aisló la levadura Candida fukuyamaensis RCL-3 de un canal de drenaje de una planta de filtro de cobre en la localidad de Ranchillos, Tucumán. Esta cepa fue seleccionada por poseer resistencia y/o tolerancia a altas concentraciones de Ni(II), Cr(VI), Cd(II) y Cu(II)11. La alta resistencia al Cu(II) de esta levadura autóctona fue luego demostrada en ensayos semicuantitativos y cualitativos; asimismo, fueron realizadas caracterizaciones de dicha levadura mediante estudios morfológicos y de actividades enzimáticas12. Un estudio de publicación reciente reveló mediante herramientas proteómicas parte de las rutas metabólicas utilizadas por C.fukuyamaensis RCL-3 cuando es cultivada en presencia de cobre5.
Basándonos en el gran interés biotecnológico que presenta esta levadura para la biorremediación de Cu(II), nos planteamos como objetivo de este trabajo determinar si la biomineralización del cobre sobre la superficie de la células es uno de los mecanismos que utiliza C.fukuyamaensis RCL-3 para disminuir la concentración del metal en el medio de cultivo.
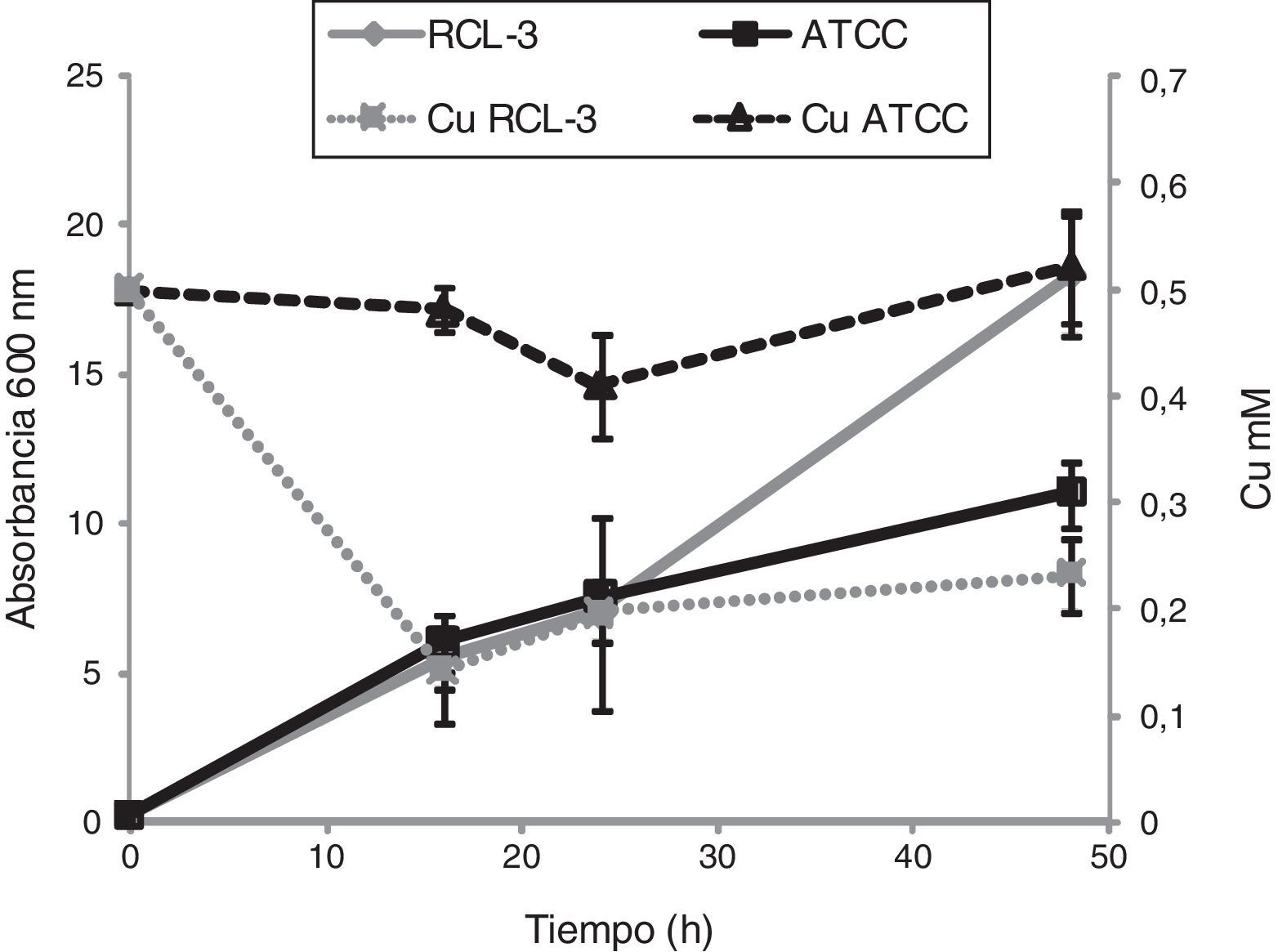
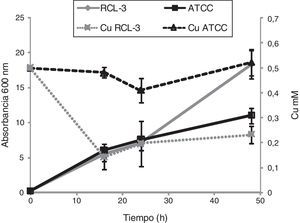
Como punto de partida se realizaron curvas de crecimiento y de remoción de cobre con la cepa de interés, C.fukuyamaensis RCL-3, y con una cepa control: Saccharomyces cerevisiae ATCC 3205. Los resultados demuestran la capacidad que presenta la levadura autóctona de interaccionar con el metal disminuyendo un 70% del cobre inicialmente añadido (fig. 1). Sin embargo, en el caso de la cepa de levadura de colección no se observó remoción de dicho metal, el cual fue medido y tuvo una concentración de 0,52±0,12mM luego de 48h de cultivo (fig. 1). Por otro lado, se pudo observar un crecimiento diferente entre ambas cepas cuando fueron cultivadas con adición de Cu(II): S.cerevisiae ATCC 3205 alcanzó una absorbancia (Abs600nm) de 11,0±1, mientras que C.fukuyamaensis RCL-3 alcanzó una Abs600nm de 18,4±2 (fig. 1). Estos resultados y los publicados anteriormente11 ponen de manifiesto que la capacidad de remediar el cobre por parte de la cepa C.fukuyamaensis RCL-3 no afecta su crecimiento, por lo que puede tener un gran futuro para su aplicación a gran escala.
Efecto de 0,5mM de Cu en el crecimiento de Candida fukuyamaensis RCL-3 y de Saccharomyces cerevisiae ATCC 32051 y concentración de cobre extracelular en el medio de cultivo a diferentes tiempos de incubación. Absorbancia a 600nm de cultivos de C.fukuyamaensis RCL-3 (diamantes grises) y de S.cerevisiae ATCC 32051 (cuadrados negros) a 16, 24 y 48h. Concentración de cobre en el medio de cultivo luego de 12, 24 y 48h de incubación con C.fukuyamaensis RCL-3 (cuadrados grises) y con S.cerevisiae ATCC 32051 (triángulos negros). El experimento fue realizado por triplicado y las barras de error representan el desvío estándar.
A pesar de que diversos autores han estudiado los microorganismos y en particular las levaduras en procesos de biorremediación de metales pesados, existe poca información sobre cuáles son los mecanismos que estos utilizan. Nuestra hipótesis es que la precipitación-biomineralización de cobre en sulfuro de cobre (CuS) es uno de los mecanismos utilizados por la levadura C.fukuyamaensis RCL-3 para biorremediar el Cu(II). En trabajos previos, al determinar la distribución intracelular del cobre en C.fukuyamaensis RCL-3 mediante microscopia de transmisión electrónica, se evidenció la presencia de cuerpos negros tanto en el citoplasma como en la pared celular, correspondientes a depósitos de cobre12.
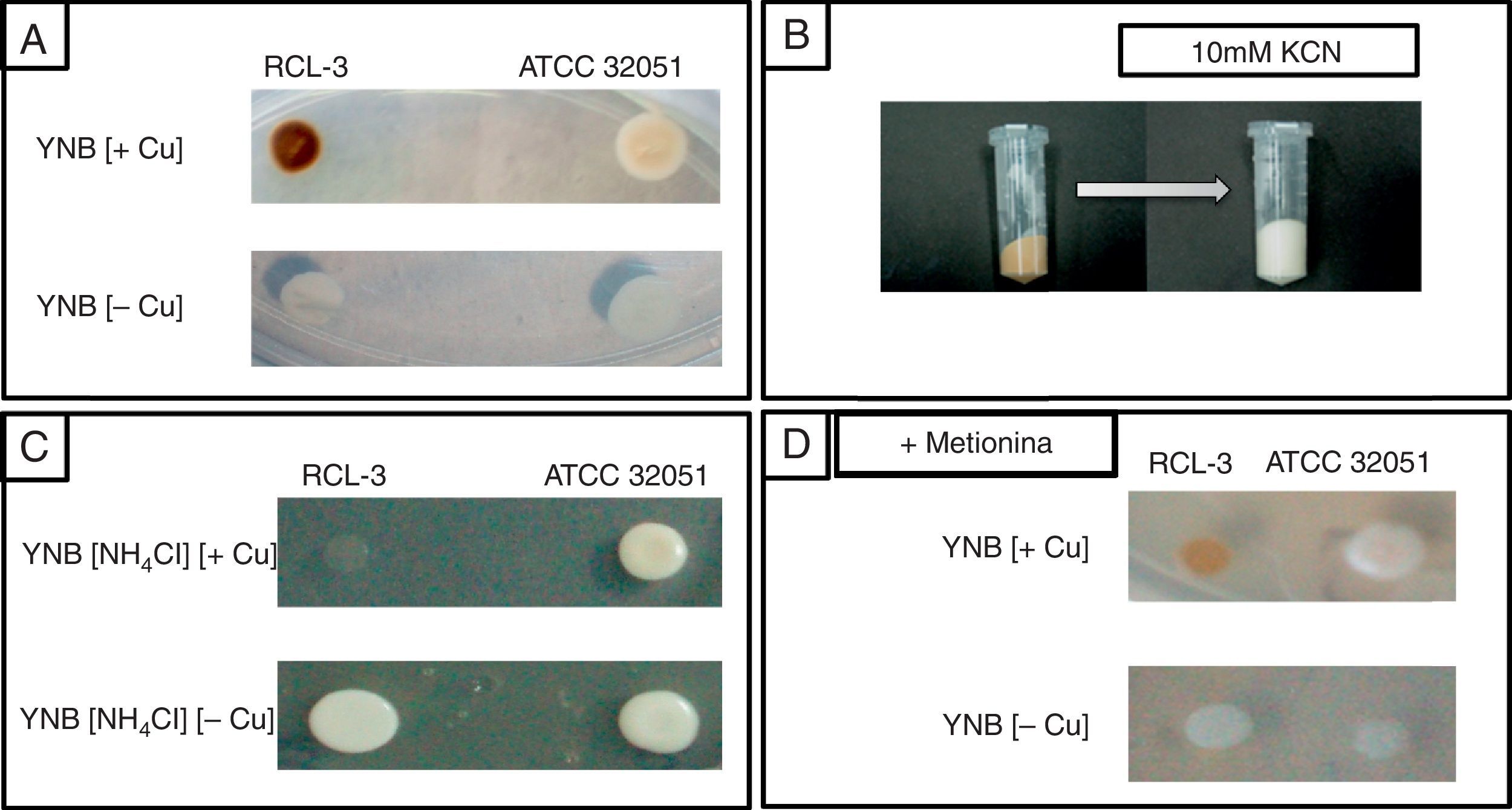
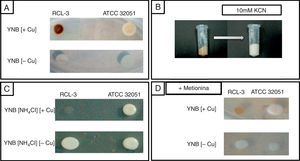
Por otro lado, al cultivar C.fukuyamaensis RCL-3 en medio YNB-glucosa (glucosa 20g/l, Tris pH 5, 50mM, YNB sin aminoácidos 6,7g/l) en presencia de 0,5mM de CuSO4, observamos que las células se tornaban de color más oscuro respecto de la coloración observada en las mismas levaduras crecidas sin cobre en el medio de cultivo. Este cambio en la coloración se vio exacerbado a las 16h de cultivo. El cambio en la coloración de las colonias de C. fukuyamaensis RCL-3 de blancas/cremas a un intenso marrón pudo ser visualizado en medio sólido YNB-glucosa con 0,5mM de CuSO4, incubado a 30°C durante 72h (fig. 2A).
Crecimiento de las levaduras Candida fukuyamaensis RCL-3 y Saccharomyces cerevisiae ATCC 32051 en presencia y ausencia de cobre en medios de cultivos sólidos y efecto del KCN sobre C.fukuyamaensis RCL-3. A)Crecimiento en medio YNB-glucosa con (+Cu) y sin (−Cu) cobre de C.fukuyamaensis RCL-3 y S.cerevisiae ATCC 32051 luego de 48h a 30°C. B)Pellet celular de C.fukuyamaensis RCL-3 luego de 16h de cultivo en medio YNB-glucosa suplementado con 0,5mM CuSO4, antes y después del tratamiento con 10mM KCN. C)Crecimiento de las levaduras C.fukuyamaensis RCL-3 y S.cerevisiae ATCC 32051 en medio de cultivo YNB-glucosa sin (NH4)2SO4 y con NH4Cl como fuente de nitrógeno y con (+Cu) o sin (−Cu) la adición de CuSO4 luego de 48h a 30°C. D)Crecimiento de las levaduras C.fukuyamaensis RCL-3 y S.cerevisiae ATCC 32051 en medio de cultivo YNB-glucosa, suplementando con 1,2mM de metionina y con (+Cu) o sin (−Cu) la adición de CuSO4 luego de 48h a 30°C.
Durante los últimos años, el estudio de la biorremediación de metales tóxicos como el cobre ha recibido gran atención, no solo por su importancia científica, sino también por sus potenciales aplicaciones industriales9,13. Con respecto a la bioadsorción, también denominada biomineralización, se ha demostrado que algunos microorganismos son capaces de precipitar diversos metales, entre ellos el Cu(II). Uno de los minerales capaces de ser producidos por los microorganismos es el sulfuro de cobre, el cual se deposita sobre la superficie de las células14. Este proceso de mineralización requiere de fuente de iones sulfuro y de iones cobre para la formación de los cristales de CuS6.
Otros investigadores observaron que la precipitación del Cu en forma de CuS resulta en una coloración marrón cuando la concentración del mineral estaba entre 0,5 y 5mM7. Con el fin de demostrar que la pigmentación marrón observada en C.fukuyamaensis RCL-3 en presencia de cobre proviene de la mineralización y formación de CuS en la pared de las células, se realizaron ensayos de disociación del complejo CuS.
Los cristales de CuS son estables en medio ácido, pero se disocian en presencia de KCN como resultado de la formación de complejos de cianuro de cobre, lo que provoca la pérdida instantánea del color marrón en el pellet celular14. Con el objetivo de demostrar la presencia de CuS sobre la superficie celular de C.fukuyamaensis RCL-3, células de 16h de cultivo con adición de 0,5mM de CuSO4 fueron centrifugadas para la eliminación del medio de cultivo y resuspendidas en HCl 1N o KCN 10mM. Como puede observarse en la figura 2B, la adición de KCN en las células de C.fukuyamaensis RCL-3 previamente tratadas con cobre provoca la pérdida de coloración de forma instantánea, demostrando la formación de complejos de cianuro de cobre. Con el objetivo de comprobar que la pérdida de coloración de las células no se debía a su acidificación, se realizaron tratamientos de C.fukuyamaensis RCL-3 con HCl como medio ácido. Se observó que la coloración marrón del pellet celular no sufrió ninguna modificación en presencia de HCl, manteniéndose el color marrón que las células habían adquirido previamente.
Otra manera de demostrar la mineralización del cobre sobre la superficie celular es a través del estudio de la fuente de los iones sulfuro que participan en la precipitación de los iones cobre durante la formación del sulfuro de cobre.
El medio de cultivo YNB-glucosa utilizado en los ensayos aquí descriptos posee (NH4)2SO4 como única fuente de nitrógeno y de sulfato. Se realizaron ensayos en medio de cultivo YNB-glucosa reemplazando el (NH4)2SO4, por NH4Cl como fuente de nitrógeno, y de esta forma se eliminó toda fuente de iones sulfato. Como se observa en los cultivos sólidos de la figura 2C, la eliminación del sulfato del medio imposibilitó la formación del biomineral y, por lo tanto, no se observó coloración marrón en presencia de cobre.
La falta de coloración en las células en el medio de cultivo YNB-glucosa sin (NH4)2SO4 fue observada también en medio líquido. Fue interesante descubrir que, además de perder su coloración, las colonias de C.fukuyamaensis RCL-3 también veían afectado su crecimiento negativamente (fig. 2C). Esto podría indicar la dificultad de estas levaduras para desarrollarse en presencia de cobre sin una fuente externa de iones sulfato. Este hecho nos lleva a hipotetizar que cuando C.fukuyamaensis RCL-3 está en presencia de cobre y sin iones sulfato, no presenta la capacidad de depositar cobre en forma de CuS. Esta incapacidad para la formación de minerales de cobre generaría, además, una sensibilidad al metal. Cabe destacar que la disminución en el crecimiento de las células de C.fukuyamaensis RCL-3 fue verificada también por densidad óptica a 600nm, ya que se observó aproximadamente un 70% menos de crecimiento (datos no mostrados).
Tanto la coloración como el crecimiento de las células de S.cerevisiae ATCC 32051 no se vieron afectadas en presencia de (NH4)2SO4 o NH4Cl como fuentes de nitrógeno, ni por la adición o no del metal (fig. 2C). Por lo tanto, S.cerevisiae ATCC 32051 permaneció con uno tono blanco/crema bajo todos los tratamiento efectuados (fig. 2). Este hecho se corresponde con la falta de capacidad que presenta esta cepa de interaccionar con el metal, como se demuestra en la figura 1.
Yu et al.14 reportaron resultados similares con respecto a la coloración de las células en una levadura modificada genéticamente que presentaba la capacidad de formar CuS sobre la superficie celular en presencia de cobre. Dicha levadura también demostró la atenuación del color marrón a partir del reemplazo del (NH4)2SO4 por NH4Cl como fuente de nitrógeno para la eliminación de los iones sulfato. De modo similar, los ensayos con KCN eliminaron la coloración marrón de las células que presentaban depósitos de CuS. Otras investigaciones demostraron que bacterias con capacidad de reducir el sulfato en presencia de cobre también fueron capaces de remover del medio el cobre mediante su precipitación y bioacumulación en forma de minerales del azufre4,8. A partir de estudios de microscopia electrónica se pudo determinar que los biominerales formados por la bacteria Citrobacterspp. eran del tipo CuS y generaban un oscurecimiento de las bacterias8.
Por último, se cultivó C.fukuyamaensis RCL-3 y S.cerevisiae ATCC 32051 en medio YNB-glucosa suplementado con 1,2mM de metionina. Un exceso de metionina en presencia del metal produjo una disminución de la intensidad del color marrón de las colonias de C.fukuyamaensis RCL-3 (fig. 2D). Esto se debe a que un exceso de metionina es capaz de elevar los niveles de S-adenosilmetionina, un correpresor de los genes involucrados en la reducción de sulfato3. Esto dificulta la disponibilidad de iones sulfuro, a partir de los cuales se producen los cristales de CuS. Por lo tanto, la adición de metionina en el medio de cultivo disminuye la formación de CuS.
Todos los resultados expuestos con respecto a la capacidad que tiene la levadura C.fukuyamaensis RCL-3 de interaccionar con el cobre pueden explicarse a partir de la existencia de un mecanismo de precipitación del cobre sobre la pared celular de esta levadura. Otros autores relacionaron la capacidad de detoxificación del cobre con la precipitación de CuS en la superficie de las levaduras2. La precipitación del cobre sobre la superficie de los microorganismos en forma de CuS parece estar relacionada con la capacidad de resistir altas concentraciones de dicho metal. Aunque la mayoría de los estudios en este sentido fueron realizados en cepas de S.cerevisiae modificadas genéticamente, con deleciones o adiciones que les confieren resistencia al cobre2,14, la levadura Rhodotorula aislada de una mina y con gran tolerancia al cobre también demostró ser capaz de producir CuS sobre la superficie de sus células1. Por lo expuesto, la capacidad de las levaduras para precipitar el cobre en forma de CuS parece estar relacionada con su capacidad de resistir altas concentraciones del metal.
Estudios de microscopia electrónica efectuados en la cepa bajo estudio demuestran la presencia de acúmulos de cobre que se localizan cercanos a la pared celular, más específicamente en el límite entre esta última y la membrana12. Dichas observaciones son coherentes con la formación de biominerales en la superficie de las células. Sin embargo, para corroborar la localización del CuS en las levaduras estudiadas sería necesario un estudio más profundo que determinara la composición molecular de los depósitos formados.
Es interesante comentar que estudios recientes reportaron que los genes que participan en la biomineralización del cobre sobre la superficie de las células también se encuentran involucrados en la homeostasis del cobre, al estabilizar diferentes ARN mensajeros10. Resulta llamativo que muchas de las proteínas observadas como sobreexpresadas en presencia de cobre en C.fukuyamaensis RCL-3, en el estudio proteómico fueron proteínas ribosomales5. Nuestros hallazgos alientan a la realización de nuevos estudios, que podrían relacionar la síntesis de proteínas ribosomales con la biomineralización del cobre en C.fukuyamaensis RCL-3.
A partir del presente trabajo podemos continuar profundizando en la composición del biomineral formado, así como también en el estudio de las rutas metabólicas, moléculas, y enzimas involucradas en la precipitación-biomineralización del cobre en forma de CuS, con el fin de demostrar que este es uno de los principales mecanismos utilizados por la levadura autóctona C.fukuyamaensis RCL-3 para la remoción del cobre. Por otro lado, este es el primer trabajo que describe ensayos simples, capaces de indicar la precipitación de cobre en presencia de iones sulfato y que podrían ser reproducidos por otros investigadores utilizando diversos microorganismos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Este trabajo fue financiado por la Agencia Nacional de Promoción Científica Tecnológica, FONCYT (PICT 2013-0932), y por el Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET).