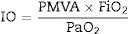El síndrome de hipertensión pulmonar persistente del recién nacido es una entidad clínica que se presenta ante algunos factores de riesgo, condicionada por una alta presión en la arteria pulmonar de forma persistente que altera la transición de la circulación fetal a la posnatal.
ObjetivoRealizar una guía de práctica clínica para la atención de estos pacientes.
MetodologíaSe siguieron las pautas definidas por el Ministerio de Protección Social de Colombia en su guía metodológica para la elaboración de guías de práctica clínica basadas en la evidencia.
Materiales y métodosBúsqueda de la literatura en las bases Lilacs, Embase, Pubmed, Mdconsult, Cochrane, Scopus, clinicaltrials.gov y buscadores de internet, en inglés y en español.
DiscusiónEn el recién nacido ocurre en 1,9 por 1.000 nacidos vivos y su incidencia está estimada en el 0,2% de todos los recién nacidos vivos. Se considera un problema clínico importante en nuestra unidad de cuidado intensivo neonatal, ya que contribuye a la morbimortalidad de los a término y pretérmino. No corresponde a una patología única, y puede ser tanto primaria como secundaria. Se analizan condiciones como asfixia in útero y perinatal, infección, aspiración de meconio, síndrome de distrés respiratorio e hipoplasia pulmonar, responsables de los principales motivos de ingreso a la unidad de cuidado intensivo neonatal.
ConclusiónEs fundamental el diagnóstico temprano de la causa subyacente para iniciar el tratamiento adecuado.
Persistent pulmonary hypertension syndrome of the newborn is a clinical condition that occurs in the presence of some risk factors, conditioned by persistent high pressure in the pulmonary artery that alters the transition from foetal to neonatal circulation.
ObjectiveTo create a clinical practice guideline for managing these patients.
MethodologyThe principles defined by the Colombian Ministry of Social Protection in its instructions to develop evidence-based clinical practice guidelines were followed.
Materials and methodsA search was made in the literature using Lilacs, Embase, PubMed, Mdconsult, Cochrane, Scopus, Clinicaltrials.gov databases and internet browsers, in English and Spanish.
DiscussionThis syndrome occurs in 1.9 per 1000 of live births, and its incidence is estimated at 0.2% of all live-born infants. It is considered an important problem in our neonatal intensive care unit (NICU) as it contributes to morbidity and mortality in preterm or term infants. It is not a singular disease, and may be primary or secondary. An analysis is also presented of the conditions that account for the main reasons for admission to the NICU such as in-utero and perinatal asphyxia, infection, meconium aspiration syndrome, respiratory distress syndrome, and hypoplastic lungs.
ConclusionsEarly diagnosis of the underlying cause is critical in order to initiate adequate treatment.
El síndrome de hipertensión pulmonar persistente (HTPP) del recién nacido es una entidad clínica caracterizada por hipoxemia acentuada y cianosis generalizada debido a la existencia de cortocircuito de derecha a izquierda a través del foramen oval o del ductus arterioso que condicionan un insuficiente flujo sanguíneo pulmonar por persistencia de presiones elevadas anormales de la arteria pulmonar en un corazón con estructura sana. Puede presentarse en forma primaria o secundaria1.
Ha sido reconocida por más de 40 años desde su descripción inicial por Gersony et al.2. Se desconoce su verdadera incidencia, pero se reporta en la literatura 2 casos por 1.000 nacidos vivos en Estados Unidos de Norteamérica. Sin embargo, la incidencia ha cambiado en la última década debido a la disminución de las patologías asociadas con este síndrome, entre ellas la reducción del síndrome de aspiración de meconio y el número de embarazos posfechados3. En contraparte, el aumento de HTTP secundaria al síndrome de distrés respiratorio ha aumentado debido al mayor número de cesáreas entre las semanas 34 a 371.
La historia natural de la HTPP ha cambiado como resultado de mejoras en la atención materna y al aumento de la disponibilidad y las condiciones de sitios de atención a recién nacidos; por ello la importancia de brindar criterios de diagnóstico y de manejo óptimos de esta enfermedad, con el fin de disminuir la heterogeneidad en la práctica clínica, la brecha entre las recomendaciones basadas en la evidencia y la práctica clínica real, y los costos en salud derivados de su tratamiento, además de proporcionar recomendaciones basadas en la evidencia acerca de las nuevas opciones terapéuticas.
MetodologíaPara la realización de la guía de práctica clínica se utilizó la metodología expuesta por el ministerio de la protección social en su Guía Metodológica para la elaboración de Guías de práctica clínica basadas en la evidencia, de evaluaciones económicas y de evaluación del impacto de la implementación de las guías en el POS y Unidad de pago por capitación del sistema general de seguridad social en salud colombiano4. Se realizaron una serie de preguntas que después fueron validadas y se llevó a cabo una revisión sistemática de la literatura existente. Los resultados se evaluaron y se definió el cumplimiento de los criterios de calidad. La búsqueda de la literatura fue realizada en las siguientes bases de datos: Lilacs, Embase, Pubmed, Mdconsult, Cochrane, Scopus, clinicaltrials.gov y buscadores de internet. Se utilizaron los siguientes términos MeSH: persistent pulmonary hypertension, infant, diagnosis, therapeutics y los términos DeCS hipertensión pulmonar persistente, diagnóstico, neonato, terapéutica; por último, se restringió la búsqueda a los idiomas inglés y español. Para la representación de la calidad de la evidencia y la fuerza de la recomendación se utilizó el sistema Grade5 (tabla 1).
Calidad de la evidencia científica y de la fuerza de las recomendaciones
| Nivel de evidencia | |
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | |
| Fuerte a favor de utilizar la recomendación | 1 |
| Débil a favor de utilizar la recomendación | 2 |
| Débil en contra de utilizar la recomendación | 2 |
| Fuerte en contra de utilizar la recomendación | 1 |
Realizar una guía de práctica clínica de atención al recién nacido con HTPP utilizando la metodología de medicina basada en la evidencia, que será aplicada en la unidad de cuidado intensivo neonatal del Hospital de San José de Bogotá DC.
Objetivos específicos- •
Unificar criterios para abordaje, evaluación y manejo de neonatos con sospecha y diagnóstico confirmado de hipertensión pulmonar.
- •
Basados en el nivel de evidencia, dar recomendaciones que ayuden a la toma de decisiones apropiadas en el diagnóstico y manejo de neonatos con hipertensión pulmonar.
- •
Establecer parámetros de cuidado clínico que puedan servir como base para el mejoramiento continuado de la calidad.
- •
Contribuir con un documento que fortalezca el conocimiento de los profesionales en formación que realizan prácticas en la unidad de cuidado intensivo neonatal del Hospital de San José.
La HTPP es un síndrome caracterizado por aumento en la resistencia vascular pulmonar (RVP), cortocircuito de derecha a izquierda a través del foramen o del ductus arterioso permeable e hipoxemia intensa, asociado con anomalías del parénquima pulmonar6. Después del nacimiento, el feto debe adaptarse muy rápido al medio extrauterino, razón por la cual cambia todo su sistema cardiopulmonar, disminuye las presiones en la arteria pulmonar para permitir el flujo sanguíneo a este y aumenta la resistencia vascular sistémica que asegure un adecuado aporte sanguíneo al resto del cuerpo. Si este proceso de adaptación falla, el resultado es la insuficiencia respiratoria hipoxémica o hipertensión pulmonar persistente del recién nacido (HTPP)6.
Durante la vida intrauterina el pulmón fetal es un órgano lleno de líquido que no participa en el intercambio gaseoso y ofrece alta resistencia al flujo de sangre. Los pulmones fetales reciben solo el 5-15% del volumen de líquido que sale del ventrículo derecho. La poca tensión de oxígeno presente durante la vida fetal y la liberación de vasoconstrictores endógenos, como la endotelina-1 y el tromboxano, facilitan el mantenimiento de la alta RVP, la cual sufre una disminución dramática en el nacimiento, ocasiona una disminución del 50% en la presión de la arteria pulmonar y un aumento en el flujo sanguíneo pulmonar durante los primeros minutos de esta transición7,8.
¿Cuáles son la incidencia, la prevalencia y la mortalidad de la hipertensión pulmonar persistente?La HTPP contribuye en forma significativa a la morbimortalidad de los recién nacidos tanto a término como pretérmino. La incidencia se estima en 2×1.000 nacidos vivos. La mortalidad ha venido en descenso, pues en la década de los ochenta del siglo pasado se estimaba entre el 11 y el 34%; ahora se conoce que es inferior al 10% gracias al aumento de la atención en los centros de tercer y cuarto nivel1.
¿Cuáles son los factores de riesgo para la presentación de la hipertensión pulmonar persistente?Los recién nacidos que presentan HTPP no logran establecer una adecuada oxigenación y pueden desarrollar una disfunción multiorgánica; se presenta por lo general poco después del nacimiento y se debe a múltiples etiologías. La mayoría de los casos de HTTP se asocian con enfermedades que alteran el parénquima pulmonar, tal como el síndrome de aspiración de meconio y el síndrome de dificultad respiratoria; sin embargo, algunos de los neonatos pueden presentar HTTP primaria, pues no cursan con enfermedad pulmonar que pudiera explicar su etiología9-11. Otras causas que condicionan la severidad de los síntomas, menor respuesta y mayor mortalidad son la displasia alveolocapilar, defectos genéticos en la síntesis de surfactante, hipoplasia pulmonar severa secundaria a oligohidramnios y anomalías congénitas12,13. Algunos autores han descrito como factor condicionante el consumo materno de AINE durante el tercer trimestre de gestación, pero esta asociación se ha descartado14.
EtiologíaSíndrome de aspiración de meconioTiene una incidencia del 5%, aunque la presentación de meconio en líquido amniótico se produce entre el 10 y el 15% de los embarazos, con un descenso en las últimas décadas dada la disminución de los embarazos postérmino15. Es considerado la causa más común de HTTP, porque afecta entre 25.000 y 30.000 infantes y causa 1.000 muertes al año en Estados Unidos15. La aspiración de meconio afecta el pulmón a través de múltiples mecanismos, incluyendo la obstrucción mecánica de las vías respiratorias, neumonitis química debido a la inflamación, activación de complemento, inactivación de sustancias tensioactivas y vasoconstricción a nivel pulmonar.
Hipertensión pulmonar persistente primaria del recién nacidoLos neonatos suelen tener hipoxemia en ausencia de enfermedad pulmonar parenquimatosa. La causa de la HTPP aún no ha sido esclarecida, pero en necropsias realizadas en niños se observó remodelación importante de la vasculatura pulmonar con engrosamiento de la pared de los vasos e hiperplasia del músculo liso y extensión hasta el nivel de las arterias intraacinares, que normalmente no se produce sino hasta más tarde en el periodo posnatal. Como resultado, los bebés afectados no dilatan su vasculatura pulmonar de una forma adecuada en respuesta a estímulos relacionados con el parto y cursan con hipoxemia profunda y campos pulmonares claros, hiperlúcidos en la radiografía; de ahí el término «pulmón negro»16.
Se considera que un factor que puede contribuir a esta patología puede ser la vasoconstricción prenatal del ductus arterioso. En reportes de casos y análisis de estudios retrospectivos se ha identificado como factor precipitante el consumo materno de AINE en el tercer trimestre, y su concentración en el meconio está relacionada con la gravedad del cuadro16.
Neumonía y sepsisLa HTPP puede ser una complicación de la sepsis o de una neumonía con agentes causales comunes de la etapa neonatal (Streptococcus del grupoB y bacterias gramnegativas)9. La causa de la HTPP puede explicarse por varios mecanismos; por ejemplo, la liberación de endotoxinas bacterianas por parte de los microrganismos desencadena toda una respuesta inflamatoria secundaria, conduce a la liberación de tromboxano endotelial y de varias citoquinas (como el factor de necrosis tumoral-alfa) que condicionan un aumento en la RVP1.
La sepsis también conduce a hipotensión sistémica debido a la actividad de la óxido nítrico sintetasa, inducible con el exceso de liberación de óxido nítrico en los lechos vasculares sistémicos que lleva a alteración de la función del miocardio y fracaso multiorgánico, que resulta como respuesta final a la hipertensión pulmonar17. El estado inflamatorio desarrollado en la sepsis puede activar la óxido nítrico sintetasa, que genera a su vez hipotensión sistémica, alteración de la función miocárdica y compromiso orgánico múltiple.
Síndrome de dificultad respiratoria del recién nacidoLa HTPP puede ocurrir como complicación, a corto plazo, en los recién nacidos pretérmino, a menudo en aquellos por parto por cesárea electiva o indicada a las 34 a 37semanas de gestación, debido al aumento de la reactividad de las arterias pulmonares en este período de gestación, lo que predispone el desarrollo de hipertensión pulmonar cuando se altera el intercambio de gases por el déficit de surfactante pulmonar1.
Hipoplasia pulmonarLa hernia diafragmática congénita y el oligohidramnios secundario a anomalías renales congénitas o a una ruptura prematura de membranas pueden llevar a hipoplasia pulmonar. La hipertensión pulmonar ocurre como una complicación debido a la disminución del número de vasos sanguíneos y el aumento de la reactividad de los vasos del pulmón hipoplásico12.
La HTPP secundaria a estas patologías es por lo regular más crónica y menos sensible a la terapia vasodilatadora. El resultado de estos pacientes depende del grado de hipoplasia pulmonar, de las anomalías asociadas y de la duración de la hipertensión pulmonar; en la actualidad, con el uso de la ventilación mecánica, la supervivencia se encuentra por encima del 75%12.
Causas letales de hipertensión pulmonar persistenteOtra causa menos común pero igual de importante por su alta mortalidad es la displasia alveolocapilar que puede presentarse en el nacimiento o días después de este, con cianosis progresiva e hipertensión pulmonar grave. El diagnóstico se realiza mediante biopsia pulmonar o hallazgos en la necropsia. Esta patología es de herencia autosómica recesiva y en algunas series de casos el 50% de los recién nacidos con displasia alveolocapilar se han asociado con malformaciones renales, gastrointestinales y cardiacas1,18.
¿Cuáles son los síntomas clínicos que hacen sospechar hipertensión pulmonar persistente?Un recién nacido a término o pretérmino tardío que presenta síntomas de dificultad respiratoria poco después del parto puede ser secundaria a una variedad de enfermedades pulmonares o solo una transición retardada a la vida extrauterina. Sin embargo, si el recién nacido tiene dificultad respiratoria que aumenta en severidad con disminución en la oxigenación e hipoxemia, se debe sospechar HTPP19. El examen físico revela taquipnea, retracciones y cianosis; en la auscultación cardiaca se puede escuchar un soplo sistólico de regurgitación tricuspídea o S2 prominente, aunque este hallazgo está presente en otras patologías20. Dado que algunos de estos signos clínicos se encuentran también en los recién nacidos con cardiopatía congénita cianosante, la diferenciación con HTPP puede ser difícil.
¿Cómo se realiza el diagnóstico de hipertensión pulmonar persistente?En la actualidad es el método no invasivo más útil en el diagnóstico de la HTPP20-23, por lo que se recomienda ante la sospecha clínica. Los recién nacidos con hipertensión pulmonar presentan ausencia de cardiopatía estructural; la ecocardiografía con contraste o la ecografía con doppler permiten visualizar el cortocircuito auricular o ductal con toda claridad, en sentido derecha-izquierda o bidireccional, así como observar la insuficiencia tricuspídea, valorar la contracción cardiaca y estimar la presión pulmonar24,25. Ante un paciente con HTPP se puede observar pobre contractilidad miocárdica, escaso movimiento del tabique interventricular, desviación del tabique interauricular hacia la izquierda y el flujo turbulento de insuficiencia tricuspídea21,23.
Prueba de hiperoxiaConsiste en administrar oxígeno con una FIO2 al 100%, de 5 a 10min, lo cual se logra mediante ventilación mecánica o a través de máscara de Hood. Deben obtenerse las medidas de la PaO2 previa a la administración de O2 al 100% y la posterior a este, para comparar. Si se evidencia un incremento de más de 150mmHg en la segunda media, se podría tratar de enfermedad pulmonar parenquimatosa. En caso contrario, debe considerarse cardiopatía congénita cianosante o HTPP. Se utiliza para demostrar derivación de derecha a izquierda a través del foramen oval o del ductus arterioso persistente (DAP) si la PaO2 no se aumenta, por lo que su uso en recién nacidos prematuros es cuestionable por su poca sensibilidad26.
Prueba de hiperoxia/hiperventilaciónConsiste en administrar FiO2 al 100% junto con un nivel de PaCO2 crítico (20-25mmHg) que se consigue a través de las hiperventilación (FR: 70 a 100×min) durante 5 a 10min. Si hay incremento acelerado en la PaO2 de 80 a 100mmHg al disminuir la PaCO2 se considera que existe HTPP. Si no hay incremento de la PaO2, puede tratarse de una cardiopatía congénita cianosante. Es de poco uso por el riesgo de barovolutrauma que puede producir27.
PaO2 preductal y posductalConsiste en obtener una PaO2 preductal (ya sea de la arteria temporal, braquial derecha o radial derecha) y una SatO2 posductal (tomada en las arterias umbilicales y tibiales posteriores) en forma simultánea. Una diferencia de PaO2 preductal/posductal de 20mmHg o superior indica la presencia de un cortocircuito de derecha a izquierda, por lo que deben descartarse patologías cardiacas y la HTPP, que se presenta en 70% de estas alteraciones. Si no hay diferencias y la PCO2 es baja, se debe considerar cardiopatía congénita cianótica. Si no hay diferencia y la PCO2 es alta, debe considerarse enfermedad pulmonar severa o grave27.
Otros paraclínicosOtros exámenes iniciales que se deben solicitar en recién nacidos sintomáticos son una radiografía de tórax y gases arteriales. La primera puede ser normal en HTPP primaria debido a que casi nunca tiene enfermedad pulmonar parenquimatosa asociada; sin embargo, el hallazgo de enfermedad pulmonar aparente en la radiografía de tórax no excluye un defecto cardiaco1.
Gases arteriales: muestran hipoxemia severa, además de acidosis metabólica en las primeras etapas, incluso sin dificultad respiratoria y grandes oscilaciones en PaO2.
¿Cuál es el tratamiento de pacientes con hipertensión pulmonar persistente?El manejo inicial consiste en corregir los factores que favorecen la vasoconstricción como son la hipotermia, la hipoglucemia, la hipocalemia, la anemia y la hipovolemia. Aunque el uso de agentes alcalinizantes es controversial, la corrección de la acidosis metabólica continúa siendo un manejo estándar. Se debe optimizar la función cardiaca según necesidad con expansores de volumen y agentes inotrópicos (dobutamina, dopamina, milrinona)28.
El objetivo de la ventilación mecánica es obtener volúmenes pulmonares óptimos, ya que volúmenes máximos pueden producir daño, edema e inflamación pulmonar. La sobreexpansión pulmonar puede empeorar la hipertensión pulmonar debido a que la sobredistensión alveolar puede comprimir capilares y arteriolas. La falla en lograr volúmenes pulmonares adecuados contribuye a la hipoxemia y al aumento de la RVP en RN con HTPP17.
Las enfermedades del parénquima pulmonar están asociadas con deficiencia de surfactante o inactivación de este. Se ha demostrado que el uso de surfactante y el óxido nítrico inhalado (ONi) mejoran la oxigenación en neonatos con síndrome de aspiración de meconio y disminuyen la necesidad de uso de circulación por membrana extracorpórea (extracorporeal membrane oxigenation [ECMO])22.
Óxido nítrico inhalado (ONi)Posee las características de ser un potente y rápido vasodilatador que puede administrarse en forma directa a través de un sistema de ventilación en la vía aérea. Actúa mediante el aumento de los niveles intracelulares de GMPc en el músculo liso promoviendo la vasodilatación. Se inactiva rápido al unirse con la Hb, lo que limita su efecto a la circulación pulmonar17. El índice de oxigenación (IO) puede utilizarse para evaluar la severidad de la hipoxemia, así como criterio de uso de ONi y de ECMO; debe ser calculado en todos los gases sanguíneos utilizando la PaO2 preductal para mejor sensibilidad y especificidad.
La fórmula para el cálculo del índice de oxigenación es:
Su interpretación es así:- •
IO>25: síndrome de dificultad respiratoria grave.
- •
IO de 10/25: síndrome de dificultad respiratoria moderado.
- •
IO<10: síndrome de dificultad respiratoria leve.
Se ha establecido que un IO mayor de 25 en al menos 2 gases en sangre sugiere la necesidad de iniciar ONi29. Tres índices de oxigenación mayores de 40 requieren inicio de ECMO. Este índice es de gran utilidad como predictor de mortalidad, pues si se tienen 3/5 IO mayores a 40 indica mortalidad del 80%, y entre 25 y 40 sugiere una mortalidad del 50-80%. La utilidad radica en que logra la disminución del uso de ECMO en neonatos con HTPP primaria; sin embargo, no se encontró que disminuyera la mortalidad, el tiempo de hospitalización o que presentara mayor utilidad en pacientes con cardiopatías congénitas30,31.
PaO2 posductalLa PaO2 ≤ 50mmHg por más de 4 a 6h en ventilación mecánica con FiO2 al 100% predice alta mortalidad con una sensibilidad del 86% y una especificidad del 96%. Existen pocas contraindicaciones de la terapia ONi, aunque es importante contar con la realización de ecocardiograma para descartar lesiones cardiacas estructurales y establecer la presencia de hipertensión pulmonar. Dicha terapia está contraindicada en cardiopatías dependientes de shunt de derecha a izquierda a través del ductus arterioso32.
Ensayos clínicos previos sugerían que la dosis de partida ideal para ONi es de 20 partes por millón (ppm) con las dosis efectivas entre 5 y 20ppm33,34. La dosis >20ppm no aumentó la eficacia y se asocia con más efectos adversos en estos lactantes35-38. El momento del inicio del tratamiento con ONi es una consideración importante en la gestión de la HTPP del recién nacido, de acuerdo con la revisión de los ensayos clínicos previos. En un reporte de caso de un neonato a término que presentó requerimiento de oxígeno, sin dificultad respiratoria o acidosis, a pesar de recibir oxígeno al 100% a través de una cánula nasal, el ecocardiograma mostraba evidencia de HTPP. Fue tratado con éxito con ONi mediante una cánula nasal sin necesidad de ventilación mecánica, con adecuada respuesta39; sin embargo, todavía se necesitan estudios prospectivos bien diseñados para corroborar si este tratamiento con pacientes con dichas características puede tener alguna utilidad33,40.
¿Qué otros tratamientos farmacológicos o no farmacológicos se utilizan en la hipertensión pulmonar persistente?Ventilación mecánicaLa ventilación mecánica casi siempre es necesaria en neonatos con HTPP. El objetivo consiste en utilizar la presión media de la vía aérea lo más baja posible para proporcionar una adecuada oxigenación y ventilación, y evitar el barotrauma41. Los parámetros del ventilador deben ajustarse para lograr una expansión pulmonar normal. La tendencia actual es el empleo de una ventilación mecánica menos agresiva. La estrategia de manejo ventilatorio depende de la presencia o ausencia de enfermedad parenquimatosa pulmonar y de la respuesta al tratamiento. El manejo debe iniciarse con ventilación convencional y ajustarse en cada paciente de acuerdo con la etiología, el cuadro clínico y la evolución. En neonatos sin enfermedad del parénquima pulmonar asociada la hipoxemia es causada por shunt de derecha a izquierda más que por el desequilibrio de la ventilación perfusión42.
La ventilación mecánica se utiliza con frecuencia en recién nacidos asfixiados, debido a la necesidad de reanimación y para proporcionar ventilación y oxigenación adecuadas. Durante muchos años se utilizó la hiperventilación como método para inducir la alcalosis y reducir la resistencia vascular pulmonar (RVP) en HTPP a pesar de la falta de ensayos clínicos para demostrar una mejoría en los resultados. Aunque la alcalosis respiratoria inducida puede de hecho ser transitoriamente eficaz en la reducción de la RVP, existen eventos adversos sobre la función cardiaca y las presiones sistémicas, y también sobre la perfusión cerebral, que pueden ser perjudiciales para un bebé con asfixia. Estas preocupaciones han llevado a un marcado cambio en la filosofía del objetivo de la terapia de ventilación para mantener la tensión de CO2 normal o alta43.
Ventilación de alta frecuenciaEs un método de ventilación alternativo ante las complicaciones y el fracaso de las medidas convencionales. Según el mecanismo que proporciona la alta frecuencia se distinguen 3 tipos: VAFO por jet, VAFO por interrupción de flujo y VAFO por oscilador44. Se utiliza como terapia de rescate ante el fracaso de la VMC, no existe una evidencia clara de que el uso de VAFO de manera temprana ofrezca importantes ventajas sobre la ventilación convencional, y tampoco hay una indicación clara para que sea tratamiento de primera línea, ya que los resultados globales comparados con la VMC no han mostrado mejoría45.
Manejo de la oxigenación en la ventilación de alta frecuenciaSe usan 2 parámetros para mejorar la oxigenación: la FiO2 y la presión media de la vía aérea (PMVA); las estrategias ventilatorias dependen de la patología del paciente46.
- 1
Alto volumen (reclutamiento pulmonar): se utiliza una estrategia de alto volumen para síndromes atelectásicos o patologías de bajo volumen. En este tipo de estrategia se inicia con una PMVA 2cmH2O por encima de la PMVA que recibía con VMC. Se aumenta la PMVA hasta mejorar la oxigenación, que se considera cuando la PO2 se eleve a 20-30mmHg o se consiga una SatO2 entre 88-93%, lo que llevaría al reclutamiento de alveolos antes colapsados. En este punto se iniciaría descenso en la FiO2 y luego reducción progresiva de la PMVA hasta la presión mínima efectiva44.
- 2
Bajo volumen: se emplea en patologías con atrapamiento de aire. Esta estrategia se inicia con una PMVA 2cm por debajo de la que se tenía en VMC. En el momento en que se logre mejorar la oxigenación, que se establece por los parámetros antes mencionados, se inicia descenso de la PMVA hasta el parámetro mínimo efectivo y luego se disminuye la FiO244.
En patologías como la HTPP se puede iniciar con la misma presión media de la vía aérea que recibía en la VMC44.
Circulación por membrana extracorpóreaLa meta de este tipo de tratamiento es mantener una adecuada oxigenación tisular y evitar daño pulmonar irreversible mientras la RVP disminuye y la hipertensión pulmonar se resuelve45. La ECMO fue introducida como terapia de rescate para apoyar a los recién nacidos con insuficiencia respiratoria grave, con más del 80% de mortalidad prevista en los estudios de 1970 por Bartlett et al.46,47. La ECMO ha mejorado en forma significativa la supervivencia de los bebés con enfermedad pulmonar grave pero reversible47-49. Proporciona soporte cardiaco para facilitar la adaptación posnatal que se produce, al mismo tiempo que ayuda a los pulmones a recuperarse de barotrauma y la toxicidad de O2. Sin embargo, la ECMO exige canulación de la arteria carótida derecha y la vena yugular, y se requiere anticoagulación con heparina para prevenir la coagulación en el circuito de derivación. En vista de su vulnerabilidad a la hemorragia intraventricular, la ECMO por lo general no se utiliza en niños prematuros <34 semanas de gestación.
La creciente aplicación de nuevos tratamientos, como el ONi y el surfactante, ha reducido en gran medida la necesidad de ECMO en los bebés con HTPP secundaria a enfermedad pulmonar parenquimatosa o HTPP primaria. Se recomienda la utilización de la ECMO en IO ≥25 cuando se ha utilizado conjuntamente ONi (o >40 en ausencia de ONi).
Uso de sedantes y relajación del músculo esqueléticoAunque los sedantes o relajantes del músculo esquelético son muy utilizados para reducir al mínimo las fluctuaciones en la oxigenación y facilitar la ventilación, no se han realizado ensayos clínicos donde se pruebe su efectividad. Estos medicamentos tienen efectos adversos importantes y suelen inducir hipotensión, edema generalizado y deterioro de la función pulmonar con el uso prolongado. La hipotensión es más común cuando se utilizan combinaciones de sedantes y relajantes musculares. El uso de la relajación del músculo esquelético se ha relacionado con una mayor incidencia de pérdida de la audición en los supervivientes de HTPP, aunque el mecanismo de esta asociación no está claro34. Los diuréticos, como la furosemida, utilizados normalmente para tratar el edema secundario a la relajación del músculo esquelético, también aumentan el riesgo de pérdida de audición37. Aunque puede ser necesaria la sedación para la comodidad en neonatos ventilados, no se recomienda el uso rutinario de la relajación del músculo esquelético y se debe limitar su uso a menos de 48h.
Uso de inhibidores de la fosfodiesterasaCerca del 30% de los pacientes no responden al ONi. Las altas concentraciones de fosfodiesterasas en la vasculatura pulmonar han llevado al uso de inhibidores de la fosfodiesterasa, tales como el sildenafilo y la milrinona50-55. Una revisión Cochrane identificó 3 ensayos elegibles con 77 recién nacidos; los estudios se realizaron en entornos con recursos limitados donde la ventilación de alta frecuencia y el ONi no estaban disponibles en el momento del estudio y administraron inhibidores de las fosfodiesterasas, con una reducción significativa de la mortalidad en el grupo de sildenafilo (RR típico: 0,20, IC95%: 0,07 a 0,57; DR típica: −0,38, IC95%: −0,60 a −0,16; número necesario a tratar para beneficiar 3 y 95% CI2-6). Ciertos parámetros, como el índice de oxigenación y la PaO2, presentaron mejoría posterior a la primera dosis de sildenafilo. No se encontraron efectos secundarios de importancia clínica53. En los últimos años el sildenafilo ha caído en desuso porque no se conoce con certeza su perfil de seguridad, y es por ello que se recomienda solo la utilización en centros donde no se cuente con terapias de primera línea como el ONi y la ventilación de alta frecuencia y no se disponga de remisión temprana a centros de mayor complejidad.
ConclusionesLa HTPP es una entidad que ha aumentado en la última década, pero aun así, los efectos adversos han disminuido gracias a la presentación de nuevas terapias que, aunque no se han probado con la rigurosidad de ensayos controlados y metaanálisis, han mostrado adecuada efectividad en pequeños grupos de enfermos. Se debe realizar un diagnóstico rápido y adecuado de los pacientes, porque se ha observado que se asocia con mejor pronóstico. También se necesitan más estudios para establecer la efectividad de las diferentes terapias y su impacto en la morbimortalidad de los pacientes a corto y mediano plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.