La enfermedad de Ménière es un trastorno crónico del oído interno caracterizado por episodios de vértigo, hipoacusia neurosensorial, acúfenos y sensación de plenitud ótica. Tradicionalmente, su diagnóstico ha sido clínico; sin embargo, los avances recientes en la resonancia magnética (RM) permiten la visualización directa del hidrops endolinfático, considerado el sustrato anatomopatológico de la enfermedad. Esta revisión proporciona una actualización sobre las técnicas de RM para la detección del hidrops endolinfático, centrándose en los protocolos de imagen más recientes, su precisión diagnóstica y sus aplicaciones clínicas. El uso de estas secuencias de RM ha mejorado significativamente la capacidad de diferenciar la enfermedad de Ménière de otros trastornos vestibulares, facilitando un diagnóstico más temprano y preciso. Este artículo busca proporcionar a radiólogos y otoneurólogos una guía práctica y completa sobre el papel de la RM en el diagnóstico de la enfermedad de Ménière. La correcta interpretación de estos hallazgos en la imagen puede contribuir a mejorar el manejo del paciente, guiar decisiones de tratamiento y desarrollar nuevas terapias.
Ménière's disease is a chronic inner ear disorder characterised by episodes of vertigo, sensorineural hearing loss, tinnitus and aural fullness. Traditionally, diagnosis has been based on clinical parameters; however, recent advances in magnetic resonance imaging (MRI) enables a direct visualisation of endolymphatic hydrops, a key pathological feature of the disease. This review provides an updated overview of MRI techniques for detecting endolymphatic hydrops, focusing on the latest imaging protocols, their diagnostic accuracy and clinical applications. The use of these MRI sequences has significantly improved the ability to distinguish Ménière's disease from other vestibular disorders, enabling an earlier and more precise diagnosis. A better understanding of these imaging findings can enhance patient management, guide treatment decisions and contribute to the development of new therapeutic approaches. This article aims to provide radiologists and otoneurologists with a comprehensive and practical guide to the role of MRI in diagnosing Ménière's disease.
La enfermedad de Ménière (EM) es un trastorno del oído interno. Se caracteriza por episodios de vértigo recurrentes y espontáneos, sin un desencadenante claro. Durante las crisis, se producen cambios importantes en la audición, con hipoacusia neurosensorial fluctuante. También pueden aparecer acúfenos temporales y sensación de presión ótica. Con el tiempo, la enfermedad causa un déficit funcional. Primero afecta la audición y luego el sistema vestibular. Estos déficits se vuelven permanentes e irreversibles. Además, la repetición de los episodios de vértigo deteriora notablemente la calidad de vida del paciente. Con la progresión de la enfermedad, los ataques de vértigo suelen disminuir, pero dan lugar a una inestabilidad persistente, cuyo impacto funcional varía en cada caso.
La carga de esta enfermedad en consultas especializadas, servicios de urgencia o medicina general es constante debido a su naturaleza crónica y curso impredecible, estimándose que representan el 12,8% de las consultas generales de otorrinolaringología, el 2,9% de las consultas generales y el 0,8% de las consultas de urgencia.
Se considera una enfermedad rara. Las tasas de prevalencia varían de 3,5 por 100.000 a 513 por 100.000: en Cantabria, la incidencia fue de 3 pacientes/100.000 habitantes-año y la prevalencia de 75/100.000, con una relación hombre-mujer de 0,381.
En cuanto a la edad, no es común en individuos menores de 18 años y muestra un pico de incidencia a los 35-55 años; sin embargo, en registros recientes, la frecuencia en individuos mayores de 65 años ha aumentado.
Aproximadamente el 10% de los casos se consideran de origen familiar. Siguen un patrón de herencia autosómica dominante, con penetrancia incompleta y expresividad variable. En los casos restantes, de tipo esporádico, es común encontrar antecedentes familiares de enfermedades otológicas o alteraciones del oído interno. La etiología de la enfermedad es compleja. Presenta una fuerte asociación con otros procesos como la migraña, la autoinmunidad y la autoinflamación. Algunos de estos no actúan solo como comorbilidades, sino que pueden ser auténticos desencadenantes.
Además, algunos de estos exhiben una influencia bidireccional: migraña, enfermedades autoinmunes, asma, hipovitaminosis D y osteoporosis2.
En la forma familiar, la alteración más común ocurre con genes que marcan la ultraestructura del oído interno: OTOG, alfa-tectorina y MYO7A, entre otros. En la forma esporádica, se han detectado anomalías en genes que también están alterados en pacientes con pérdida auditiva neurosensorial, así como otros que codifican proteínas para el crecimiento axonal dirigido3.
Estos pacientes presentan múltiples alteraciones epigenéticas que afectan la regulación de la respuesta inflamatoria e inmune. Esto los vuelve más susceptibles a desarrollar una inflamación agresiva. Como consecuencia, puede aparecer un hidrops endolinfático (HE) inducido por el estrés. Esta condición ayudaría a explicar 2 características clave de la enfermedad: su curso progresivo y sus fluctuaciones. Hasta ahora, no se han encontrado marcadores específicos. Sin embargo, los pacientes con EM tienen niveles basales más altos de citocinas proinflamatorias, incluyendo IL-1β, IL-1Ra, IL-6 y TNF-α, en comparación con controles sanos4.
Una característica intrigante de la enfermedad es su forma de inicio. Puede dividirse en 2 tipos: inicio típico, con presencia simultánea de la tríada sintomática clásica, e inicio atípico, que es más frecuente y no incluye los 3 síntomas desde el comienzo. Cuando la enfermedad comienza con un solo síntoma, el vértigo es el más común (13,7%). En los casos con 2 síntomas iniciales, la combinación más frecuente es la pérdida auditiva y el tinnitus (19,8%), ambos de tipo coclear. El tiempo que transcurre desde el primer síntoma hasta la aparición completa de la tríada varía entre estudios. Puede llegar hasta los 6 años, aunque este intervalo suele ser más corto cuando el paciente presenta varios síntomas desde el inicio.
La evolución de la enfermedad es variable. En general, durante los primeros 4 años, se presentan episodios de vértigo en años consecutivos. Estos pueden desaparecer o dar paso a un período quiescente, seguido de recurrencias. En otros casos, hay múltiples recaídas a lo largo del tiempo, con un curso continuo e impredecible. Este último modelo también se asocia con un peor pronóstico auditivo y un gran número de crisis otolíticas de Tumarkin5.
En pacientes con EM, el hallazgo histopatológico más común es el HE. Este consiste en una dilatación del laberinto membranoso por aumento del volumen de endolinfa en relación con la perilinfa. El saco endolinfático suele presentar anomalías estructurales, como cambios degenerativos o hipoplásicos. Estas alteraciones pueden dificultar la reabsorción de endolinfa. Las causas incluyen disfunción del epitelio o acumulación de sustancias no identificadas, incluidos electrolitos, que provocan un influjo osmótico de agua. Desde el punto de vista fisiopatológico, no se ha confirmado una relación directa entre el HE y la EM. Esto genera dudas sobre si el HE es solo un epifenómeno con consecuencias importantes en la función auditiva y vestibular o si es un elemento sine qua non necesario sobre el cual deben influir otros6.
A día de hoy, la EM sigue siendo un diagnóstico eminentemente clínico basado en el cumplimiento de una serie de criterios, que incluyen la tríada de crisis de vértigo de instauración brusca, tinnitus y sordera neurosensorial.
No obstante, desde que ha sido posible la visualización del HE mediante la RM, esta se ha convertido en un elemento indispensable, no solo en el diagnóstico, si no en el seguimiento de los pacientes, ayudando también a los neurootólogos a la toma de decisiones para el tratamiento.
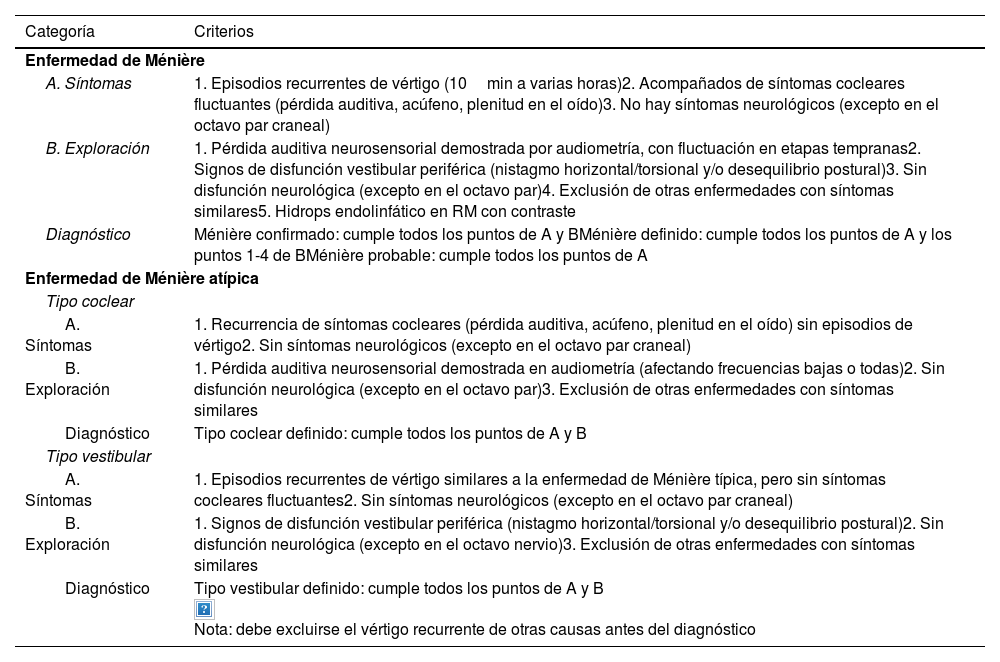
De especial interés para la neurorradiología son los nuevos criterios diagnósticos propuestos por la Sociedad Japonesa de Investigación de Trastornos del Equilibrio, donde la presencia de HE en la RM de hidrops forma parte de los criterios diagnósticos, confirmando la importancia de la prueba como pilar fundamental en el diagnóstico y definiendo la nueva categoría de Ménière confirmado7.
Estos criterios se recogen en la tabla 1.
Criterios diagnósticos de la enfermedad de Ménière y sus variantes
| Categoría | Criterios |
|---|---|
| Enfermedad de Ménière | |
| A. Síntomas | 1. Episodios recurrentes de vértigo (10min a varias horas)2. Acompañados de síntomas cocleares fluctuantes (pérdida auditiva, acúfeno, plenitud en el oído)3. No hay síntomas neurológicos (excepto en el octavo par craneal) |
| B. Exploración | 1. Pérdida auditiva neurosensorial demostrada por audiometría, con fluctuación en etapas tempranas2. Signos de disfunción vestibular periférica (nistagmo horizontal/torsional y/o desequilibrio postural)3. Sin disfunción neurológica (excepto en el octavo par)4. Exclusión de otras enfermedades con síntomas similares5. Hidrops endolinfático en RM con contraste |
| Diagnóstico | Ménière confirmado: cumple todos los puntos de A y BMénière definido: cumple todos los puntos de A y los puntos 1-4 de BMénière probable: cumple todos los puntos de A |
| Enfermedad de Ménière atípica | |
| Tipo coclear | |
| A. Síntomas | 1. Recurrencia de síntomas cocleares (pérdida auditiva, acúfeno, plenitud en el oído) sin episodios de vértigo2. Sin síntomas neurológicos (excepto en el octavo par craneal) |
| B. Exploración | 1. Pérdida auditiva neurosensorial demostrada en audiometría (afectando frecuencias bajas o todas)2. Sin disfunción neurológica (excepto en el octavo par)3. Exclusión de otras enfermedades con síntomas similares |
| Diagnóstico | Tipo coclear definido: cumple todos los puntos de A y B |
| Tipo vestibular | |
| A. Síntomas | 1. Episodios recurrentes de vértigo similares a la enfermedad de Ménière típica, pero sin síntomas cocleares fluctuantes2. Sin síntomas neurológicos (excepto en el octavo par craneal) |
| B. Exploración | 1. Signos de disfunción vestibular periférica (nistagmo horizontal/torsional y/o desequilibrio postural)2. Sin disfunción neurológica (excepto en el octavo nervio)3. Exclusión de otras enfermedades con síntomas similares |
| Diagnóstico | Tipo vestibular definido: cumple todos los puntos de A y B Nota: debe excluirse el vértigo recurrente de otras causas antes del diagnóstico |
RM: resonancia magnética.
El objetivo de esta revisión es detallar los hallazgos en RM de la EM, especialmente el HE, describiendo las secuencias disponibles en la práctica clínica diaria, los métodos de análisis (cualitativos y cuantitativos), así como hallazgos auxiliares asociados que pueden ayudar en el diagnóstico final.
Secuencias de imagen utilizadas para la visualización del HE en la EMPara una valoración in vivo del HE es necesario: disponer de una secuencia con la capacidad de diferenciar entre la perilinfa y la endolinfa; tener la suficiente resolución espacial para visualizar directamente las paredes del laberinto membranoso.
Esta distinción entre peri y endolinfa es posible dado que el gadolinio (Gd) difunde en una muy pequeña cantidad hacia la perilinfa, pero no hacia la endolinfa, cambiando sus características de relajatividad y, por tanto, cambiando las intensidades de señal de los 2 líquidos y sus tiempos de inversión (TI).
Las secuencias más extendidas en la práctica clínica diaria para la valoración del HE son la T2 fluid-attenuated inversion recovery (T2 FLAIR) y la secuencia espín eco con reconstrucción en tiempo real, con pulso de inversión recuperación (REAL-IR), ambas preferiblemente en adquisición isotrópica de corte fino (3D)8, ya que permite una reconstrucción multiplanar más precisa.
El grupo japonés de la Universidad de Nagoya, pionero en la imagen del HE mediante RM, liderados por el profesor Naganawa, sienta las bases para el estudio del HE mediante RM de 3T usando una secuencia 3D-FLAIR y confirmando que mediante esta secuencia se podían discernir separadamente la perilinfa y la endolinfa9,10. El aporte novedoso fue utilizar secuencias FLAIR en lugar de secuencias T1 para la valoración del realce.
El mismo grupo11, basándose en esta secuencia T2 FLAIR y usando 2 distintos TI, idearon otro tipo de imagen generada por «sustracción» o «híbrida», que necesitaba de procesado adicional. Obtenían 2 tipos de imágenes con distintos TI. Con un TI de 2.250ms obtenían una imagen de señal positiva de perilinfa (PPI por positive perilypmh image). Con un TI de 2.050ms obtenían una imagen positiva de endolinfa (o PEI por positive endolymph image). Invertían la señal de tonos de grises de la PEI y realizaban una sustracción de PPI-PEI, obteniendo una imagen híbrida procesada que llamaron HYbriD of Reversed image Of Positive endolymph signal and native image of positive endolymph signal (HYDROPS). Producían, por tanto, una imagen híbrida similar a la que obtenemos con el otro tipo de secuencia utilizada, la secuencia T2 REAL-IR, en donde el hueso se aprecia gris por el efecto de la sustracción.
La otra secuencia utilizada en el estudio del HE es la REAL-IR. Se trata de una secuencia turbo espín eco con pulso de inversión-recuperación con reconstrucción de la imagen en modo «real» que ya incluye valores positivos y negativos, en lugar de la reconstrucción en «magnitud» que solo considera valores positivos. Usa un TI muy ajustado para que la endolinfa se vea muy hipointensa. La ventaja de esta secuencia es que se obtienen imágenes muy similares a las secuencias híbridas con el hueso de señal intermedia (gris), la perilinfa brillante (hiperintensa) y la endolinfa negra (hipointensa), sin ninguna necesidad de posproceso adicional. La desventaja es que es una secuencia más sensible a los movimientos de los pacientes y compleja de configurar y, por tanto, menos extendida y utilizada. Naganawa et al. demostraron que se trataba de una secuencia igualmente consistente para el estudio del HE12.
Además, los protocolos de RM para el estudio del HE incluyen una secuencia T2 3D-Sampling Perfection with Application optimized Contrasts using a different flip angle Evolution –SPACE– en Siemens®, teniendo otro tipo de nomenclatura según los diferentes fabricantes (DRIVE en Philips®, FIESTA en General Electric®). Su finalidad es la delimitación anatómica de las estructuras del oído interno, denominándose también secuencia de «cisternografía». Es una secuencia muy potenciada en T2 y con un grosor de corte submilimétrico. Además, permite la valoración de los haces nerviosos de los pares craneales de la base del cráneo en sus porciones cisternales13.
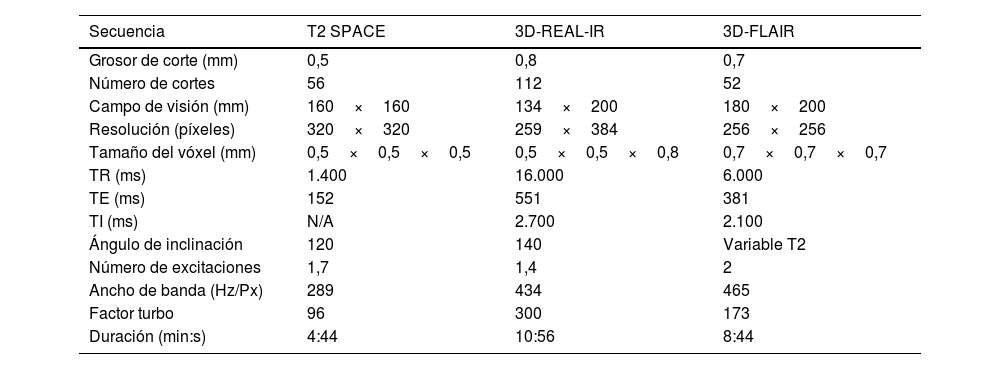
La tabla 2 incluye una descripción detallada de los distintos parámetros de las secuencias. La duración aproximada del protocolo completo es de unos 24min de máquina.
Parámetros detallados de las secuencias
| Secuencia | T2 SPACE | 3D-REAL-IR | 3D-FLAIR |
|---|---|---|---|
| Grosor de corte (mm) | 0,5 | 0,8 | 0,7 |
| Número de cortes | 56 | 112 | 52 |
| Campo de visión (mm) | 160×160 | 134×200 | 180×200 |
| Resolución (píxeles) | 320×320 | 259×384 | 256×256 |
| Tamaño del vóxel (mm) | 0,5×0,5×0,5 | 0,5×0,5×0,8 | 0,7×0,7×0,7 |
| TR (ms) | 1.400 | 16.000 | 6.000 |
| TE (ms) | 152 | 551 | 381 |
| TI (ms) | N/A | 2.700 | 2.100 |
| Ángulo de inclinación | 120 | 140 | Variable T2 |
| Número de excitaciones | 1,7 | 1,4 | 2 |
| Ancho de banda (Hz/Px) | 289 | 434 | 465 |
| Factor turbo | 96 | 300 | 173 |
| Duración (min:s) | 4:44 | 10:56 | 8:44 |
TE: tiempo de eco; TI: tiempo de inversión; TR: tiempo de repetición.
A pesar de que algunos trabajos abogan por protocolos abreviados en RM de 1,5T14, parece existir un consenso generalizado en el uso de máquina de 3T y antenas específicas de cráneo con alta densidad de bobinas que proporcionan mayor señal/ruido. Asimismo, no se recomienda la obtención de imágenes basales. El grupo actual incluso propone un protocolo específico abreviado compuesto por la imagen morfológica T2 de cisternografía más la secuencia de hidrops 3D-REAL-IR, optimizando un protocolo con una duración máxima de unos 16min.
Por tanto, la principal limitación de estas secuencias, dado su largo tiempo de adquisición, es su susceptibilidad a la aparición de artefactos de movimiento. La secuencia 3D-FLAIR es más sensible a bajas concentraciones de Gd, al contrario que la 3D-REAL-IR, pero por otro lado parece que se puede ver influida por variaciones en el TI15.
¿Cuál es la secuencia óptima para la valoración del HE?Se han publicado varios trabajos comparando la secuencia 3D-FLAIR con la 3D-REAL-IR para intentar determinar cuál de las 2 es la óptima para la valoración del HE. En el estudio comparativo realizado por nuestro grupo16, ambas secuencias, obtenidas 4h después de la inyección intravenosa de una dosis única de Gd, fueron fiables y precisas, con una correlación global kappa de 0,821 (p<0,001). No obstante, la secuencia 3D-REAL-IR mostró una mayor relación señal/ruido, así como una mayor tasa de detección de HE coclear, estadísticamente significativa. Por todo ello, la secuencia 3D-REAL-IR parece superior a la 3D-FLAIR en la valoración del HE, especialmente coclear. Estos hallazgos han sido posteriormente refrendados por los resultados de Deng et al.17, en este caso mediante administración intratimpánica, y por Zhao et al.18, con el uso de flip angle constante en la secuencia 3D-FLAIR. Recientemente, un artículo muestra que la secuencia 3D-FLAIR puede verse influida de forma importante por el TI utilizado (en variaciones tan leves como de 100ms), especialmente para la valoración del HE coclear15.
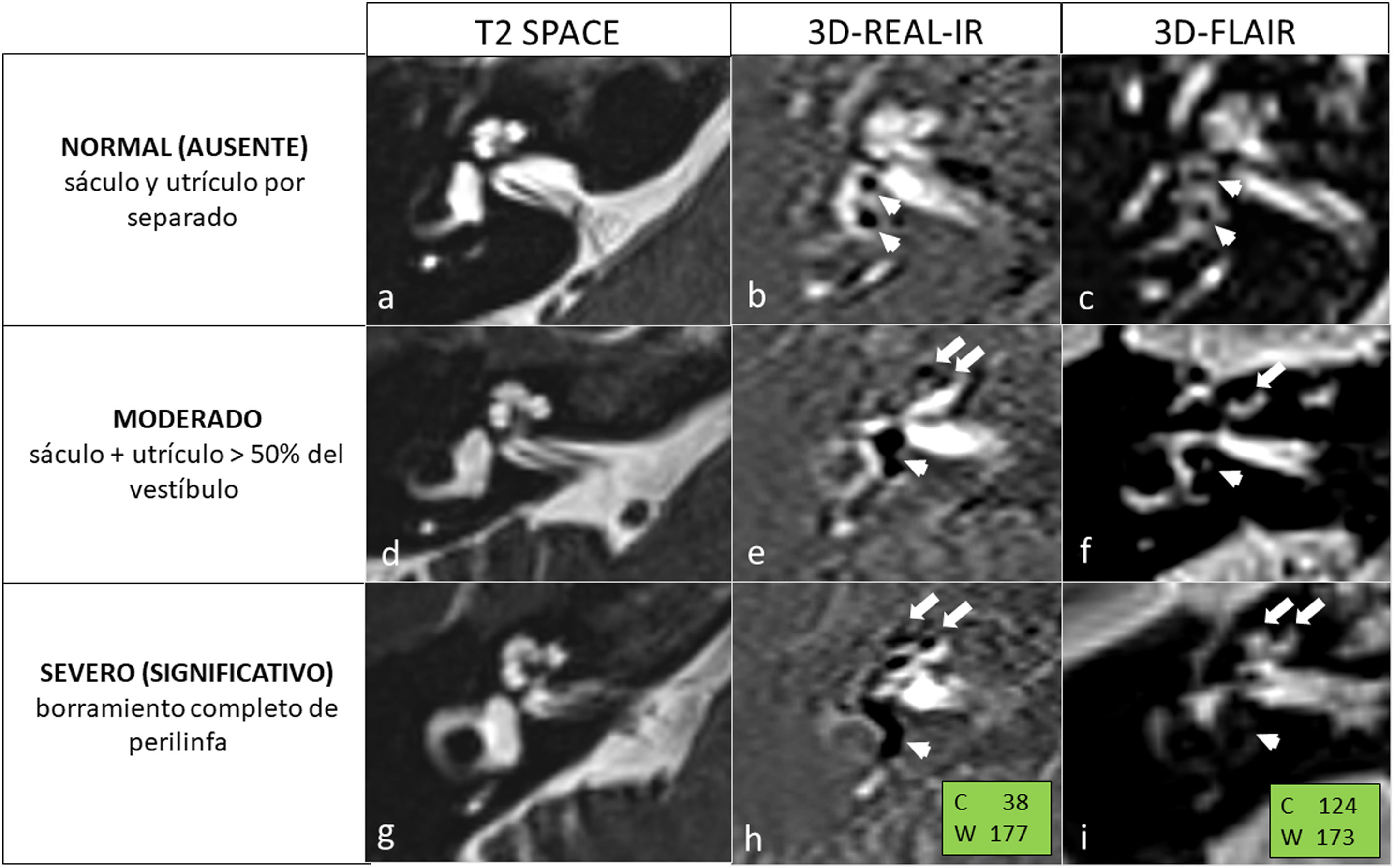
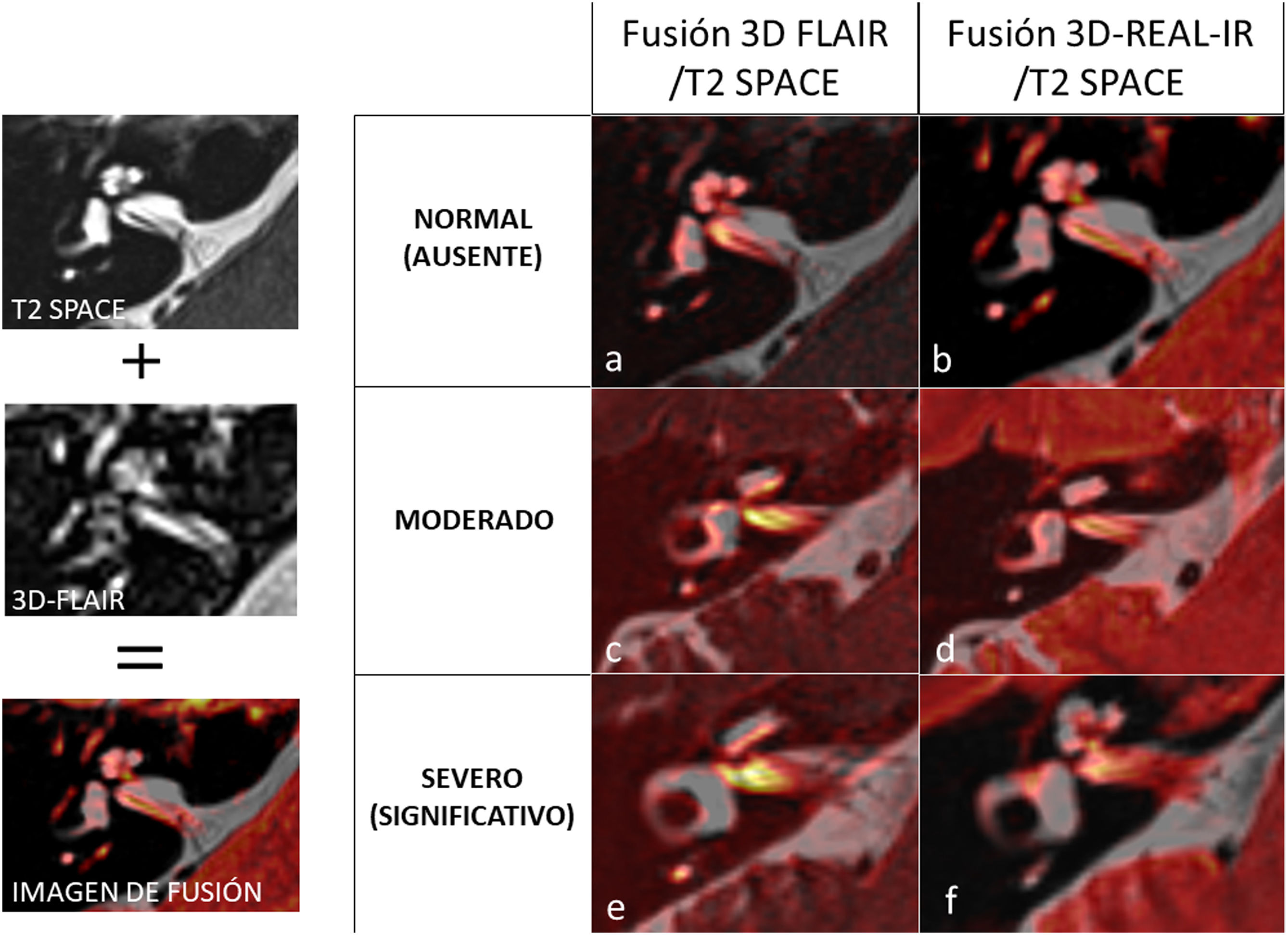
La figura 1 refleja la superioridad de la secuencia 3D-REAL-IR para la valoración de HE, especialmente en la visualización de hidrops coclear. Como se ha mencionado, estas secuencias pueden valorarse directamente sin necesidad de posprocesado. No obstante, en caso de disponer únicamente de la secuencia 3D-FLAIR, se recomienda realizar una fusión de esta con una secuencia muy potenciada en T2-3D (como SPACE, DRIVE o FIESTA), ya que esta combinación facilita considerablemente la evaluación del HE, tal como se muestra en la figura 2.
En la primera columna (imágenes a, d, g) se encuentra la imagen anatómica para facilitar la correlación de las secuencias dirigidas a la valoración de hidrops; en la segunda columna (imágenes b, e, h) la secuencia 3D-REAL-IR, y en la tercera columna (imágenes c, f, i) la secuencia 3D-FLAIR, a las 4h de administración de una dosis de contraste paramagnético intravenoso. En las filas se muestran los grados de HE, en este caso aplicando una escala de 3 grados (no HE, hidrops moderado e hidrops severo). En la primera fila (imágenes a, b, c) observamos un grado normal o ausencia de hidrops, visualizando claramente por separado tanto el sáculo como el utrículo (cabezas de flecha) y sin visualizar endolinfa en cuantía significativa en la cóclea. En la segunda fila (imágenes d, e, f) el sáculo y el utrículo ocupan más del 50% de la superficie del vestíbulo, confluyendo, configurando un HE moderado. Obsérvese asimismo una dilatación moderada del ducto coclear (flecha). La tercera fila (imágenes g, h, i) nos muestra un HE significativo, con obliteración completa de la perilinfa del vestíbulo. En la cóclea, el ducto coclear desplaza completamente la escala vestibular. En ocasiones, se puede apreciar herniación de la endolinfa hacia la porción no ampular del CSH. Adjuntamos, asimismo, unas recomendaciones de ventanas radiológicas de «intensidad de señal» con la idea de revisar siempre todos los estudios con la misma ventana.
Ejemplo de fusión de la secuencia anatómica T2 SPACE con las secuencias específicas de hidrops, para facilitar su valoración. Las columnas muestran las imágenes de fusión: la primera columna (imágenes a, c, e) entre 3D FLAIR y T2 SPACE, la segunda columna (b, d, f) entre 3D-REAL-IR y T2 SPACE. En este caso, se ha aplicado en las secuencias de hidrops el filtro «hot iron» para la imagen de fusión, donde la perilinfa se visualiza en tonos rojos-naranjas y la endolinfa, negra o hipointensa en las secuencias originales, queda sin colorear en tono naranja en la fusión. Para ello se ha empleado el software de visualización syngo.via de Siemens. Hay que poner especial cuidado en no forzar demasiado la ventana de la capa naranja o se podría sobre o infraestimar el grado de HE. Se muestran los mismos ejemplos de la figura 1: en la primera fila (a, b) un grado normal o no hidrops; en la segunda fila (imágenes c, d) un HE moderado; y en la tercera fila (imágenes e, f) un HE significativo.
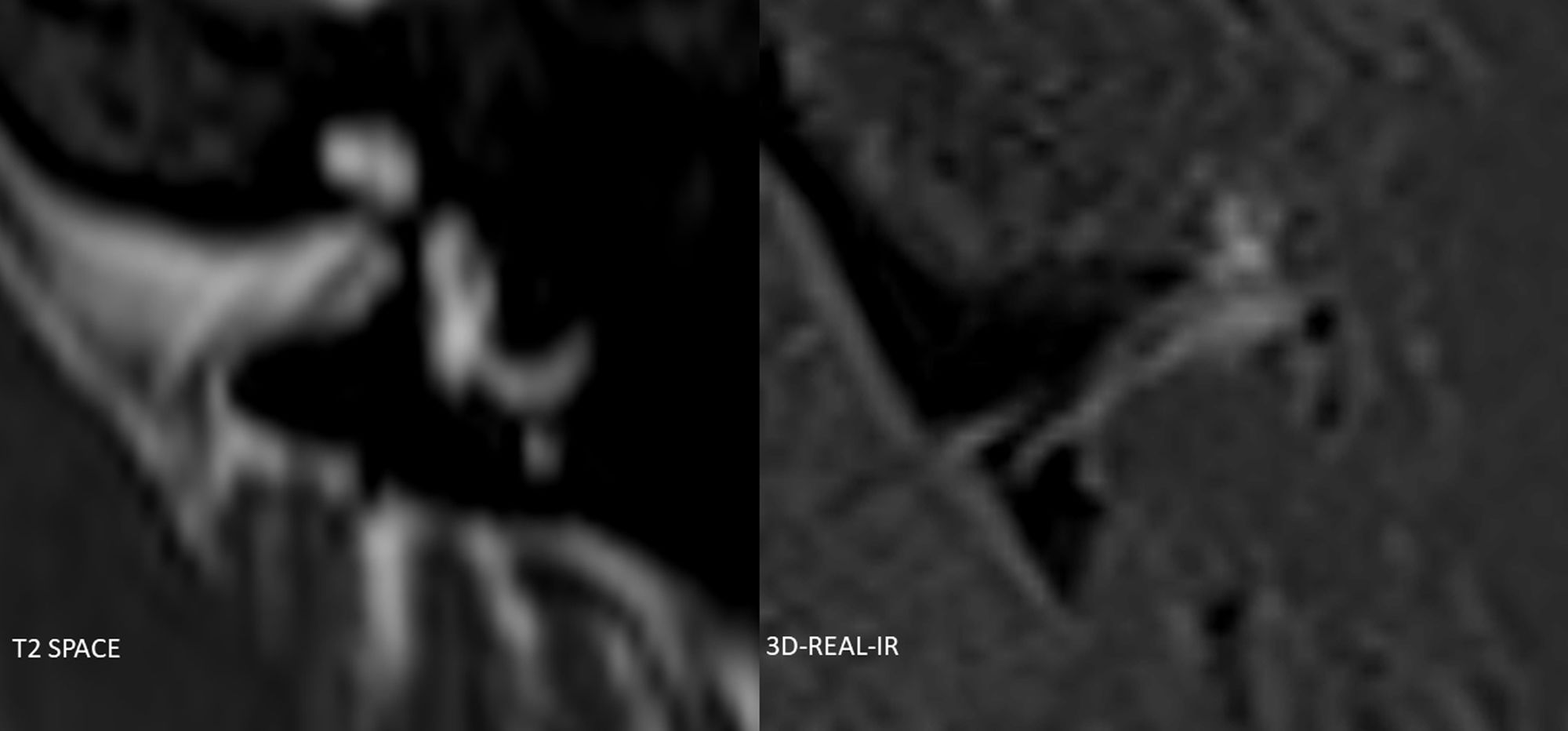
Algunos tipos de contrastes paramagnéticos basados en el Gd usados en la clínica diaria son el gadoterato de meglumina, el gadoteridol y el gadobutrol. Aunque no hay suficientes estudios para aportar una evidencia clínica firme de que el tipo de Gd empleado influya en la calidad final de la imagen, parece que el gadobutrol produce mayor grado de realce perilinfático y mejor detalle anatómico de la endolinfa19,20. No obstante, el artículo de consenso de Liu et al. no se decanta por ninguno en particular8. En la figura 3 se muestra un ejemplo de utilización de gadoterato de meglumina para la valoración de HE en un paciente alérgico al contraste habitualmente utilizado de gadobutrol.
Ejemplo de secuencia 3D-REAL-IR axial obtenida 4h tras la administración de una dosis única de gadoterato de meglumina (Dotarem®) por vía intravenosa, para la valoración de HE, en un paciente alérgico al contraste de gadobutrol. Se muestra como alternativa a la utilización de los contrastes comúnmente utilizados. En este paciente no se observaron signos de HE.
En cuanto a las vías de administración del Gd, existen fundamentalmente 2 métodos: la vía intravenosa y la vía intratimpánica (para depósito del contraste en el oído medio).
La dosis más extendida para la vía intravenosa es de 0,1mmol/kg de Gd, aunque algunos autores recomiendan doble dosis (0,2mmol/kg), para conseguir un realce más intenso de la perilinfa21. No obstante, la administración de dosis doble, o incluso triple, en el momento actual está desaconsejada: por los efectos secundarios reportados por el uso excesivo de Gd en pacientes con insuficiencia renal (fibrosis sistémica nefrogénica) y por los múltiples reportes en la literatura que documentan el depósito de quelantes del Gd en las estructuras cerebrales, tales como los núcleos dentados cerebelosos y los globos pálidos22 (todavía sin una significación clínica demostrada).
La vía intravenosa tiene la ventaja de ser una vía aceptada en ficha técnica (no así la vía intratimpánica). Requiere 4h de espera tras su administración para la obtención de las imágenes y difunde a la perilinfa de ambos oídos internos. Este hecho permite, con una única dosis, evaluar ambos oídos a la vez. Además, permite valorar el grado de «realce perilinfático», es decir, el mayor paso de Gd al espacio perilinfático por una alteración en la integridad de la barrera «hematolaberíntica», cuyo significado está siendo valorado como un signo más a tener en cuenta en los pacientes con EM21,23.
En la vía intratimpánica se administra una pequeña cantidad (0,3 a 0,6ml) de contraste, diluido entre 1:6 a 1:8 por punción transtimpánica. El paciente debe entonces mantener la cabeza girada hacia el lado contralateral unos 30-40min. Solo permite valorar un oído a la vez (aunque en algunos casos algunos autores han realizado punción bilateral). De forma excepcional, existe la posibilidad de combinar ambas vías (intratimpánica en el oído afecto e intravenosa para valorar el contralateral)24.
En la tabla 3 se resumen las vías de administración de contraste paramagnético y las ventajas y los inconvenientes de cada una de ellas.
Ventajas e inconvenientes de las vías de administración de gadolinio
| Ventajas | Inconvenientes | |
|---|---|---|
| Transtimpánica | • Mayor concentración de Gd en la perilinfa• No toxicidad sistémica | • Fuera de ficha técnica• Unilateral (un oído cada vez)• Espera de 24h• Tasa de fallo de 10-20% |
| Intravenosa | • Permite valoración bilateral• 4h de espera• Casi 100% de estudios diagnósticos• Aprobado en ficha técnica | • Menor concentración de Gd en la perilinfa• Problemas si insuficiencia renal |
Gd: gadolinio.
En cuanto a los grados de severidad del HE, las escalas visuales, cualitativas o semicuantitativas, han sido las más utilizadas, en gran parte por la mayor facilidad, reproducibilidad y aplicabilidad de las mismas en la práctica clínica diaria. El grupo de Nagoya publicó en 2009 una escala semicuantitativa de 3 grados25, de aplicación tanto para el HE coclear como vestibular, y constando los grados de «nada», «moderado» y «significativo».
La principal virtud de las escalas cualitativas reside en su facilidad de aplicación. Una de sus principales limitaciones es que realmente evalúa el grado de distensión del espacio endolinfático en un único corte, a menudo el plano que pasa por el conducto semicircular horizontal, que se refiere en la literatura anglosajona como «midmodiolar»26. Estas escalas evalúan por separado el grado de HE coclear y vestibular. El HE coclear, en el que la endolinfa de la rampa media (ducto coclear) se extiende «hacia arriba» a la rampa vestibular (anatómicamente no puede extenderse a la rampa timpánica), puede clasificarse como dicotómico (grado 0 ausente o grado 1 presente) o bien con una escala de 3 grados (ausente, leve o significativo).
El HE vestibular (que se define por el grado de distensión del sáculo y el utrículo) suele clasificarse en 3 grados25,27 (ausente, leve y significativo) o en 4 grados (no hidrops, leve, moderado y severo)21,28. La escala propuesta de 4 grados tiene como objetivo mejorar la sensibilidad y especificidad del diagnóstico radiológico de la EM. Al añadir un grado intermedio («leve») entre el «ausente» y el «moderado», se obtenía una mejor correlación con los hallazgos clínicos y audiológicos, lo que aumentaba el rendimiento diagnóstico frente a las escalas anteriores.
En ocasiones, el HE vestibular es tan severo que sobrepasa los límites anatómicos del vestíbulo y se «hernia» o «protruye» hacia los canales semicirculares (CC. SS.). Esta herniación del HE hacia los CC. SS. fue observada por primera vez por Gürkov et al.29 y ligada a hipofunción calórica de los CC. SS.30. El significado fisiopatológico de esta herniación todavía se desconoce.
En resumen, en la valoración cualitativa/semicuantitativa del HE se han consolidado de manera extensa las escalas de 3 grados para el HE coclear y de 3 o 4 grados para el HE vestibular. En este último caso, la adición de un cuarto grado ha demostrado aumentar la sensibilidad y especificidad diagnósticas de la EM, al permitir una mejor diferenciación entre pacientes con grados leves de afectación y los controles sanos. Esto aporta una justificación fisiopatológica y práctica para preferir la escala de 4 grados en algunos contextos.
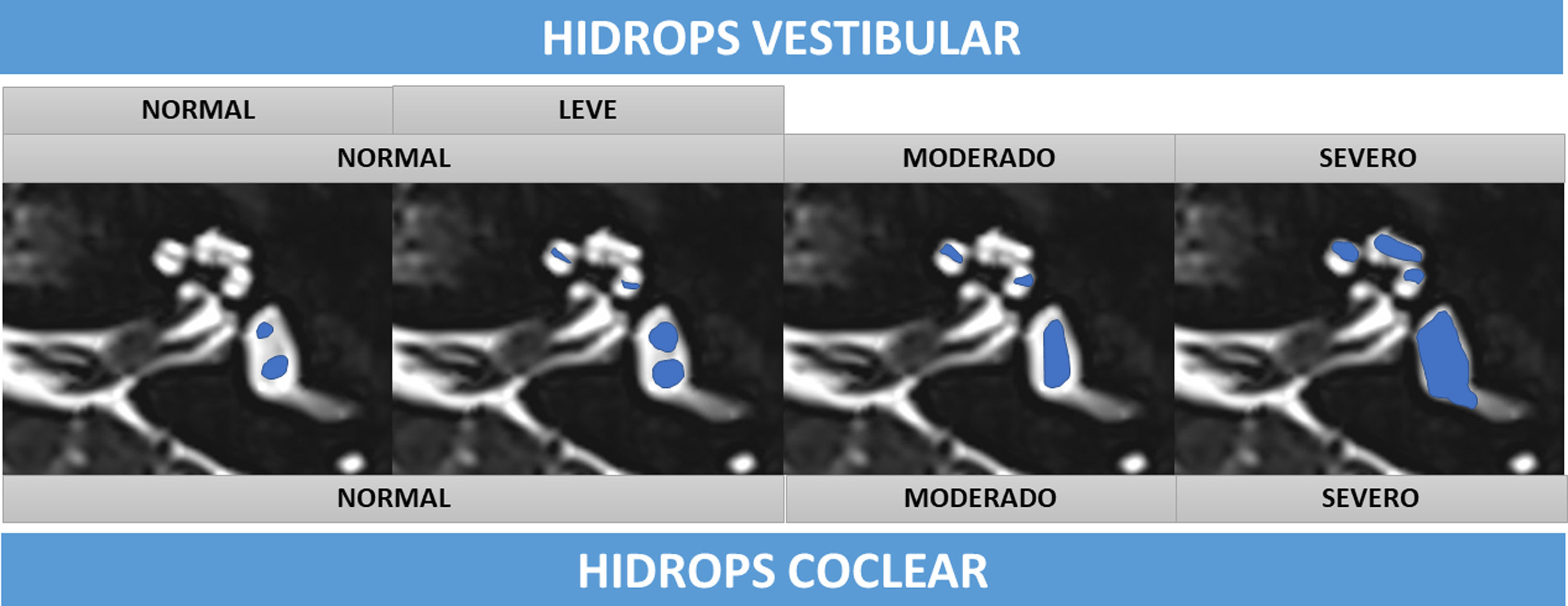
Esta valoración cualitativa se resume en el esquema de la figura 4.
Representación esquemática sobre secuencia T2 de cisternografía de los grados de HE vestibular y coclear, sombreado en azul el componente endolinfático. Se representan los 3 grados de HE coclear y las escalas de 3 y 4 grados de HE vestibular. Nótese cómo el grado normal de la escala de 3 grados vestibular se escinde en normal y leve en la escala de 4 grados (en el grado normal, el sáculo es más pequeño que el utrículo, en el grado leve el sáculo es igual o mayor que el utrículo, pero todavía no confluyen).
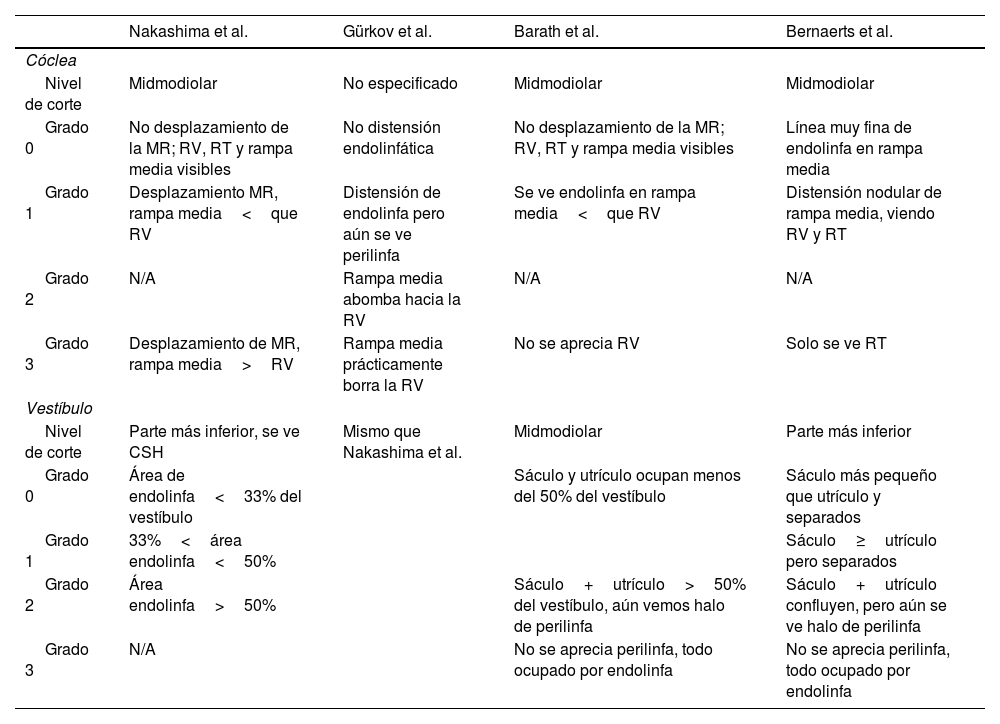
La tabla 4 resume los distintos autores y métodos de valoración cualitativos del HE (modificada de Boegle et al.31).
Distintos autores y métodos de valoración cualitativos del hidrops endolinfático
| Nakashima et al. | Gürkov et al. | Barath et al. | Bernaerts et al. | |
|---|---|---|---|---|
| Cóclea | ||||
| Nivel de corte | Midmodiolar | No especificado | Midmodiolar | Midmodiolar |
| Grado 0 | No desplazamiento de la MR; RV, RT y rampa media visibles | No distensión endolinfática | No desplazamiento de la MR; RV, RT y rampa media visibles | Línea muy fina de endolinfa en rampa media |
| Grado 1 | Desplazamiento MR, rampa media<que RV | Distensión de endolinfa pero aún se ve perilinfa | Se ve endolinfa en rampa media<que RV | Distensión nodular de rampa media, viendo RV y RT |
| Grado 2 | N/A | Rampa media abomba hacia la RV | N/A | N/A |
| Grado 3 | Desplazamiento de MR, rampa media>RV | Rampa media prácticamente borra la RV | No se aprecia RV | Solo se ve RT |
| Vestíbulo | ||||
| Nivel de corte | Parte más inferior, se ve CSH | Mismo que Nakashima et al. | Midmodiolar | Parte más inferior |
| Grado 0 | Área de endolinfa<33% del vestíbulo | Sáculo y utrículo ocupan menos del 50% del vestíbulo | Sáculo más pequeño que utrículo y separados | |
| Grado 1 | 33%<área endolinfa<50% | Sáculo≥utrículo pero separados | ||
| Grado 2 | Área endolinfa>50% | Sáculo+utrículo>50% del vestíbulo, aún vemos halo de perilinfa | Sáculo+utrículo confluyen, pero aún se ve halo de perilinfa | |
| Grado 3 | N/A | No se aprecia perilinfa, todo ocupado por endolinfa | No se aprecia perilinfa, todo ocupado por endolinfa | |
Nótese que en la clasificación del HE vestibular, Bernaerts et al. emplean la clasificación de 4 grados. En el HE coclear, únicamente Gürkov et al. emplean una escala de 4 grados.
CSH: conducto semicircular horizontal; MR: membrana de Reissner; N/A: no aplica; RV: rampa vestibular; RT: rampa timpánica.
Modificada de Boegle et al.31.
Por último, un sistema minoritario de valoración cualitativa es la llamado’ inversión de la proporción sáculo/utrículo (SURI). En este sistema de gradación, el grado 0 se define cuando no se observa ninguna anomalía sacular (SURI<1). El grado 1 se define cuando SURI≥1. El grado 2 se define cuando el sáculo no es visible32.
Valoración cuantitativa del HESe podría definir de forma general como todo aquel tipo de medición o valoración que no sea cualitativa, es decir, que realice algún tipo de medida del espacio endolinfático. Estas medidas pueden ser volumétricas en todos y cada uno de los cortes en los que se visualice endo y perilinfa, o bien pueden ser medidas de las áreas que ocupan la perilinfa y la endolinfa en un corte específico único (habitualmente el corte a nivel del tercio medio del modiolo).
A pesar de que a priori y conceptualmente podría asumirse como más exacta que la cualitativa, su aplicación está mucho menos extendida ya que: 1) la medición volumétrica fiable de estructuras tan pequeñas como el vestíbulo o el canal coclear es difícil de realizar y no existe un método extendido y generalizado, ya que depende en gran medida de los softwares utilizados; 2) una medición basada en la delimitación manual de los límites de la endolinfa en cada uno de los cortes de la secuencia volumétrica conlleva un mayor esfuerzo y requiere emplear un mayor tiempo de posproceso.
Al no existir un método estandarizado de realizar la cuantificación volumétrica, la metodología se ve influida por el software de que se disponga. Habitualmente, se requiere de una intervención activa del neurorradiólogo33.
El primer artículo que demostró una cuantificación volumétrica in vivo del HE fue el publicado por Gürkov et al.34 en el que se incluyeron 16 pacientes con EM definida unilateral. La vía de administración del contraste fue la intratimpánica y las secuencias escogidas fueron la T2 cisternografía para el cálculo del volumen total de las estructuras del oído interno (cóclea, vestíbulo y CC. SS.) y la 3D-REAL-IR para el cálculo endolinfático. Obtuvieron medidas volumétricas, así como representaciones tridimensionales. Resaltan la dificultad de visualización de la endolinfa en los CC. SS. y por ello no realizan mediciones volumétricas endolinfáticas de los mismos e introducen el concepto de las ratios endolinfáticas (REL).
Las REL indican el porcentaje de ocupación de la endolinfa de las estructuras del oído interno. Por tanto, podremos hablar de una REL vestibular, coclear o total de todo el oído interno membranoso35, y son el indicador más extendido para la cuantificación volumétrica del HE, como han demostrado los trabajos de los grupos japoneses36–38.
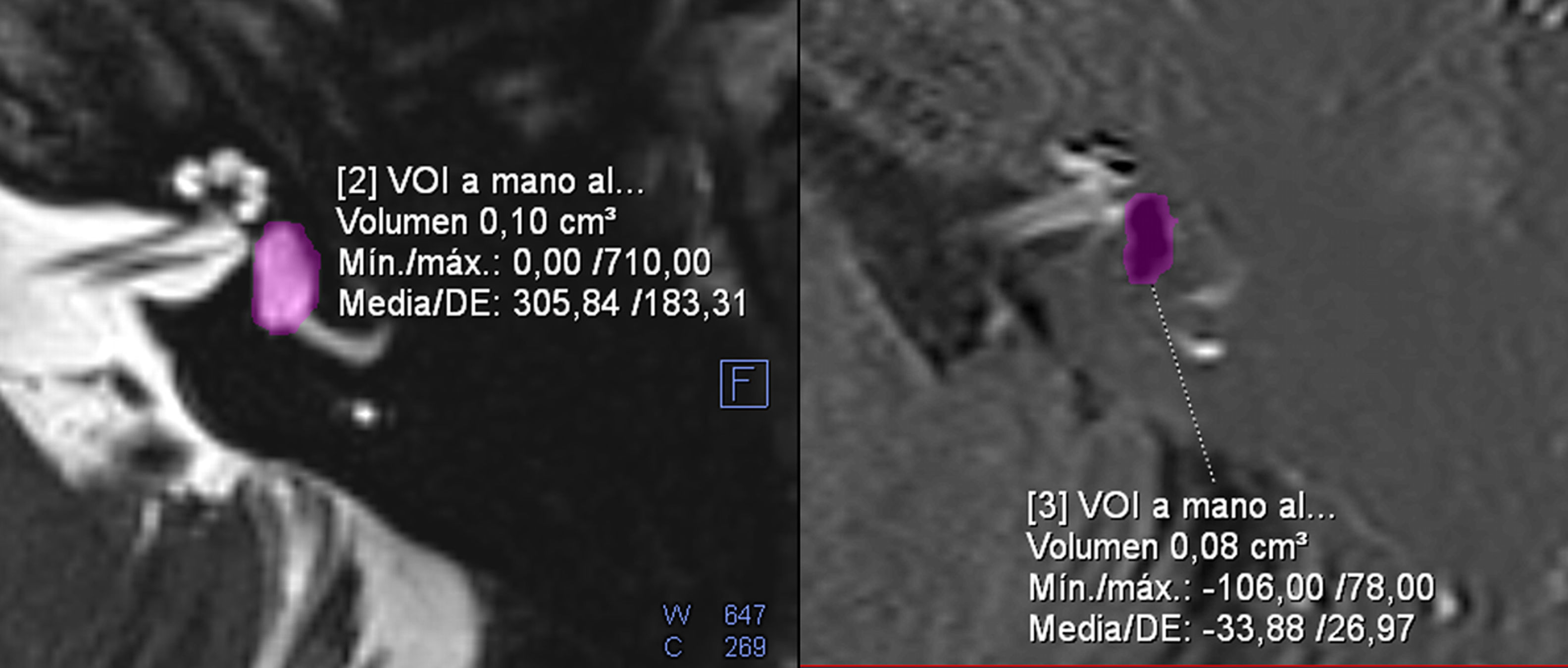
Nuestro grupo realizó una cuantificación volumétrica calculando los REL vestibulares en pacientes con EM definida unilateral39 y correlacionó los valores numéricos con las escalas cualitativas de valoración de HE, obteniendo unos valores umbrales de corte de REL por encima del 60% para HE vestibular radiológicamente significativo y por debajo del 30% para HE vestibular radiológicamente no significativo. Un ejemplo de cómo se ha calculado la REL vestibular se puede apreciar en la figura 5.
Cálculo de la razón o ratio endolinfática (REL) vestibular. Corresponde al porcentaje del volumen total del vestíbulo que es ocupado por la endolinfa. Un volumen endolinfático de 0,08cm3 en un vestíbulo de 0,1cm3 corresponde a un REL del 80%. Grado moderado según la clasificación cualitativa.
Otros autores optan por un método de cálculo volumétrico menos extendido40 para el HE vestibular, en el que realizan una medición del área endolinfática y perilinfática en varios cortes y multiplican por el espesor de corte de la secuencia, en vez de analizar todos y cada uno de los cortes del estudio.
En cuanto al papel novedoso de la inteligencia artificial en la cuantificación volumétrica, se han desarrollado herramientas para la segmentación automática del espacio endolinfático en forma de pipelines. Algunos de ellos están disponibles en formato abierto u open-source, previa consulta con los autores, en forma de plug-in41.
En resumen, hay que resaltar la variabilidad de metodologías para el cálculo volumétrico que dependen en gran medida del software disponible.
El realce perilinfáticoEl realce perilinfático se aprecia como una mayor hiperintensidad de la perilinfa en el oído patológico, que se hace evidente si se compara con el oído sano contralateral. Traduce una disrupción de la barrera hematolaberíntica y su valoración suele ser cualitativa, pudiendo valorar por separado el realce perilinfático vestibular y el coclear21. En caso de hidrops vestibular severo, no se podrá valorar el grado de realce perilinfático vestibular, ya que no habrá perilinfa visible. En la vía intravenosa de administración de contraste, se podrán valorar ambos oídos, no así en la vía intratimpánica unilateral. Algunos autores abogan por una valoración cuantitativa del realce perilinfático23,42. No obstante, su implicación en el algoritmo diagnóstico aún no está del todo clara. Parece que su presencia aumenta el valor predictivo positivo en el diagnóstico de la EM definida y que se asocia con el grado de HE, pero sin una relación todavía clara con la severidad de los síntomas audiovestibulares.
Un ejemplo gráfico de realce perilinfático se puede apreciar en la figura 6.
Secuencia 3D-REAL-IR axial obtenida 4h tras la administración de una dosis única de gadolinio intravenoso. Llamativa y asimétrica hiperintensidad de la cóclea y el vestíbulo izquierdos en comparación con los contralaterales, compatible con un realce perilinfático positivo izquierdo cócleo-vestibular, en un paciente con síntomas menieriformes izquierdos, traduciendo una disrupción de la barrera hematolaberíntica. Nótese que el paciente no presenta HE izquierdo, no teniendo necesariamente por qué coincidir ambos hallazgos.
La extensión o herniación del componente endolinfático vestibular hacia los CC. SS. fue primeramente descrito por Gürkov et al. y relacionado inicialmente con una hipofunción calórica de los mismos en las pruebas vestibulares43,44. No obstante, el significado fisiopatológico de este fenómeno no está todavía del todo dilucidado.
Algunos autores45 han intentado describir topográficamente los tipos de herniación: hacia la porción no ampular del canal semicircular lateral o bien hacia la cruz común del canal semicircular posterior. Aunque, conceptualmente, se pudiera asumir que una herniación de endolinfa a CC. SS. conlleva un grado severo de HE vestibular, estos autores describen este último tipo de herniación al canal semicircular posterior en oídos internos sin un HE vestibular llamativo. También describen que herniaciones unilaterales ocurren con la progresión del HE, pero que cuando las herniaciones son bilaterales pueden ocurrir independientemente del grado de progresión del HE y que pueden estar influidas por otros factores que alteren el laberinto membranoso.
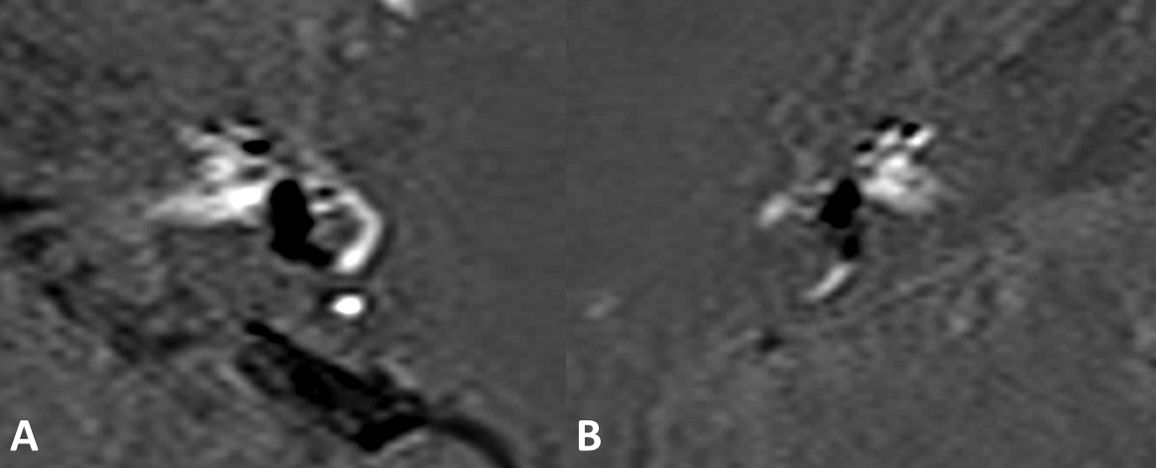
Estos hallazgos se pueden observar en la figura 7.
Secuencias 3D-REAL-IR de 2 pacientes distintos, obtenidas 4h después de la administración de dosis única de gadolinio. A. HE vestibular severo con herniación a la porción no ampular del canal semicircular horizontal. B. HE vestibular también marcado, en este caso con herniación a la cruz común/canal semicircular superior.
Es importante resaltar que la indicación del estudio radiológico de la EM debe ser filtrada por el neurootólogo, puesto que hasta un 26% de los sujetos sanos muestran hidrops endolinfático por RM y entre un 10 y un 33% de los pacientes con EM no muestran hidrops por RM. Las principales indicaciones se pueden resumir en: sospecha de EM unilateral o bilateral; vértigo episódico recurrente con hipoacusia fluctuante y tinnitus, sin diagnóstico claro tras pruebas funcionales (audiometría, VEMP, ECOG); evaluación prequirúrgica (por ejemplo, antes de una descompresión del saco endolinfático o neurectomía vestibular); duda diagnóstica entre EM y migraña vestibular; seguimiento de pacientes con tratamiento intratimpánico o diuréticos, para valorar cambios en el volumen endolinfático; síntomas vestibulares atípicos o refractarios, en los que se quiere descartar otras etiologías del oído interno.
Además, no es infrecuente encontrar distintos grados de HE en pacientes con EM unilateral. Nuestro grupo analizó este hallazgo46, observando que en el oído no sintomático no se producía deterioro de la audición y que, a grados similares de EH, los síntomas vestibulares eran mucho más evidentes en el oído sintomático. Se cree, por tanto, que el grado de HE puede considerarse como un proceso inactivo o quiescente en el oído no sintomático.
Propuesta de informe estructuradoDurante los últimos años, el informe radiológico estructurado ha ido ganando protagonismo como elemento clave y diferenciador de la práctica clínica diaria en los departamentos de radiología.
Se describen 3 niveles de informe estructurado:
- -
Nivel 1, con párrafos y subdivisiones estructuradas.
- -
Nivel 2, con ítems, en el que cada uno repasa detalladamente cada una de las estructuras anatómicas a estudiar.
- -
Nivel 3, con léxico y terminología muy estandarizada y especializada, a veces incluso implementando el uso de menús desplegables en los que el radiólogo selecciona una opción y se genera un informe definitivo.
La mayoría de las sociedades científicas radiológicas47 se han posicionado a favor de los informes estructurados. Entre sus ventajas se encuentran: una estructura estandarizada que contiene toda la información esencial y es comparable, independientemente del autor; un idioma estandarizado que disminuye la ambigüedad; facilitar procesos automatizados y compartir los datos.
En nuestro grupo, proponemos un informe tipo estandarizado para los estudios de RM de hidrops que ya usamos habitualmente, que incluye: técnica de exploración, tipo de Gd y vía de administración, grados cualitativos de HE, presencia o ausencia de realce perilinfático y de herniación a CC. SS., y valoración cuantitativa con cálculo de las REL vestibulares. Un ejemplo del mismo puede apreciarse en la figura 8.
ConclusiónLa evaluación del grado de HE mediante RM se ha consolidado como una herramienta de apoyo indispensable para el manejo y el tratamiento del paciente con EM por parte del neurootólogo.
Esta revisión ha descrito las secuencias disponibles para su estudio (3D-FLAIR y 3D-REAL-IR), con las ventajas e inconvenientes de cada una. La valoración del grado de HE puede ser tanto cualitativa (la más extendida) como cuantitativa, disponiendo de múltiples opciones de software para conseguirla. Los hallazgos asociados (realce perilinfático y herniación a CC. SS.), aunque con un significado todavía por dilucidar, deben ser conocidos y reportados en el informe radiológico.
Dada la importancia creciente de la visualización de HE mediante RM (llegando incluso a ser considerado criterio diagnóstico por alguno de los grupos), es necesaria una estandarización de los protocolos de visualización y de las escalas de valoración.
Autoría- -
VMSV: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, búsqueda bibliográfica, redacción del trabajo, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
- -
GLE: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, búsqueda bibliográfica, redacción del trabajo, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
- -
PDE: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
- -
MBP: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
- -
MCI: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
- -
NPF: responsable de la integridad del estudio, concepción del estudio, diseño del estudio, obtención de los datos, análisis e interpretación de los datos, búsqueda bibliográfica, redacción del trabajo, revisión crítica del manuscrito con aportaciones intelectualmente relevantes, aprobación de la versión final.
Este estudio ha sido subvencionado por el Instituto de Salud Carlos III mediante los proyectos PI19/00414 y PI24/00175, y cofinanciado por el Fondo Europeo de Desarrollo Regional/Fondo Social Europeo, «Una manera de hacer Europa».
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
A los pacientes y a todo el personal del departamento de radiología de las sedes de Madrid y Pamplona.