Valorar si la perfusión tumoral en el estudio diagnóstico inicial de RM es un marcador pronóstico para la supervivencia en pacientes diagnosticados de gliomas de alto grado. Analizar los factores de riesgo que influyen en la mortalidad por gliomas de alto grado para poder cuantificar la supervivencia global esperada del paciente.
Pacientes y métodosSe seleccionaron las RM de todos los pacientes diagnosticados de glioma de alto grado en un hospital de tercer nivel entre los años 2017 y 2019. Se recogieron variables clínicas y tumorales. Se usó el análisis de supervivencia para determinar la asociación entre la perfusión tumoral y el tiempo de supervivencia. Se estudió la relación entre las variables recogidas y la supervivencia mediante el estadístico de Wald, cuantificando esta relación mediante la regresión de Cox. Por último, se analizó el tipo de relación existente entre la perfusión tumoral y la supervivencia a través del estudio de regresión lineal. Estos análisis estadísticos se realizaron con el software SPSS v.17.
ResultadosSe incluyeron 38 pacientes (media de edad 61,1años). La supervivencia media global fue de 20,6meses. Se observó asociación entre la perfusión tumoral en la RM diagnóstica y la supervivencia global, mostrando el grupo con valores intratumorales de volumen sanguíneo cerebral relativo (rVSC) >3,0 una disminución significativa en el tiempo medio de supervivencia respecto al grupo con valores <3,0 (14,6meses vs 22,8meses, p=0,046). También han demostrado influir significativamente en la supervivencia media variables como la escala de Karfnosky y el tiempo de recidiva desde la intervención.
ConclusionesSe ha evidenciado que la perfusión tumoral por RM tiene valor pronóstico en el estudio inicial de los gliomas de alto grado. La media de supervivencia de los pacientes con rVSC inferior o igual a 3,0 es significativamente mayor que en aquellos cuyo valor es superior, lo que permitiría una aproximación pronóstica más precisa en cada paciente en el momento del diagnóstico.
To evaluate if the tumour perfusion at the initial MRI scan is a marker of prognosis for survival in patients diagnosed with high grade gliomas (HGG). To analyse the risk factors which influence on the mortality from HGG to quantify the overall survival to be expected in patients.
Patients and methodsThe patients diagnosed with HGG through a MRI scan in a third-level hospital between 2017 and 2019 were selected. Clinical and tumour variables were collected. The survival analysis was used to determine the association between the tumour perfusion and the survival time. The relation between the collected variables and the survival period was assessed through Wald's statistical method, measuring the relationship via Cox's regression model. Finally, the type of relationship that exists between the tumour perfusion and the survival was analysed through the lineal regression method.Those statistical analysis were carried out using the software SPSS v.17.
ResultsThirty-eight patients were included (average age: 61.1years old). The general average survival period was 20.6months. A relationship between the tumour perfusion at the MRI scan and the overall survival has been identified, in detail, a group with intratumor values of relative cerebral blood volume (rCBV) >3.0 has shown a significant decline in the average survival period with regard to the average survival period of the group with values <3.0 (14.6months vs. 22.8months, P=.046). It has also been proved that variables like Karnofsky's scale and the response time since the intervention significantly influence on the survival period.
ConclusionsIt has become evident that the tumour perfusion via MRI scan has a prognostic value in the initial analysis of HGG. The average survival period of patients with rCBV less than or equal to 3.0 is significantly higher than those patients whose values are higher, which allows to be more precise with the prognosis of each patient.
Los gliomas de alto grado (grados3 y4 de la OMS) son los tumores cerebrales malignos más frecuentes en adultos, siendo el pronóstico especialmente pobre en los gliomas grado4, con una supervivencia media de unos 15meses desde su diagnóstico y un rango de supervivencia a los 5años que oscila entre el 5% y el 10%1,2.
La resonancia magnética (RM) es la técnica de elección para su diagnóstico3,4, jugando un papel fundamental en la caracterización de las lesiones y en la planificación del tratamiento. En los últimos años también se ha postulado sobre el papel de la RM en el pronóstico de esta enfermedad. El glioma grado4 es un tumor con una marcada neoangiogénesis5, por lo que los estudios de perfusión pueden aportar mucha información en este sentido, ya que representan un método no invasivo y fácilmente reproducible para la valoración tanto cuantitativa como cualitativa de los tumores cerebrales. Existen tres técnicas principales para realizar estudios de perfusión por RM: imagen de susceptibilidad magnética ponderada en T2* (perfusión T2*; DSC, por sus siglas en inglés), perfusión dinámica ponderada en T1 (DCE, por sus siglas en inglés) y técnicas Arterial Spin Labelling. La perfusión T2* evalúa fundamentalmente la microvasculatura y la angiogénesis, mientras que la perfusión T1 estudia la permeabilidad vascular. La más empleada, y también la que ha sido utilizada en nuestro estudio, es la técnica ponderada en T2*, ya que tiene una ratio señal/ruido alta y una buena resolución temporal, así como un tiempo de adquisición relativamente corto6. Los parámetros que se pueden analizar, entre otros, son el volumen sanguíneo cerebral (VSC), el flujo sanguíneo cerebral (FSC) y el tiempo de tránsito medio (TTM), pudiendo obtener igualmente mediciones como el VSC relativo (rVSC), siendo este último el más empleado en la valoración de tumores cerebrales7.
La hipótesis de nuestro estudio es que valores elevados de VSC en la RM diagnóstica de los gliomas de alto grado se correlacionan con un peor pronóstico. Para ello se va a analizar la asociación entre la perfusión tumoral en el diagnóstico inicial y la supervivencia global del paciente diagnosticado de esta patología. También se analizarán los factores de riesgo que influyen en la mortalidad por estos tumores para poder cuantificar la supervivencia esperada del paciente.
Material y métodosDiseño del estudio y obtención de la serie de pacientesSe ha realizado un estudio observacional y retrospectivo, con una población compuesta por los pacientes diagnosticados de glioma de alto grado mediante RM realizada en nuestro centro, desde el 1 de enero de 2017 al 31 de diciembre de 2019. El estudio fue aprobado por el comité ético asistencial de nuestro hospital.
La base de datos empleada para el estudio ha sido facilitada por el servicio de neurocirugía de nuestro hospital, con pacientes diagnosticados de gliomas de alto grado en el periodo referido anteriormente.
Los criterios de inclusión fueron: 1)pacientes adultos con edad >18años; 2)diagnóstico de glioma de alto grado con confirmación histológica en el período del 1 de enero de 2017 a 31 de diciembre de 2019, y 3)RM realizada en nuestro centro previa a biopsia. Se excluyeron aquellos pacientes que no disponían de estudio de perfusión inicial o en los que este no fue valorable por motivos técnicos. En el período de tiempo incluido en el estudio, 42 pacientes fueron diagnosticados de glioma de alto grado; dos pacientes no tenían estudio de perfusión inicial y en otros dos la perfusión no fue valorable por cuestiones técnicas, por lo que fueron excluidos. Por tanto, el tamaño muestral final fue de 38 pacientes.
Variables analizadasLas características recogidas de los pacientes fueron: edad al diagnóstico, sexo, tipo de resección (total, parcial o biopsia), que fue determinada en función de la RM postoperatoria realizada en las primeras 48-72horas tras la intervención, escala de Karfnosky (mide la capacidad de los pacientes con cáncer de realizar tareas rutinarias [100: realizar todas las tareas; 0: fallecido]), recidiva (sí/no) y tiempo de recidiva (tiempo transcurrido en meses desde la fecha de cirugía a la fecha del diagnóstico de recidiva por imagen), y tiempo de supervivencia global (tiempo transcurrido en meses desde el diagnóstico al fallecimiento o a la última fecha de actualización de la base de datos [diciembre de 2021]). Las RM de control en el seguimiento de los pacientes tras la finalización del tratamiento se realizaron con una periodicidad trimestral.
Características tumorales: volumen tumoral (cm3), necrosis tumoral (estimada en cm3 mediante la medición de los tres ejes de la lesión), perfusión (cociente de perfusión), lateralidad y la expresión del indicador p53 y la mutación IDH (sí/no).
Adquisición de imagen y valoración de la perfusiónTodos los estudios fueron adquiridos en equipos de 1,5T (MAGNETOM Aera) o 3,0T (MAGNETOM Vida). Las secuencias realizadas incluyen sagital y axial T1, axial T2, axial Difusión (b0 y b800) y mapa ADC, susceptibilidad magnética (SWI), 3DFLAIR, perfusión T2*EG y 3DT1 poscontraste. Los parámetros del protocolo de adquisición de la secuencia de perfusión potenciada en T2*EG en el equipo de 1,5T son TE/TR 30/1.650ms, 20 cortes, grosor de corte de 5mm, flip angle 90°, FOV 23×23cm, tamaño del vóxel 1,8×1,8×5,0mm y matriz de adquisición de 128×128mm; en el equipo de 3T son TE/TR 30/1.600ms, 20 cortes, grosor de corte de 4mm, flip angle 90°, FOV 22×22cm, tamaño del vóxel 1,7×1,7×4,0mm y matriz de adquisición de 128×128mm. En ambos casos se administran 7ml de contraste Gadovist a un flujo de 5ml/s.
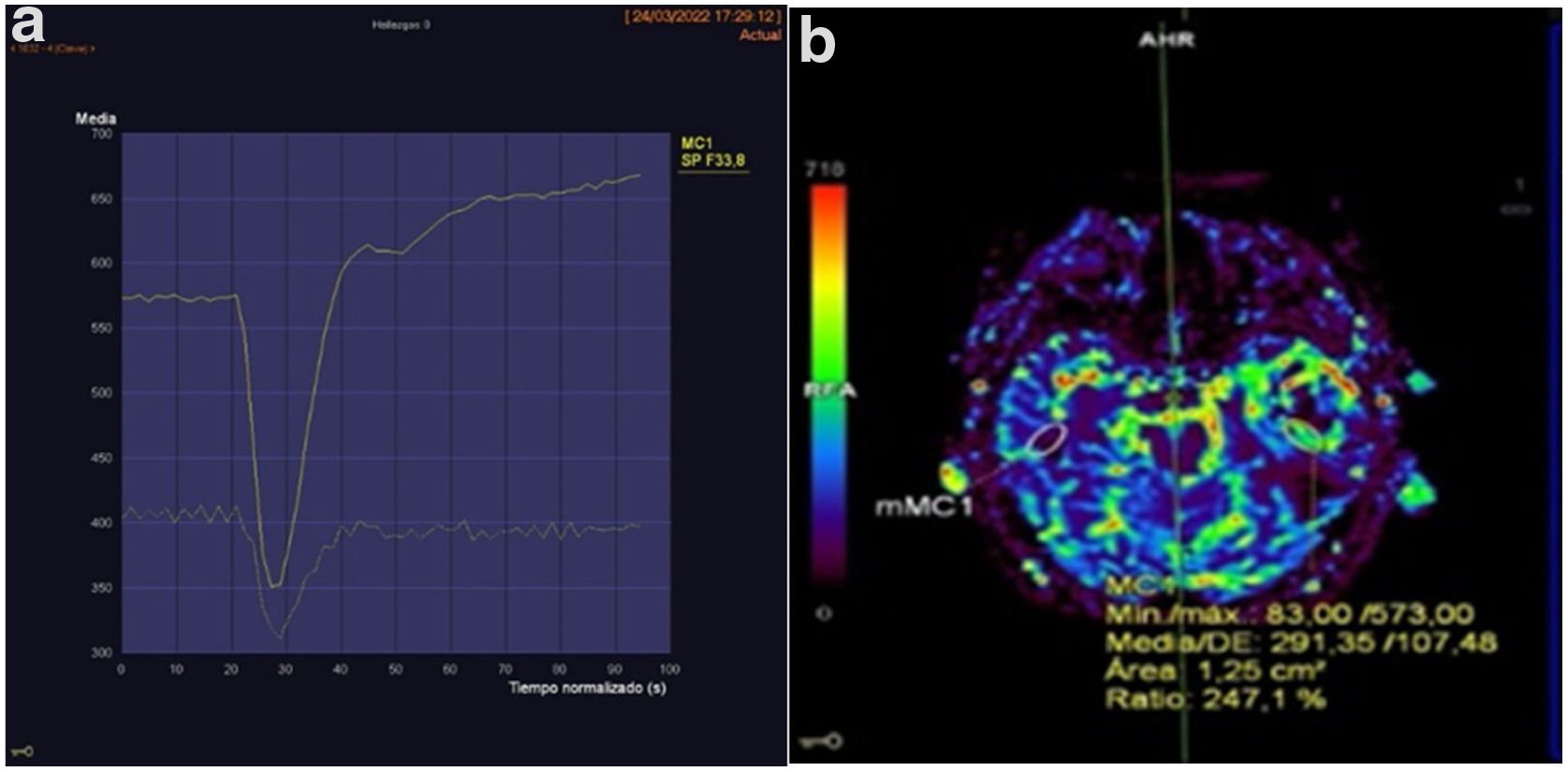
Para la valoración del estudio de perfusión se ha escogido aquella zona del tumor con un mayor VSC y se ha establecido una comparación con el área correspondiente del hemisferio contralateral, resultado un valor de rVSC (fig. 1).
A)Ejemplo de curva de perfusión medida en uno de los pacientes. B)En esta imagen se puede apreciar, mediante escala de colores, el volumen sanguíneo que llega a cada parte. Mediante la ROI (región de interés) elíptica se ha seleccionado la zona en la que se pretende medir la perfusión y se ha espejado de forma que se mida exactamente la misma zona del cerebro contralateral. Se comprueba que la perfusión (rVSC) es 2,47 mayor en el lado con el tumor.
Los datos se han registrado en una base de datos de manera anonimizada. Las variables cualitativas se han expresado en frecuencias absolutas, y las cuantitativas, como media y desviación estándar (DE).
Para analizar si existen diferencias en la supervivencia dependiendo del valor de perfusión tumoral se ha realizado un análisis de supervivencia o Kaplan-Meier. Para ello, se ha codificado la variable porcentaje de perfusión en una nueva variable dicotómica en la que se han distinguido dos grupos: rVSC mayor a 3,0 o igual/menor a 3,0. Este valor se ha fijado considerando publicaciones previas8 y teniendo en cuenta que es un valor aproximado de la perfusión media de la muestra estudiada. El test de log-rank fue usado para determinar si las diferencias entre ambos grupos eran estadísticamente significativas.
El análisis de la asociación entre las variables estudiadas y la supervivencia de los pacientes se ha realizado mediante el estadístico de Wald, cuantificando posteriormente esta asociación mediante la regresión de Cox para aquellas en las que el estadístico es significativo.
Por último, para evaluar el tipo de relación existente entre la perfusión tumoral y la supervivencia del paciente se ha calculado el coeficiente de correlación de Pearson, seguido de un análisis de regresión lineal que permita estimar la relación.
Para este análisis estadístico se ha utilizado el software estadístico SPSS v.17 para Windows, considerando significativos valores de p<0,05 y expresando los intervalos de confianza al 95%.
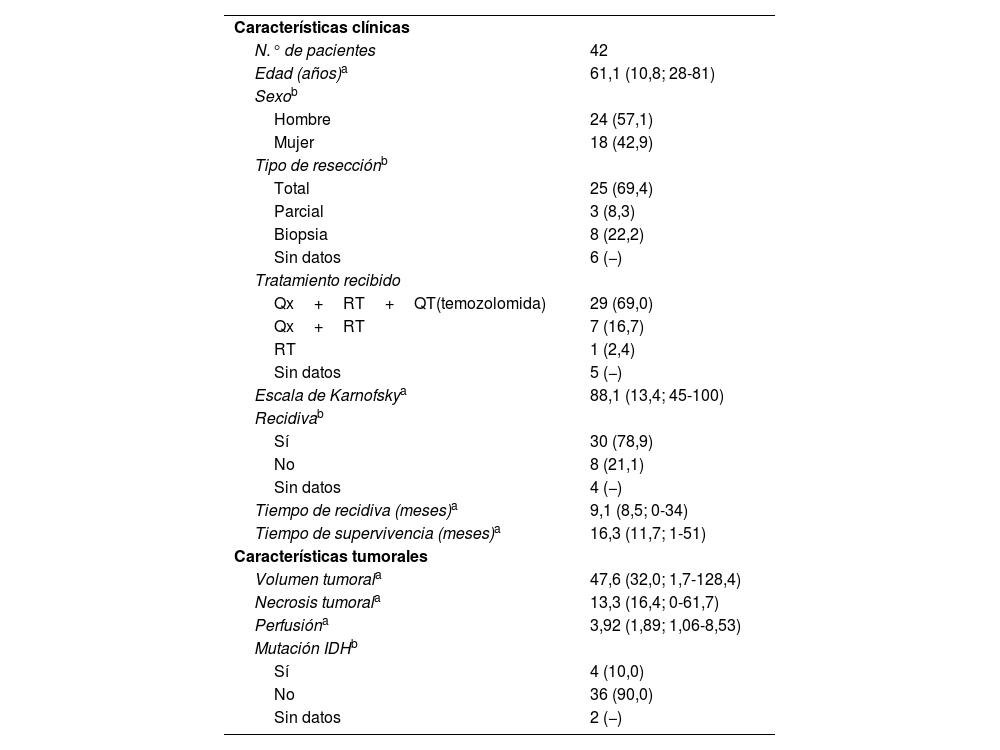
ResultadosCaracterísticas de la poblaciónEn la tabla 1 se muestran las características clínicas y tumorales de la población de estudio.
Características clínicas y tumorales de la población de estudio
| Características clínicas | |
| N.° de pacientes | 42 |
| Edad (años)a | 61,1 (10,8; 28-81) |
| Sexob | |
| Hombre | 24 (57,1) |
| Mujer | 18 (42,9) |
| Tipo de resecciónb | |
| Total | 25 (69,4) |
| Parcial | 3 (8,3) |
| Biopsia | 8 (22,2) |
| Sin datos | 6 (−) |
| Tratamiento recibido | |
| Qx+RT+QT(temozolomida) | 29 (69,0) |
| Qx+RT | 7 (16,7) |
| RT | 1 (2,4) |
| Sin datos | 5 (−) |
| Escala de Karnofskya | 88,1 (13,4; 45-100) |
| Recidivab | |
| Sí | 30 (78,9) |
| No | 8 (21,1) |
| Sin datos | 4 (−) |
| Tiempo de recidiva (meses)a | 9,1 (8,5; 0-34) |
| Tiempo de supervivencia (meses)a | 16,3 (11,7; 1-51) |
| Características tumorales | |
| Volumen tumorala | 47,6 (32,0; 1,7-128,4) |
| Necrosis tumorala | 13,3 (16,4; 0-61,7) |
| Perfusióna | 3,92 (1,89; 1,06-8,53) |
| Mutación IDHb | |
| Sí | 4 (10,0) |
| No | 36 (90,0) |
| Sin datos | 2 (−) |
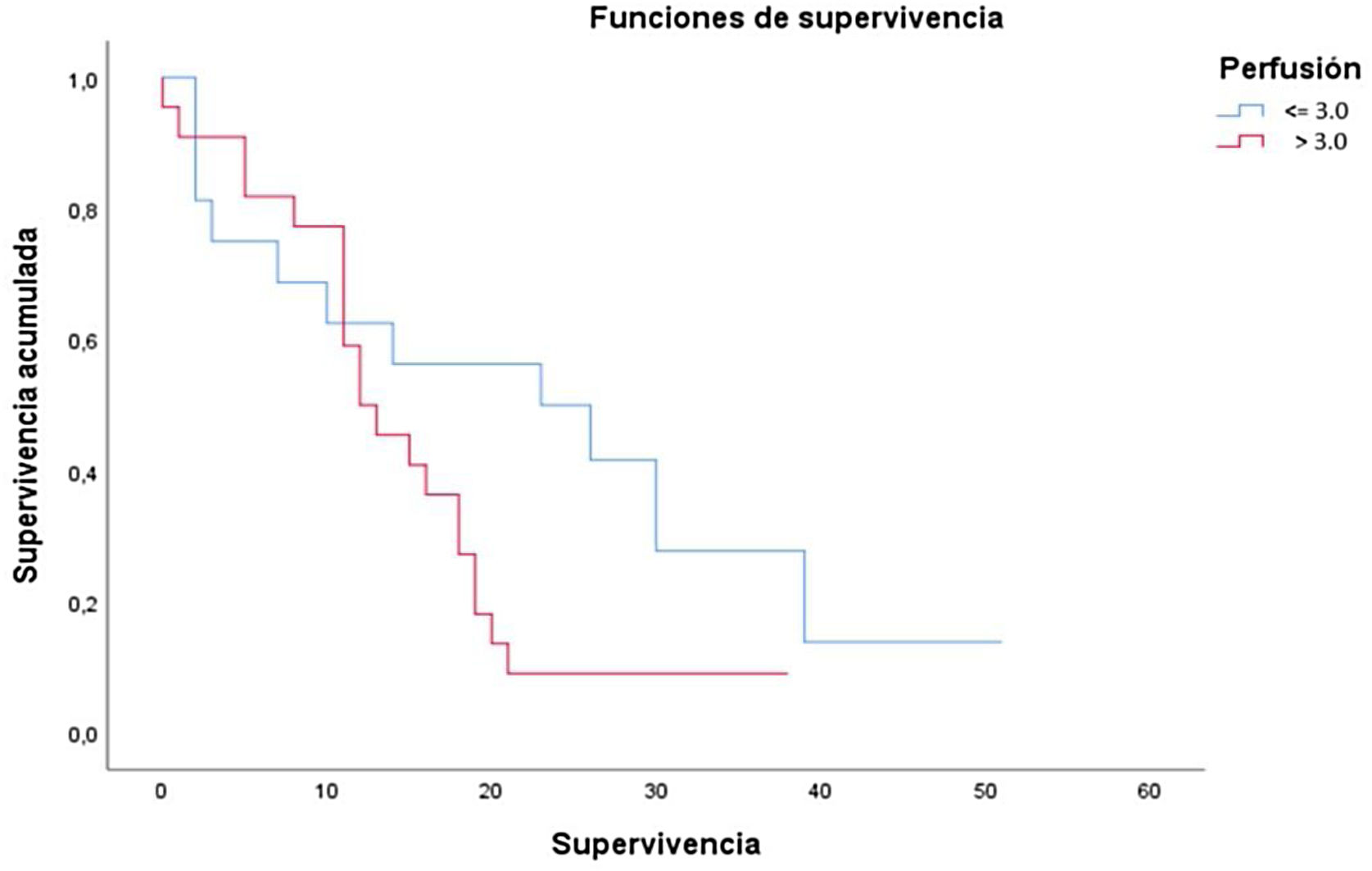
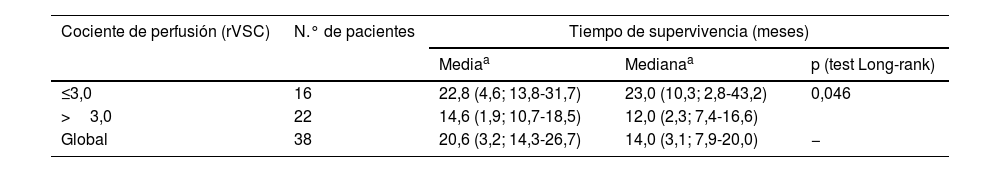
Los resultados de las curvas de supervivencia o de Kaplan-Meier se resumen en la tabla 2 y en figura 2, dividiendo a nuestra población según el umbral óptimo para el porcentaje de perfusión (≤3,0 o >3,0). La supervivencia media global obtenida fue de 20,6meses (DE: 3,2; IC95%: 14,3-26,7). Podemos observar que los pacientes con un valor de rVSC mayor a 3,0 tienen una reducción estadísticamente significativa de la supervivencia media en comparación con el grupo de pacientes que muestran un valor menor o igual a 3,0 (14,6meses vs 22,8meses, respectivamente, p=0,046).
Resultados del análisis de Kaplan-Meier y test Long-rank para el tiempo de supervivencia según el valor de la perfusión
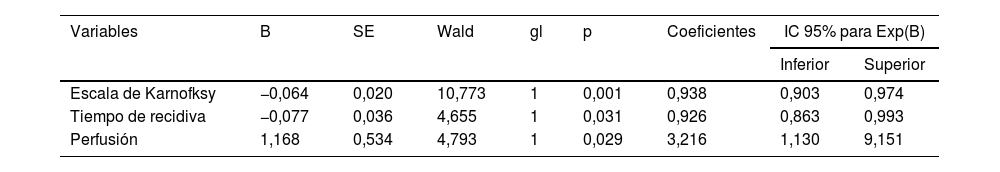
La tabla 3 muestra las variables que influyen en la supervivencia mediante la significación en el estadístico de Wald. En este caso, se ha obtenido un valor significativo para las variables escala de Karnofsky (p=0,001), tiempo de recidiva (p=0,036) y perfusión (p=0,029).
Estadísticos y coeficientes de las variables del modelo
| Variables | B | SE | Wald | gl | p | Coeficientes | IC 95% para Exp(B) | |
|---|---|---|---|---|---|---|---|---|
| Inferior | Superior | |||||||
| Escala de Karnofksy | −0,064 | 0,020 | 10,773 | 1 | 0,001 | 0,938 | 0,903 | 0,974 |
| Tiempo de recidiva | −0,077 | 0,036 | 4,655 | 1 | 0,031 | 0,926 | 0,863 | 0,993 |
| Perfusión | 1,168 | 0,534 | 4,793 | 1 | 0,029 | 3,216 | 1,130 | 9,151 |
Se ha obtenido que la probabilidad de muerte por glioma de alto grado en un tiempo t, utilizando la ecuación de regresión de Cox, es:
donde λ0t es la función de riesgo base cuando todas las variables son cero, que depende del tiempo, y las variables karnofsky, t.recidiva y perfusión de la ecuación corresponden a los datos de la escala de Karnofsky, el tiempo de recidiva desde la operación y el porcentaje de perfusión, respectivamente, con los que se quiere realizar la predicción. Para comprobar si el modelo es adecuado se ha realizado el test de la razón de verosimilitud o prueba ómnibus, obteniendo una p<0,001, con lo cual se acepta que las variables aportan información.
Se ha encontrado una mayor probabilidad de muerte entre los pacientes con mayor perfusión tumoral. Según el modelo, el riesgo de morir en un paciente diagnosticado de glioma de alto grado con rVSC mayor a 3,0 es 3,2 veces superior que en un paciente con rVSC menor a 3,0, a igualdad en el resto de variables (IC95%: 1,130-9,151). Mientras que se ha encontrado una menor probabilidad de muerte por glioma de alto grado según aumentan los valores en la escala de Karnofsky (por cada aumento de 10 unidades, a igualdad en el resto de las demás variables, el riesgo de morir disminuye un 6,6% [1/0,938=1,066; IC95%: 0,903-0,974]) o con el aumento en el tiempo de recidiva desde la intervención (por cada mes más en el tiempo de recidiva el riesgo de morir del paciente disminuye un 8% [1/0,926=1,080, IC95%: 0,863-0,993]).
Estudio del tipo de relación entre perfusión y supervivencia de los pacientesEl coeficiente de correlación de Pearson calculado para las variables cociente de perfusión y tiempo de supervivencia en meses es −0,163 (p=0,329), lo que implica que al aumentar el cociente de perfusión disminuye el tiempo de supervivencia esperado. Sin embargo, al no encontrar diferencias estadísticamente significativas, no se puede concluir que exista una relación de tipo lineal entre ambas variables.
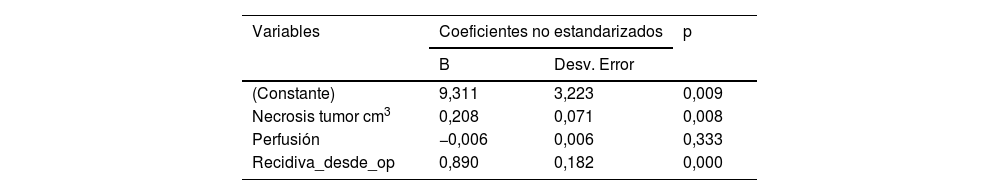
En la tabla 4 se detallan las variables que han obtenido significación estadística tras el análisis de regresión lineal, es decir, los factores de riesgo que influyen en la supervivencia de los pacientes. La variable cociente de perfusión no demuestra influencia en la supervivencia en este modelo lineal (p=0,333).
Al definir un modelo de regresión con las variables significativas se ha obtenido un coeficiente de determinación, o R2, igual a 0,574, por lo que este modelo explicaría el 57,4% de la variabilidad de los datos. Este bajo valor para R2 indica que un modelo lineal no es adecuado para predecir la supervivencia del paciente. Ya hemos visto que incluso la variable perfusión no se incluye en este modelo, mientras que en el modelo regresión de Cox sí tiene influencia. Por tanto, no tiene sentido predecir el tiempo de supervivencia mediante una relación lineal.
DiscusiónEn nuestro trabajo se ha comprobado que existe asociación entre la perfusión por RM en el estudio inicial y la supervivencia del paciente diagnosticado de glioma de alto grado, por lo que la perfusión cerebral se puede considerar como marcador pronóstico en esta enfermedad. Se ha observado que en el grupo de pacientes que mostraban valores intratumorales de rVSC>3,0 el tiempo medio de supervivencia disminuye notablemente respecto al grupo cuyos valores son ≤3,0 (14,6meses vs 22,8meses, respectivamente).
Estos resultados están en consonancia con numerosos estudios previos publicados en la literatura. Álvarez-Torres et al.9 realizan un estudio multicéntrico con 184 pacientes diagnosticados de glioblastoma multiforme (GBM) en el que, basándose en un trabajo previo de Albarracín et al.10 sobre ONCOhabitats vasculares del GBM, concluyen que, al presentar este tipo de tumores una gran heterogeneidad vascular, los valores de rVSC máximo (rVSCmax) obtenidos pueden ser empleados como biomarcador pronóstico de esta enfermedad. Jain et al.11 definen que los valores de rVSCmax obtenidos pueden usarse para predecir la supervivencia del paciente independientemente de las subclases moleculares del GBM, asociando altos valores de rVSC con un peor pronóstico. Hirai et al12, en un estudio sobre la perfusión-RM pretratamiento en astrocitomas de alto grado (grados3 y4), establecen que cuando los valores de rVSC son superiores al 2,3 pueden ser considerados como biomarcador pronóstico para predecir la supervivencia del paciente, siendo este valor de rVSC ligeramente inferior al referenciado en nuestro estudio. Law et al.13, en un trabajo que incluye a casi 200 pacientes con gliomas de bajo y alto grado, también concluyen que valores de rVSC por encima del 1,75 se asocian a una progresión tumoral más precoz (265días de media) en comparación con aquellos pacientes con valores inferiores al 1,75, donde el tiempo medio de progresión es de 3.585 días. También se han publicado trabajos similares en los que, a diferencia de los anteriores y del nuestro, se analizan parámetros de permeabilidad vascular como el coeficiente de transferencia de volumen (Ktrans). Así, Mills et al.14 observan que existe una relación directa entre Ktrans y tiempo de supervivencia en pacientes con GBM. Del mismo modo, Sanz-Requena et al.15 estiman que valores de Ktrans10% se asocian a un peor pronóstico en pacientes con gliomas de alto grado.
Predecir el tiempo de vida de un paciente desde el diagnóstico de glioma de alto grado es difícil. Únicamente se puede asegurar que, a menor perfusión, el tiempo de supervivencia generalmente es mayor. Sin embargo, esto depende de muchos factores que no son sencillos de controlar: genética, condiciones hereditarias, tipo de tumor, estadio del tumor cuando se ha diagnosticado, etc. En este estudio, como ya se ha comentado anteriormente, han resultado ser significativas, además de la perfusión, la escala de Karnofsky y el tiempo de recidiva tras la intervención. Estudios similares con mayor número de pacientes han demostrado que pueden influir otros factores, como la edad16. Por ello, es necesario estudiar detenidamente la historia clínica y la información disponible del paciente.
Por otra parte, la relación que existe entre la disminución de la supervivencia y valores elevados de rVSC no es lineal. Sería interesante investigar otras variables, como necrosis y recidiva desde la operación16, y otras técnicas que, en combinación, pudieran influir en el modelo para disponer de una mayor cantidad de información a la hora de realizar estimaciones y predicciones en el tiempo de supervivencia17. Igualmente, sería de gran utilidad plantear modelos de regresión no lineales, aunque su formulación es compleja.
En cuanto a las limitaciones de nuestro estudio, la primera sería el reducido número de pacientes incluidos. Aunque la base de datos original estaba compuesta por 42 pacientes, 4 fueron excluidos debido a la ausencia de estudio de perfusión en la RM inicial. La segunda es que el estudio se ha realizado en un único centro. También puede suponer una limitación el hecho de no haber incluido otras variables clínicas o histológicas, como el estado de la metilación del gen MGMT, que se ha relacionado con el pronóstico en los glioblastomas18.
En conclusión, nuestro estudio sugiere que existe una asociación entre la perfusión por RM en el estudio inicial de los gliomas de alto grado y la supervivencia global del paciente, observando que en tumores con valores de rVSC>3,0 disminuye notablemente el tiempo de supervivencia media. Futuros estudios, incluyendo la posibilidad de analizar la relación entre otros factores de riesgo y el tiempo de supervivencia, serían necesarios para validar nuestros resultados.
Autoría- 1.
Responsables de la integridad del estudio: FFV, MBB, ERR, JSV, FBR y MRG.
- 2.
Concepción del estudio: MRG.
- 3.
Diseño del estudio: MRG y ERR.
- 4.
Obtención de los datos: JSV.
- 5.
Análisis e interpretación de los datos: MBB.
- 6.
Tratamiento estadístico: MBB.
- 7.
Búsqueda bibliográfica: FFV y ERR.
- 8.
Redacción del trabajo: FFV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: FBR.
- 10.
Aprobación de la versión final: FFV, MRG y JSV.
Los autores declaran no haber recibido ningún tipo de financiación del sector público o privado para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.