El número de pacientes oncológicos que requieren atención urgente continúa en aumento. Muchas de estas urgencias suponen un riesgo vital y pueden derivarse tanto de la enfermedad tumoral como de los procedimientos diagnósticos o terapéuticos empleados. En este contexto, las técnicas de imagen adquieren un papel fundamental, ya que permiten una detección precoz y orientan el manejo clínico. Entre los escenarios más desafiantes se encuentran las infecciones oportunistas en pacientes sometidos a trasplante de progenitores hematopoyéticos, donde la afectación pulmonar supone un reto diagnóstico. Además de conocer las complicaciones de tratamientos convencionales como cirugía, quimioterapia y radioterapia, el radiólogo debe identificar efectos asociados a modalidades de inmunoterapia, que también pueden motivar consultas urgentes. Este artículo ofrece una revisión ilustrativa de las principales urgencias oncológicas, destacando el papel del radiólogo en su reconocimiento.
The number of oncology patients requiring emergency care continues to rise. Many of these emergencies are life-threatening and may result either from the underlying malignancy or the diagnostic and therapeutic procedures employed. In this context, imaging techniques play a fundamental role by enabling early detection and guiding clinical management. Among the most challenging scenarios are opportunistic infections in patients undergoing haematopoietic stem cell transplantation, where pulmonary involvement presents a significant diagnostic challenge. In addition to being familiar with complications related to conventional treatments such as surgery, chemotherapy and radiotherapy, radiologists must also be able to recognise adverse effects associated with immunotherapy modalities, which can also require urgent consultations. This article provides an illustrative review of the main oncological emergencies, highlighting the radiologist's role in their identification.
El cáncer es la segunda causa de muerte a nivel mundial, con el cáncer de pulmón y el colorrectal liderando la mortalidad específica1. Históricamente, el tratamiento oncológico se ha sustentado en tres terapias fundamentales: la cirugía, la quimioterapia y la radioterapia. Estas dos últimas, desarrolladas entre finales del sigloxix y comienzos del sigloxx, marcaron un punto de inflexión al convertir el cáncer en una enfermedad potencialmente controlable. En el sigloxxi, la oncología alcanzó un hito clave con la aprobación de ipilimumab, el primer inmunoterápico que demostró aumentar la supervivencia en melanoma avanzado2. Desde entonces, la inmunoterapia ha revolucionado el tratamiento de tumores avanzados, con fármacos como inhibidores de puntos de control inmunológico (ICI), anticuerpos monoclonales y vacunas terapéuticas.
En 2017, otro avance significativo llegó con la aprobación de la inmunoterapia con células CAR-T (siglas del inglés chimeric antigen receptor T-cell), que modifica genéticamente los linfocitosT (LT) del propio paciente para atacar sus células tumorales. Inicialmente autorizada para la leucemia linfoblástica aguda (LLA) refractaria, esta terapia se ha expandido al manejo de otros tumores hematológicos como el linfoma no Hodgkin y el mieloma múltiple3,4.
Estos avances han mejorado la supervivencia de los pacientes oncológicos, lo que ha generado un incremento en la demanda de atención médica en urgencias y cuidados intensivos5. En Estados Unidos, de los 16 millones de pacientes con cáncer, se registran aproximadamente 4 millones de visitas anuales a los departamentos de emergencia6.
Clasificación de las urgencias oncológicasLa urgencia oncológica puede definirse como una situación oncológica aguda en un paciente con cáncer, ya sea como un efecto directo de la patología subyacente o secundario a los procedimientos diagnósticos o terapéuticos recibidos, que requiere una intervención rápida para evitar la muerte o la morbilidad grave. Según la causa, se plantea su clasificación en las siguientes categorías7:
- 1.
Debut oncológico en el servicio de urgencias: la enfermedad se diagnostica en este escenario.
- 2.
Urgencias relacionadas con el propio tumor: manifestaciones locales y sistémicas.
- 3.
Urgencias asociadas a procedimientos diagnósticos.
- 4.
Urgencias relacionadas con tratamientos convencionales: complicaciones derivadas de la cirugía, la quimioterapia o la radioterapia.
- 5.
Urgencias secundarias al trasplante de progenitores hematopoyéticos.
- 6.
Complicaciones derivadas de nuevas terapias oncológicas.
Este artículo ofrece una revisión ilustrativa de las principales urgencias relacionadas con el cáncer y sus tratamientos, adoptando un enfoque basado en la clasificación etiológica en lugar de la tradicional segmentación por órganos y sistemas.
Diagnóstico oncológico en el servicio de urgenciasLas urgencias oncológicas pueden representar la manifestación inicial en algunos pacientes aún no diagnosticados de cáncer. En estos casos, el debut clínico puede presentarse como una obstrucción intestinal, biliar o urinaria, o como una infección sobre un parénquima pulmonar atelectasiado8.
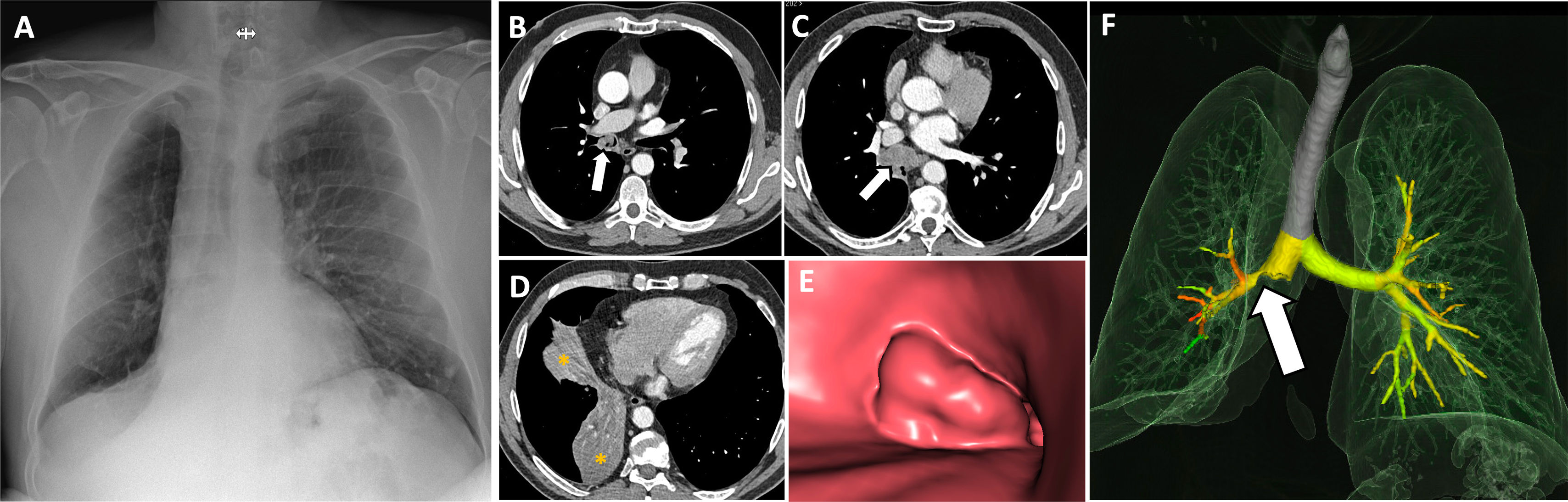
Neumonitis obstructivaEl cáncer de pulmón es el tumor más mortal en España y en el mundo1. Su alta mortalidad se debe al retraso en el diagnóstico, ya que entre el 50-70% de los casos se detectan en fases avanzadas debido a síntomas inespecíficos9. Puede comenzar con síntomas infecciosos o disnea causados por neumonitis obstructiva secundaria a obstrucción bronquial (fig. 1).
Varón de 64 años, exfumador, que acude a urgencias refiriendo tos con expectoración blanquecina desde hace un año, acentuada en los últimos dos días. Actualmente asocia disnea de esfuerzo. Se solicita una radiografía de tórax (A), que muestra hipovascularización y pérdida de volumen del pulmón derecho, hallazgo que sugiere atelectasia obstructiva. El radiólogo torácico recomienda completar con estudio de TC torácica tras la administración intravenosa de contraste. B-D)Las reconstrucciones axiales en ventana de mediastino muestran la presencia de una lesión tumoral endobronquial, desde el bronquio intermediario (flechas), que provoca atelectasia obstructiva total del LID y prácticamente completa del LM (asteriscos). E)La reconstrucción 3D endoluminal (modo «broncoscopia virtual») muestra la lesión tumoral en el bronquio intermediario. F)La reconstrucción 3D del árbol traqueobronquial muestra amputación de la vía aérea a nivel del bronquio intermediario (flecha).
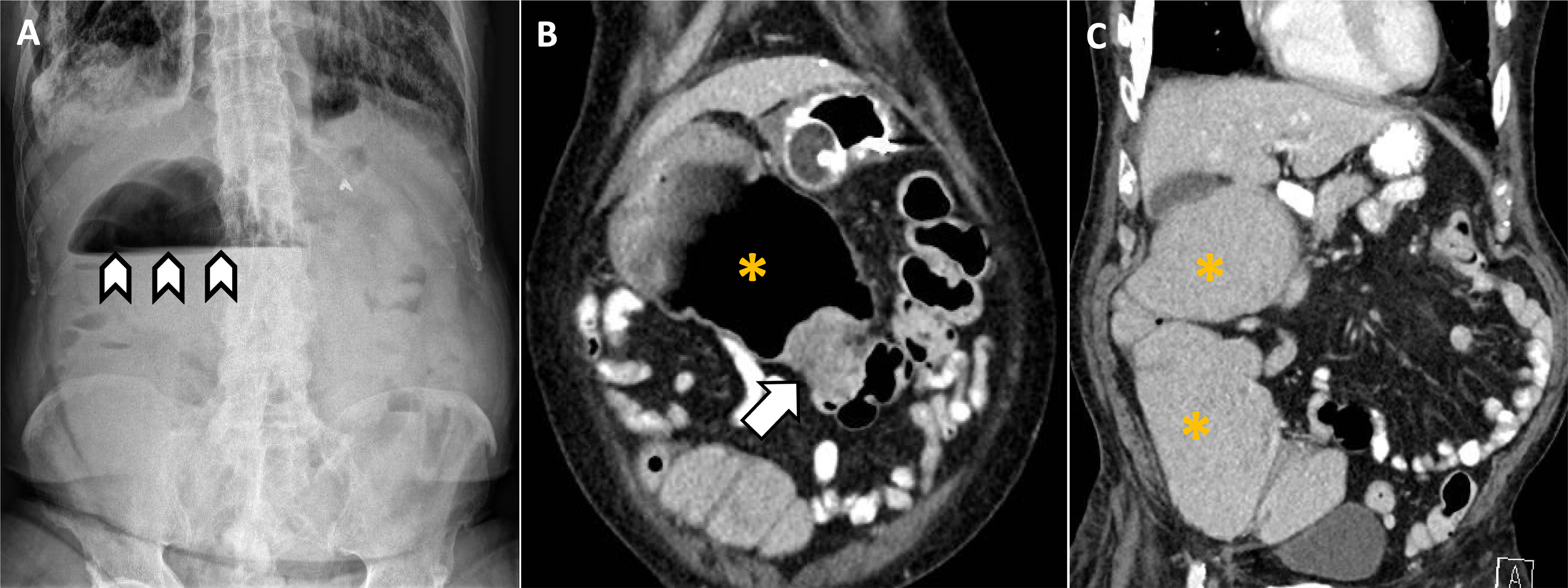
Aunque suele aparecer en estadios avanzados de neoplasias gastrointestinales y de ovario (10-30% y 20-50% de los casos, respectivamente), la obstrucción intestinal aguda puede ser la primera manifestación clínica de un cáncer de colon10 (fig. 2). En el debut de la enfermedad la obstrucción puede deberse al crecimiento endoluminal o mural del tumor, afectando en este último caso a la motilidad intestinal y causando linitis plástica. En fases avanzadas, la presencia de metástasis, especialmente implantes peritoneales, provoca una obstrucción extraluminal.
Varón de 77 años que acude al servicio de urgencias refiriendo estreñimiento y distensión abdominal de cuatro días de evolución. A)La radiografía de abdomen muestra escasa aireación intestinal, salvo un nivel hidroaéreo en vacío derecho (puntas de flecha) que parece corresponder el ángulo hepático del colon dilatado. No se objetiva distensión de asas de delgado ni neumoperitoneo. B-C)Para descartar causa obstructiva se recomienda completar con una TC abdominal que confirma la presencia de una zona de estenosis concéntrica en «corazón de manzana» en el colon transverso (flecha), sugestiva de neoformación primaria (probable adenocarcinoma) con dilatación retrógrada de ángulo hepático y colon ascendente (asteriscos). Se programa colostomía derivativa, que confirma el cuadro obstructivo secundario a neoplasia en colon transverso.
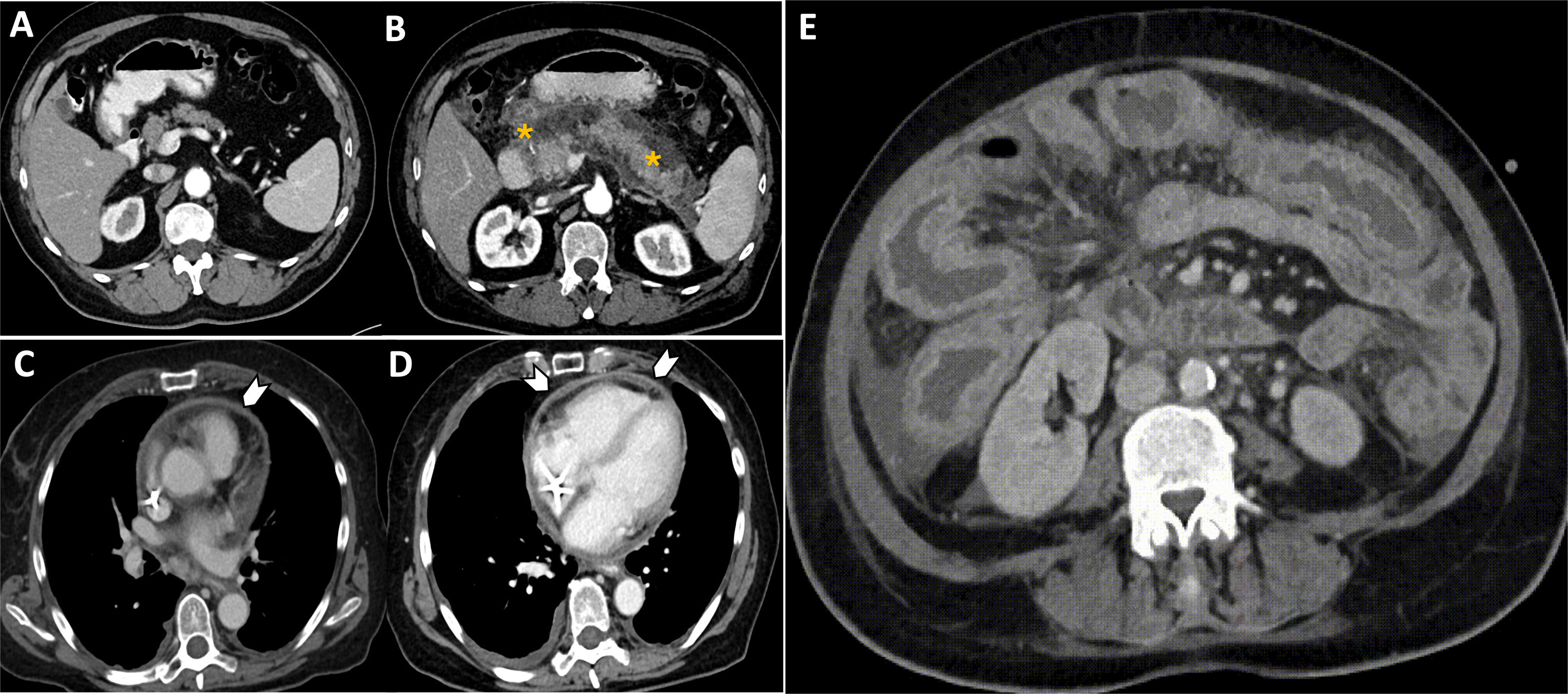
El síndrome de vena cava superior es el conjunto de síntomas derivados del descenso del retorno venoso a la aurícula derecha secundario a la obstrucción de la vena cava superior (VCS) por compresión extrínseca, invasión tumoral o trombosis. Se presenta con edema en esclavina, disnea, tos y cianosis. En casos graves puede causar edema cerebral y laríngeo, con confusión o estridor. El cáncer de pulmón, linfoma y las adenopatías son las causas más frecuentes11.
La radiografía de tórax no permite el diagnóstico directo, pudiendo orientar la causa del síndrome, al mostrar ensanchamiento mediastínico superior derecho o la presencia de una masa pulmonar. La tomografía computarizada (TC) torácica con contraste es el método de elección, permitiendo determinar la causa y evaluar la presencia de circulación colateral, especialmente a expensas de las venas ácigos, mamaria interna y cava inferior (fig. 3). Permite, además, detectar la presencia de trombosis y su naturaleza (hemática o tumoral), determinar el diámetro nativo, la extensión de la obstrucción y la afectación de otras estructuras venosas12. Cuando la obstrucción ocurre por encima del cayado de la vena ácigos, la circulación colateral es más eficiente. Si la obstrucción es a nivel del cayado o más abajo, el pronóstico es peor11,12.
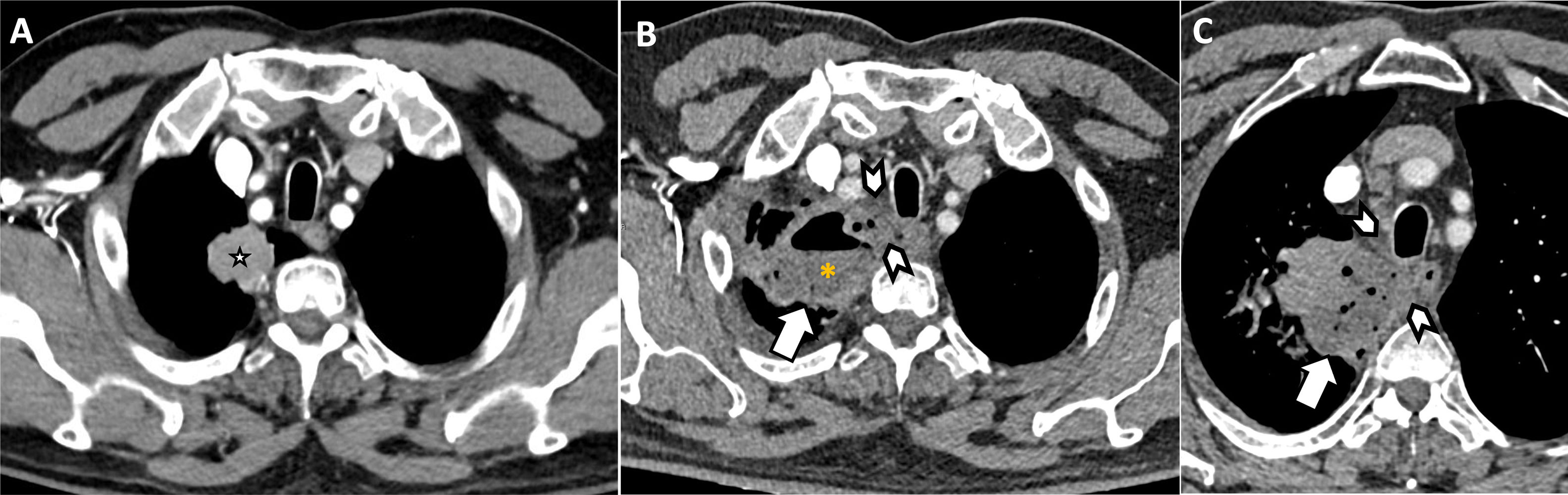
Mujer de 67 años con cáncer microcítico de tumor en tratamiento con quimioterapia clásica (cisplatino y etopósido). Acude a urgencias refiriendo tos seca persistente y edema cérvico-torácico. Ante la sospecha de un síndrome de vena cava superior se solicita una TC torácica con contraste (A), que muestra conglomerados adenopáticos mediastínicos (A, asteriscos) que provocan compresión de la vena cava superior, con marcada reducción de su calibre. Se observa también afilamiento del tronco innominado izquierdo (A, punta de flecha). La presencia de circulación colateral en mediastino anterior y pared torácica anterior (flechas blancas), con especial dilatación de las venas mamarias internas, confirma la repercusión hemodinámica de la obstrucción. B)Reconstrucción cinemática del tórax en coronal que resalta la circulación colateral prominente secundaria a síndrome de vena cava superior.
El papel del radiólogo es fundamental para confirmar el diagnóstico y planificar el tratamiento intravascular (selección del tamaño del stent, identificación de los puntos de anclaje para su colocación y necesidad de trombólisis)12.
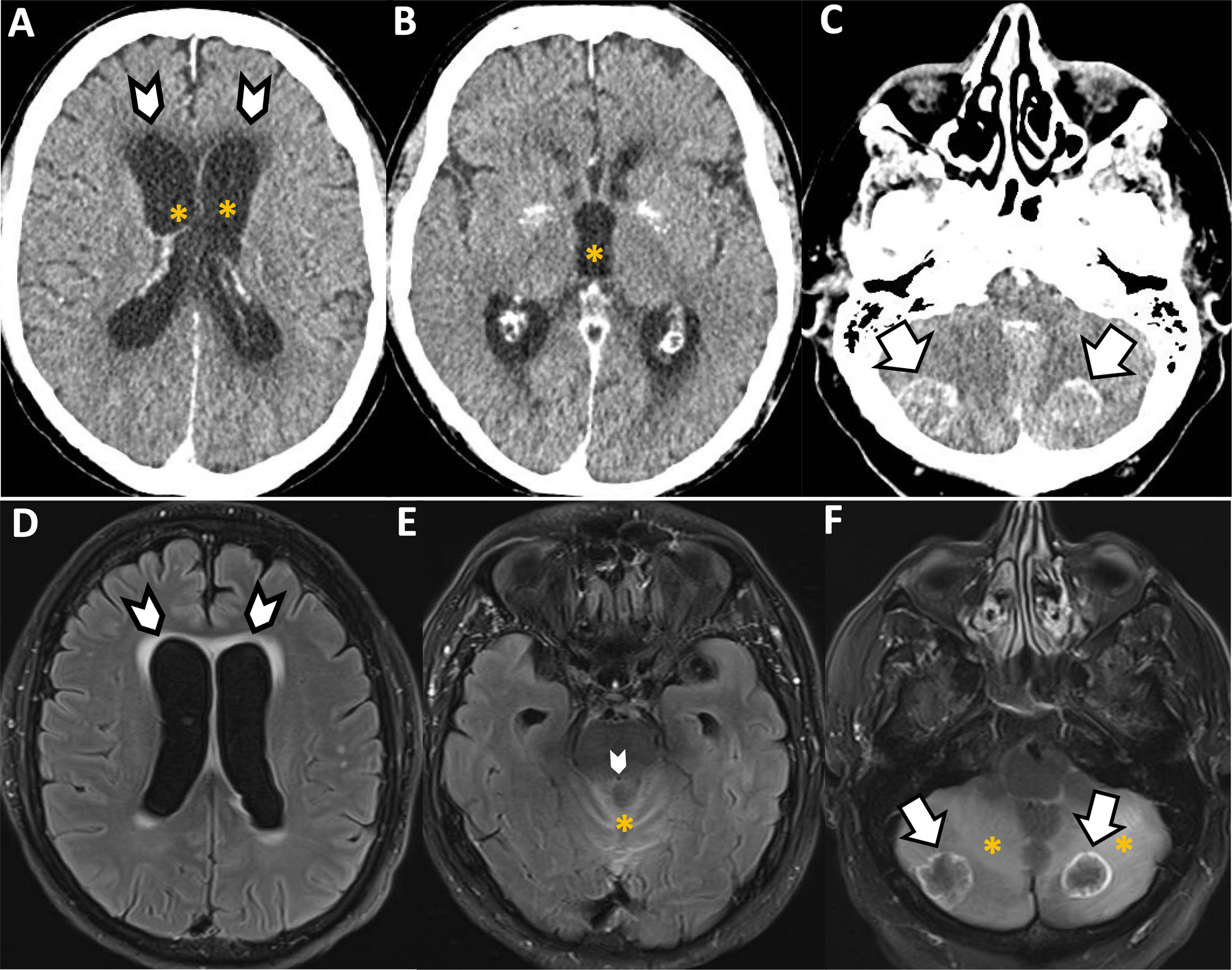
Hidrocefalia obstructiva y compresión medularDos tipos de urgencias oncológicas neurológicas relacionadas con la extensión o compresión (local) del tumor son la herniación cerebral, la hidrocefalia obstructiva y la compresión medular. Si bien la TC cerebral es la técnica de elección en la evaluación urgente de las dos primeras entidades (fig. 4), ante la sospecha de compresión medular la técnica de elección debe ser la RM de columna completa (fig. 5). Se deben realizar secuencias sagitales potenciadas en T1 y/o STIR; sagitales en T2 y axiales potenciadas en T2 con el fin de identificar la alteración de señal del cordón medular, con o sin persistencia de líquido cefalorraquídeo en torno al mismo13.
Varón de 68 años, cardiópata, con adenocarcinoma de sigma metastásico (hepático, peritoneal y pulmonar) en tratamiento con quimioterápicos clásicos y antiangiogénicos (bevacizumab). Desde hace unos meses se encuentra en fibrilación auricular paroxística con alteraciones asociadas de la repolarización. Acude a urgencias por primer episodio de cefalea de inicio súbito. Se solicita una TC cerebral para descartar afectación tumoral cerebral y/o sangrado. Reconstrucciones multiplanares axiales (A-C) realizadas tras la administración intravenosa de contraste muestran como nuevos hallazgos dos lesiones ocupantes de espacio en ambos lóbulos cerebelosos (flechas), con realce anular de contraste, que condicionan obliteración prácticamente completa del cuarto ventrículo con hidrocefalia supratentorial (asteriscos) y edema transependimario especialmente a nivel frontal (puntas de flecha). Se realiza, de manera programada, una RM cerebral (D-F, imágenes T2 FLAIR en plano axial), que confirma la presencia de edema transependimario periventricular (D, puntas de flecha), obstrucción del cuarto ventrículo (E, punta de flecha) y lesiones metastásicas con captación anular de contraste en ambos hemisferios cerebelosos (F, flechas). Se observa también extenso edema perilesional en vermis (E, asterisco) y hemisferios cerebelosos (F, asteriscos).
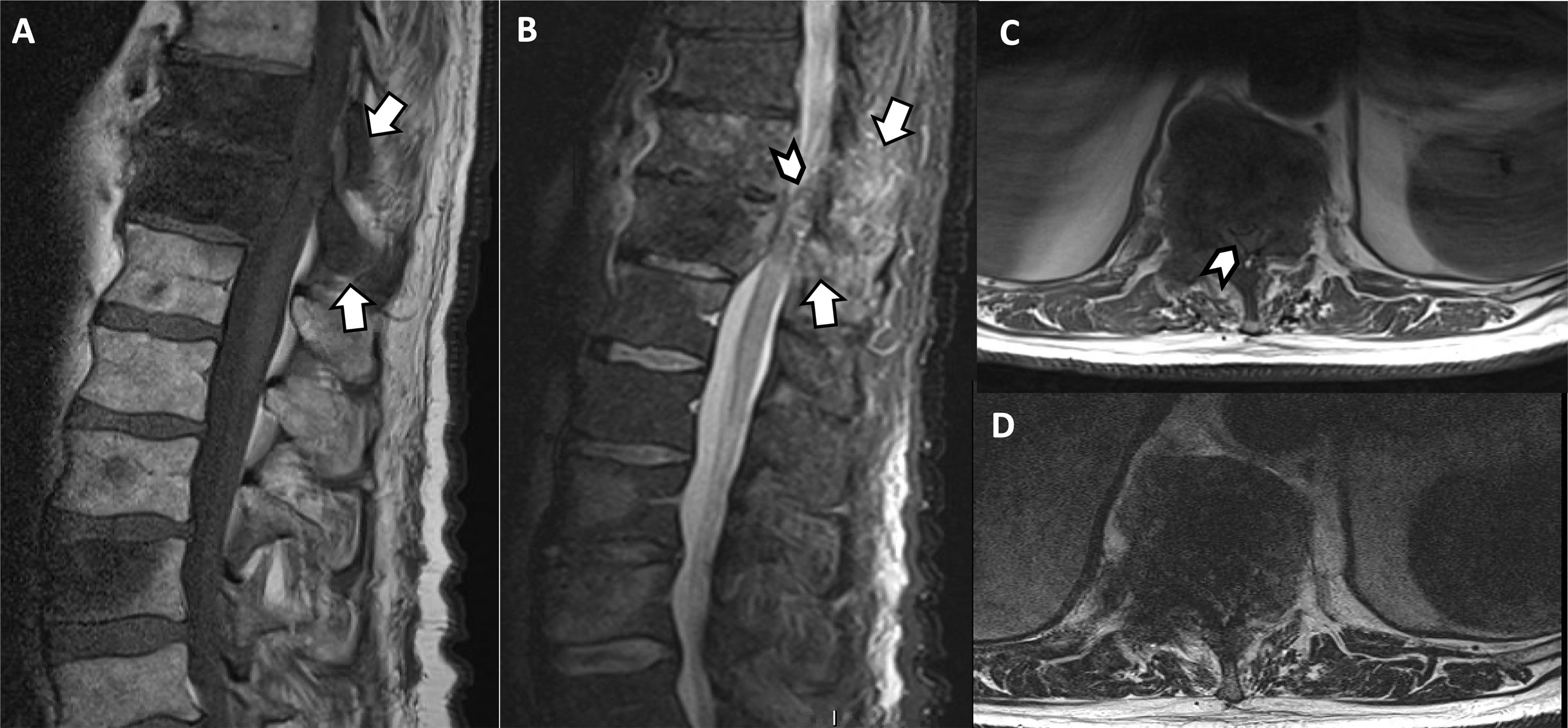
Paciente de 62 años con cáncer de próstata metastásico y debilidad en extremidades inferiores de nueva aparición. Se solicita una RM de columna urgente. (A,B)Las imágenes T1 y T2 STIR en sagital muestran afectación metastásica en T11 y T12, con rotura del muro posterior y afectación de elementos posteriores (flechas). Las imágenes T1 y T2 en axial (C-D) confirman la extensión de la enfermedad al espacio epidural anterior. En todas las imágenes se aprecia reducción significativa de la amplitud del canal vertebral y compresión en dicho nivel del cordón medular (puntas de flecha).
Los pacientes oncológicos pueden presentar complicaciones hemorrágicas debido a diversas causas, como trombocitopenia, invasión tumoral con formación de fístulas, roturas tumorales o procesos secundarios a necrosis, inflamación y daño vascular inducido por los tratamientos (fig. 6)11. Entre estas complicaciones, la hemoptisis masiva es un evento crítico con una tasa de mortalidad de hasta el 60% (fig. 6C). En pacientes mayores de 40años la causa más frecuente es el carcinoma broncogénico. Sin embargo, también puede deberse a metástasis endobronquiales de melanomas, sarcomas, cáncer de mama, tumores carcinoides o cáncer renal. En este contexto, la radiología intervencionista juega un papel crucial en la embolización de arterias bronquiales para controlar la hemorragia y mejorar la supervivencia14.
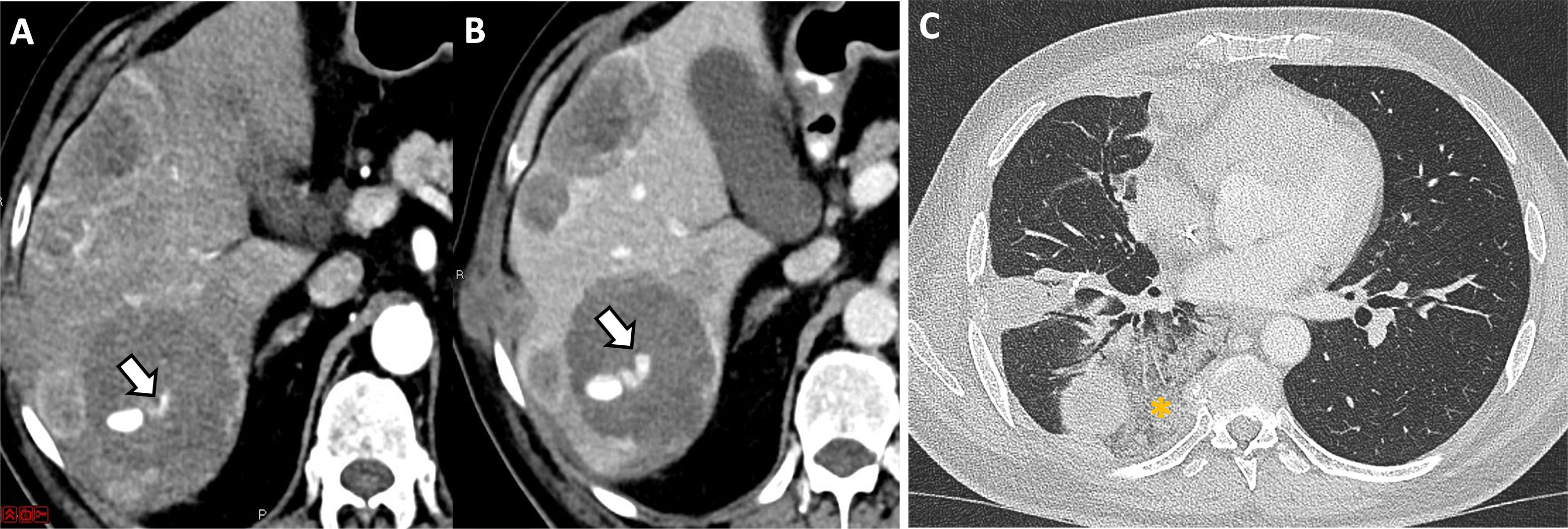
(A,B) Paciente con melanoma metastásico que acude a urgencias refiriendo dolor abdominal agudo en el hipocondrio derecho. Se realiza una TC abdominal, donde se observa sangrado activo (flechas) de una metástasis hepática en la fase arterial (A), que aumenta confirmado en la fase portal (B). C)Varón de 42años con sarcoma metastásico que acude a urgencias por varios episodios de hemoptisis desde hace 12horas. Se realiza una TC de tórax, que revela opacidades en vidrio deslustrado (asterisco) alrededor de las metástasis pulmonares, sugestivas de corresponder con focos de hemorragia alveolar.
El cáncer se asocia a un estado protrombótico. No es de extrañar, por tanto, que la presencia de una neoplasia oculta sea descubierta a raíz de un evento tromboembólico, como un tromboembolismo pulmonar. Del mismo modo, algunos tumores, como el cáncer de páncreas, de pulmón o el glioblastoma, muestran una incidencia especialmente alta de enfermedad tromboembólica venosa.
Los síndromes paraneoplásicos son causados por la producción de sustancias con actividad biológica por parte del tumor, como hormonas, citoquinas o factores de crecimiento, generando síntomas a distancia. Una manifestación paraneoplásica es el síndrome carcinoide. Incluye síntomas como diarrea, flushing, broncoespasmo o insuficiencia tricúspidea/fallo derecho derivados de una producción excesiva de hormonas (serotonina la más frecuente) por las metástasis hepáticas15. La diarrea, síntoma más frecuente y temprano, suele ser motivo de consulta de urgencia. La TC suele revelar signos sugestivos de síndrome carcinoide con dilatación de cavidades cardíacas derechas (a veces con derrame pleural derecho), metástasis hepáticas y tumoración primaria gastrointestinal.
La encefalitis paraneoplásica es uno de los síndromes más graves y de rápida progresión. De origen autoinmune, suele afectar a los lóbulos temporales mediales y los sistemas límbicos, manifestándose típicamente por un engrosamiento cortical y un aumento de la intensidad de la señal en T2-FLAIR en estas regiones16.
Urgencias asociadas a procedimientos diagnósticosLos procedimientos diagnósticos (biopsias percutáneas, ecoendoscopia con punción), aunque muchos de ellos mínimamente invasivos y seguros, pueden asociar complicaciones (hemorragias, infecciones, pseudoaneurismas…). La punción-aspiración transbronquial guiada por ecografía endobronquial (EBUS-TBNA) presenta una tasa de complicaciones inferior al 1,5%, siendo el sangrado una de las más comunes17,18. Entre las complicaciones graves, aunque raras, destacan la mediastinitis/absceso mediastínico, la formación de fístulas o de pseudoaneurismas bronquiales o pulmonares. La TC torácica permite detectar alteración de la atenuación grasa mediastínica post-punción, que, junto a otros hallazgos, puede sugerir la presencia de mediastinitis (fig. 7). Por su parte, la angio-TC permite el diagnóstico de los pseudoaneurismas que típicamente presentan la misma densidad que el vaso del que dependen en todas las fases del estudio19. Debido a su elevado riesgo de rotura, su tratamiento, generalmente intravascular mediante coils o plugs, está indicado independientemente de su tamaño o localización (fig. 8).
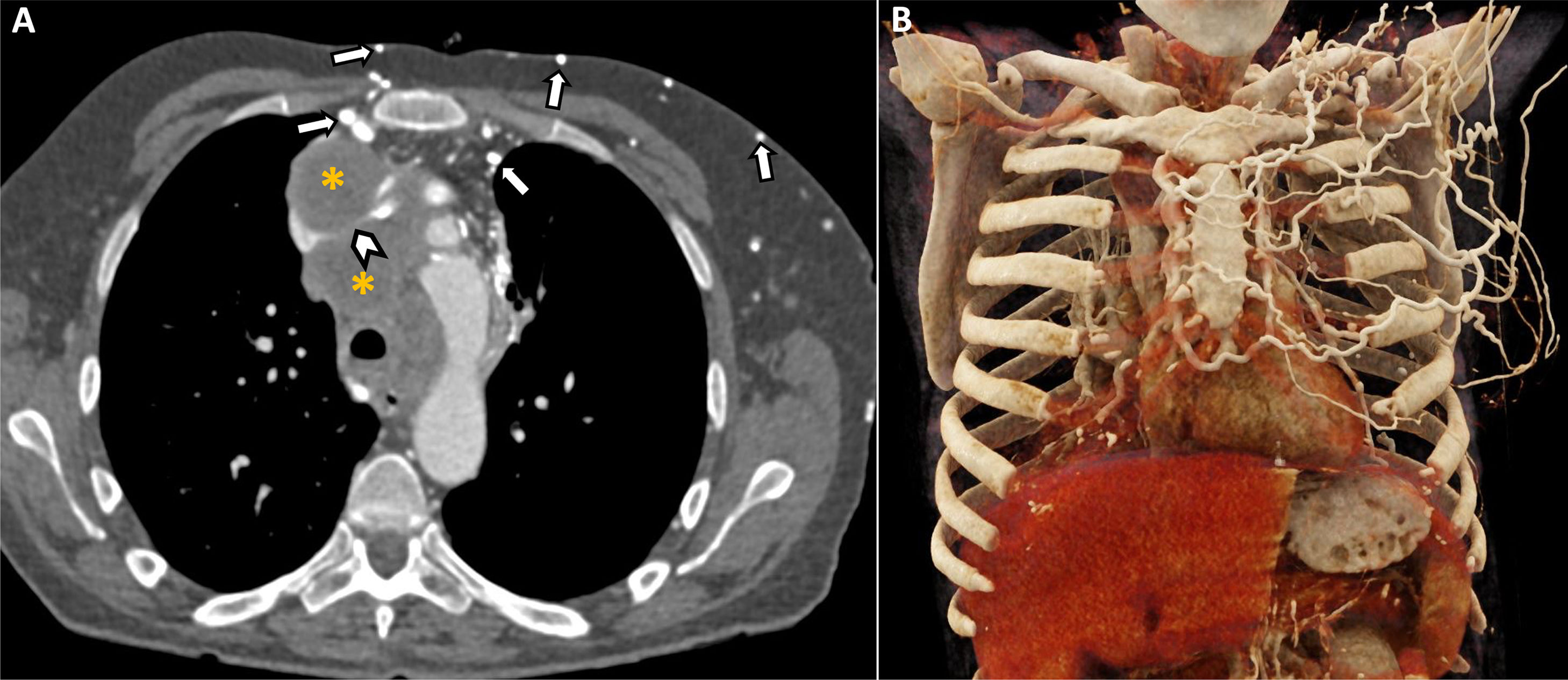
Varón de 62 años en estudio por sospecha de neoformación broncopulmonar primara en lóbulo superior derecho (A, estrella). Acude a urgencias cinco días tras la realización de biopsia de la lesión mediante ecoendoscopia alta, refiriendo fiebre termometrada de 38°C, tos y dolor torácico leve. B,C)Se solicita una TC torácica, que muestra incremento de la extensión de la lesión localizada en ápice pulmonar derecho (flechas), que presenta burbujas de gas en su interior y un nivel hidroaéreo (asterisco). Los hallazgos son compatibles con sobreinfección (abscesificación) de la lesión pulmonar localizada en ápice derecho. Se observa, además, aumento de la atenuación de la grasa en mediastino, especialmente en la región paraesofágica derecha (puntas de flecha), que sugiere inflamación regional (mediastinitis).
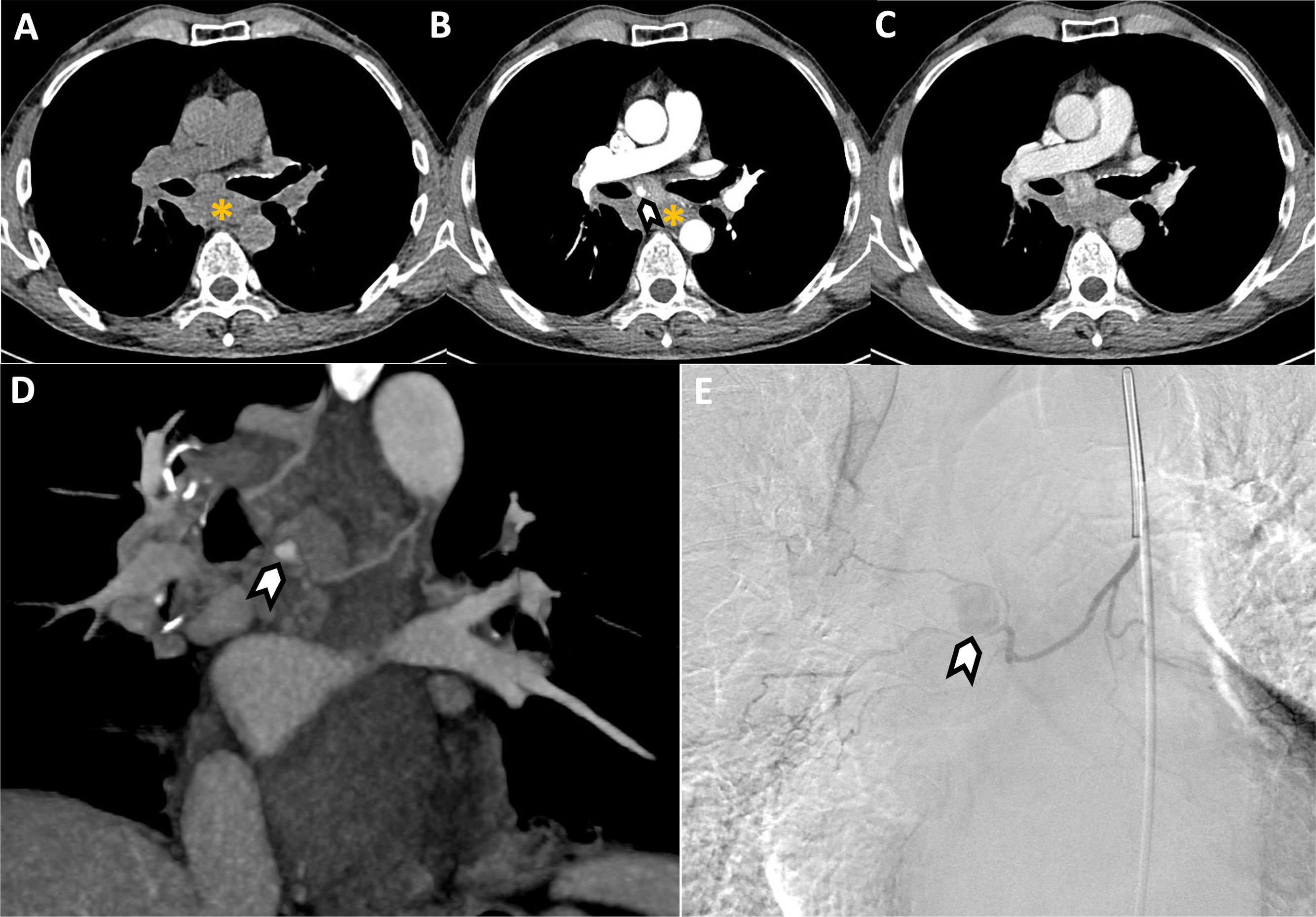
Varón de 59 años que acude a urgencias por dolor torácico centrotorácico punzante. Se sometió a una biopsia de una adenopatía subcarinal hace 7días para valorar posible afectación metastásica. Angio-TC torácica sin (A) y tras la administración intravenosa de contraste (B-C) que muestra un hematoma mediastínico (asterisco) cuyos valores de atenuación no se modifican en las distintas fases del estudio. En la fase arterial (B) se identifica una pequeña imagen pseudonodular (punta de flecha) dependiente de la arteria bronquial derecha, localizada en la región subcarinal adyacente a la adenopatía puncionada. La formación vascular no se logra identificar en la fase venosa (C), descartando que corresponda con un punto de sangrado activo. D)Reconstrucción de máxima intensidad (MIP) en plano coronal modificado que confirma la presencia de un pseudoaneurisma dependiente de la arteria bronquial (punta de flecha). E)Arteriografía supraselectiva de la arteria bronquial derecha que confirma la presencia de un pseudoaneurisma (punta de flecha), con morfología esférica y un diámetro aproximado de 10mm, situado en una bifurcación de la arteria bronquial inferior derecha.
Las dehiscencias de sutura «precoces» ocurren dentro del primer mes tras la cirugía y pueden ser completas o contenidas (con formación de absceso). Los pacientes acuden a urgencias con síntomas de abdomen agudo (dolor, fiebre, leucocitosis…). En la TC, los hallazgos característicos son neumoperitoneo o retroneumoperitoneo y la presencia de burbujas de aire y líquido perianastomóticos. La extravasación de contraste oral confirma el diagnóstico20.
Tratamiento con quimioterápicos convencionales y radioterapiaDehiscencia de sutura «tardías»Bevacizumab, fármaco antiangiogénico, se ha asociado con fugas anastomóticas tardías (más de un año después de una resección de colon). Factores predisponentes incluyen la radioterapia preoperatoria, antecedentes de fuga postoperatoria y la resección anterior baja por cáncer rectal20.
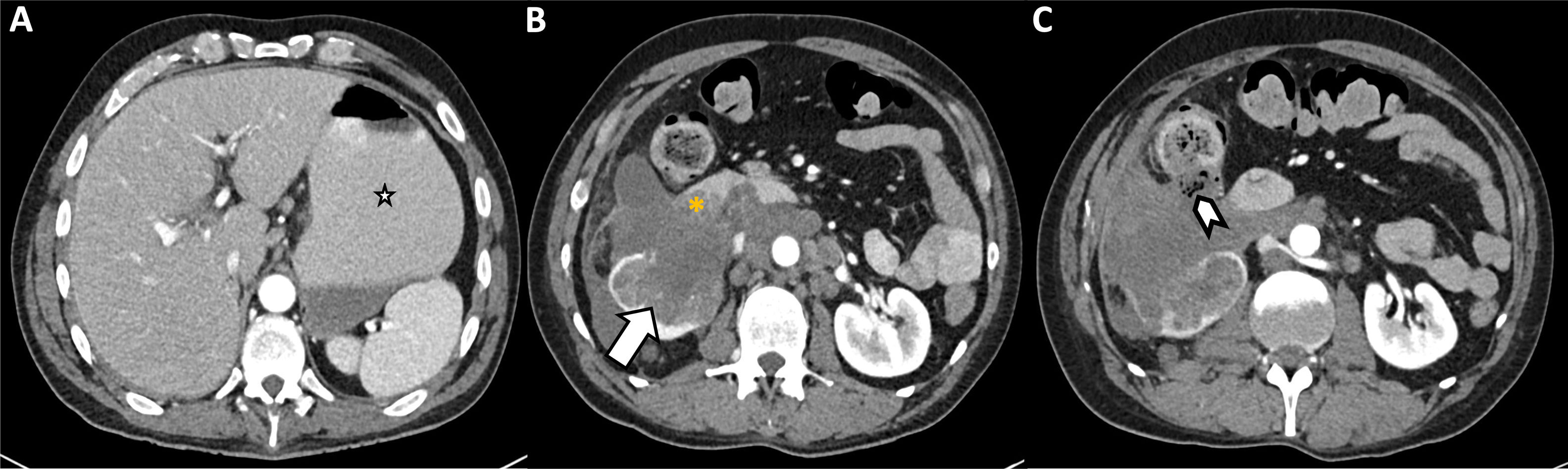
Fístulas tumor-estructuras adyacentesLas fístulas tumor-intestino son una complicación de las neoplasias abdominopélvicas y se encuentran favorecidas por la quimioterapia y la radioterapia. Terapias dirigidas moleculares, especialmente el bevacizumab, pueden inducir fístulas tumorales por sus propiedades antiangiogénicas que debilitan la mucosa intestinal (fig. 9)21.
Varón de 48 años con cáncer renal metastásico que acude a urgencias por dolor intenso (VAS 9/10) en flanco derecho. La TC abdominopélvica realizada tras la administración intravenosa de contraste muestra distensión de la cámara gástrica (A, estrella) secundaria a estenosis de la segunda porción duodenal por infiltración tumoral (B, asterisco). Además de la obstrucción mecánica se observa fistulización de la masa renal con el colon ascendente (C, punta de flecha).
Las fístulas esófago-respiratorias adquiridas son una urgencia oncológica que resulta de una complicación potencialmente mortal de los tumores pulmonares, esofágicos y mediastínicos o de tratamientos recibidos, sobre todo radioterápico22. Puede sospecharse en casos de infecciones respiratorias recidivantes en pacientes con neoplasias torácicas avanzadas. El diagnóstico se basa en la TC y el esofagograma. La colocación de prótesis esofágicas es esencial para prevenir complicaciones23,24.
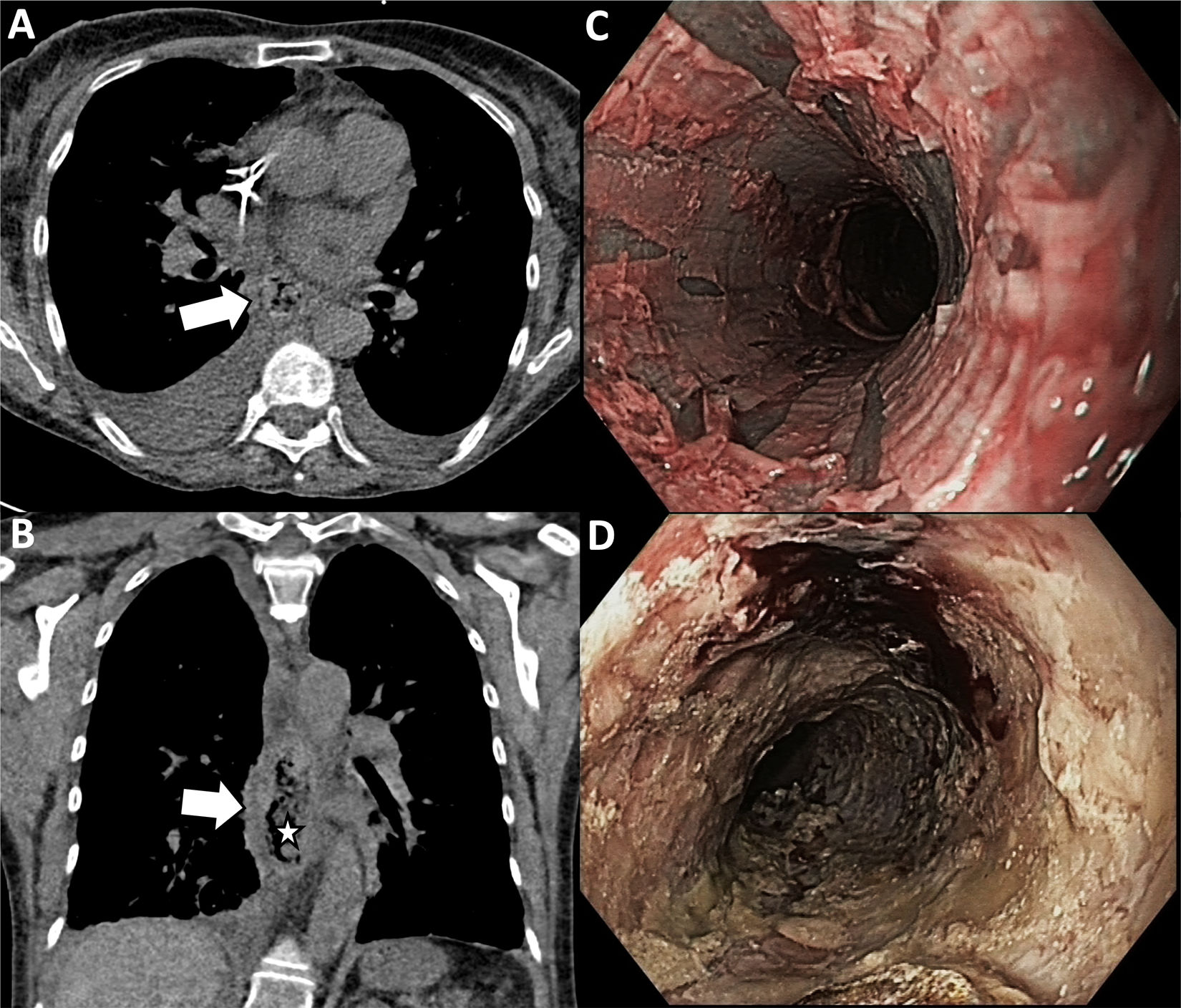
Esofagitis y necrosis esofágica agudaLa inflamación de la mucosa esofágica es una complicación frecuente en pacientes en quimio-radioterapia, pudiendo causar dolor torácico25. Debe ser identificada e informada por los radiólogos. En casos extremos, puede evolucionar a necrosis esofágica aguda (NEA) o «esófago negro» (fig. 10), entidad rara caracterizada endoscópicamente por una mucosa necrótica negra y circunferencial en el tercio distal del esófago respetando típicamente la unión esofagogástrica26. Los pacientes con NEA suelen presentar hematemesis. Es frecuente que coexista con infecciones esofágicas oportunistas (Candida, virus herpes simple…), especialmente si están inmunodeprimidos. El diagnóstico por TC debe sospecharse ante engrosamiento de la pared, dilatación luminal y burbujas de aire en la luz y pared del esófago. Las principales complicaciones incluyen la perforación esofágica, abscesos y mediastinitis.
Mujer de 60 años con antecedentes de linfoma no Hodgkin y síndrome mielodisplásico secundario a leucemia mieloide aguda, refiere, en el día +15 tras TPH alogénico, dolor epigástrico y disfagia en el contexto de neutropenia febril. A-B)Se realiza una TC torácica sin contraste intravenoso que muestra engrosamiento y dilatación del esófago distal (flechas) con burbujas de aire en su pared y en la luz (estrella). La presencia de estas burbujas de aire le confieren el aspecto de «esófago negro apolillado», descrito en la necrosis esofágica aguda. C-D)La gastroscopia posterior confirma la presencia de una mucosa negra friable circunferencial y múltiples desgarros lineales.
Muchos pacientes en tratamiento con quimioterapia están inmunosuprimidos y reciben antibióticos de amplio espectro para tratar infecciones, lo que les predispone a desarrollar colitis por Clostridium difficile. Suele comenzar una semana después del inicio del tratamiento antibiótico. Clínicamente, se manifiesta con dolor abdominal, náuseas y vómitos. En la TC, los hallazgos principales incluyen engrosamiento difuso de la pared del colon («signo del acordeón»), estriación de la grasa pericólica y leve ascitis27.
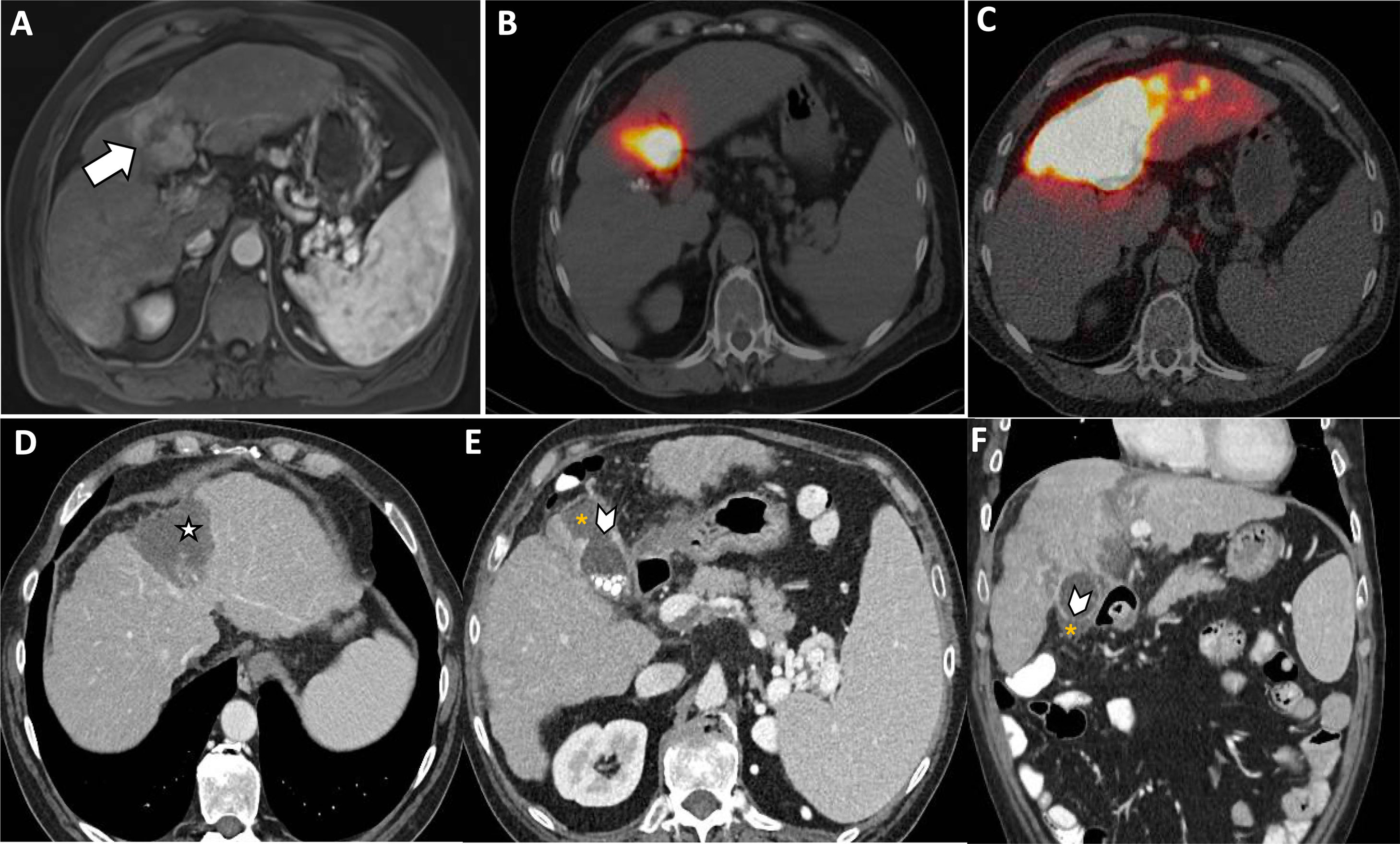
Colecistitis post-radioembolizaciónLa radioembolización transarterial (TARE, por sus siglas en inglés) con microesferas de ytrio-90 (Y-90) es reconocida como opción de tratamiento mínimamente invasivo para tumores hepáticos, como el carcinoma hepatocelular, y para las metástasis hepáticas28. La colecistitis inducida por radiación es una complicación conocida pero rara de la TARE. Se produce por embolización inadvertida de microesferas a arterias y capilares que irrigan la vesícula (fig. 11).
Paciente con recidiva de hepatocarcinoma en el segmento IV (A, flecha) candidato al tratamiento con radioembolización mediante esferas de ytrio-90 (Y90-RE). El SPECT con macroagregrados de albúmina muestra el correcto depósito de los mismos (B) y la PET/TC tras la administración de las microesferas, el área radiada (C). El paciente acude refiriendo dolor en hipocondrio derecho cinco días tras el procedimiento. D-F)Se realiza una TC de abdomen con contraste intravenoso, objetivándose cambios secundarios a tratamiento (D, estrella), rotura de la pared vesicular (E-F, puntas de flecha) y una pequeña colección adyacente al fundus (E-F, asteriscos). Los hallazgos son compatibles con colecistitis por irradiación y rotura por necrosis del fundus vesicular, secundarias a administración de tratamiento a través de la arteria cística.
Los agentes quimioterapéuticos responsables del PRES incluyen taxanos, platinos, alcaloides de la vinca, antraciclinas, inhibidores angiogénicos y antagonistas del folato. Este trastorno clínico-radiológico, con síntomas reversibles, se caracteriza por edema vasogénico subcortical y lesiones predominantes en la sustancia blanca, afectando especialmente a las regiones parieto-occipitales29. Esta entidad también se ha descrito con ICI.
Urgencias relacionadas con trasplante de progenitores hematopoyéticosNeumoníasLas infecciones pulmonares son las complicaciones más frecuentes en pacientes inmunocomprometidos tras un trasplante de progenitores hematopoyéticos (TPH), con alta morbimortalidad, por lo que su diagnóstico precoz es crucial. La radiografía de tórax es una técnica limitada para la aproximación etiológica.
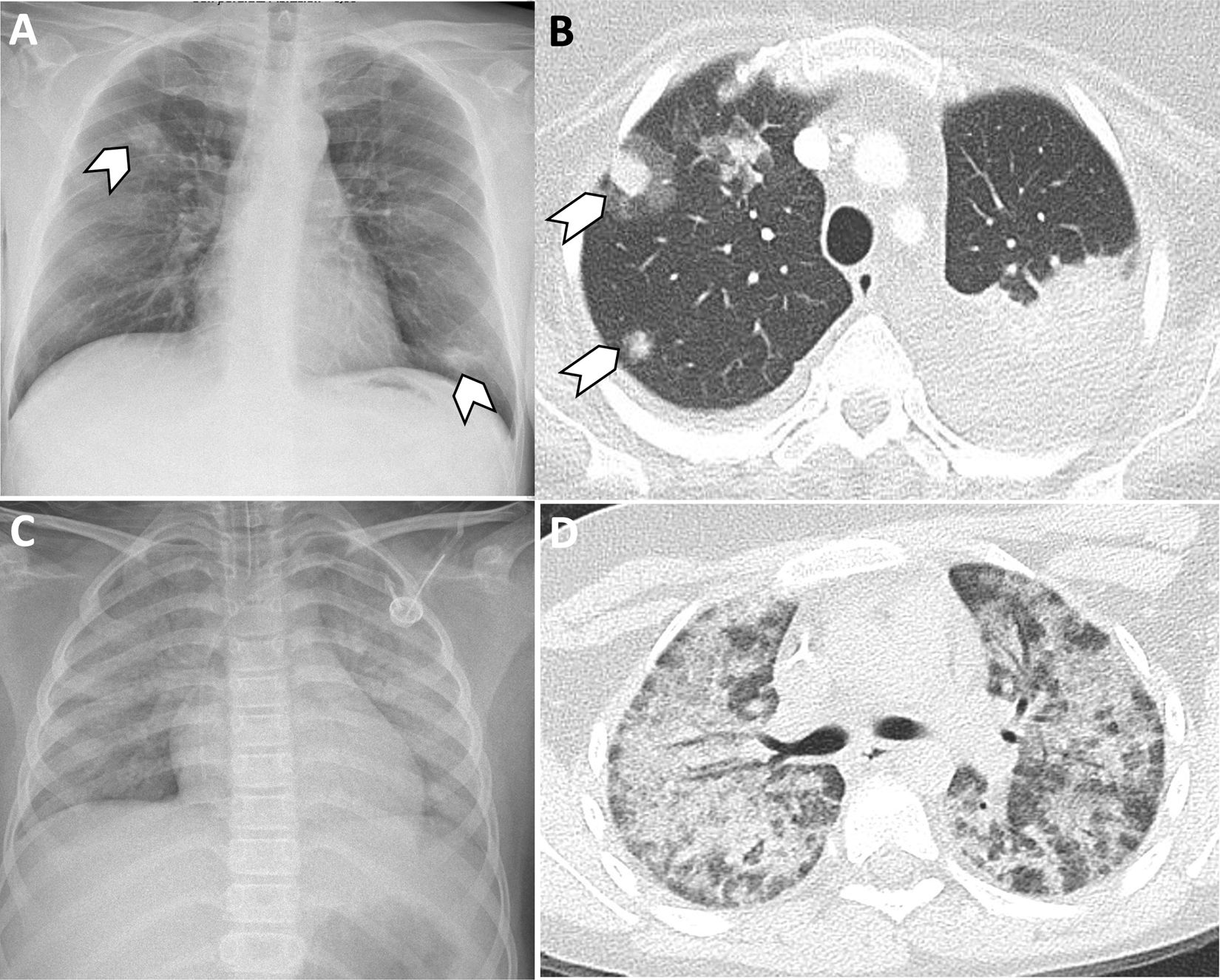
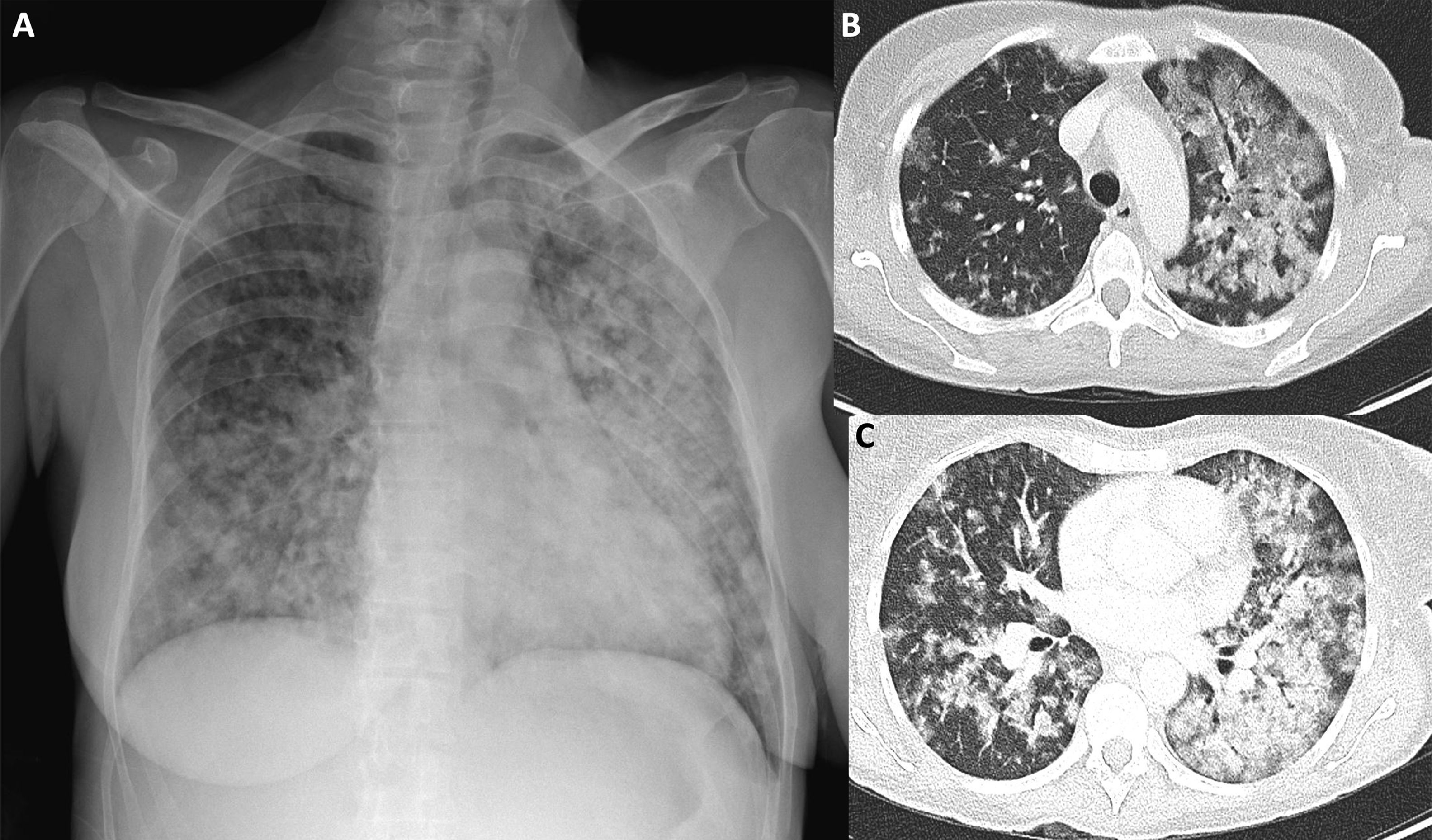
En el primer mes post-TPH, entre el 25 y el 50% de las infecciones son fúngicas. Radiológicamente, se caracterizan por la presencia de consolidaciones pseudonodulares y halo perilesional en vidrio deslustrado. En el post-TPH precoz (30-100días post-TPH) es importante considerar la reactivación del citomegalovirus, especialmente en trasplantes alogénicos. La profilaxis frente Pneumocystis jirovecii ha reducido su incidencia (fig. 12)30. En fases más tardías (>100días), las neumonías suelen deberse a bacterias y virus respiratorios comunes (adenovirus, rinovirus, parainfluenza). Para el diagnóstico etiológico, biomarcadores como galactomanano y (1-3)β-D-glucano pueden ser útiles, pero el lavado broncoalveolar sigue siendo el método de elección31.
A)Varón de 52 años en el post-TPH precoz con neutropenia febril. La radiografía de tórax muestra consolidaciones pseudonodulares (punta de flecha), que sugieren infección fúngica. B)TC de tórax realizada a una paciente de 36años en el día +28 post-TPH por LLA en recaída. Se observan consolidaciones pseudonodulares con halo perilesional en vidrio deslustrado (puntas de flecha), compatibles con aspergilosis angioinvasiva. C-D)Paciente varón con neutropenia febril en el día +188 post-TPH. La radiografía de tórax (C) muestra un aumento difuso de la atenuación de ambos pulmones, algo más marcada en lóbulos superiores. La TC de tórax (D) confirma la afectación pulmonar bilateral en forma de vidrio deslustrado y consolidaciones confluentes, de predominio en lóbulos superiores. Los hallazgos radiológicos fueron sugestivos de neumonía por Pneumocystis jirovecii, confirmada en el lavado broncoalveolar posterior.
La colitis neutropénica o tiflitis es una urgencia oncológica caracterizada por inflamación transmural del ciego, que puede extenderse al colon ascendente e íleon32,33. Ocurre especialmente tras tratamiento para leucemia mieloide aguda o TPH10. El daño mucoso cecal favorece la translocación bacteriana e infección de esa porción intestinal, con riesgo de necrosis intestinal. Dada su alta morbimortalidad, su diagnóstico precoz es crucial.
Urgencias derivadas de nuevas terapias oncológicasEfectos adversos inmunomediadosLos ICI pueden causar eventos adversos inmunomediados (EAI), que incluyen enfermedades autoinmunes («itis») y síndrome de liberación de citoquinas (citokine release síndrome [CRS]). Muchos de ellos pueden ocasionar sintomatología relevante y ser motivo de visitas a los servicios de urgencias34. La terapia con células CAR-T ha evidenciado dos síndromes clínicos asociados: el CRS y el síndrome de neurotoxicidad inmunomediado (ICANS).
Enfermedades autoinmunesLas enfermedades autoinmunes pueden afectar múltiples órganos, con manifestaciones como enterocolitis, hepatitis, pancreatitis, hipofisitis y neumonitis33,34. Síntomas respiratorios y digestivos pueden requerir atención urgente, siendo el diagnóstico temprano esencial. La colitis es la complicación digestiva más frecuente, mientras que la pancreatitis inmunomediada, aunque rara, es más grave. También se ha descrito con inhibidores de tirosina-kinasa (TKI) y gemcitabina. La neumonitis puede imitar diversos patrones pulmonares (opacidades en vidrio deslustrado, neumonía organizada y un patrón de neumonía intersticial), y en casos severos, presentarse como neumopatía intersticial aguda34. Las complicaciones cardíacas, como miocarditis y pericarditis, son infrecuentes (fig. 13).
Imágenes de TC de tres pacientes con enfermedades autoinmunes secundarias a tratamiento con inmunoterapia. A-B)Pancreatitis inducida por durvalumab en un paciente con carcinoma pulmonar de células escamosas. La glándula pancreática presenta un aspecto conservado en la TC basal (A). Semanas tras el inicio del tratamiento, el paciente refiere dolor epigástrico. Se realiza una TC de abdomen, donde se observa edematización de la glándula y grasa peripancreática (B, asteriscos). C,D)Paciente con adenocarcinoma de pulmón en tratamiento con durvalumab que acudió al servicio de urgencias por dolor torácico agudo y disnea. En la TC de tórax con contraste se observa engrosamiento y realce de las hojas pericárdicas (puntas de flecha), sugestivo de pericarditis. E)Engrosamiento difuso de la pared del intestino delgado y grueso, con hiperemia mucosa y edema submucoso, en un paciente con cáncer de pulmón no microcítico en tratamiento con atezolizumab (enterocolitis inmunomediada).
El CRS, asociado tanto a ICI como a células CAR-T, se produce por una respuesta inmunitaria descontrolada con liberación masiva de citoquinas proinflamatorias (tormenta de citoquinas), generalmente entre 3días-2semanas tras el inicio de la terapia35. Sus manifestaciones van desde síntomas pseudogripales hasta fallo multiorgánico (renal agudo, cardíaco) o síndrome de fuga capilar (SFC, capillary leak syndrome). También puede generar complicaciones neurológicas como infarto agudo y leucoencefalopatía.
El SFC es un conjunto de manifestaciones clínicas del CRS caracterizadas por un aumento de la permeabilidad capilar a las proteínas (edema no cardiogénico). Estos pacientes presentan simultáneamente un edema generalizado severo junto con un volumen sanguíneo circulante efectivo insuficiente36. Pueden presentar hipotensión, shock e insuficiencia renal aguda y, al mismo tiempo, derrames y ascitis. En el parénquima pulmonar se presenta como un edema pulmonar no cardiogénico (fig. 14).
Mujer de 36 años con LLA-B refractaria. Refiere disnea e hipoxia 3días tras el inicio de la terapia con CAR-T. A)Se solicita una radiografía de tórax urgente (anteroposterior), que muestra infiltrados alveolares asimétricos, confluentes, de predominio izquierdo. B,C)Imágenes axiales en ventana de parénquima pulmonar de la TC torácica realizada ese mismo día que confirma la presencia de infiltrados confluentes en lóbulos superiores, con áreas de mayor consolidación en lóbulos inferiores. La afectación, bilateral, predomina en el pulmón izquierdo. Los hallazgos sugieren edema pulmonar no cardiogénico, en el contexto de un síndrome de liberación de citoquinas (CRS).
La Asociación Americana de Trasplante y Terapia Celular (ASTCT) ha propuesto una clasificación de CRS e ICANS, aunque la correlación entre los hallazgos radiológicos y el grado de toxicidad aún no está clara (tablas 1 y 2)35.
Clasificación del CRS en grados del 1 al 4 según fiebre, hipotensión, hipoxemia y daño orgánico
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| Fiebre | Temperatura ≥ 38 °C | |||
| con | ||||
| Hipotensión | Ninguno | No requiere vasopresores | Requerir un vasopresor con o sin vasopresina | Requerir múltiples vasopresores (excluyendo la vasopresina) |
| y/o | ||||
| Hipoxia | Ninguno | Cánula nasal de bajo flujo | Cánula nasal de alto flujo, mascarilla, mascarilla sin rebreather o mascarilla Venturi | Presión positiva (CPAP, BiPAP, intubación, ventilación mecánica) |
Clasificación del ICANS en grados del 1 al 4
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| ICE | 9-7 | 6-3 | 2-0 | 0 |
| Consciencia | Despierto | Responde a la voz | Responde al estímulo táctil | Inconsciente o requiere de estímulo vigoroso. Estupor |
| Convulsiones | No | No | Cualquier tipo de convulsión o crisis no convulsiva (EEG) que se resuelve rápidamente, sin intervención | Estatus convulsivo o no convulsivo sin recuperación de la consciencia |
| Déficit motor | No | No | No | Debilidad focal motora |
| Elevación PIC/edema cerebral | No | No | Edema focal detectado por TC o RM | Edema cerebral difuso detectado por TC o RM/decorticación o descerebración/triada de Cushing |
ICE (immune effector cell-associated encephalopathy): herramienta de evaluación de la encefalopatía asociada a células inmunoefectoras. Se trata de una escala del 0 al 10, donde 10 es la ausencia de alteración. Una puntuación de 0 supone una disminución severa del nivel de consciencia.
PIC: presión intracraneal.
El ICANS afecta al 40-65% de los pacientes y suele aparecer 4-5días después de la infusión. Sus síntomas incluyen cefalea, confusión, fiebre, apraxia, afasia, disgrafia y letargo, pudiendo evolucionar a coma.
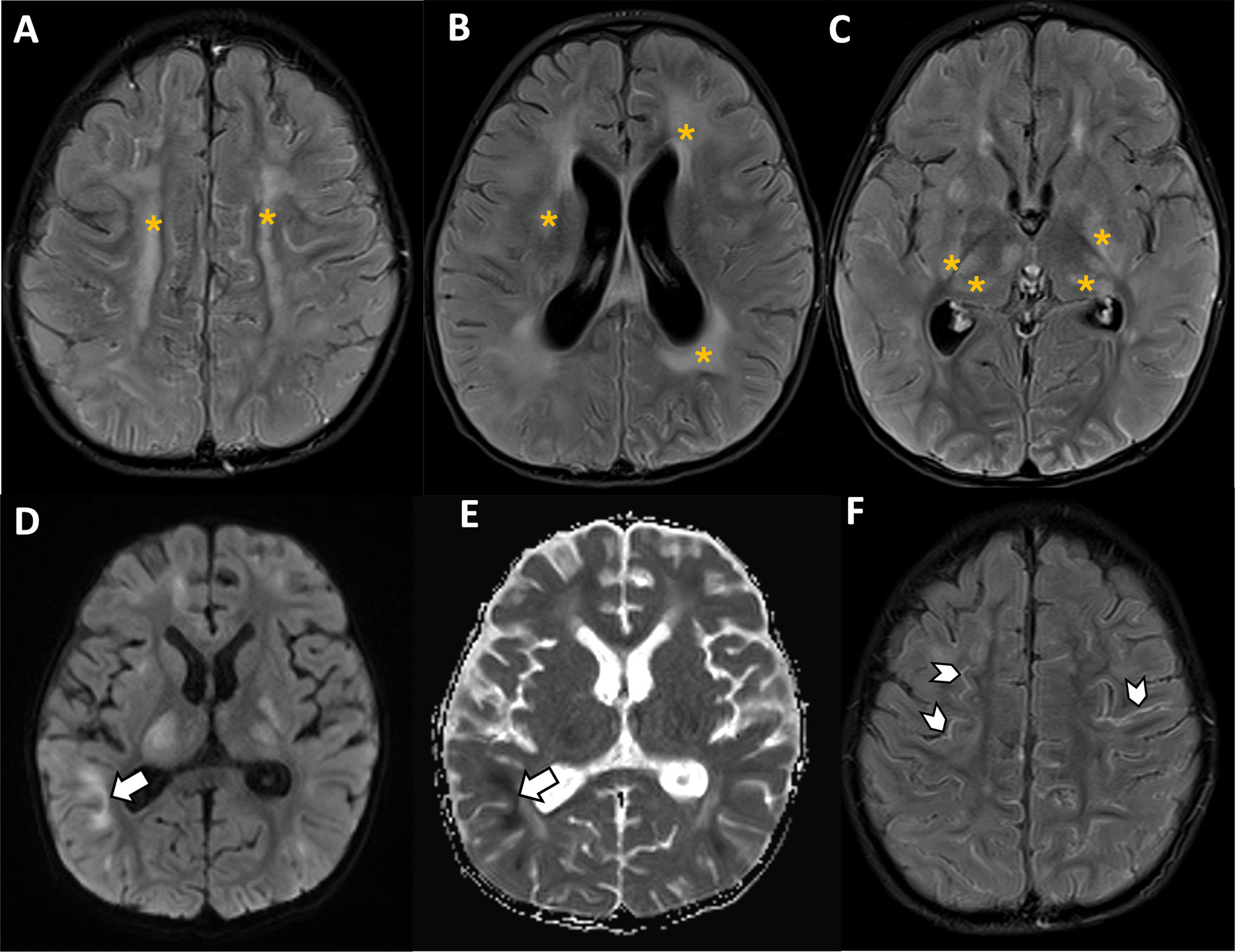
Aunque la neuroimagen suele ser normal, se recomienda realizar estudios en casos sospechosos. La TC es útil en urgencias, mientras que la RM es más sensible para detectar anomalías. El hallazgo más frecuente es hiperintensidad en T2-FLAIR en áreas de alta demanda metabólica (ganglios basales, tálamos, cápsulas externas y tronco encefálico) (fig. 15). También pueden observarse realce leptomeníngeo, hemorragias y eventos trombóticos37,38.
Niño de 3 años con LLA-B con sospecha de toxicidad neurológica por terapia CAR-T. Se solicita una RM cerebral. A-C)En secuencias T2-FLAIR se observa afectación generalizada de la sustancia blanca, ambos tálamos y ganglios basales sugestivo de edema cerebral difuso (asteriscos). D-E)Algunas de estas áreas muestran hiperintensidad en secuencias de difusión (D) con restricción de la difusión en el mapa de coeficiente de difusión aparente (ADC, E) que sugiere restricción a la difusión de la alteración de señal subcortical parietal derecha (flechas). F)En secuencias T2 FLAIR post-contraste se observa también realce leptomeníngeo en surcos (puntas de flecha), coincidiendo con áreas de hiperintensidad de señal. Los hallazgos son sugestivos de ICANS (ASTCT-4).
Tanto el CRS como el ICANS son reversibles con tratamiento oportuno. En CRS graves (grados3-4) el tocilizumab es la primera opción, mientras que en ICANS se emplean corticoides. Si ambos síndromes coinciden, se recomienda terapia combinada.
ConclusionesLos pacientes con cáncer generan millones de visitas a los servicios de urgencias en todo el mundo. Las urgencias oncológicas pueden presentarse en diferentes contextos, incluyendo el inicio de la enfermedad, complicaciones locales o paraneoplásicas, y efectos adversos de los tratamientos, tanto convencionales como avanzados. Como radiólogos, es fundamental identificar las urgencias oncológicas que requieren un manejo inmediato o que pueden impactar significativamente en la calidad de vida del paciente.
FinanciaciónNinguna.
Conflicto de interesesLos autores no tienen intereses contrapuestos en este estudio.