Los tumores de partes blandas (TPB) constituyen un grupo heterogéneo de lesiones estudiadas con frecuencia mediante resonancia magnética (RM). Aún no se ha establecido claramente si la inclusión de mapas de imágenes potenciadas en difusión (diffusion-weighted imaging [DWI]) con coeficiente de difusión aparente (apparent diffusion coefficient [ADC]) ayudaría a determinar mejor la agresividad del tumor.
ObjetivosDeterminar el valor diagnóstico de los mapas cuantitativos del ADC en el diagnóstico inicial de los TPB; y determinar si la inclusión de la difusión proporciona información más valiosa que las secuencias convencionales por sí solas.
Materiales y métodosEstudio retrospectivo de pacientes con TPB confirmados histológicamente. Se analizaron las secuencias morfológicas convencionales de RM y la secuencia de difusión. El ADC se cuantificó utilizando una región de interés (region of interest [ROI]) que abarcaba la mayor área seccional (ADC global) y otra que seleccionaba el área de mayor restricción (ADC seleccionado). Se analizaron las diferencias en los valores de ADC entre las lesiones benignas y malignas y los sarcomas de alto y bajo grado. Se realizó un análisis multivariante para determinar la capacidad del ADC para diagnosticar adecuadamente la naturaleza de los TPB cuando se asocia a otras características morfológicas.
ResultadosOchenta y cuatro pacientes con TPB, de los cuales 40 eran benignos y 44 malignos. Entre los malignos se incluían 10 sarcomas de bajo grado, 23 sarcomas de alto grado, 4 neoplasias no sarcomatosas y 7 sarcomas sin gradación histológica. Los valores ADC fueron notablemente superiores en las lesiones benignas para el ADC seleccionado. También se obtuvieron valores de ADC seleccionado notablemente superiores en los sarcomas de bajo grado. En el análisis multivariante, los valores más altos de precisión diagnóstica se obtuvieron cuando se incluyeron las características morfológicas y el ADC, con una sensibilidad, una especificidad y un área bajo la curva (ABC) del 84, del 75 y del 91%, respectivamente.
ConclusiónLa inclusión de los valores ADC de las imágenes de difusión mejora la precisión diagnóstica de la RM para los TPB, especialmente cuando se utiliza en combinación con secuencias de RM convencionales.
Soft tissue tumours (STT) constitute a heterogeneous group of lesions frequently studied by Magnetic Resonance Imaging (MRI). It has not yet been clearly established whether the inclusion of apparent diffusion coefficient (ADC) diffusion-weighted imaging (DWI) maps would better determine tumour aggressiveness.
PurposeTo assess the diagnostic value of quantitative ADC DWI maps in the initial diagnosis of STT; and to determine whether the inclusion of DWI provides more valuable information than conventional sequences alone.
Material and methodsRetrospective study of patients with histologically proven STT. Conventional morphological MRI sequences and the DWI sequence were analysed. The ADC was quantified using a region of interest (ROI) that covered the largest sectional area (global ADC) and another that selected the area of greatest restriction (selected ADC). Differences in ADC values were analysed between both benign and malignant lesions and high and low-grade sarcomas. A multivariate analysis was performed to determine the ability of ADC to adequately diagnose the nature of STTs when associated with other morphological characteristics.
Results84 patients with STT, of which 40 were benign and 44 malignant. The malignant group included 10 low-grade sarcomas, 23 high-grade sarcomas, 4 non-sarcomatous neoplasms and 7 sarcomas with no histological grading. The ADC values were significantly higher in benign lesions for the selected ADC. Significantly higher selected ADC values were also obtained in low-grade sarcomas. In the multivariate analysis, the highest diagnostic precision values were obtained when morphological features and ADC were included, with a sensitivity, specificity, and area under the curve (AUC) of 84, 75 and 91%, respectively.
ConclusionThe inclusion of ADC DWI values improves the diagnostic accuracy of MRI for STTs, especially when used in combination with conventional MRI sequences.
Los tumores de partes blandas (TPB) son un grupo heterogéneo de lesiones que normalmente se manifiestan como una masa palpable. Muchos tumores de tejidos blandos pueden etiquetarse de benignos según sus características clínicas, y su manejo se limita al seguimiento clínico o a la escisión directa. Sin embargo, un porcentaje significativo de estas lesiones son indeterminadas o sospechosas de malignidad, y el siguiente paso diagnóstico se completa con las técnicas de imagen1-3.
La resonancia magnética (RM) es la modalidad de referencia para caracterizar los TPB debido a su capacidad multiplanar, su alto contraste y su elevada resolución espacial. A pesar de estas ventajas, entre un cuarto y un tercio de todas las lesiones estudiadas con secuencias de RM convencionales son indeterminadas, por lo que a menudo es necesario realizar un estudio histológico3,4.
Sería deseable reducir al mínimo el número de lesiones que requieren análisis histológico, así como realizar la biopsia de forma eficaz y en la zona más representativa del tumor, especialmente cuando es maligno5,6.
Además, la clasificación histológica preoperatoria de los sarcomas suele complicarse por la heterogeneidad de las muestras o por su escasa representatividad de la histología de la neoplasia. Por lo tanto, es necesario que se utilicen técnicas de imagen, concretamente la RM, para determinar de forma fiable la naturaleza y el grado de malignidad de los TPB7-9.
El papel de las secuencias avanzadas de RM, como las imágenes potenciadas en difusión (diffusion-weighted imaging [DWI]) y con realce dinámico del contraste (dynamic contrast enhancement [DCE]), se ha evaluado en el estudio de diferentes patologías, en particular en el campo de los TPB. Estas secuencias avanzadas proporcionan información funcional y facilitan la adquisición de mapas paramétricos, lo que permite una aproximación a la naturaleza celular de las lesiones10,11.
Diferentes estudios han abordado el papel de las secuencias de difusión en el diagnóstico de los TPB, pero los resultados acerca de su utilidad no han sido concluyentes. En muchos casos, dichos estudios son unicéntricos, con muestras de pacientes pequeñas y protocolos no estandarizados, lo que hace más difícil determinar la verdadera eficacia diagnóstica de las secuencias de difusión12-19.
Teniendo todo esto en cuenta, el objetivo principal de este estudio es evaluar la utilidad de las secuencias de difusión para diferenciar no solo las lesiones benignas de las malignas, sino también los sarcomas de alto grado de los de bajo grado, así como determinar si las secuencias de difusión añaden valor a las convencionales en el diagnóstico inicial de los TPB.
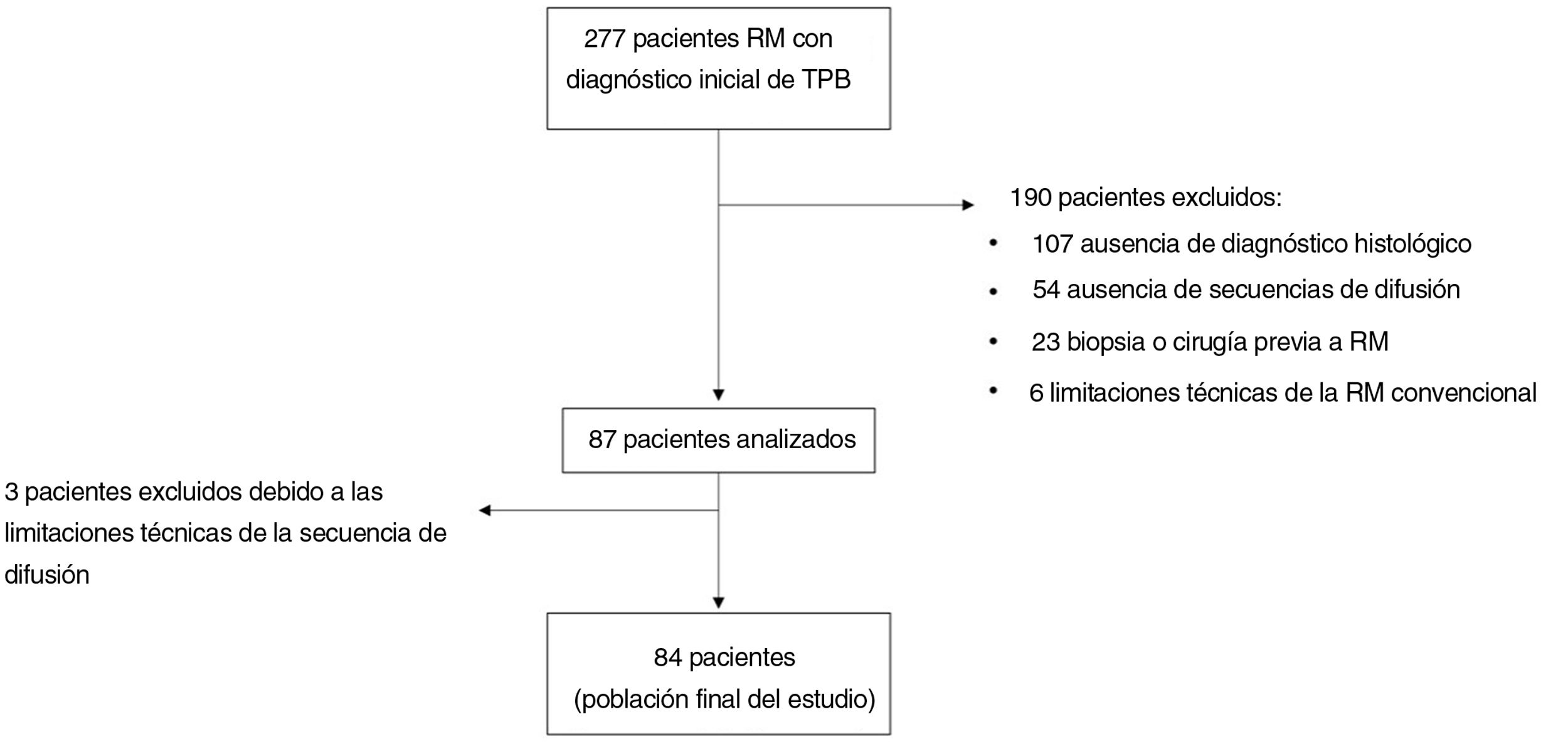
MétodosPoblación del estudioSe trata de un estudio retrospectivo, multicéntrico y observacional de pacientes evaluados mediante RM, con sospecha clínica de TPB, que posteriormente fueron analizados histológicamente, ya fuera mediante biopsia o cirugía. Este resultado histológico se consideró la norma de referencia. En el caso de los sarcomas, el grado histológico (de I a III) se registró según la clasificación de la Fédération Nationale des Centers de Lutte Contre le Cancer (FNCLCC) y se subclasificó en bajo (grado histológico I) y alto grado (grados histológicos II y III).
El estudio recibió la aprobación del Comité Ético («ciego»), y se eximió de la necesidad de obtener el consentimiento informado.
Se realizó una búsqueda en las bases de datos internas desde enero de 2015 hasta enero de 2021. Los pacientes fueron evaluados con 10 equipos de RM de 7 centros diferentes, desde hospitales terciarios hasta centros ambulatorios.
Los criterios de inclusión fueron RM de las extremidades por sospecha clínica de TPB, disponibilidad de secuencias morfológicas y DWI para el diagnóstico y confirmación histológica del TPB.
Los criterios de exclusión fueron biopsia o cirugía previa a la RM, o tratamiento neoadyuvante previo a la RM.
Equipos y secuencias de RMTodas las exploraciones se realizaron con imanes de alta intensidad de campo (1,5T) de diferentes fabricantes comerciales, y con bobinas de superficie o dedicadas a las extremidades en función de las características individuales de cada paciente.
Todos los estudios cumplían los siguientes criterios estándar: secuencias de RM morfológicas y sensibles a los líquidos al menos en dos planos para cubrir toda la longitud de la lesión; secuencias poscontraste al menos en dos planos; secuencias DWI con saturación grasa y al menos dos valores b (normalmente 50 y 800mm/s2) (tabla 1).
Parámetros de imagen de RM
| Parámetros | Secuencias convencionales | DWI (disparo único) |
|---|---|---|
| Campo de visión | 90-420 mm | 100-360 mm |
| Tamaño de la matriz | 512 × 256 | 70 × 42 / 128 ×128 |
| TR (ms)/TE (ms) | T1: 420-680/10-18T2: 3.800-4.700/60-95 | |
| Supresión de la grasa | Pulso CHESS | |
| Espesor de la sección | 3-5 mm | 3-5 mm |
| Espacio entre secciones | 0-10% | 0 |
| Factor turbo o factor EPI | T1: 2-4; T2: 2-6 | 32-56 |
| Número de adquisiciones | 1-4 | 4-9 |
CHESS: desplazamiento químico selectivo; DWI: imagen potenciada en difusión; EPI: imagen ecoplanar; TE: tiempo de eco; TR: tiempo de repetición.
Las imágenes fueron analizadas a ciegas (sin conocimiento del diagnóstico histológico) por tres radiólogos especialistas en RM con 7, 9 y 12años de experiencia en RM musculoesqueléticas.
- a)
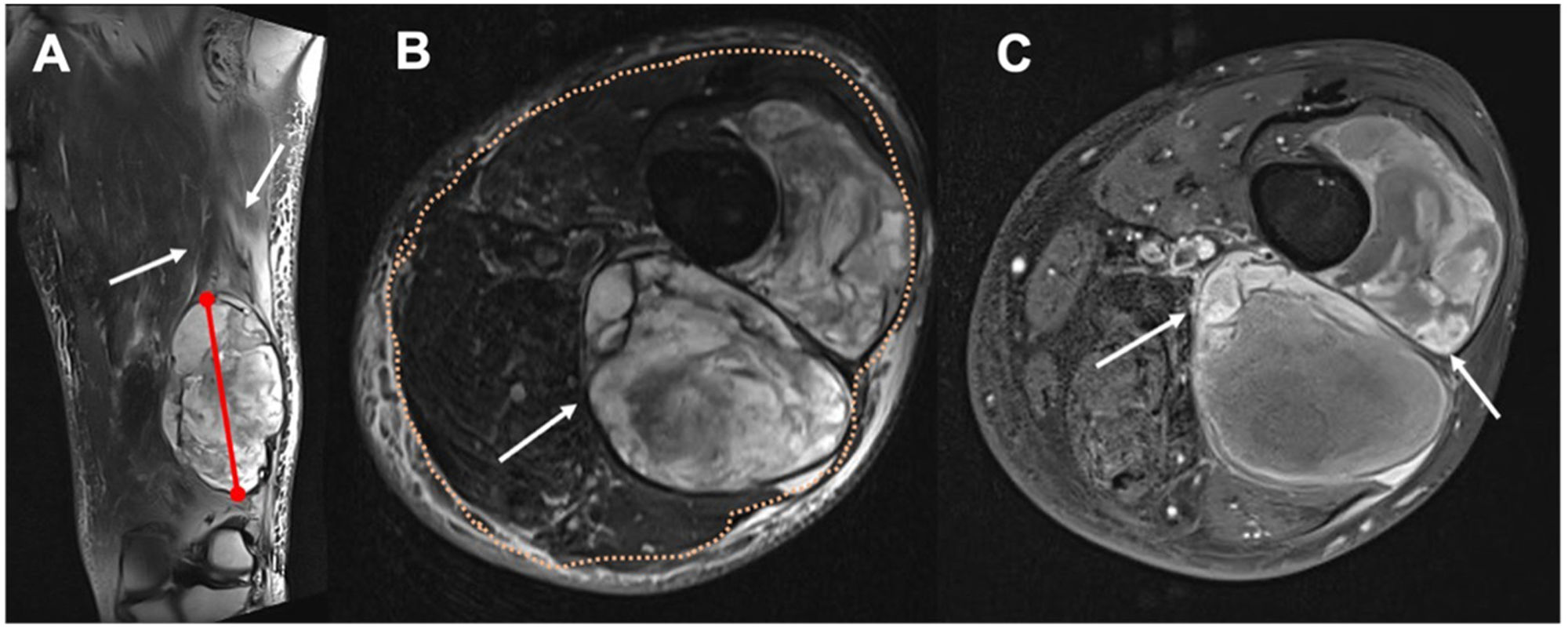
El primer radiólogo (R1) determinó las siguientes características morfológicas de cada TPB. Tamaño: mayor diámetro en cm, medido en las secuencias sensibles al líquido. Profundidad: localización superficial o profunda relacionada con la fascia muscular periférica profunda, determinada en la secuencia axial T2 turbo spin-echo (TSE). Edema perilesional: zonas hiperintensas que sobrepasan el margen de la lesión en las secuencias sensibles al líquido. Realce nodular periférico: focos redondeados (mayores de 2mm) de captación de contraste en la secuencia T1 FS posterior a la inyección de gadolinio en los límites de la lesión. Heterogeneidad de la lesión en T2 TSE: al menos un tercio del área con cambios en la intensidad de la señal. Zonas de necrosis quística: focos hipointensos de al menos 2mm, sin realce en T1 FS posgadolinio (fig. 1).
Figura 1.Determinación de las características morfológicas de los TPB en un sarcoma pleomórfico indiferenciado en una mujer de 56años. A)Medición del eje largo (línea roja) y determinación del edema perilesional (flechas blancas) en una T2 FS coronal. B)Tumor profundo (flecha blanca) según la relación con la fascia superficial (puntos naranjas), y lesión heterogénea con al menos un tercio del área con cambios en la intensidad de la señal. C)Realce de focos nodulares periféricos (flechas blancas) en T1 FS posgadolinio, y zonas de necrosis quística: focos hipointensos de al menos 2mm, sin realce en T1 FS posgadolinio (flechas negras).
- b)
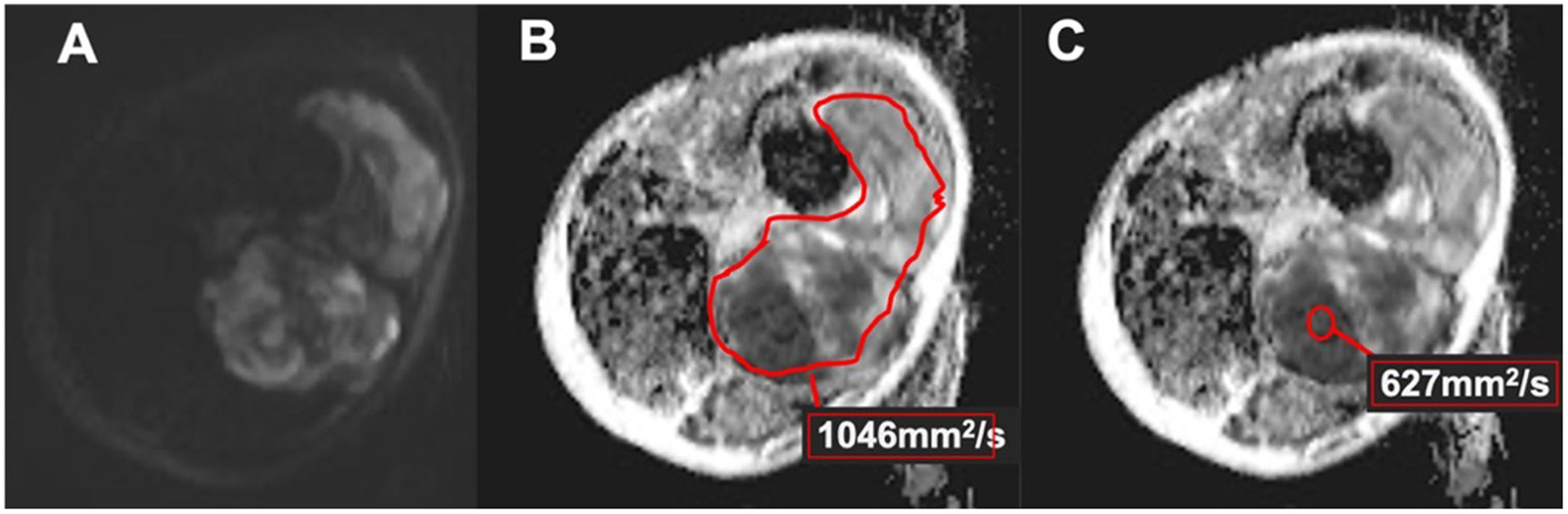
La DWI fue evaluada por dos radiólogos (R2 y R3) de forma independiente. Basándose en las secuencias morfológicas, los dos radiólogos dibujaron en la estación del sistema de archivo y comunicación de imágenes (PACS) (Agfa Health care Impax 6, Mortsel, Bélgica) una región de interés (region of interest [ROI]) a mano alzada o redonda en el mapa de coeficiente de difusión aparente (apparent diffusion coefficient [ADC]) de los TPB, procediendo de dos maneras: incluyendo la mayor superficie de la lesión en el plano axial, teniendo cuidado de no sobrepasar los bordes de la lesión (ADC total) en las zonas de mayor restricción de la difusión, con un tamaño mínimo de 1cm2, e intentando evitar las zonas de necrosis, de calcificación o de hemorragia (ADC seleccionado). Se registraron los valores medios (en mm2/s) y la DE del mapa cuantitativo de ADC (fig. 2).
Figura 2.Sarcoma pleomórfico indiferenciado del muslo en una mujer de 56años (la misma de la figura 1). A)DWI de alto valor b (800mm2/s) con restricción heterogénea de la difusión. B)Mapa de ADC con ROI a mano alzada (línea roja) que incluye la mayor área de lesión en el plano axial, teniendo cuidado de no sobrepasar los bordes de la lesión (ADC global). C)Mapa de ADC con ROI circular (círculo rojo) en la zona de mayor restricción de difusión, intentando evitar las zonas de necrosis, calcificación o hemorragia (ADC seleccionado).
Las características morfológicas y los parámetros cuantitativos de la secuencia DWI se correlacionaron con la naturaleza benigna o maligna de la lesión y con la agresividad de la neoplasia en los casos de lesiones malignas.
La calidad de la DWI fue evaluada de forma consensuada por ambos radiólogos en una escala Likert de 4 puntos. Grado 1: imágenes óptimas para el diagnóstico; grado 2: presencia de artefactos aislados y/o leves que no interfieren en la interpretación de las imágenes; grado 3: presencia de artefactos moderados que no impiden la interpretación de las imágenes, y grado 4: imágenes no interpretables que no son válidas para el estudio.
Análisis estadísticoEl análisis estadístico se realizó con SPSS v.20.0 (IBM, Armonk, Nueva York). Se utilizaron la prueba t de Student y la prueba de suma de rangos de Wilcoxon para el análisis de las variables cuantitativas, y la prueba ji cuadrado o la prueba de Fisher para las variables cualitativas. En todos los casos, p<0,05 se consideró estadísticamente significativo. El análisis de la concordancia interobservador se realizó mediante el coeficiente de correlación intraclase (CCI). Para determinar la precisión diagnóstica de los modelos ADC y multiparamétricos se realizó un análisis de la curva de la característica operativa del receptor (receiver operating characteristic [ROC]) y se calcularon las áreas bajo la curva (AUC). La relación entre las variables epidemiológicas de la muestra y las características morfológicas de las lesiones con respecto a su naturaleza benigna o maligna se evaluó mediante la prueba ji cuadrado y la odds ratio (OR). La relación entre la naturaleza maligna o benigna de la lesión y las variables morfológicas, el ADC total y el ADC seleccionado como variables continuas se analizaron mediante regresión logística multivariante con análisis de la curva ROC y las correspondientes AUC.
ResultadosPoblación del estudioEn la muestra final se incluyeron 84 lesiones de 84 pacientes diferentes (42 mujeres y 42 hombres). La edad media de los pacientes fue de 54años (rango: 18-86años) (fig. 3).
El análisis histológico se realizó mediante biopsia (26 lesiones) o muestra quirúrgica (58 lesiones).
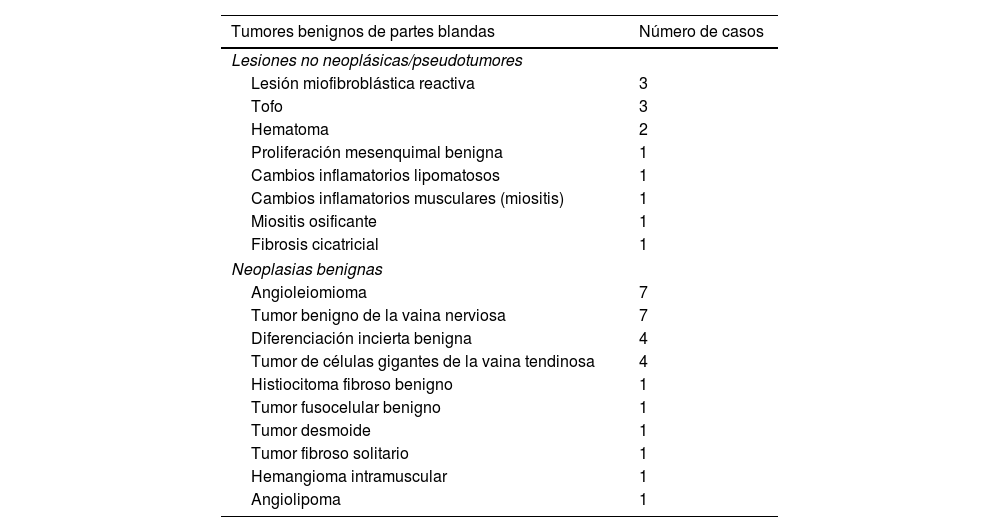
Cuarenta lesiones eran benignas y 44 eran tumores malignos (tabla 2). La mayoría de los tumores malignos eran sarcomas (40 de 44; 91%), y de estos, 10 lesiones (23%) eran sarcomas de bajo grado. Además, 23 lesiones (52%) eran sarcomas de alto grado (8 de gradoII y 15 de gradoIII). Un total de 7 sarcomas no se clasificaron según su gradación histológica, bien porque la gradación histológica no se incluyó en el informe patológico o porque la clasificación no era adecuada según la histología (tabla 3).
Tipos histológicos de tumores malignos de partes blandas
| Tumores benignos de partes blandas | Número de casos |
|---|---|
| Lesiones no neoplásicas/pseudotumores | |
| Lesión miofibroblástica reactiva | 3 |
| Tofo | 3 |
| Hematoma | 2 |
| Proliferación mesenquimal benigna | 1 |
| Cambios inflamatorios lipomatosos | 1 |
| Cambios inflamatorios musculares (miositis) | 1 |
| Miositis osificante | 1 |
| Fibrosis cicatricial | 1 |
| Neoplasias benignas | |
| Angioleiomioma | 7 |
| Tumor benigno de la vaina nerviosa | 7 |
| Diferenciación incierta benigna | 4 |
| Tumor de células gigantes de la vaina tendinosa | 4 |
| Histiocitoma fibroso benigno | 1 |
| Tumor fusocelular benigno | 1 |
| Tumor desmoide | 1 |
| Tumor fibroso solitario | 1 |
| Hemangioma intramuscular | 1 |
| Angiolipoma | 1 |
Tipos histológicos de tumores malignos de partes blandas
| Tumores malignos de partes blandas | Número de casos |
|---|---|
| Sarcomas de bajo grado | |
| Sarcoma de diferenciación mixoide incierta | 3 |
| Sarcoma fusocelular | 2 |
| Sarcoma sinovial monofásico | 2 |
| Sarcoma fibromixoide | 1 |
| Sarcoma fibroblástico mixoinflamatorio | 1 |
| Liposarcoma mixoide | 1 |
| Sarcomas de alto grado | |
| Sarcoma pleomórfico indiferenciado | 10 |
| Liposarcoma desdiferenciado | 3 |
| Leiomiosarcoma | 3 |
| Sarcoma sinovial bifásico | 2 |
| Condrosarcoma mixoide | 2 |
| Mixofibrosarcoma | 2 |
| Sarcoma fusocelular de alto grado | 1 |
| Sarcomas sin gradación | |
| Sarcoma de Ewing extraesquelético | 3 |
| Tumor fibroso solitario maligno | 2 |
| Tumor maligno de la vaina nerviosa | 2 |
| Tumores de partes blandas no sarcomatosos | |
| Metástasis de carcinoma esofágico | 1 |
| Carcinoma epidérmico | 1 |
| Linfoma folicular cutáneo primario | 1 |
| Leucemia linfocítica crónica | 1 |
No hubo diferencias estadísticamente significativas en la distribución de las lesiones benignas o malignas según el sexo de los pacientes, pero sí se observó una mayor edad entre los pacientes diagnosticados con neoplasias malignas (p=0,023).
En cuanto a la localización de las lesiones, una gran proporción se encontraban en el muslo (42%), el brazo (11%) o el pie (9%), y el resto se distribuían de forma relativamente homogénea a lo largo de las extremidades; sin diferencias entre TPB benignos y malignos (p>0,05).
Características morfológicas y anatómicasEl tamaño medio de las lesiones fue de 6,5cm (rango: 2-28cm), siendo las lesiones malignas significativamente mayores, con un diámetro medio de 8,3cm (rango: 3-28cm) frente a 4,5cm (rango: 2-19cm) para las lesiones benignas (p<0,001).
El 79% de los TPB se encontraban en las capas profundas, sin diferencias significativas entre las lesiones benignas y malignas; p>0,05. Por otro lado, se observaron diferencias significativas en la presencia de edema perilesional (75% en las lesiones malignas frente al 45% en las benignas), realce nodular intralesional (77% frente al 35%, respectivamente) y necrosis quística (57% frente al 20%), así como en la heterogeneidad del T2 (73% frente al 35%) (p<0,001).
Calidad de las secuencias de difusiónCuarenta y siete secuencias DWI (56%) fueron óptimas para el diagnóstico, 28 presentaban artefactos leves (33%) y 9, artefactos moderados (11%). Solo 3 exámenes tuvieron que ser excluidos debido a artefactos.
Influencia de la cuantificación del ADC para diferenciar lesiones benignas y malignasLa media de los valores de ADC total fue de 1.497 ±580mm2/s para las lesiones benignas y de 1.348 ±521mm2/s para las lesiones malignas para el observador R1, y de 1.520 ±589mm2/s y 1.342 ±511mm2/s, respectivamente, para el observador R2. Los TPB malignos tenían un valor de ADC total inferior al de los tumores benignos, aunque las diferencias no alcanzaron significación estadística (p=0,177).
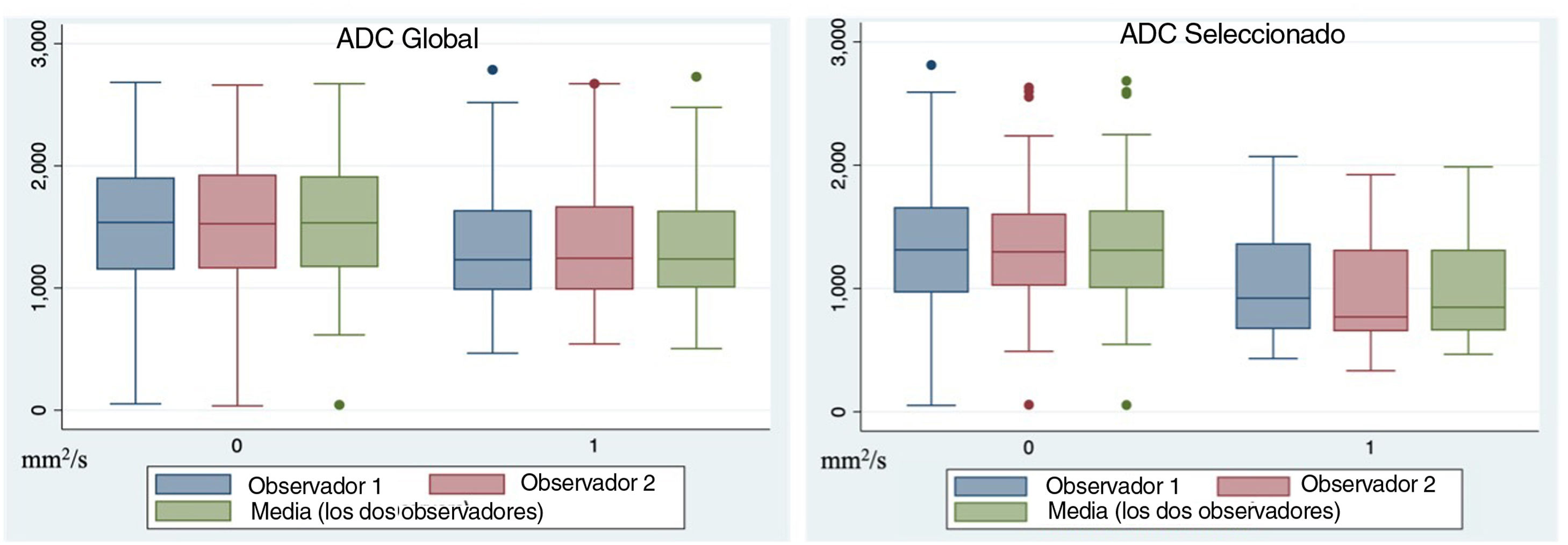
Los valores de ADC seleccionado fueron de 1.335 ±596mm2/s y de 1.035 ±439mm2/s para las lesiones benignas y malignas, respectivamente, para el observador R1, y de 1.331 ±582mm2/s y 951 ±411mm2/s para las lesiones benignas y malignas, para el observador R2. En este caso, los valores registrados por ambos observadores de los valores de ADC seleccionado para las neoplasias malignas fueron significativamente inferiores a los de las lesiones benignas (p<0,05) (fig. 4).
Concordancia entre observadoresEl CCI entre ambos observadores fue de 0,990 (IC del 95%: 0,985 a 0,994) y de 0,986 (IC del 95%: 0,971 a 0,993) para el ADC total y el ADC seleccionado, respectivamente, lo que implica un alto nivel de concordancia y un alto grado de fiabilidad para ambas mediciones.
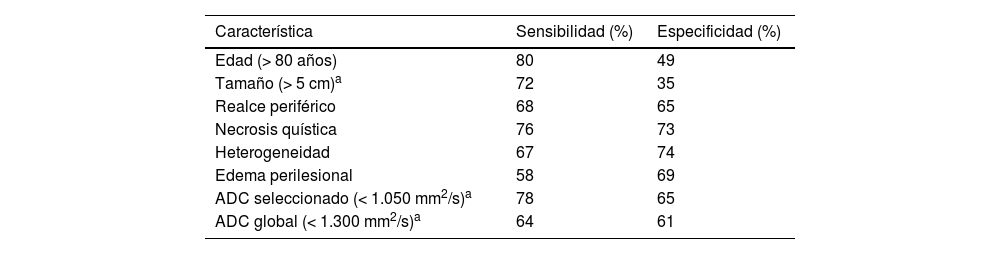
Características morfológicas y valores de ADCSe realizó un análisis multivariante para evaluar la relación entre las distintas covariables y la influencia del valor ADC en la capacidad de clasificar correctamente las lesiones como benignas o malignas. Las variables más determinantes fueron la edad (una mayor edad indica una mayor probabilidad de malignidad), el tamaño (cuanto mayor es el diámetro de la lesión, mayor es la probabilidad de malignidad), las áreas de realce nodular periférico, la necrosis quística, la heterogeneidad del TPB y la presencia de edema perilesional (tabla 4).
Sensibilidad y especificidad de cada característica de la RM para la predicción de malignidad
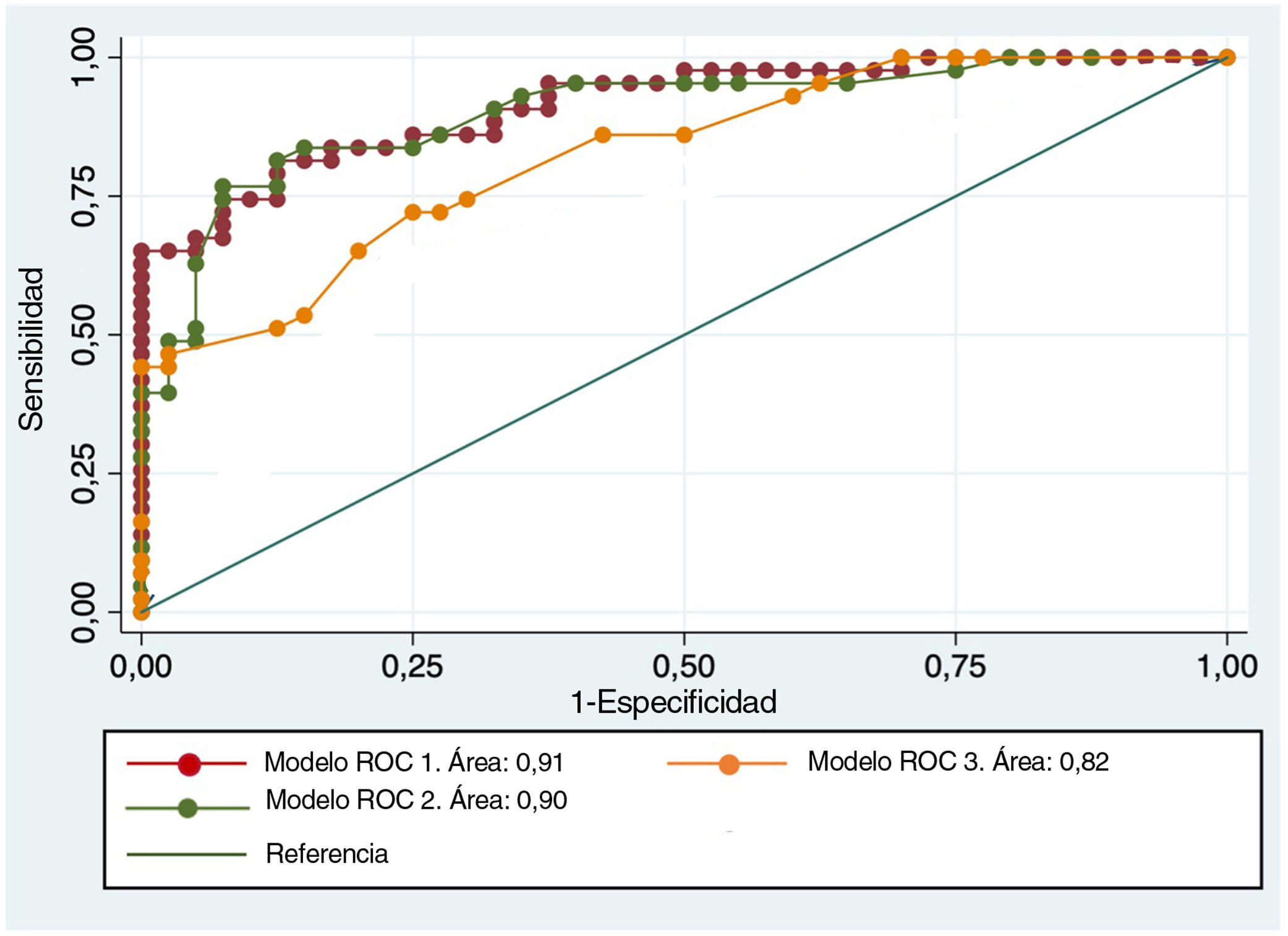
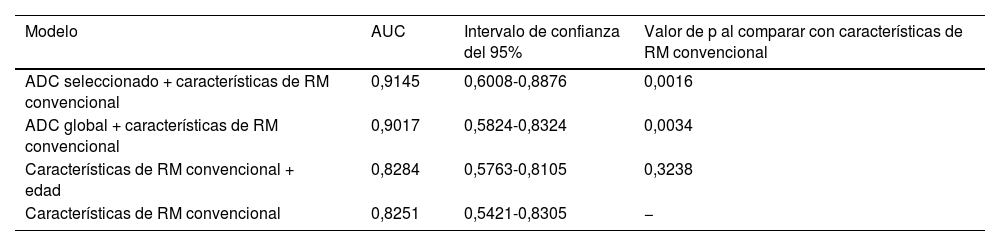
Las curvas ROC de este análisis multivariante mostraron que los valores de precisión diagnóstica eran superiores en los modelos en los que también se añadía el valor ADC (tabla 5). Cuando se utilizó el ADC seleccionado combinado con las principales características morfológicas, la sensibilidad y la especificidad alcanzaron el 84% y el 75%, respectivamente, con un AUC del 91,45% (fig. 5).
Área bajo la curva ROC (AUC) y regresión lineal multivariante
| Modelo | AUC | Intervalo de confianza del 95% | Valor de p al comparar con características de RM convencional |
|---|---|---|---|
| ADC seleccionado + características de RM convencional | 0,9145 | 0,6008-0,8876 | 0,0016 |
| ADC global + características de RM convencional | 0,9017 | 0,5824-0,8324 | 0,0034 |
| Características de RM convencional + edad | 0,8284 | 0,5763-0,8105 | 0,3238 |
| Características de RM convencional | 0,8251 | 0,5421-0,8305 | − |
Curva ROC con modelos multivariantes. La mayor precisión diagnóstica para la discriminación entre TPB benignos y malignos se obtiene con modelos que añaden los valores de ADC, tanto el global como el seleccionado (rojo y verde, respectivamente), a las principales características morfológicas representadas en el modelo3 (edad, tamaño, realce nodular periférico, necrosis quística, edema perilesional y heterogeneidad de la señalT2).
El ADC medio fue mayor en los sarcomas de bajo grado que en el grupo de alto grado, tanto en el ADC total como en el seleccionado, de forma estadísticamente significativa en el caso del ADC seleccionado. La media del ADC total de los sarcomas de bajo grado fue de 1.380 ±428mm2/s y de 1.392 ±402mm2/s para los observadores R1 y R2, respectivamente, mientras que el valor de ADC total de los sarcomas de alto grado fue de 1.212 ±497mm2/s (observador1) y de 1.258 ±431mm2/s (observador2), pero la diferencia no fue significativa (p=0,240). Por otra parte, el valor medio de ADC seleccionado fue significativamente diferente entre los sarcomas de bajo grado (1.180 ±376mm2/s, observador1, y 1.013 ±399mm2/s, observador2) y los de alto grado (855 ±394mm2/s, observador1, y 887 ±315mm2/s, observador2; p<0,05).
DiscusiónLos valores cuantitativos de los mapas de ADC fueron superiores en las lesiones benignas que en las malignas, alcanzando significación estadística cuando la ROI se trazó en la zona seleccionada del tumor, donde visualmente existe una mayor restricción de la difusión dentro del TPB. La cuantificación del ADC aumentó la precisión diagnóstica de la RM en la caracterización de los TPB cuando se combinó con parámetros morfológicos. Además, los sarcomas de bajo grado tenían valores de ADC más altos que los de alto grado, y esta diferencia fue estadísticamente significativa cuando se comparó el ADC seleccionado.
Aunque diferentes estudios han respaldado el papel de los valores de ADC para diferenciar los TPB malignos de los benignos, aún no existe consenso sobre el protocolo ideal para adquirir las secuencias de difusión, ni tampoco para medir los valores de ADC20-22.
Basándonos en estos resultados, podría recomendarse el uso del valor ADC mediante ROI dibujadas para seleccionar con precisión las zonas de mayor restricción, evitando la sangre, las calcificaciones, las zonas de necrosis o los focos mixoides dentro del tumor, evaluando así la zona que más probablemente refleje la verdadera naturaleza de la lesión. Dicho objetivo cobra una mayor importancia en el caso de tumores heterogéneos y con zonas de comportamiento variable dentro del propio tumor.
En nuestro estudio, la medición del ADC se realizó sin separar las lesiones en función de sus componentes mixoides o fibrosos, dado que el dilema diagnóstico que se presenta con mayor frecuencia en nuestra práctica clínica es la determinación de la agresividad de la lesión. De acuerdo con las características en imagen de los TPB, el origen histológico de estas lesiones suele ser incierto, por lo que el uso de las secuencias de difusión se vería muy limitado si solo se utilizaran para lesiones de linaje histológico claro.
Al igual que los hallazgos en la literatura, nuestro estudio mostró un grado significativo de solapamiento en los valores de ADC entre lesiones benignas y malignas14,21-24. Debido al amplio solapamiento de los valores de ADC, es difícil establecer un punto de corte óptimo y exacto que distinga de forma fiable el grado de agresividad de los TPB. Sin embargo, basándonos en nuestros resultados, podemos considerar que el valor de 1.000mm2/s tendría la mejor precisión diagnóstica para distinguir las lesiones benignas de las malignas, y valores inferiores a 850mm2/s podrían sugerir el diagnóstico de tumores de comportamiento más agresivo. Estos valores son coherentes con lo descrito anteriormente en la literatura13,14,24,25.
Por lo tanto, la combinación de la información de la DWI con otras características diferenciadoras de las lesiones benignas y malignas puede ser decisiva para orientar la discriminación entre ellas. Así lo demostró el análisis multivariante de nuestro estudio, en el que la capacidad discriminatoria del modelo aumentó significativamente cuando los valores de ADC, tanto el total como el seleccionado, se examinaron junto con la edad, el edema perilesional, el realce nodular periférico poscontraste, la presencia de necrosis quística intralesional y la heterogeneidad de la lesión, arrojando unos valores de AUC del 89% y el 91%, respectivamente. En concreto, el uso del ADC seleccionado en este análisis multivariante proporcionó los mejores resultados, con unos valores de sensibilidad y especificidad del 84% y del 75%, respectivamente.
En cuanto a la utilidad de las secuencias de difusión para discriminar los sarcomas de alto y bajo grado, el único estudio que encontramos fue el trabajo de Chhabra et al.25, que presentó una muestra de 51 pacientes con sarcomas de partes blandas. En consonancia con nuestros resultados, el ADC seleccionado de dichos pacientes fue significativamente inferior en los sarcomas de gradoII yIII que en los de gradoI.
Nuestros resultados también mostraron un solapamiento significativo entre los valores de ADC de los sarcomas de alto y bajo grado, probablemente porque las muestras de sarcoma incluían un alto porcentaje de lesiones con contenido mixoide, lo que limita la estimación de un punto de corte numérico para discriminar las lesiones con estructura biológica heterogénea.
Aunque la inteligencia artificial desempeñará un papel cada vez más importante en el diagnóstico por imagen, sigue siendo necesario conocer la utilidad que las secuencias de difusión y sus parámetros cuantitativos pueden desempeñar en el diagnóstico clínico de los TPB.
El estudio tiene algunas limitaciones. En primer lugar, se trata de un estudio retrospectivo, por lo que puede estar asociado a un sesgo de selección de pacientes. Un número significativo de pacientes tuvo que ser excluido debido a la ausencia de imágenes DWI, lo que hace que la representación histológica de la cohorte sea en cierto modo atípica; por ejemplo, con muy pocas neoplasias lipomatosas. Además, se analizó una muestra heterogénea de pacientes, desde los ingresados en hospitales terciarios hasta los pacientes ambulatorios de centros de salud primaria. A pesar de ello, nuestra cohorte simulaba de forma bastante realista el trabajo rutinario de nuestros radiólogos, que se enfrentan a diario con casos de distintos niveles de complejidad y con pacientes remitidos desde distintos escalones del sistema sanitario.
En segundo lugar, se evaluaron protocolos no unificados con equipos de RM de diferentes fabricantes. En la mayoría de nuestras secuencias de difusión se utilizaron dos valores b (normalmente 0, 800s/mm2), aunque no fue infrecuente un esquema de tres valores b (normalmente 50, 400 y 800s/mm2). Esta heterogeneidad entre los protocolos es coherente con la falta de estandarización en las secuencias de difusión observada en la mayoría de los estudios20-25. Nuestros resultados sirven para determinar la validez de la cuantificación del ADC con equipos de RM de distintos fabricantes y con protocolos no estandarizados.
En tercer lugar, el tamaño de la muestra de sarcomas era pequeño; en particular, el de los sarcomas de bajo grado. No obstante, parece que el valor ADC podría ayudar a clasificar las lesiones malignas, aunque son necesarios estudios con un mayor número de pacientes para verificar este hallazgo.
ConclusionesNuestros resultados apoyan el valor de las secuencias de difusión para el diagnóstico inicial de los TPB, lo que justifica su inclusión rutinaria en los estudios de RM de dichos tumores. Las secuencias de difusión pueden ser útiles para diferenciar entre lesiones benignas y malignas, y entre tumores de sarcoma de alto y bajo grado, lo que aumenta la precisión diagnóstica de la RM cuando se añade a las secuencias convencionales.
FinanciaciónEsta investigación no recibió financiación.
Autoría- 1.
Responsable de la integridad del estudio: ROP.
- 2.
Concepción del estudio: ROP, NHA, TSY, TPC.
- 3.
Diseño del estudio: ROP, NHA, TSY, TPC.
- 4.
Adquisición de datos: ROP.
- 5.
Análisis e interpretación de los datos: ROP, BFR.
- 6.
Tratamiento estadístico: ROP, TPC.
- 7.
Búsqueda bibliográfica: ROP.
- 8.
Redacción del manuscrito: ROP.
- 9.
Revisión crítica del manuscrito con contribuciones intelectualmente significativas: ROP, NHA, TSY, TPC, CTL.
- 10.
Aprobación de la versión final: ROP, NHA, TSY, TPC, BFR, CTL.
Los autores no tienen ningún conflicto de intereses.
Queremos expresar nuestro más sincero agradecimiento a todo el equipo de enfermeras, técnicos de imagen, auxiliares y secretarias de la unidad de resonancia magnética de Osatek Deusto. Sin su inestimable apoyo y dedicación, este trabajo no habría sido posible.