La demencia es un síndrome caracterizado por un deterioro cognitivo crónico, adquirido, multidominio y que produce limitaciones funcionales significativas. La RM estructural es el estudio de imagen de elección en estos casos, dado que permite detectar los patrones de atrofia propios de las distintas enfermedades neurodegenerativas (enfermedad de Alzheimer, degeneración frontotemporal, demencia con cuerpos de Lewy), las lesiones vasculares asociadas a las demencias vasculares y varias patologías potencialmente reversibles (p.ej. tumores, hidrocefalia) o que requieren medidas de manejo especiales (p.ej. enfermedades priónicas). En casos seleccionados pueden utilizarse otros métodos de imagen, tales como la TC, la RM funcional, el SPECT con HMPAO o marcadores dopaminérgicos y el PET con FDG, marcadores de amiloide o marcadores dopaminérgicos. Las indicaciones de estos métodos no están aún bien establecidas, con lo que conviene utilizarlos en el contexto de unidades de demencia multidisciplinares.
Dementia is a syndrome characterised by chronic, multi-domain, acquired cognitive impairment that causes significant functional limitations. MRI is the standard imaging study for these cases, since it enables detection of the atrophy patterns of the various neurodegenerative diseases (Alzheimer's disease, frontotemporal degeneration, Lewy body dementia), the vascular lesions associated with vascular dementia, and various potentially reversible diseases (for example, tumours, hydrocephaly) or diseases that require special management measures (for example, prion diseases). In certain cases other imaging methods can be used, such as CT, functional MRI, HMPAO SPECT or dopaminergic markers and FDG PET, amyloid markers or dopaminergic markers. The indications for these methods have not yet been clearly established, and therefore should be used in multidisciplinary dementia units.
La demencia es un síndrome clínico que consiste en un deterioro cognitivo multidominio, adquirido, crónico y que interfiere de forma significativa en las actividades diarias1,2:
- •
Las definiciones previas de demencia exigían la afectación de la memoria reciente más al menos otra función cognitiva. Actualmente, sabemos que la afectación de la memoria es un elemento secundario o tardío en algunas demencias, por lo que ya no se considera imprescindible. La exigencia de una afectación multidominio distingue la demencia de los síndromes focales.
- •
El origen adquirido de la demencia la diferencia del retraso mental.
- •
El curso crónico, definido de forma arbitraria como superior a 6 meses, permite diferenciar la demencia del síndrome confusional agudo. No obstante, el límite entre estos dos síndromes es impreciso, así como con las formas de demencia de evolución rápida (demencia subaguda)3.
- •
La presencia de alteraciones funcionales significativas diferencia la demencia del deterioro cognitivo leve.
La incidencia y la prevalencia de la demencia aumentan de forma exponencial con la edad. La prevalencia de demencia en los menores de 65 años es inferior al 5%, mientras que en los mayores de 85 años alcanza cifras del 30-60%. Teniendo en cuenta el envejecimiento progresivo de la población y el gasto asociado a estas patologías, la demencia es uno de los principales retos de salud pública en los países occidentales4.
La etiología de la demencia también varía mucho dependiendo de la edad. En los casos de inicio precoz predominan las causas genéticas y secundarias (p. ej., traumatismos, infecciones, enfermedades cerebrovasculares). En los mayores de 65 años la mayoría de los casos corresponden a demencias degenerativas esporádicas, demencias vasculares o una combinación de ambas.
La mayoría de los pacientes con demencia presentan manifestaciones clínicas sutiles durante años. Los primeros síntomas suelen corresponder a quejas de memoria subjetivas. Posteriormente desarrollan un deterioro cognitivo leve, caracterizado por déficits en una o más esferas cognitivas sin interferencia significativa en las actividades sociales y laborales. La demencia representaría la fase final de este continuo, y a su vez incluye diferentes fases de gravedad hasta la dependencia completa.
Clasificación clínico-anatómicaLas principales redes neurales implicadas en las funciones cognitivas son las siguientes5:
- •
La red frontal, de la que dependen las funciones ejecutivas y el control del comportamiento social.
- •
La red temporolímbica, dedicada a la memoria de fijación y las emociones.
- •
La red occipitotemporal, responsable del reconocimiento visual de los objetos.
- •
La red parietofrontal derecha, dedicada a las funciones espaciales de localización y movimiento.
- •
La red perisilviana izquierda, que se ocupa del lenguaje y otras funciones afines.
Además de estas redes neurales clásicas, en los últimos años se ha descrito una red neural por defecto, que se encuentra activa con el sujeto en reposo, y que está constituida por varias estructuras cercanas a la línea media (corteza prefrontal medial, cíngulo posterior, precuña) y las regiones asociativas de la confluencia parieto-témporo-occipital6.
La distribución anatómica de las redes neurales y su afectación selectiva en las diferentes entidades explican la gran variabilidad en las manifestaciones clínicas de las demencias. No obstante, en la práctica clínica observamos dos cuadros característicos7,8:
- •
Las demencias corticales, cuyo prototipo es la enfermedad de Alzheimer (EA), se caracterizan por una afectación precoz de la memoria de fijación y el desarrollo de síndromes cognitivos clásicos, tales como afasia, apraxia y agnosia. En las fases iniciales, estos pacientes no suelen tener manifestaciones motoras prominentes.
- •
Las demencias frontosubcorticales, propias de los parkinsonismos y la enfermedad isquémica cerebral de pequeño vaso, se caracterizan por bradipsiquia, disfunción ejecutiva y la presencia de alteraciones motoras prominentes desde las fases iniciales.
Las principales causas de demencia pueden clasificarse en dos grandes grupos (tabla 1):
- •
Las demencias primarias, idiopáticas o degenerativas representan el grupo dominante en nuestro entorno. Estos procesos se caracterizan por un curso lentamente progresivo y la presencia de depósitos cerebrales de proteínas anormalmente plegadas. La mayoría de los casos son esporádicos, pero pueden tener un origen genético autosómico dominante. Las demencias degenerativas más frecuentes son la EA, la demencia con cuerpos de Lewy (DCL) y la degeneración frontotemporal.
- •
Las demencias secundarias ocurren como consecuencia de patologías neurológicas estructurales o enfermedades sistémicas específicas. La entidad más frecuente en este grupo es la demencia vascular. Otras causas importantes incluyen la hidrocefalia normotensiva, el hipotiroidismo y el déficit de vitamina B12. La identificación de estos procesos permite iniciar un tratamiento específico y, en algunos casos, estabilizar o revertir el deterioro cognitivo.
Clasificación etiológica de las demencias. Se indican las causas principales de cada categoría
| 1. Enfermedades degenerativas: |
| • Demencia como manifestación principal: enfermedad de Alzheimer, demencia con cuerpos de Lewy, degeneración frontotemporal |
| • Otras enfermedades degenerativas: enfermedad de Parkinson, otros parkinsonismos, ataxias, epilepsias mioclónicas progresivas |
| 2. Enfermedades cerebrovasculares: |
| • Isquémicas: demencia multiinfarto, demencia por infarto estratégico, enfermedad isquémica de pequeño vaso |
| • Hemorrágicas: angiopatía hipertensiva, angiopatía amiloide, hemorragia subaracnoidea, hematomas subdurales |
| 3. Enfermedades infecciosas: VIH, sífilis, encefalitis víricas, enfermedad de Whipple, abscesos, enfermedad de Creutzfeldt-Jakob. |
| 4. Enfermedades metabólicas: enfermedad de Wilson, enfermedades mitocondriales, enfermedades lisosómicas, leucodistrofias |
| 5. Neoplasias: |
| • Tumores primarios y metastásicos |
| • Síndromes paraneoplásicos |
| 6. Epilepsias: epilepsias mioclónicas progresivas, epilepsias resistentes al tratamiento, estatus epiléptico |
| 7. Enfermedades desmielinizantes: esclerosis múltiple |
| 8. Enfermedades sistémicas, endocrinas y carenciales: |
| • Hipotiroidismo, hipertiroidismo y encefalitis de Hashimoto |
| • Hipercalcemia y otros trastornos electrolíticos |
| • Hipopituitarismo |
| • Encefalopatía hepática y encefalopatía urémica |
| • Encefalopatía hipóxico-isquémica e insuficiencia respiratoria |
| • Hipoglucemia |
| • Déficit de vitamina B12, encefalopatía de Wernicke y pelagra |
| • Vasculitis, conectivopatías y encefalitis autoinmunitarias asociadas a anticuerpos onconeuronales y antineuropilo |
| 9. Tóxicos: alcohol, drogas, fármacos, metales pesados, monóxido de carbono, solventes orgánicos |
| 10. Enfermedades psiquiátricas: depresión, esquizofrenia, trastornos conversivos |
| 11. Hidrocefalias |
| 12. Traumatismos craneales |
VIH: virus de la inmunodeficiencia humana.
Aunque las causas de demencia suelen describirse de forma independiente, en las series de autopsias se observa que la mayoría de los pacientes presentan una combinación de patologías, incluyendo lesiones degenerativas tipo Alzheimer y lesiones vasculares.
Valoración general de los pacientes con demenciaLa valoración de un paciente con síntomas cognitivos o conductuales se inicia con la anamnesis. En estos casos resulta esencial obtener información adicional de algún familiar. Debemos recoger la lista de síntomas y prestar especial atención a su orden de aparición y su rapidez de desarrollo.
La exploración neurológica debe incluir, aparte de los componentes habituales, un análisis detallado del estado mental9. Deben explorarse de forma ordenada el nivel de conciencia, la atención, la orientación, la memoria reciente y remota, el lenguaje, el reconocimiento visual, la ejecución de actos motores, la capacidad de abstracción, las habilidades constructivas y las funciones ejecutivas. También debemos investigar en todos los casos el estado de ánimo y la capacidad funcional de los pacientes. Para facilitar la recogida sistemática de esta información conviene utilizar escalas y cuestionarios validados. Las herramientas en concreto dependerán en gran medida del ámbito clínico (p. ej., atención primaria, unidad de memoria) y la población de referencia (p. ej., bajo nivel educativo). Los test más empleados, en diversas combinaciones, incluyen: Mini Mental State Examination (MMSE), Montreal Cognitive Assessment (MoCA), test de recuerdo selectivo (Buschke), escala de memoria de Weschler (WMS-III), fluencia categorial (animales) y fonológica (letra “p”), Trail Making Test (partes A y B), test del reloj, test de rastreo visual (Mesulam), escala de depresión geriátrica (GDS-15), test del informador (SS-IQCODE) y cuestionario de actividades funcionales (FAQ).
En cuanto a las exploraciones complementarias, los estudios esenciales incluyen1,2:
- •
Análisis de sangre: hemograma, velocidad de sedimentación globular, bioquímica general y niveles de vitamina B12, ácido fólico y TSH.
- •
Una prueba de imagen cerebral, preferiblemente resonancia magnética (RM).
En el estudio inicial de un paciente con demencia, el papel clásico de la neuroimagen es detectar formas secundarias de demencia, especialmente las causas potencialmente tratables. Los casos más frecuentes incluyen la hidrocefalia del adulto (“hidrocefalia normotensiva”), el hematoma subdural crónico y algunos tumores, especialmente los de crecimiento lento, como los meningiomas.
El resto de exploraciones se realizarán en casos seleccionados, dependiendo de la sospecha clínica y su disponibilidad: análisis inmunológicos y microbiológicos en sangre y líquido cefalorraquídeo (LCR), cuantificación de Aβ-42, tau y tau fosforilada en LCR, electroencefalograma, análisis genéticos, tomografía por emisión de positrones (PET) cerebral (fluorodesoxiglucosa [FDG], ioflupano, marcadores de amiloide) y otros estudios dirigidos a descartar procesos sistémicos (p. ej., neoplasias ocultas).
Hallazgos de imagen en las principales causas de demenciaEnfermedad de AlzheimerLa EA es la causa más frecuente de demencia en los países occidentales, donde representa el 60% de todos los casos10,11. Las lesiones anatomopatológicas características incluyen las placas seniles, compuestas de péptido beta-amiloide (Aβ), y los ovillos neurofibrilares, constituidos por proteína tau fosforilada. La mayoría de los casos corresponden a formas esporádicas de inicio tardío (más de 65 años). El alelo 4 de la apolipoproteína E es un factor de riesgo para estas formas tardías. Menos del 5% de los casos corresponden a formas genéticas asociadas a mutaciones dominantes en los genes del precursor de la proteína amiloide (APP), la presenilina 1 o la presenilina 2.
La EA es el prototipo de demencia cortical. Los casos típicos se presentan con una afectación grave de la memoria reciente episódica. Los casos atípicos pueden iniciarse con manifestaciones frontales, alteraciones visuoespaciales (variante posterior) o alteraciones del lenguaje (afasia logopénica).
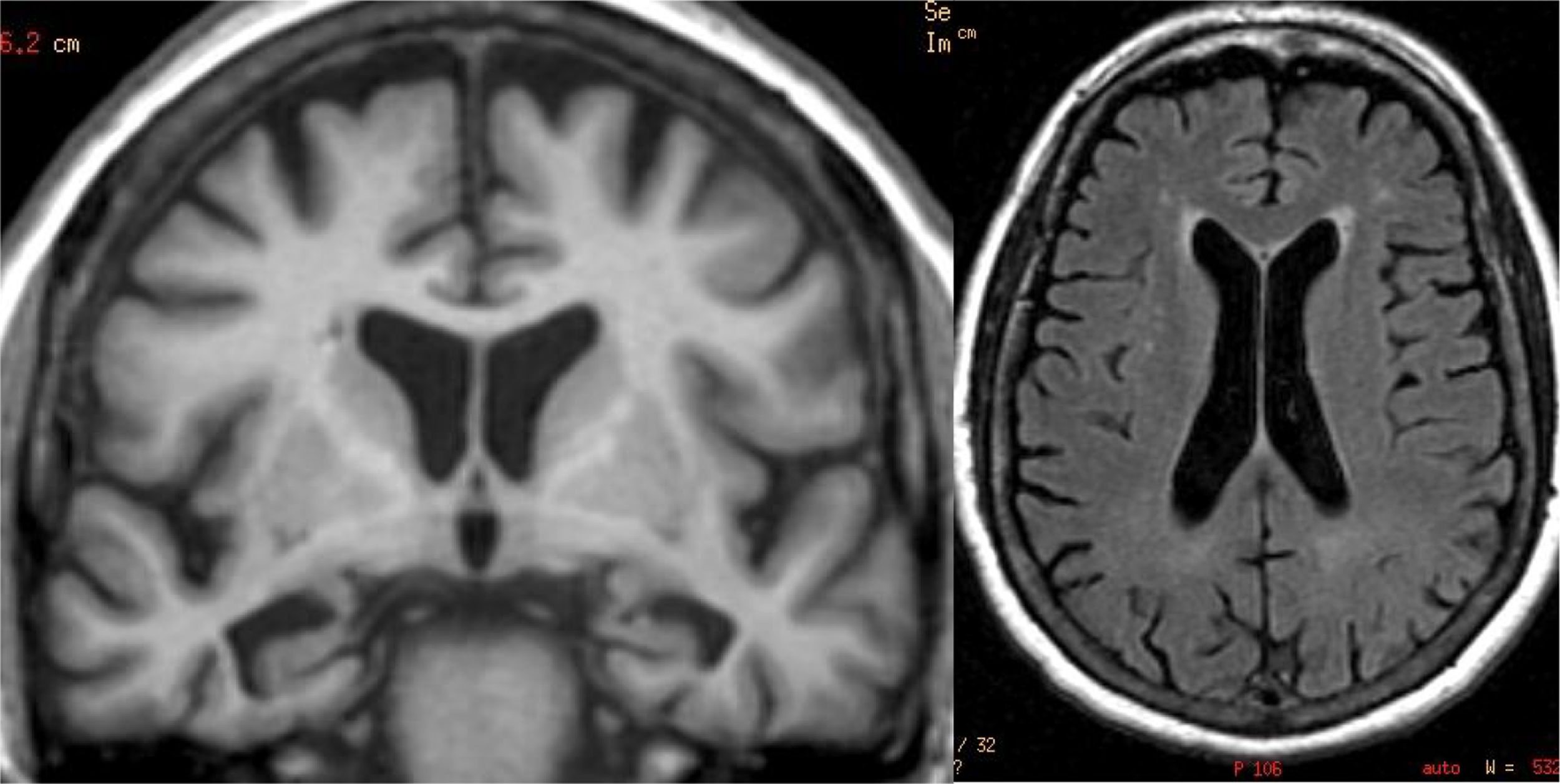
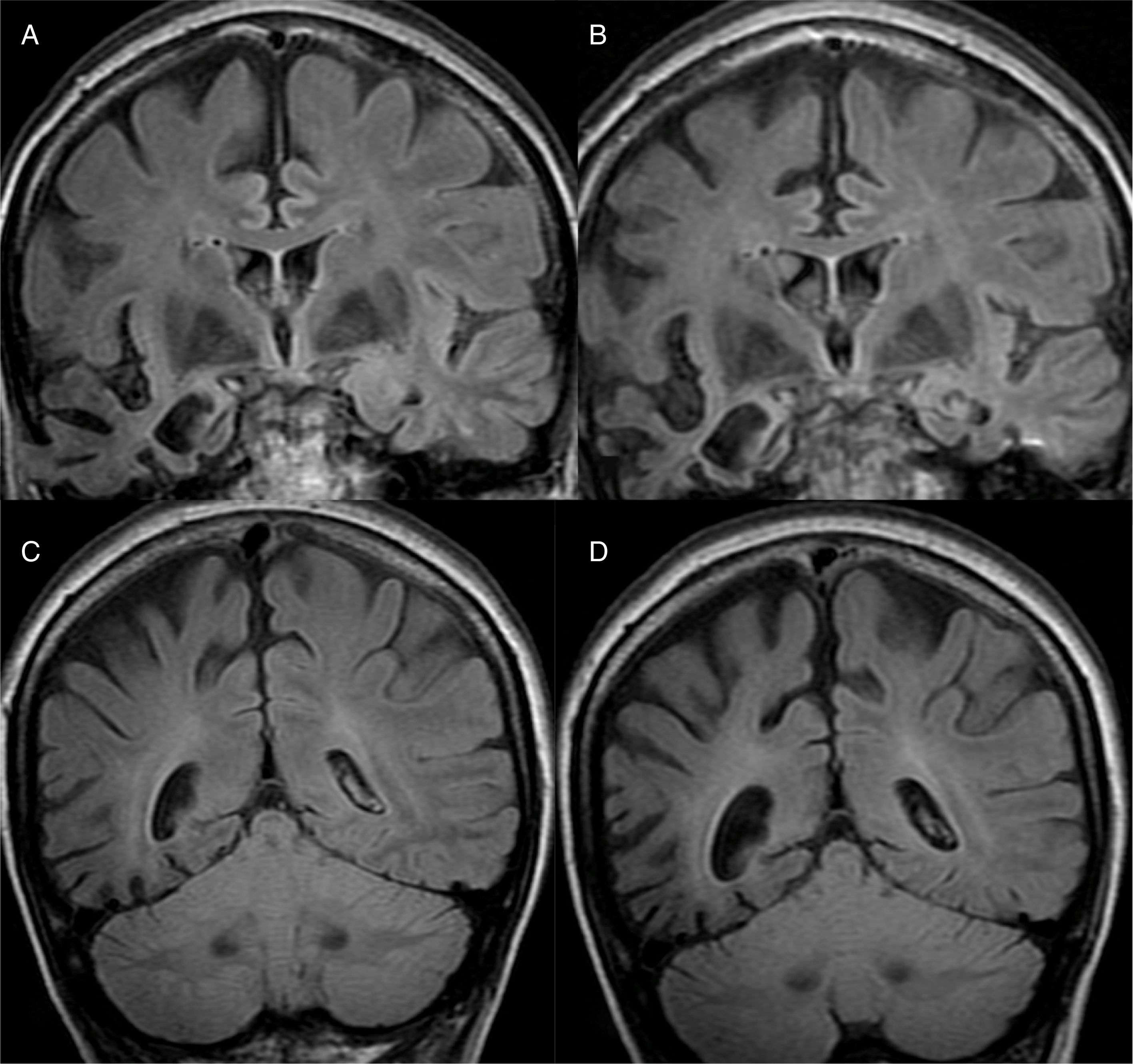
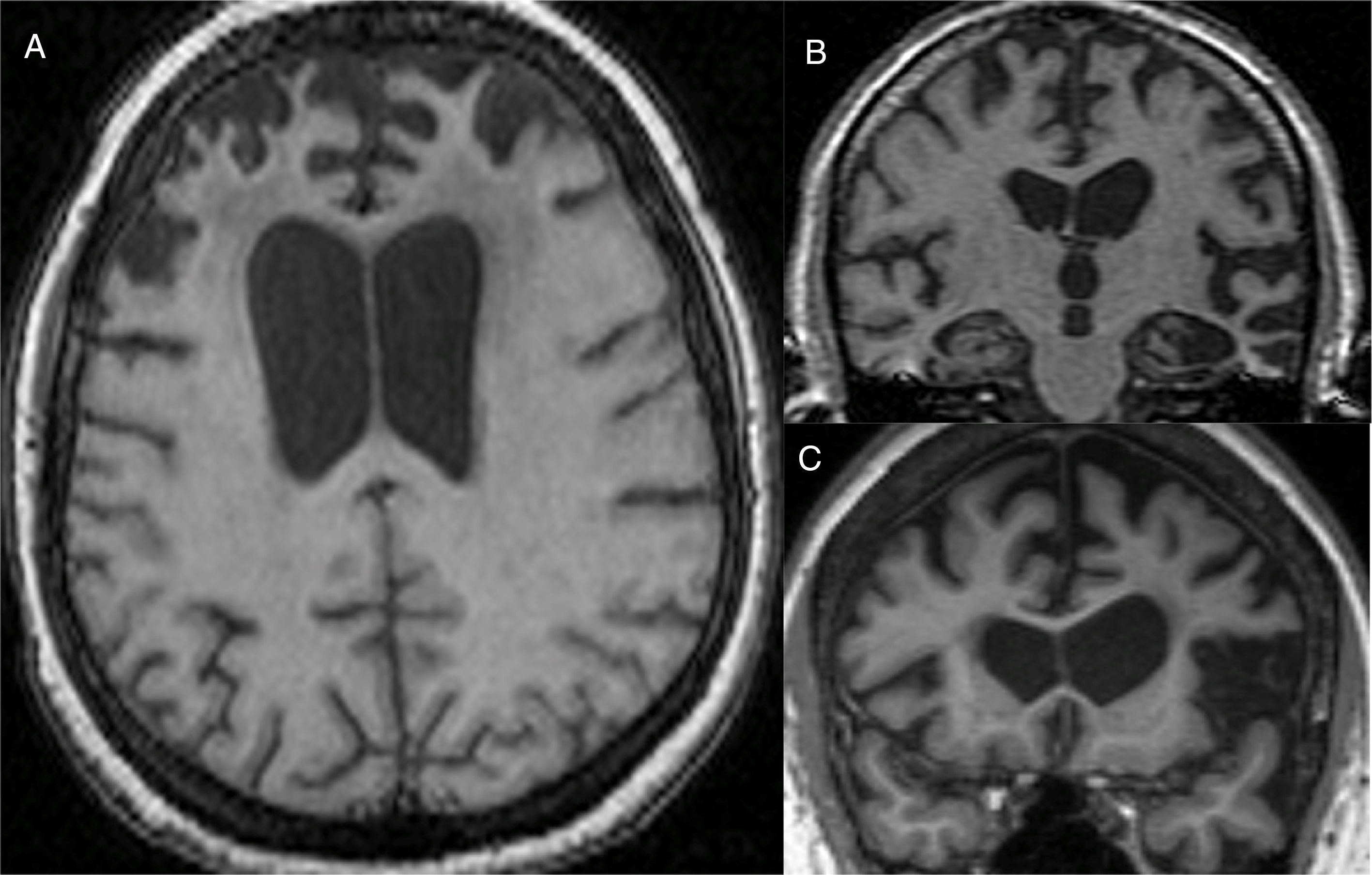
El hallazgo principal en imagen estructural en la EA es la atrofia cerebral de predominio temporal medial (fig. 1). La corteza entorrinal y el hipocampo se afectan precozmente; como el hipocampo es una estructura fácilmente identificable en RM, su atrofia es el principal signo radiológico en la EA12. La afectación temporal en la EA es típicamente simétrica, aunque ocasionalmente puede existir afectación asimétrica, que es más típica en la demencia frontotemporal (DFT). En estos casos es muy útil valorar el llamado gradiente anteroposterior: en la EA, la pérdida de volumen es mayor en el lóbulo parietal que en el frontal (gradiente posterior), mientras que en la DFT la pérdida de volumen predomina en el lóbulo frontal (gradiente de predominio anterior) (fig. 2). Sin embargo, la identificación de atrofia significativa en pacientes de edad avanzada tiene importantes limitaciones debido a que es frecuente la aparición de pérdida de volumen cerebral en individuos asintomáticos en este grupo de edad, incluyendo la región temporal medial13. Por otro lado, aunque los estudios transversales de grupos indican que existen diferencias significativas en el grado de atrofia entre sujetos normales y pacientes con EA, la estimación de atrofia en individuos aislados tiene un valor limitado debido al solapamiento con individuos sanos, especialmente los de edad avanzada. Los estudios longitudinales aumentan la especificidad, ya que la velocidad con la que se produce la pérdida de volumen (especialmente del hipocampo), es significativamente mayor en pacientes con EA, lo que puede ser útil cuando se estudia un solo individuo, ya que el índice anual de atrofia hipocampal puede separar mejor a individuos sanos y pacientes con EA14.
Los estudios funcionales, obtenidos mediante tomografía por emisión de fotón único (SPECT) o PET y, más recientemente mediante RM, con secuencias de perfusión con marcado de spines (ASL), pueden demostrar hipofunción cortical en pacientes con neurodegeneración. En la EA pueden observarse alteraciones funcionales en estadios precoces, mientras que los individuos sanos muestran casi siempre un patrón de función cortical normal, por lo que, en un paciente con demencia, un estudio funcional negativo hace muy poco probable una enfermedad neurodegenerativa y deben considerarse otras causas de demencia. Además, los nuevos radiofármacos para la PET permiten detectar depósitos patológicos de amiloide en la corteza cerebral; los sujetos sanos menores de 65 años presentan estudios de PET con marcador de amiloide negativos en más del 80% de los casos, mientras que es excepcional un estudio negativo en pacientes con EA. La principal limitación de estos estudios es que los sujetos mayores de 85 años presentan hasta un 50% de PET de amiloide positivos, por lo que el mayor potencial de esta prueba en edades avanzadas es el valor predictivo negativo.
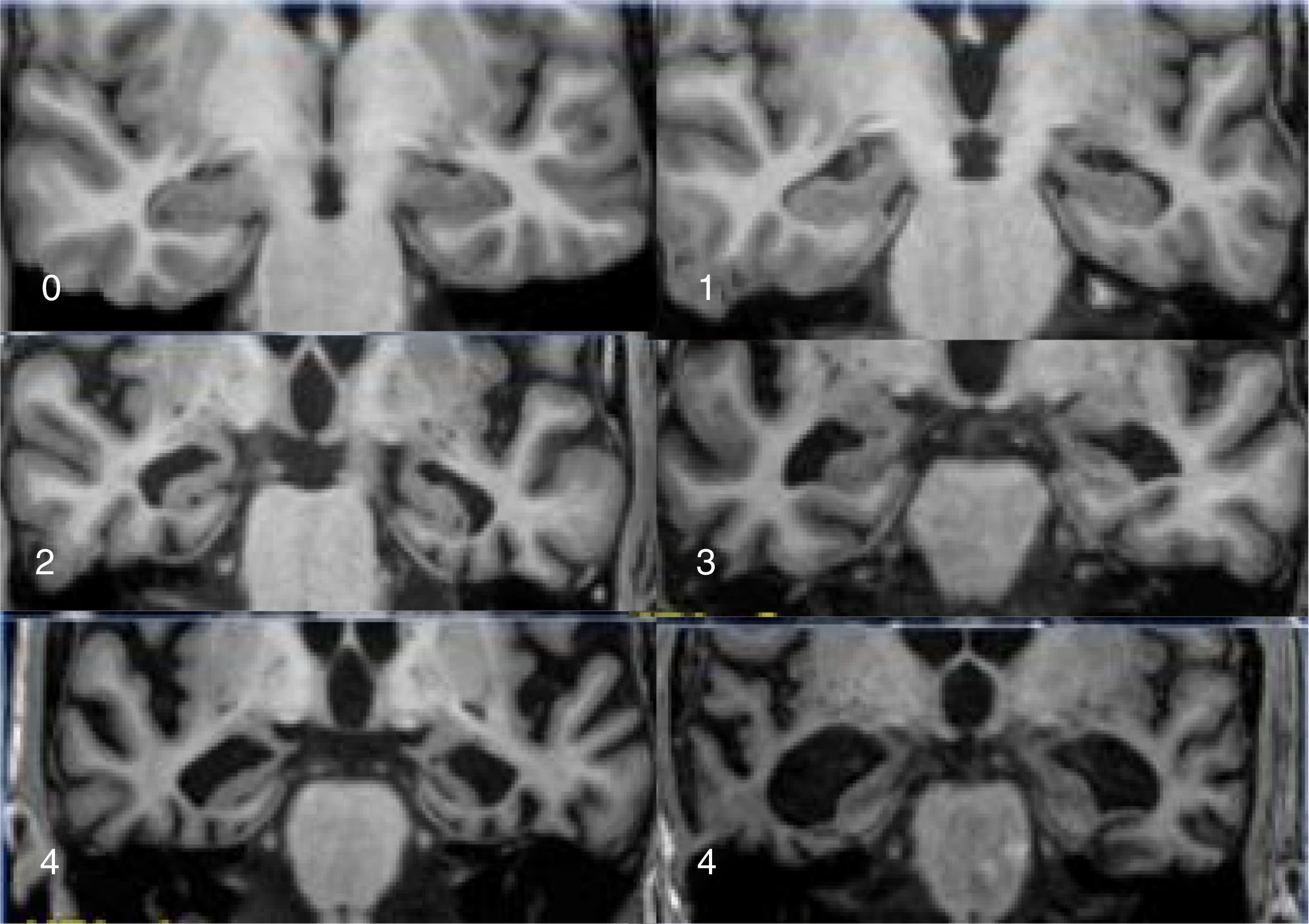
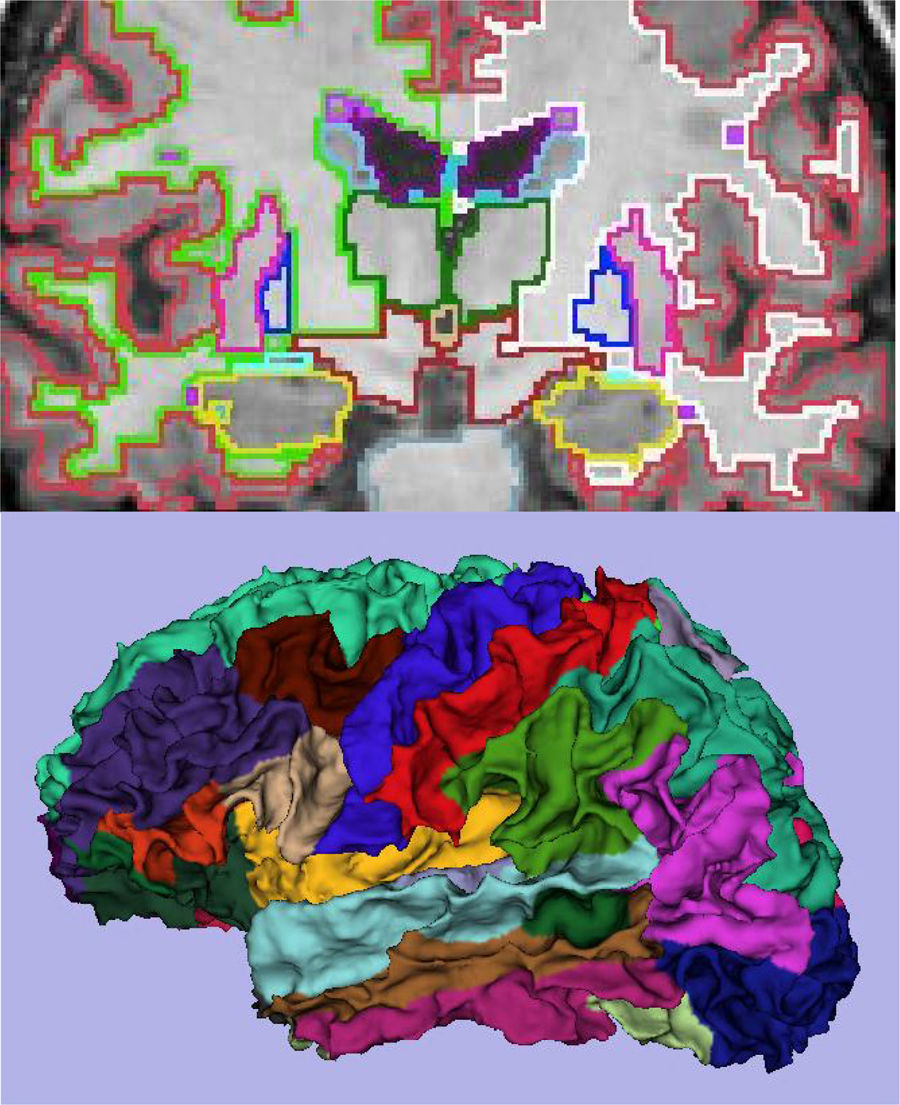
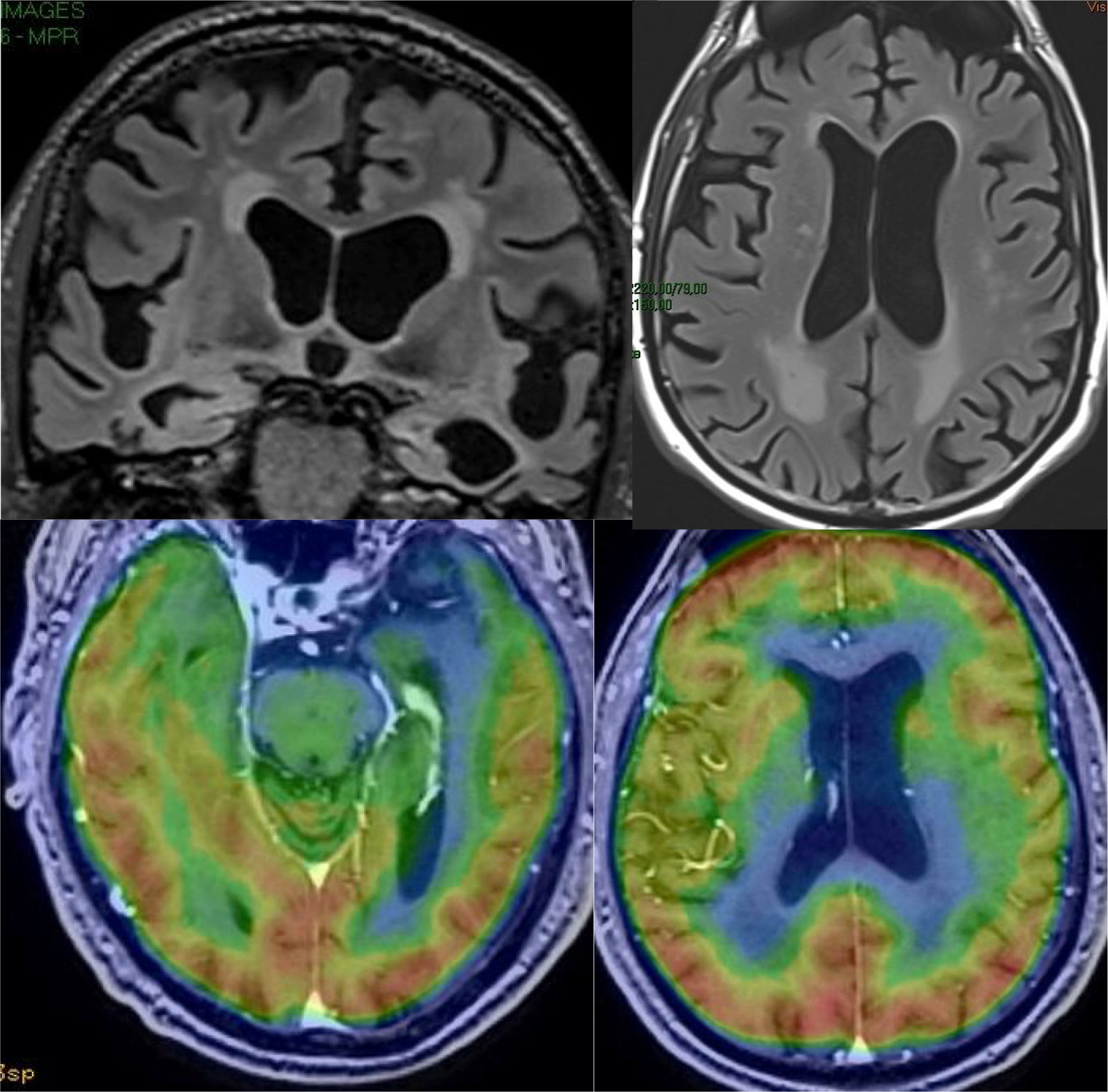
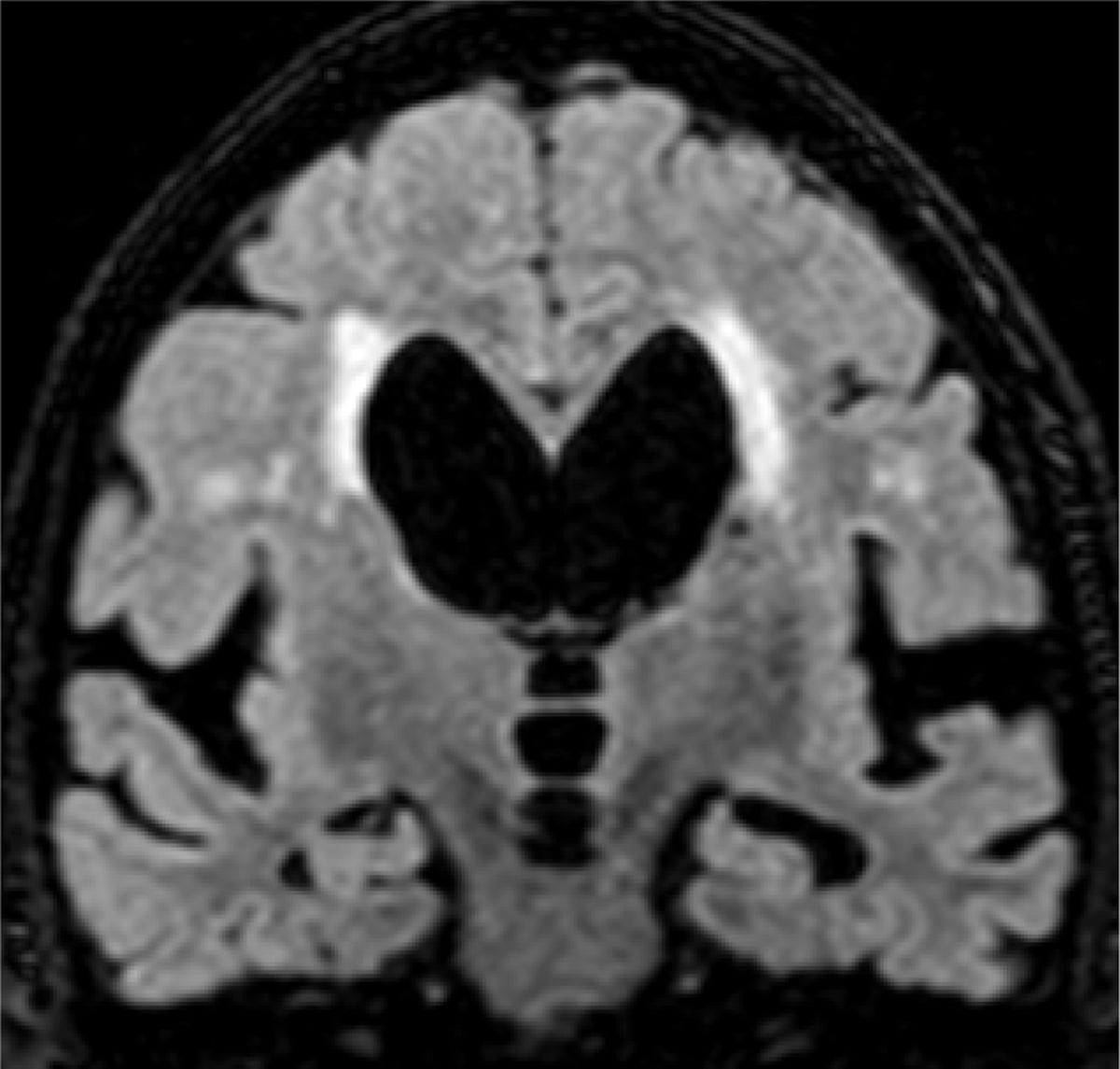
El principal marcador de neurodegeneración con RM es la atrofia del hipocampo, que suele ser de un 20-25% en sujetos con EA y de un 10-15% en sujetos con deterioro cognitivo leve13. Para la estimación cualitativa de la atrofia del hipocampo, la escala más empleada es la de Scheltens, que valora la morfología de la cisura coroidea, el asta temporal y el propio hipocampo y elabora un sistema de puntuación en ambos lados de 0 a 4 (fig. 3)15. La volumetría con RM permite calcular volúmenes de estructuras corticales y subcorticales, así como el espesor cortical (fig. 4)16, lo que mejora la estimación de la atrofia, especialmente del hipocampo, y además se puede medir con precisión el índice anual de atrofia. La atrofia del hipocampo también se observa en otras enfermedades, incluida la demencia relacionada con lesiones vasculares. La atrofia de otras estructuras, como la precuña y la región posterior de la circunvolución del cíngulo, es más específica de la EA, por lo que puede ser útil añadir estas medidas a la del propio hipocampo17. Las medidas de espesor cortical son muy sensibles a pequeños cambios, pero se emplean más en estudios de grupos, por lo que su utilización en la clínica tiene menos potencial que los cálculos de volumen. Actualmente existen programas validados que calculan de forma automática el volumen del hipocampo y estiman la desviación respecto a las medidas normales de cada rango de edad.
El diagnóstico definitivo de EA requiere la demostración en anatomía patológica (AP) de placas neuríticas y anillos neurofibrilares. Sin embargo, el creciente interés en el diagnóstico precoz ha propiciado el desarrollo de biomarcadores que aumenten la fiabilidad del diagnóstico de probable EA. Actualmente, se admite el diagnóstico de probable EA en pacientes sin demencia. Dentro de los nuevos criterios diagnósticos, se considera el estadio prodrómico de EA cuando existe pérdida de memoria junto con biomarcadores positivos. Se admiten como biomarcadores validados tanto los que detectan depósito de amiloide (mediante PET o análisis del LCR), relacionados con la fisiopatología de la EA, como los relacionados con neurodegeneración, detectando alteración funcional (PET-FDG) o atrofia del hipocampo (RM). No obstante, la principal aplicación de estos nuevos criterios es la investigación y el desarrollo de nuevos tratamientos, mientras no se disponga de terapias que modifiquen el curso de la enfermedad.
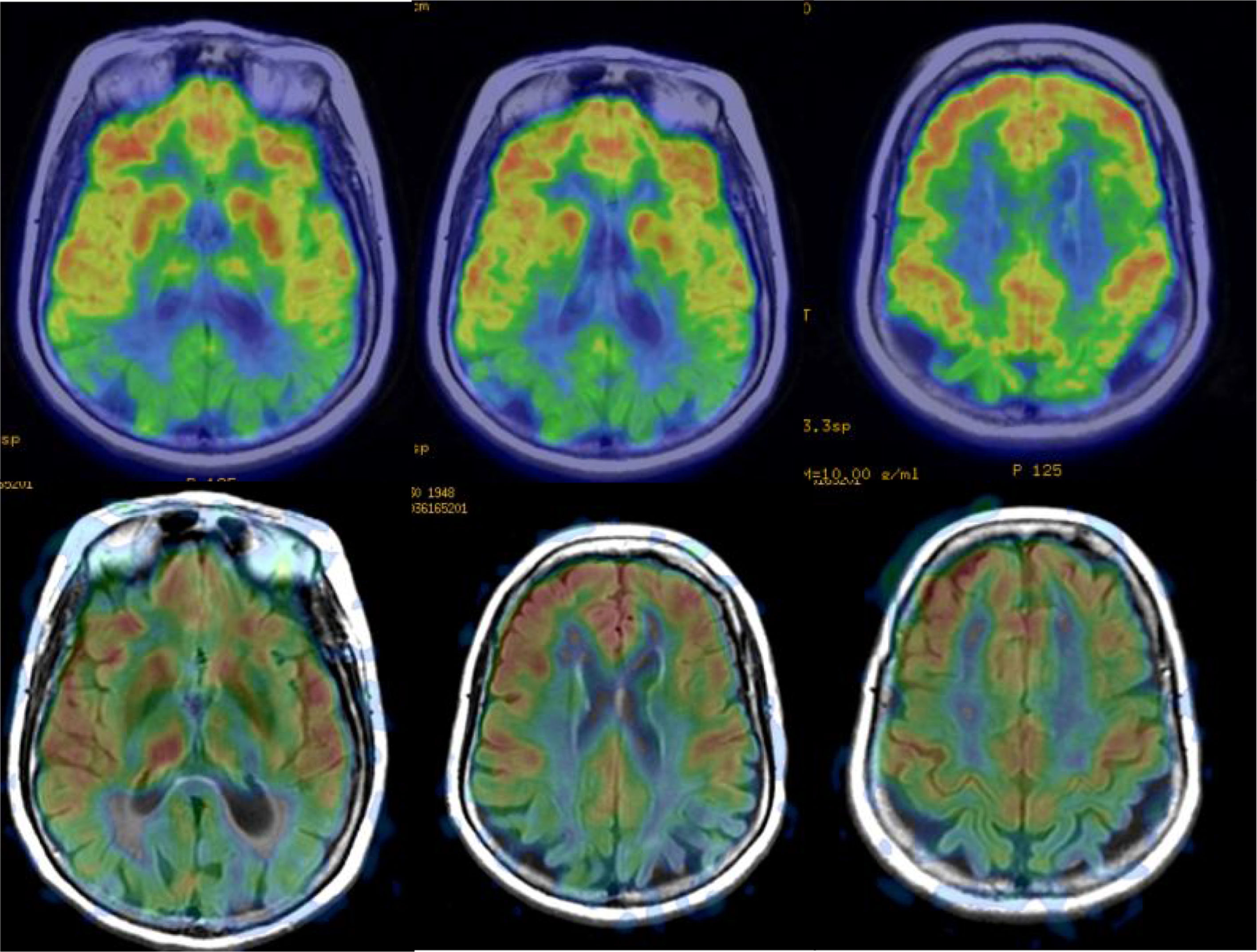
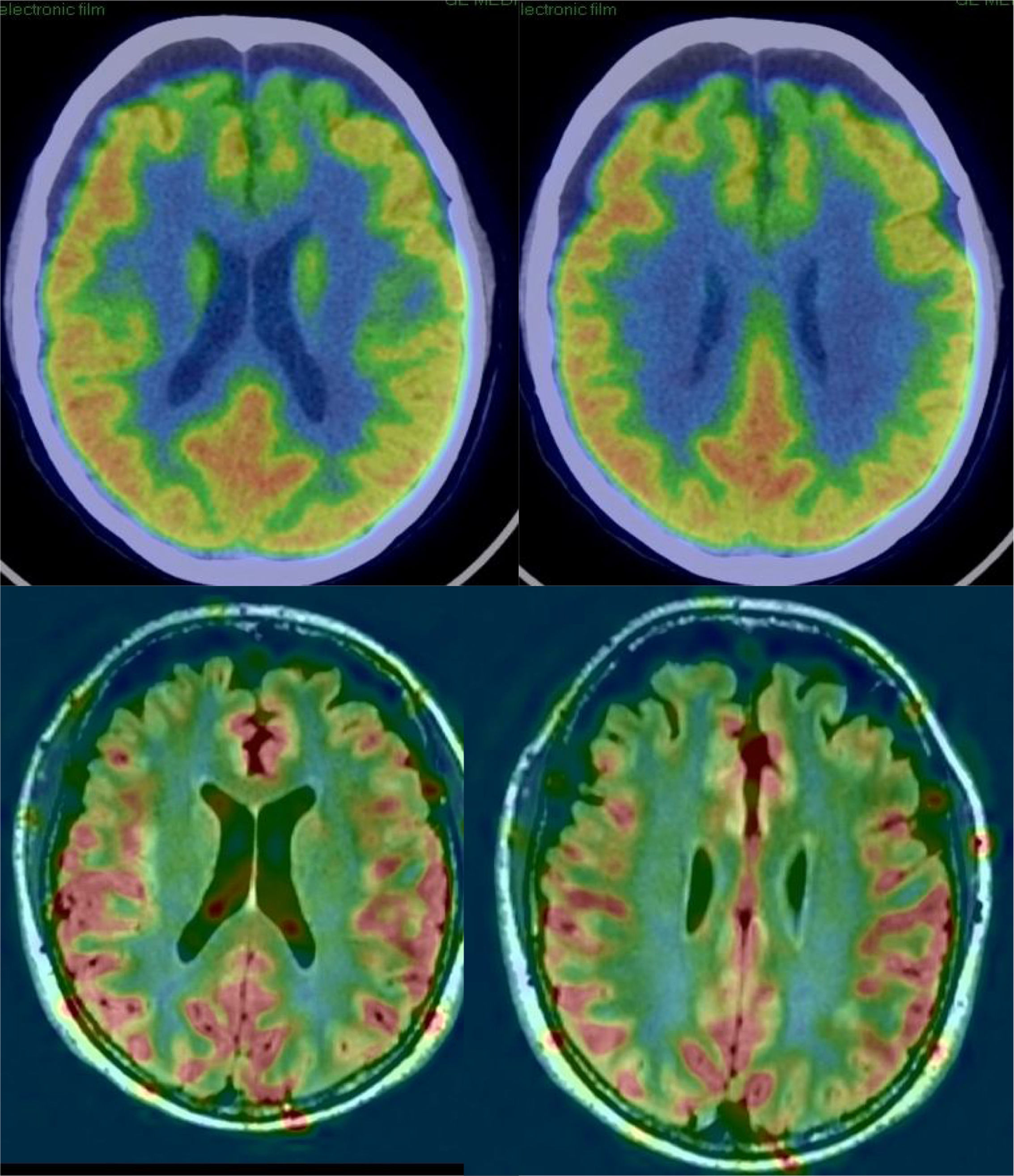
En la EA, los estudios realizados con PET-FDG muestran frecuentemente un patrón característico de hipometabolismo en la corteza temporoparietal lateral, precuña y en la región posterior de la circunvolución del cíngulo, así como en región temporal medial (fig. 5). Los lóbulos frontales no se ven afectados hasta fases tardías de la enfermedad, y no hay afectación de núcleos basales y corteza primaria salvo en fases muy tardías o fenotipos atípicos, que son infrecuentes. En fases precoces, el signo más fiable es el hipometabolismo en la región posterior de la circunvolución del cíngulo18,19, aunque también se observan cambios sutiles en las otras localizaciones. Se ha considerado que estos cambios funcionales se producen antes que la pérdida de volumen, pero estudios recientes demuestran que ambas alteraciones se producen simultáneamente20.
Los estudios de perfusión con RM inicialmente no han dado buenos resultados en las enfermedades neurodegenerativas, debido a que las técnicas habituales (dynamic susceptibility contrast [DSC] y dynamic contrast enhanced [DCE]) que emplean una inyección de contraste son poco sensibles a los cambios de flujo relacionados con la función cerebral. Más recientemente, la secuencia ASL, que no precisa inyección de contraste y puede cuantificar el flujo sanguíneo regional, ha demostrado mucha mayor sensibilidad (fig. 5), con resultados similares a las técnicas de medicina nuclear21. La secuencia ASL tiene el inconveniente de ser muy sensible a los artefactos por movimiento, pero puede ser un complemento muy útil a la RM estructural, aunque es necesario mejorar la estandarización de las medidas y validar clínicamente los resultados en series con mayor número de sujetos.
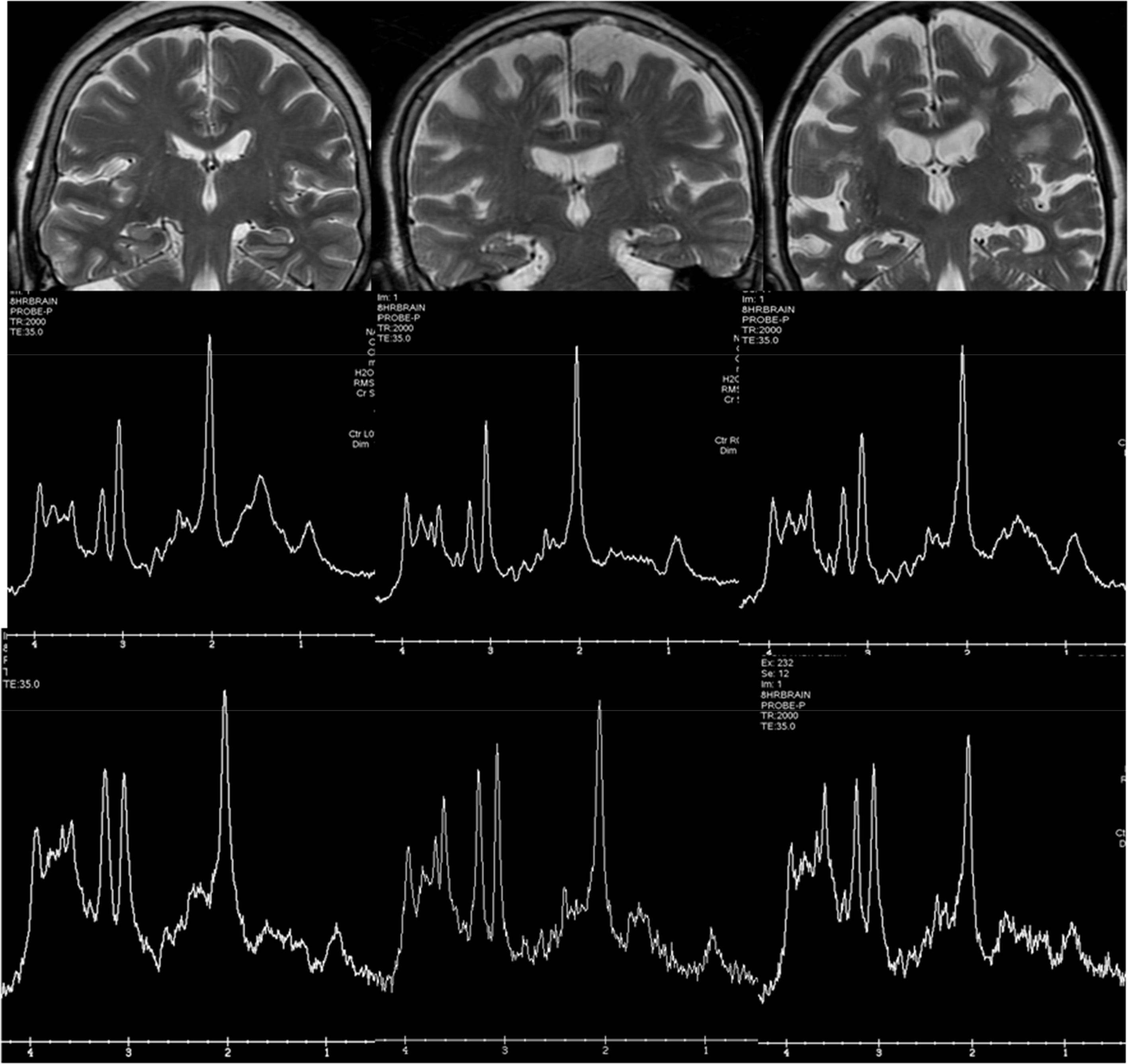
La espectroscopia ha sido muy utilizada en investigación antes del desarrollo de otras técnicas de RM, ya que la EA presenta un patrón característico, con disminución del pico de N-acetil aspartato (NAA) y aumento del pico de mioinositol (fig. 6). Sin embargo, las medidas de espectroscopia presentan cierta variabilidad, que en la región temporal medial es mucho mayor debido a la presencia del hueso de la base del cráneo y del aire de los senos paranasales, por lo que su uso clínico en demencia es escaso.
Ejemplos de espectroscopia de hidrógeno localizados en precuña (fila central) e hipocampo (fila inferior). En la columna izquierda se trata de un sujeto normal. La columna central corresponde a un paciente con demencia con cuerpos de Lewy y la derecha a un paciente con enfermedad de Alzheimer. El aumento del Mi y la disminución de NAA son más prominentes en el hipocampo, aunque la calidad del espectro es más baja.
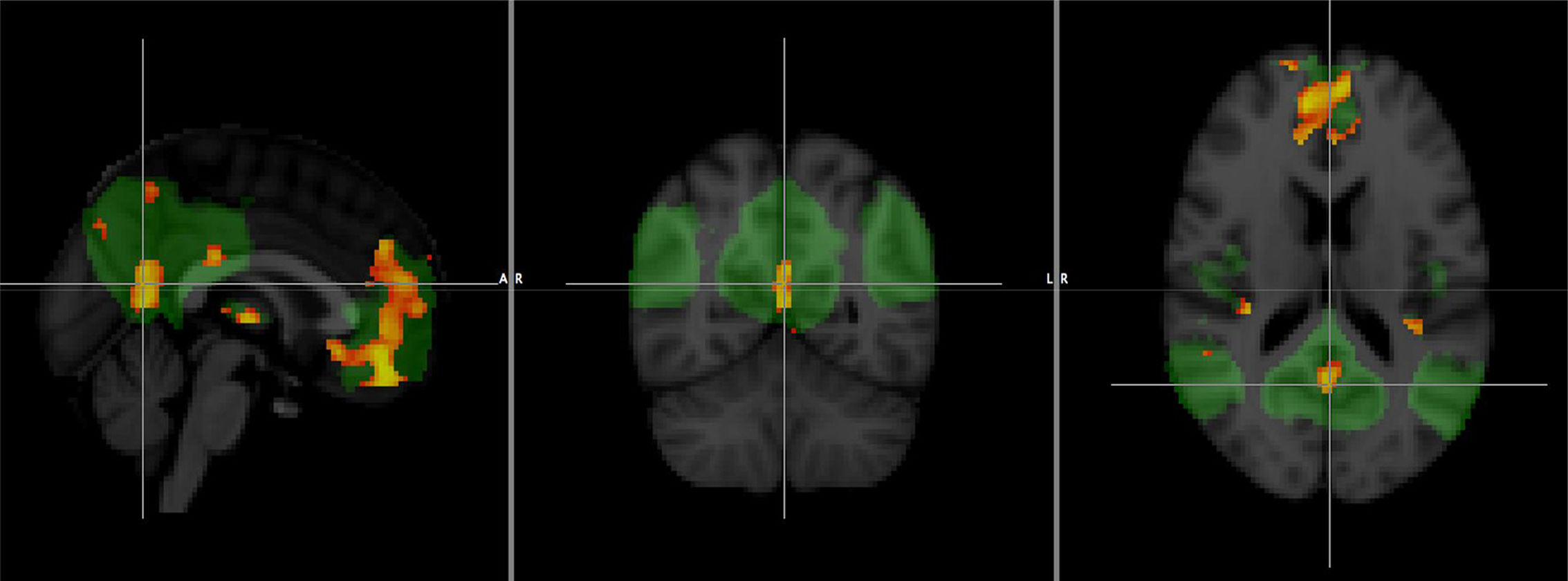
Otras técnicas, como la RM funcional y la diffusion tensor imaging (DTI), están ofreciendo resultados prometedores, aunque su menor accesibilidad, así como la mayor dificultad técnica y sobre todo la falta de estandarización, hacen que su uso en la actualidad esté restringido al ámbito de la investigación. La RM funcional en reposo permite estudiar la conectividad en las redes cerebrales y se ha demostrado que los cambios en la red por defecto pueden observarse incluso en fase preclínica (fig. 7), por lo que en el futuro podría ser muy útil en estudios de cribado22.
Comparación de un grupo de pacientes con enfermedad de Alzheimer y otro sano en valor de conectividad funcional en la red por defecto obtenida mediante resonancia magnética funcional en reposo. Las áreas en naranja se corresponden con disminución significativa (p <0,001) en el grupo con enfermedad de Alzheimer.
La DFT incluye una serie de procesos degenerativos caracterizados por una afectación predominante de las regiones cerebrales anteriores23. En nuestro medio representa el 10% de los casos de demencia, y es más frecuente en las formas de inicio presenil (menores de 65 años). Alrededor del 50% de los casos cursan con una acumulación cerebral de proteína tau. El resto de casos presenta depósitos de otras proteínas, como TDP-43. Se estima que un 40% de los casos de DFT tienen un origen genético autosómico dominante. Los principales genes implicados son MAPT, GRN, C9orf72, FUS, CHMP2B, TARDBP y VCP.
La presentación clínica suele corresponder a uno de estos tres síndromes:
- •
La demencia frontal o variante conductual se asocia a atrofia de predominio frontal y cursa con una combinación variable de apatía, desinhibición, falta de introspección y disfunción ejecutiva.
- •
En la afasia progresiva no fluente, la atrofia se centra en áreas perisilvianas izquierdas y cursa con un trastorno del lenguaje de predominio expresivo. Estos casos suelen asociarse a depósitos de tau.
- •
La demencia semántica se caracteriza por una atrofia predominante del lóbulo temporal izquierdo y cursa con una pérdida progresiva del conocimiento de los significados de las palabras. En las fases iniciales, los pacientes suelen tener un lenguaje fluente, incluso verborreico, pero con escaso contenido y abundantes circunloquios. La patología subyacente suele consistir en depósitos de TDP-43.
Los hallazgos en imagen también varían dependiendo del síndrome clínico24, aunque el patrón más habitual es la atrofia frontotemporal, que suele ser asimétrica. Además, en la DFT puede verse alteración de señal en la sustancia blanca (fig. 8). Los patrones de atrofia suelen corresponderse con los subtipos clínicos (fig. 9) y muestran correlación con el subtipo patológico, aunque puede haber variaciones individuales25. Los estudios funcionales muestran hipofunción, relacionada con la neurodegeneración, que suele coincidir con zonas de mayor pérdida de volumen, con la ventaja de que la sensibilidad de los estudios funcionales es mayor en los estadios precoces26–28 (fig. 10). En algunos casos, los pacientes con DFT pueden presentar un patrón funcional similar a la EA, aunque casi siempre existe además hipofunción frontal, que es excepcional en la EA hasta los estadios avanzados (fig. 11). Los estudios de perfusión con ASL se correlacionan con los estudios con PET-FDG, aunque existe menos experiencia que en la EA21. Los marcadores de amiloide son negativos en estos pacientes (salvo si existe comorbilidad con EA)29, lo que puede ser muy útil para el diagnóstico diferencial en casos dudosos, especialmente en las formas de afectación temporal.
La DCL representa alrededor del 20% de todos los casos de demencia y se caracteriza por la presencia de cuerpos de Lewy corticales y subcorticales constituidos por la proteína α-sinucleína30. La mayoría de los casos son esporádicos. El diagnóstico clínico requiere la presencia de una demencia, que suele ser de predominio disejecutivo y visuoespacial, y una combinación variable de parkinsonismo espontáneo, alucinaciones visuales y fluctuaciones graves. Estos pacientes tienen una especial sensibilidad a los neurolépticos clásicos (p. ej., haloperidol).
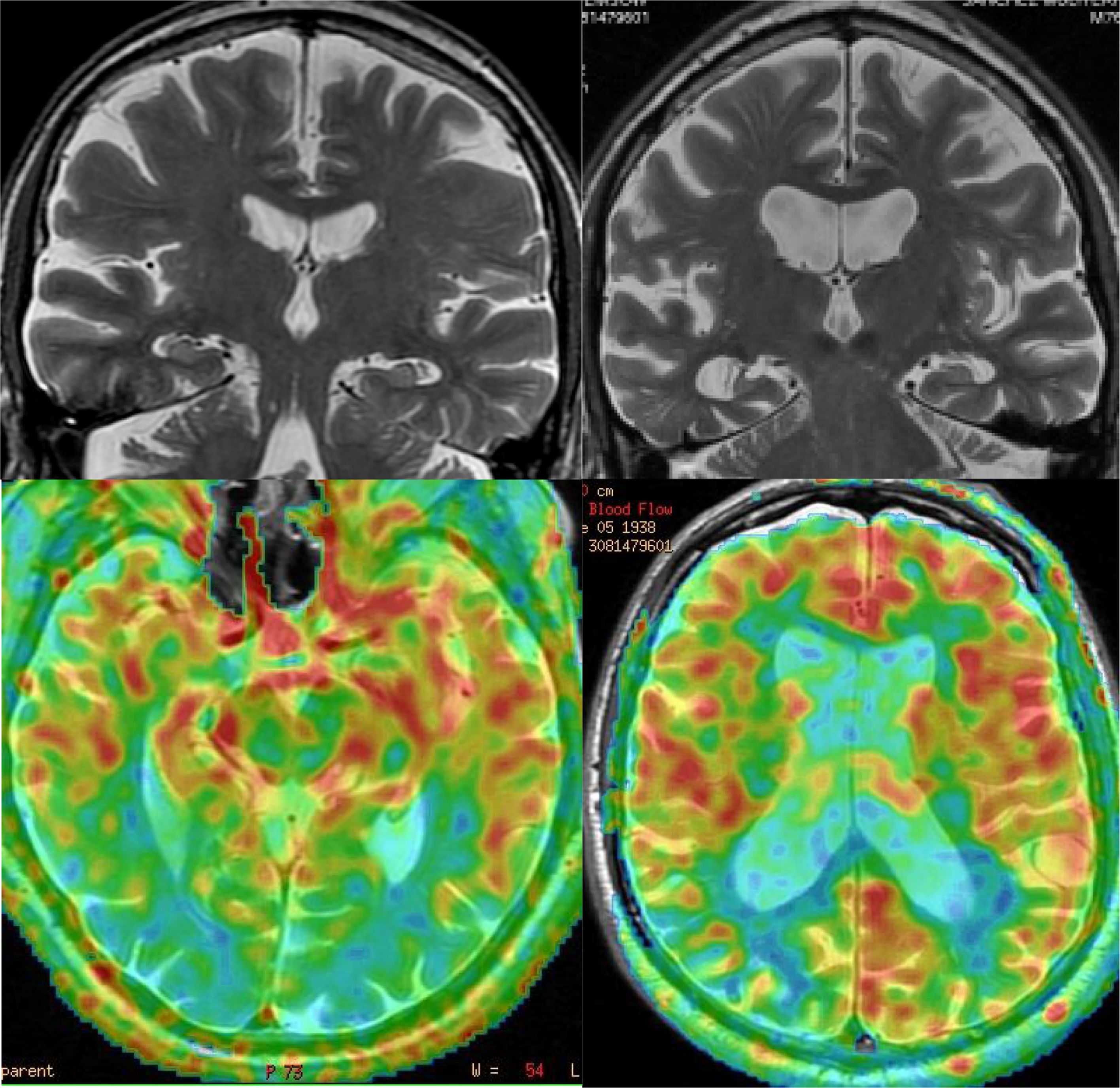
Los hallazgos en RM estructural son poco expresivos. En fases precoces, la RM suele ser normal y posteriormente puede presentarse atrofia, que tiende a tener una distribución difusa, por lo que los hallazgos no son específicos31. Se ha atribuido la existencia de atrofia a comorbilidad con EA, ya que estudios con sujetos con DCL, pero sin EA, no han mostrado pérdida de volumen significativa31. No obstante, en un paciente con demencia e hipocampos normales debe pensarse en esta posibilidad, ya que es una causa de demencia relativamente frecuente: la tercera, después de la EA y la demencia vascular. Los estudios funcionales son muy útiles en estos casos, ya que la DCL presenta de forma característica hipofunción occipital (fig. 11), además de otras áreas comunes con EA, mientras que en la EA es muy infrecuente la afectación funcional de los lóbulos occipitales, salvo en el fenotipo conocido como degeneración cortical posterior (fig. 12). La presencia de hipometabolismo occipital en PET en la DCL tiene una sensibilidad y especificidad del 90%32. La PET con marcadores de amiloide no es útil en el diagnóstico diferencial con EA, ya que la DCL presenta muy frecuentemente estudios positivos con dichos marcadores33. En estos casos están indicados los marcadores dopaminérgicos (p. ej., ioflupano), que muestran disminución de captación en estriados, lo que no se observa en la EA34.
Ejemplos de la utilidad de la perfusión con ASL. En la fila izquierda, paciente con demencia con cuerpos de Lewy, con mínima atrofia difusa, que presenta marcada hipoperfusión occipital bilateral. En la fila derecha, paciente con enfermedad de Alzheimer, que presenta atrofia difusa, sin claro predominio temporal, que sin embargo muestra un patrón típico de hipoperfusión parietal.
Las lesiones vasculares cerebrales causan el 20% de todas las demencias y con frecuencia se asocian a lesiones degenerativas de tipo Alzheimer. El cuadro clínico característico consiste en un déficit focal agudo que precede o acompaña al deterioro cognitivo35. No obstante, hay casos que evolucionan de forma progresiva, simulando una enfermedad degenerativa.
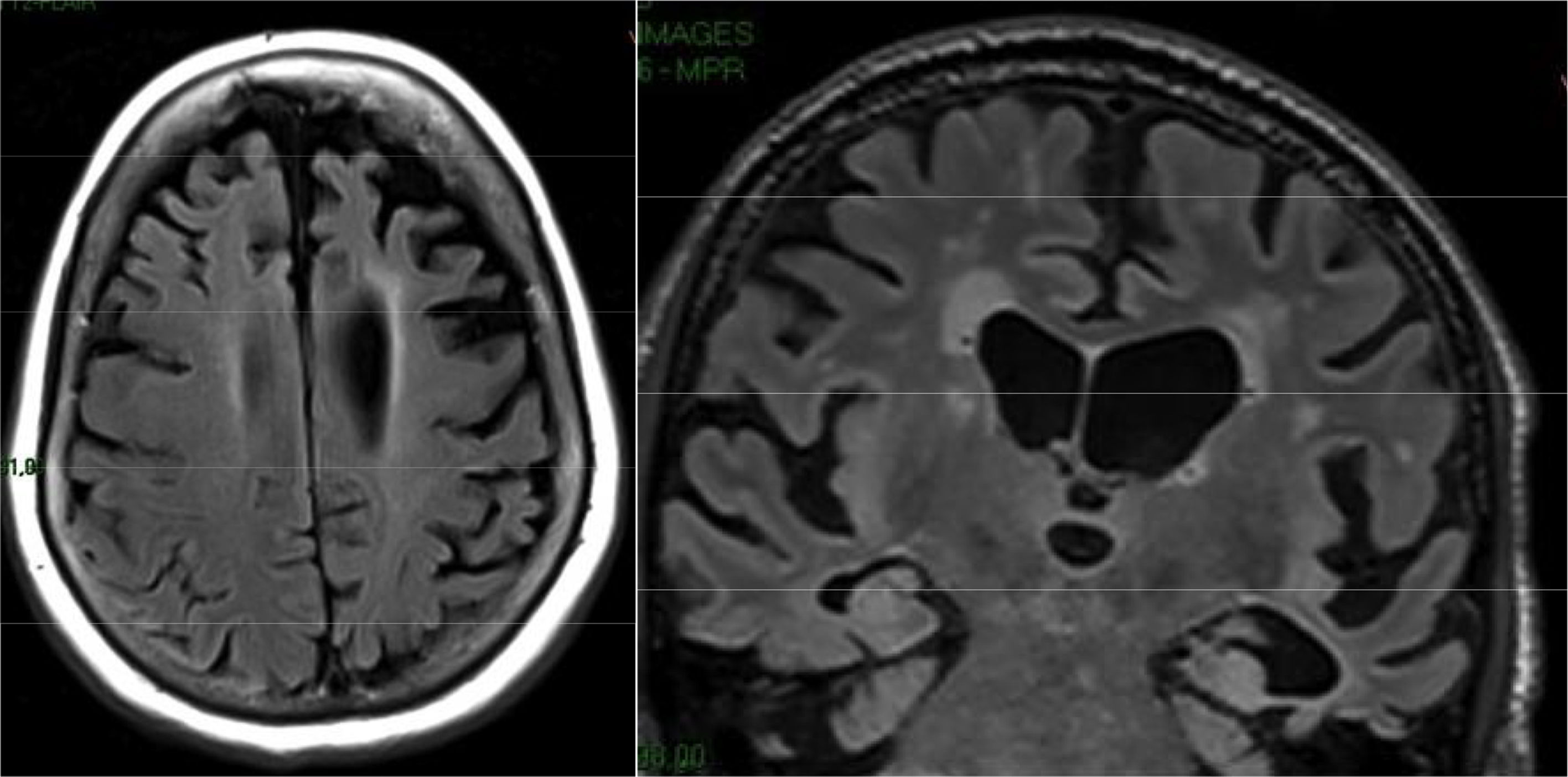
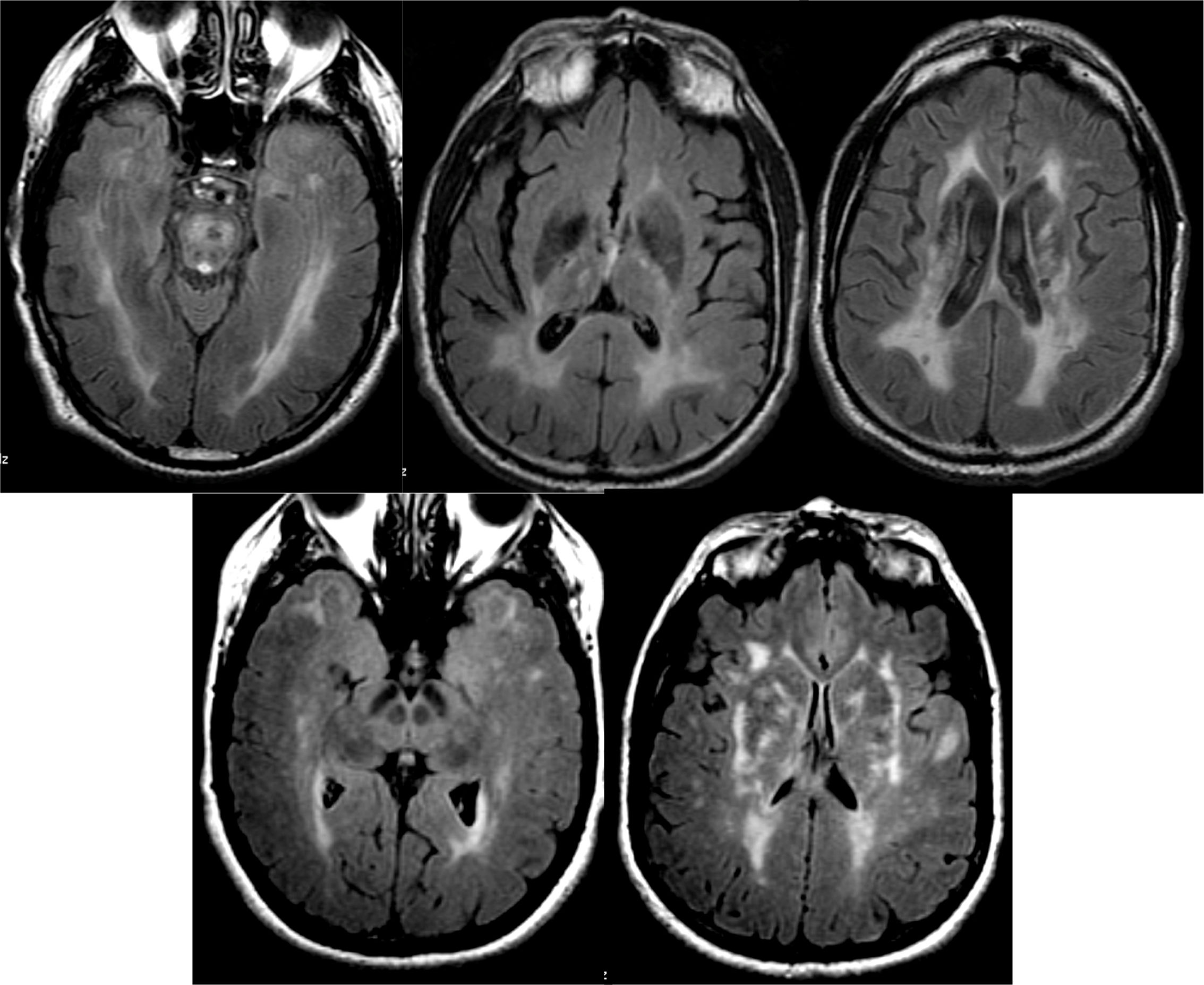
Las lesiones isquémicas pueden corresponder a lesiones de grandes vasos, propias de los infartos territoriales, o lesiones de los pequeños vasos, causantes de los infartos lacunares y la leucoencefalopatía isquémica subcortical. El patrón de afectación incluye típicamente las regiones periventriculares, el área de ganglios basales y la región central de la protuberancia (fig. 13). El grado de deterioro cognitivo suele guardar relación con la extensión de las lesiones, que suele valorarse mediante escalas cualitativas. Una de las más utilizadas es la de Facekas, que establece cuatro grados: 0) ausencia de lesiones, 1) pequeñas lesiones no confluentes, 2) lesiones parcialmente confluentes y 3) afectación difusa periventricular. Se han descrito casos de demencia asociados a lesiones de pequeño tamaño (infartos estratégicos), tales como los infartos lacunares en el territorio de las arterias talámicas paramedianas, los infartos de la rodilla inferior de la cápsula interna, los infartos de la cabeza del núcleo caudado y los infartos bilaterales de los núcleos pálidos. El principal problema diagnóstico es la frecuente coexistencia de la demencia vascular con la EA. En estos casos puede ser útil la realización de estudios funcionales. En los casos de demencia vascular no se observa el patrón típico de EA, sino que es frecuente observar un patrón heterogéneo, dependiendo de las áreas isquémicas, que suelen incluir los ganglios basales, lo que no se observa en la EA36. Cuando se observa el patrón típico de EA debe sospecharse comorbilidad. Las formas hereditarias (CADASIL y la forma recesiva CARASIL) son infrecuentes y suelen presentarse de forma precoz. El patrón de afectación es similar a la leucoencefalopatía isquémica subcortical, con la particularidad de que en las formas hereditarias puede verse frecuentemente afectación de la sustancia blanca de los polos temporales y de la cápsula externa, que no suelen estar presentes en la primera (fig. 13).
Las hemorragias cerebrales se clasifican, dependiendo de su localización, en hemorragias intraparenquimatosas, subaracnoideas, subdurales y epidurales. Las hemorragias intraparenquimatosas profundas suelen tener un origen hipertensivo, mientras que las superficiales no traumáticas, especialmente en las regiones parietooccipitales, suelen depender de una angiopatía amiloide. La angiopatía amiloide merece una mención especial por sus peculiaridades clínico-patológicas37. La mayoría de los casos aparecen de forma esporádica en pacientes ancianos, y en este grupo las lesiones subyacentes consisten en depósitos de péptido Aβ a nivel de las arterias leptomeníngeas y corticales. Las formas hereditarias son raras y suelen presentarse edades inferiores. Las hemorragias subaracnoideas espontáneas suelen ser secundarias a la rotura de aneurismas cerebrales. Las hemorragias subdurales y epidurales tienen un origen traumático en la mayoría de los casos.
Hidrocefalia del adultoEl cuadro clínico característico de esta entidad consiste en la tríada de Hakim: demencia, alteración de la marcha e incontinencia38. El deterioro cognitivo es de tipo frontosubcortical y habitualmente aparece después de la alteración de la marcha. Los casos asociados a hemorragias o procesos inflamatorios previos suelen responder bien al drenaje ventricular. Los casos primarios con frecuencia presentan una respuesta parcial y transitoria. Se sospecha que un porcentaje significativo de estas formas primarias presenta patología vascular o degenerativa subyacente. Frecuentemente se observa prominencia de los ventrículos laterales y del tercer ventrículo, con vacío de señal en el acueducto de Silvio en las secuencias T2 debido al aumento de flujo de LCR. Los estudios de la dinámica del LCR pueden facilitar la selección de los pacientes para cirugía, pero todos ellos tienen falsos positivos y negativos y su utilidad clínica es debatida. Más recientemente, se ha descrito un patrón característico en la RM, con aumento desproporcionado del espacio subaracnoideo en regiones silvianas, asociado a borramiento de los surcos en la convexidad (disproportionately enlarged subarachnoid space hydrocephalus o DESH), que traduce una alteración en el drenaje del LCR hacia la circulación venosa mediada por acuaporinas39,40 (fig. 14).
Enfermedad de Creutzfeldt-JakobLa enfermedad de Creutzfeldt-Jakob es la enfermedad priónica más frecuente41. Su incidencia es de un caso por millón de habitantes y año. La mayoría de los casos aparecen de forma esporádica, pero también puede tener un origen hereditario, en relación con mutaciones en el gen PRNP42, iatrogénico (p. ej., implantes de duramadre, hormona de crecimiento no recombinante) o infeccioso (p. ej., nueva variante). El cuadro clínico característico consiste en una demencia mioclónica rápidamente progresiva. En algunos pacientes se inicia con ataxia o manifestaciones focales (p. ej., variante posterior de Heidenhain). Los casos típicos tienen una supervivencia inferior a un año. Los análisis de sangre y LCR rutinarios suelen ser normales. Los casos típicos suelen mostrar un aumento de los niveles de proteína 14-3-3 en LCR. Recientemente se ha descrito un método analítico, denominado RT QuIC, que aplicado al LCR o epitelio olfatorio alcanza cifras de sensibilidad y especificidad para el diagnóstico de enfermedad de Creutzfeldt-Jakob esporádica cercanas al 100%43.
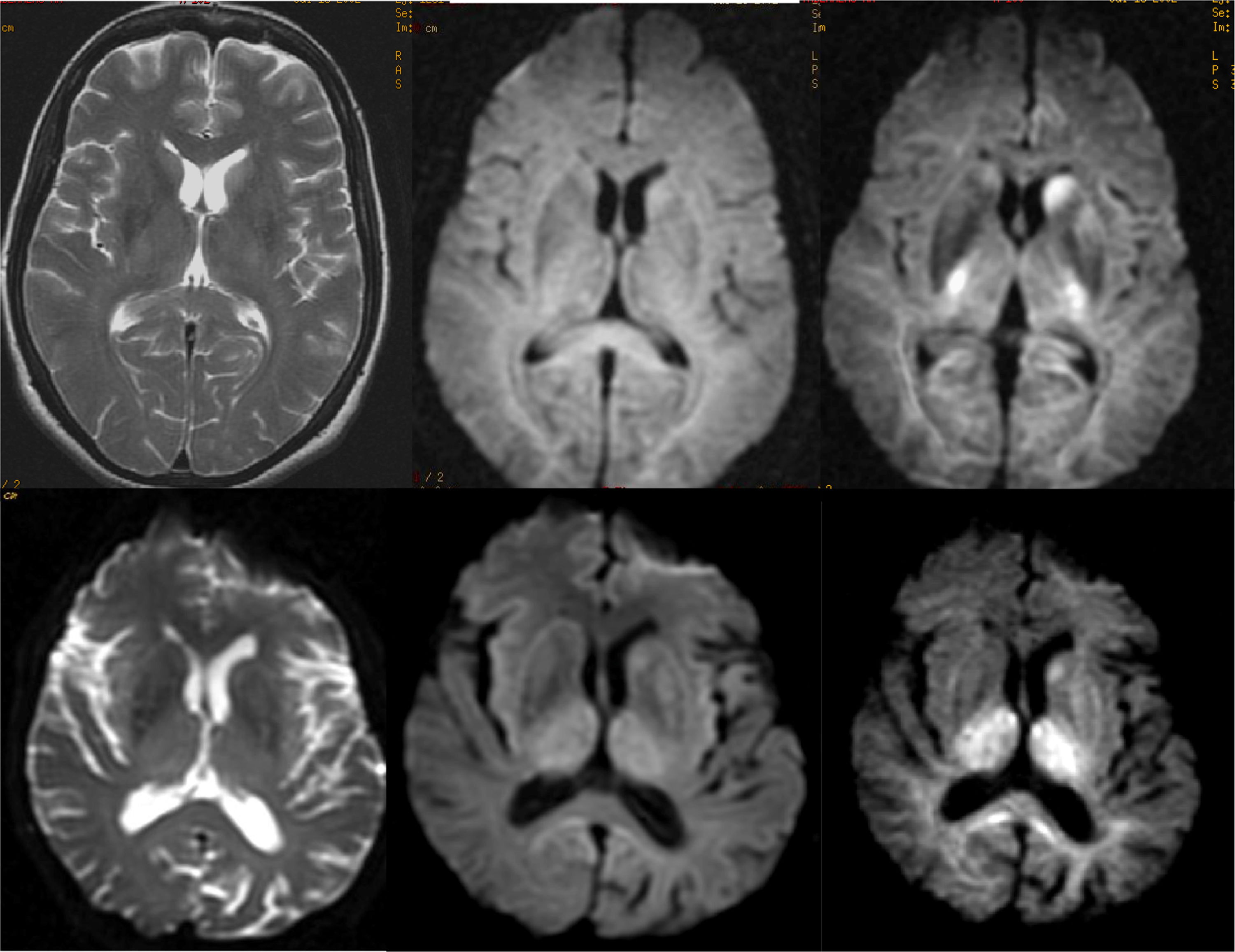
El patrón de imagen característico en la forma esporádica muestra aumento de señal en T2/FLAIR en los estriados, que puede asociar un grado variable de alteración de señal cortical (en algunas formas puede ser la alteración predominante)44. Las secuencias de difusión están especialmente indicadas, ya que presentan precozmente restricción de la difusión en estas localizaciones, incluso en fases precoces en las que aún no se observan alteraciones significativas en las secuencias convencionales. En algunos casos es necesario emplear secuencias de difusión con valores b más altos (2000-3000) para poner de manifiesto estas alteraciones (fig. 15)45.
Enfermedad de Creuzfeldt-Jakob (forma esporádica: fila superior; forma adquirida: fila inferior): utilidad de la difusión con alto valor b. Las alteraciones de señal son difícilmente visibles en las secuencias con valor b de 1000 (columna central), pero se observan claramente con valor b de 3000 (columna derecha).
La prueba de imagen cerebral de elección en la mayoría de los pacientes con deterioro cognitivo es la RM46. En los casos en los que no está disponible o esté contraindicada, se realizará en su lugar una tomografía computarizada cerebral. El protocolo recomendado incluye una secuencia T1 en adquisición 3D para valoración de los patrones de atrofia, una secuencia FLAIR (también preferentemente en 3D) para valoración de lesiones de sustancia blanca y una secuencia T2* p de susceptibilidad magnética (SWI) para valoración de microhemorragias y/o siderosis superficial. Además, se recomienda incluir una secuencia de difusión, especialmente si se sospecha la posibilidad de enfermedad priónica (tabla 2). En casos seleccionados puede ser necesario realizar estudios con contraste o angio-RM, pero no están indicados de forma rutinaria.
Protocolo de resonancia magnética en paciente con demencia
| 1. Secuencia 3D-T1 isotrópica con vóxel de 1,2-1,4 mm (5-7 min) |
| 2. Secuencia FLAIR (axial 2D 4-5 mm o sagital 3D isotrópica) (3-5 min) |
| 3. Secuencia T2* axial 3-5 mm (1 min) |
| 4. Axial difusión (b 1000) (1 min) |
| 5. Opcional: coronal T2 3 mm |
| 6. Opcional: perfusión ASL |
La indicación de estudios funcionales deberá valorarse de forma individualizada, preferentemente en unidades de demencia47. Suelen ser muy útiles para el diagnóstico diferencial en casos dudosos, sobre todo en fases precoces y formas atípicas. Se considera que un estudio funcional normal en un paciente con demencia hace muy poco probable la posibilidad de una enfermedad neurodegenerativa, pero no está indicado su uso en el cribado de pacientes. Los nuevos marcadores de amiloide están indicados en casos atípicos de EA (sobre todo en el diagnóstico diferencial con la DFT) y poseen un valor predictivo negativo muy alto para EA, aunque en edades muy avanzadas los falsos positivos son frecuentes: es posible ver estudios positivos en pacientes sin demencia, aunque se cree que se trata de casos que con toda probabilidad desarrollen posteriormente la enfermedad. Teniendo en cuenta que el depósito de amiloide se produce mucho antes del desarrollo de demencia, muchos de estos pacientes de edad avanzada no llegarán a presentar demencia. En todo caso, los estudios no convencionales no suelen nunca estar indicados en la evaluación inicial de un paciente con demencia, sino que se indican dentro de protocolos desarrollados en unidades de demencia, con una aproximación multidisciplinar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.