La resonancia magnética es la piedra angular en la evaluación de las metástasis cerebrales. Los retos clínicos residen en discriminar las metástasis de imitadores como infecciones o tumores primarios y en evaluar la respuesta al tratamiento. Este, en ocasiones, condiciona un crecimiento, que debe encuadrarse como una pseudoprogresión o una radionecrosis, ambos fenómenos inflamatorios atribuibles al mismo, o bien considerarse como una recurrencia. Para responder a estas necesidades, las técnicas de imagen son objeto de constantes investigaciones. No obstante, un crecimiento exponencial tras la radioterapia debe interpretarse con cautela, incluso ante resultados sospechosos de progresión por técnicas avanzadas, ya que puede tratarse de una radionecrosis. El objetivo de este trabajo es familiarizar al lector con los fenómenos inflamatorios de las metástasis cerebrales tratadas con radioterapia y describir dos signos radiológicos relacionados: la «nube inflamatoria» y el «realce en anillo incompleto», con el fin de adoptar un manejo conservador en estos casos.
MRI is the cornerstone in the evaluation of brain metastases. The clinical challenges lie in discriminating metastases from mimickers such as infections or primary tumors and in evaluating the response to treatment. The latter sometimes leads to growth, which must be framed as pseudo-progression or radionecrosis, both inflammatory phenomena attributable to treatment, or be considered as recurrence. To meet these needs, imaging techniques are the subject of constant research. However, an exponential growth after radiotherapy must be interpreted with caution, even in the presence of results suspicious of tumor progression by advanced techniques, because it may be due to inflammatory changes. The aim of this paper is to familiarize the reader with inflammatory phenomena of brain metastases treated with radiotherapy and to describe two related radiological signs: «the inflammatory cloud» and «incomplete ring enhancement», in order to adopt a conservative management with close follow-up.
Las metástasis cerebrales son los tumores intracraneales más frecuentes en los adultos y se asocian a una escasa supervivencia. Del 15% al 40% de los pacientes con cáncer las desarrollan1.
La distribución de las metástasis cerebrales depende del flujo sanguíneo, y usualmente alcanzan el cerebro a través de las arterias. Se localizan por ello de forma mayoritaria en el territorio de la arteria cerebral media, en áreas vasculares distales y en zonas de cambio brusco del calibre vascular, como la unión córtico-subcortical2. La enfermedad metastásica que se disemina por vía venosa es típica de tumores primarios pélvicos (próstata y útero) o gastrointestinales, y lo hace a través del plexo venoso prevertebral de Batson, dirigiéndose al plexo petroclival3. Esto justifica la predisposición de dichos tumores a una afectación infratentorial.
La prueba de imagen de elección para la evaluación de las metástasis cerebrales es la resonancia magnética (RM)4. La tomografía computarizada (TC) mantiene su rol en la urgencia para la valoración de pacientes con déficits neurológicos5.
Habitualmente, las metástasis no son hemorrágicas, si bien las del coriocarcinoma, las del melanoma, las de origen tiroideo o las de origen renal asocian hemorragias con mayor frecuencia. Las metástasis de pulmón y mama solo sangran ocasionalmente; sin embargo, son responsables de la mayoría de las hemorragias metastásicas, por ser los primarios más prevalentes6.
Las metástasis pueden ser parenquimatosas o extraaxiales7. La afectación leptomeníngea (LM) en forma de implantes aislados surge por una diseminación hematógena, mientras que la carcinomatosis o siembra meníngea, típica de tumores de mama o de pulmón, se disemina a través del líquido cefalorraquídeo. Esto promueve el depósito de implantes en posición declive, que justifica su predisposición por la fosa posterior. Algunos autores no diferencian ambas situaciones7; sin embargo, la supervivencia en el primer escenario puede ser de años, en pacientes con buena respuesta al tratamiento con radioterapia (RT), o en pacientes tratados con terapias dirigidas denominados TKis (inhibidores de la tirosina quinasa) para mutaciones como la del receptor del factor de crecimiento epidérmico (EGFR) o del receptor de la tirosina quinasa del linfoma anaplásico (ALK). Por el contrario, en la carcinomatosis el pronóstico es infausto8.
El objetivo del trabajo es repasar las características radiológicas de las metástasis cerebrales. El crecimiento tras la RT no siempre se debe interpretar como una recurrencia tumoral, ya que puede estar relacionado con fenómenos inflamatorios. La diferenciación entre crecimiento tumoral o por inflamación es crucial para evitar una cirugía o una reirradiación innecesaria. En este artículo se exponen las características de estos fenómenos inflamatorios y se describen dos signos radiológicos, la «nube inflamatoria» y el «realce en anillo incompleto», que se han relacionado con la pseudoprogresión y la necrosis por radiación.
Tratamiento de las metástasis cerebralesLos radiólogos debemos estar familiarizados con los tratamientos de las metástasis cerebrales para valorar adecuadamente la respuesta. El tratamiento puede ser local mediante RT o cirugía, o bien sistémico, cuando la presencia de determinadas mutaciones permite adoptar una terapia dirigida1. Según la Sociedad Europea de Oncología Médica, la elección depende de la localización, del tamaño y del número de lesiones, así como de la situación de la enfermedad extracraneal, del estado general del paciente y del tipo histológico, pues el melanoma y el cáncer renal, por ejemplo, son más radiorresistentes9,10. Mientras la cirugía suele ser el tratamiento de elección en pacientes sin histología conocida, buen estado general con lesiones únicas y accesibles o metástasis con efecto de masa que condicionan una importante sintomatología, la radiocirugía se puede plantear en pacientes que presentan desde una a múltiples metástasis, administrándose en sesión única en lesiones con un diámetro <3cm y de forma fraccionada cuando el volumen es mayor11.
El tratamiento con RT holocraneal queda relegado a pacientes con múltiples metástasis y con una finalidad más paliativa, a diferencia de la radiocirugía estereotáxica intracraneal (conocida por sus siglas en inglés: SRS), cuya intención es radical.
La SRS es una técnica no invasiva basada en un sistema de haces de radiación convergentes que permiten liberar una alta dosis de radiación con gran precisión en un volumen pequeño y con una rápida caída de dosis. Esto le confiere gran eficacia biológica con altas tasas de control local, de hasta el 90% en el primer año12.
La radiocirugía, clásicamente, se reservaba para pacientes con ≤2 metástasis cerebrales11, aunque las guías internacionales cada vez abogan por tratar a pacientes con hasta 10 lesiones, maximizando el control local y evitando los efectos a largo plazo de la radioterapia holocaneal13. La radiocirugía estereotáxica fraccionada es similar a la SRS única por tratar en condiciones de estereotaxia, pero fraccionando la dosis total en varias sesiones, lo que mejora el índice terapéutico, la tasa de reparación del tejido sano y, por tanto, la tolerancia cuando la lesión es grande o está muy próxima a órganos sanos radiosensibles como la vía óptica. Existen también estudios que han demostrado la eficacia y la seguridad de esquemas hipofraccionados de radiocirugía basados en 5 fracciones de 6-7Gy o 10 fracciones de 4Gy14-16 en pacientes con metástasis cerebrales mayores de 3cm. Estos hipofraccionamientos son igualmente aplicados en la radiación del lecho quirúrgico tras una cirugía previa16.
Evaluación de la respuesta de las metástasis cerebralesLa RM es la técnica de elección para la evaluación de la respuesta de las metástasis cerebrales4. La TC es de utilidad en la evaluación inicial y en el ámbito perioperatorio17. En general, la TC se solicita de urgencia para descartar alteraciones ante un déficit neurológico5. La planificación del tratamiento, sin embargo, se realiza mediante resonancia, siempre y cuando esté disponible, ya que permite detectar metástasis milimétricas, que pasarían desapercibidas en una TC, y cuya detección es susceptible de modificar la elección del tratamiento5. De acuerdo con las directrices americanas de la red nacional integral del cáncer (NCCN), el seguimiento en pacientes con metástasis cerebrales debe de realizarse cada 2 o 3 meses durante el primer o primeros dos años, distanciando los exámenes cada 4 a 6meses de forma indefinida18. La RM del neuroeje completo debe realizarse en presencia de signos o síntomas sugestivos de afectación intrarraquídea, aunque algunos autores sostienen que en presencia de afectación leptomeníngea cerebral estaría indicado realizarla, ya que hasta un tercio de los pacientes presentan alteraciones que repercuten en el tratamiento dirigido a la afectación LM19. Además, tras una revisión en 72 pacientes con afectación intrarraquídea secundaria a tumores primarios originados fuera del sistema nervioso central, solo la mitad manifestaban afectación concurrente intracraneal20.
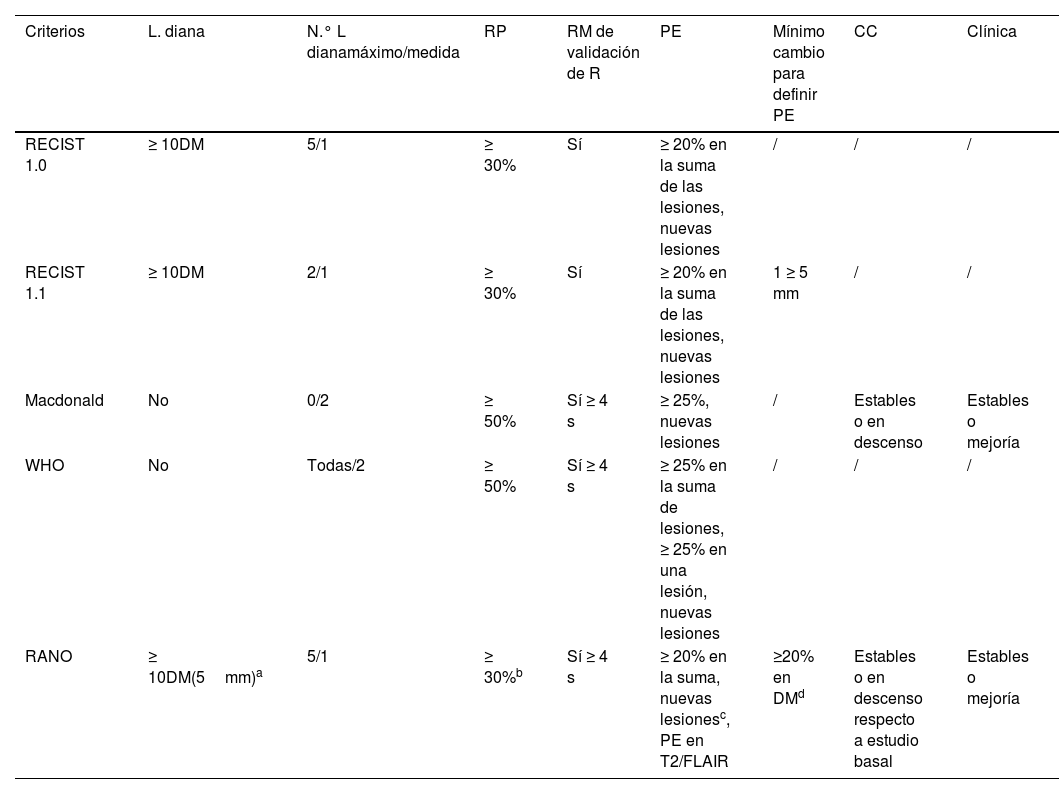
Escalas de evaluación de la respuestaA lo largo de los años han surgido diferentes escalas de evaluación de la respuesta de las metástasis cerebrales con criterios radiológicos heterogéneos. En un intento de unificarlas, el grupo de trabajo en la evaluación de la respuesta en neurooncología (RANO)21,22 propuso nuevos criterios para la evaluación de metástasis cerebrales (RANO-BM) (tabla 1)21. Estos consideran necesaria una reducción del diámetro de un 30% para establecer una respuesta parcial, que debe mantenerse 4semanas. Para determinar una progresión demandan un 20% de crecimiento. Además, de forma específica, los criterios de evaluación de la respuesta de la inmunoterapia en neurooncología (iRANO) sugieren, ante un crecimiento, esperar hasta el sexto mes desde el inicio del tratamiento antes de determinar una progresión siempre que el paciente esté estable clínicamente21,23. Los criterios RANO surgen por la necesidad de evaluar una respuesta en pacientes incluidos en ensayos clínicos y tratados en la mayoría de los casos con tratamiento sistémico21.
Características de los criterios de evaluación de respuesta en ensayos de neurooncología
| Criterios | L. diana | N.° L dianamáximo/medida | RP | RM de validación de R | PE | Mínimo cambio para definir PE | CC | Clínica |
|---|---|---|---|---|---|---|---|---|
| RECIST 1.0 | ≥ 10DM | 5/1 | ≥ 30% | Sí | ≥ 20% en la suma de las lesiones, nuevas lesiones | / | / | / |
| RECIST 1.1 | ≥ 10DM | 2/1 | ≥ 30% | Sí | ≥ 20% en la suma de las lesiones, nuevas lesiones | 1 ≥ 5 mm | / | / |
| Macdonald | No | 0/2 | ≥ 50% | Sí ≥ 4 s | ≥ 25%, nuevas lesiones | / | Estables o en descenso | Estables o mejoría |
| WHO | No | Todas/2 | ≥ 50% | Sí ≥ 4 s | ≥ 25% en la suma de lesiones, ≥ 25% en una lesión, nuevas lesiones | / | / | / |
| RANO | ≥ 10DM(5mm)a | 5/1 | ≥ 30%b | Sí ≥ 4 s | ≥ 20% en la suma, nuevas lesionesc, PE en T2/FLAIR | ≥20% en DMd | Estables o en descenso respecto a estudio basal | Estables o mejoría |
CC: corticoides; DM: diámetro máximo; L: lesión; Medida: uni o bidimensional; PE: progresión de la enfermedad; R: respuesta; RANO: evaluación de respuesta del grupo de neurooncología; RECIST: criterios de evaluación de respuesta en tumores sólidos; RP: respuesta parcial; /: no incluido, 0: no especificado.
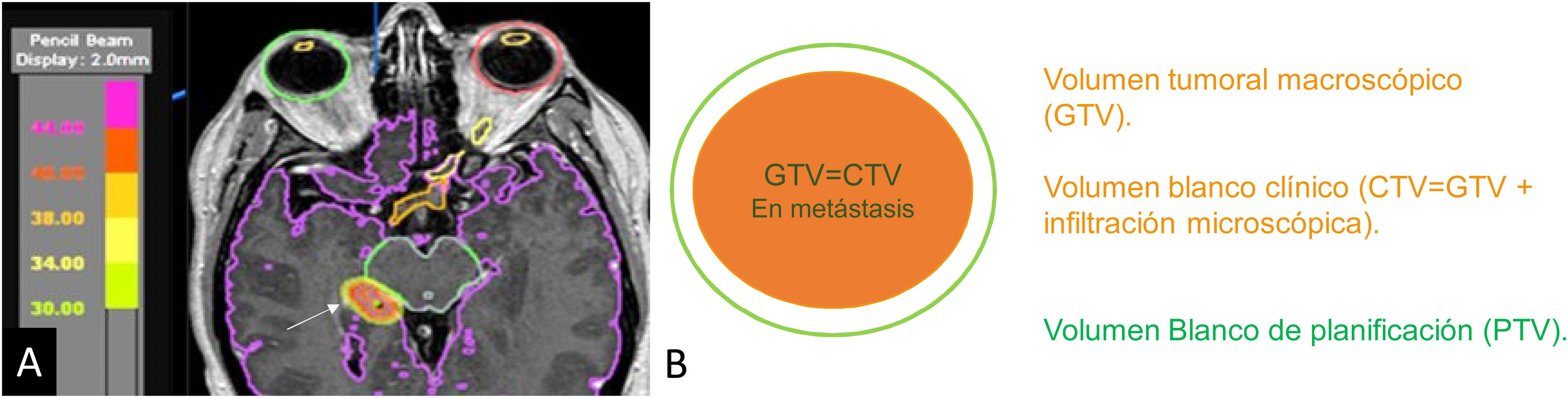
El volumen tumoral macroscópico (gross tumor volume [GTV]) es el volumen que podemos delimitar en la resonancia24. En las metástasis, cuyo margen es bien definido, el GTV es igual al volumen tumoral clínico (clinical target volume [CTV]) que incluye la extensión microscópica alrededor del tumor. Por su parte, el volumen blanco de planificación (planning target volume [PTV]) añade un margen de seguridad alrededor del CTV para vencer las incertidumbres internas y externas de la técnica, debidas al posible movimiento del órgano, al posicionado del paciente o a imprecisiones técnicas24. En la radiocirugía de metástasis cerebrales con dosis única el PTV generalmente es igual al GTV y al CTV. En tratamientos fraccionados se añade un margen al CTV normalmente de 1mm para crear el PTV (fig. 1)24. El incremento de este margen ha demostrado presentar mayor riesgo de radionecrosis25.
Imagen de planificación de radioterapia de una metástasis en el hipocampo derecho (coloreada en naranja y señalada con flecha) (A). Se encuentran delineados los órganos de riesgo, como los globos oculares, el quiasma, los nervios ópticos y el mesencéfalo. El volumen tumoral macroscópico (GTV) representado en naranja es el volumen de la metástasis que podemos delinear en la resonancia. En las metástasis, el GTV es igual al volumen blanco clínico (CTV), ya que no demuestran infiltración peritumoral. El volumen blanco de planificación (PTV) puede añadir un margen de 0mm (radiocirugía) o mínimo (1mm representado por el halo verde) en tratamientos fraccionados.
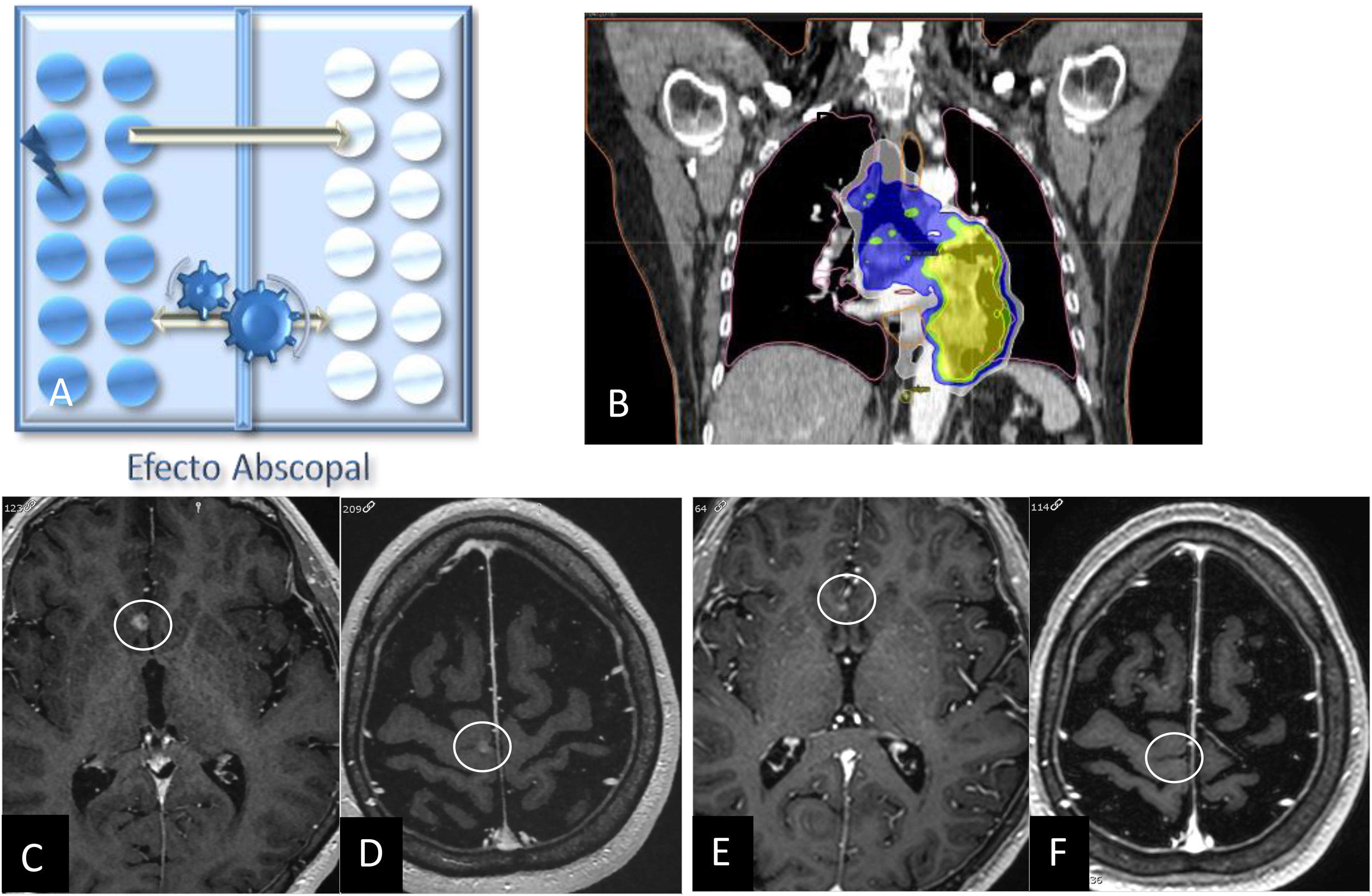
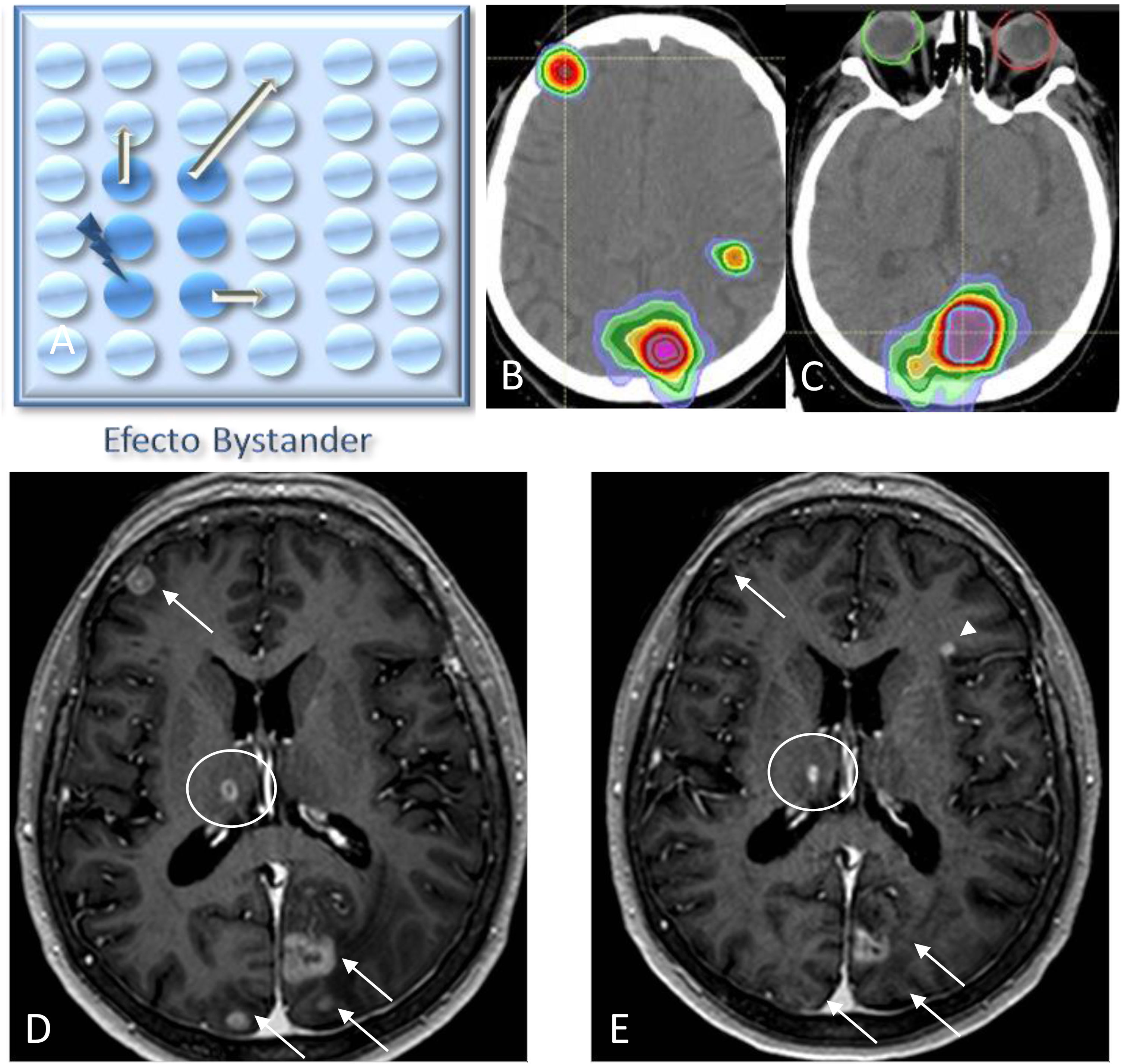
En la evaluación de respuesta tras el tratamiento con RT es interesante conocer dos fenómenos conocidos como el efecto abscopal y el efecto bystander. El efecto abscopal, acuñado por Robin Mole en 1953, es un evento radiobiológico que ocurre fuera del volumen irradiado en el mismo individuo, es decir, hace referencia a la regresión tumoral de las metástasis a distancia del tratamiento local en ausencia de otro tratamiento (fig. 2)26. Por el contrario, el efecto bystander se define como aquel en el que las células no irradiadas exhiben un efecto como resultado de las señales recibidas de células irradiadas vecinas (fig. 3)27,28.
Esquema que representa el efecto abscopal, donde existe una respuesta de las células metastásicas (en blanco) al irradiar células en otro órgano (representadas en azul) (A). Imagen coronal del TC de tórax de planificación del tratamiento con radioterapia del cáncer de pulmón (B). Imágenes 3DT1 con contraste previas a la irradiación del pulmón (C, D) y 2 meses después del tratamiento (E, F) mostrando una respuesta de ambas metástasis cerebrales en ausencia de otros tratamientos.
Esquema que representa el efecto bystander (A), donde observamos una respuesta de las células metastásicas (representadas en azul claro) al irradiar células vecinas (representadas en azul). Imagen de TC de cráneo mostrando la planificación del tratamiento con radioterapia (B y C). Imágenes 3DT1 con contraste antes del tratamiento con radioterapia fraccionada (D) y 2 meses después de éste (E), donde se aprecia una respuesta de las metástasis cerebrales radiadas (flechas) pero también de la lesión talámica derecha (círculo), no incluida en el campo de irradiación de ninguna de las lesiones, y en ausencia de otro tratamiento dirigido. Nótese la aparición de una nueva metástasis frontal izquierda (E) (cabeza de flecha).
El crecimiento de una metástasis tras irradiación puede ser consecuencia de «cambios relacionados con el tratamiento». Este término abarca tanto la pseudoprogresión como la radionecrosis, y aunque algunos autores los agrupen en un mismo evento, se trata de dos acontecimientos bien diferenciados29.
a) La pseudoprogresión y el signo de la «nube inflamatoria»La pseudoprogresión es un fenómeno descrito como un crecimiento transitorio debido a cambios inflamatorios inducidos por un tratamiento con RT o con tratamiento sistémico (fig. 4)21,29. Este crecimiento es precoz, pues sucede típicamente en los primeros 3meses tras RT, habitualmente antes del sexto mes, y ocurre hasta en el 10% de los casos29. Es por tanto un evento no desdeñable, responsable de dos tercios de los crecimientos tras la RT30. Se ha relacionado con un buen control local y con la respuesta inmune, lo que justificaría su mayor frecuencia en pacientes tratados con inmunoterapia o en pacientes jóvenes31-33. Este fenómeno radiológico puede sospecharse en presencia del signo de la «nube inflamatoria»31. Este signo describe la aparición de un realce alrededor de la metástasis, de mayor intensidad que el propio tejido tumoral y de márgenes difuminados, mal definidos, que se asemeja a una nube (fig. 5)31. Se trata de una captación focal, ya que habitualmente no rodea la totalidad de la metástasis y posiblemente corresponde con un infiltrado inflamatorio31. En el contexto de la pseudoprogresión, un grupo de trabajo presentó una imagen superponible a la descrita sin describir en sí la nube inflamatoria32, y otros describieron la aparición de un realce posiblemente no tumoral32,34. El signo de la «nube inflamatoria» surge tanto en metástasis treatment-naïve, es decir, sin tratamiento previo, como en lesiones tratadas. Al igual que la pseudoprogresión, la «nube inflamatoria» se asocia a un buen control local (fig. 6)31. El hecho de que este signo se manifieste de forma casi exclusiva en las metástasis de melanoma, pulmón y mama, que son precisamente las que asocian característicamente linfocitos infiltrantes de tumor (TIL), sugiere que ambos fenómenos podrían estar relacionados31,35. En el contexto de un tratamiento con inmunoterapia, el grupo RANO también sugiere la posible relación de la pseudoprogresión con infiltrados inmunes21.
Pseudoprogresión. Paciente con cáncer de ovario con una metástasis cerebral tratada con radiocirugía. Las imágenes transversales 3DT1 con contraste pretratamiento (A), a los 3 (B), a los 6 (C) y a los 9meses (D) muestran un crecimiento transitorio, pues la lesión responde progresivamente a los 6 y a los 9meses. En la imagen a los 3meses (B) se evidencia el signo de la «nube inflamatoria» en forma de un realce intenso periférico (flechas) rodeando el tejido tumoral (cabeza de flecha) con extenso edema vasogénico asociado (*). Nótese como este tejido tumoral tiene un realce menos intenso que la «nube» (flechas) y como ha disminuido de tamaño respecto al previo, aunque el volumen global del tejido captante sea mayor en la resonancia de los 3meses. La RM realizada 4años más tarde (no mostrada) no manifiesta recidiva en esta zona.
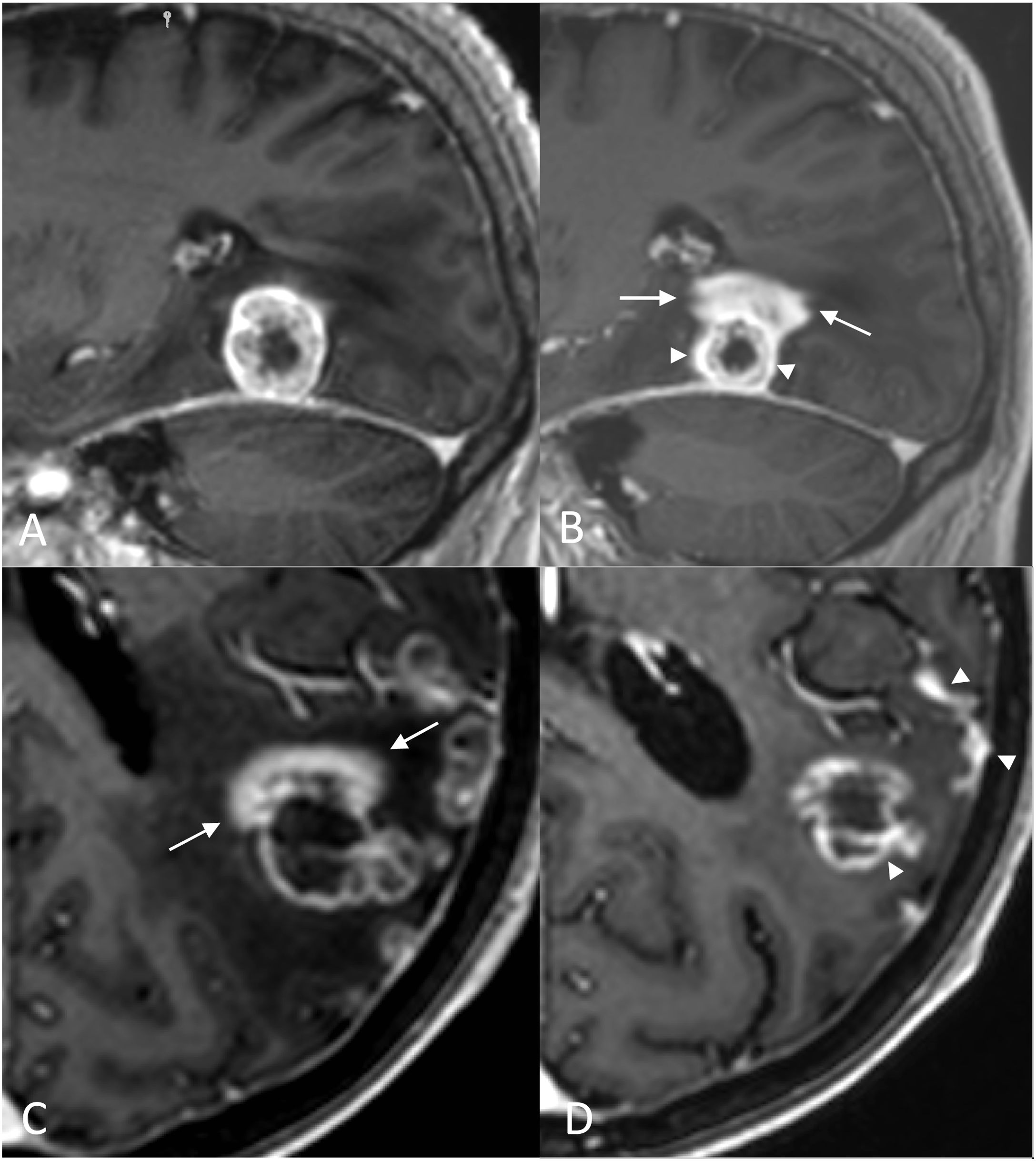
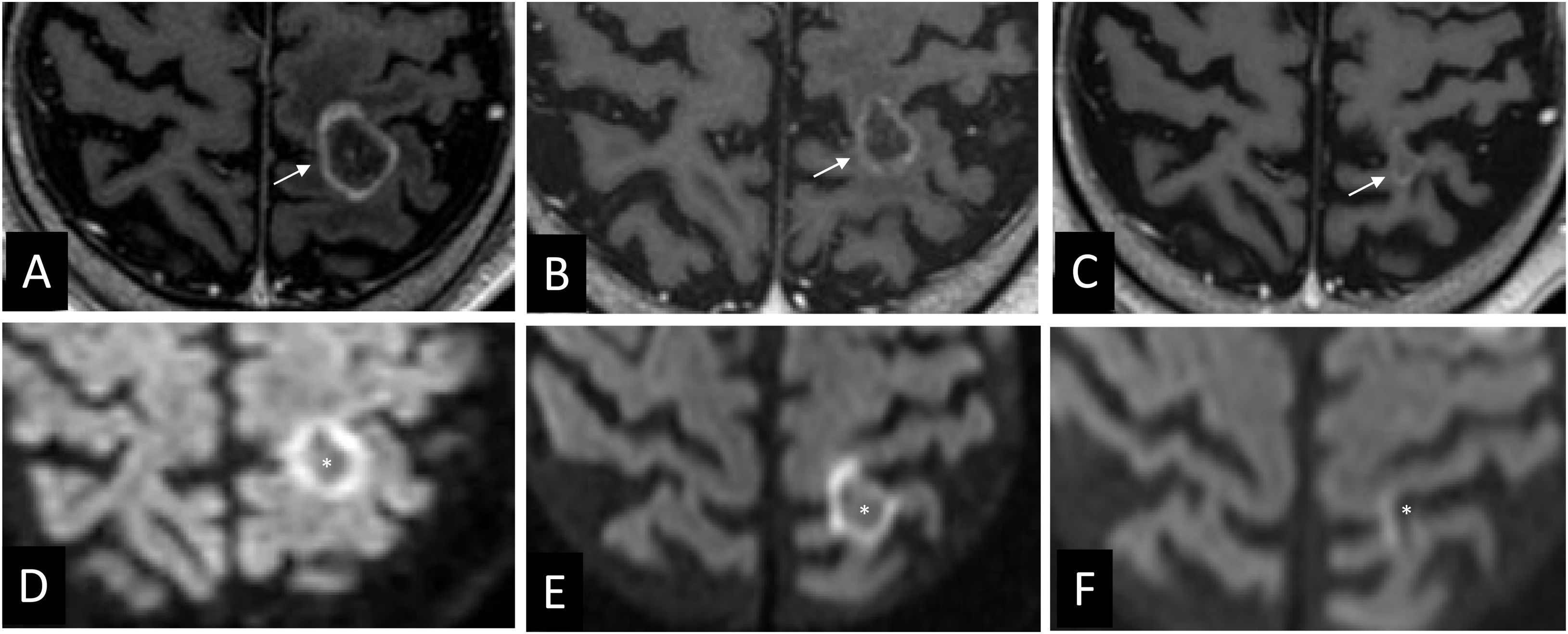
Signo de la «nube inflamatoria». Las imágenes 3DT1 con contraste muestran, alrededor del tejido interpretado como propiamente tumoral (cabeza de flecha), un área de realce intenso, focal y periférico que podría corresponder con un infiltrado inflamatorio (flechas). La existencia de unos márgenes difuminados le confiere un aspecto de nube. En la figuraA, la metástasis se localiza en íntima relación con el seno sigmoide (*).
Respuesta parcial asociada al signo de la «nube inflamatoria». Caso1: paciente con cáncer de pulmón. Imágenes transversales 3DT1 con contraste pretratamiento (A), y a los 3meses del tratamiento con radioterapia (B), que ponen de manifiesto una disminución de tamaño del tejido tumoral (cabeza de flecha) al tiempo que aparece un realce focal difuminado similar a una «nube» (flechas enB). Caso2: paciente con cáncer de mama. Imágenes transversales 3DT1 con contraste a los 6meses del tratamiento (C), donde se evidencia el signo de la «nube inflamatoria» (flechas). En la imagenD se constata la respuesta parcial del reguero de implantes leptomeníngeos (cabezas de flecha).
La radionecrosis, por el contrario, es una complicación del tratamiento con RT que ocurre del 3% al 24% de los casos según las series, debido al daño vascular y glial36,37. Histológicamente es un área de necrosis coagulativa con proliferación fibroblástica rodeada por un robusto infiltrado de células inflamatorias (linfocitos y macrófagos cargados de hemosiderina). Esta zona reactiva marginal queda circunscrita por un área de gliosis y desmielinización38,39,51. Las radionecrosis pueden contener algunas células tumorales39-41. El porcentaje es variable y posiblemente dependa de su tiempo de evolución42,43. Parece razonable pensar que el daño estructural, y notablemente el compromiso vascular producido por la RT, repercuten en el microambiente requerido para la proliferación celular tumoral, favoreciendo por tanto la muerte celular y la regresión, de forma que el porcentaje tumoral de las radionecrosis probablemente decrezca progresivamente. Esto explicaría la ausencia de recidivas en el seno de las radionecrosis a lo largo del tiempo31.
La necrosis por radiación ocurre rara vez antes de los 6meses o después de los 3años tras la finalización del tratamiento con RT. El 85% aparecen en los primeros 2años pero se han descrito hasta 20 años después de tratamiento44.
Los factores de riesgo asociados al desarrollo de radionecrosis son el tumor primario (el cáncer renal, el adenocarcinoma de pulmón y el cáncer de mama HER-2), algunas alteraciones genéticas como las translocaciones en ALK y mutaciones en BRAF37, la adición de tratamientos sistémicos (terapias diana o inmunoterapia), la dosis de radiación y el volumen tumoral, así como el volumen de tejido sano irradiado que recibe una dosis ≥10-12Gy. En la serie retrospectiva de Sneed et al.45, tras evaluar un total de 2.200 metástasis cerebrales tratadas con radiocirugía, identificaron que el riesgo de efectos secundarios sintomáticos tras radiocirugía única era del 3%, del 4% tras RT holocraneal seguida de radiocirugía, del 8% tras RT holocraneal combinada con radiocirugía y del 20% tras dos radiocirugías sobre la misma lesión. Por ello, cuando las lesiones metastásicas son grandes, el tratamiento fraccionado minimiza el riesgo de radionecrosis24. El conocimiento de estos datos permite una interpretación de los hallazgos más acertada. Por ende, la evaluación de respuesta se beneficia de la comunicación directa con los oncólogos radioterápicos y se enriquece de la discusión de los casos en un comité multidisciplinar.
La sospecha debe establecerse cuando se produce un crecimiento rápido y exponencial acompañado de un extenso edema vasogénico31,46-48. La lesión suele mostrar un incremento de tamaño progresivo durante 6meses, llegando a postergarse hasta 15meses antes de estabilizarse o de reducir el tamaño47. La localización frontal es la más frecuente, seguida por la periventricular y el cuerpo calloso49. En cambio, el tronco del encéfalo es la localización más inusual, por ser resistente a la radiación49. Cuando son multifocales, la transgresión de límites anatómicos como la hoz cerebral o el tentorio, es decir, la presencia de lesiones captantes necróticas a ambos lados de estas estructuras sin clara continuidad entre ellas, permite sospechar una radionecrosis31.
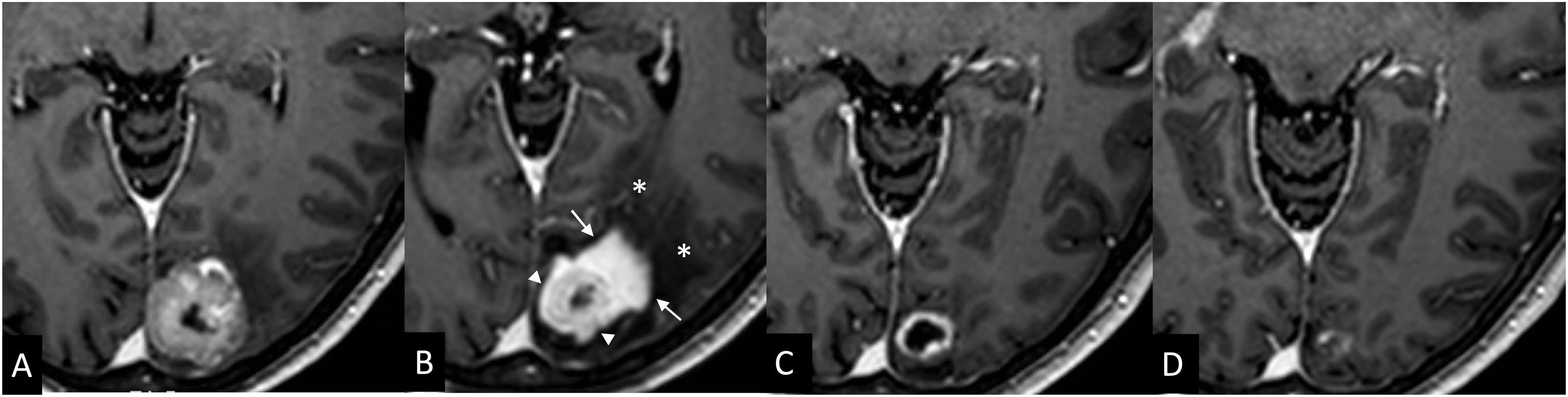
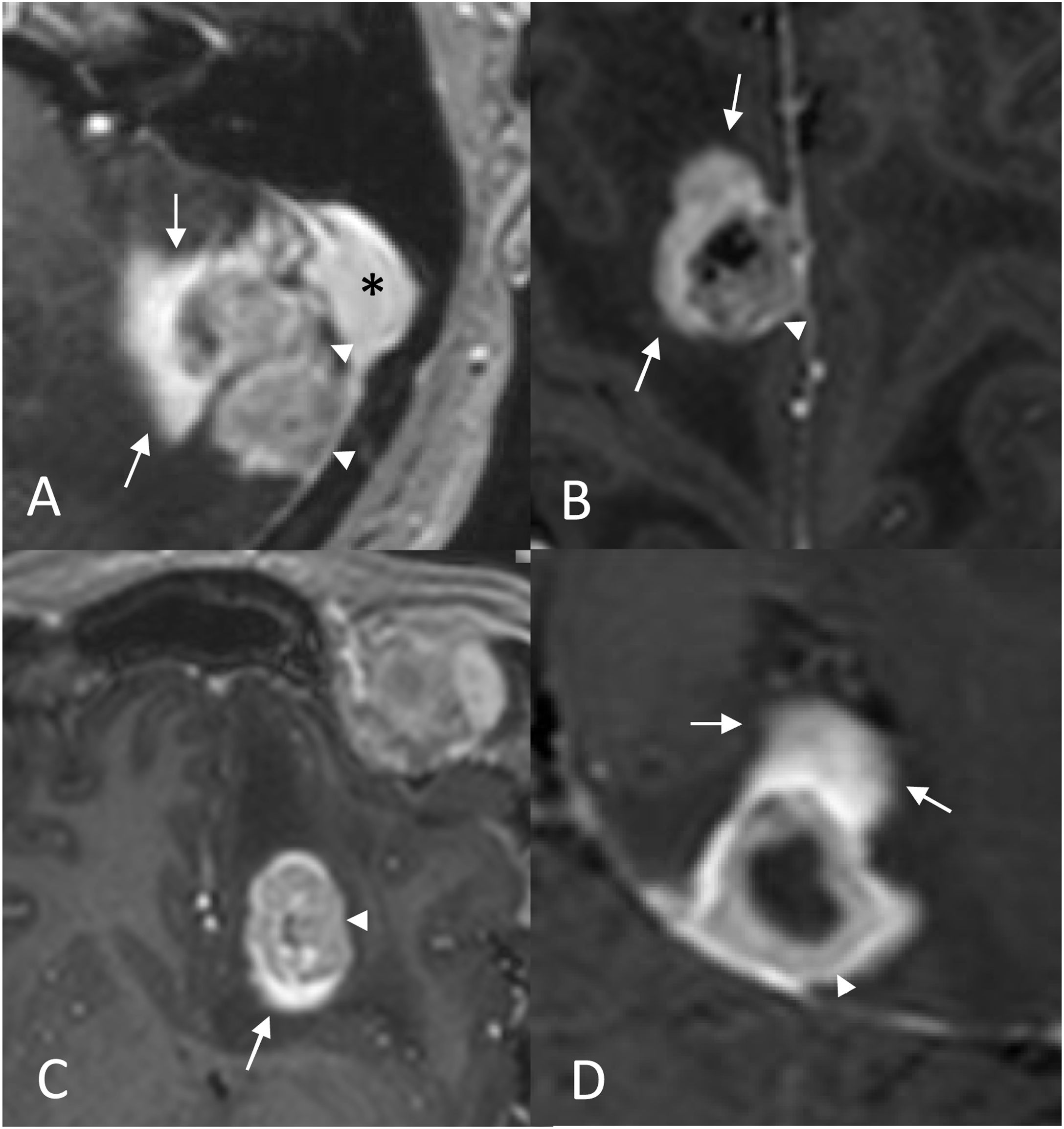
Radiológicamente, la radionecrosis es una lesión anfractuosa, muy irregular, con realce heterogéneo periférico con aspecto de pimiento cortado, queso suizo o pompas de jabón50. Se trata de un tejido desorganizado, desestructurado, donde no se delimita una masa en secuencias básicas49. Muestra múltiples áreas puntiformes o lineales debidas a la presencia de productos de la degradación de la hemoglobina, calcificaciones y componente licuefacto (la necrosis). La presencia del signo del «realce en anillo incompleto» o con morfología enC (fig. 7), con apertura de este hacia la superficie pial o ventricular, permite sospechar la existencia de una radionecrosis31. Esto podría atribuirse al proceso de desmielinización que las acompaña31.
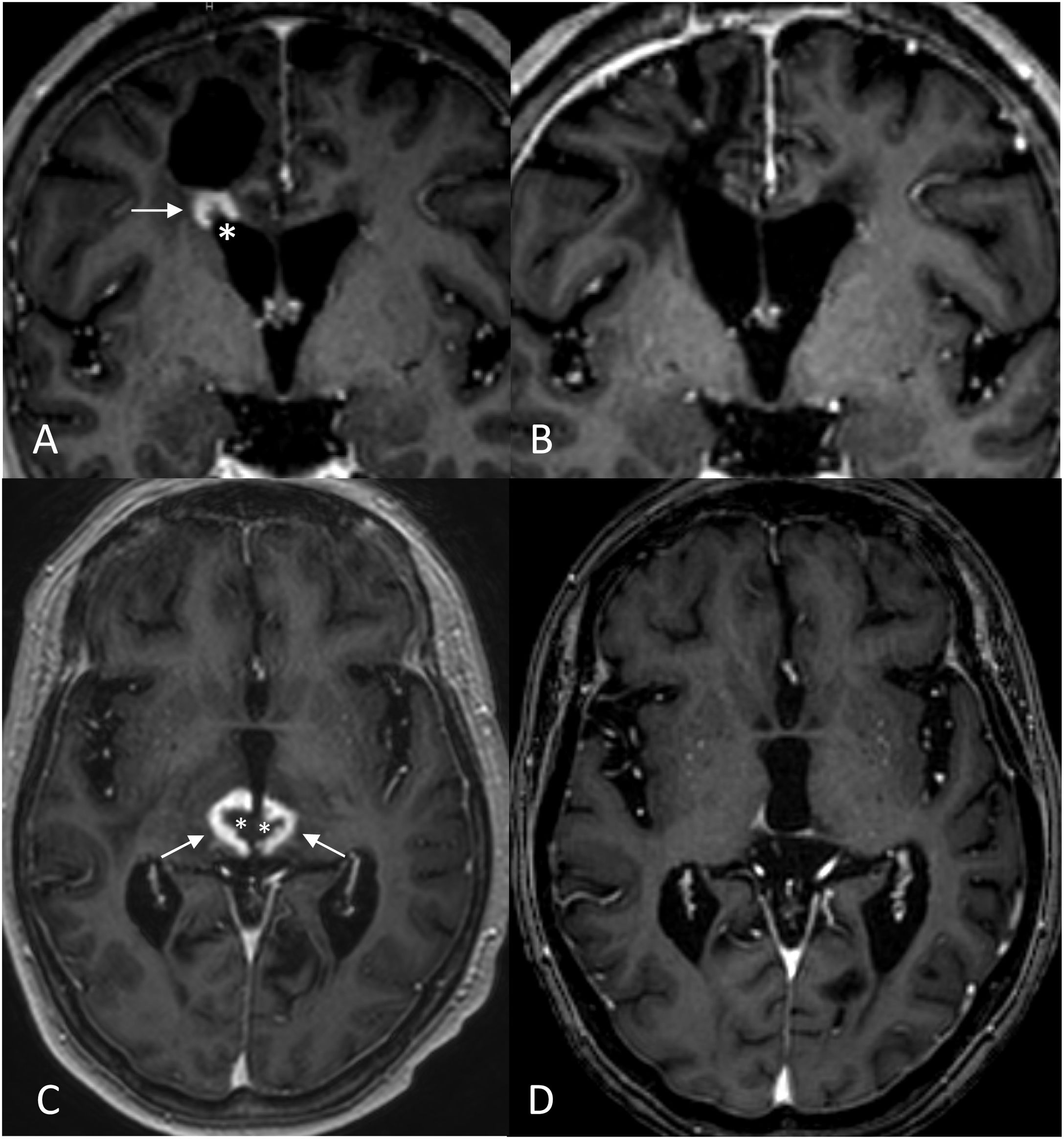
Signo del «realce en anillo incompleto» abierto a la superficie ependimaria en dos casos de radionecrosis. Caso1: paciente con cáncer de mama con metástasis cerebral (no mostrada) intervenida y tratada con RT. Imágenes transversales 3DT1 tras el tratamiento con RT fraccionada del lecho, a los 6meses (A) donde se observa una radionecrosis con realce en «C» (flecha), abierto a la superficie ependimaria (*) del asta frontal derecha, y a los 13meses (B), donde se evidencia la regresión de la lesión. Caso2: paciente con germinoma pineal seminomatoso tratado con quimio y radioterapia (PTV ventricular: 32Gy en 20 sesiones de 1,6Gy/sesión y PTV boost supraselar: 46Gy en 20 sesiones de 2,3Gy/sesión). Imágenes transversales 3DT1 a los 2años (C) y a los 4años (D) tras el tratamiento con RT fraccionada. Las zonas de radionecrosis (flechas) aparecen a los 20 meses (no mostrado) y mantienen un incremento progresivo de tamaño durante 5meses hasta los 24meses (C), después comienzan a disminuir de tamaño. Nótese la apertura a la superficie ependimaria del tercer ventrículo (*) y la transgresión de límites anatómicos con lesiones en ambos tálamos no comunicadas (otra lesión se localizaba en cuerpo calloso, no mostrada).
Además, el área de necrosis coagulativa aséptica puede contener un material viscoso similar al pus con abundantes leucocitos polimorfonucleares52, lo que explica la restricción de la difusión y el bajo valor del coeficiente de difusión aparente (apparent diffusion coefficient [ADC]), que se identifica en el centro de la radionecrosis fundamentalmente en la fase subaguda (fig. 8)31,40,53,54. Con el tiempo aumenta la difusibilidad, probablemente por degradación de los productos de la sangre.
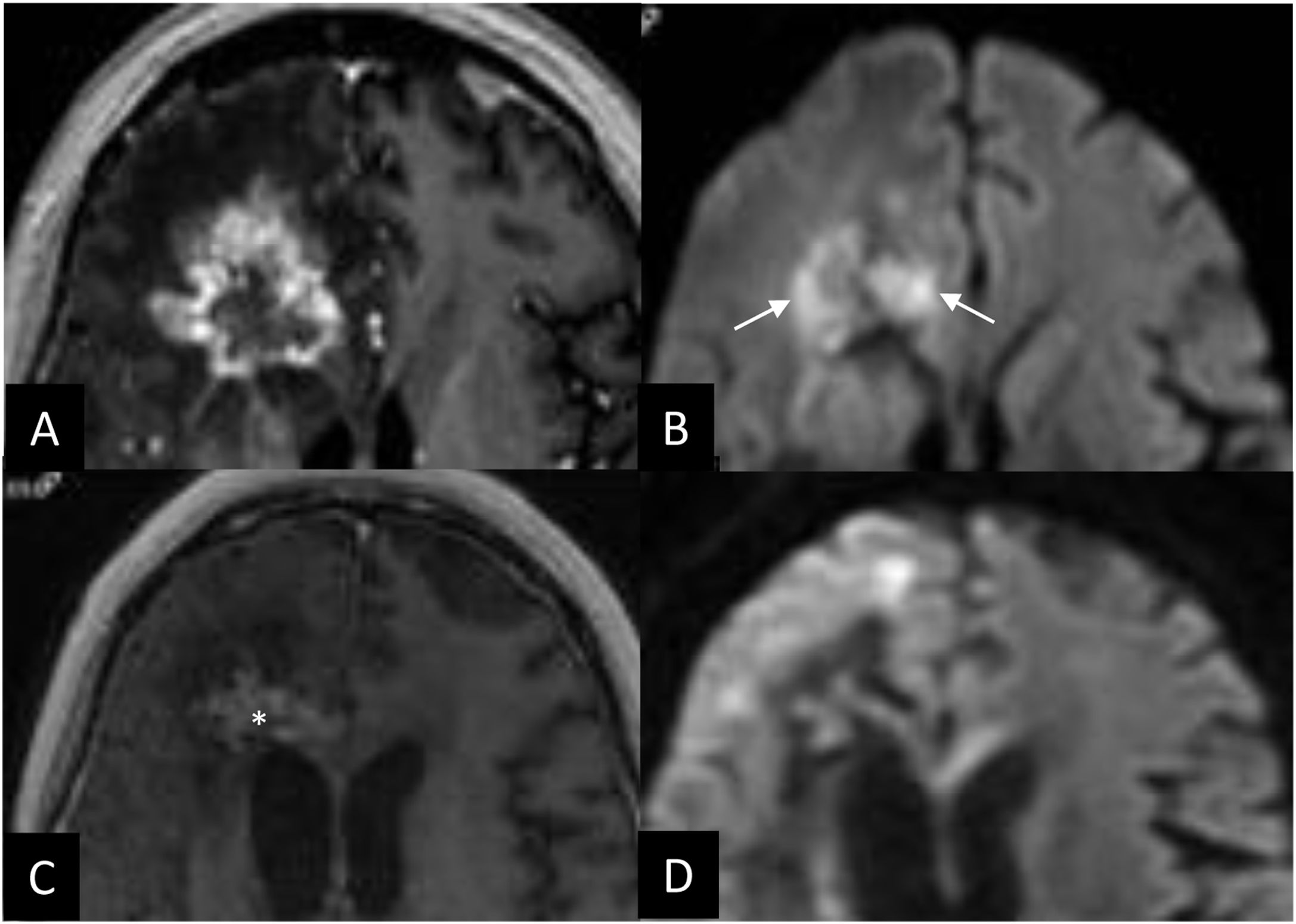
Difusión en la radionecrosis. Paciente con cáncer de mama con una metástasis cerebral intervenida que recibe radioterapia sobre el lecho quirúrgico (RTEF con 40Gy en 10 fracciones). A los 5meses se realiza RT holocraneal con buena respuesta de múltiples lesiones. Tras 10meses, se trata otra lesión cercana al lecho con radiocirugía (20Gy). A los 18meses, la imagen transversal 3DT1 con contraste (A) muestra en la misma zona irradiada una nueva lesión con un realce periférico anfractuoso. En la secuencia de difusión (B) identificamos una restricción central (flechas) que permite sospechar una radionecrosis. El control a los 27meses (C,D) permite confirmar la sospecha, al demostrar una reducción de la lesión, del edema y de la restricción, sin otro tratamiento añadido aparte de corticoides. La hiperseñal central a los 27meses (C) se corresponde con calcificaciones, pues también se observa en la secuencia 3DT1 sin contraste y en la TC (no mostradas).
El grupo RANO reconoce la necesidad de emplear otras técnicas aparte de la resonancia estándar en casos de sospecha de cambios relacionados con el tratamiento con RT21. Por ello, no se puede considerar todo crecimiento mayor al 20% como una progresión. En pacientes tratados con inmunoterapia, esperar hasta el sexto mes tampoco es garantía de que se trate de una recurrencia tumoral, pues las radionecrosis pueden presentar un crecimiento progresivo de más de un año de evolución antes de estabilizarse31.
La resonancia en las metástasis cerebralesEl protocolo básico de resonancia suele incluir secuencias potenciadas en T1, T2, T2-FLAIR (del inglés fluid attenuated inversion recovery), difusión y una secuencia 3DT1 sin y tras la administración de contraste basado en gadolinio55.
En la enfermedad leptomeníngea, la secuencia FLAIR con contraste resulta más sensible que las secuencias potenciadas en T1 con contraste8.
Para la detección de pequeñas metástasis es de utilidad la reconstrucción MIP de la secuencia 3DT1 con contraste, siendo un MIP de 4 o 5mm de grosor idóneo31.
La resonancia posquirúrgica inmediata es necesaria para estimar el resto tumoral. Debe realizarse idealmente en las primeras 48horas y no más de 72horas tras la cirugía, para evitar realces de origen isquémico o inflamatorio56,57.
En la evaluación de respuesta al tratamiento, el crecimiento tumoral entraña un complejo diagnóstico diferencial entre una recurrencia tumoral y cambios relacionados con el tratamiento. Es aquí donde las nuevas técnicas de RM juegan un rol importante21. Las imágenes de difusión y perfusión, la espectroscopia y el PET son objeto de constantes investigaciones, con varias vías prometedoras de valor añadido ya identificadas55.
La secuencia de difusiónLa difusión se define como el proceso de movimiento aleatorio de las moléculas de agua. El coeficiente de difusión aparente caracteriza la tasa de movimiento difusional. El valor «b» representa la fuerza del gradiente de difusión, y habitualmente está en el rango de 900 a 1.000s/mm238.
La difusión permite diferenciar las metástasis con realce anular de los abscesos, al demostrar en estos una restricción del contenido purulento viscoso en el centro de la lesión38.
En el estudio posquirúrgico el papel es incuestionable, ya que revela el infarto isquémico agudo58. En la RM de control el realce isquémico podría malinterpretarse como una recidiva precoz, de no conocer la preexistencia de un infarto en esta zona38.
En la evaluación de respuesta, la utilidad de la difusión se encuentra supeditada a la presencia de un tipo tumoral con un elevado ratio núcleo/citoplasma, habitualmente un tumor de pulmón, de mama, de colon o testicular59. En estos es esperable encontrar restricción del componente captante. Por el contrario, la recurrencia tumoral no restringirá si la metástasis original no lo hacía. En general, aquellas lesiones tratadas que gozan de una buena evolución ven disminuir su tamaño al tiempo que se desvanece la restricción (fig. 9). En cuanto a la progresión del tumor, se han descrito resultados opuestos en la literatura con respecto a la difusividad central en el área necrótica38,53, siendo más frecuente hallarla aumentada en una recurrencia. Por ello, el signo de la restricción central en el área necrótica es sugerente de una radionecrosis31,53,54.
Paciente con un cáncer microcítico de pulmón tratado con radioterapia holocraneal profiláctica; el paciente progresa a los 6meses (A y D). Imágenes de planificación del tratamiento con radioterapia con 35Gy en 7 fracciones (A,D), a los 2meses del tratamiento con radioterapia (B,E) y a los 4meses (C,F). Las imágenes transversales 3DT1 con contraste (flechas) demuestran una disminución progresiva del volumen de la metástasis. Las lesiones en la secuencia de difusión (*) exhiben una reducción de la restricción en respuesta al tratamiento.
Las técnicas principales para realizar perfusión por RM son la imagen de susceptibilidad magnética dinámica (DSC), la imagen de realce de contraste dinámico (DCE) o la técnica que emplea el etiquetado de espín arterial (ASL)60.
La DSC obtiene información derivada del primer paso de contraste paramagnético a través del sistema cerebrovascular. Estima el volumen sanguíneo cerebral relativo (VSCr), que es un reflejo de la neoangiogénesis. Se trata de una técnica validada para el diagnóstico y el manejo de tumores cerebrales60.
La DCE es una secuencia ponderada en T1 que tiene la ventaja de una mayor resolución espacial que la DSC y menor proporción de artefactos de susceptibilidad60. Sin embargo, los tiempos de adquisición son más largos. Permite calcular, entre otros parámetros, el Ktrans y el volumen plasmático, relacionados con la permeabilidad vascular. Ktrans es una constante de transferencia que caracteriza la difusividad de los quelatos de gadolinio a través del endotelio capilar60,61.
El ASL es un método de perfusión que no utiliza agentes de contraste. Emplea la propia sangre como trazador endógeno, previa magnetización. Sin embargo, tiene la limitación de una baja relación señal/ruido y una resolución espacial menor que las otras60.
La imagen de perfusión DSC es una herramienta valiosa en el diagnóstico diferencial entre el glioma de alto grado y las metástasis cerebrales, gracias a la diferencia del VSCr peritumoral en ambos tumores. Esta diferencia se explica por la ausencia de infiltración microscópica más allá del margen captante externo de la metástasis. En los gliomas, por el contrario, la región peritumoral alberga una combinación de edema vasogénico y de tejido tumoral infiltrante no captante62-65.
La imagen de perfusión ayuda a diferenciar entre recurrencia tumoral y radionecrosis61,66. Morabito et al.61 marcan un punto de corte óptimo para el VSCr de 1,23, con el 88% de sensibilidad (S) y el 75% de especificidad (E), mientras que para la constante Ktrans es de 28,76, con el 89% de S y el 97% de E. Por su parte, el grupo de Barajas et al.36 establece un punto de corte para el VSCr de 1,54 que permite detectar la recurrencia con una S y una E elevadas. En su serie, solo encuentran valores de VSCr inferiores a 1,35 en las radionecrosis. Otros sugieren la exclusión de la radionecrosis con un VSCr a la sustancia gris mayor a 1,85. Sin embargo, la cercanía de las metástasis a la corteza cerebral y el tamaño de estas limitan la técnica. Por ello, la ausencia de un incremento del VSCr no permite descartar una progresión tumoral, especialmente en metástasis quísticas, donde la fina pared puede resultar en un VSCr indetectable. Estos trabajos posiblemente incluyen radionecrosis en fases crónicas, y es importante tener presente que en la fase aguda la radionecrosis suele manifestar un elevado volumen sanguíneo cerebral relativo (fig. 10)31.
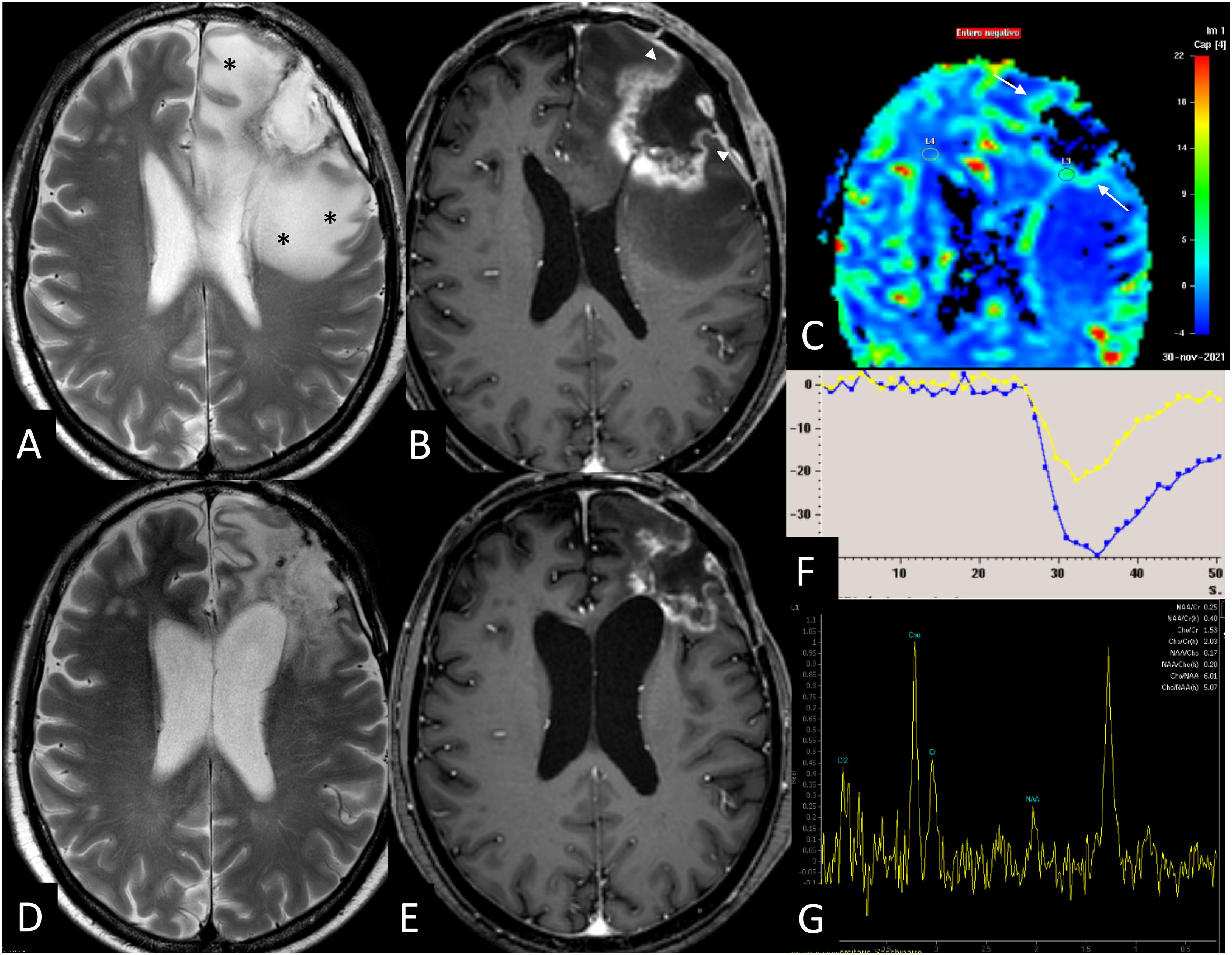
RM avanzada en la radionecrosis. Paciente con adenocarcinoma de colon con una metástasis cerebral frontal izquierda tratada con cirugía y radioterapia fraccionada del lecho quirúrgico con 10 fracciones de 4Gy. A los 6meses del tratamiento con radioterapia (A,B,C,F,G) las secuencias T2 (A) y 3DT1 con contraste (B) demuestran una lesión con realce periférico de márgenes irregulares. El mapa de color de la perfusión T2* (C) y la curva de intensidad de señal-tiempo (F) reflejan un aumento del volumen sanguíneo cerebral relativo (flechas) de 2,9 y la secuencia de espectroscopia con TE 144ms (G) un aumento de las ratios Cho/Cr y Cho/NAA con un gran pico de lípidos. Sin embargo, el tipo de realce y el extenso edema (*), así como el adelgazamiento del realce hacia la superficie pial (cabeza de flecha), deben hacer sospechar una radionecrosis. La RM de control posterior (D,E) demuestra una reducción de tamaño que confirma la sospecha de una radionecrosis.
La DCE y el ASL tienen también un papel en el diagnóstico diferencial entre gliomas de alto grado y metástasis62.
La espectroscopia por resonancia magnéticaLa secuencia de espectroscopia evalúa el contenido químico de un volumen de tejido y genera un espectro de frecuencias expresadas en partes por millón (ppm). Múltiples metabolitos han demostrado su utilidad en la práctica clínica60. El N-acetil-aspartato (NAA) es un marcador de la integridad neuronal con un pico de resonancia a 2ppm. La colina (Cho), con un pico de resonancia a 3,2ppm, es un marcador de recambio celular. El lactato, con pico de resonancia a 1,3ppm, es un marcador de metabolismo. El mioinositol es un marcador de gliosis, con pico a 3,5ppm. La creatina (pico a 3ppm) es un metabolito estable y sirve como marcador de control60,67.
En los tumores, los niveles elevados de Cho/NAA se relacionan con densidad celular, índice de proliferación e índice de muerte celular. Las metástasis muestran niveles elevados de Cho, lactato y lípidos67. El NAA está ausente al carecer de neuronas. La espectroscopia permite analizar la infiltración peritumoral para diferenciar una metástasis de un tumor primario. Los glioblastomas tienden a presentar ratios colina/creatina elevados y los linfomas muestran ratios Co/Cr y lípidos-lactato/Cr mayores que las metástasis60,65,68,69.
En la evaluación de respuesta, la espectroscopia por RM añade moderado rendimiento diagnóstico por sí sola, debido a que los cambios relacionados con el tratamiento, incluida la radionecrosis, revelan ratios Cho/Cr y Cho/NAA elevados (fig. 10), atribuibles a un elevado recambio celular70.
Tomografía por emisión de positrones (PET)La PET emplea diversos radiotrazadores que señalan diferentes rutas metabólicas. Es una prueba complementaria en el diagnóstico diferencial entre recurrencia tumoral o cambios por tratamiento. La glucosa marcada con 18F-fluorodeoxy-glucosa (18F-FDG) no es el radiotrazador ideal para la evaluación de tumores cerebrales debido a la intensa captación fisiológica cerebral, aunque, gracias a la técnica dual, la adquisición tardía mejora la sensibilidad diagnóstica71. Los radiotrazadores con aminoácidos marcados han mostrado ser una herramienta útil en la evaluación de respuesta de las metástasis, específicamente la 11C-metil-metionina (11C-MET)72. Otros han suscitado asimismo un gran interés, como son la 18F-fluorofenilalanina (18F-DOPA) y la 18F-fluoroetil-L-tirosina (18F-FET), ya que al marcarse con 18F-flúor se facilita su disponibilidad73. Estas técnicas presentan una buena precisión diagnóstica, aunque pueden dar lugar a falsos positivos en situaciones que alteran la barrera hematoencefálica (isquemia, hemorragia, infección o desmielinización). Las radionecrosis en fase aguda muestran una gran avidez por la FDG y por otros radiotrazadores74,75.
ConclusiónLa evaluación de la respuesta de una metástasis cerebral tras un tratamiento con RT continúa siendo un desafío clínico-radiológico. La aproximación multiparamétrica resulta de gran utilidad cuando se presenta un crecimiento tras el tratamiento. Sin embargo, la presencia de un crecimiento brusco y exponencial tras la RT, incluso ante datos de sospecha de recurrencia tumoral por técnicas avanzadas, debe analizarse con cautela, ya que es probable que corresponda con cambios inflamatorios. En estos casos, el seguimiento estrecho con frecuencia permite confirmar la sospecha, al producirse una regresión de la lesión. Por este motivo, la evaluación multidisciplinar con conocimiento del tipo de tratamiento recibido es imprescindible para evitar un manejo agresivo o un abandono de un ensayo clínico, innecesarios.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro más sincero agradecimiento a Julián Pérez-Beteta PhD (Mathematical Oncology Laboratory) y a Pablo Cardinal MD, PhD, por su ayuda en el análisis estadístico de la tesis doctoral que despertó nuestro interés por la evaluación radiológica de las metástasis cerebrales.