La sarcoidosis es una enfermedad granulomatosa multisistémica de causa desconocida, que afecta principalmente a los ganglios linfáticos torácicos y a los pulmones. La estadificación, que agrupa a los pacientes con similar probabilidad de remisión espontánea, se basa en los hallazgos de la radiografía de tórax, que tiene menor sensibilidad que la tomografía computarizada de alta resolución (TCAR) para detectar la afectación ganglionar, pulmonar y bronquial. Los hallazgos en TCAR pueden ser típicos, prácticamente patognomónicos, o atípicos. La TCAR aporta información sobre la actividad de la enfermedad y detecta incipientes signos de fibrosis y otras complicaciones. Para realizar el diagnóstico es precisa la correlación clínica, radiológica, y en muchos casos anatomopatológica.
La afectación cardiaca puede provocar muerte súbita; el diagnóstico, difícil, se basa en varias pruebas de imagen, como la resonancia magnética, que tiene mayor especificidad, y la tomografía por emisión de positrones; la confirmación mediante biopsia endomiocárdica se obtiene en pocos pacientes.
Sarcoidosis is a multisystemic granulomatous disease of unknown etiology. It mainly affects the thoracic lymph nodes and the lungs. The staging of sarcoidosis, which classifies patients according to their probability of spontaneous remission, is based on the plain chest film findings. Plain chest films are not as sensitive as high resolution computed tomography (HRCT) at detecting involvement of the lymph nodes, lungs, or bronchi. The high resolution CT findings can be typical, practically pathognomic, or atypical. High resolution CT provides information about the activity of the disease and detects incipient signs of fibrosis and other complications. To reach the diagnosis, it is necessary to correlate the clinical and radiological findings (and often the histological findings).
Cardiac involvement can cause sudden death. The diagnosis of cardiac involvement is difficult; it is based on various imaging tests, like magnetic resonance imaging, which is more specific, and positron emission tomography. Diagnostic confirmation by endomyocardial biopsy is obtained in few patients.
La sarcoidosis (del griego «sark oid» -parecido a la carne-) o enfermedad de Besnier-Boeck debe su nombre al dermatólogo noruego Caesar Boeck, que en 1899 describió las lesiones cutáneas de la enfermedad y las llamó sarcoide benigno, por su parecido histológico con el sarcoma; posteriormente, describió la afectación sistémica de la enfermedad en el pulmón, el hueso, los ganglios linfáticos, el bazo, la mucosa nasal y la conjuntiva. En 1915, Kusnitski y Bittorf describieron las alteraciones en la radiografía de tórax1.
La sarcoidosis es una enfermedad granulomatosa multisistémica de causa aún desconocida2, aunque pueden existir factores infecciosos como virus, micobacterias (en algunos casos, se ha detectado ADN con técnicas de reacción en cadena de la polimerasa [PCR]) y hongos, ambientales (como ejemplo, después del 11S aumentaron los casos de sarcoidosis detectados en los bomberos que trabajaron en las tareas de rescate de las torres gemelas) o genéticos que induzcan la respuesta inmune alterada que aparece en la enfermedad, aunque no se sabe por qué se desencadena esta respuesta1. Afecta fundamentalmente a los ganglios linfáticos torácicos y a los pulmones; aunque puede afectar a otros órganos, como los ojos, la piel, las glándulas salivares, el hígado, el bazo, el corazón, los huesos y el sistema nervioso central, la enfermedad pulmonar es la que causa la mayor morbi-mortalidad. En general, el pronóstico es bueno, aunque la evolución de la enfermedad es impredecible y su curso es crónico o progresivo en el 10-30% de los pacientes.
Es una de las enfermedades pulmonares infiltrativas difusas (EPID) más frecuentes; en una serie de 500 pacientes consecutivos con sospecha de EPID, la sarcoidosis fue la enfermedad más frecuente, diagnosticada en el 19% de los casos3. La incidencia es variable en distintas poblaciones4, rara en el Ecuador y más frecuente en los países nórdicos, con 60 casos/100.000 habitantes, y en afroamericanos; la afectación es mayor en mujeres entre la tercera y la cuarta décadas de la vida.
El 30% de los pacientes son asintomáticos y en el resto las manifestaciones clínicas más frecuentes son el eritema nodoso y escasos síntomas respiratorios, como tos seca irritativa, dolor torácico y disnea, con disociación clínico-radiológica (mayor afectación radiológica que clínica). Algunos pacientes presentan el síndrome de Löfgren, con fiebre, eritema nodoso, artralgias y adenopatías hiliares bilaterales. En los pacientes mayores de 70 años suele haber síntomas generales y es frecuente la afectación de las glándulas salivares5. Con frecuencia hay elevación de la enzima convertidora de la angiotensina (ECA), hipercalciuria, disminución de la capacidad de difusión y patrón restrictivo en las pruebas funcionales respiratorias y elevación del cociente CD4/CD8 en el lavado broncoalveolar (LBA).
La lesión histológica fundamental es el granuloma bien formado, no necrotizante, con histiocitos, células epitelioides y células gigantes multinucleadas en la parte central y linfocitos en la periferia6; puede presentar cambios fibróticos y, ocasionalmente, mínima necrosis coagulativa focal1. En las fases precoces de la enfermedad pulmonar, antes de la aparición de los granulomas, hay acúmulo de linfocitos en los septos alveolares (alveolitis linfocítica); posteriormente se forman los granulomas en el intersticio perilinfático: peribroncovasculares, centrolobulillares, subpleurales y, con menor frecuencia, en los septos interlobulillares7. Los granulomas pueden coalescer, dando lugar a nódulos macroscópicos.
Afectación ganglionar, pulmonar y bronquialHallazgos en la radiografía de tórax y estadificación de la sarcoidosisLa radiografía (Rx) de tórax PA y L es una exploración fundamental, ya que la afectación torácica es la más frecuente y en más del 90% de los pacientes hay alteraciones radiológicas en algún momento de la evolución de la enfermedad8; no obstante, la Rx de tórax puede ser normal en presencia de enfermedad parenquimatosa demostrada histológicamente. En pacientes asintomáticos, las alteraciones de la Rx de tórax pueden ser la primera manifestación de la enfermedad.
Hace 5 décadas, Scadding9 clasificó la sarcoidosis en 4 estadios dependiendo de la afectación detectada en la Rx de tórax; posteriormente se incorporó el estadio 0 para los casos con Rx de tórax normal. Los estadios agrupan a los pacientes con similar probabilidad de remisión espontánea de la enfermedad, mayor en el estadio I, con remisión en el 55-90% de los casos, y sin remisión en el estadio IV.
Estadio 0: se caracteriza por la ausencia de alteraciones en la Rx de tórax.
Estadio I: hay adenopatías hiliares bilaterales y pueden verse otras adenopatías acompañantes, fundamentalmente paratraqueales derechas y en la ventana aorto-pulmonar8. El diagnóstico diferencial debe realizarse con las infecciones fúngicas o por micobacterias y con las enfermedades malignas como el linfoma, el carcinoma broncogénico y el carcinoma extratorácico pero, en ausencia de síntomas específicos, la causa más frecuente de adenopatías hiliares bilaterales es la sarcoidosis10. Las adenopatías de larga evolución pueden calcificar11, a veces con morfología en «cáscara de huevo», como en la silicosis.
Estadio II: se observan adenopatías hilares bilaterales y afectación parenquimatosa, con patrón micronodular o reticulonodular bilateral, simétrico, de predominio perihiliar, en los campos pulmonares medios y superiores. Hallazgos atípicos son los nódulos grandes, las masas, las consolidaciones, las atelectasias por obstrucción bronquial, las cavidades, la afectación pleural y el neumotórax. El diagnóstico diferencial incluye fundamentalmente la neumoconiosis y, cuando aparecen masas y consolidaciones, la tuberculosis y el linfoma.
Estadio III: hay afectación parenquimatosa sin adenopatías hiliares. En el diagnóstico diferencial hay que considerar la neumoconiosis, la linfangitis carcinomatosa y, si hay masas y consolidaciones, las infecciones, la neumonía organizativa criptogenética, las vasculitis, el adenocarcinoma y el linfoma.
Estadio IV: se observa fibrosis pulmonar, manifestada como patrón reticular con bronquiectasias de tracción, masas con distorsión de la arquitectura pulmonar o quistes de panal, con predominio en los campos superiores. El diagnóstico diferencial incluye la neumoconiosis complicada y otras causas de fibrosis pulmonar, como la alveolitis alérgica extrínseca crónica y la fibrosis pulmonar idiopática.
La estadificación tiene implicaciones pronósticas y terapeúticas y se sigue realizando actualmente con los mismos criterios, en base a los hallazgos radiológicos10.
Hallazgos en la tomografía computarizada de alta resoluciónLa TCAR, secuencial o volumétrica con contraste IV, puede detectar lesiones no visibles en la RX de tórax y demuestra que la afectación pulmonar y ganglionar es más frecuente que la observada en la radiografía simple; la RX de tórax sólo detecta el 50-60% de las adenopatías y el 30-40% de la afectación parenquimatosa observada en la TCAR. En pocos casos, la TCAR es normal en pacientes con sarcoidosis demostrada histológicamente mediante biopsia transbronquial (BTB)10.
La mayoría de los pacientes muestran en la TC afectación de múltiples cadenas ganglionares, típicamente paratraqueales derechas e hiliares bilaterales y simétricas, a las que suelen acompañar las prevasculares, paratraqueales izquierdas, de la ventana aortopulmonar, paraaórticas y subcarinales. Menos frecuente es la afectación ganglionar unilateral y de las cadenas mamarias internas y mediastínicas posteriores (paravertebrales y retrocrurales)12.
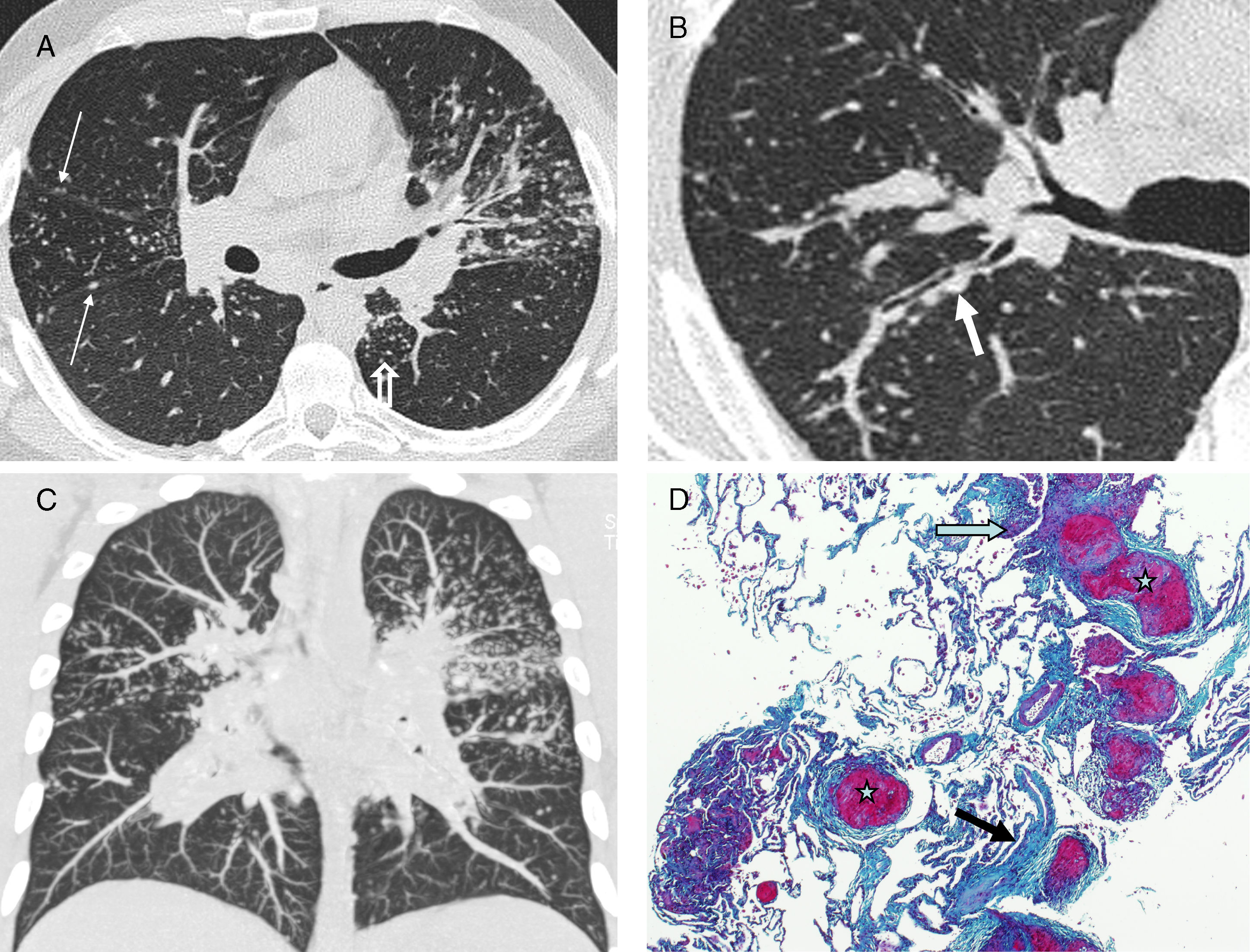
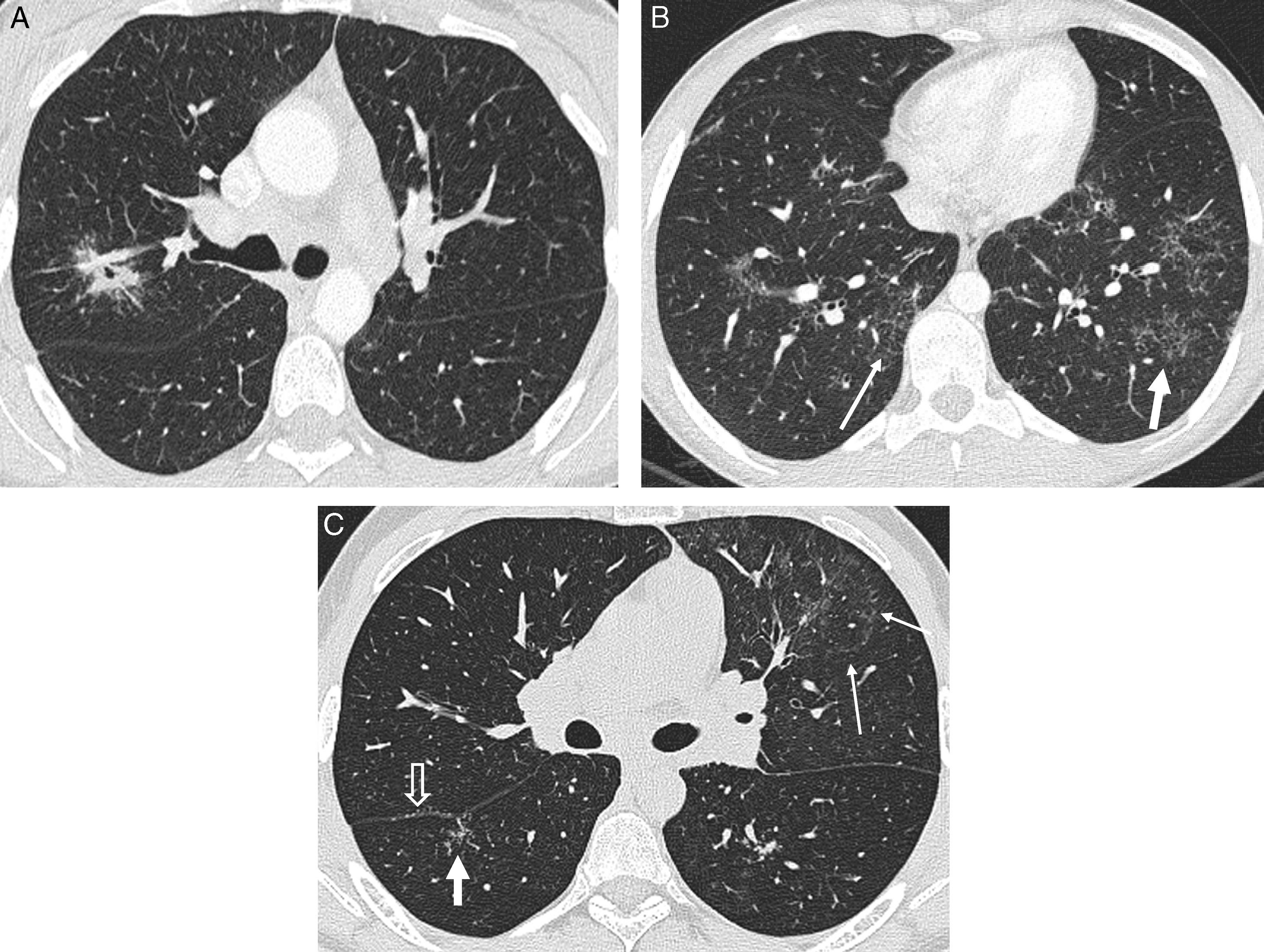
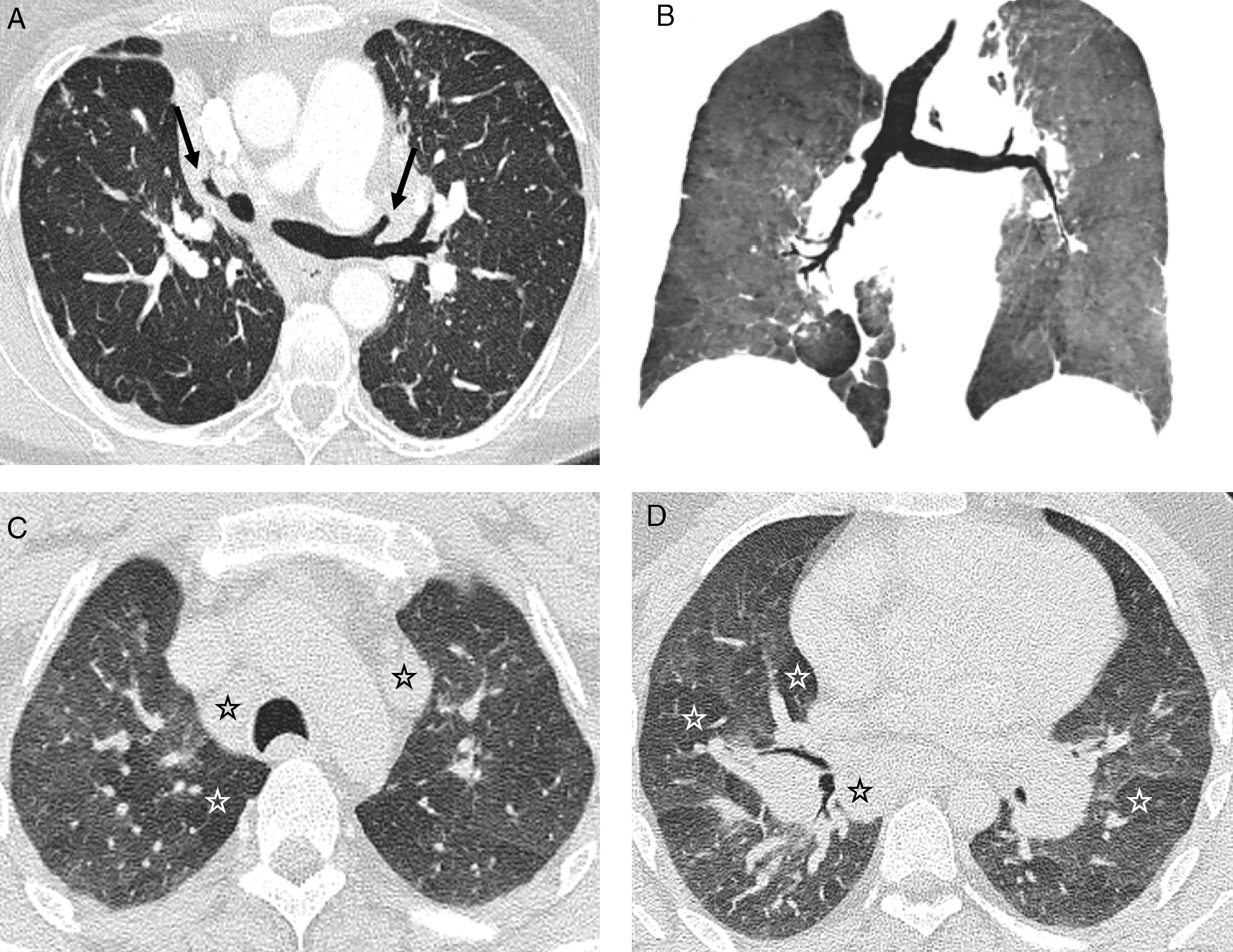
En la TCAR es fácil reconocer la distribución perilinfática de los granulomas pulmonares13. Las alteraciones que se observan con más frecuencia y constituyen el patrón típico de la enfermedad son los nodulillos menores de 1cm, con mayor frecuencia entre 2 y 5mm, bien definidos, lisos o irregulares, con distribución linfangítica (patrón nodulillar linfangítico): peribroncovasculares, centrolobulillares, subpleurales y, menos frecuentemente, en los septos interlobulillares14,15 (fig. 1); las lesiones se pueden observar en el pulmón central, con nodulillos preferentemente peribroncovasculares y centrolobulillares, pero son más frecuentes en el pulmón periférico, con nodulillos principalmente centrolobulillares y subpleurales, incluyendo las cisuras. Además, la afectación es con mayor frecuencia simétrica y parcheada y predomina en los campos pulmonares superiores y medios16 (tabla 1).
Sarcoidosis con patrón típico. A y B) TCAR axiales: patrón nodulillar linfangítico parcheado, con nodulillos peribroncovasculares (flecha gruesa), centrolobulillares (flecha abierta) y subpleurales (flechas finas). C) Reconstrucción MIP coronal: distribución predominante perihiliar y en los campos medios. D) Microfotografía de biopsia transbronquial: granulomas bien circunscritos (estrellas) en disposición linfangítica (septo interlobulillar -fecha gruesa- y haz broncovascular -flecha abierta-) (tricrómico de Masson).
Hallazgos típicos de sarcoidosis en TCAR
| Adenopatías: hiliares simétricas y paratraqueales derechas; además, mediastínicas medias y anteriores |
| Patrón nodulillar linfangítico |
| Tipo nódulos: < de 10mm, más frecuentes entre 2 y 5 mm bien definidos, lisos o irregulares |
| Tipo de distribución: linfangítica, parcheada, predominio en pulmón central o periférico (más frecuente) y predominio en campos superiores y medios |
| Signos «del corro de brujas» y «del cúmulo sarcoideo»* |
| Afectación bronquiolar: atrapamiento aéreo en espiración** |
| Fibrosis: bronquiectasias de tracción en LLSS, panal en los campos medios |
*Descritos en sarcoidosis. Solo un caso de cúmulo sarcoideo descrito en tuberculosis.
**Hallazgo no específico, aunque el 2° en frecuencia después del patrón nodulillar linfangítico.
En pacientes con sarcoidosis se han descrito otros patrones nodulillares, como el de distribución centrolobulillar, debido a la afectación única o predominante del intersticio centrolobulillar17, y el patrón al azar o miliar18; ambos son hallazgos atípicos y poco frecuentes en esta enfermedad.
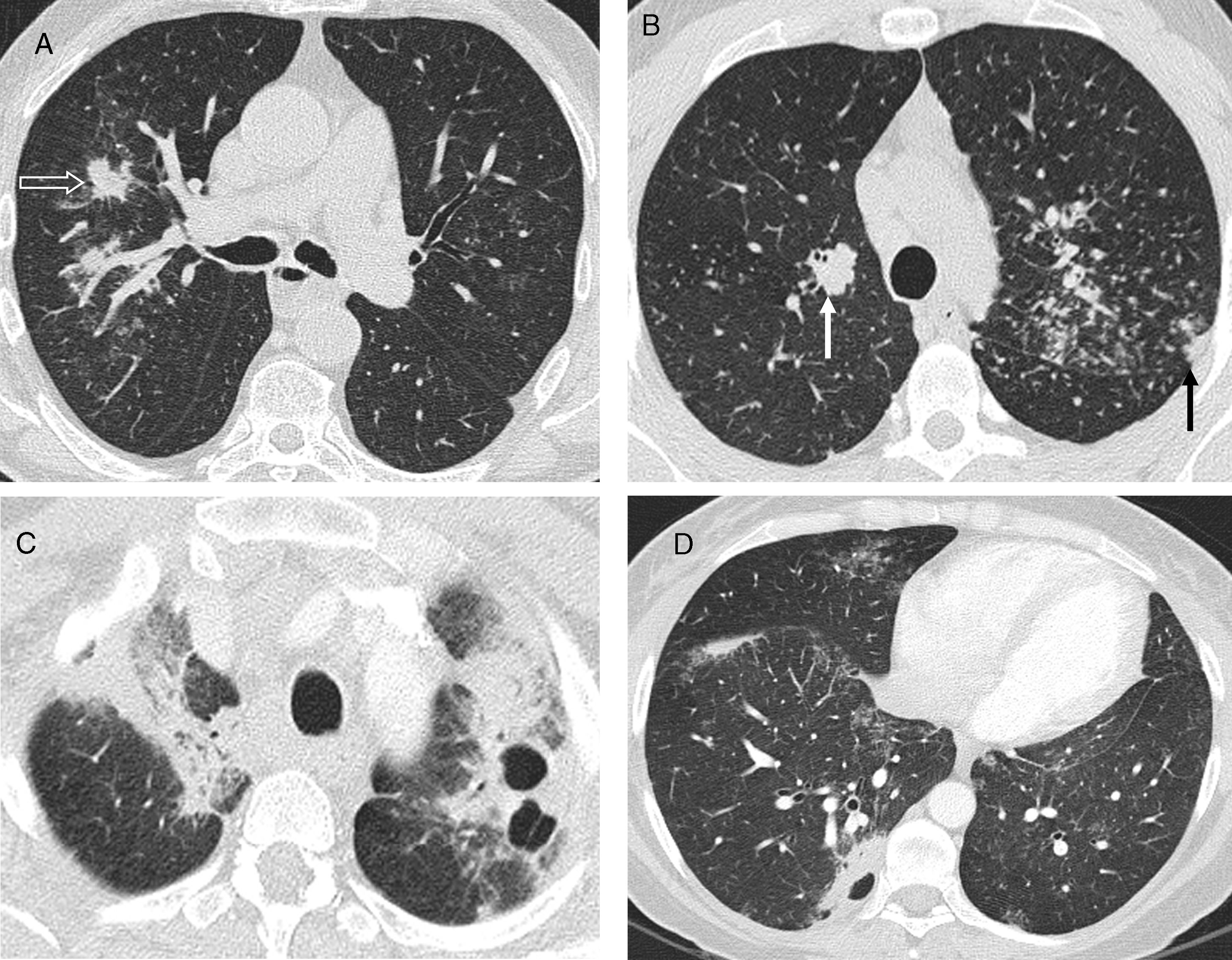
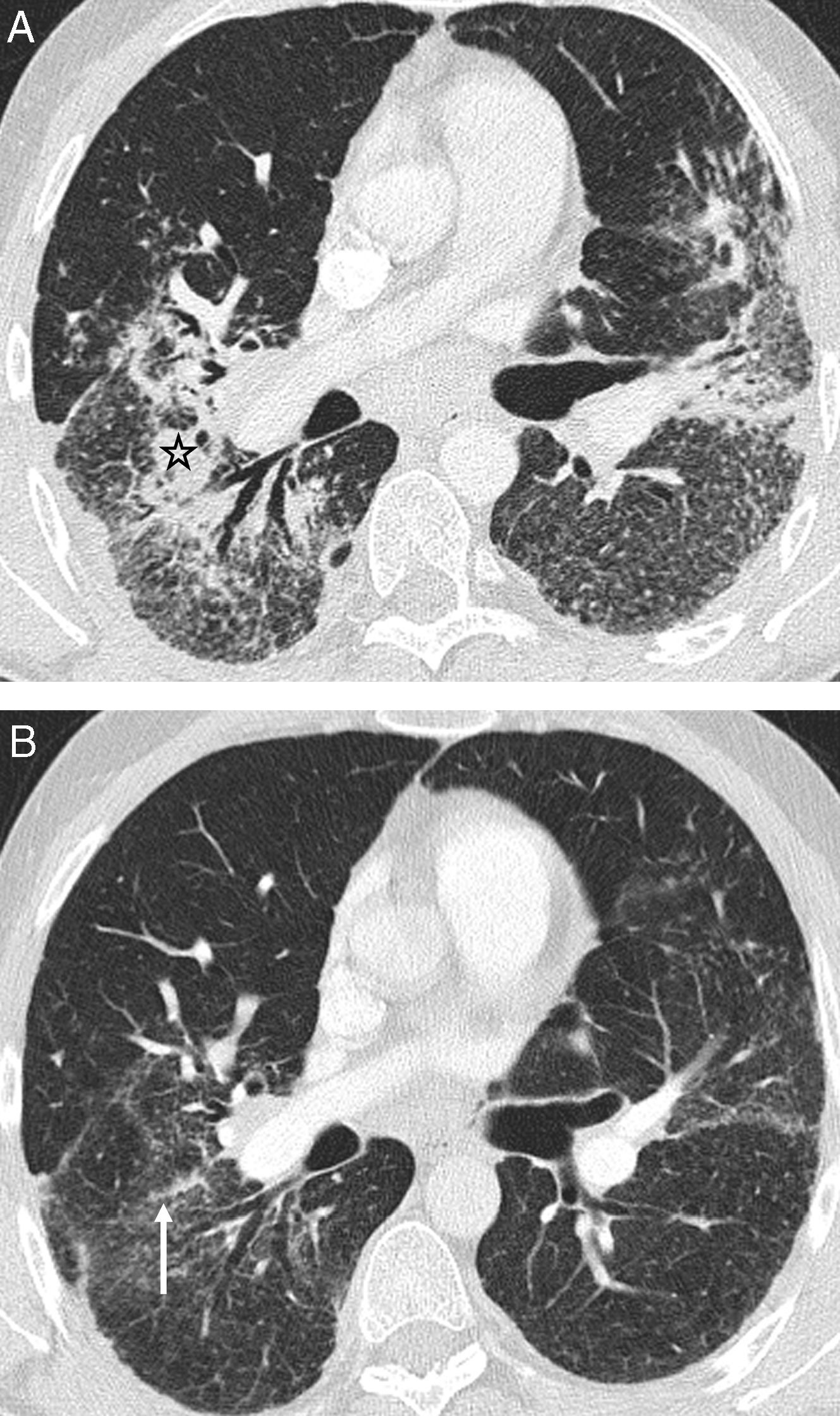
Las lesiones pulmonares que también forman parte de los hallazgos atípicos de la sarcoidosis y se deben a la confluencia de los granulomas19 son los nódulos grandes, las masas, las opacidades en vidrio deslustrado y las consolidaciones12 (tabla 2). Los nódulos grandes, de 1 a 3cm de diámetro, y las masas, mayores de 3cm, pueden cavitar y, excepcionalmente, calcificar20; pueden presentarse como único hallazgo o asociadas a otras lesiones de sarcoidosis (fig. 2). El vidrio deslustrado siempre acompaña a otras alteraciones pulmonares y a veces se superpone al patrón nodulillar. La presencia de consolidaciones, generalmente peribroncovasculares y con broncograma aéreo, da lugar a la llamada «sarcoidosis alveolar»; las consolidaciones se suelen asociar a un patrón nodulillar (fig. 3). Tanto el vidrio deslustrado como las consolidaciones se deben a un gran acúmulo de granulomas en el intersticio, con o sin fibrosis microscópica; este acúmulo provoca el colapso parcial (vidrio deslustrado) o total (consolidación) de los espacios alveolares.
Hallazgos atípicos de sarcoidosis en TCAR
| Adenopatías: unilaterales, mamarias internas, mediastínicas posteriores |
| Patrones pulmonares: nodulillar centrolobulillar, miliar, nódulos grandes y masas, vidrio deslustrado, consolidaciones, empedrado, septal interlobulillar y micronódulos calcificados |
| Fibrosis pulmonar: similar a la FPI |
| Afectaciones bronquial, pleural, cardiaca, mediastínica, vascular |
FPI:fibrosis pulmonar idiopática.
Sarcoidosis con patrón atípico. A) TCAR axial: nódulos grandes espiculados en el LSD (flecha abierta). B) TCAR axial: nódulos grandes polilobulados, peribroncovascular en el LSD (flecha blanca) y subpleural en el LSI (flecha negra). Además, nodulillos centrolobulilares y subpleurales. C y D) TCAR axiales: masas cavitadas en otro paciente.
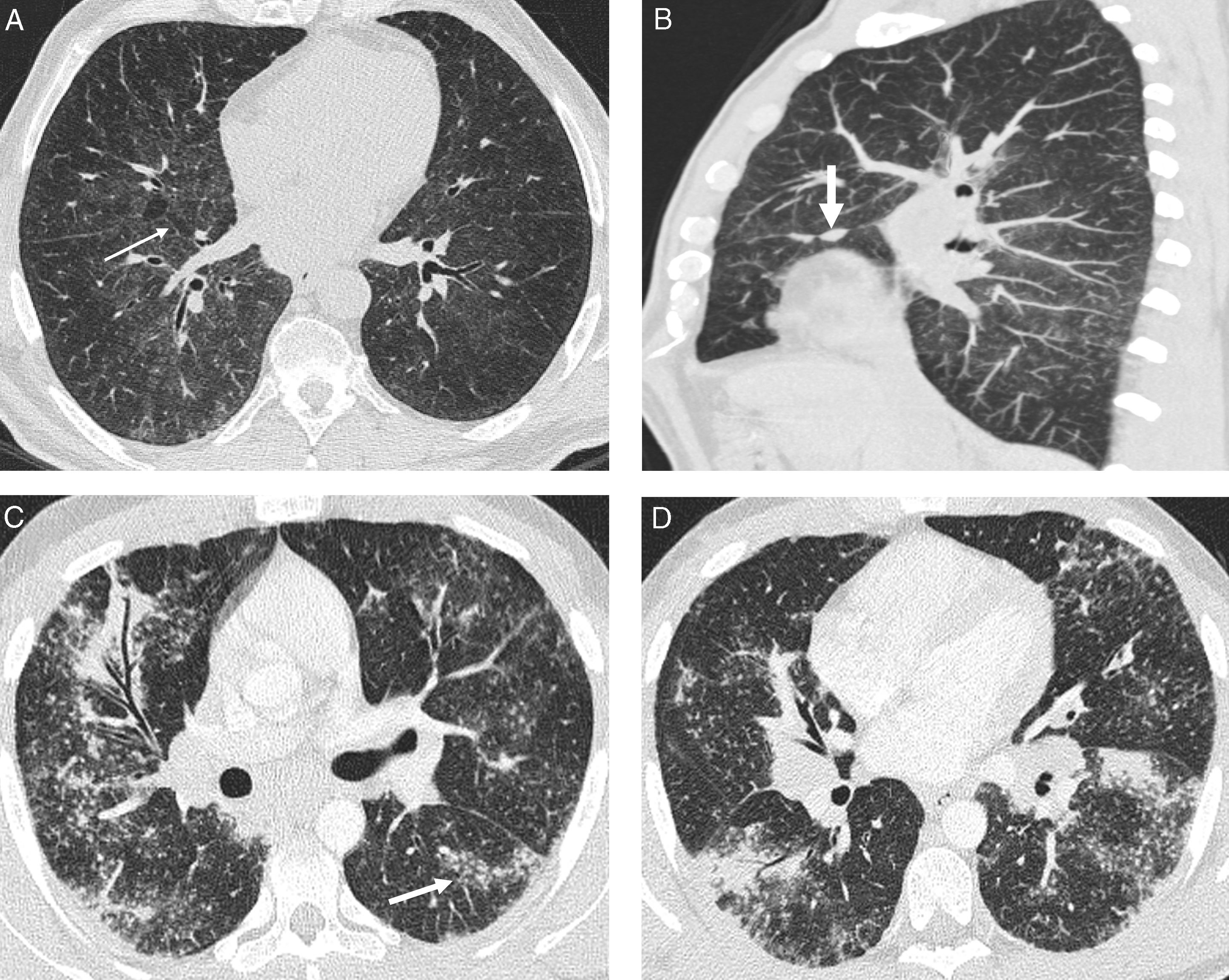
Sarcoidosis con patrón atípico. A) TCAR axial: áreas de vidrio deslustrado con el signo del «bronquio negro» y nodulillos superpuestos; hay algunos septos interlobulillares engrosados (flecha). B) Reconstrucción MIP sagital en el mismo paciente de la figura A: nodulillos centrolobulillares y subpleurales de predominio en la parte posterior de los lóbulos inferiores; nódulos en la cisura menor (flecha). C y D) TCAR axiales en otro paciente con sarcoidosis «alveolar»: consolidaciones peribroncovasculares, con broncograma aéreo, y múltiples nodulillos centrolobulillares y subpleurales, algunos formando cúmulos; hay opacidad en vidrio deslustrado superpuesta a muchas áreas de nodulillos.
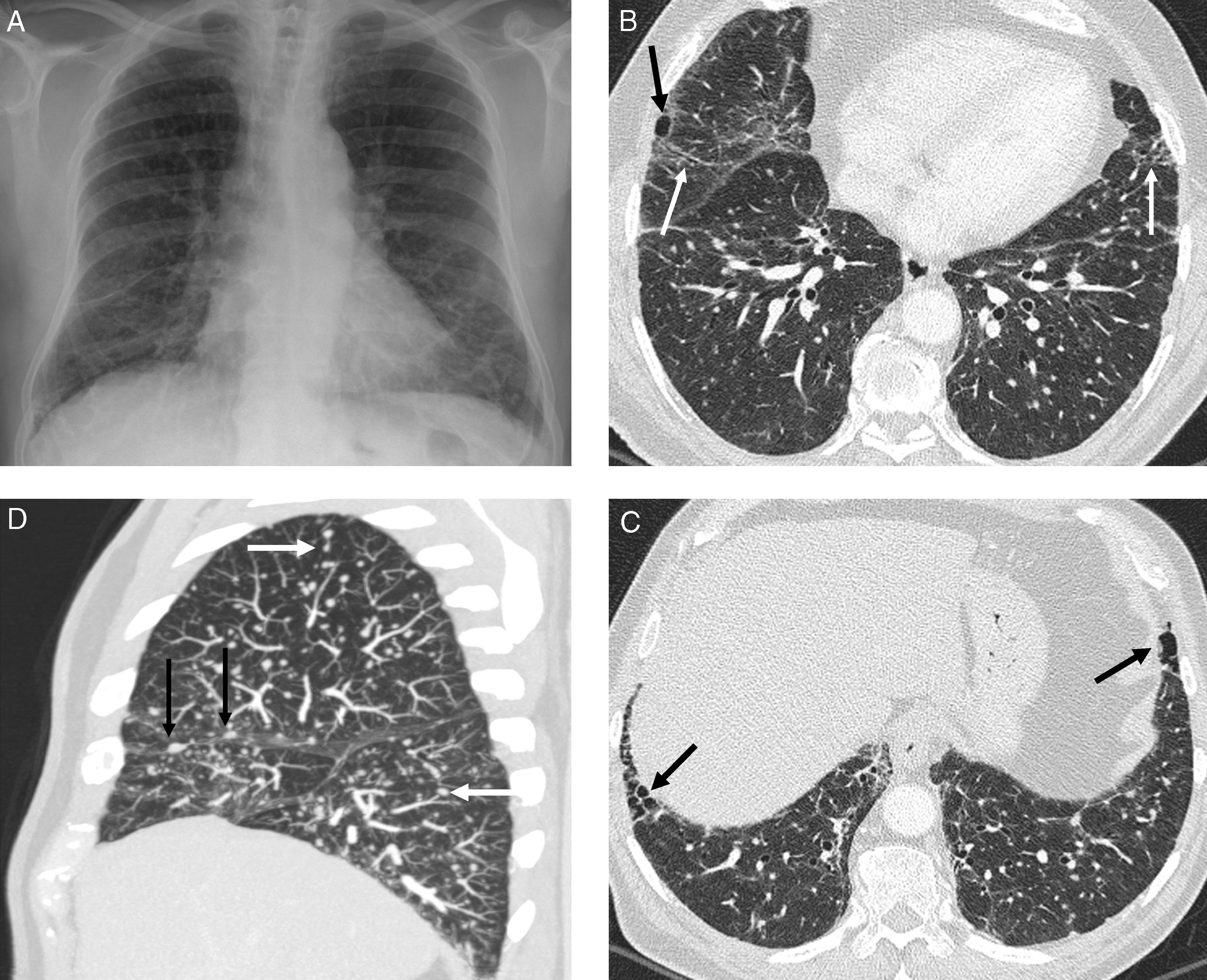
Hallazgos menos frecuentes son el patrón en empedrado21, el patrón septal como hallazgo dominante de la enfermedad (fig. 4), el patrón micronodular calcificado similar a la microlitiasis alveolar, el signo del halo22 y el signo del halo invertido, con nodulillos en el área de vidrio deslustrado central y alrededor de la consolidación periférica23.
Sarcoidosis con patrón atípico. A) TCAR coronal: engrosamiento liso de septos interlobulillares (flecha), con predominio en los campos superiores, y múltiples nodulillos subpleurales y centrolobulillares. B) Reconstrucción MIP coronal: detecta mejor el patrón nodulillar linfangítico y las adenopatías mediastínicas calcificadas, algunas en cáscara de huevo (flecha).
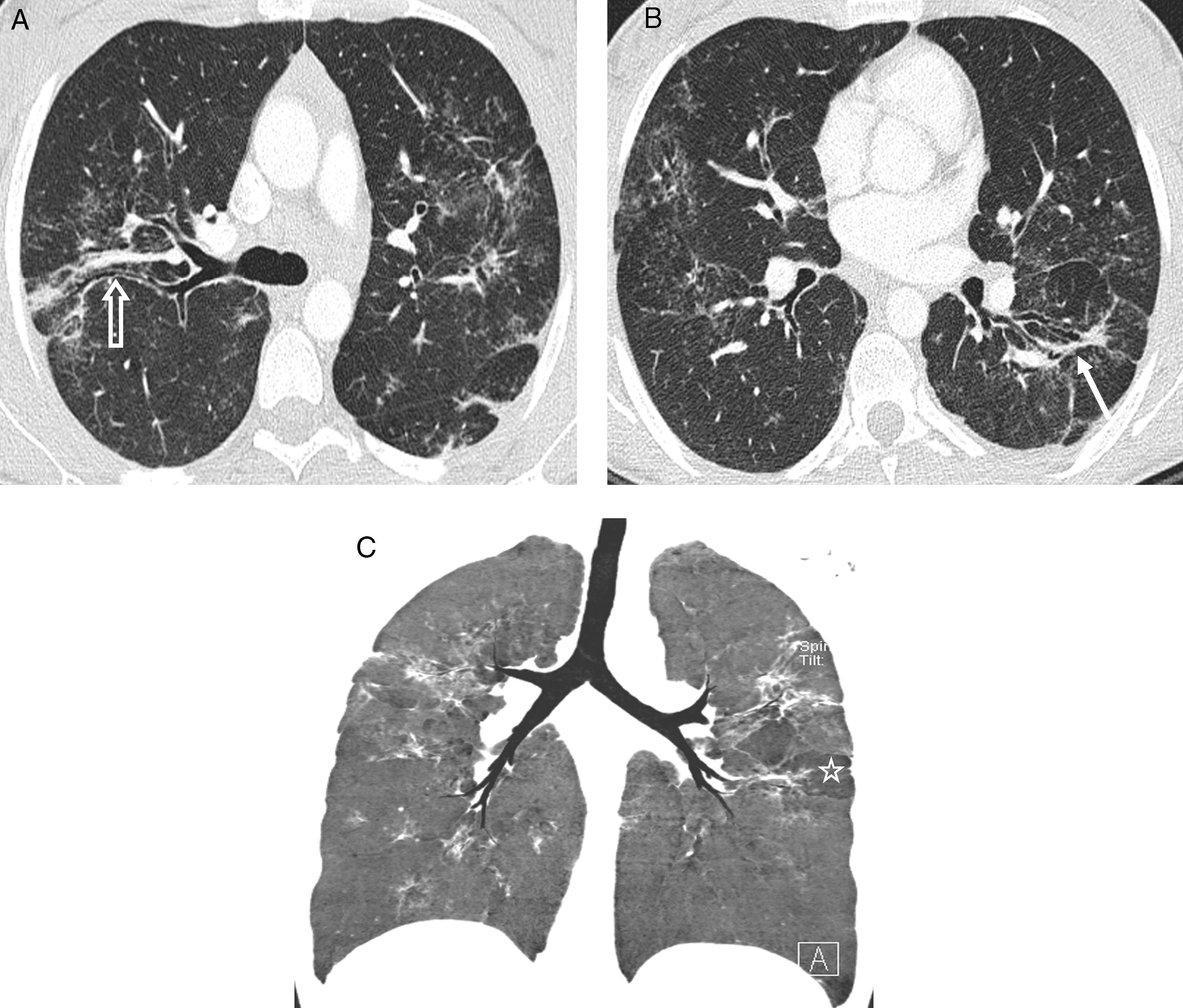
En algunos casos, debido a la especial distribución de los granulomas, se puede observar el «signo de la galaxia sarcoidea», consistente en un nódulo grande, formado por la coalescencia de los granulomas, rodeado de nodulillos satélites24, hallazgo que también se puede ver en la tuberculosis y en el cáncer de pulmón. Otros signos descritos como característicos de la sarcoidosis son el del «corro de brujas», en el que los nodulillos se disponen en círculo25, y el recientemente descrito «signo del cúmulo sarcoideo», que aparece cuando múltiples nodulillos centrolobulillares, muy próximos pero no coalescentes, forman grupos en el pulmón periférico26; cuando el cúmulo tiene localización periférica subpleural, hay nodulillos subpleurales formando parte del mismo (fig. 5); en estudios de correlación radiopatológica se ha visto que los nodulillos corresponden a granulomas no caseosos, no coalescentes, con predominio de linfocitos CD4+, sin fibrosis y con distribución linfangítica; el «signo del cúmulo sarcoideo» ha sido observado posteriormente en un caso de tuberculosis27.
Signos en la sarcoidosis. A) TCAR axial: signo de la «galaxia sarcoidea»; el nódulo central, cavitado, está rodeado por nodulillos satélites. B) Signo del «cúmulo sarcoideo»: múltiples grupos de nodulillos centrolobulillares (flecha blanca gruesa) y centrolobulillares y subpleurales (flecha blanca fina). C) Signos del «cúmulo sarcoideo» (flecha gruesa) y del «corro de brujas» (flechas finas); también, nodulillos subpleurales en la cisura mayor derecha (flecha abierta).
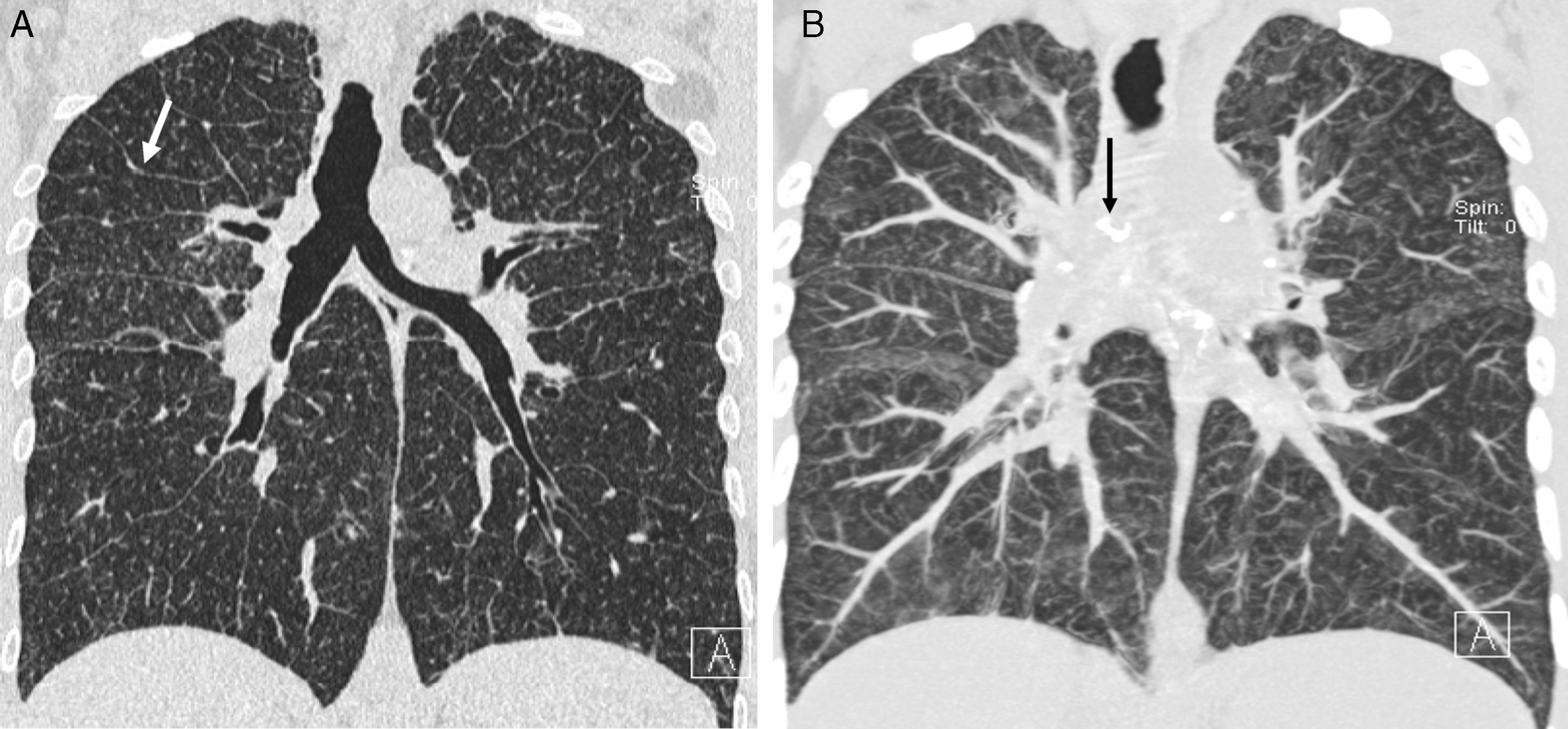
La TCAR es más precisa que la RX de tórax en la valoración de los signos de fibrosis pulmonar8 (fig. 6), que pueden consistir en bronquiectasias centrales y periféricas con gran distorsión pulmonar28, opacidades lineales o bandas irregulares con bronquiectasias de tracción y pérdida de volumen (fig. 7) o masas con bronquiectasias de tracción y pérdida de volumen; en cualquier caso, la afectación predomina en los campos pulmonares superiores y medios y típicamente provoca desplazamiento posterior de los bronquios principales y de los bronquios de los lóbulos superiores. En ocasiones se observa un patrón en panal, de predominio periférico, en los campos pulmonares superiores y medios; rara vez el patrón en panal predomina en los campos inferiores, de forma similar a la fibrosis pulmonar idiopática (FPI)29 (fig. 8). Los nódulos no se ven en las zonas de panalización pero se pueden ver asociados a los otros patrones de fibrosis30.
Sarcoidosis II. Discordancia con los hallazgos en TCAR. A) Rx de tórax: afectación ganglionar y pulmonar. B y C) TCAR axiales: signos de fibrosis (quistes de panal periféricos subpleurales en las bases –flechas negras– y bronquiectasias de tracción –flechas blancas–) no visibles en la Rx; además, patrón nodulillar. D) Reconstrucción MIP sagital: nodulillos centrolobulillares (flechas blancas) y subpleurales (flechas negras), con discreto predominio en la mitad inferior de los campos pulmonares.
Sarcoidosis IV. A y B) TCAR axiales: bandas densas irregulares (flecha sólida) con bronquiectasias de tracción (flecha hueca) y distorsión de la arquitectura pulmonar; predominan en los segmentos posteriores de los lóbulos superiores y los apicales de los inferiores. Además, múltiples nodulillos pulmonares agrupados formando cúmulos. C) Reconstrucción minIP coronal: muestra la distribución predominante de las lesiones en los campos medios, las bronquiectasias de tracción y zonas parcheadas de menor atenuación por afectación de la pequeña vía aérea (estrella).
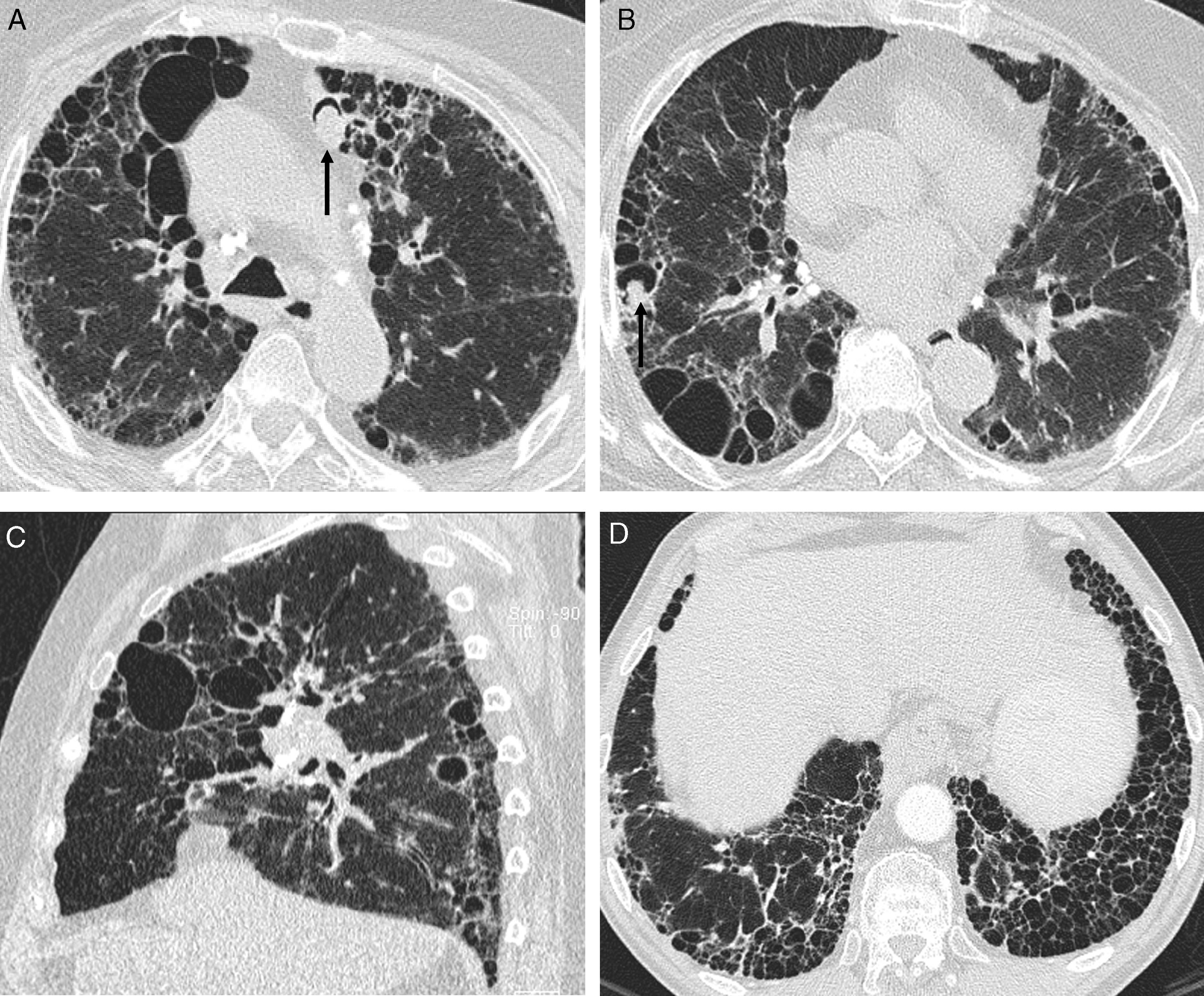
Sarcoidosis IV. A y B) TCAR axiales: quistes de panal, algunos de gran tamaño, con distribución predominante periférica. Micetomas en dos quistes de panal (flechas) y adenopatías hiliares y mediastínicas calcificadas. C) TCAR sagital: panalización con distribución predominante en los campos pulmonares medios. D) TCAR axial en otro paciente con panalización de predominio basal, similar a la FPI (biopsia ganglionar por mediastinoscopia).
La TCAR puede mostrar signos de afectación bronquial31, como engrosamiento de las paredes bronquiales y estenosis y obstrucción de la vía aérea con atelectasia distal, hallazgos debidos a granulomas intramurales y endobronquiales; también se puede observar compresión bronquial por adenopatías adyacentes. Sin embargo, son más frecuentes los signos de afectación bronquiolar, como el atrapamiento aéreo en espiración (fig. 9), que es el segundo hallazgo más frecuente después del patrón nodulillar linfangítico; puede aparecer en cualquier estadio de la enfermedad y a veces es la única alteración detectada en los campos pulmonares; se debe a la obstrucción de las pequeñas vías aéreas por granulomas peribronquiolares o intraluminales32,33. En espiración, el atrapamiento aéreo se manifiesta como áreas de morfología lobulillar, parcheadas, de menor atenuación que el resto del parénquima34; en inspiración, estas áreas presentan disminución de la vascularización, por vasoconstricción refleja, y disminución de la atenuación (patrones de vascularización y atenuación en mosaico); las reconstrucciones de máxima y mínima intensidad de proyección (MIP y minIP) ayudan a visualizarlas35.
Sarcoidosis con afectación de la vía aérea. A) TCAR axial y B) Reconstrucción coronal minIP: obstrucción completa de los bronquios de los lóbulos superiores (flechas), con atelectasias distales. Áreas parcheadas de menor atenuación por afectación de la pequeña vía aérea. C y D) TCAR en espiración: áreas parcheadas de atrapamiento aéreo (estrellas blancas), debidas a afectación de la pequeña vía aérea, como alteración pulmonar predominante en paciente con afectación ganglionar (estrellas negras) (estadio I por RX de tórax).
La TCAR es muy útil para valorar las complicaciones de la sarcoidosis como la insuficiencia respiratoria crónica debida a la fibrosis, la hipertensión pulmonar y la hemoptisis36. La causa principal de la hemoptisis en los paciente con sarcoidosis es la presencia de un micetoma en una lesión cavitada (fig. 8); otras causas son las bronquiectasias, la aspergilosis bronquial necrotizante, la aspergilosis pulmonar semiinvasiva, la erosión de una arteria pulmonar por una lesión sarcoidea necrótica adyacente y las lesiones endobronquiales.
Se ha descrito la broncomalacia, o colapso bronquial al final de la espiración, como una complicación de la afectación bronquial por la sarcoidosis37; se asocia con mayor atrapamiento aéreo.
Diagnóstico con la tomografía computarizada de alta resoluciónCuando la TCAR muestra el patrón típico de nodulillos con distribución linfangítica, es prácticamente patognomónico de la enfermedad. La exactitud diagnóstica aumenta si se incorporan los datos clínicos y los hallazgos de la Rx de tórax. El diagnóstico radiológico es casi siempre correcto cuando se basa en estos hallazgos38,39.
A pesar de la discordancia existente en muchos pacientes entre los hallazgos en la Rx de tórax y la TCAR debida a la mayor sensibilidad de la TCAR en la detección de las adenopatías, las alteraciones pulmonares y la fibrosis, no se ha estudiado suficientemente el valor de la TCAR para establecer la valoración pronóstica de la enfermedad y, por tanto, la estadificación se sigue realizando fundamentalmente en función de los hallazgos en la Rx de tórax1,10.
No hay criterios radiológicos para determinar si las lesiones se van a resolver, van a persistir o van a evolucionar a fibrosis, lo que sucede en el 20% de los pacientes. No obstante, la TCAR puede aportar información sobre su posible reversibilidad38; los nódulos son reversibles en la mayoría de los casos, aunque no en todos; la distorsión de la arquitectura pulmonar, las bronquiectasias de tracción y el panal son irreversibles; el vidrio deslustrado es impredecible, ya que puede estabilizarse, empeorar o resolverse, según corresponda a enfermedad activa o a fibrosis microscópica (fig. 10). En un trabajo con 40 pacientes y seguimiento durante 7 años40, las lesiones de vidrio deslustrado y consolidación eran las que con mayor frecuencia evolucionaban a quistes de panal (5 y 3 pacientes, respectivamente) y los patrones nodulillar y de nódulos grandes evolucionaban a la resolución o a la disminución de tamaño. Las lesiones de fibrosis no se resuelven y se asocian con un peor pronóstico y aumento de la morbimortalidad.
Evolución de la sarcoidosis, antes A) y después B) del tratamiento: desaparición de las consolidaciones peribroncovasculares y de muchos nodulillos con distribución difusa al azar predominantes en ambos lóbulos inferiores; persisten las bronquiectasias y la pérdida de volumen en el LID; ha aparecido una línea irregular (flecha) en el lugar del nódulo grande (estrella) que se veía antes del tratamiento.
Respecto a la correlación con otros marcadores de actividad, como la gammagrafía con Ga 67, el recuento de linfocitos y el cociente CD4/CD8 en el LBA y la ECA, los estudios son discrepantes, aunque en el de Leung41 existía buena correlación entre estos estudios y la extensión de los nódulos y las consolidaciones. En cuanto a las pruebas de función respiratoria, los resultados de los estudios son variables8, aunque la presencia de fibrosis está relacionada con una mayor alteración de las pruebas funcionales, especialmente en los pacientes con quistes de panal; la alteración funcional es menor en los pacientes que tienen fibrosis con opacidades lineales o bandas irregulares.
La TCAR no debe realizarse indiscriminadamente en todos los pacientes con sospecha o diagnóstico de sarcoidosis42. En el documento de consenso de la ATS/ERS/WASOG (Asociación mundial de sarcoidosis y otras enfermedades granulomatosas) de 19991 se recomienda realizar TC de tórax cuando los hallazgos clínicos y/o de la Rx de tórax son atípicos, cuando hay sospecha clínica de sarcoidosis y la Rx de tórax es normal43 y para detectar complicaciones de la enfermedad, como bronquiectasias, aspergiloma, fibrosis pulmonar, enfisema paracicatricial e infección o malignidad añadidas.
Diagnóstico diferencial con la tomografía computarizada de alta resoluciónEl diagnóstico diferencial radiológico incluye la beriliosis (se diferencian por la historia de exposición al berilio, con hallazgos radiológicos e histológicos similares), otras neumoconiosis (como la silicosis y la antracosis), la linfangitis carcinomatosa y el linfoma44,45. En la forma «alveolar», el diagnóstico diferencial incluye las vasculitis, las infecciones, la neumonía organizativa criptogenética, el adenocarcinoma y el linfoma46. Cuando hay fibrosis pulmonar, el diagnóstico diferencial debe realizarse con otras causas de fibrosis: la alveolitis alérgica extrínseca crónica, la FPI y la fibrosis asociada a las enfermedades del colágeno y a la toxicidad medicamentosa; la presencia de un patrón nodulillar asociado a la fibrosis ayuda a realizar el diagnóstico47.
Afectación traquealEs poco frecuente y se debe a la compresión por las adenopatías adyacentes o a la presencia de granulomas en la mucosa y la submucosa. Causa un engrosamiento liso, irregular o nodular de la pared y estenosis de la luz y, si la afectación es extensa, puede provocar broncomalacia47. Debe diferenciarse de la traqueopatía osteocondroplásica y la policondritis recidivante, en las que no se afecta la pared posterior de la tráquea, la amiloidosis y la granulomatosis de Wegener.
Afectación pleuralLa afectación granulomatosa sarcoidea de la pleura es poco frecuente; provoca derrame pleural que se resuelve en unos 2 o 3 meses y puede dejar como secuela una paquipleuritis.
El neumotórax espontáneo es una complicación rara que ocurre entre el 2 y el 5% de los pacientes con sarcoidosis de larga evolución, especialmente en los que tienen fibrosis, y puede ser recurrente, aunque también puede aparecer como primera manifestación de la enfermedad48. La causa puede ser la ruptura de una bulla subpleural o la necrosis de un granuloma subpleural. Se han descrito neumotórax bilaterales, a tensión y hemoneumotórax49.
Afectación vascularLa afectación de las arterias y venas pulmonares por granulomas sarcoideos se detecta en el 42-89% de las biopsias pulmonares, pero rara vez tiene repercusión clínica.
La hipertensión pulmonar ocurre en el 1-5% de los pacientes y se asocia con una mayor mortalidad10,50; los mecanismos que contribuyen a la aparición de la hipertensión incluyen la destrucción fibrótica del lecho vascular pulmonar51, la compresión extrínseca de las arterias pulmonares centrales por adenopatías o por mediastinitis granulomatosa52 y la vasculopatía intrínseca. Otra causa de hipertensión pulmonar es la disfunción del ventrículo izquierdo.
Afectación cardiacaPuede ser primaria o secundaria. La forma secundaria corresponde a un cor pulmonale causado por la hipertensión pulmonar asociada a la afectación pulmonar. La forma primaria es debida a la infiltración granulomatosa del miocardio, que provoca una miocardiopatía restrictiva o insuficiencia cardiaca53. Su incidencia en las autopsias de pacientes con sarcoidosis oscila entre el 20 y el 60%. No obstante, el diagnóstico de la afectación cardiaca durante el desarrollo de la enfermedad sarcoidea es poco frecuente ya que la infiltración cardiaca es a menudo silente y solo presentan clínica aproximadamente un 10% de los pacientes; es importante conocer que es una causa de muerte súbita, por lo que realizar el diagnóstico precoz y el tratamiento pueden ser vitales en estos pacientes. Aún así, no hay evidencia científica que apoye el cribado de afectación cardiaca en pacientes asintomáticos con diagnóstico establecido de sarcoidosis54.
Las manifestaciones más frecuentes son las alteraciones en la conducción aurículo-ventricular y los bloqueos de rama, seguidos de las taquicardias ventriculares sostenidas y no sostenidas y las arritmias auriculares54.
La infiltración de las paredes ventriculares por el proceso inflamatorio granulomatoso puede provocar una disminución en la contractilidad miocárdica (fallo sistólico) o reducción en la relajación ventricular (fallo diastólico), con insuficiencia cardiaca en ambos casos. La insuficiencia cardiaca también puede ser consecuencia de una disfunción valvular mitral secundaria a la infiltración o ruptura de los músculos papilares y cuando aparece la enfermedad se encuentra, por regla general, en una fase avanzada.
No hay ninguna técnica diagnóstica que combine alta sensibilidad y alta especificidad, por lo que el diagnóstico debe establecerse por una combinación de hallazgos de ECG, morfológicos, funcionales y/o histológicos. La resonancia magnética (RM) es actualmente la técnica no invasiva que presenta mayor sensibilidad y especificidad en el diagnóstico de la sarcoidosis cardiaca, además de ser la técnica de imagen más útil en su diagnóstico precoz.
Las anomalías encontradas más frecuentemente son alteraciones morfológicas y funcionales (áreas de dilatación ventricular, alteraciones de la contractilidad segmentaria y zonas de adelgazamiento en los segmentos basales del ventrículo izquierdo), insuficiencias valvulares y derrame pericárdico. Además, aporta información adicional en las secuencias potenciadas en T2 y en las secuencias de realce tardío de gadolinio55.
La RM muestra los tres estadios de la sarcoidosis cardiaca: fase inicial de edema miocárdico, seguido de infiltración granulomatosa y finalmente, fase de cicatriz postinflamatoria. Estas tres etapas se superponen pudiendo encontrar hallazgos de todas ellas en un mismo paciente56.
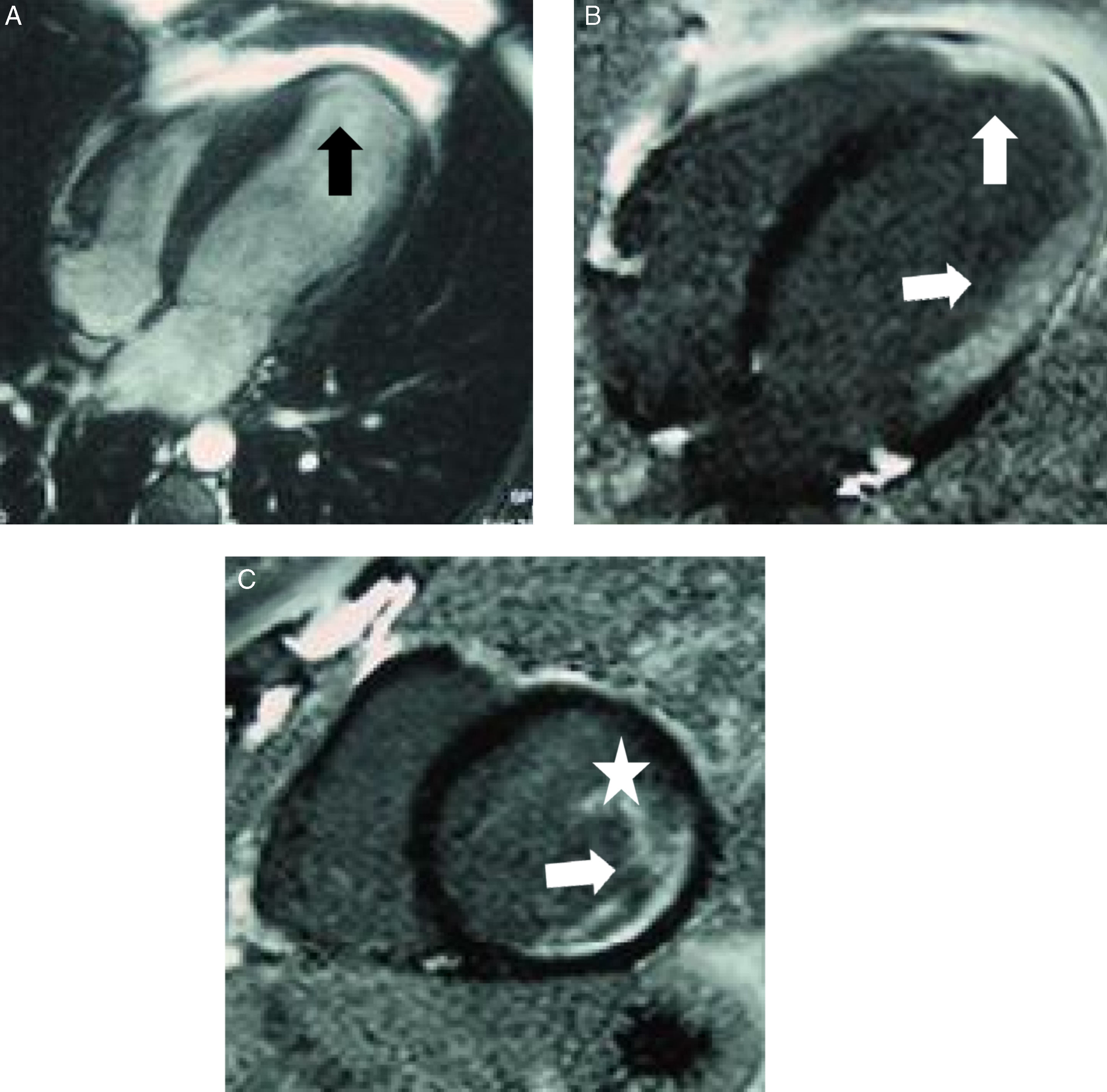
Para el diagnóstico de sarcoidosis cardiaca es fundamental el estudio tras la administración de contraste (0,1 mmol/kg). Se analiza la perfusión de primer paso y la secuencia de «miocardio negro»; así, el miocardio normal hipointenso contrasta con las áreas patológicas, hiperintensas. Las cicatrices miocárdicas se manifiestan como áreas parcheadas de miocardio adelgazado e hipocinético y con realce de predominio subepicárdico en las secuencias de «miocardio negro». También se han descrito casos con realce subendocárdico en áreas adelgazadas e hipocinéticas aunque sin distribución vascular, a diferencia de la patología isquémica. Las áreas de edema y de realce tardío disminuyen tras el tratamiento con corticoides57 (fig. 11).
Sarcoidosis cardiaca. Paciente con alteraciones del ritmo cardiaco; enzimas cardiacas y cateterismo cardiaco normales. Precisó trasplante cardiaco, confirmándose el diagnóstico de sarcoidosis cardiaca en la pieza explantada. A) Secuencia eco de gradiente en eje de cuatro cámaras: área adelgazada en el ápex del ventrículo izquierdo que además se encuentra ligeramente dilatado (flecha negra). B y C) Secuencias de «miocardio negro» en el eje de cuatro cámaras y en el eje corto, respectivamente, donde se identifica una zona de realce tardío transmural (flecha) y subendocárdico del ventrículo izquierdo, extendiéndose hacia el músculo papilar (flecha y estrella blanca). (Cortesía de la Dra. Álvarez López, Centro de Resonancia Magnética de León).
La alteración miocárdica es más frecuente que la pericárdica, con una especial predilección por los segmentos basales y la pared libre del ventrículo izquierdo y menos frecuentemente por el ventrículo derecho y las aurículas58,59 (tabla 3).
Otras técnicas diagnósticas incluyen el ECG, el ecocardiograma, la tomografía por emisión de positrones (PET), la gammagrafía con galio-67 y/o talio-201 y la biopsia endomiocárdica60.
Diagnóstico histológicoEl objetivo del estudio histológico en los pacientes con sospecha de sarcoidosis pulmonar es la confirmación de la presencia de granulomas bien formados y no necrotizantes, en disposición perilinfática; en la mayoría de los casos se realiza mediante BTB, que tiene una sensibilidad del 80-90% y puede detectar enfermedad pulmonar en ausencia de alteraciones en la TCAR; la TCAR aumenta la rentabilidad de la BTB al seleccionar las zonas con posible actividad de la enfermedad, lo que permite dirigir la biopsia hacia dichas zonas61. Debido a la frecuencia de afectación endobronquial en la sarcoidosis, la biopsia endobronquial aumenta el rendimiento diagnóstico de la broncoscopia cuando se asocia a BTB62.
Otro sitio para realizar la biopsia son las adenopatías. La punción-aspiración transbronquial de las adenopatías mediastínicas guiada con ecografía endobronquial es una nueva técnica mínimamente invasiva muy útil en el diagnóstico de los estadios I y II de la sarcoidosis, con una sensibilidad del 83-93% y una especificidad del 100%63.
La biopsia quirúrgica de las adenopatías, mediante mediastinoscopia o mediastinotomía, y la biopsia pulmonar, abierta o por toracoscopia videoasistida, únicamente se realizan cuando hay sospecha clínico-radiológica de sarcoidosis y no hay confirmación histológica por otros tipos de biopsia.
Tanto la biopsia transbronquial como la pulmonar deben realizarse en las zonas de posible enfermedad activa, detectadas con la TCAR. En algunos estudios se ha mostrado que la PET puede ser útil para localizar zonas ocultas de enfermedad activa y realizar la biopsia64.
El patólogo, además de detectar la presencia de los granulomas, debe excluir causas conocidas de granulomas, como las infecciones por bacterias, micobacterias y hongos, la beriliosis, la granulomatosis por talco inyectado vía intravenosa, la alveolitis alérgica extrínseca, los fármacos como el metotrexate, el linfoma y las vasculitis. También se han descrito reacciones sarcoideas en ganglios linfáticos y parénquima pulmonar de pacientes con enfermedades malignas torácicas y extratorácicas65. Los granulomas con patrón sarcoideo, por sí solos y en ausencia de una causa identificable, son lesiones no específicas y no diagnósticas de sarcoidosis66.
En los pacientes con sospecha de sarcoidosis cardiaca, la biopsia endomiocárdica puede detectar edema, infiltración por granulomas no necrotizantes y fibrosis. Sin embargo, con frecuencia es negativa debido a que la afectación cardiaca es parcheada y además la biopsia se toma de la porción apical del septo interventricular, en el margen del ventrículo derecho60. Por todo ello, presenta una baja sensibilidad (20-63%) y, unido a la naturaleza invasiva de esta técnica, hace que otros métodos sean los de elección para llegar al diagnóstico. No se requiere una biopsia positiva para hacer el diagnóstico de la enfermedad1.
Diagnóstico de consenso clínico-radiológico- patológicoEl diagnóstico de certeza de la enfermedad pulmonar se basa en los hallazgos clínicos y radiológicos compatibles, la evidencia histológica de granulomas no necrotizantes o con mínima necrosis en disposición linfangítica y la exclusión de otras enfermedades con hallazgos similares67,68. En los casos de presentación típica del síndrome de Löfgren no se considera necesaria la biopsia; también se acepta un diagnóstico de alta probabilidad sin confirmación histológica cuando hay datos clínico-radiológicos compatibles y un cociente de linfocitos CD4/CD8 > 3,5 en el LBA, que tiene una especificidad del 93-96%, con sensibilidad del 53-59%63,69. El diagnóstico debe realizarse por consenso en grupos multidisciplinares70.
El diagnóstico de sarcoidosis cardiaca se realiza por los criterios establecidos por el Ministerio de Salud Japonés aunque no han sido admitidos de manera generalizada por la comunidad científica internacional (tabla 4)54. Son necesarios, por tanto, nuevos estudios que permitan desarrollar un algoritmo diagnóstico para valorar la afectación cardiaca por la sarcoidosis68.
Criterios del Ministerio de Salud Japonés para el diagnóstico de sarcoidosis cardiaca
| Grupo de diagnóstico histológico: La sarcoidosis cardiaca se confirma cuando el análisis histológico de la biopsia endomiocárdica muestra granulomas epitelioides sin granulomas caseificantes. |
| Grupo de diagnóstico clínico: En pacientes con un diagnóstico histológico de sarcoidosis extracardiaca, se sospecha una sarcoidosis cardiaca cuando el ítem (a) y uno o más ítems (b-e) estén presentes |
| (a) Bloqueo completo de rama derecha, desviación del eje cardiaco hacia la izquierda, bloqueo aurículoventricular, taquicardia ventricular, contracción ventricular prematura, anomalías ECG en la onda Q o cambios en el ST-T. |
| (b) Anomalías en el movimiento de la pared del ventrículo izquierdo, adelgazamiento focal de su pared o dilatación del ventrículo izquierdo. |
| (c) Defectos de perfusión en la gammagrafía cardiaca con talio-201 o captación anómala en la gammagrafía cardiaca con galio-67 o tecnecio-99m. |
| (d) Presión intracardiaca anómala, bajo gasto cardiaco o anomalías en la movilidad de la pared del ventrículo izquierdo o disminución de la fracción de eyección del ventrículo izquierdo. |
| (e) Fibrosis intersticial o infiltración celular al menos de forma moderada incluso aunque los hallazgos no sean específicos. |
- 1.
Responsable de la integridad del estudio: IHO.
- 2.
Concepción del estudio: IHO.
- 3.
Diseño del estudio: IHO.
- 4.
Obtención de los datos: IHO, LLG.
- 5.
Análisis e interpretación de los datos: IHO, LLG.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: IHO, LLG.
- 8.
Redacción del trabajo: IHO, LLG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: IHO, LLG.
- 10.
Aprobación de la versión final: IHO, LLG.
Los autores declaran no tener ningún conflicto de intereses.